TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DPPH (1,1-DIFENIL-2-PIKRILHIDRAZIL) DAN PENETAPAN
KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DPPH (1,1-DIFENIL-2-PIKRILHIDRAZIL) DAN PENETAPAN
KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DPPH (1,1-DIFENIL-2-PIKRILHIDRAZIL) DAN PENETAPAN
KANDUNGAN FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
iv
HALAMAN PERSEMBAHAN
“Kita tidak tahu bagaimana hari esok, yang bisa
kita lakukan adalah berbuat sebaik-baiknya dan
berbahagia hari ini.”
(Samuel Taylor Coleridge)Skripsi ini aku persembahkan kepada :
Tuhan Yesus Kristus dan Bunda Maria
sebagai ungkapan rasa syukurku
Ibu, Bapak, dan keluargaku
tanda hormat dan bhaktiku atas kasih sayang yang kalian berikan
tak lupa untuk almamaterku yang aku banggakan
“TUHAN adalah gembalaku,
vi
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma:
Nama : Valentinus Widyawan
Nomor Mahasiswa : 08 8114 068
Demi perkembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan Universitas Sanata Dharma karya ilmiah saya yang berjudul:
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DPPH
(1,1-DIFENIL-2-PIKRILHIDRAZIL) DAN PENETAPAN KANDUNGAN
FENOLIK TOTAL FRAKSI ETIL ASETAT EKSTRAK METANOLIK BAWANG DAUN (Allium fistulosumL.)
beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pangkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya ataupun memberi royalti kepada saya selama tetap mencantumkan nama saya sebagai penulis.
Demikian pernyataan ini yang saya buat dengan sebenamya.
Dibuat di Yogyakarta
Pada tanggal: 6 Februari 2012 Yang menyatakan
vii
KATA PENGANTAR
Puji syukur kepada Tuhan karena berkat rahmat dan karunia-Nya penulis dapat menyelesaikan skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Metode DPPH (1,1-Difenil-2-Pikrilhidrazil) dan Penetapan
Kandungan Fenolik Total Fraksi Etil Asetat Ekstrak Metanolik Bawang
Daun (Allium fistulosumL.)” sebagai salah satu syarat guna memperoleh gelar Sarjana Farnasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi ini, penulis menyadari begitu banyak bantuan dan dukungan dari semua pihak baik secara langsung ataupun tidak langsung sehingga skripsi ini dapat terselesaikan. Pada kesempatan ini penulis ingin mengucapkan terimakasih yang sebesar-besarnya kepada :
1. Ipang Djunarko, M.Sc., Apt., selaku Dekan Fakultas Farmasi Universitas Sanata Dharma.
2. Prof. Dr. CJ. Soegihardjo, Apt. Sebagai Dosen Pembimbing yang telah memberikan bimbingan, pengarahan serta ilmu dalam penelitian dan penyusunan skripsi ini.
3. Yohanes Dwiatmaka, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
4. Lucia Wiwid Wijayanti, M.Si. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
viii
6. Segenap laboran Laboratorium Fakultas Farmasi Universitas Sanata Dharma, khususnya Mas Wagiran selaku laboran Laboratorium Farmakognosi-Fitokimia dan juga Mas Bimo selaku laboran Laboratorium Kimia Analisis Instrumen atas segala bantuan selama penulis melakukan penelitian.
7. Sahabat seperjuangan Angela Natalia Meta Karvitasaria, Rollando, Louis Aldo Sahala, Antonius Pandu Wilakartika, terimakasih atas bantuan dan kerjasama yang telah dilewati bersama dalam penelitian ini.
8. Ayesa Syenina, atas kasih dan segala perhatian, dukungan juga doanya.
9. Semua sahabat-sahabat terbaikku, atas segala pengalaman tak terlupakan yang telah kita jalani.
10.Teman-teman Farmasi kelas B angkatan 2008, dan FST 2008 terimakasih atas dukungan dan kebersamaan kita.
11.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat desebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini banyak kekurangan dan jauh dari kata sempurna. Oleh sebab itu, dengan segala kerendahan hati penulis menerima saran dan kritik guna perbaikan dan penyempurnaan skripsi ini. Harapan penulis semoga penelitian dan penyusunan skripsi ini bermanfaat bagi semua pihak yang membutuhkan dan menjadi sumbangan kecil bagi perkembangan ilmu pengetahuan.
Yogyakarta, Januari 2012
ix
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS...vi
BAB II PENELAAHAN PUSTAKA... 5
A. Bawang Daun... 5
1. Morfologi tanaman... 5
2. Kandungan kimia bawang daun... 6
3. Kegunaan bawang daun... 6
B. Senyawa Fenolik... 7
C. Ekstraksi... 8
x
E. Antioksidan... 15
F. Metode DPPH... 17
G. Spektrofotometri... 18
H. Validasi Metode Analisis... 20
I. Landasan Teori... 22
J. Hipotesis... 23
BAB III METODE PENELITIAN... 24
A. Jenis dan Rancangan Penelitian... 24
B. Variabel... 24
C. Definisi Operasional... 24
D. Bahan dan Alat Penelitian... 25
E. Tata Cara Penelitian... 26
1. Determinasi tanaman... 26
2. Pengumpulan bahan... 26
3. Preparasi bawang daun...27
4. Pembuatan larutan pembanding dan uji... 28
5. Uji pendahuluan... 29
6. Optimasi metode uji aktivitas antioksidan... 30
7. Uji aktivitas antioksidan... 31
8. Optimasi metode penetapan kandungan fenolik total... 32
9. Penetapan kandungan fenolik total... 32
F. Analisis Hasil... 34
BAB IV HASIL DAN PEMBAHASAN... 36
A. Hasil Determinasi Tanaman... 36
B. Hasil Pengumpulan Bahan... 36
C. Hasil Preparasi Sampel... 38
D. Hasil Uji Pendahuluan... 42
1. Uji pendahuluan aktivitas antioksidan... 42
2. Uji pendahuluan fenolik... 43
E. Hasil Optimasi Metode Uji Aktivitas Antioksidan... 44
xi
2. Penentuan panjang gelombang maksimum... 46
F. Hasil Validasi Metode Uji Aktivitas Antioksidan... 47
1. Akurasi... 49
2. Presisi... 52
3. Linearitas... 52
4. Spesifitas... 53
G. Hasil Penentuan Aktivitas Antioksidan dengan Radikal DPPH... 54
H. Hasil Optimasi Metode Penetapan Kandungan Fenolik Total... 60
1. Penentuanoperating time (OT)... 60
2. Penentuan panjang gelombang maksimum... 61
I. Hasil Validasi Metode Penetapan Kandungan Fenolik Total... 62
1. Akurasi... 64
2. Presisi... 65
3. Liniearitas... 65
4. Spesifitas... 65
J. Hasil Penentuan Kandungan Fenolik Total... 66
BAB V KESIMPULAN DAN SARAN... 69
A. Kesimpulan... 69
B. Saran... 69
DAFTAR PUSTAKA... 70
LAMPIRAN... 74
xii
DAFTAR TABEL
xiii
DAFTAR GAMBAR
Gambar 1. Reaksi radikal DPPH dengan antioksidan (Windono,2001)
...17
Gambar 2. Diagram Skematis Spektrofotometer UV-Vis (Sastrohamidjojo, 2001) ...20
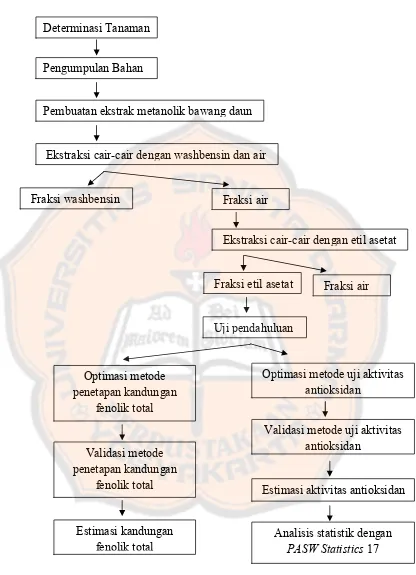
Gambar 3. Skema jalannya penelitian... 35
Gambar 4. Hasil Uji pendahuluan uji aktivitas antioksidan ( A = Larutan DPPH; B = Larutan DPPH + rutin; C = Larutan DPPH + fraksi etil asetat ekstrak metanol bawang daun ... 43
Gambar 5. Hasil Uji pendahuluan uji fenolik ( A = pereaksi Follin Ciocalteu + fraksi etil asetat ekstrak metanol bawang daun; B = pereaksi Follin Ciocalteu + asam galat; C = blanko)... 44
Gambar 6. Grafik penentuan OT rutin... 45
Gambar 7. Grafik penentuan OT etil asetat... 45
Gambar 8. Spektra λ maksimum DPPH pada tiga seri konsentrasi Keterangan : konsentrasi A = 0,080 mM; konsentrasi B = 0,040 mM; konsentrasi C = 0,020 mM... 47
Gambar 9. Kurva persamaan regresi linear aktivitas antioksidan rutin...48
Gambar 10. Kurva persamaan regresi linear aktivitas antioksidan fraksi etil asetat ekstrak metanolik bawang daun... 49
Gambar 11. Resonansi DPPH... 54
Gambar 12. Struktur Rutin... 55
Gambar 13. Donasi proton senyawa antioksidan pada radikal DPPH... 58
Gambar 14. Grafik penentuan OT asam galat... 60
Gambar 15. Spektra λ maksimum hasil scanning pada tiga seri konsentrasi asam galat (Keterangan : konsentrasi asam galat A = 50 µg/mL; B = 100 µg/mL; C = 150 µg/mL)... 61
Gambar 16. Reaksi senyawa fenolik dengan pereaksi Follin-Ciocalteu... 66
xiv
DAFTAR LAMPIRAN
Lampiran 1. Surat pengesahan determinasi tanaman bawang daun...74
Lampiran 2. Gambar tanaman bawang daun dari daerah Wukirsari, Cangkringan, Sleman ...75
Lampiran 3. Perhitungan rendemen...75
Lampiran 4. Data penimbangan bahan... 76
Lampiran 5. Data perhitungan konsentrasi DPPH, larutan pembanding dan larutan uji... 77
Lampiran 6. Scanningpengkoreksi... 79
Lampiran 7. Optimasi metode uji aktivitas antioksidan... 82
Lampiran 8. Uji aktivitas antioksidan menggunakan radikal DPPH... 84
Lampiran 9. Perhitungan nilai IC50 fraksi etil asetat ekstrak metanol bawang daun dan rutin... 85
Lampiran 10. Uji statistik aktivitas antioksidan dengan SPSS 17.0... 85
Lampiran 11. Penimbangan untuk uji kandungan fenolik total... ..86
Lampiran 12. Optimasi penentuan kandungan fenolik total... ..87
xv
INTISARI
Radikal bebas merupakan salah satu faktor berbahaya yang dapat menyebabkan berbagai penyakit pada tubuh. Untuk mengurangi atau menangkal efek buruk yang ditimbulkan oleh radikal bebas dibutuhkan suatu antioksidan. Antioksidan merupakan suatu senyawa yang dapat menetralkan reaksi radikal bebas dalam tubuh. Di dalam tumbuhan terdapat suatu senyawa fenolik dan flavonoid yang merupakan salah satu sumber antioksidan alami. Bawang daun merupakan salah satu tumbuhan yang biasanya digunakan untuk pelengkap sayuran namun ternyata memiliki kandungan flavonoid dan senyawa-senyawa golongan fenol.
Penelitian ini dilakukan untuk menentukan aktivitas antioksidan dan kandungan fenolik total fraksi etil asetat ekstrak metanolik bawang daun. Pengujian aktivitas antioksidan menggunakan radikal DPPH (1,1-diphenyl -2-picryl-hydrazyl), dan dinyatakan dengan nilai IC50 (Inhibition Concentration). Adanya senyawa antioksidan dapat menyebabkan perubahan warna larutan DPPH dari ungu menjadi kuning dan terjadi penurunan absorbansi DPPH yang dapat diukur menggunakan spektrofotometer pada λ maksimum DPPH yaitu 515,8 nm. Penetapan kandungan fenolik total menggunakan metode Follin-Ciocalteu dan dinyatakan dengan nilai massa ekivalen asam galat per g fraksi etil asetat ekstrak metanolik bawang daun. Senyawa fenolik dioksidasi oleh pereaksi fenol Follin-Ciocalteu dalam suasana basa sehingga terbentuk larutan berwarna biru yang memiliki λ maksimum 750 nm. Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak metanolik bawang daun memiliki nilai IC50 sebesar (188 ± 5,22) µg/mL dan tergolong memiliki aktivitas antioksidan lemah. Kandungan fenolik total sebesar (1,7 ± 0,04) mg ekivalen asam galat per g fraksi etil asetat.
xvi ABSTRACT
Free radical is a dangerous factor that can cause various diseases in the body. To decrease or avoid the negative effects of free radicals there is a need for antioxidants. Antioxidants are compounds that can neutralize the reaction of free radicals inside the body. In plants there are phenolic and flavonoid compounds which is a source of natural antioxidants, Welsh onion, a plant that is generally used as a complementary vegetable, turns out to possess an amount of flavonoid and compounds from the phenol group.
This research was executed to determine the antioxidant activity and the total amount of phenolic in the ethyl acetate fraction of the methanolic extract of Welsh onions. The antioxidant activity was tested using DPPH (1,1- diphenyl-2-picryl-hydrazyl) radical, and was indicated with a value of IC50 (Inhibition Concentration). The existence of antioxidant compounds can cause a change of colour in the DPPH solution from purple to yellow and a decline in the absorption of DPPH which can be measured using a spectrophotometer with the maximum wavelength of DPPH at 515.8 nm. The determination of the total phenolic amount was done using the Follin-Ciocalteu method and indicated with the equivalent mass value of gallic acid per gram ethyl acetate fraction of the methanolic extract of Welsh onions. The phenolic compound was oxidized with the phenol reactant Follin-Ciocalteu in an alkali environment, thus a blue solution was formed with a maximum wavelength of 750 nm. The results of this research showed that the ethyl acetate fraction of the methanolic extract of Welsh onions has an IC50value of (188 ± 5,22) µg/mL and is classified to have a weak antioxidant activity. The total phenolic amount is (1,7 ± 0,04) mg equivalent mass value of gallic acid per gram ethyl acetate fraction of the methanolic extract of Welsh onions.
1
BAB I
PENGANTAR
A. Latar Belakang
Radikal bebas adalah suatu atom atau molekul yang tidak stabil dan sangat
reaktif karena memiliki satu atau lebih elektron tidak berpasangan pada orbital
terluarnya. Untuk mengembalikan kesetimbangannya, radikal bebas akan
berusaha mendapatkan elektron dari molekul lain atau melepas elektron yang
tidak berpasangan yang dimilikinya. Reaksi ini akan berlangsung terus menerus
dalam tubuh, dan akan sangat berbahaya jika jumlahnya berlebihan dalam tubuh
karena dapat menimbulkan berbagai penyakit seperti jantung, penuaan dini,
kanker, serta penyakit degeneratif lainnya. Radikal bebas terbentuk di dalam
tubuh akibat produk sampingan metabolisme atau karena paparan radikal bebas
dari luar melalui pernapasan. Oleh karena itu, dibutuhkan suatu antioksidan, yaitu
suatu substansi yang mampu menangkap radikal bebas tersebut sehingga tidak
dapat menginduksi suatu penyakit. Senyawa antioksidan akan menyerahkan satu
atau lebih elektronnya pada radikal bebas sehingga dapat menghentikan kerusakan
yang disebabkan oleh radikal bebas (Dalimartha & Soedibyo, 1998; Sibuea,
2003).
Sebenarnya tubuh manusia sudah menghasilkan senyawa antioksidan,
tetapi jumlahnya seringkali tidak mencukupi untuk dapat menetralkan radikal
bebas yang masuk dalam tubuh. Kekurangan antioksidan di dalam tubuh
radikal bebas dalam tubuh dapat dijaga dan mencegah stres oksidatif dan penyakit
penyakit kronis yang ditimbulkannya (Sofia, 2006).
Terdapat dua macam antioksidan, yaitu antioksidan alami dan antioksidan
sintetik. Namun antioksidan alami lebih dikembangkan dalam masyarakat
dibandingkan antioksidan sinetetik karena timbul kekhawatiran adanya efek
samping yang dapat ditimbulkan oleh antioksidan sintetik (Rohdiana, 2001).
Antioksidan alami dapat diperoleh dari berbagai sumber tumbuhan seperti
sayuran, buah-buahan dan juga rempah-rempah. Kebanyakan antioksidan yang
terdapat pada tumbuhan merupakan senyawa fenolik atau polifenolik. Senyawa
tersebut merupakan golongan flavonoid, dimana flavonoid telah terbukti memiliki
kemampuan untuk merubah atau menangkal radikal bebas (Sarastani, dkk., 2002;
Giorgio, 2000).
Salah satu sumber antioksidan alami adalah sayuran. Bawang daun (Allium
fistulosum L.) merupakan sayuran yang biasa digunakan sebagai penyedap dan
pelengkap aneka masakan. Bawang daun berkhasiat menghilangkan lendir dalam
kerongkongan, menyembuhkan reumatik, dan kurang darah (Wahyuningsih,
2010). Hasil penapisan terhadap simplisia bawang daun menunjukkan adanya
senyawa golongan flavonoid, saponin, steroid dan triterpenoid (Fransisca,
Fidrianny, Ruslan, 2006). Menurut penelitian bawang daun memiliki aktivitas
antioksidan karena mengandung senyawa flavonoid seperti kuersetin dan
kaempferol (Aoyama dan Yamamoto, 2007; Feng dan Liu, 2011).
Untuk mengetahui besar aktivitas antioksidan dari Bawang daun dilakukan
dikerjakan, mudah, cepat dan peka. Aktivitas antioksidan dari suatu senyawa
dapat diketahui dari penurunan absorbansi DPPH yang terjadi akibat penambahan
senyawa tersebut (Zuhraet al., 2008).
Berdasarkan hal-hal diatas maka penelitian ini bertujuan untuk mengetahui
besar aktivitas antioksidan dari bawang daun menggunakan metode DPPH yang
besar nilai aktivitas antioksidannya dinyatakan dengan IC50. Dan mengetahui
seberapa besar kandungan fenolik total yang terdapat dalam bawang daun yang
berperan dalam menghasilkan aktivitas antioksidannya.
B. Perumusan Masalah
a. Berapa nilai aktivitas antioksidan fraksi etil asetat ekstrak bawang daun
dengan menggunakan radikal bebas DPPH yang dinyatakan dengan IC50?
b. Berapakah kandungan fenolik total fraksi etil asetat bawang daun yang
dinyatakan dengan massa ekivalen asam galat?
C. Keaslian penelitian
Uji aktivitas antioksidan pada penelitian ini berbeda dengan penelitian
sebelumnya. Perbedaannya terletak pada sampel yang digunakan, yaitu fraksi etil
asetat bawang daun. Berdasarkan pengamatan penulis, uji aktivitas antioksidan
D. Manfaat Penelitian
1. Manfaat teoritis
Hasil dari penelitian ini diharapkan dapat memberikan tambahan
pengetahuan mengenai aktivitas antioksidan yang dimiliki bawang daun, sehingga
hasil penelitian dapat menjadi acuan untuk penelitian selanjutnya.
2. Manfaat praktis
Penelitian ini diharapkan dapat memberi informasi bagi penelitian lebih
lanjut maupun masyarakat luas mengenai potensi bawang daun sebagai salah satu
sumber antioksidan alami.
E. Tujuan Penelitian
1. Tujuan Umum
Tujuan umum penelitian ini adalah menguji aktivitas antioksidan
menggunakan radikal bebas DPPH dan menentukan kandungan fenolik total fraksi
etil asetat ekstrak metanolik bawang daun.
2. Tujuan khusus
a. Mengetahui nilai aktivitas antioksidan fraksi etil asetat ekstrak metanolik
bawang daun dengan menggunakan radikal bebas DPPH yang
dinyatakan dengan IC50.
b. Mengetahui kandungan fenolik total fraksi etil asetat ekstrak metanolik
5
BAB II
PENELAAHAN PUSTAKA
A. Bawang daun
Bawang daun ( Allium fistulosum L.) berasal dari Siberia, dengan umbi
memanjang, putih, serta kurang terkembang dan berdaun geronggang berwarna
hijau. Dalam bahasa Inggris disebut Welsh onion, dalam bahasa Indonesia adalah
bawang daun, di Jawa disebutbawang oncang(Heyne, 1987).
1. Morfologi tanaman
Struktur tubuh tanaman bawang daun terdiri atas : akar, batang semu, dan
daun. Di samping itu, pada stadium reproduktif dapat menghasilkan bunga dan
biji. Bawang daun termasuk tanaman setahun atau semusim yang berbentuk
rumput. Sistem perakarannya termasuk akar serabut yang terpencar kesemua arah
pada kedalaman antara 15-30 cm (Rukmana, 1995).
Batang semu terbentuk dan tersusun dari pelepah-pelepah daun yang
saling menutupi. Bagian batang semu yang tertimbun tanah umumnya berwarna
putih bersih, sedangkan batang semu dipermukaan tanah berwarna hijau
keputihan. Sifat hidup tanaman ini merumpun, yakni membentuk anak-anakan
yang baru (Rukmana, 1995).
Bentuk daun dari bawang daun dibedakan atas dua macam, yaitu bulat
panjang didalamnya berlubang seperti pipa. Panjang pipih tidak berlubang. Warna
antara 18-30 cm atau lebih, tergantung dari varieties dan kesuburan
pertumbuhannya (Rukmana, 1995).
Tangkai bunga keluar dari ujung tanaman (titik tumbuh) yang panjangnya
antara 30-90 cm. Secara keseluruhan, bentuk bunga bawang daun seperti paying
(umbrella). Bunga bawang daun dapat menyerbuk sendiri ataupun silang dengan
bantuan serangga lalat-hijau ataupun dengan bantuan manusia, sehingga
menghasilkan buah dan biji (Rukmana, 1995).
Bentuk biji bawang daun umumnya agak pipih dan berwarna hitam. Biji
ini dapat dipergunakan sebagai bahan perbanyakan tanaman secara generatif
(Rukmana, 1995).
2. Kandungan kimia bawang daun
Bawang daun memiliki kandungan kuersetin dan juga kaempferol
(Aoyama dan Yamato, 2007; Feng dan Liu, 2011).Daun ini memiliki kandungan
vitamin A dan C tinggi, kalsium, protein, lemak, karbohidrat, serat dan kalori
(Wahyuningsih, 2010). Bawang daun mengandung saponin, tanin serta daunnya
juga mengandung minyak atsiri (Udechi, 2011). Hasil penapisan fitokimia bawang
daun menunjukkan kandungan senyawa golongan flavonoid, steroid, triterpenoid,
dan saponin (Fransisca, dkk., 2006).
3. Kegunaan bawang daun
Kebanyakan bawang daun digunakan sebagai sayuran dan berfungsi
sebagai penyedap dan pelengkap aneka masakan. Daun ini mengandung
unsur-unsur aktif yang memiliki daya bunuh bakteri (sebagai antibiotik) serta dapat
menghilangkan lendir dalam kerongkongan, menyembuhkan reumatik, dan kurang
darah (Wahyuningsih, 2010). Bawang daun bersifat diuretik, diaforetik dan
antiradang (Udechi, 2011). Bawang daun juga berguna bagi tubuh anatara lain
untuk memudahkan pencernaan, menghilangkan lendir-lendir dalam
kerongkongan, dan diduga dapat mendorong napas panjang (Rukmana, 1995).
B. Senyawa Fenolik
Senyawa fenolik merupakan substansi organik, terdiri dari senyawa
aromatik yang terikat dengan satu atau lebih substituen hidroksil (-OH). Senyawa
utamanya adalah fenol namun kebanyakan fenolik merupakan polifenol. Sumber
fenolik yang paling besar pada tumbuhan, dan diantara banyaknya senyawa
polifenol yang telah diketahui, paling banyak adalah golongan flavonoid (Mann,
Davidson, Hobss, Banthorpe, Harborne, 1994).
Golongan fenolik yang terbanyak adalah flavonoid. Flavonoid memiliki
sejumlah gugus hidroksil yang tidak tersubstitusi, atau suatu gula, sehingga
flavonoid merupakan senyawa polar yang cukup larut dalam senyawa polar
seperti metanol, etanol, butanol, aseton , dan air. (Markham,1988). Flavonoid
biasanya terdapat dalam dua jenis, yaitu flavonoid bentuk aglikon dan flavonoid
yang terikat gula (glikosida). Flavonoid yang terikat gula akan lebih larut dalam
air sedangkan flavonoid aglikon akan lebih larut dalam etil asetat (Robinson,
1995).
Senyawa fenolik meliputi beraneka ragam senyawa yang berasal dari
mengandung satu atau dua penyulih hidroksil. Senyawa fenolik cenderung mudah
larut dalam air karena umumnya berikatan dengan gula sebagai glikosida. Semua
senyawa fenol berupa senyawa aromatik sehingga semuanya menunjukkan
serapan di daerah spectrum UV. Selain itu. Senyawa fenolik menunjukkan
geseran batokrom pada spektrumnya bila ditambahkan basa. Oleh sebab itu,
senyawa fenolik dapat di identifikasi dan dianalisis secara kuantitatif
menggunakan spektrofotometer (Harborne, 1987).
Efek antioksidan terutama disebabkan karena adanya senyawa fenol
seperti flavonoid dan asam fenolat. Biasanya senyawa-senyawa yang memiliki
aktivitas antioksidan adalah senyawa fenol yang mempunyai gugus hidroksi yang
tersubstitusi pada posisi orto dan para terhadap gugus –OH dan -OR (Waji dan
Sugrani, 2009)
Fenolik memiliki aktivitas antioksidan kuat, hampir semua tanaman
memiliki polifenol, sehingga penentuan fenolik ini dilakukan. Metode standar
yang digunakan adalah Folin Ciocalteu. Untuk senyawa standar yang digunakan
adalah asam galat. Metode ini terbukti memiliki spesifitas yang baik untuk
berbagai ekstrak tanaman dan tidak terdapat masalah yang berarti dengan prinsip
analisis (Saifudin, Rahayu, Teruna, 2011).
C. Ekstraksi
Ekstraksi adalah penarikan zat pokok yang diinginkan dari bahan mentah
obat dan menggunakan pelarut yang dipilih dimana zat yang diinginkan dapat
tidak perlu diproses lebih lanjut kecuali dikumpulkan atau dikeringkan. Tiap-tiap
bahan mentah obat disebut ekstrak, tidak mengandung hanya satu unsur saja tetapi
berbagai unsur, tergantung pada obat yang digunakan dan kondisi dari ekstraksi
(Ansel, 1989).
Ekstrak adalah sediaan kental yang diperoleh dengan mengekstraksi
senyawa aktif dari simplisia nabati atau simplisia hewani dengan menggunakan
pelarut yang sesuai, kemudian semua atau hamper semua pelarut diuapkan dan
massa atau serbuk yang tersisa diperlakukan sedemikian rupa hingga memenuhi
baku yang telah ditetapkan (BPOM RI, 2005).
Maserasi (maserace = mengairi, melunakkan) adalah cara ekstraksi yang
paling sederhana. Bahan simplisia yang dihaluskan sesuai syarat-syarat farmakope
(umumnya terpotong-potong atau berupa serbuk kasar) disatukan dengan bahan
pengekstraksi. Selanjutnya, rendaman tersebut disimpan terlindungi dari cahaya
langsung (mencegah reaksi yang dikatalisis cahaya atau perubahan warna) dan
dikocok kembali. Waktu maserasi pada umumnya 5 hari. Setelah waktu tersebut,
artinya keseimbangan antara bahan yang diekstraksi pada bagian dalam sel
dengan yang masuk dalam cairan telah tercapai. Dengan pengocokan dijamin
keseimbangan konsentrasi bahan ekstraksi lebih cepat dalam cairan. Keadaan
diam selama maserasi tidak memungkinkan terjadinya ekstraksi absolut. Makin
besar perbandingan simplisia terhadap cairan pengekstraksi, akan makin banyak
Beberapa modifikasi dapat dilakukan pada metode maserasi, yakni:
1. Digesti
Merupakan maserasi dengan pemanasan lemah pada suhu 400-500C. Maserasi seperti ini hanya digunakan untuk zat aktif yang tahan terhadap
pemanasan.
2. Maserasi dengan mesin pengaduk
Adanya penggunaan mesin pengaduk yang berputar terus-menerus dapat
mempersingkat waktu maserasi terjadi 6-24 jam.
3. Remaserasi
Merupakan maserasi dengan cairan penyari yang ada dua. Serbuk
simplisia dimaserasi dengan cairan pertama, dienapkan tuangkan dan diperas,
kemudia dimaserasi kembali dengan cairan yang kedua.
4. Maserasi melingkar
Merupakan proses maserasi dengan cairan penyari yang selalu bergerak
dan menyebar, dengan demikian proses maserasi akan menjadi lebih baik. Cairan
penyari dipompa dari bawah bejana penyari, melalui pipa penghubung dan
kemudian masuk kembali ke bejana penyari dengan cara diemburkan oleh alat
penyembur ke permukaan serbuk simplisia. Proses tersebut dilakukan secara
berulang hingga cairan penyari menjadi jenuh oleh zat aktif (Ansel, 1989).
Ekstrak kasar perlu difraksinasi untuk memisahkan golongan utama
kandungan yang satu dari golongan utama lainnya. Salah satu caranya adalah
dengan metode ekstraksi cair-cair. Ekstraksi cair-cair merupakan suatu teknik
(biasanya pelarut organik), sehingga menimbulkan perpindahan satu atau lebih zat
terlarut ke dalam pelarut yang kedua. Pada prinsipnya, kedua pelarut yang
digunakan tidak saling tercampurkan. Metode ektrasksi cairan-cairan yang sering
digunakan adalah menggunakan alat corong pisah, dimana kedua pelarut yang
tidak saling campur dimasukkan ke dalam corong pisah dan dilakukan
penggojogan selama beberapa menit (Bassett,et al., 1991).
D. Radikal Bebas
Radikal bebas adalah sekelompok bahan kimia baik berupa atom maupun
molekul yang tidak stabil san sangat reaktif karena memiliki satu atau lebih
elektron tidak berpasangan pada lapisan atau orbital terluarnya. Merupakan juga
suatu kelompok bahan kimia dengan reaksi jangka pendek yang memiliki satu
atau lebih elektron bebas (Droge, 2002).
Untuk mencapai kestabilan atom atau molekul, radikal bebas akan
bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron.
Reaksi ini akan berlangsung terus menerus dalam tubuh dan bila tidak dihentikan
akan menimbulkan berbagai penyakit seperti kanker, jantung, katarak, penuaan
dini, dan penyakit degeneratif lainnya. Oleh karena itu, tubuh memerlukan suatu
substansi yang penting, yaitu antioksidan yang mampu menangkap radikal bebas
tersebut sehingga tidak dapat menginduksi suatu penyakit (Waji dan Sugrani,
Secara umum tahapan reaksi pembentukan radikal bebas mirip dengan
rancidity oxidative,yaitu melalui 3 tahapan reaksi berikut.
a. Tahap inisiasi, yaitu awal pembentukan radikal bebas. Misalnya :
Fe+++ H2O Fe++++ OH-+ OH R1-H + OH R1 + H2O
b. Tahap propagasi, yaitu pemanjangan rantai radikal.
R2-H + OH R2 + R1-H R3H + R2 R3 + R2-H
c. Tahap terminasi, yaitu bereaksinya senyawa radikal dengan radikal
lain atau dengan penangkap radikal, sehingga potensi propagasinya
rendah.
Radikal bebas yang ada ditubuh manusia berasal dari 2 sumber :
a. Sumber endogen
(Fe II) juga dapat kehilangan elektronnya melalui oksigen untuk membuat
superoksida dan Fe III melalui proses autoksidasi (Droge, 2002).
2. Oksidasi enzimatik
Beberapa jenis sistem enzim mampu menghasilkan radikal bebas
dalam jumlah yang cukup bermakna, meliputi xanthine oxidase (activated in
ischemia-reperfusion), prostaglandin synthase, lipoxygenase, aldehyde oxidase,
dan amino acid oxidase. Enzim myeloperoxidase hasil aktifasi netrofil,
memanfaatkan hidrogen peroksida untuk oksidasi ion klorida menjadi suatu
oksidan yang kuat asam hipoklor (Inoue, 2001).
3. Respiratory burst
Merupakan terminologi yang digunakan untuk menggambarkan proses
dimana sel fagositik menggunakan oksigen dalam jumlah yang besar selama
fagositosis. Lebih kurang 70-90 % penggunaan oksigen tersebut dapat
diperhitungkan dalam produksi superoksida. Fagositik sel tersebut memiliki
sistem membran bound flavoprotein cytochrome-b-245 NADPH oxidase.
Enzim membran sel seperti NADPH-oxidase keluar dalam bentuk inaktif.
Paparan terhadap bakteri yang diselimuti imunoglobulin, kompleks imun,
komplemen 5a, atau leukotrien dapat mengaktifkan enzim NADPH-oxidase.
Aktifasi tersebut mengawali respiratory burst pada membran sel untuk
memproduksi superoksida. Kemudian H2O2 dibentuk dari superoksida dengan
cara dismutasi bersama generasi berikutnya dari OH dan HOCl oleh bakteri
b. Sumber eksogen
1. Obat-obatan
Beberapa macam obat dapat meningkatkan produksi radikal bebas dalam
bentuk peningkatan tekanan oksigen. Bahan-bahan tersebut bereaksi bersama
hiperoksia dapat mempercepat tingkat kerusakan. Termasuk didalamnya
antibiotika kelompok quinoid atau berikatan logam untuk aktifitasnya
(nitrofurantoin), obat kanker seperti bleomycin, anthracyclines (adriamycin), dan
methotrexate, yang memiliki aktifitas pro-oksidan. Selain itu, radikal juga berasal
dari fenilbutason, beberapa asam fenamat dan komponen aminosalisilat dari
sulfasalasin dapat menginaktifasi protease, dan penggunaan asam askorbat
dalam jumlah banyak mempercepat peroksidasi lemak (Proctor and Reynold,
1984).
2. Radiasi
Radioterapi memungkinkan terjadinya kerusakan jaringan yang
disebabkan oleh radikal bebas. Radiasi elektromagnetik (sinar X, sinar gamma)
dan radiasi partikel (partikel elektron, photon, neutron, alfa, dan beta)
menghasilkan radikal primer dengan cara memindahkan energinya pada
komponen seluler seperti air. Radikal primer tersebut dapat mengalami reaksi
sekunder bersama oksigen yang terurai atau bersama cairan seluler (Droge,
2002).
3. Asap rokok
Oksidan dalam rokok mempunyai jumlah yang cukup untuk memainkan
oksidan asap tembakau menghabiskan antioksidan intraseluler dalam sel paru (in
vivo) melalui mekanisme yang dikaitkan terhadap tekanan oksidan. Diperkirakan
bahwa tiap hisapan rokok mempunyai bahan oksidan dalam jumlah yang sangat
besar, meliputi aldehida,epoxida, peroxida, dan radikal bebas lain yang mungkin
cukup berumur panjang dan bertahan hingga menyebabkan kerusakan alveoli.
Bahan lain seperti nitrit oksida, radikal peroksil, dan radikal yang mengandung
karbon ada dalam fase gas. Juga mengandung radikal lain yang relatif stabil
dalam fase tar. Contoh radikal dalam fase tar meliputi semiquinone moieties
dihasilkan dari bermacam-macam quinone dan hydroquinone. Perdarahan kecil
berulang merupakan penyebab yang sangat mungkin dari desposisi besi dalam
jaringan paru perokok. Besi dalam bentuk tersebut meyebabkan pembentukan
radikal hidroksil yang mematikan dari hidrogen peroksida. Juga ditemukan bahwa
perokok mengalami peningkatan netrofil dalam saluran napas bawah yang
mempunyai kontribusi pada peningkatan lebih lanjut konsentrasi radikal bebas
(Droge, 2002).
E. Antioksidan
Antioksidan merupakan zat yang dapat menetralkan radikal bebas, atau
suatu bahan yang berfungsi mencegah sistem biologi tubuh dari efek yang
merugikan yang timbul dari proses ataupun reaksi yang menyebabkan oksidasi
yang berlebihan (Hariyatmi, 2004).
Antioksidan menstabilkan radikal bebas dengan melengkapi kekurangan
dari pembentukan radikal bebas yang dapat menimbulkan stress oksidatif. Ada
beberapa bentuk antioksidan, diantaranya vitamin, mineral, dan fitokimia.
Berbagai tipe antioksidan bekerja bersama dalam melindungi sel normal dan
menetralisir radikal bebas. Antioksidan adalah suatu inhibitor yang bekerja
menghambat oksidasi dengan cara bereaksi dengan radikal bebas reaktif
membentuk radikal bebas tak reaktif yang relatif lebih stabil (Waji dan Sugrani,
2009).
Berdasarkan titik tangkap dari aktivitas antioksidan terhadap radikal bebas
maka antioksidan digolongkan menjadi 3, yaitu antioksidan primer, sekunder,
tersier. Antioksidan primer bekerja dengan menghalangi pembentukan radikal
bebas baru, contohnya adalah katalase. Antioksidan sekunder bekerja menekan
terjadinya reaksi rantai, biasa disebut penangkap radikal, misalnya vitamin E.
Sedangkan sntioksidan tersier bekerja memperbaiki kerusakan-kerusakan yang
terjadi akibat serangan radikal bebas. Termasuk golongan ini adalah enzim yang
memperbaiki DNA dan metionin sulfoksida reduktase (Hertiani, 2000).
Aktivitas senyawa polifenol sebagai antioksidan meliputi tiga
mekanisme, yaitu sebagai berikut.
1) Aktivitas penangkapan radikal bebas dengan proses transfer elektron melalui
atom hidrogen,
2) mencegah spesies senyawa reaktif memproduksi katalisis melalui reaksi
khelasi metal (pengkelatan logam), dan
3) interaksi dengan antioksidan lain untuk meningkatkan aktivitasnya, seperti
F. Metode DPPH
Molekul 1,1-diphenyl-2-picryl-hydrazyl (DPPH) merupakan suatu radikal
bebas yang stabil dan dapat bereaki dengan senyawa yang dapat mendonorkan
atom hidrogen, sehingga berguna untuk pengujian suatu aktivitas antioksidan dari
suatu senyawa (Dinis, Maderia, dan Almeida, 1994).
Metode DPPH dapat digunakan untuk menguji aktivitas antioksidan
didasarkan pada kemampuan suatu antioksidan untuk mengurangi intensitas
warna ungu radikal DPPH. Interaksi antara antioksidan dan radikal DPPH adalah
dengan donasi atom hidrogen pada DPPH akan menetralkan radikal bebas dari
DPPH. Perubahan warna dari ungu menjadi kuning terang menandakan bahwa
elektron pada radikal bebas DPPH telah menjadi berpasangan (Molyneux,2004).
Pengujian menggunakan metode DPPH yaitu menggunakan 1,1-diphenyl
-2-picryl-hydrazyl (DPPH) yang merupakan radikal bebas, yang jika direaksikan
dengan ekstrak tumbuhan yang mengandung antioksidan maka akan terjadi reaksi
penangkapan hidrogen dari antioksidan oleh radikal bebas DPPH (berwarna ungu)
yang kemudian akan berubah menjadi 1,1-diphenyl-2-picryl-hydrazin (berwarna
kuning).
Metode DPPH merupakan salah satu metode yang akurat untuk mengukur
aktivitas antioksidan pada buah dan ekstrak sayur (Kwok, 2003). Pengukurannya
menggunakan spektrofotometri visible, karena DPPH memberikan serapan kuat
pada 517 nm, absorbsinya menurun saat elektron yang dimilikinya menjadi
berpasangan ketika ada suatu penangkap radikal bebas. Larutan DPPH berubah
dari ungu menjadi kuning ketika terdapat suatu senyawa antioksidan yang dapat
menangkap radikal bebas yang dimilikinya (Dehpouret. al,2009)
G. Spektrofotometri
Spektrofotometri UV-visibel merupakan teknik spektroskopik yang
memakai sumber radiasi elektromagnetik ultra violet dekat (190-380 nm) dan
sinar tampak (380-780 nm) dengan memakai instrumen spektrofotometer. (Mulja
dan Suharman, 1995).
Sinar ultraviolet dan sinar tampak memberikan energi yang cukup untuk
terjadinya transisi elektronik. Dengan demikian, spektra ultraviolet dan spektra
tampak dikatakan sebagai spektra elektronik. Keadaan energi yang paling rendah
disebut dengan keadaan dasar (ground state). Transisi-transisi elektronik akan
meningkatkan energi molekuler dari keadaan dasar ke satu atau lebih tingkat
energi tereksitasi. Jika suatu molekul sederhana dikenakan radiasi elektromagnetik
maka molekul tersebut akan menyerap radiasi elektromagnetik yang energinya
sesuai. Interaksi antara molekul dengan radiasi elektromagnetik ini akan
meningkatkan energi potensial elektron pada tingkat keadaan tereksitasi. Apabila
macam gugus yang terdapat pada molekul, maka hanya akan terjadi satu absorbsi
yang merupakan garis spektrum (Gandjar dan Rohman, 2007).
Spektra UV-Vis dapat digunakan untuk informasi kualitatif dan juga
digunakan untuk analisis kuantitatif. Dalam aspek kuantitatif, suatu berkas radiasi
dikenakan pada cuplikan (larutan sampel) dan intensitas sinar radiasi yang
diteruskan diukur besarnya. Radiasi yang diserap oleh cuplikan ditentukan dengan
membandingkan intensitas yang diteruskan dengan intensitas sinar yang diserap
jika tidak ada spesies penyerap lainnya. Intensitas atau kekuatan radiasi cahaya
sebanding dengan jumlah foton perdetik yang melalui satu satuan luas
penampang. Serapan dapat terjadi jika foton/radiasi yang mengenai cuplikan
memiliki energi yang sama dengan energi yang dibutuhkan untuk menyebabkan
terjadinya perubahan tenaga. Kekuatan radiasi juga mengalami penurunan dengan
adanya penghamburan dan pemantulan cahaya, akan tetapi penurunan karena hal
tersebut sangat kecil dibandingkan dengan proses penyerapan (Gandjar dan
Rohman, 2007).
Hukum Lambert-Beer menyatakan bahwa intensitas yang diteruskan oleh
larutan zat penyerap berbanding lurus dengan tebal dan konsentrasi larutan.
= ε bc
Harga ε adalah karakteristik untuk molekul atau ion penyerap dalam pelarut
tertentu dan pada panjang gelombang tertentu. Harga ε tidak tergantung pada
konsentrasi dan panjang lintasan radiasi. Pada persamaan menunjukkan bahwa
penentuan absorbansi atau transmitan akan menghasilkan konsentrasi jika ε dan b
Spektofotometer yang sesuai untuk pengukuran di daerah spektrum
ultraviolet dan sinar tampak terdiri atas suatu sistem optik dengan kemampuan
menghasilkan sinar monokromatis dalam jangkauan panjang gelombang 200-800
nm (Gandjar dan Rohman, 2007).
Gambar 2. Diagram Skematis Spektrofotometer UV-Vis (Sastrohamidjodjo, 2001)
Sumber radiasi terlihat biasanya digunakan lampu filament tungsten.
Monokromator merupakan rangkaian alat optik yang menguraiakan radiasi
polikromatik menjadi jalur-jalur yang efektif/panjang gelombang-gelombang
tunggalnya dan memisahkan panjang gelombang-gelombang tersebut menjadi
jalur-jalur yang sangat sempit. Cahaya monokromatis dilewatkan pada sel
penyerap atau tempat sampel. Sampel biasanya diletakkan pada kuvet,terbuat dari
gelas atau kuarsa transparan. Detektor berfungsi menangkap cahaya yang
diteruskan dari sampel dan mengubahnya menjadi arus listrik. Meter/pencatat
akan menangkap besarnya isyarat listrik yang berasal dari detektor
(Sastrohamidjojo, 2001).
H. Validasi Metode Analisis
Validasi metoda analisis adalah suatu tindakan penilaian terhadap
parameter tertentu, berdasarkan percobaan laboratorium, untuk membuktikan
bahwa parameter tersebut memenuhi persyaratan untuk penggunaannya (Harmita,
Paramater-parameter validasi metode analisis yang diperlukan untuk
menilai kesahihan metode analisis antara lain meliputi akurasi, presisi, linearitas,
dan spesifisitas.
Akurasi metode analisis adalah ukuran yang menunjukkan derajat
kedekatan hasil analisis dengan kadar analit yang sebenarnya. Kecermatan
dinyatakan sebagai persen perolehan kembali (recovery) analit yang ditambahkan.
Kriteria kecermatan sangat bergantung kepada konsentrasi analit dalam matriks
sampel dan pada keseksamaan metode (RSD). Akurasi ditentukan dengan %
recovery. (Harmita, 2004).
Tabel 1. Rentang kesalahan yang diperbolehkan (Harmita, 2004)
Analit pada matrik
Presisi adalah ukuran yang menunjukkan derajat kesesuaian antara hasil
uji individual, diukur melalui penyebaran hasil individual dari rata-rata jika
prosedur diterapkan secara berulang pada sampel-sampel yang diambil dari
campuran yang homogen (Harmita, 2004).
Presisi dinyatakan dalam standar deviasi atau koefisien variasi, dan tabel
Tabel 2. RentangCVyang masih dapat diterima (Harmita, 2004) Analit pada matrik
sampel (%)
KV (%)
>1 2,5
0,001 5
0,000.1 (1ppm) 16
0,0000.000.1 (1ppb) 32
Linearitas adalah kemampuan metode analisis yang memberikan respon
yang secara langsung atau dengan bantuan transformasi matematik yang baik,
proporsional terhadap konsentrasi analit dalam sampel (Harmita, 2004).
Sebagai parameter adanya hubungan linear digunakan koefisien korelasi
r pada analisis regresi linear. Hubungan linear yang ideal dicapai jika nilai b=0
dan r=+1 atau -1 tergantung arah garis (Harmita, 2004).
Selektifitas atau spesifitas merupakan kemampuan dari metode untuk
mendeteksi dan menganalisa analit dalam sebuah matriks tanpa gangguan dari
komponen lain yang berada dalam matriks tersebut (Ahuja dan Rasmussen, 2007).
I. Landasan Teori
Bawang daun (Allium fistulosumL.) yang dalam keseharian dimanfaatkan
sebagai salah satu pelengkap masakan ternyata memiliki kandungan vitamin A
dan C yang cukup tinggi dan juga menurut penelitian memiliki kandungan
flavonoid yang sperti telah diketahui memiliki aktivitas antioksidan. Adanya
gugus –OH fenolik pada senyawa flavonoid bertanggung jawab terhadap aktivitas
yang dapat menangkal radikal bebas yang dapat menimbulkan suatu efek buruk
pada tubuh.
Metode DPPH (1,1-diphenyl-2-picryl-hydrazyl) merupakan suatu metode
yang relatif sederhana dan akurat untuk mengukur suatu aktivitas antioksidan dari
suatu senyawa. Metode ini biasanya digunakan untuk pengujian aktivitas
antioksidan dari senyawa yang berasal dari suatu bahan alam. Besarnya aktivitas
antioksidan ditunjukkan dengan nilai IC50yang dihasilkan pada pengukuran.
Pengujian besarnya fenolik total berhubungan dengan besarnya daya
antioksidan yang dimiliki senyawa tersebut. Kandungan fenolik total akan
berbanding lurus dengan besarnya aktivitas antioksidan yang ditunjukkan oleh
senyawa yang diuji. Kandungan fenolik total ditentukan dengan metode
Folin-Ciocalteu.
J. Hipotesis
Fraksi etil asetat ekstrak metanolik bawang daun mempunyai aktivitas
antioksidan yang ditunjukkan oleh besarnya nilai IC50 melalui pengujian
menggunakan metode DPPH dan kandungan fenolik total dalam fraksi etil asetat
24
BAB III
METODOLOGI PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental rancangan acak
sederhana karena subjek uji diberi perlakuan.
B. Variabel
1. Variabel bebas berupa konsentrasi fraksi etil asetat ekstrak metanolik bawang
daun .
2. Variabel tergantung berupa aktivitas antioksidan dan kandungan fenolik total
fraksi etil asetat ekstrak metanolik bawang daun .
3. Variabel pengacau terkendali berupa tempat tumbuh tanaman, waktu
pemanenan, umur daun yang dipanen, cara panen, cara pengeringan dan
pembuatan simplisia, dan jumlah (g) daun segar yang digunakan. cahaya
matahari
4. Variabel pengacau tak terkendali berupa, cuaca atau musim, dan curah hujan,
kelembaban ruangan.
C. Definisi Operasional
1. Bawang daun adalah keseluruhan bagian tanaman bawang daun kecuali akar
yang dipanen dari hasil budidaya tanaman organik di daerah Wukirsari,
2. Ekstrak bawang daun adalah ekstrak kental yang diperoleh dari hasil maserasi
dengan metanol.
3. Fraksi etil asetat adalah hasil fraksi ekstak metanol bawang daun dengan
menggunakan etil asetat.
4. Persen inhibition concentration (%IC) adalah persen yang menyatakan
kemampuan fraksi etil asetat ekstrak metanolik bawang daun untuk menangkap
radikal DPPH.
5. Persen inhibition concentration 50 (IC50) adalah nilai konsentrasi fraksi etil
asetat ekstrak metanolik bawang daun yang menghasilkan penangkapan 50%
radikal DPPH.
D. Bahan dan Alat Penelitian
1. Bahan penelitian
Bahan yang digunakan dalam penelitian ini antara lain: bawang daun
(Allium fistulosum L.) yang berasal dari lahan budidaya tanaman organik daerah
Wukirsari, Kecamatan Cangkringan, Kabupaten Sleman, Yogyakarta. Bahan kima
kualitas farmasetis (CV. General Labora) berupa akuades. Bahan kimia kualitas
pro analitik (E.Merck) meliputi Silika gel GF254 , metanol. Bahan kualitas pro
analitik Sigma Chem. Co., USA meliputi rutin, DPPH , reagen Folin-Ciocalteu,
asam galat. Bahan kualitas teknis Brataco Chemica, yaitu: metanol, wasbensin,
2. Alat penelitian
Alat-alat yang digunakan dalam penelitian ini berupa vortex (junke &
kunkel), spektrofotometer UV-VIS (Perkin Elmer Lamda 20), blender, corong,
Buchner, oven, mikropipet 10-1000 µL; 1-10 mL (Acura 825, Socorex), neraca
analitik (Scaltec SBC 22, BP 160P), vacuum rotary evaporator (Junke &
Kunkel), waterbath (labo-tech, Heraceus), tabung reaksi bertutup, dan alat-alat
gelas yang lazim digunakan di laboratorium analisis (Pyrex-Germany dan Iwaki).
E. Tatacara Penelitian
1. Determinasi tanaman
Determinasi tanaman bawang daun dilakukan di Laboratorium
Farmakognosi-Fitokimia, Fakultas farmasi Universitas Sanata Dharma menurut
buku Flora of Java volume I dan III karangan Backer dan Bakhuizen van den
Brink (1968).
2. Pengumpulan bahan
Bawang daun diperoleh dari ahan budidaya tanaman organik daerah
Wukirsari, Kecamatan Cangkringan, Kabupaten Sleman, Yogyakarta.
Pengumpulan pada bulan September. Pemanenan dilakukan pada tanaman yang
3. Preparasi bawang daun
Sebanyak 1 kg bawang daun segar, dibersihkan ,kemudian dihaluskan
dengan blender. Ketika dihaluskan, daun tersebut ditambah sedikit cairan penyari
(metanol). Simplisia yang telah dihaluskan ditimbang dan dituang kedalam
bejana maserasi, ditambah metanol sampai terendam sempurna, dan dicampur
homogen. Campuran dimasersi pada suhu ruangan selama dua hari. Filtrat
diperoleh melalui penyaringan dengan corong Buchner. Ampas penyaringan
diremaserasi dengan metanol secukupnya selama 2 hari. Kemudian disaring. Lalu
hasil penyaringan filtat diuapkan pelarutnya mengguanganrotary evaporator dan
dilanjutkan dengan waterbath sehingga diperoleh ekstrak metanol bawang daun
hingga mencapai bobot tetap.
Ekstrak metanol bawang daun ditambahkan atau dilarutkan dengan air
hangat dan di ekstraksi cair-cair menggunakan wasbensin dengan perbandingan
larutan ekstrak dan washbensin (1:1 v/v), kemudian didiamkan sampai terpisah
sempurna. Fase air akan berada pada paling bawah, sedangkan fase wasbensin
berada pada bagian atas.
Dari hasil partisi diperoleh dua fraksi, yaitu fraksi wasbensin dan fraksi
air. Selanjutnya fraksi air diekstraksi cair-cair lagi menggunakan etil asetat dengan
perbandingan larutan fraksi air-etil asetat (1:1 v/v) sehingga didapatkan fraksi air
dan etil asetat. Kemudian fraksi air dan fraksi etil asetat dipisahkan. Setelah
dipisahkan fraksi etil asetat diuapkan dengan vacum rotary evaporator dan
sehingga didapatkan fraksi kental etil asetat bawang daun. Lalu hasil fraksi etil
asetat tersebut digunakan analisis lebih lanjut.
4. Pembuatan larutan pembanding dan uji
a. Pembuatan larutan DPPH
Sejumlah DPPH dilarutkan ke dalam metanol p.a sehingga diperoleh
larutan DPPH dengan konsentrasi 0,4 mM. Larutan tersebut ditutup dengan
alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan stok rutin
Sebanyak 2,5 mg rutin dilarutkan dengan metanol p.a sampai 10,0
mL.
c. Pembuatan larutan pembanding
Diambil sebanyak 0,5 mL larutan stok rutin, ditambah metanol p.a
sampai 10,0 mL menjadi larutan intermediet. Kemudian diambil sebanyak 0,5;
1,0; 1,5; 2,0; dan 2,5 mL larutan intermediet, lalu ditambahkan metanol p.a
sampai 10,0 mL, sehingga diperoleh konsentrasi larutan standar rutin sebesar
2,5; 5,0; 7,5; 10,0; dan 12,5 μg/mL.
d. Pembuatan larutan uji
i. Larutan uji untuk aktivitas antioksidan
Sejumlah 25,0 mg fraksi etil asetat ditimbang dan ditambah metanol
p.a sampai 25,0 mL. Diambil sebanyak 1,0 mL larutan tersebut, kemudian
ditambahkan metanol p.a sampai 10,0 mL menjadi larutan intermediet.
Kemudian diambil 2,0 mL; 3,0 mL; 4,0 mL; 5,0 mL; 6,0 mL sehingga
ii. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 15 mg fraksi etil asetat ditimbang, lalu ditambahkan
methanolp.asampai diperoleh konsentrasi larutan uji sebesar 1500,0 µg/mL.
e. Pembuatan larutan asam galat
Dibuat larutan asam galat dengan konsetrasi 500 µg/mL dalam akuades
: methanol p.a (1:1). Diambil sebanyak 0,5; 1,0; 1,5; 2,0; dan 2,5 mL larutan
tersebut, kemudian ditambahkan akuades : methanolp.a(1:1) sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan baku asam galat sebesar 25; 50; 75;
100; dan 125 µg/mL.
5. Uji pendahuluan
a. Uji fenolik
Sejumlah 0,5 mL larutan uji 1500,0 µg/mL dan larutan pembanding
asam galat 125,0 µg/mL ditambahkan 2,5 mL pereaksi fenol Folin-Ciocalteu
yang telah diencerkan dengan akuades (1:10 v/v) kedalam tabung reaksi.
Diamkan selama 10 menit. Tambahkan 7,5 mL larutan natrium karbonat 1 M.
Kemudian amati warna larutan tersebut.
b. Uji pendahuluan aktivitas antioksidan
Sebanyak 1 mL larutan DPPH dimasukan ke dalam masing-masing
tabung reaksi. Ditambahkan masing-masing dengan 1 mL metanol p.a, larutan
pembanding rutin 7,5 μg/mL , dan larutan uji 60,0 μg/mL. Selanjutnya larutan
divortex selamam 30 detik. Setelah 30 menit, amati warna pada larutan
tersebut.
6. Optimasi metode uji aktivitas antioksidan
a. Penentuanoperating time(OT)
Sebanyak 1 mL larutan DPPH dimasukan kedalam masing-masing tiga
labu ukur 10 mL, ditambahkan masing-masing dengan 1 mL larutan
pembanding rutin 2,5; 7,5 dan 12,5 μg/mL. Selanjutnya larutan tersebut
ditambahkan dengan metanol p.a hingga tanda batas. Larutan tersebut
kemudian divortex selama 30 detik. Setelah itu dibaca absorbansinya denga
spektrofotometer visibel pada panjang gelombang 517 nm selama 1 jam.
Dilakukan demikian juga untuk larutan uji 20; 40; 60 μg/mL.
b. Penentuan panjang gelombang serapan maksimum
Pada 3 labu ukur 10 mL, dimasukan masing-masing 0,5; 1,0; 1,5 mL
larutan DPPH. Ditambahkan larutan tersebut dengan metanol p.a hingga tanda
batas sehingga konsentrasi DPPH menjadi 0,020; 0,040; dan 0,080. Larutan
tersebut kemudian divortex selama 30 detik. Diamkan selama OT. Lalu
dilakukan scanning panjang gelombang serapan maksimum dengan
7. Uji aktivitas antioksidan
Uji aktivitas antioksidan ditentukan dengan menggunakan metode
spoktrofotometri sesuai dengan penelitian Nusarini (2007).
a. Pengukuran absorbansi larutan DPPH (kontrol)
Pada labu ukur 10 mL, dimasukan sebanyak 2 mL larutan DPPH.
Ditambahan larutan tersebut dengan metanolp.ahingga tanda batas. Kemudian
larutan tersebut dibaca absorbansinya pada saat OT dan panjang gelombang
maksimum. Pengerjaan dilakukan sebanyak 5 kali. Larutan ini digunakan
sebagai kontrol untuk menguji larutan pembanding dan uji.
b. Pengukuran absorbansi larutan pembanding dan uji
Sebanyak 1 mL larutan DPPH dimasukkan ke dalam tabung reaksi
bertutup kemudian ditambah dengan 1 mL larutan pembanding dan uji pada
berbagai seri konsentrasi telah dibuat. Selanjutnya larutan tersebut ditambah
dengan metanol p.a hingga tanda batas. Larutan tersebut kemudian divortex
selama 30 detik dan diamkan selamaOT. Larutan dibaca absorbansinya dengan
spektrofotometer visibel pada panjang gelombang maksimum hasil optimasi.
Pengujian dilakukan dengan 5 kali replikasi.
c. Validasi metode uji aktivitas antioksidan
Hasil dari prosedur 7 a dan b, divalidasi akurasi (% recovery), presisi
(%CV) spesipisitas (spektra kontrol), dan linearitas (nilai r).
%Recovery= x 100%
d. Estimasi aktivitas antioksidan
Hasil dari prosedur 7 a dan b, dihitung nilai %ICdanIC50untuk rutin dan
fraksi etil asetat ekstrak metanolik bawang daun.
8. Optimasi metode penetapan kandungan fenolik total
Optimasi metode penetapan kandungan fenolik total ditentukan dengan
menggunakan metode spektrofotometri sesuai dengan penelitian Nusarini ( 2007).
a. PenentuanOT
Sebanyak 0,5 mL larutan asam galat 25; 75; dan 125 μg/mL ditambahkan
dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v).
Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah
itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang
gelombang 750 nm selama 30 menit.
b. Penentuan panjang gelombang maksimum
Sebanyak 0,5 mL larutan asam galat 25; 75; dan 125 μg/mL ditambahkan
dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:1 v/v).
Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan
selama OT, absorbansinya dibaca pada λ maksimum dengan spektrofotometer
visibel pada panjang gelombang 600-800 nm.
9. Penetapan kandungan fenolik total
a. Pembuatan kurva baku asam galat
Sebanyak 0,5 mL larutan asam galat 25; 50; 75; 100; dan 125 μg/mL
ditambah dengan 5 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air
SetelahOT,absorbansinya dibaca pada λ maksimum terhadap blanko yang terdiri
atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium
karbonat 1M. Pengerjaan dilakukan 5 kali.
b. Validasi metode penetapan kandungan fenolik total
Hasil dari prosedur 9 a , divalidasi akurasi (%recovery), presisi (%CV),
spesipisitas (spektra kontrol), dan linearitas (nilai r).
%Recovery= x 100%
%CV= ( ) x 100%
c. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 1500 μg/mL, lalu masing-masing dimasukan
ke dalam labu takar 10,0 mL dan dilanjutkan sebagaimana perlakuan pada
pembuatan kurva baku asam galat . Kandungan fenolik total dinyatakan sebagai
gram ekivalen asam galat (mg ekivalen asam galat per g fraksi etil asetat).
F. Analisis Hasil
Aktivitas penangkapan radikal DPPH (%) dihitung dengan rumus :
Absorbansi (larutan kontrol) – Absorbansisampel (larutan pembanding/uji) X 100%
Absorbansilarutan kontrol
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 mengunakan
persamaan regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun
pembanding, sedangkan sumbu y adalah %IC. Lalu dianalisis secara statistik
untuk menentukan ada atau tidak adanya perbedaan bermakna antara IC50 larutan
pembanding dan larutan uji.
Uji kandungan fenolik total menghasilkan nilai mg ekivalen asam galat
dalam per g fraksi etil asetat. Nilai tersebut didapatkan dari analisis regresi linier
Gambar 3. Skema jalannya penelitian
Pembuatan ekstrak metanolik bawang daun
0
Ekstraksi cair-cair dengan washbensin dan air
Fraksi washbensin Fraksi air
Ekstraksi cair-cair dengan etil asetat
36
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman bertujuan untuk mengetahui dan memastikan
kebenaran identitas tanaman tanaman yang akan digunakan dalam penelitian.
Maka determinasi merupakan hal yang terpenting sebagai langkah awal dalam
penelitian yang menggunakan bahan tanaman. Determinasi dilakukan untuk
kepentingan dalam analisis fitokimia, yaitu agar tidak terjadi kesalahan dalam
pengambilan sampel yang akan digunakan. Hasil determinasi yang menyatakan
kebenaran bahwa tanaman tersebut adalah bawang daun (Allium fistulosum L.)
dapat dilihat pada lampiran 1.
B. Hasil Pengumpulan Bahan
Tanaman bawang daun diperoleh dari daerah Desa Wukirsari, Kecamatan
Cangkringan, Kabupaten Sleman. Tanaman bawang daun yang digunakan
merupakan hasil budidaya secara organik dan dipanen pada bulan September
2011. Tanaman bawang daun yang digunakan merupakan hasil budidaya secara
organik sehingga baik digunakan sebagai bahan penelitian dibandingkan dengan
tanaman liar atau tanaman yang tidak dibudidaya secara organik. Hal ini
dikarenakan tanaman hasil budidaya organik memiliki kelebihan yaitu dapat
mengurangi kesalahan pada pengambilan jenis tanaman, pada tanaman budidaya
perlakuan, dan kondisi pada tanaman juga sama sehingga dapat diperkirakan
bahwa kandungan metabolit sekunder pada tanaman relatif sama. Menurut
penelitian kandungan fenolik pada tanaman bayam, kubis, dan bawang daun yang
ditanam secara organik memiliki 20-50 % aktivitas antioksidan lebih besar jika
dibandingkan dengan tanaman yang ditanam secara konvensional atau non
organik (Renet al., 2001).
Pemanenan bawang daun dilakukan saat tanaman berumur 2,5-5 bulan,
dan dilakukan pada pagi hari. Hal ini dikarenakan pada saat umur tersebut
kandungan metabolit sekunder dari tanaman bawang daun berada pada jumlah
yang maksimal, sedangkan jika sudah berbunga kandungan metabolit sekundernya
akan berkurang. Pemanenan dilakukan pada pagi hari, hal ini dilakukan untuk
menjaga kandungan metabolit sekunder pada bawang daun relatif masih sama.
Jika pemanenan dilakukan pada siang atau sore hari akan mempengaruhi
kandungan metabolit sekundernya karena pada saat tersebut tanaman memperoleh
sinar matahari dengan intensitas yang tidak menentu sehingga fotosintesis untuk
menghasilkan energi pada tanaman juga mengalami fluktuasi. Energi yang
dihasilkan pada fotosintesis tersebut akan dipakai untuk jalannya metabolisme
pada tanaman, sehingga hasil metabolitnya secara tidak langsung juga tergantung
pada jumlah energi yang dipakai untuk metabolisme tanaman.
Bawang daun yang diperoleh segera dilakukan preparasi saat masih dalam
keadaan segar. Preparasi dilakukan secepat mungkin karena dikhawatirkan
terjadinya peristiwa browning yaitu terjadinya respon polifenol oksidase terhadap
mengoksidasi senyawa fenolik menjadi senyawa radikal untuk menutup luka
tersebut sehingga aktivitas antioksidan senyawa fenolik pada tanaman akan
berkurang.
C. Hasil Preparasi Sampel
Pada preparasi sampel untuk mendapatkan fraksi etil asetat ekstrak
metanolik bawang daun digunakan tanaman yang masih segar dan belum layu.
Bagian tanaman yang digunakan adalah seluruh bagian tanaman bawang daun
kecuali bagian akar. Dalam penelitian ini digunakan bahan yang masih segar dan
bukan simplisia kering karena terkait kestabilan senyawa flavonoid yang
terkandung didalamnya. Senyawa flavonoid, yang merupakan golongan fenolik
ini merupakan komponen utama yang penting dalam penelitian ini. Jika bahan
yang digunakan dikeringkan terlebih dahulu dikhawatirkan adanya degradasi atau
kerusakan senyawa flavonoid.
Tanaman bawang daun yang akan digunakan dipilih yang masih baik dan
segar, kemudian dicuci dengan air mengalir untuk membersihkannya dari
pengotor-pengotor atau kontaminan yang menempel. Setelah dicuci dan
dibersihkan, tanaman bawang daun diangin-anginkan untuk menghilangkan air
yang masih tersisa dari proses pencucian. Sebelum dimaserasi, bawang daun
tersebut diblender dengan tujuan untuk memperkecil ukuran permukaan tanaman
sehingga akan semakin luas kontak antara bahan tanaman dan penyari, proses
Proses maserasi dilakukan dengan penyari metanol dan menggunakan
bantuan alat shaker. Metode maserasi dipilih karena memiliki kelebihan
dibanding metode lainnya. Selain sederhana dan mudah dilakukan, metode ini
juga menguntungkan untuk sampel yang digunakan karena proses maserasi ini
tidak membutuhkan panas sehingga stabilitas senyawa fenolik yang terekstraksi
dari sampel dapat terjaga. Alat shaker digunakan bertujuan untuk membantu
proses masrasi yang lebih efektif karena dengan alat tersebut penyari lebih dapat
kontak langsung ke dalam sel-sel daripada jika didiamkan saja. Maserasi
dilakukan selama dua hari, dan setelah itu cairan penyari dipisahkan dari
ampasnya menggunakan corong Buchner yang dilapisi kertas saring dan dengan
bantuan pompa vakum untuk mempercepat dan memaksimalkan hasil
penyaringan. Ampas hasil penyarian kemudian dilakukan penyarian lagi
menggunakan metanol. Proses ini merupakan remaserasi yang bertujuan untuk
memaksimalkan hasil penyarian. Senyawa-senyawa yang kemungkinan belum
tersari karena sudah jenuhnya penyari dapat tersari pada proses remaserasi ini
sehingga akan dihasilkan lebih banyak senyawa-senyawa yang tersari dari sampel.
Penyari yang digunakan dalam proses maserasi penelitian ini adalah
metanol yang merupakan pelarut universal. Metanol memiliki polaritas yang mirip
dengan etanol namun metanol memilki viskositas yang lebih rendah sehingga
akan lebih mudah untuk penetrasi maupun berdifusi ke dalam sel-sel tanaman dan
tingkat pembasahannya lebih besar, sehingga metanol lebih dipilih sebagai
Sari metanol yang diperoleh diuapkan pelarutnya menggunakan alat
vacuum rotary evaporator sampai hampir semua metanol menguap. Prinsip alat
ini yaitu penguapan dengan pengurangan tekanan. Jika tekanan uap suatu cairan
sama dengan tekanan atmosfer di sekelilingnya maka cairan tersebut akan
mendidih, sehingga dengan adanya pengurangan tekanan pada alat di bawah
tekanan atmosfer akan menyebabkan cairan mendidih di bawah titik didih
normalnya. Setelah itu, dilanjutkan pemanasan di atas waterbath dan dihembus
dengan bantuan kipas angin untuk memperoleh ekstrak kental metanolik bawang
daun sampai pada bobot tetap.
Ekstrak kental metanolik bawang daun yang didapat kemudian dilarutkan
dengan air hangat, karena jika digunakan air dingin akan lebih susah melarutkan
ekstrak metanolik. Lalu dipartisi menggunakan pelarut washbensin, sehingga
fraksi air berada di bagian bawah dan fraksi washbensin berada di bagian atas. Hal
tersebut dikarenakan berat jenis air (b.j. air sebesar 0,996) lebih besar daripada
berat jenis washbensin (b.j.washbensin sebesar 0,730) (Anonim, 1995). Proses
partisi atau ekstraksi cair-cair ekstrak metanolik ini dilakukan secara
berulang-ulang sebanyak tiga kali agar lebih efektif sampai lapisan washbensin terlihat
bening yang menandakan tidak ada lagi senyawa yang tertarik ke dalam
washbensin. Partisi ini dilakukan dengan perbandingan pelarut air : washbensin
1:1 v/v. Bagian yang polar akan cenderung larut dalam air sedangkan bagian yang
non polar akan larut dalam washbensin. Dalam fraksi washbensin akan diperoleh
senyawa-senyawa kimia yang tidak diinginkan seperti lipid dan klorofil sehingga