TINJAUAN PUSTAKA Botani Tanaman
Steenis (2005) mengelompokkan kedudukan tanaman karet dalam
tatanama (sistematika) sebagai berikut: Kingdom: Plantae, Divisio: Spermatophyta, Subdivisio: Angiospermae, Kelas: Dicotyledoneae,
Ordo: Euphorbiales, Famili: Euphorbiaceae, Genus: Hevea, Species : Hevea brassiliensis Muell. Arg.
Sebagai tanaman berbiji belah akar pohon karet berupa akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi keatas. Dengan akar yang seperti itu pohon karet bisa berdiri kokoh meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2007).
Karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa mencapai 15-25 meter. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi. Di beberapa kebun karet ada kecondongan arah tumbuh tanamannya agak miring ke arah utara (Nugroho, 2010).
Daun karet terdiri dari tangkai daun utama dan tangkai anak daun. Panjang tangkai daun utama 3-20 cm. Panjang tangkai anak daun sekitar 3-10 cm, pada ujungnya terdapat kelenjar. Ada tiga anak daun yang terdapat pada sehelai daun
karet. Anak daun berbentuk eliptis, memanjang dengan ujung meruncing (Astuti, 2008).
bunga betina yang tidak fertil akan mengalami pengguguran secara cepat. Buah yang bertahan berkembang, mencapai ukuran maksimum pada hari ke 80-90 dan menjadi keras pada hari ke 110 (Priyadarshan, 2011).
Buah karet berbentuk seperti setengah bola dengan pembagian ruang yang jelas. Jumlah ruang biasanya adalah tiga dan terkadang dapat mencapai enam ruang pada satu buah. Dalam setiap ruang buah terdapat biji yang berperan penting dalam perkembangbiakan. Biji karet berukuran besar dengan berat 3.5-6.0 g, memiliki kulit keras, dan berwarna coklat kehitaman dengan bercak berpola yang khas. Ukuran biji besar dengan kulit keras. Warnanya coklat kehitaman dengan bercak-bercak berpola yang khas (Astuti, 2008).
Lateks merupakan hasil fotosintesis dalam bentuk sukrosa yang ditranslokasikan dari daun melalui pembuluh tapis ke dalam pembuluh lateks. Di dalam pembuluh lateks terdapat enzim seperti invertase yang akan mengatur proses perombakan sukrosa untuk pembentukan karet. Biosintesis lateks berlangsung dalam sel-sel pembuluh lateks dengan bahan dasar berupa sukrosa yang ditranport dari daun sebagai hasil fotosintesis yang telah mengalami perubahan secara enzimatik (Dalimunthe, 2004).
Syarat Tumbuh Iklim
daerah yang cocok untuk tanaman karet adalah daerah-daerah Indonesia bagian barat, yaitu Sumatera, Jawa, dan Kalimatan, sebab iklimnya lebih basah (Budiman, 2012).
Tanah
Berbagai jenis tanah dapat sesuai dengan syarat tumbuh tanaman karet baik tanah vulkanis muda dan tua, bahkan pada tanah gambut < 2 m. Tanah vulkanis mempunyai sifat fisika yang cukup baik terutama struktur, tekstur, sulum, kedalaman air tanah, aerasi dan drainasenya, tetapi sifat kimianya secara umum kurang baik karena kandungan haranya rendah. Tanah aluvial biasanya cukup subur, tetapi sifat fisikanya terutama drainase dan aerasinya kurang baik. Reaksi tanah berkisar antara pH 3,0 - pH 8,0 tetapi tidak sesuai pada pH < 3,0 dan > pH 8,0 (Anwar, 2001).
Indonesia memiliki kisaran iklim yang luas yaitu dari tropika basah hingga semi-arid dan curah hujan merupakan unsur utama iklim yang bervariasi pada berbagai wilayah. Sebahagian besar perkebunan karet di Indonesia terletak di Sumatera dan Kalimantan dengan kisaran curah hujan antara 1.500 – 4.000 µM/th dan rata-rata bulan kering 0-4 bulan per tahun (Thomas et al., 2009).
Klon Tanaman
IRR 103, IRR 104, IRR 105, IRR 106, IRR 107, IRR 109, IRR 110, IRR 111, IRR 112, IRR 117, IRR 118, IRR 119 dan IRR 120 dan klon dengan metabolisme rendah telah diuji pada beberapa klon antara lain: AVROS 2037, BPM 107, BPM 109, PB 217, RRIC 102, PR 303, TM 2, TM 6, TM 8, TM 9, IRR 24, IRR 39, IRR 41, IRR 42 dan IRR 44.
Klon PB 260 berasal dari persilangan klon PB 5/51 dengan PB 49 yang dikategorikan sebagai tipe klon penghasil lateks. Produksi karet kering rata-rata klon PB 260 adalah 2.063 kg/ha/th. Klon PB 260 memiliki karakteristik pertumbuhan lilit batang 45 cm, tebal kulit murni 6,3 µM dan cenderung resisten
terhadap Oidium, Colletotrichum, Corynespora dan jamur upas (Daslin et al., 2009).
Potensi klon PB 260 penghasil lateks pertumbuhan jagur, resisten terhadap Corynespora colletotrichum dan Oidium. Produksi lateks
mencapai 1.5-2.5 ton/ha/th dengan warna lateks putih kekuningan. Lateks diolah dalam bentuk sheet (Janudianto et al., 2013).
Lokakarya Nasional Pemuliaan Tanaman Karet tahun 2005 telah merekomendasikan beberapa klon unggul, di antaranya adalah klon PB 260 yang telah teruji pada periode sebelumnya memiliki produktivitas mencapai 2,1 ton karet kering per hektar per tahun. Selain itu karet klon PB 260 juga memiliki
ketahanan terhadap terpaan angin karena perakarannya yang kuat (Marchino et al., 2010).
berbeda akan membutuhkan kondisi lingkungan (agroekosistem) yang sesuai guna mewujudkan tingkat produktivitas yang optimal. Hasil penelitian menunjukkan bahwa beberapa kultivar tanaman karet dapat beradaptasi pada berbagai daerah
dengan agroekosistem yang luas ataupun pada lingkungan yang spesifik (Thomas et al., 2009).
Kering Alur Sadap (KAS)
Penyakit karet sering menimbulkan kerugian ekonomis di perkebunan karet. Kerugian yang ditimbulkan tidak hanya berupa kehilangan hasil akibat kerusakan tanaman, tetapi juga biaya yang dikeluarkan dalam upaya pengendaliannya. Lebih dari 25 jenis penyakit menimbulkan kerusakan di perkebunan karet. Salah satu penyakit tanaman karet yang ditemukan pada
perkebunan karet adalah KAS (Tapping Panel Dryness, Brown Bast) (Sirait dan Syahnen, 2013).
Gambar 1. Tanaman yang terserang KAS (Foto di lapangan)
sel tilasoid. Luka kayu juga menjadi penyebab terjadinya KAS pada panel bawah. Status kejadian KAS di bidang sadapan menjadi nyata merugikan apabila dalam satu populasi telah terserang lebih dari 5%. Kejadian KAS dilapangan juga ditemukan di bidang sadap kulit perawan bahkan pada waktu awal buka sadap (Mochlisin dan Tistama, 2014).
Pengendalian penyakit KAS dapat dilakukan secara terpadu dengan pemupukan, pengikisan, pengistirahatan bidang sadapan selama 6 bulan, pengolesan fungisida Anti rot F95 (mengandung fungisida 1%, ZPT 200 ppm dan bahan lain 4%) atau pengolesan fungisida berbahan aktif triadimefon 250 g/l (Sirait dan Syahnen, 2013).
Analisis kandungan lateks pada tanaman KAS parsial diketahui menunjukkan kandungan gula tinggi, tetapi fosfat anorganik (Pi) rendah demikian pula dengan kandungan thiol meskipun tanaman diberi stimulan ethepon. Intensitas eksploitasi yang tinggi pada tanaman sehat menyebabkan kandungan gula didalam lateks turun. Sementara kandungan Pi dan thiol justru meningkat. Gula yang tersedia tidak dapat diolah karena energi yang tersedia sangat rendah dan enzim yang terlibat dalam metabolisme karet terganggu aktivitasnya. Kandungan Pi berkorelasi negatif terhadap KAS (Sumarmadji, 2000).
Gejala KAS ditandai dengan terdapatnya bagian-bagian alur sadap yang tidak mengeluarkan lateks. Bagian-bagian tersebut kemudian meluas dan akhirnya seluruh pohon tidak mengeluarkan lateks sama sekali. Kulit sebelah dalam bagian yang sakit berubah warna menjadi cokelat (Semangun, 2000).
Gambar 2. Perbedaan Tanaman Sehat dan Terserang KAS (Jacob, 1989). Dari Gambar 2 dapat dilihat bahwa sel lutoid pada tanaman sehat tidak terdapat ruang kosong yang artinya aliran lateks mengalir dengan baik. Berbeda dengan Sel lutoid pada tanaman KAS yang terdapat sela-sela kosong yang akan mengakibatkan terjadinya koagulasi. Hal ini dikarenakan pada tanaman KAS senyawa radikal bebas menyerang sedangkan enzim antioksidan tidak mampu melawannya. Menurut Siswanto (1994) terjadinya koagulasi dalam pembuluh lateks disebabkan oleh adanya degradasi membran lutoid oleh senyawa ROS seperti O2-, H2O selanjutnya senyawa yang terkandung dalam lutoid akan
Gugur Daun Karet
Salah satu faktor penentu terpenuhinya ketersediaan air bagi tanaman karet adalah curah hujan dan hari hujan. Curah hujan dan hari hujan merupakan faktor iklim yang ikut mengalami penyimpangan dikarenakan perubahan iklim. Perubahan iklim dapat berdampak negatif maupun positif bagi tanaman karet di lapangan (Irsal et al., 2015).
Perontokan atau gugur daun pada pohon karet lazim disebut wintering atau leaf shedding. Perontokan daun merupakan aklimatisasi saat periode kering.
Perontokan daun penting dalam rangka homoeostatik, untuk mempertahankan keseimbangan antara tajuk dengan bagian tanaman lain, dan keseimbangan pohon dengan lingkungan (Siregar et al., 2007).
Morgan (1984) berpendapat bahwa perontokan daun terdiri atas 3 tahap : 1. Inisiasi perontokan daun melalui signal internal perontokan
2. Induksi perontokan melalui sintesis hormon pada daun
3. Perontokan daun yang didahului perubahan-perubahan biokimia, anatomi, dan fisiologi. Perontokan daun dapat terjadi secara serentak ataupun bertahap
Ciri musim gugur daun tahunan tidak sama di setiap wilayah. Disamping itu juga terdapat perbedaan lamanya klon mengalami gugur daun, di antaranya ada yang berlangsung serentak dan ada yang bertahap. Keserentakan gugur daun kurang dapat dibedakan antar klon (Sumarmadji, 1999).
Menurut Turner dan Jones (1980) adaptasi tanaman terhadap kekeringan : 1. Menghindari kekeringan (drought escape), yaitu kemampuan tanaman untuk
2. Penundaan dehidrasi (drought postponement) yaitu kemampuan tanaman untuk bertahan dalam kondisi kekeringan dengan cara mempertahankan status air yang tinggi melalui peningkatan absorbsi air dan mengurangi tingkat transpirasi
3. Toleran terhadap dehidrasi (dehydration tolerance) yaitu ketahanan membran sel terhadap dehidrasi
Dalam pertumbuhan karet diketahui bahwa menjelang berakhirnya musim hujan, pohon karet mulai menggugurkan daunnya. tetapi masa gugur daun pada tanaman tidak terjadi dalam waktu yang bersamaan. Masa gugur daun dipengaruhi oleh klon dan keadaan iklim setempat (Setyamidjaja, 1986).
Tanaman karet dalam menghadapi kondisi cekaman kekeringan akan beradaptasi dengan cara menggugurkan daunnya. Klon-klon karet dapat pulih kembali mendekati kondisi normal hanya terjadi jika kondisi stres air sampai pada tingkat payung daun pertama menguning 50% saja. Apabila kondisi tanaman stres sampai payung daun pertama rontok dan payung kedua mengguning 50%, payung daun kedua rontok > 75%, payung daun pertama dan kedua rontok serta batang menguning dan keriput, tanaman dapat pulih kembali, tetapi pertumbuhannya sangat lambat (Amypalupy dan Wijaya, 2009).
Fisiologi Karet
Karakter-karakter yang mendukung sifat fisiologi aliran lateks dari genotipe klon penghasil lateks dan lateks kayu memiliki jumlah ring pembuluh lebih banyak yaitu 11,75 pembuluh, diameter ring pembuluh lateks lebih besar sama dengan 34, 48 mikron, indeks penyumbatan lebih kecil sama dengan 22,99, kecepatan aliran lateks lebih besar sama dengan 8, 18 (ml/menit/cm) dan indeks hasil lebih besar sama dengan 77,03% (Pasaribu et al., 2014).
Pada umumnya klon yang berproduksi tinggi tanpa stimulasi mempunyai kadar fosfat anorganik (Pi) tinggi dan sukrosa rendah, yang menunjukkan aktifitas metabolisme yang tinggi. Sebaliknya, kadar Pi rendah dan sukrosa tinggi pada klon berproduksi rendah, yang menunjukkan rendahnya aktifitas metabolisme lateks (Lacote, 2007).
Thiol (R-SH) berfungsi sebagai antioksidan, sehingga stress oksidatif sebagai akibat aktifnya metabolisme dalam sel dapat ditekan. Kadar R-SH yang rendah menunjukkan terlalu intensifnya eksploitasi sehingga perlu dikurangi dengan menurunkan intensitas sadapan maupun stimulasi (Gohet et al., 1996).
Kisaran optimal kadar fosfat anorganik lateks adalah 10-20 µM. Semakin rendah kandungan fosfat anorganik dari kisaran optimal tersebut berarti kemampuan tanaman dalam melakukan metabolisme juga semakin berkurang. Sebaliknya, semakin tinggi kadar fosfat anorganik dari kisaran optimalnya, mengindikasikan bahwa tanaman mengalami over eksploitasi atau mungkin juga terserang penyakit (D’ Auzac et al., 1989).
sukrosa pada klon IRR 42 lebih diutamakan dalam proses pembelahan sel-sel pada jaringan kulit sehingga latisifer lebih padat pada klon PB 260 dibanding klon IRR 42 (Lubis, 2014).
Kadar sukrosa yang terukur dalam lateks merupakan selisih antara influks sukrosa dengan banyaknya sukrosa yang digunakan untuk metabolisme lateks. Kadar sukrosa lateks yang tinggi tidak mutlak memberikan gambaran pada potensi produksinya tetapi justru dapat menggambarkan produksi aktual yang rendah, karena produksi lateks dan pertumbuhan berkompetisi dengan kuat dalam hal penggunaan sukrosa (Sumarmadji, 2000).
Pada klon RRIM 623 yang berasal dari Malaysia kulit karet memiliki kandungan K+ yaitu 186,7 µM, Pi memiliki kandungan 20,3 µM, Mg+ sebesar 27,5 µM, Ca+ adalah 15,5 µM, Na+ yaitu 2,9 µM, dan untuk nilai total protein adalah 67 mg/unit, serta nilai sukrosa adalah 18-27 mg/mol (Gohet et al., 1996).
Tanaman karet dengan metabolisme rendah memiliki tingkat pemulihan terhadap KAS lebih baik dibandingkan tanaman karet dengan metabolisme tinggi. Hal tersebut diduga berkaitan dengan tipe metabolisme masing-masing klon. Tanaman karet metabolisme rendah memiliki respon fisiologis yang lebih rendah sehingga memiliki tingkat stress fisiologis yang lebih rendah dibandingkan tanaman karet metabolisme tinggi. Hal ini mempengaruhi kadar sukrosa pada tanaman, tanaman karet metabolisme rendah yang mengalami KAS akan mengalami biosintesis sukrosa dengan baik pada saat pemulihan dibandingkan dengan tanaman karet metabolisme tinggi (Wibowo, 2016).
harus mempertimbangkan nilai kritis dari karakter fisiologinya (Sumarmadji, 1999).
Beberapa faktor yang menyebabkan penurunan produksi tanaman karet antara lain adalah keletihan fisiologis tanaman, kebocoran aplikator, dan sisa panel sadap yang semakin menipis (Siregar et al., 2013).
Antidepresan
Auksin dan sitokinin berbeda dengan hormon tumbuhan yang lain. Auksin dan sitokinin merupakan agen sinyal yang sangat penting dalam mempengaruhi viabilitas tanaman. Auksin mengontrol bermacam-macam proses perkembangan tanaman diantaranya perpanjangan batang, dominansi apikal, inisiasi akar, perkembangan buah dan pertumbuhan (Taiz dan Zeiger, 2002).
Asam naftalena asetat (NAA) dan 2.4-D merupakan senyawa tanpa ciri indol tapi mempunyai aktivitas biologis seperti IAA. NAA banyak digunakan sebagai hormon akar dan selang konsentrasi yang mendorong pembesaran sel-sel pada akar adalah sangat rendah. Menurut Zaer dan Mapes (1985), NAA memiliki sifat kimia lebih stabil dibanding IAA dan tidak mudah teroksidasi oleh enzim. Anwar (2007) menambahkan bahwa NAA merupakan IAA sintetik yang sering digunakan karena memiliki sifat yang lebih tahan, tidak terdegradasi dan lebih murah. Naphthalene Asetic Acid/Naphtyl Acetic Acid (NAA) memiliki berat molekul 186.21 dengan rumus molekul C12H10O2.
dibandingkan IAA dalam menginduksi pertumbuhan akar pada stek batang. Senyawa ini cenderung lebih stabil di dalam jaringan tanaman (Srivastava, 2002).
Askorbat berperan penting dalam beberapa proses fisiologis tanaman diantaranya adalah pertumbuhan, diferensiasi, dan metabolisme. Selain itu askorbat juga berfungsi sebagai pereduktor untuk beberapa radikal bebas sehingga
dapat meminimalkan kerusakan yang disebabkan oleh cekaman oksidatif (Mc Kersie dan Leshem 1994).
Asam askorbat atau vitamin C merupakan salah satu bentuk antioksidan yang secara alami terdapat pada tumbuhan. Askorbat merupakan senyawa metabolit utama pada tumbuhan yang memiliki fungsi sebagai antioksidan, yang melindungi tanaman dari kerusakan oksidatif yang dihasilkan dari metabolisme aerobik, fotosintesis dan berbagai polutan. Askorbat juga merupakan kofaktor untuk beberapa enzim hidroksilase (misalnya prolyl hidroksilase) dan violaxanthin de-epoxidase. Askorbat berada di dinding sel sebagai baris
pertahanan pertama terhadap ozon (Smirnoff, 1996).
Diantara bahan tambahan yang dianggap paling aman sebagai penyerap oksigen, asam askorbat (vitamin C) dianggap yang paling aman untuk digunakan sebagai oxygen scavenger. Pada prinsipnya, asam L-askorbat akan dioksidasi menjadi aam dehidro L-askorbat dengan bantuan enzim oksidase atau peroksidase (Vermeiren et al., 1999).
Enzim Peroksidase
aktivitas enzim peroksidase dipengaruhi juga oleh adanya serangan virus. Gupta et al. (1990) menyatakan bahwa tanaman yang tahan terhadap penyakit
cenderung memperlihatkan aktivitas peroksidase yang lebih tinggi dibandingkan dengan tanaman rentan.
Peroksidase termasuk ke dalam enzim golongan oksidoreduktase, yaitu enzim yang menggunakan hidrogen peroksida sebagai substrat. Enzim peroksidase berkaitan erat dengan sejumlah proses fisiologi yang meliputi lignifikasi, penyembuhan luka, oksidasi fenol, dan pertahanan terhadap pathogen (Reimmann et al. 1992).
Gen ketahanan hipersensitif yang dominan diekspresikan pada tanaman adalah gen penyandi enzim peroksidae dan polifenol peroksidase. Kedua enzim tersebut lebih umum berperan dalam mekanisme pertahanan terhadap penyakit
sehingga aktivitasnya dijadikan sebagai induksi ketahanan (Saravanan et al., 2004).
Nilai absolut aktivitas kitinase dan peroksidase berbeda diantara jaringan tanaman. Hal ini kemungkinan disebabkan perbedaan tingkat diferensiasi sel jaringan dan juga faktor lingkungan. Pada kalus dan tunas in vitro, lingkungan dalam kondisi steril sehingga faktor yang berpengaruh terhadap ekspresi gen kitinase dan peroksidase kemungkinan adalah faktor abiotik seperti media dan lingkungan (Sukma et al., 2008).
Penyadapan dan stimulasi etefon direspons oleh tanaman karet sebagai cekaman bagi kehidupannya. Cekaman lingkungan akan menyebabkan akumulasi Reactive Oxygen species (ROS) yang dapat menghancurkan makromolekul
penyusun membran organel atau sel. Kerusakan membran tersebut akan memicu kematian sel. Untuk mengatasi cekaman tersebut, tanaman karet meningkatkan aktivitas askorbat peroksidase (APX; EC 1.11.1.9). Enzim tersebut berperan dalam detoksifikasi ROS invivo, dan berperan dalam ketahanan terhadap cekaman dan/atau mengatur lamanya aliran lateks (Astuti, 2008).
Pada tanaman yang toleran/tahan diketahui terjadi peningkatan aktivitas peroksidase, sedangkan pada tanaman yang peka tidak ada perubahan atau bahkan turun dibandingkan dengan keadaan sehat. Enzim tersebut merupakan enzim oksidase yang paling tinggi intensitasnya di dalam jaringan luka atau sakit (Agrios, 2005).
Peroksidase termasuk ke dalam enzim golongan oksidoreduktase yaitu enzim yang mengkatalis reaksi oksidasi-reduksi. Radikal bebas yang terbentuk dari proses respirasi aerobik, misalnya radikal hidroksida (OH-), superoksida (O-), dan hidrogen peroksida (H2O2), dapat merusak fraksi lipid membran dan
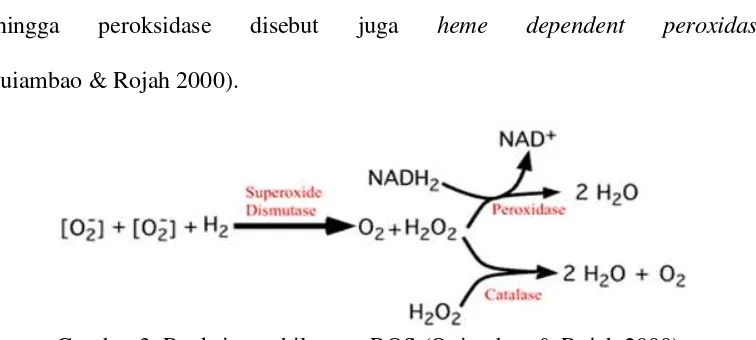
menghasilkan lipid peroksida dan selanjutnya terurai menjadi senyawa produk oksidasi sekunder yang toksik (Dumet & Benson 2000). Molekul-molekul toksik tersebut dibatasi jumlahnya di dalam sel oleh sejumlah enzim antioksidan. Superoksida dipecahkan oleh Superoksida dismutase (SOD) dimana dalam proses tersebut dihasilkan hidrogen peroksida (H2O2) yang kemudian diuraikan oleh
enzim peroksidase. Peroksidase memecahkan H2O2 menjadi air (Gambar 3)
enzim golongan oksidoreduktase yang menggunakan H2O2 sebagai akseptor
elektron untuk mengkatalis berbagai reaksi oksidatif. Peroksidase juga membutuhkan kofaktor untuk melakukan aktivitas enzimatisnya yaitu heme
sehingga peroksidase disebut juga heme dependent peroxidase (Quiambao & Rojah 2000).
Gambar 3. Reaksi penghilangan ROS (Quiambao & Rojah 2000).
Pada tanaman karet, ada tiga gen yang terekspresi saat suatu klon tercekam kekeringan, yaitu 1) Peroksidase, tingkat peroksidase yang tinggi menunjukkan keterkaitannya dalam perbaikan stres melalui detoksifikasi Species oksigen reaktif (ROS) yang diproduksi dalam jumlah besar ketika tanaman mengalami kekeringan yang dikombinasikan dengan suhu dan cahaya tinggi. Klon karet RRIM 600 dan RRII 430 diketahui mempunyai sistem pembilasan ROS yang lebih baik sehingga klon tersebut lebih toleran selama kondisi kekurangan air di lapang yang dialami selama musim panas; 2) Protein Late embryogenesis abundant 5 (LEA 5), merupakan protein hidrofobik yang mengandung proporsi
antioksidan pada bagian-bagian sel selain kloroplas seperti mitokondria, sitosol, peroksisom dan dalam inti. Sehingga dapat disimpulkan bahwa tingkat GPX yang lebih tinggi pada semua klon toleran menunjukkan relevansinya terhadap pembilasan ROS selama cekaman kekeringan (Sathik et al., 2011).