BAB II BAB II PEMBAHASAN PEMBAHASAN A. Laju Subsitusi Nukleotida
A. Laju Subsitusi Nukleotida Daerah Pengkodean
Daerah Pengkodean
Daerah Pengkode memiliki rata-rata subsitusi nonsinonim yang bervariasi diantara Daerah Pengkode memiliki rata-rata subsitusi nonsinonim yang bervariasi diantara gen-gennya, merefleksikan rata-rata protein
gen-gennya, merefleksikan rata-rata protein evolusi. evolusi. Insulin pada Insulin pada C peptida digC peptida digunakanunakan sebagai contoh dari kecepatan evolusi walau sangat lambat. Apolipoprotein, immunoglobin, sebagai contoh dari kecepatan evolusi walau sangat lambat. Apolipoprotein, immunoglobin, interferon sangat ceoat. Apolioprotein merupakan protein yang besar (4536 asam amino) interferon sangat ceoat. Apolioprotein merupakan protein yang besar (4536 asam amino) memiliki rata-rata nonsinonim yang tinggi. Sebaliknya rantai miosin beta memiliki laju memiliki rata-rata nonsinonim yang tinggi. Sebaliknya rantai miosin beta memiliki laju yang rendah. Rata-rata sinonim subsitustusi juga bervariasi dari gen satu ke gen yang lain yang rendah. Rata-rata sinonim subsitustusi juga bervariasi dari gen satu ke gen yang lain (koefisisen dari variasi nonsynonim 91%, rata-rata synonim hanya 29%). Pada
(koefisisen dari variasi nonsynonim 91%, rata-rata synonim hanya 29%). Pada kecepatannya dari gen-gen tersebut, subsitusi sinonim melebihi yang nonsinonim. kecepatannya dari gen-gen tersebut, subsitusi sinonim melebihi yang nonsinonim. Perbandingannya subsitusi sinonim 25 kali lebih
Perbandingannya subsitusi sinonim 25 kali lebih tinggi daripada subsitusi nonsinonim.tinggi daripada subsitusi nonsinonim. Liahtlah tabel berikut.
Ada
Adapun pun padpada a tahtahap ap degdegeneenerasi rasi dua dua kalkali i liplipat, at, terterdapdapat at perperbanbandindingan gan subsubsitsitusiusi transisional dengan tranversional dari tipe subsitusi sinonim. Rata-rata transisi (2.24 x10 transisional dengan tranversional dari tipe subsitusi sinonim. Rata-rata transisi (2.24 x10-9-9))
lebih tinggi
lebih tinggi daripdaripada ada tranvtranversi ersi (1.47(1.47x10x10-9-9). Terdapat suatu observasi bahwa mutasi secara). Terdapat suatu observasi bahwa mutasi secara
transisi lebih lebih besar peluangnya daripada tranversional. Pada tahap dua kali lipat tahap transisi lebih lebih besar peluangnya daripada tranversional. Pada tahap dua kali lipat tahap degenarasi, rata-rata subsitusi transisi sama dengan tahap degenarasi empat kali lipatnya, degenarasi, rata-rata subsitusi transisi sama dengan tahap degenarasi empat kali lipatnya, tetapi rata-rata subsitusi transversional lebih rendah daripada tahap degenarasi empat kali tetapi rata-rata subsitusi transversional lebih rendah daripada tahap degenarasi empat kali lipatnya, perbandingan dari kedua tipe subsitusi adalah 1.86 x10
lipatnya, perbandingan dari kedua tipe subsitusi adalah 1.86 x10-9-9dan 0,38 10dan 0,38 10-9-9. Perubahan. Perubahan
Subsitusi rendah karena bersifat nonsinonim. Pada tahap nondegenarsi, semuaperubahan Subsitusi rendah karena bersifat nonsinonim. Pada tahap nondegenarsi, semuaperubahan bersifat nonsinonim, rata-rata dari
bersifat nonsinonim, rata-rata dari subsitusi nonsinonim dan sinonim hampir sama (0.4x10subsitusi nonsinonim dan sinonim hampir sama (0.4x10-9-9
d
dan an 00,3,38 8 xx1010-9-9). Se). Sehihingngga ga rarata-ta-rarata ta susubsbsititususi i nunuklkleoeotitida da lelebibih h rerendndah ah papada da tatahahapp
nondegenerasi, sedang-sedang pada tahap degenrasi duakali lipat, lebih tinggi pada tahap nondegenerasi, sedang-sedang pada tahap degenrasi duakali lipat, lebih tinggi pada tahap denerasi 4 kalil lipat.
Daerah non penkodean
Data dari daerah noncoding jauh lebih banyak daripada data dari coding daerah, sehingga hanya analisis komparatif yang terbatas dapat dilakukan. (Perhatikan bahwa dalam rangka untuk memperkirakan tingkat substitusi secara berurutan kita harus memiliki data dari setidaknya dua spesies.). Kasus yang luar biasa adalah Na , K-ATPase , di mana tingkat di daerahtersebut belum diterjemahkan dalam 3 'dan bersifat lambat, meskipun wilayah ini sudah lama ada. Alasannya adalah bahwa Na, K-ATPase. gen mengkodekan berbagai bentuk protein dengan menggunakan situs polyadenylation alternatif, belum diterjemahkan. Di
hampir semua gen, tingkat substitusi dalam 5 'dan 3' regionsare diterjemahkan lebih rendah daripada di empat kali lipat tahap degenarsi (yaitu, situs di mana semua substitusi nukleotida mungkin adalah sinonim). daerah 5 'dan 3' belum diterjemahkan adalah 1,96 x 10-9 dan 2,10 x 10-9 substitusi persite per tahun, masing-masing, yang keduanya sekitar 55% dari rata-rata empat kali lipat tahap degenarsi (3.71 x 10-9 substitusi per situs per tahun).
Tabel 4.4 menunjukkan perbandingan antara tingkat substitusi globin pseudogen pada Wvx sapi dan kambing dan rata-rata di daerah noncoding dan daerah empat kali lipat
tahap degenarsi suatu gen globin
. Hasilnya, tingkat ingkat dalam pseudogen sedikit lebih tinggi daripada di daerah lain. Hal ini tampaknya menjadi umum berlaku untuk pseudogen.
Profil-Profil Yang Sama
Metode yang cepat dan kuat untuk mendeteksi tingkat variasi dari subsitusi disebut Kesamaan profil, metode ini dapat memberikan wawasan tentang sejarah evolusi, seperti tabel dibawah ini.
B. Penyebab Variasi Dalam Subsitusi
Laju subsitusi ditentukan oleh dua faktor yaitu 1)laju mutasi, 2) probabilitas mutasi. a. Kendala Fungsional
Kendala fungsional ditentukan oleh tingkat karakteristik intoleransi dari genom menuju kerarah mutasi. Hal ini mendefinisikan berbagai nukleotida alternatif yang dapat diterima tanpa mempengaruhi fungsi dan struktur dari gen yang dihasilkan. Mutasi akan mempengaruhi fungsi. Semakin kuat kendala fungsional maka semakin lambat laju subsitusi yang akan terjadi. Sejauh protein-coding gen yang bersangkutan, telah ada
beberapa upaya
untuk mengukur kendala fungsional yang bergantung dari tingkat substitusi mereka. Salah satu ukuran tersebut adalah kerapatan fungsional. Proporsi asam amino yang memiliki kendala fungsional dan kepadatan fungsional tinggi maka semakin rendah tingkat substitusi diharapkan.
b. Laju Sinonim dan Non sinonim
Karena tingkat mutasi pada sinonim dan nonsynonymous dalam gen sama, atau setidaknya sangat mirip, perbedaan subsitusi disebabkan oleh intensitas kemurnian seleksi antara kedua tipe tersebut. Mutasi yang menghasilkan penggantian asam amino yang memiliki kesempatan lebih besar untuk menimbulkan efek
merusak fungsi suati protein daripada perubahan sinonim (identik). Akibatnya, mayoritas nonsynonymous mutasi akan dihilangkan dari populasi dengan memurnikan seleksi.
perubahan identik (sinonim) memiliki kesempatan yang lebih baik untuk menjadi netral, dan sebagian besar dari mereka akan tetap dalam suatu populasi
c. Adanya variasi Diantara Daerah gen yang Berbeda-beda
Sebuah contoh adanya insulin , suatu hor. The prekursor insulin, preproinsulin, adalah rantai dari 86 asam amino yangon dimer yang disekresikaan oleh sel beta pada pulau langerhans terdiri dari empat segmen: A, B, C, dan sebuah sinyal peptida (Gambar 4.5). Setelah peptida sinyal dihapus, menjadi proinsulin yang panjang sebanyak 62-asam amino, suatu struktur tiga dimensi yang distabilkan oleh dua ikatan disulfida. Pmotongan internal pada asam amino peptida C yang berada di tengah-tengah rantai proinsulin bertujuan agar hormon insulin aktif pada dua segmen yang tersisa yang terdiri dari rantai A dan B. Tingkat subsitusi nonsinonim (tidak identik) untuk daerah kode peptida C 5 kali libeh tinggi daripada A dan B. Tingakt subsitusi daerah non identik pada sinyal peptida 6 kali lebih tinggi dariapasa pengkodean wilayah A dan B, seperti pada gambar dibawah ini
c. Variasi Diantara Gen
Variasi besar dalam tingkat substitusi nonsynonymous antara gen, disebabkan oleh: (1) tingkat mutasi, dan (2) intensitas seleksi. Variasi Laju sinonim subsitusi dari gen satu ke gen yang alain kurang jelas. Terdapat dua alasan pada variasi ini, pertama laju mutasi yang berbeda diantara genome yang berbeda dan laju variasi pada kromosom dalam gen, kedua tidak
semua kode yang sinonim memiliki efek yang sama. Jadi perlu adanya seleksi seperti seleksi murni yang dapat menciptakan laju subsitusi sinonim diantara gen.
Subsitusi dapat menghambat fungsi protein, contoh histon ynag berinteraksi dengan DNA untuk membentuk nukleosom. H3 harus mempertahankan kekompakan strukturnya agar dapet berinteraksi dengan asam molekul DNA. Kosekwensinya H3 toleran dengan perubahan asam amino. Perkembangan protein ini memmang paling lambat yaitu dari 1.000 kali lebih lambat daripada apolipoproteins. Seperti gambar dibawah ini
Contoh lainnya adalah hemoglobin memerlukan lampiran heme prostetik , dan memiliki kemampuan untuk merespon secara struktural terhadap perubahan pH dan CO2 konsentrasi. Namun, sebagian besar dari persyaratan fungsional dibatasi ke bagian molekul. Banyak asam amino-mengubah mutasi, terutama pada permukaan ini protein globular,. Sitokrom c juga membawa oksigen, mengikat heme, dan merespon terhadap perubahan struktural dalam kondisi fisiologis, Dengan demikian, proporsi yang mengambil bagian dalam fungsi lebih tinggi ada pada pada sitokrom c tertentu, dan laju substitusi asam aminonya lebih tinggi daripada hemoglobin.
C. Seleksi Positif
Tingkat substitusi nukleotida dalam sebagian besar daerah genom dapat dijelaskan oleh kombinasi dari (1)input mutasi,(2) seleksi murni terhadap alel yang merugikan. Seleksi positif bertujuan untuk memainkan peran penting dalam evolusi molekuler gen
a) Pendeteksian Seleksi Positif
Perubahan Nonsynonymous jauh lebih mungkin meningkatkan fungsi protein dibandingkan perubahan sinonim. Laju substitusi nonsynonymous harus melebihi dari sinonim substitusi sehingga dapat menguntungkan memainkan peran utama dalam evolusi dari protein. Oleh karena itu, salah satu cara untuk mendeteksi seleksi Darwin positif adalah untuk menunjukkan bahwa jumlah substitusi per situs nonsynonymous secara signifikan lebih besar dari jumlah substitusi per situs sinonim
b)Paralelisme dan konvergensi: Evolusi Lisosimdi ruminansia, lutung, dan hoatzins
Paralelisme pada tingkat molekul didefinisikan sebagai terjadinya dua atau lebih substitusi nukleotida (atau penggantian asam amino) yang homolog dan dari garis keturunan evolusi yang berbeda. Molekuler konvergensi adalah terjadinya dua atau lebih substitusi nukleotida (atau amino acid pengganti) yang homolog dalam garis keturunan evolusi yang berbeda mengakibatkan hasil yang sama.
Lisozim merupakan enzim asam amino panjang 130 yang katalitik berfungsi untuk memotong ikatan P (1-4) glikosidik iantara N-asetil glucoseamine dan Nacetyl Asam muramic dalam dinding sel Eubacteria, sehingga bamteri kurang memiliki perlindungan terhadap tekanan osmosis dan bisa lisis. Lizosim terdapat di air liur, air mata, putih telur burung sebagai pertahanan terhadap bakteri. The lysozyme hoatzin adalah lisozim yang
mengikat kalsium , sedangkan ruminansia dan lisosim lutung berasal dari cabang keluarga gen lisozim konvensional. Konvergensi fungsional dari lisozim dalam tiga garis keturunan adalah hasil dari paralel i sebagai pengganti asam amino yang terjadidalam garis keturunan masing-masing. Misalnya, posisi 75 berubah menjadi asam aspartat asam dalam tiga garis keturunan. kita harus berasumsi bahwa seleksi adaptif memainkan utamaperan dalam evolusi lisozim. Seprti pada gambar dibawah ini
D. Pola Subtitusi
Ada 12 tipe subtitusi nukleotida yang mungkin (misal, dari A menjadi G, dari A menjadi C, dari T menjadi A). Untuk menghitung jumlah subtitusi nukleotida antara dua rangkaian DNA, kami menggelompokkan ke 12 tipe menjadi satu. Namun, kadang menarik untuk menentukan secara terpisah frekuensi yang dengannya masing-masing tipe subtitusi nukleotida terjadi. Pola subtitusi nukleotida didefinisikan sebagai frekuensi relatif yang dengannya nukleotida tertentu berubah menjadi yang lain selama evolusi. Pola biasanya ditunjukkan dalam bentuk matriks 4 x 4, dimana masing-masing dari 12 elemen matriks (tidak termasuk empat elemen diagonal yang menunjukkan kasus tidak ada subtitusi) menunjukkan jumlah perubahan dari nukleotida tertentu menjadi lainnya.
Biarkan Pij menjadi bagian perubahan dasar dari tipe ke-i menjadi tipe ke-j
nukleotida (i, j = A, T, C atau G dan i ≠ j). Bagian ini dihitung sebagai
(15)
Dimana nij adalah jumlah subtitusi dari i menjadi j, dan ni adalah jumlah nukleotida
i pada rangkaian pendahulunya. Agar mampu untuk membandingkan pola subtitusi nukleotida antara rangkaian, kami mendefinisikan f ij, frekuensi subtitusi relatif dari
nukleotida i menjadi nukleotida j, sebagai
Jadi, f ij menunjukkan jumlah yang diharapkan dari perubahan dasar dari nukleotida
tipe i menjadi tipe j di antara setiap 100 subtitusi pada rangkaian acak (yaitu, pada sebuah rangkaian dimana empat dasar sama-sama sering).
Pola Mutasi Spontan
Karena mutasi poin merupakan salah satu faktor paling penting pada evolusi rangkaian DNA, ahli evolusi molekuler lama tertarik dalam mengetahui pola mutasi spontan (Beale dan Lehmann 1965; Fitch 1967; Zuckerkandl dkk 1971; Vogel dan Kopun 1977; Sinha dan Haimes 1980). Pola ini dapat bertindak sebagai standar untuk menyimpulkan seberapa jauh frekuensi pertukaran yang diamati antara nukleotida pada rangkaian DNA tertentu menyimpang dari nilai-nilai yang diharapkan di bawah asumsi tidak ada seleksi, atau netralitas selektif.
Satu cara untuk mempelajari pola mutasi poin adalah mempelajari pola subtitusi di wilayah DNA yang terbuka bagi tidak adanya batasan selektif. Pseudogen berguna dalam hal ini. Karena mereka tidak memiliki fungsi, semua mutasi yang muncul pada pseudogen netral dan menjadi tetap pada populasi dengan kemungkinan yang sama. Jadi, rata-rata subtitusi nukleotida pada pseudogen diharapkan untuk menyamakan rata-rata mutasi. Dengan cara yang sama, pola subtitusi nukleotida pada pseudogen diharapkan menunjukkan pola mutasipoin spontan.
Gambar 8 menunjukkan metode sederhana untuk meringkas subtitusi nukleotida pada rangkaian pseudogen (Gojobori dkk, 1982). Rangkaian 1 adalah pseudogen, rangkaian 2 adalah pasangan fungsional dari spesies yang sama dan rangkaian 3 adalah rangkaian fungsional yang menyebar sebelum kemunculan pseudogen. Andaikan bahwa di tempat nukleotida tertentu, rangkaian 1 dan 2 memiliki A dan G. maka kita dapat mengasumsikan bahwa nukleotida pada rangkaian pseudogen berubah dari G menjadi A jika rangkaian 3 memiliki G, tapi bahwa nukleotida pada rangkaian 2 berubah dari A menjadi G jika rangkaian 3 memiliki A. Namun, jika rangkaian 3 memiliki T atau C, maka kita tidak dapat memutuskan arah perubahan dan pada kasus ini tempat dikeluarkan dari perbandingan. Secara umum, ketika nukleotida pendahulu di sebuah tempat tidak dapat ditentukan, tempat itu harusnya dikeluarkan dari analisa. Dengan cara yang sama, penghapusan dan penambahan harus juga dikeluarkan. Karena rata-rata subtitusi biasanya jauh lebih tinggi pada pseudogen dibandingkan yang ada pada gen fungsional homolog, perbedaan pada rangkaian nukleotida antara sebuah gen dan pseudogen dijelaskan pada mayoritas kasus oleh subtitusi yang muncul pada pseudogen daripada dengan subtitusi pada gen fungsional.
Gambar 8. Pohon filogenetik pola subtitusi nukleotida pada sekuens pseudogen
Pada sebuah studi atas 105 mamalia memiliki pseudogen, Ophir dan Graur menemukan bahwa nilai f ij sangat berbeda dari satu pseudogen dengan yang lain. Matriks
menunjukkan pola gabungan subtitusi yang diperoleh dari 55 rangkaian pseudogen yang diproses dari manusia. Arah mutasi tidak acak. Sebagai contoh, A berubah lebih sering menjadi G dibandingkan T atau C. Empat elemen dari sudut kanan atas ke sudut kiri bawah adalah nilai f ij untuk transisi, sementara delapan elemen lainnya menunjukkan transverse.
Jumlah frekuensi relatif transisi adalah 67,5% (66,2% jika dinukleotida CG dikeluarkan). Karena ada empat tipe transisi dan delapan tipe transverse, bagian yang diharapkan dari transisi di bawah asumsi bahwa semua mutasi yang mungkin terjadi dengan frekuensi yang sama adalah 33,3%. Bagian yang diamati (67,4%) sekitar dua kali nilai yang diharapkan.
Beberapa nukleotida lebih dapat bermutasi dibanding yang lain. Jika keempat nukleotida sama-sama dapat bermutasi, kita akan mengharapkan nilai 25% pada setiap elemen kolom. Dalam praktiknya, kita melihat bahwa G bermutasi dengan frekuensi relatif 29,7% (31,6% jika dinukleotida CG dikeluarkan) yaitu G adalah nukleotida yang dapat bermutasi, sementara A bermutasi dengan frekuensi relatif 20,3% (yaitu, tidak dapat bermutasi). Di bagian bawah baris, kami mendata frekuensi relatif semua mutasi yang menghasilkan A, T, C atau G. Kami mencatat bahwa 56,4% semua mutasi menghasilkan A, atau T, sementara pengharapan untuk kasus kemungkinan mutasi yang sama di semua arah adalah 50%. Karena ada kecenderungan bagi C dan G untuk berubah menjadi A atau T, dan karena A dan T tidak dapat berubah seperti C dan G untuk berubah menjadi A atau T, dank
arena A dan T tidak dapat berubah seperti C dan G, pseudogen diharapkan menjadi kaya pada A dan T. Hal ini harusnya benar untuk wilayah bukan pembuatan kode lain yang
terbuka bagi tidak adanya batasan fungsional. Tentu saja, wilayah bukan pembuatan kode secara umum kaya AT.
Diketahui bahwa, selain kesalahan pemasangan dasar, transisi dari C ke T dapat juga muncul dari konversi residu C methylate atas deaminasi (Coulondre dkk 1978; Razin dan Riggs 1980). Efek akan meningkatkan frekuensi C:G → T:A dan G:C → A:T;
yaitu, f CT dan f GA. Karena sekitar 90% residu C metilat pada DNA vertebrata muncul pada
dinukleotida 5`-CG-3` (Razin dan Riggs, 1980), efek ini harusnya diekspresikan sebagai perubahan dinukleotida CG menjadi TG atau CA. Setelah sebuah gen menjadi pseudogen, perubahan tersebut tidak akan lagi terbuka bagi batasan fungsional dan dapat memberikan kontribusi bagi transisi C → T dan G → A, jika frekuensi CG relatif tinggi sebelum
penghentian gen (yaitu, kehilangan fungsinya). Pola subtitusi yang diperoleh dengan mengeluarkan semua tempat nukleotida mungkin lebih sesuai untuk memprediksikan pola mutasi dalam sebuah rangkaian yang tidak terbuka bagi batasan fungsional untuk waktu yang lama (misal, beberapa bagian intron), karena pada rangkaian tersebut sedikit CG dinukleotida akan ada untuk mulai. Pola yang diperoleh setelah mengeluarkan CG dinukleotida agak berbeda dari yang diperoleh sebaliknya. Secara khusus, frekuensi relatif transisi C→T lebih rendah sekitar 20%.
Ketidaksamaan jenis: Pola subtitusi pada DNA mitokondria manusia
Studi awal tentang DNA mitokondia primate (mtDNA) mengungkapkan bias transisi ekstrim pada pola subtitusi nukleotida (Brown dkk, 1982). Tamura dan Nei (1993) mempelajari pola subtitusi di wilayah kontrol dianggap tidak memiliki batasan fungsional, dan pola subtitusinya menunjukkan pola mutasi spontan pada mtDNA. Transversi ditemukan terjadi dengan frekuensi sangat rendah dan rata-rata rasio transisi/transversi adalah 15,7 jauh lebih besar dibandingkan rasio 2 pada DNA inti. Lebih lanjut frekuensi relatif transisi antara pirimidin (C ↔T) hampir dua kali besar antara purine (G ↔ A), yang
melanggar dua persamaan, f CT = f GA dan f TC = f AG, dan yang menyarankan bahwa pola dan
rata-rata mutasi mungkin berbeda antara dua jenis. Dalam perbandingan, tidak ada bukti untuk ketidaksamaan jenis diperoleh dari pola inti dimana frekuensi relatif transisi antara pirimidin (34,5%) hampir sama seperti antara purin (32,9%).
Ada banyak ukuran pada literatur yang ditujukan dalam menghitung kesamaan atau ketidak-samaan antara dua asam amino (Sneath 1966; Grantham 1974; Miyata dkk, 1979). Jarak fisikokimia berdasarkan pada sifat asam amino seperti polaritas, volume molekuler dan komposisi kimia. Subtitusi asam amino dengan yang sama (misal, leusin menjadi isoleusin atau leusin menjadi metionin disebut subtitusi konsevatif dan subtitusi asam amino yang tidak sama (misal, glisin menjadi triptofan atau sistein menjadi triptofan) disebut subtitusi radikal. Beberapa asam amino, seperti leusin, isoleusin, glutamin, dan metionin adalah asam amino tipikal, karena mereka memiliki sejumlah asam amino alternatif yang sama yang dengannya mereka dapat diganti melalui subtitusi non sinonim tunggal. Asam amino lain, seperti sistein, triptofan, tirosin dan glisin, adalah asam amino khusus; mereka memiliki sedikit asam amino alternatif sama yang dengannya mereka dapat digantikan. Graur (1985) merancang sebuah indeks stabilitas, yang merupakan mean jarak fisikokimia antara asam amino dan turunan mutasinya yang dapat diproduksi melalui subtitusi nukleotida tunggal. Indeks stabilitas dapat digunakan untuk memprediksikan kecenderungan evolusioner asam amino untuk menjalani subtitusi.
Dikenal sejak karya awal Zuckerkandl dan Pauling (1965) bahwa subtitusi konservatif sering muncul dibandingkan subtitusi radikal pada evolusi protein. Sifat konservatif subtitusi asam amino terbukti ketika menempatkan frekuensi relatif subtitusi asam amino terhadap jarak fisikokimia. Dari sudut pandang teori netral, fenomena ini dapat dengan mudah dijelaskan dengan menggunakan Persamaan 2. Subtitusi konservatif mungkin kurang mengganggu dibandingkan yang radikal; karena itu, kemungkinan perubahan mutasi yang netral (sebagai kebalikan dari yang membahayakan) lebih besar jika subtitusi asam amino terjadi antara dua asam amino yang sama dibandingkan jika terjadi antara dua yang tidak sama. Namun, pada beberapa kasus kodon asam amino yang sama berbeda lebih banyak dibandingkan satu nukleotida dan jadi subtitusi asam amino
Gambar 9. Hubungan antara jarak fisikokimia dan frekuensi penggantian asam amino pada 20 protein mamalia (reseptor ryanodin, distrofin, protein lokus ataxia, faktor koagulasi 8 dan 9, regulator konduktan transmembran cystic
fibrosis, α glukosidase, reseptor low density protein, piruvat kinase, hexosaminidase A dan B, glucocerebrosidase, fenilalanin hidroksilase, asam fumarat hidroksilasi, galactosa 1 uridiltransferase, periferin, uroporphrynogen
III sintase CD 40 ligand dan faktor Hippel lindau.
Argyle (1980) merancang sebuah perwakilan grafik lingkaran pertukaran asam amino. Sebuah versi yang telah diubah oleh Pieber dan Toha (1983) ditunjukkan pada Gambar 9. Dengan tergantung pada protein, 60 – 90% subtitusi asam amino yang diamati melibatkan tetangga terdekat atau terdekat kedua di cincin itu.
Properti protein apa yang disimpan dalam evolusi?
Evolusi setiap gen pembuat kode protein dibatasi oleh persyaratan fungsional protein khusus yang dihasilkan. Namun, menarik untuk mencari tahu apakah ada atau tidak properti umum yang dibatasi selama evolusi pada semua protein. Jawabannya sepertinya
adalah bahwa beberapa properti tentu saja disimpan selama evolusi protein (Soto dan Toha 1983). Dua properti yang paling banyak disimpan adalah volume dan indeks refraktif (ukuran kepadatan protein). Hydrophobisitas dan polaritas sepertinya juga disimpan, sementara rotasi optic sepertinya merupakan properti yang tidak relevan pada evolusi protein. Mengejutkan, distribusi asam amino, yang mungkin diharapkan menjadi faktor penting dalam menentukan evolusi, merupakan salah satu properti yang paling sedikit
Gambar 10. Lingkaran yang menunjukkan kemampuan berubah dari asam amino menurut metode Argyl (1980). jumlah yang ditulis adalah jumlah kodon pada famili dimana asam amino tidak dikode oleh 2 kodon sefamili. Sekitar
60%-90% observasi pergantian asam amino tergantung asam amino di dekatnya Sebagai konsekuensi dari penyimpanan kumpulan dan hidrofobisitas, beberapa asam amino cenderung menjadi kaku untuk subtitusi selama evolusi. Tentu saja, glisin, asam amino paling kecil, cenderung disimpan selama evolusi dengan mengabaikan kedekatannya dengan tempat yang aktif secara fungsional. Subtitusi di tempat-tempat yang didiami oleh glisin akan memperkenalkan ke dalam rantai polipeptida sebuah asam amino yang jauh lebih banyak. Karena gangguan struktural tersebut memiliki kemungkinan tinggi untuk memiliki efek yang membahayakan terhadap fungsi protein dengan mengabaikan lokasi glisin relatif dengan tempat aktif, mutasi tersebut sering dipilih. Akibatnya, gen yang memberi kode protein yang mengandung bagian besar residu glisin akan cenderung untuk berkembang secara lebih lambat dibandingkan yang miskin glisin (Graur, 1985). Selain
glisin, asam amino lain (misal, lisin, sistein dan prolin) juga disimpan secara konsisten (Naor dkk, 1996). Lisin dan sistein paling mungkin disimpan karena keterlibatan mereka dalam hubungan silang antara rantai polipeptida, sementara prolin disimpan karena kontribusi uniknya terhadap ikatan protein yang ditekuk.
Jumlah Substitusi Nukleotida Antara Dua Urutan Dna
Substitusi alel dalam suatu populasi biasanya memerlukan waktu ribuan atau bahkan jutaan tahun untuk menyelesaikannya (Bab 2). Untuk alasan ini, kita tidak bisa berurusan dengan proses substitusi nukleotida melalui observasi langsung, dan substitusi nukleotida selalu disimpulkan dari perbandingan berpasangan dari molekul DNA yang terbagi atas sebuah asal evolusi yang sama. Setelah dua sequence nukleotida menyimpang
satu sama lain, masing-masing dari mereka akan mulai menggabungkan substitusi nukleotida . Dengan demikian, jumlah substitusi nukleotida yang terjadi sejak dua urutan menyimpang adalah yang paling dasar dan umum digunakan variabel dalam evolusi molekuler.
Jika dua urutan panjang N berbeda satu sama lain di n lokasi, maka proporsi dari perbedaan, n / N, disebut sebagai tingkatan divergensi atau jarak Hamming. Derajat perbedaan biasanya dinyatakan sebagai persentase (n / N x 100%). Ketika tingkat perbedaan antara kedua perbandingan sequences kecil, kesempatan untuk lebih dari satu substitusi telah terjadi di site manapun diabaikan, dan jumlah perbedaan antara dua sequence yang diamati harus dekat dengan jumlah yang sebenarnya dari Substitution . Namun, jika tingkat perbedaan substansial, maka jumlah yang teramati dari perbedaan kemungkinan lebih kecil dari jumlah sebenarnya dari substitutions karena substitusi ganda atau beberapa hits di site yang sama. Misalnya, jika nukleotida pada sebuah site tertentu berubah dari A ke C dan kemudian ke T dalam satu urutan, dan dari A T dalam urutan lainnya, maka dua sequence di bawah perbandingan adalah identik pada site ini, meskipun fakta bahwa ketiga terjadi dalam sejarah evolusionernya (Gambar 3.6). Banyak metode telah diusulkan dalam literatur untuk mengoreksi beberapa substitusi (e.g., Jukes dan Cantor 1969; Holmquist 1972, Kimura 1980,1981, Holmquist dan Pearl 1980; Kaplan dan Risko 1982;. Lanave et al 1984). Pada bagian berikutnya kita akan meninjau beberapa metode yang paling sering digunakan.
Jumlah substitusi nukleotida antara dua sequence biasanya dinyatakan dalam jumlah nomor tempat substitusi per nukleotida daripada jumlah antara dua sekuens.
fasilitasi ini membandingkan antara pasangan urutan yang berbeda panjangnya.
Sequence Protein-coding dan noncoding harus diperlakukan secara terpisah karena mereka biasanya berkembang pada tingkat yang berbeda. Dalam kasus yang pertama, disarankan untuk membedakan antara substitusi identik dan tidak identik, karena mereka dikenal berkembang pada tingkat yang sangat berbeda dan karena perbedaan antara dua jenis substitusi dapat memberikan kita wawasan tambahan ke dalam mekanisme evolusi
Hasil yang telah kami peroleh sebelumnya dalam bab ini untuk urutan DNA tunggal dapat diterapkan untuk mempelajari perbedaan nukleotida antara dua urutan yang berbagi asal mula yang sama. Kami berasumsi bahwa semua situs secara berurutan berkembang pada tingkat yang sama dan mengikuti pola pengganti yang sama. Jumlah situs
dibandingkan antara dua sekuens dilambangkan oleh L. Delesi dan insertions yang termasuk dalam analisis.
FIGURE3.6 Two homologous DNA sequences that descended from an ancestral
sequence have accumulated mutations since their divergence from each other. Note that although 13 mutations have occurred, differences can be detected at only three nucleotide sites (-). Note further that "sequential substitutions," "coincidental substitutions," "parallel substitutions," "convergent substitutions," and "back substitutions" all involve multiple
substitutions at the aame site, though perhaps in different lineages.
Single substitution
Sequential substitutions Coincidental substitutions
Mari kita mulai dengan model satu-parameter. Dalam model ini, ini cukup untuk mempertimbangkan hanya I (i}, yang merupakan probabilitas bahwa nukleotida pada site tertentu pada waktu t adalah sama di kedua sekuens. Misalkan bahwa nukleotida pada site tertentu adalah A pada waktu 0. pada waktu t, probabilitas bahwa urutan keturunan akan memiliki A pada site ini adalah PAAW anc * akibatnya kemungkinan bahwa dua sekuens keturunan memiliki A pada site ini adalah PAA «- Demikian pula, kemungkinan bahwa kedua sekuens memiliki T, C, atau G di situs ini adalah PAT «, PACW dan PAG«) 'masing-masing. Oleh karena itu,
Persamaan 3.22 juga berlaku untuk T, C, atau G. Oleh karena itu, terlepas dari initial nucleotida pada sebuah site , / (,) merupakan proporsi nukleotida identik antara dua urutan yang menyimpang t unit waktu yang lalu. Perhatikan bahwa kemungkinan bahwa dua sekuens berbeda di sebuah lokasi pada waktu tis p = 1 - l ^ y demikian,
perbedaan waktu antara dua sekuens biasanya tidak diketahui, dan dengan demikian kita tidak bisa memperkirakan. Sebaliknya, kita menghitung K, yang merupakan jumlah substitusi per situs sejak zaman perbedaan antara dua sekuens. Dalam kasus model satu parameter, K = 2 (3AT), di mana Sortir adalah jumlah substitusi per situs dalam garis keturunan tunggal. Dengan menggunakan Persamaan 3.24 kita dapat menghitung K sebagai
di mana p adalah proporsi yang teramati dari nukleotida yang berbeda antara dua sekuens (Jukes dan Cantor 1969). Untuk sekuens L panjang, varians sampling K, V (K), yang mendekati diberikan oleh
(Kimura dan Ohta 1972). Persamaan 3.26 hanya berlaku untuk nilai besar L.
Dalam kasus pada model dua parameter (Kimura 1980), perbedaan antara dua sekuens diklasifikasikan ke dalam transisi dan transversi. Misalkan P
Catatan bahwa jika kita tidak membedakan antara perbedaan transisi dan transversional, yaitu, p = P + Q, maka Persamaan 3.27 untuk mengurangi Persamaan 3.25, sebagaimana dalam model Jukes dan Cantor. Variansi sampling kurang diberikan oleh
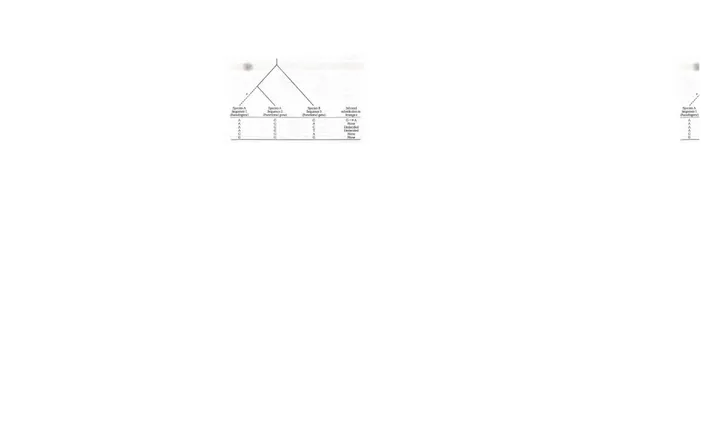
Mari kita mempertimbangkan sebuah hipotesis contoh numerik atau dua urutan panjang 200 nukleotida yang berbeda satu sama lain dengan 20 transisi dan transversi 4. Dengan demikian, L = 200, P = 20/200 = 0,10, dan Q = 4/200 = 0,02. Menurut model dua parameter, kita memperoleh K = 0,13. Jumlah substitusi dapat diperoleh dengan mengalikan jumlah substitusi per situs, K, dengan jumlah situs, L. Dalam hal ini kita memperoleh perkiraan sekitar 26 substitusi, sehingga 24 perbedaan yang diamati antara dua sekuens. Berdasarkan pada model satu-parameter, p = 24/200 = 0,12, dan 1C-0,13. E. Local Clock
Jam molekuler dapat berbeda antara suatu kelompok organisme dengan organisme lainnya. Jam molekuler yang khusus untuk suatu kelompok organisme itulah yang disebut sebagai local clock. Berikut ini merupakan contoh metode untuk mengetahui local clock
pada mencit, tikus dan hamster menggunakan perbandingan rata-rata subtitusi sinonim dan nonsinonim dengan tes rata-rata relatif.
Jika spesies 1 adalah mencit, spesies 2 adalah tikus dan spesies 3 adalah hamster, maka tanda positif untuk nilai K 13-K 23 artinya bahwa laju pada mencit lebih tinggi daripada
pada tikus, sedangkan tanda negatif menunjukkan sebaliknya. Data sekuen yang digunakan terdiri dari 28 gen dengan panjang total 11.295 nukleotida. Baik nilai K 13-K 23 bukan 0
sehingga hipotesis nol tingkat substitusi yang sama pada mencit dan tikus diterima.
Hasil dari perbandingan tersebut menunjukkan bahwa rata-rata subtitusi cenderung konstan tidak hanya untuk subtitusi yang sinonim namun juga subtitusi nonsinonim. Hasil ini konsisten dengan hipotesis mutasi netral yang merumuskan bahwa kebanyakan perubahan molekular pada evolusi merupakan mutasi netral.
Berdasarkan jarak imunologi dan data sekuen protein, diperkirakan terjadi penurunan laju subtitusi pada hominoid (manusia dan kera) setelah perpisahan mereka saat masa lampau. Perlambatan tersebut adalah karena perkiraan yang salah tentang waktu divergensi antara kera dan manusia. Dengan uji ID Tajima pada urutan pseudogene ŋ-globin dari manusia, simpanse ( Pan troglodytes), simpanse kerdil ( P. paniscus), gorila (Gorilla gorilla), orangutan ( Pongo pygmaeus) dan Gibbon ( Hylobates lar ). Dalam setiap perbandingan berpasangan, digunakan referensi berupa spesies outgroup terdekat. Misalnya untuk membandingkan Pan troglodytes dengan Pan paniscus, digunakan manusia sebagai outgroup. Demikian pula, dalam perbandingan Pan dengan Homo digunakan Gorilla sebagai outgroup.
Dalam perbandingan antara Homo (spesies 1) dengan P. paniscus, P. troglodytes atau Gorilla gorilla (spesies 2) terlihat bahwa nilai-nilai m1, secara signifikan lebih kecil
dari nilai m2. Oleh karena itu, tingkat substitusi pada manusia lebih kecil dibandingkan di
kera Afrika. Pada perbandingan antara manusia dan orangutan dengan Gibbon sebagai outgroup, m1<m2tetapi perbedaannya tidak signifikan secara statistik.
Sebuah studi menunjukkan bahwa perlambatan dalam keturunan manusia tidak terbatas pada pseudogene ŋ-globin, tetapi merupakan fenomena yang umum dan mungkin juga mempengaruhi seluruh genom. Diperkirakan bahwa garis keturunan simpanse dan gorila berevolusi sekitar 1,5 kali lebih cepat dari garis keturunan manusia. Percobaan hibridisasi DNA-DNA juga telah memberikan bukti kuat untuk hipotesis perlambatan ini.
Perbedaan antara hominoid dan monyet Afrika (Cercopithecidae) diperkirakan telah terjadi pada Oligosen (sekitar 20-30 juta tahun yang lalu). Perbedaan antara monyet Dunia Lama (Catarrhini) yang meliputi Hominoidea dan Cercopithecidae dan monyet Dunia Baru (Platyrrhini) diperkirakan telah terjadi setidaknya 10 juta tahun lalu. Oleh karena itu mungkin untuk menguji ketidaksetaraan dalam tingkat substitusi antara manusia dan monyet Afrika dengan menggunakan monyet Dunia Baru sebagai outgroup.
Pada tabel di atas, K 13 dan K 23 adalah jarak antara monyet Afrika dan monyet
Dunia Baru dan antara manusia dan monyet Dunia Baru. Pada semua kasus, K 13-K 12 secara
signifikan lebih besar dari 0 sehingga dapat disimpulkan bahwa tingkat substitusi di daerah noncoding , yang mungkin mencerminkan tingkat mutasi, lebih tinggi pada monyet Afrika daripada manusia.
Berdasarkan data hibridisasi DNA-DNA, laju substitusi nukleotida pada tikus dan mencit ternyata jauh lebih tinggi dibanding manusia dan simpanse. Diperkirakan tingkat evolusi mencit dan tikus 16 kali lebih tinggi dibandingkan dengan manusia dan simpanse. Evaluasi Hipotesis Jam Molekuler
Jika ditelaah secara ekstrim, hipotesis jam molekuler menyatakan bahwa DNA homolog berevolusi pada =tingkat yang sama sepanjang garis keturunan evolusi selama mereka mempertahankan fungsi asli mereka. Analisis urutan DNA dari beberapa ordo mamalia menunjukkan bahwa tidak ada jam molekuler global yang ada dalam kelas Mamalia. Bahkan variasi yang signifikan dalam tingkat substitusi nukleotida telah ditemukan baik di dalam dan di antara perintah yang berbeda dari mamalia.
Tikus tampaknya berkembang jauh lebih cepat daripada artiodactyls, yang pada gilirannya berkembang lebih cepat dari primata. Dalam ordo mamalia, variasi dalam tingkat substitusi antara spesies agak kecil. Namun, ada kasus-kasus di mana perbedaan intraordinal substansial telah terbukti ada. Contohnya, dalam primata, tingkat substitusi sinonim dalam monyet Dunia Lama hampir dua kali lipat daripada kera masa kini.
Karena asumsi laju kekonstanan dilanggar bahkan pada Mammalia, sebuah jam molekuler yang benar-benar universal yang berlaku untuk semua organisme tidak dapat diasumsikan ada. Memang, tingkat substitusi antara organisme yang berkerabat jauh telah selalu terbukti bervariasi. Sebagai contoh, telah diperkirakan bahwa tingkat substitusi di Drosophila 5-10 kali lebih cepat daripada sebagian besar vertebrata dan perbedaan ini berlaku untuk bagian-bagian yang paling konservatif dari genom. Oleh karena itu, ketika menggunakan asumsi jam molekuler untuk menyimpulkan waktu divergensi harus dilakuakan dengan sangat hati-hati, terlebih ketika menyangkut spesies yang berkerabat jauh.
Penjelasan tersebut bukan berarti bahwa jam molekuler tidak ada. Sebaliknya, ada banyak jam lokal yang cukup teratur bagi banyak kelompok spesies yang berhubungan dekat. Selain itu, ketika parameter yang berkaitan dengan sejarah kehidupan tanaman, bakteri, serangga, dan mamalia yang berbeda satu sama lain, memiliki tingkat substitusi berarti yang identik dalam genom inti sel organisme tersebut. Oleh karena itu, jam
molekuler masih dapat digunakan untuk memperkirakan divergensi spesies dengan tingkat kepercayaan yang wajar dan dikoreksi sesuai tingkat evolusi molekuler antara garis keturunan.
Laju Subtitusi pada DNA Organel
Sebagian besar eukariota memiliki setidaknya satu genom ekstranuklear yang direplikasi secara independen dari genom inti. Genom organel, seperti mitokondria dan kloroplas yang jauh lebih kecil akan lebih mudah untuk diteliti daripada genom inti. Organel hampir selalu diwariskan secara uniparental. Mitokondria hewan diwariskan dari garis ibu meskipun pada beberapa kasus terjadi kebocoran mitokondria dari ayah. Kloroplas dan mitokondria tumbuhan sebagian besar diwariskan secara maternal juga. Ada pengecualian yaitu pada konifer, kloroplas diwariskan dari ayah dan pada Chlamydomonas
reinhartii, mitokondria yang diwariskan dari ayah.
Genom mitokondria hewan terdiri dari DNA untai ganda melingkar s ekitar 15.000-17.000 pasangan basa yang panjangnya kira-kira 1/10.000 dari genom inti terkecil. Genom mitokondria ini unik karena berisi sekuen yang nonrepetitif yaitu 13 gen penyandi protein (7 subunit NADH-ubiquinone oxireductase, 3 subunit oksidase sitokrom c dan 2 subunit dari sintase ATP +H dan sitokrom b) serta 22 tRNA gen, daerah kontrol yang berisi situs untuk replikasi dan inisiasi transkripsi dan beberapa spacer intergenik. Semua gen tidak memiliki intron dan genom tersebut sangat stabil dalam hal struktural dan evolusi.
Laju substitusi nonsinonim bervariasi antara 13 gen pengkode protein dan umumnya jauh lebih tinggi dari rata-rata laju untuk substitusi nonsinonim gen inti. Alasan utama untuk tingginya tingkat substitusi ini mungkin karena DNA mitokondria memiliki ketahanan yang rendah dari proses replikasi DNA dalam mitokondria, terjadi perbaikan efisien mekanisme dan adanya konsentrasi tinggi mutagen misalnya radikal superoksida yang dihasilkan dari fungsi metabolisme yang dilakukan oleh mitokondria.
Baru-baru ini dilakukan penelitian tentang biologi molekuler tanaman sehingga memungkinkan penyelidikan pada evolusi gen tanaman. Karena kingdom tumbuhan dan hewan berpisah sekitar 1 miliar tahun yang lalu, pola evolusi pada tanaman mungkin menjadi sangat berbeda dengan hewan. Tanaman memiliki perberbedaan dengan hewan dalam organisasi DNA organel karena tumbuhan memiliki genom mitokondria yang jauh lebih besar dan secara struktural lebih bervariasi dan dengan memiliki genom ketiga yang independen yaitu kloroplas.
Genom mitokondria tanaman menunjukkan variabilitas struktur lebih banyak daripada hewan. Genome mitokondria pada tanaman sering mengalami penyusunan ulang,
duplikasi dan delesi. Meskipun variasi ukuran genom kloroplas lebih kecil dibandingkan dengan mitokondria, genom kloroplas bervariasi antar tumbuhan terutama dalam jumlah gen penyandi protein, gen untuk tRNA, pseudogen dan berbagai jenis intron. Berdasarkan urutan gen pada beberapa enzim restriksi, menunjukkan bahwa gen kloroplas memiliki laju yang lebih rendah daripada substitusi nukleotida gen inti mamalia dan DNA mitokondria tumbuhan berkembang perlahan pada urutan nukleotida meskipun sering mengalami penyusunan ulang.
Tingkat substitusi nukleotida tidak berkorelasi baik dengan tingkat perubahan struktural dalam genom organel. Pada mamalia, DNA mitokondria berkembang sangat pesat dalam hal substitusi nukleotida tetapi penataan ruang gen dan ukuran genom relatif
konstan. Sebaliknya genom mitokondria tumbuhan sering mengalami perubahan struktural dalam hal ukuran dan urutan gen tetapi tingkat substitusi nukleotida sangat rendah. Pada DNA kloroplas baik tingkat substitusi nukleotida dan evolusi struktural sangat rendah. Kurangnya korelasi antara tingkat substitusi dan tingkat evolusi struktural menunjukkan bahwa dua proses tersebut terjadi secara independen.
Laju Subtitusi pada Virus RNA
Virus RNA diketahui berevolusi pada tingkat yang sangat tinggi, mungkin 1 juta kali lebih cepat dari organisme dengan genom DNA. Oleh karena itu sejumlah besar substitusi nukleotida terakumulasi selama periode waktu yang singkat dan perbedaan dalam urutan nukleotida antara strain virus yang diisolasi pada interval waktu yang relatif singkat. Hal ini memungkinkan untuk pendekatan yang berbeda untuk memperkirakan tingkat evolusioner daripada yang digunakan sebelumnya. Tingkat substitusi yang tinggi dari HIV terutama disebabkan oleh kesalahan dalam transkripsi balik dari RNA ke DNA. Tingkat substitusi yang tinggi tersebut mengakibatkan perubahan cepat dari sifat virus seperti tropisme jaringan dan kepekaan terhadap terapi obat antiviral.
BAB I
PENDAHULUAN
A. Latar Belakang Masalah
Perubahan dalam suatu urutan nucleoticks: digunakan dalam studi evolusi molekuler baik untuk memperkirakan laju evolusi dan untuk merekonstruksi evolusi nya ¬ tory organisme.Namun, karena proses substitusi nukleotida biasanya sangat lambat, tidak dapat diamati dalam kehidupan secara mata telanjang. Oleh karena itu, untuk mendeteksi perubahan evolusioner dalam urutan DNA, kita menggunakan metode-metode komparatif
dimana urutan tertentu dibandingkan dengan yang lain dengan urutan yang berbagi nenek moyang yang sama di masa lalu evolusi. Daerah Pengkode memiliki rata-rata subsitusi nonsinonim yang bervariasi diantara gen-gennya, merefleksikan rata-rata protein evolusi.
Laju subsitusi nukleotida merupakan basic dari evolusi molekuler,yang memiliki karakateristik pada urutan DNA. Dengan mengetahui subsitusi nukleotida maka akan mengetahui perbedaan secara divergensi dari spesies sampai ke takson yang tinggi dengan mempelajari garis evolusi yang terjadi. Kita menginvestigasi berbagai macam faktor yang mempengaruhi adanya variasi. Laju evolusi dari nukleus, organel, genom RNA yang diamati. Oleh karena itu makalah ini akan dibahas berhubungan dengan rumusan masalah sebagai berikut:
1. Bagaimanakah laju subsitusi nukleotida beserta faktor yang mempengaruhinya? 2. Bagaimana Pola subsitusi dan jam molekular yang terjadi?
3. Bagaimana Lokal jam yang terjadi berhubungan dengan laju dan pola subsitusi nukleotida pada evolusi molekular?
B. Tujuan
1. Mengetahui laju subsitusi nukleotida beserta faktor yang mempengaruhinya 2. Mengetahui Pola subsitusi dan jam molekular yang terjadi
3. Mengaetahui Lokal jam yang terjadi berhubungan dengan laju dan pola subsitusi nukleotida pada evolusi molekular
BAB III PENUTUP
A. Kesimpulan
• Laju subsitusi nukleotida terdapat pada daerah pengkodean, nonpengkodean
• Terdapat berbagai macm faktor penyebab adanya variaso pada laju subsitusi
nukleotida yaitu adanya laju nukleotida identik dan nonidentik, adanya variasi antar gen yang berbeda, adanya kendala fungsional, adanya variasi dalam gen tersebut
• Jam molekuler dapat berbeda antara suatu kelompok organisme dengan organisme
lainnya. Jam molekuler yang khusus untuk suatu kelompok organisme itulah yang disebut sebagai local clock
• hipotesis jam molekuler menyatakan bahwa DNA homolog berevolusi pada
=tingkat yang sama sepanjang garis keturunan evolusi selama mereka mempertahankan fungsi asli mereka
• Contoh dari laju subsitusi organel adanya Genom mitokondria tanaman
menunjukkan variabilitas struktur lebih banyak daripada hewan. Genome mitokondria pada tanaman sering mengalami penyusunan ulang, duplikasi dan delesi
• Laju subsitusi pada virus RNAA, diketahui berevolusi pada tingkat yang sangat
DAFTAR PUSTAKA
Gaur, Dan. 1999. Fundamentals Of Molecular Evolution. Universitas Of Chicago: wen-H-siung Li
LAJU DAN POLA SUBSITUSI NUKLEOTIDA
MAKALAH
Untuk Memenuhi Tugas Matakuliah Biokimia
yang Dibina Oleh Prof. Dr. agr. Mohamad Amin, S.Pd., M.Si
Oleh
Eka Vasia Anggis Ema Aprilissa Sefi Andi Alinuha
UNIVERSITAS NEGERI MALANG PROGRAM PASCASARJANA
PROGRAM STUDI PENDIDIKAN BIOLOGI Maret 2013