ISOLASI DAN KARAKTERISASI FRAGMEN cDNA DARI GEN PENYANDI METALLOTHIONEIN
DARI KEDELAI KULTIVAR SLAMET
YASSIER ANWAR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2008
SURAT PERNYATAAN
Dengan ini saya menyatakan bahwa tesis yang berjudul:
Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi METALLOTHIONEIN Tipe 2 dari Kedelai Kultivar Slamet
adalah karya saya sendiri yang diarahkan oleh Komisi Pembimbing dan belum pernah dipublikasikan oleh siapapun. Sumber data dan informasi yang dikutip dalam tesis ini telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Oleh karena itu, semua isi tesis ini dapat dipertanggung jawabkan kebenarannya.
ABSTRACT
YASSIER ANWAR. Isolation and characterization of cDNA fragment of gene encoding metallothionein type 2 from Glycine max L. cv. Slamet under direction of SUHARSONO, UTUT WIDYASTUTI SUHARSONO.
Metallothionein (MT) has a capability to bind the metal ion. Therefore it has an important role in the detoxification of this ion, including aluminum (Al). This protein has a low molecular weight and contains cysteine-rich residue. The objective of this research is to isolate and characterize the fragment of cDNA encoding MT type 2 (Mt2) from Glycine max L. (GmMt2). To isolate the cDNA fragment of GmMt2, we started with total RNA isolation. We had successfully isolated total RNA. Total cDNA had been synthesized with using the total RNA as template by reverse transcription. By PCR technique, the cDNA fragment of GmMt2 had been successfully isolated with using total cDNA as template and specific primers of Mt2 designed from Arabidopsis thaliana (AtMt2)(Acc. EM_PL:AY037263). The GmMt2 fragment was succesfully inserted into pGEM®–T Easy plasmid, then the recombinant plasmid was introduced into Escherichia coli DH5α. Sequence analysis showed that the lenght of PCR-isolated GmMt2 fragment is 257 bp containing 246 bp open reading frame encoding for 81 amino acids. Enzym restriction sites analysis showed that GmMt2 fragment does not contain the restriction sites found in the multi cloning sites of pGEM®–T Easy. Nucleotide and amino acid alignment analysis using BLAST programshowed that GmMt2 fragment is similar with complete cDNA of AtMt2A (Acc. NM_111773).
RINGKASAN
YASSIER ANWAR. Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi metallothionein Tipe 2 dari Kedelai Kultivar Slamet. Dibimbing oleh SUHARSONO, UTUT WIDYASTUTI SUHARSONO.
Metallothionein merupakan protein yang mengandung banyak asam amino sistein, memiliki berat molekul yang rendah serta memiliki kemampuan dalam mengikat dan mengkoordinasi atom-atom logam. Oleh karena itu, MT mempunyai peranan yang penting dalam mendetoksifikasi ion logam, termasuk aluminium (Al). MT telah ditemukan pada berbagai macam organisme termasuk tanaman, mamalia, cendawan dan beberapa spesies dari prokariot. Penelitian ini tujuan untuk mengisolasi dan mengkarakterisasi fragmen cDNA dari gen yang menyandikan MT tipe 2 dari kedelai kultivar Slamet (GmMt2).
Isolasi fragmen cDNA Mt2 Glycine max L. (GmMt2), diawali dengan isolasi RNA total. Dengan transkripsi balik, cDNA total berhasil disintesis dari RNA total sebagai cetakan. cDNA total hasil sintesis diuji kemurniannya dari kontaminasi genom dengan PCR menggunakan primer spesifik untuk cDNA ekson1-ekson2 dari aktin.
Dengan PCR, fragmen cDNA GmMt2telah berhasil diisolasi denganmenggunakan cDNA total sebagai cetakan dan primer spesifik Mt2 yaitu MF dan M7R yang dirancang dari Arabidopsis thaliana (AtMt2) (nomor akses EM_PL:AY037263).Fragmen GmMt2 berhasil disisipkan ke dalam plasmid pGEM-T Easy, kemudian plasmid rekombinan ini diintroduksikan ke dalam Escherichia coli DH5α. Analisis cDNA sisipan didalam plasmid rekombinan dilakukan melalui pemotongan dengan EcoRI.
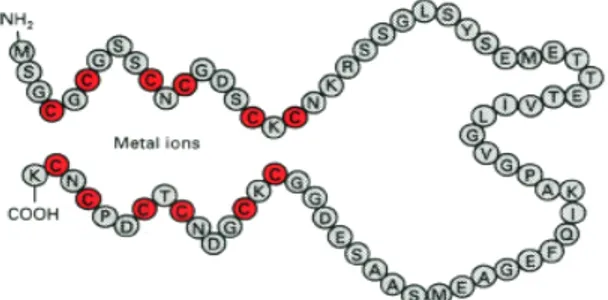
Pengurutan fragmen GmMt2 dilakukan untuk analisis dan karakterisasi sekuen. Analisis sekuen menunjukkan bahwa panjang fragmen GmMt2 yang diisolasi dengan PCR adalah 257 pb, mengandung 246 pb open reading frame dan menyandikan 81 asam amino dengan 14 asam amino cysteine (Cys). GmMt2 memiliki berat molekul 8,2 kDA. GmMt2 mengandung cDNA lengkap yang mengandung kodon awal sampai kodon akhir dari Mt2. Analisis penyejajaran urutan nukleotida dan asam amino yang menggunakan program BLAST, menunjukkan bahwa fragmen GmMt2 sama dengan cDNA utuh dari AtMt2A (nomor akses NM_111773). Hasil deduksi asam amino dari fragmen GmMt2 memperlihatkan bahwa motif urutan asam amino Cys dari GmMT2 terdiri dari Cys-Cys (residu 3-4), Cys-X-Cys (8-10, 14-16, 67-69, 73-75, 78-80) dan Cys-X-X-Cys (20-23).
Analisis situs restriksi pada fragmen GmMt2 menunjukkan bahwa fragmen tersebut tidak mengandung situs pemotongan enzim restriksi endonuklease yang terdapat pada situs pengklonan (MCS = multi cloning sites) dari pGEM®–T Easy. Semua situs restriksi yang terdapat pada MCS pGEM®–T Easy dapat digunakan untuk mengisolasi sisipan GmMt2.
Berdasarkan kesamaan urutan nukleotida Mt2, GmMt2 sama dengan AtMt2A dari Arabidopsis thaliana. Kesamaan antara GmMt2 dengan AtMt2A dapat mengindikasikan kesamaan peran. Berdasarkan kesamaan urutan nukleotida Mt2, GmMt2 sama dengan AtMt2A dari Arabidopsis thaliana. Kesamaan antara GmMt2 dengan AtMt2A dapat mengindikasikan kesamaan peran. GmMT2 mempunyai fungsi yang sama dengan AtMT2A yaitu berperan dalam pengikatan dan detoksifikasi logam dan membatasi kerusakan oksidatif.
Analisis domain berdasarkan analisis kesejajaran asam amino GmMT2 dari berbagai spesies tanaman, fragmen GmMT2 memiliki 33 residu yang secara umum sejajar dengan domain MT tanaman, famili MT kelompok ke-15 (MT2_15p). GmMT2 memiliki 81 residu yang sama dengan domain dari subfamili MT kelompok tanaman yaitu MT tipe 2.
@ Hak Cipta milik IPB, tahun 2008
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebut sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis dalam bentuk apapun tanpa izin IPB
ISOLASI DAN KARAKTERISASI FRAGMEN cDNA DARI GEN PENYANDI METALLOTHIONEIN TIPE 2
DARI KEDELAI KULTIVAR SLAMET
YASSIER ANWAR
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2008
Judul Penelitian : Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi metallothionein Tipe 2 dari Kedelai Kultivar Slamet
Nama Mahasiswa : Yassier Anwar Nomor Pokok : P055040011 Program Studi : Bioteknologi
Menyetujui Komisi Pembimbing
Dr. Ir. Suharsono, DEA Ketua
Dr. Ir. Utut Widyastuti S, M.Si Anggota
Diketahui Ketua Program
Studi Bioteknologi
Dr. Ir. Muhammad Jusuf, DEA
Dekan Sekolah Pascasarjana
Prof. Dr. Ir. Khairil Anwar Notodiputro, MS
PRAKATA
Segala puji penulis panjatkan kepada Allah Subhanaahu Wa Ta’alaa atas limpahan berkat dan rahmat-Nya yang tiada terhingga sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini. Shalawat dan salam disampaikan kepada Rasulullah Muhammad SAW atas keteladanannya.
Terima kasih penulis sampaikan kepada dan yang telah membimbing dengan sabar dan penuh perhatian dalam penelitian ini. Terima kasih kepada Dr. Ir. Suharsono, DEA dan Dr. Ir. Utut Widyastuti S, M.Si selaku pembimbing yang telah meluangkan waktu didalam memberi bimbingan, nasehat dan ilmu yang sangat berharga bagi penulis. Terima kasih kepada Dr. Ir.Miftahuddin, M.Si selaku penguji tesis yang telah memberikan saran dan masukannya. Terima kasih kepada Dr. Ir.Muhammad Jusuf, DEA selaku ketua Program Studi Bioteknologi SPs IPB.
Terima kasih kepada Proyek Hibah Penelitian Tim Pascasarjana (HPTP) batch III atas nama Dr. Ir. Suharsono, DEA, yang telah membiayai penelitian ini. Terima kasih kepada Laboratorium BIORIN dan BMST PPSHB IPB yang telah menyediakan fasilitas dalam pelaksanaan penelitian dan juga kepada Pak Mulya serta Mbak Pepi atas kerjasama dan bantuannya.
Terima kasih yang tak terhingga penulis sampaikan kepada Ayahanda (Alm) Anwar Kasim, Ibunda (Almh) Rasmiwati Amin, Adinda (Almh) Maisarah, (Almh) Siti Rahmah dan (Alm) Kautsar yang telah menjadi inspirator bagi penulis untuk menyelesaikan cita-cita ini. Kepada Ayahanda (Alm) M. Jusuf, Ibunda Badrulaili, serta Istri Intan Keumala Sary dan Ananda Muhammad Fathul Islam atas doa, kesabaran, pengertian, pengorbanan dan kasih sayangnya.
Terima kasih juga kepada yang selalu memberi motivasi dan kerjasamanya bagi penulis selama menempuh studi. Rekan-rekan sejati dan seperjuangan di Laboratorium BIORIN dan BMST PPSHB IPB: Pak Muzuni, Mas Firda, Mbak Laela Sari, Rina Kurnianingsih, Bu Sri Listyowati, Niken, Ulfa, Pak Ulung, Bu Hanum, Bu Ratna, Pak Ali, Mashuda, Rizki Amelia Lubis, Agustina Senjayani, Siti Mutti Sawitri, Widyartini, Pak Hadi Sunarso, Mas Neo, Yasinta Ratna Wulandari, Bahrelfi, Budi Hebat, Ammay, Popi, T. Dian Fauziah, Lulut, Hakiim, Jaya, Nindia, Zahro, Dona, teman-teman BTK ‘04 dan semua pihak yang telah banyak membantu.
Sebagai penutup, semoga karya ilmiah ini bermanfaat bagi kemajuan ilmu pengetahuan.
Bogor, Agustus 2008 Yassier Anwar
RIWAYAT HIDUP
Penulis dilahirkan di Meuredu, Aceh Pidie pada tanggal 27 Juni 1979 sebagai anak pertama dari pasangan (Alm) Anwar Kasim dan (Almh) Rasmiwati. Saat ini penulis telah menikah dengan Intan Keumala Sary dan memiliki putra Muhammad Fathul Islam.
Penulis menyelesaikan studi di Jurusan Agronomi, FAPERTA, Universitas Syiah Kuala Banda Aceh tahun 2004. Pada tahun yang sama penulis melanjutkan studi S2 pada program Studi Bioteknologi, Sekolah Pascasarjana IPB Bogor.
DAFTAR ISI
Halaman
DAFTAR TABEL ... .. xi
DAFTAR GAMBAR ... ... xii
DAFTAR LAMPIRAN ... xiii
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 2
TINJAUAN PUSTAKA Struktur dan Klasifikasi Metallothionein ... 3
Metallothionein pada Tanaman ... 5
Metallothionein dan Detoksifikasi Logam ... 7
Peranan Metallothionein dalam Berbagai Mekanisme Seluler ... 8
Metallothionein pada Organisme Lain ... 10
BAHAN DAN METODE Waktu dan Tempat ... 12
Bahan Penelitian ... 12
Metode Penelitian ... 13
Isolasi RNA total ... 14
Sintesis cDNA total ... 15
Isolasi putatif fragmen Mt2 ... 15
Pengklonan fragmen putatif Mt2 ... 15
Seleksi E. coli yang mengandung vektor rekombinan ... 16
Isolasi plasmid E. coli DH5α transforman rekombinan ... 16
Analisis cDNA sisipan ... 17
Pengurutan dan analisis sekuen fragmen GmMt2 ... 17
HASIL DAN PEMBAHASAN Isolasi RNA Total ... 18
Sintesis cDNA Total ... 18
Isolasi cDNA Mt2 melalui PCR ... 19
Pengklonan Fragmen GmMt2 ke dalam Plasmid pGEM®-T Easy ... 20
Analisis Fragmen GmMt2 ... 22
Analisis Domain Fragmen GmMt2 ... 27
SIMPULAN DAN SARAN Simpulan ... 29
Saran ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Halaman
1. Klasifikasi MT kedalam famili dan subfamili ... 4 2. Hasil Isolasi RNA Total ... ... 17
DAFTAR GAMBAR
Halaman
1. Model struktur pengikatan logam oleh PsMTA ... 8
2. Vektor pengklonan pGEM® –T Easy ... 12
3. Tahapan isolasi, pengklonan dan karakterisasi fragmen GmMt2 dari kedelai kultivar Slamet. ... 13
4. RNA total dari ujung akar ... 17
5. cDNA aktin hasil PCR menggunakan cDNA total dari ujung akar sebagai cetakan ... 18
6. Fragmen GmMt2 hasil PCR menggunakan cDNA total dari ujung akar sebagai cetakan… ... 19
7. Seleksi biru putih koloni E.coli DH5α yang ditransformasi dengan DNA plasmid pGEM®–T Easy dan GmMt2 pada media seleksi yang mengandung ampisilin, IPTG dan X-gal ... 20
8. Hasil PCR terhadap koloni putih sebagai cetakan ... 21
9. Hasil pemotongan plasmid dengan enzim restriksi ... 21
10. Urutan basa fragmen GmMt2 dan deduksi asam aminonya ... 22
11. Posisi GmMt2 di dalam MCS dari pGEM®–T Easy ... 22
12. Urutan ORF dan motif asam amino Cys ... 23
13. Peta restriksi yang terdapat pada fragmen GmMt2 ... 23
14. Filogenetik berdasarkan urutan nukleotida Mt2 dari berbagai spesies .. ... 24
15. Filogenetik berdasarkan urutan asam amino MT2 dari berbagai spesies... 25
16. Posisi fragmen GmMT2 pada MT tanaman famili ke-15 berdasarkan analisis kesejajaran urutan asam amino ... 26
DAFTAR LAMPIRAN
Halaman
1. Hasil pengurutan nukleotida dengan primer T7 ... 37 2. Hasil analisis penyejajaran fragmen GmMt2 dengan gen pada data GenBank
menggunakan program BLAST ... 38 3. Hasil analisis penyejajaran urutan asam amino fragmen GmMT2dengan
PENDAHULUAN Latar Belakang
Metallothionein merupakan protein yang memiliki kemampuan mengikat dan mengkoordinasi atom-atom logam, mengandung banyak asam amino sistein, dan memiliki berat molekul yang rendah (4-8 kDa). MT telah ditemukan pada berbagai macam organisme termasuk tanaman, mamalia, cendawan dan beberapa spesies dari prokariot (Valle 1991; Cobbet & Goldsbrough 2002; Coyle et al. 2002).
Pada hewan dan tanaman, MT tidak hanya berperan dalam mekanisme homeostasis dan detoksifikasi logam (Cobbet & Goldsbrough 2002; Hall 2002), tapi juga terlibat dalam proses fisiologis, mengatur pertumbuhan sel, proliferasi, dan aktifitas dari metalloenzim, faktor transkripsi (Haq et al. 2003; Akashi et al. 2004; Wong et al. 2004), dan peradangan serta kematian sel (Vasak & Hasler 2000). Selain itu, keberadaan MT di dalam nukleus juga dapat melindungi DNA dari kerusakan oksidatif yang disebabkan oleh oksida radikal (Chubatsu & Meneghini 1993; Cai et al. 1995). Sintesis protein MT berada dibawah kontrol transkripsi dan dapat diinduksi oleh beberapa jenis logam, hormon dan juga sinyal pertumbuhan (Templeton et al. 1985; Andrews et al. 1987; Nartey et al. 1987).
MT terlibat dalam detoksifikasi ion logam (Hall 2002). Snowden & Gardner (1993) menunjukkan bahwa ekspresi gen MT pada tanaman gandum meningkat akibat akumulasi Al. Menurut Pilon-Smith & Pilon (2002) detoksifikasi Al dapat dilakukan dengan cara diikat oleh protein yang banyak mengandung asam amino cystein (Cys) seperti MT, GSH dan fitokelatin. Snowden et al. (1995) dan Wu et al. (2000) yakin bahwa protein seperti MT dan fitokelatin ikut berperan dalam toleransi tanaman terhadap Al, karena ekspresi gen yang homolog dengan gen penyandi MT diinduksi oleh cekaman Al.
Beberapa sekuen genom dan transkrip mRNA dari MT telah diidentifikasi pada berbagai spesies tanaman dan dibagi menjadi dua tipe MT, yang terdiri hanya dari pola residu Cys yaitu Cys-X-Cys digolongkan kedalam MT tipe 1, dan yang terdiri dari kombinasi Cys-Cys, Cys-X-Cys dan Cys-X-X-Cys digolongkan sebagai MT tipe 2
(-X- adalah asam amino selain sistein) (Yang et al. 2000). Pada klasifikasi MT yang disusun berdasarkan hubungan taksonomi, Kojima et al. (1999) dan Binz & Kägi (1999) membagi MT kedalam 15 famili, dengan MT tanaman masuk dalam famili yang ke-15, dengan 6 subfamili yaitu p1, p2, p2v, p3, pec dan p21.
Kedelai (Glycine max L.) merupakan komoditas pertanian yang sangat penting karena mempunyai nilai ekonomi yang tinggi dan merupakan salah satu sumber protein nabati utama di Indonesia. Kebutuhan kedelai di Indonesia diperkirakan mencapai 2 juta ton/tahun, sedangkan produksi dalam negeri hanya mampu memasok 0.8 juta ton/tahun dari yang dibutuhkan sehingga untuk memenuhi kebutuhan tersebut diperlukan impor sebanyak 1.2 juta ton/tahun (BPS 2007),yang berdampak pada hilangnya devisa negara yang mencapai Rp. 3 triliun per tahun.
Kedelai kultivar Slamet merupakan kultivar lokal yang toleran terhadap tanah asam dan Al. Al dapat menimbulkan cekaman oksidatif dengan terbentuknya oksigen radikal (ROS) (Panda et al. 2003). Karena MT terlibat dalam detoksifikasi radikal oksida, maka kemungkinan MT terlibat juga terhadap detoksifikasi Al.
Berdasarkan peranan MT dalam berbagai mekanisme penting pada tanaman terutama dalam detoksifikasi terhadap ion-ion logam, maka isolasi dan karakterisasi dari cDNA gen penyandi MT2 dari tanaman kedelai (GmMt2) sangat penting dilakukan. cDNA ini dapat digunakan untuk mengetahui dan memahami peran MT2 khususnya dalam ketahanan terhadap cekaman oleh ion logam yang dapat bersifat toksik seperti Al.
Tujuan Penelitian
Tujuan penelitian ini adalah mengisolasi dan mengkarakterisasi fragmen cDNA dari gen penyandi metallothionein tipe 2 dari kedelai kultivar Slamet.
TINJAUAN PUSTAKA
Struktur dan Klasifikasi Metallothionein
Metallothionein pertama kali ditemukan pada tahun 1957 sebagai protein yang mengandung banyak sulfur dan mengikat cadmium (Cd) dari ginjal kuda (Vallee 1991), dan menunjukkan hubungan yang erat dengan beberapa ion logam lainnya seperti zink (Zn)dan cupper (Cu) (Kagi & Kojima 1987). Sejak itu, MT telah diidentifikasi hampir pada berbagai organisme yang berbeda termasuk tanaman, mamalia, fungi bahkan pada beberapa prokariot (Vallee 1991; Cobbett & Goldsbrough 2002; Coyle et al. 2002).
MT merupakan protein (polipeptida) yang mempunyai massa molekul yang kecil (4-8 kDa), dan sifat utamanya adalah mengandung 26-33% asam amino cysteine (Cys) serta tidak mempunyai asam amino aromatik atau histidin (Frankenne et al. 1980; Engel & Brouwer 1984; Bayne et al. 1985; Rand & Petrocelli 1985; Binz & Kagi 1999). MT adalah protein yang terkonservasi, yang ditemukan tidak hanya pada berbagai tingkat jaringan/organ (misalnya hati, ginjal, insang, testis, usus, otot, plasma, eritrosit, sel-sel epitelial dan urine) tetapi ditemukan juga pada sitoplasma dan nukleus (Cherian 1994b).
Sistem tata nama untuk klasifikasi MT, pertama kali digunakan pada tahun 1978 (Nordberg & Kojima 1979), dan diperbaharui kembali pada tahun 1999 (Binz & Kagi 1999) kedalam 15 famili dan beberapa subfamili (Tabel 1). Klasifikasi MT disusun berdasarkan komposisi asam amino, jumlah dan pembagian asam amino Cys didalam sekuen, similaritas dari sekuen dan hubungan filogenetik (Binz & Kagi 1999).
Berdasarkan hubungan struktural, protein MT dibagi menjadi tiga kelas utama yang juga berdasarkan susunan dari asam amino Cys didalam urutan sekuen (Fowler et al. 1987; Zhou et al. 1995). MT kelas I mengandung residu Cys yang berkelompok dekat N-terminal dan C-terminal. Dua kelompok ini dipisahkan oleh daerah bagian tengah kira-kira sekitar lebih kurang 40 residu tetapi tanpa residu Cys. Dalam kelas ini, MT kelas I telah dikarakterisasi dengan beberapa motif C-X-C dalam domain pada N-terminal dan karakteristik ini diwakili oleh MT mamalia (Munger & Lerch 1985; Binz & Kagi 1999).
Berbeda dengan MT kelas I, MT kelas II tidak hanya mempunyai motif Cys-X-Cys tapi juga Cys-Cys dan Cys-X-X-Cys. MT kelas II diwakili oleh protein
EcMT dari gandum dimana residu Cys dikelompokkan kedalam tiga domain yang banyak mengandung Cys dan dipisahkan oleh 10-15 residu selain Cys (Lane et al. 1987; Zhou et al. 2005). MT kelas II merupakan MT pertama pada tanaman yang diisolasi (Kagi 1991). Selain itu, MT kelas II juga telah diidentifikasi pada cyanobacteria, nematoda Caenorhabditis elegans dan kapang (Kagi 1991).
MT kelas III pertama kali diidentifikasi dan karakterisasi dari Schizosaccharomyces pombe dan disebut cadystins (Murasugi et al. 1981; Kondo et al. 1984). Polipeptida yang serupa dan disebut dengan fitokelatin, dipurifikasi dari
kultur sel tanaman (Grill et al. 1985). Cadystin dan fitokelatin disintesis secara enzimatik oleh enzim Phytochelatin synthase dari glutathione dengan struktur umum gamma-glutamyl-cysteinyl-glycine (Cobbett & Goldsbrough 2002).
Tabel 1 Klasifikasi MT kedalam famili dan subfamili (Binz & Kagi 1999)
No Famili Subfamili
1 Vertebrata m1, m2, m3, m4, m, a, a1, a2, b, ba, t
2 Molusca mo1, mo2, mog, mo
3 Crustacean c1, c2, c 4 Echinodermata e1, e2 5 Diptera d1, d2 6 Nematoda n1, n2 7 Ciliata ci 8 Fungi-I f1 9 Fungi-II f2 10 Fungi-III f3 11 Fungi-IV f4 12 Fungi-V f5 13 Fungi-VI f6 14 Prokariot Pr 15 Planta p1, p2, p3, p2v, p21, pec 4
Klasifikasi MT juga dilakukan oleh Cobbet dan Goldsbrough (2002) yang membagi MT menjadi empat macam tipe yang juga berdasarkan pada komposisi urutan
asam amino Cys, yaitu (1) MT tipe 1 yang tersusun atas enam motif Cys-X-Cys (-X- adalah asam amino selain sistein) yang terdistribusi secara seimbang pada dua
terminal, (2) MT tipe 2 memiliki dua ujung N-terminal dan C-terminal yang kaya Cys, dengan komposisi motif Cys-Cys pada asam amino ketiga dan keempat dari sekuen asam aminonya. Selain itu, MT tipe 2 mempunyai motif Cys-Gly-Gly-Cys pada ujung N-terminal dan motif Cys-X-Cys pada ujung C-terminal.(3) MT tipe 3 hanya terdiri dari empat asam amino Cys pada ujung N-terminal. Tiga Cys pertama membentuk motif Cys-Gly-Asn-Cys-Asp-Cys. Sedangkan Cys keempat membentuk motif tersendiri yaitu Gln-Cys-X-Lys- Lys-Gly. (4) MT tipe 4 memiliki tiga wilayah yang masing-masing memiliki 5 sampai 6 Cys yang biasanya membentuk motif Cys-X-Cys sehingga MT tipe 4 ini berbeda dari kelompok MT tanaman lainnya. MT tanaman memiliki daerah
pemisah yang lebih panjang antara N-terminal dengan C-terminal, yaitu sekitar 20-40 asam amino selain Cys (Yu et al. 2000), dibandingkan dengan MT mamalia yang
memiliki kemiripan yang tinggi dengan MT tanaman.
Metallothionein pada Tanaman
MT pada tanaman pertama kali diidentifikasi pada tahun 1987, yaitu EcMT (Early
cysteine MT) pada embrio gandum (Wheat) (Lane et al. 1987). Saat ini, lebih dari 140 sekuens MT telah dicatat dari berbagai spesies tanaman (Guo et al. 2003; Zhou et al. 2005), termasuk dari beberapa tanaman seperti kedelai (Kawashima et al. 1991), buncis (Evans et al. 1990), jagung (de Framond 1991), Arabidopsis (Zhou & Goldsbrough 1995), padi (Zhou et al. 2006), Sambucus nigra (Coupe et al. 1995), kopi (Moisyadi & Stiles 1995), tembakau dan alfalfa (Robinson et al. 1992).
Gen Mt telah diisolasi dari banyak jenis tanaman dan diekspresikan didalam berbagai jaringan maupun organ seperti pada akar, batang, daun, bunga, buah dan biji dari berbagai spesies tanaman yang berbeda. Analisis pola ekspresi dapat membantu untuk mengungkapkan kemungkinan fungsi biologi dari gen Mt. mRNA Mt1 sebagian besar ditemukan di akar (Evan et al. 1990; de Framond 1991), Mt2 pada daun (Zhou & 5
Goldsbrough 1995; Hsieh et al. 1995; Foley & Singh 1994), sementara Mt3/Mt4 kebanyakan dideteksi didalam pemasakan buah (Clendennen et al. 1997). Transkrip Mt pada buncis (PsMt) sebagian besar ditemukan didalam akar dibandingkan dengan yang ada pada daun dan benih (Evans et al. 1990). Gen Mt pada gandum (EcMT) dan padi (OsMt-II-1a) diekspresikan pada tahap perkembangan benih (Lane et al. 1987; Zhou et al. 2005), sedangkan Mt pada kedelai diekspresikan lebih kuat di daun daripada di akar (Kawashima et al. 1991).
Ekspresi gen Mt pada tanaman diregulasi oleh berbagai faktor termasuk ion-ion logam dan infeksi pathogen (Robinsons et al. 1993). Efek dari induksi berbagai faktor tersebut terhadap ekspresi MT tergantung pada spesies tanaman, jaringan dan tipe MT. Pada Mimulus guttatus (de Miranda 1990), kedelai (Kawashima et al. 1991) dan barley (Okumura et al. 1991), tingkat mRNA MT berkurang dengan perlakuan Cu, sedangkan ekspresi MT pada Vicia faba (Foley & Singh 1994), dan Nicotiana glutinosa (Choi et al. 1996) diinduksi akibat pelukaan dan infeksi virus. Pada Arabidopsis (Zhou & Goldsbrough 1995; Murphy & Taiz 1995), gandum (Snowden & Gardner 1993), kacang kapri (Evans et al. 1990), dan padi (Hsieh et al. 1995), transkripsi Mt dapat meningkat oleh induksi dari beberapa jenis logam.
MT pada tanaman yang paling banyak dipelajari adalah pada Arabidopsis karena hanya tanaman ini yang memiliki lebih dari satu famili gen Mt yang telah diidentifikasi (Garcia-Hernandez et al. 1998). Analisis dari genom Arabidopsis yang telah selesai dilakukan, menunjukkan bahwa Arabidopsis mengandung famili gen Mt dengan tujuh gen Mt yang aktif (Guo et al. 2003). Ada tiga famili gen yang telah diisolasi yaitu Mt1, Mt2, dan Mt3, ketiganya homolog dengan gen Mt yang telah diidentifikasi dari spesies lain. Empat gen dari Mt (Mt1a, Mt1c, Mt2a dan Mt2b) ditranskripsikan pada Arabidopsis (Zhou & Goldsbrough 1995). Analisis Southern blot dan isolasi cDNA pada Arabidopsis dan spesies tanaman lainnya telah mengindikasikan bahwa gen Mt selalu ada sebagai famili gen pada tanaman (Giritch et al. 1998; Liu et al. 2002; Guo et al. 2003).
Famili gen Mt juga telah dianalisis pada padi (OsMt). Analisis yang menyeluruh dari sekuen genom padi menunjukkan ada 11 gen yang menyandikan OsMt, ini mengindikasikan bahwa OsMt merupakan famili gen kecil didalam genom padi. 6
Ekspresi dari tiap gen dalam famili gen OsMt memperlihatkan perbedaan, tidak hanya pada sekuennya tetapi juga pada pola ekspresi dari jaringannya (Zhou et al. 2006).
cDNA Mt tipe I dan II telah diisolasi dari beberapa tanaman leguminosa seperti kedelai, kacang merah, green gram, kidney bean, green peas dan broad bean. cDNA Mt tipe I memiliki ukuran sekitar 530-550 pb termasuk 216-240 pb ORF (open reading frame) sedangkan cDNA Mt tipe II berukuran sekitar 540-570 pb dan 231-243 pb ORF. Kedua cDNA Mt tersebut menunjukkan karakteristik yang khas dari MT tipe I dan II yaitu terdapat susunan Cys pada setiap N-terminal dan C-terminal dari sekuen (Sun et al. 2004). Kawashima et al. (1991) berhasil mengisolasi klon cDNA dari pustaka kedelai yang memiliki ORF dengan 79 asam amino yang menyandikan MT. MT kedelai menunjukkan homologi yang signifikan dengan daerah yang terkonservasi pada N-terminal dan C-terminal dari Neurospora crassa dan sebagian besar MT mamalia.
Metallothionein dan Detoksifikasi Logam
Ion logam biasanya terlibat dalam proses biologi yang komplek, termasuk perannya sebagai kofaktor atau sebagai modulator didalam reaksi biokimia oksidasi dan reduksi. Sel perlu menyimpan cadangan logam tetapi tidak berlebihan atau pada konsentrasi toksik. Ion-ion logam tersebut selanjutnya dibebaskan secara perlahan sebagai fungsi keperluan sel (Carpene 1993).
Peningkatan konsentrasi dari logam-logam esensial dan non-esensial didalam tanah, dapat memacu terjadinya gejala keracunan dan terhambatnya pertumbuhan pada sejumlah besar tanaman (Hall 2001). Peranan MT didalam mekanisme detoksifikasi logam berkaitan dengan kemampuan MT dalam mengikat logam-logam yang dapat bersifat toksik seperti logam esensial (Cu+ dan Zn2+) dan logam non-esensial (Cd2+ dan Hg2+) (Kagi & Kojima 1987).
MT juga digunakan sebagai indikator pencemaran karena kepekaan dan keakuratannya. Hal ini didasarkan pada suatu fenomena alam dimana logam-logam dapat tersekap di dalam jaringan tubuh organisme yang dimungkinkan karena adanya protein tersebut. Metallothionein merupakan protein pengikat logam (metal-binding protein) yang berfungsi dan berperan dalam proses pengikatan ataupun penyekapan 7
logam di dalam jaringan setiap mahkluk hidup (Noël-Lambot et al. 1978; Langston & Zhou 1986; Bebianno et al. 1993).
Sebagai konsekuensi dari banyaknya kandungan asam amino Cys maka protein ini mengandung kelompok 'thiol' (sulfhydryl, -SH) dalam jumlah yang besar. Kelompok ini mengikat logam-logam berat dengan sangat kuat dan efisien, termasuk zink, mercury, cupper, dan cadmium. Residu sulfhydryl dari Cys mampu mengikat logam, dimana 1 ion logam (misalnya: Cd, Zn atau Hg) untuk 3 residu -SH, atau 1 ion logam dengan 2 residu -SH (Noël-Lambot & Bouquegneau 1977; Edwards & Hassall 1980; Engel & Brouwer 1989; Bebiano & Langston 1992 a, b; Manahan 1991, 1992). Koordinasi pengikatan dari setiap ion logam melalui sulfur yang ada pada Cys, membentuk struktur tetrahedral tetrathiolate (Schultze et al. 1988; Robbins et al. 1991).
MT mengandung banyak residu Cys yang dibutuhkan untuk mendetoksifikasi
logam-logam berat dengan mengikat kation dari logam transisi (Kagi 1991). MT memiliki dua domain yang mempunyai peranan fungsional yaitu domain β (N-terminal) yang terlibat dalam homeostasis dari ion logam esensial, dan domain α (C-terminal) yang mengikat dengan kuat logam-logam toksik (Hamer 1986; Cherian et al. 1994a). Mekanisme kedua pengikatan ion logam oleh kedua domain tersebut telah diamati oleh Kille et al. (1991) pada asosiasi antara logam dengan PsMTA (Pisum
sativum MTA),yang kemudian di ilustrasikan dalam bentuk model (Gambar 1).
Gambar 1 Model struktur pengikatan logam oleh PsMTA (Kille et al. 1991)
MT mengikat logam dengan sangat kuat namun pertukaran ikatan dengan protein lain juga dapat berlangsung dengan mudah. Kondisi ini disebabkan karena ikatan MT terhadap logam memiliki kestabilan thermodinamik yang tinggi tetapi dengan stabilitas 8
kinetik yang rendah (Zangger et al. 2001). Karena alasan ini, MT mempunyai fungsi biologis sebagai distributor dan mediator intraseluler terhadap logam-logam yang diikatnya (Kagi 1987).
Regulasi ion logam oleh gen Mt dilakukan melalui perantara yaitu suatu motif sekuen spesifik yang disebut MRE (metal responsive element), yang berada di daerah promoter. MRE mengikat faktor transkripsi dan menunjukkan peran esensial dalam respon terhadap logam berat, dan juga terlibat didalam perkembangan jaringan dan reaksi fisiologis. MRE telah dikarakterisasi dari manusia, tikus, Drosophila dan kapang (Palmiter 1998; Coyle et al. 2002; Haq et al. 2003).
Peranan Metallothionein dalam Berbagai Mekanisme Seluler
Sel bereaksi dengan berbagai respon homeostatik yang luas terhadap lingkungan yang mengalami cekaman akibat dari terjadinya perubahan fisiologis. Respon ini termasuk dengan mensintesis protein heat shock, cytokine dan metallothionein (Hamer 1986).
Sejumlah fungsi seluler untuk MT telah diajukan, termasuk meregulasi homeostasis logam esensial, perlindungan terhadap radiasi dan kerusakan oksidatif, kontribusi didalam kontrol seluler dari proliferasi dan apoptosis (Lazo et al. 1998; Klaassen et al. 1999). Simpkins (2000) menyatakan bahwa MT diketahui mengatur tiga proses fundamental: (1) melepaskan gas perantara seperti radikal hidroksil atau oksida nitrik; (2) apoptosis dan (3) pengikatan dan pertukaran dari logam berat seperti Zn, Cd atau Cu.
Akumulasi MT pada tingkat seluler tergantung pada ekspresi gen dan degradasi protein. Kedua mekanisme tersebut sebagian besar tergantung pada kemampuan MT untuk mengikat Zn. Ekpresi MT dihubungkan dengan akumulasi Zn didalam berbagai organ (Davis & Cousins 2000). MT memainkan peran penting dalam homeostasis Zn terutama pada pankreas, dimana MT tidak hanya melindungi terhadap defisiensi Zn tetapi juga mencegah efek racun dari Zn pada pankreas (de Lisle et al. 1996).
Berbagai penelitian tentang peran MT telah menunjukkan bukti bahwa MT dapat berperan dalam sejumlah proses biokimia (Davis & Cousins 2000). MT dapat berperan
dalam pelacakan Zn dan/atau mentransfer Zn ke apoprotein, termasuk karbonik anhidrase (Li et al. 1980), aldolase, alkalin phosphatase, themolisin (Udom & Brady 1980), piridoxal kinase (Churchich et al. 1989; Hao et al. 1993), reseptor estrogen (Cano-Gauci & Sarkar 1996), dan protein zinc finger (jari-jari zinc) yang berperan dalam pensinyalan seluler dan regulasi transkripsi (Davis & Cousins 2000).
Meningkatnya konsentrasi logam berat dapat menstimulasi terbentuknya formasi dari radikal bebas dan spesies oksigen reaktif yang menyebabkan terjadinya kerusakan oksidatif (Diezt et al. 1999). Kerusakan oksidatif tersebut direspon oleh sel dengan mensintesis protein dan antioksidan (Halliwell & Gutteridge 1990). MT adalah protein dari kelompok 'thiol' yang berfungsi sebagai antioksidan dalam sistem pertahanan oksidan secara non-enzimatik didalam mengatasi cekaman oksidatif (Goodyear 2002). Induksi gen Mt yang diakibatkan oleh cekaman oksidatif terjadi pada berbagai tipe sel. Overekspresi dari MT melindungi sel mamalia dan secara dramatis dapat mengurangi
tingkat radikal oksigen dari intraseluler (Schwarz et al. 1994). Secara in vitro, MT merupakan pengambil radikal hidroksil yang efisien (Thornalley et al. 1985), ini diperlihatkan oleh adanya reaksi langsung dengan spesies oksigen reaktif termasuk
radikal hidroksil dan hidrogen peroksida (Kang 1999). Peranan MT didalam mencegah kerusakan oksidatif yang diakibatkan oleh spesies oksigen reaktif, telah dikuatkan dengan penelitian pada embrio somatik (Mir et al. 2004).
MT dapat melindungi sel dari apoptosis yang diinduksi oleh logam dan cekaman oksidatif. MT adalah regulator potensial yang penting dalam proses apoptosis (Shimoda et al. 2003). Secara in vitro, ekspresi MT telah dihubungkan dengan pertahanan terhadap apoptosis yang diinduksi oleh doxorubicin didalam cardiomyocytes (Wang et al. 2001), logam dan cekaman oksidatif pada sel pigmen retinal (Lu et al. 2002), dan cisplatin pada sel embrio tikus (Kondo et al. 1997).
MT disintesis sebagai konsekuensi dari berbagai macam cekaman pada tingkat seluler, dan ditemukan baik pada intraseluler dan extraseluler. Pada tingkat intraseluler, MT dapat bertindak sebagai penyimpan logam-logam berat yang esensial, pengambil (scavenger) spesies oksigen reaktif dan regulator untuk aktifitas faktor transkripsi (Lynes et al. 2006)
Keberadaan MT pada tingkat extraseluler, memberi kontribusi dalam peran yang sangat penting, yaitu sebagai danger signal terhadap kerusakan yang dapat ditimbulkan pada tingkat seluler. MT ditemukan pada hasil sekresi dan ekskresi yang merupakan bagian dari jaringan ekstraseluler. MT ekstraseluler memiliki peran penting sebagai regulator dari berbagai fungsi seluler seperti pada perkembangan fungsi adaptif imunitas (Canpolat & Lynes 2001).
Dalam proses pengendalian terhadap kondisi stres, MT ditemukan didalam darah dengan konsentrasi yang meningkat (Armario et al. 1987). MT yang ditemukan dalam urine (metallothionuria) selalu digunakan sebagai indikator terhadap keracunan Cd (Tohyama et al.1981; Tang et al. 1999). Selain itu, MT juga telah ditemukan didalam susu manusia (Milnerowicz et al. 2005), bronchoalveolar (Hart et al. 1986), cairan prostat (Suzuki et al. 1992), empedu (Bremner et al. 1987), saluran pankreas (de Lisle et al. 1996), liver sinusoid dan renal tubules (Danielson et al. 1982).
Metallothionein pada Organisme Lain
MT pada hewan termasuk juga manusia telah menjadi subjek dari penelitian yang intensif, terutama terhadap peranan MT didalam detoksifikasi logam, homeostasis dan proteksi terhadap kerusakan oksidatif (Sato & Bremner 1993; Cai et al. 1999; Coyle et al. 2002). Gen Mt hewan merespon terhadap faktor-faktor endogen, termasuk berbagai jenis hormon, second messengers, faktor pertumbuhan dan cytokine (Thornalley &Vasak 1985).
Daftar MT hewan yang telah dikarakterisasi meliputi cakupan spesies yang luas termasuk vertebrata, mollusca, crustacea, echinoderma dan nematoda. Seluruh MT dari spesies-spesies tersebut memiliki struktur dan fungsi yang hampir serupa, namun menunjukkan perbedaan yang signifikan pada pola Cys dalam sekuen nukleotida dan asam amino (Davis & Cousins 2000).
MT yang telah diidentifikasi pada hewan terdiri dari sekitar 60 asam amino dan mengandung 20 Cys yang mengikat ion-ion logam kedalam dua domain (Kagi 1991). Posisi residu Cys antar sekuen MT mamalia tidaklah berbeda, dan protein dari berbagai 11
jenis filum (seperti pada Neurospora crassa dan Agaricus bisporus) memiliki similiritas pada struktur utamanya dan digolongkan kedalam MT kelas I (Munger & Lerch 1985).
MT hewan diketahui memiliki empat isoform yaitu MT-1, MT-2, MT-3 dan MT-4. Isoform MT-1 dan MT-2 terdistribusi pada berbagai jaringan terutama pada hati, pankreas, intestin dan ginjal. Sedangkan MT-3 dan MT-4 ditemukan terutama pada otak dan kulit(Klaassen 1998; Vasak et al. 2000).
Sebagian besar MT invertebrata, seperti Drosophila, memiliki satu domain protein yang mengandung beberapa residu Cys. Ada dua gen Mt yang telah diketahui pada
Drosophila melanogaster, yaitu Mtn (Lastowski-Perry et al.1985) dan Mto (Mokdad et al. 1987). Protein Mtn terdiri dari 40 asam amino dan Mto terdiri dari 43 asam amino,
dan kedua protein tersebut hanya memiliki 30 % asam amino yang identik .
BAHAN DAN METODE Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan September 2007 sampai dengan bulan April 2008. Penelitian dilakukan di Laboratorium Biologi Molekuler Seluler Tanaman, dan Laboratorium BIORIN (Biotechnology Research Indonesian-The Netherlands), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB.
Bahan Penelitian
Bahan yang digunakan dalam penelitian adalah kedelai kultivar Slamet yang
toleran terhadap cekaman Al sebagai bahan tanaman yang diambil ujung akarnya. Kit TRIzol (Invitrogen) digunakan untuk isolasi RNA. Untuk mengetahui keberhasilan
terbentuknya cDNA dan kemurnian cDNA dari kontaminasi DNA genom, digunakan
primer spesifik gen aktin yang didesain dari Glycine max (telah didepositkan di GenBank dengan nomor akses V00450). Primer ActF (ATGGCAGATGCCGAGGATAT) dan ActR (CAGTTGTGCGACCACTTGCA) akan mengamplifikasi cDNA ekson1-ekson2 dari β aktin. Primer spesifik MF (TCGAGAAAAATGTCTTGCTGTG) dan M7R
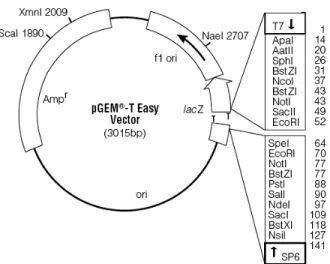
(CCTTGCACCTGCAAGTGAAG) yang didesain berdasarkan cDNA dari Arabidopsis thaliana, yaitu AtMt2 (nomor akses EM_PL: AY037263) digunakan untuk mengisolasi fragmen penyandi MT2 dari kedelai (GmMt2). Plasmid pGEM®–T Easy (Promega) digunakan sebagai vektor pengklonan (Gambar 2). Escherichia coli galur DH5α
digunakan sebagai sel inang dari plasmid rekombinan.
Metode Penelitian
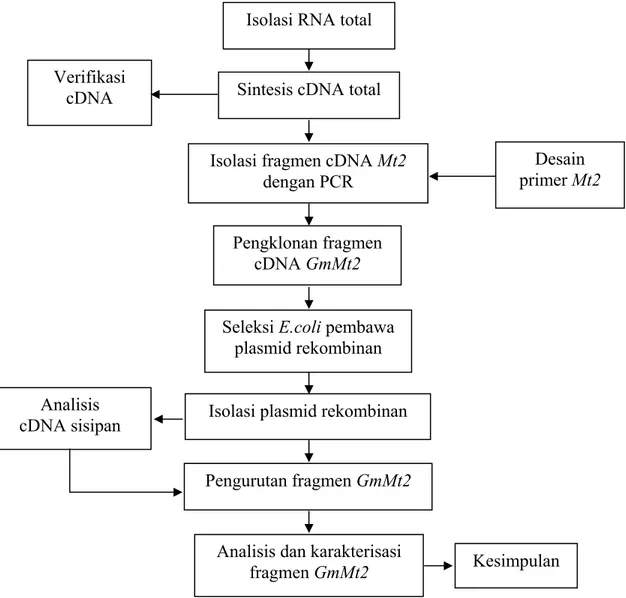
Penelitian ini dilakukan dalam beberapa tahapan, yaitu isolasi RNA total, sintesis cDNA total melalui transkripsi balik (RT = reverse transcription), isolasi fragmen cDNA Mt2, pengklonan fragmen cDNA dari gen Mt2 yang telah diisolasi dengan PCR menggunakan primer spesifik MF dan M7R ke dalam plasmid pGEM®–T Easy dan introduksi pGEM®–T Easy rekombinan ke dalam E. coli DH5α, seleksi E. coli pembawa plasmid rekombinan, analisis sisipan, pengurutan nukleotida, dan analisis dan karakterisasi fragmen cDNA GmMt2. Tahapan penelitian dilakukan seperti yang disajikan pada Gambar 3.
Gambar 3 Tahapan isolasi, pengklonan dan karakterisasi fragmen GmMt2 dari kedelai kultivar Slamet
Isolasi fragmen cDNA Mt2 dengan PCR
Verifikasi cDNA
Desain primer Mt2
Seleksi E.coli pembawa plasmid rekombinan
Analisis
cDNA sisipan Isolasi plasmid rekombinan Pengklonan fragmen
cDNA GmMt2
Pengurutan fragmen GmMt2
Analisis dan karakterisasi fragmen GmMt2 Isolasi RNA total
Sintesis cDNA total
Kesimpulan
Isolasi RNA Total
Ujung akar kedelai sebanyak 1 g digerus sampai halus dengan menambahkan nitrogen cair ke dalam mortar. Bubuk dicampur dengan 800 μl TRIzol (Invitrogen) untuk membentuk suspensi sel, kemudian dipindahkan ke dalam tabung ependorf, dan diinkubasikan pada suhu ruang selama kurang lebih 5 menit. Ke dalam ependorf tersebut ditambahkan lagi 200 μl kloroform kemudian divortex sampai tercampur rata. Campuran diinkubasikan pada suhu ruang selama 3 menit. Selanjutnya ependorf tersebut disentrifugasi (Jouan BR4i) dengan kecepatan 9000 rpm (38000xg) pada suhu 6˚C selama 15 menit. Fase cairan bagian atas (supernatan) diambil minimal sebanyak 60% dari volume TRIzol. Supernatan kemudian dipindahkan ke dalam ependorf baru, dan ditambah dengan 500 μl isopropyl alkohol lalu diinkubasikan pada suhu ruang selama 10 menit. Setelah disentrifugasi pada kecepatan 9000 rpm 6˚C selama 10 menit, cairan dibuang, dan endapannya ditambah 500 μl ethanol 75%. Ependorf kembali disentrifugasi dengan kecepatan 5700 rpm (22000xg) pada suhu 6˚C selama 5 menit. Cairan dibuang, endapan dikeringkan dengan menggunakan vakum. Setelah kering, endapan RNA total disuspensikan dalam 30 μl H2O-DEPC.
Kuantitas dan kualitas RNA total ditentukan dengan spektrofotometer UV-VIS (Cecil CE 2020) pada panjang gelombang 260 (λ260) dan 280 (λ280). Konsentrasi RNA
ditentukan dengan asumsi satu satuan absorban pada panjang gelombang 260 nm setara dengan 40 μg/ml RNA. Kemurnian RNA total dari kontaminan protein ditentukan melalui nilai perbandingan absorban pada panjang gelombang 260nm dan 280nm. Jika nilai λ260/ λ280 ≥ 1.80 maka RNA mempunyai kemurnian yang tinggi (Saunders &
Parker 1999). Kuantitas (konsentrasi) RNA dapat diduga dengan rumus berikut:
[RNA] = OD 260nm x fp x 40 µg/ml dimana;
fp = faktor pengenceran
40 = nilai satu satuan absorban pada panjang gelombang 260 nm (40μg/ml)
Keutuhan RNA total ditentukan dengan elektroforesis pada gel agarosa 1% (b/v) (FMC, USA) dengan larutan penyangga MOPS (4.2 g/l MOPS, 0.41 g/l Na-asetat, 0.37 g/l Na2-EDTA). Sebanyak 1 μl RNA total dicampur dengan 12 μl larutan premiks
[MOPS, 50% (v/v) formamida, 17.5% (v/v) formaldehid dan 27.5% (v/v) air DEPC] dipanaskan pada suhu 65°C 10 menit, didinginkan di es selama 5 menit dan diberi 1/6 volume loading dye (0.25% bromophenol blue, 0.25% xylene cyanol FF, 30% gliserol) dan dielektroforesis pada 100 volt 30 menit. Setelah diwarnai dengan EtBr (0.5 μg/ml) selama 30 menit, dan dibilas dengan H2O, visualisasi RNA di dalam gel dilakukan di
atas transiluminator GelDoc (Labquip) dan difoto dengan kamera digital.
Sintesis cDNA total
cDNA total disintesis dari RNA total dengan menggunakan enzim Superscript III Reverse Transcriptase (Invitrogen). Komposisi sintesis cDNA total adalah 5 μg RNA total, 4 μl (1x) RT buffer, 1 μl (20 pmol) oligo(dT), 2 μl (2 mM) dNTP mix, 2 μl (10 mM) DTT, 0.2 μl (2 U) enzim SuperScript TMIII RTase dan air DEPC dengan volume akhir reaksi 20 μl. Sintesis cDNA dilakukan pada suhu 45°C 50 menit. Keberhasilan terbentuknya cDNA dan kemurnian cDNA diverifikasi menggunakan PCR dengan primer spesifik aktin. Komposisi PCR adalah 1 μl (10 ng) cDNA total, 1 μl Buffer Taq (10x), 1 μl (2 mM) dNTP mix, 0.5 μl (10 pmol) primer ActF, 0.5 μl (10 pmol) primer ActR, 0.4 μl (4%) DMSO, 0.1 μl (5 U) enzim Taq DNA polymerase (Fermentas) dan ddH2O dengan volume akhir reaksi 10 μl. PCR dilakukan dengan
kondisi praPCR pada 95°C 5 menit, denaturasi pada 94°C 30 detik, penempelan primer pada 55°C 30 detik, dan pemanjangan pada 72°C 1.5 menit, dengan 37 siklus, dan pasca PCR pada 72°C 5 menit, diikuti dengan 15°C 5 menit.
Isolasi putatif fragmen Mt2
Fragmen cDNA Mt2 diisolasi dari cDNA total dengan PCR menggunakan primer spesifik Mt2. Komposisi PCR adalah 2 μl cDNA total, 2 μl Buffer Taq (10x), 2 μl (2 mM) dNTP mix, 1 μl (20 pmol) primer MF, 1 μl (20 pmol) primer M7R, 0.8 μl (4%) DMSO, 0.2 μl (5 U) enzim Taq DNA polymerase (RBC) dan ddH2O dengan volume
reaksi 20 μl. Kondisi PCR adalah praPCR pada 95°C 5 menit, denaturasi pada 94°C 16
30 detik, penempelan primer pada 58°C 30 detik dan pemanjangan pada 72°C 1.5 menit, 37 kali siklus, pasca PCR pada 72°C 5 menit diikuti 15°C 5 menit.
Pengklonan fragmen putatif Mt2
Fragmen Mt2 hasil PCR diligasikan dengan pGEM®–T Easy (Promega) mengikuti prosedur Promega Inc. yaitu dengan mencampurkan 3 μl (5 ng) hasil PCR, 1 μl (10 ng) pGEM®–T Easy, 0.5 μl (1U) T4 DNA ligase (Promega), 1 μl 10x rapid buffer ligasi dan ddH2O sampai volume akhir 10 μl. Campuran diinkubasi pada 4°C selama semalam.
Hasil ligasi diintroduksikan ke dalam E. coli galur DH5α mengikuti metode yang dipublikasikan Suharsono (2002).
Seleksi E. coli yang mengandung vektor rekombinan
E. coli galur DH5α yang mengandung vektor rekombinan diseleksi menggunakan seleksi resistensi terhadap ampisilin dan seleksi biru-putih. Koloni putih yang tumbuh di media yang mengandung ampisilin digunakan sebagai bahan cetakan untuk PCR untuk mendeteksi keberadaan Mt2. Untuk itu koloni putih diambil dengan tusuk gigi kemudian
disuspensikan ke dalam 6.5 μl ddH2O dan dipanaskan di dalam waterbath 95°C
10 menit dan didinginkan di dalam es 5 menit. Suspensi ini dicampur dengan 1 μl Buffer Taq (10x), 1 μl (2 mM) dNTP mix, 0.5 μl (20 pmol) primer MF, 0.5 μl (20 pmol) primer M7R, 0.4 μl (4%) DMSO, 0.1 μl (5 U) enzim Taq DNA polymerase (Fermentas) dengan volume akhir 10 μl. PCR dilakukan dengan kondisi yang sama dengan isolasi fragmen Mt2.
Isolasi plasmid E. coli DH5α transforman rekombinan
Isolasi DNA plasmid pGEM®–T Easy rekombinan yang terdapat di dalam E. coli DH5α dilakukan dengan menggunakan prosedur Suharsono (2002). Satu koloni E. coli DH5α rekombinan dikulturkan di dalam 2 ml media LB yang mengandung 100 mg/l ampisilin dan diinkubasi pada suhu 37oC didalam inkubator bergoyang (250 rpm) selama semalam. Kultur bakteri disentrifugasi dengan kecepatan 12000 rpm pada suhu 4oC selama 10 menit. Endapan bakteri kemudian disuspensikan dalam 300 μl larutan resuspensi sel [50 mM tris-HCl, pH 7.5 dan 10 mM EDTA] di homogenisasi dengan 17
divorteks, tambahkan 300 μl larutan lisis sel [0.2 M NaOH, dan 1% SDS] dan dibolak-balik beberapa kali sampai menghasilkan lendir, yang berarti dinding sel telah pecah. Setelah lisis, tambahkan 300 μl larutan netralisasi sel [5 M Na-Asetat, asam asetat glasial dan H2O dengan perbandingan 60 : 11.5 : 28.5, pH 4.8] dan divorteks kembali
sampai terhomogenisasi dengan baik. Campuran ini disentrifugasi pada kecepatan 12000 rpm pada suhu 4oC selama 20 menit. Supernatan yang mengandung DNA plasmid diambil dan kemudian diekstraksi dengan 1 x volume fenol-kloroform-isoamil alkohol (PCI) (25:24:1), divorteks dan disentrifugasi dengan kecepatan 12000 rpm pada suhu 20oC selama 20 menit. Supernatan kemudian diambil dengan hati-hati dan dipresipitasi
dengan menambahkan 0.1 x volume 2M sodium asetat (NaOAc) pH 5.2 dan 2 x volume etanol absolut. Selanjutnya larutan diinkubasi pada suhu -35oC selama 2 jam dan disentrifugasi dengan kecepatan 12000 rpm pada suhu 4oC selama 20 menit. Endapan (DNA plasmid) dibilas dengan 1 x volume etanol 70% dan dikeringkan dengan vakum selama 10 menit. DNA plasmid yang sudah kering dilarutkan di dalam 10-20 μl ddH2O.
RNA didegradasi dengan menambahkan 0.2 x volume RNAse dan diinkubasi pada suhu 37oC selama semalam. Plasmid dielektroforesis di agarosa 1% (b/v) pada tegangan 100 volt selama 30 menit.
Analisis cDNA sisipan
Untuk mengeluarkan cDNA sisipan, DNA plasmid rekombinan hasil isolasi plasmid dipotong dengan enzim EcoR1 (Fermentas) yaitu dengan mencampur 200 ng DNA plasmid, 10 U enzim restriksi EcoR1, 1x Buffer restriksi dan ddH2O sampai
volumenya 20 μl. Pemotongan dilakukan pada suhu 37°C selama 2 jam.
Pengurutan dan analisis sekuen fragmen GmMt2
Pengurutan fragmen GmMt2 dilakukan di BPPT (Balai Penelitian dan Pengembangan Teknologi) dengan menggunakan DNA sequencer ABI Model 3100/3130 MERCIAN. Identifikasi urutan basa nukleotida dan deduksi asam amino hasil pengurutan fragmen cDNA GmMt2 dilakukan dengan beberapa analisis. Analisis kesejajaran lokal (local alignment) GmMt2 berdasarkan urutan nukleotida dan asam amino dengan data yang ada di GenBank, dilakukan dengan program BLAST
(Basic Local Alignment Search Tools) yang diakses dari NCBI (National Center for Biotechnology Information) (http://www.ncbi.nlm.nih.gov/BLAST/). Deduksi asam amino fragmen GmMT2 menggunakan program translation dari EXPASY (http://www.expasy.ch/tools/dna.htm). Analisis urutan nukleotida untuk mencari open reading frame (ORF) digunakan program BESTORF
(http://www.softberry/bestorf/htm). Analisis situs restriksi (restriction site) fragmen
cDNA GmMt2 dilakukan dengan menggunakan program NEBCutter
(http://www.firstmarket.com/cutter/cut2.html). Analisis similaritas dan filogenetik dari urutan nukleotida dan deduksi asam amino GmMT2 dengan MT2 dari berbagai spesies juga dilakukan dengan menggunakan program BLAST (http://www.ncbi.nlm.nih.gov/BLAST/TreeView/htm). Daerah ekson dan intron dianalisis dengan program Genewise (http://www.ebi.ac.uk/tools/htm). Domain fragmen GmMt2 ditentukan dengan program InterProScan (http://www.ebi.ac.uk/tools/htm) dan program motif scan (http://www.myhits/motifscan/htm).
HASIL DAN PEMBAHASAN
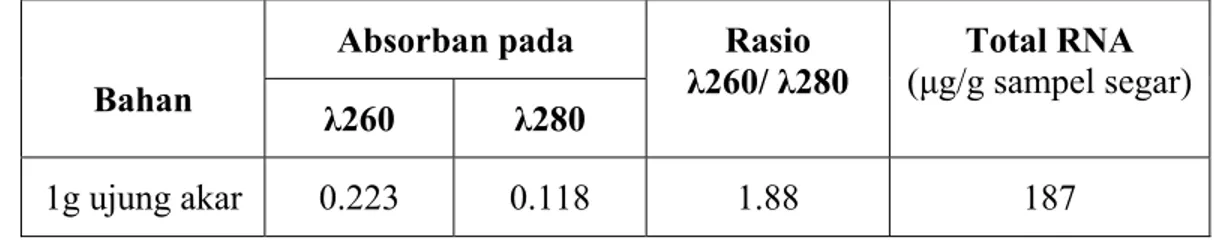
Isolasi RNA totalRNA total dari ujung akar G. max kultivar Slamet telah berhasil diisolasi. Kuantifikasi RNA total dengan spektrofotometer menunjukkan bahwa rendemen isolasi RNA total adalah 187 μg tiap g bahan tanaman. Jumlah ini menunjukkan rendemen isolasi RNA yang cukup tinggi dan optimal. Pengujian kemurnian RNA total dilakukan dengan membandingkan nilai OD260 dan OD280. Rasio OD260/OD280 dari RNA total pada
penelitian ini adalah 1.88 (Tabel 2) yang menunjukkan bahwa RNA total yang diisolasi mempunyai kemurnian yang tinggi yang tidak terkontaminasi oleh protein (Farrel 1993).
Tabel 2. Hasil isolasi RNA total
Bahan
Absorban pada Rasio
λ260/ λ280 (μg/g sampel segar)Total RNA
λ260 λ280
1g ujung akar 0.223 0.118 1.88 187
Analisis keutuhan RNA total dilakukan dengan elektroforesis di gel agarosa yang terdenaturasi yang mengandung formaldehid. Hasil elektroforesis RNA total menunjukkan adanya dua pita RNA yang dominan yaitu RNA ribosomal (rRNA) 28S dan 18S (Gambar 4). Hal ini mengindikasikan bahwa RNA total yang telah diisolasi adalah utuh, sehingga mRNA yang terdapat di dalam RNA total juga utuh. Keutuhan mRNA sangat penting dalam sintesis cDNA.
Gambar 4 RNA total dari ujung akar. 28S
Sintesis cDNA total.
Proses transkripsi balik (reverse transcription) dilakukan untuk mensintesis cDNA dengan menggunakan RNA total yang telah diisolasi sebagai cetakan (template). Primer oligo(dT) digunakan untuk sintesis cDNA, sehingga hanya mRNA yang dapat disintesis menjadi cDNA melalui transkripsi balik karena memiliki ekor poly A. Keberhasilan sintesis cDNA total dan kemurniannya, dan kemurnian RNA total dari kontaminan DNA diuji dengan PCR menggunakan primer spesifik untuk cDNA ekson1-ekson2 dari aktin.
PCR dengan menggunakan cDNA total sebagai cetakan dan cDNA ekson1-ekson2 dari gen aktin (ActF dan ActR) sebagai primer, menghasilkan pita DNA yang berukuran sekitar 450 pb (Gambar 5). Hasil ini menunjukkan bahwa daerah yang diamplifikasi adalah cDNA ekson2 bukan DNA ekson2 dari gen aktin. DNA ekson1-ekson2 akan berukuran lebih besar daripada 450 pb karena terdapat intron yang dibuang pada saat pembentukan mRNA. Keberadaan intron ditengah ekson1-ekson2 akan menghasilkan ukuran DNA sekitar 600 pb.
Gambar 5 cDNA aktin hasil PCR menggunakan cDNA total dari ujung akar sebagai cetakan; M: marker 1 kb, Act: aktin.
Proses transkripsi balik untuk mensintesis cDNA total dengan menggunakan primer ActF dan ActR telah berlangsung dengan baik dan bebas dari kontaminan yang diperlihatkan dengan diperolehnya pita dengan ukuran 450 pb. Selain itu, hal ini juga membuktikan bahwa RNA total yang telah diisolasi mempunyai kualitas yang sangat bagus, karena selain dapat digunakan untuk mensintesis cDNA juga terbebas dari DNA.
M Act
1000 pb 500 pb
Isolasi cDNA Mt2 melalui PCR
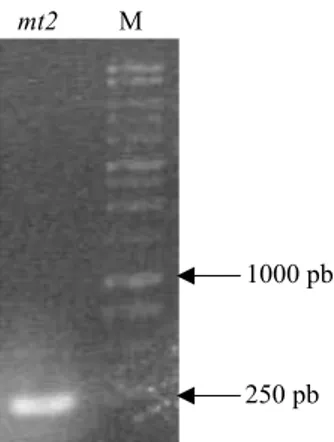
Isolasi fragmen cDNA Mt2 melalui PCR dengan cDNA total sebagai cetakan dan primer spesifik fragmen Mt2, menghasilkan fragmen cDNA berukuran sekitar 250 pb (Gambar 6) yang kemudian disebut dengan fragmen GmMt2 (Glycine maxMt2) yang merupakan fragmen cDNA kandidat gen penyandi MT2 dari G. max. Ukuran fragmen ini juga sama dengan ukuran gen Mt2 dari A. thaliana (AtMt2A).
Gambar 6 Fragmen GmMt2 hasil PCR menggunakan cDNA total dari ujung akar sebagai cetakan; M: marker 1 kb, mt2: fragmen mt2.
Pengklonan fragmen GmMt2 ke dalam plasmid pGEM®–T Easy
Fragmen GmMt2 telah diligasikan dengan plasmid pGEM®–T Easy di tengah gen lacZ dan hasil ligasi kemudian telah berhasil diintroduksikan ke dalam E. coli galur DH5α. Keberhasilan penyisipan GmMt2 ke dalam pGEM®–T Easy dan introduksi pGEM®–T Easy rekombinan ke E. coli ditunjukkan oleh adanya koloni putih yang dapat tumbuh pada media seleksi yang mengandung antibiotik ampisilin, IPTG dan X-gal. E. coli yang dapat bertahan hidup di media seleksi berarti mengandung plasmid, dan koloni yang berwarna putih di media seleksi adalah koloni E. coli yang mengandung plasmid rekombinan, sedangkan yang berwarna biru adalah E. coli yang mengandung plasmid non-rekombinan (Gambar 7). Gen lacZ menyandi β-galactosidase (β-gal) yang mengubah substrat X-gal yang tidak berwarna menjadi berwarna biru bila ada IPTG yang berfungsi menginduksi promoter lacZ. Bila fragmen GmMt2 menyisip pada gen lacZ, maka gen lacZ tidak dapat diekspresikan sehingga koloni E. coli berwarna putih. Bila tidak ada penyisipan pada lacZ, maka koloni yang terbentuk akan berwarna biru.
1000 pb
250 pb mt2 M
Gambar 7 Seleksi biru putih koloni E. coli DH5α yang ditransformasi dengan hasil ligasi antara DNA plasmid pGEM®–T Easy dan GmMt2 pada media seleksi yang mengandung ampisilin, IPTG dan X-gal.
Adanya sisipan fragmen GmMt2 di dalam koloni E. coli putih dikonfirmasi dengan PCR-koloni. PCR-koloni terhadap koloni putih menghasilkan DNA yang berukuran sekitar 250 pb yang menunjukkan bahwa koloni putih mengandung fragmen GmMt2 (Gambar 8).
Gambar 8 Hasil PCR terhadap koloni putih sebagai cetakan; M: marker 1 kb, mt2: fragmen mt2.
Untuk memastikan fragmen GmMt2 tersisip di dalam pGEM®–T Easy, DNA plasmid rekombinan yang telah diisolasi dari koloni putih, dipotong dengan enzim restriksi EcoR1 untuk mengeluarkan sisipan GmMt2. Pemotongan dengan enzim restriksi bertujuan untuk memutus DNA pada situs pemotongannya, sehingga DNA plasmid yang berbentuk sirkuler terputus dan terbagi menjadi vektor dan sisipan. Ukuran
M mt2 1000 pb 250 pb Koloni biru Koloni putih 23
molekul vektor biasanya lebih besar dibandingkan dengan sisipan yang berukuran lebih kecil (Old & Primrose 2003) .
Pemotongan terhadap DNA plasmid rekombinan dengan EcoR1 yang situs pemotongannya mengapit daerah penyisipan, menghasilkan dua fragmen yaitu fragmen sekitar 3000 pb yang merupakan vektor pGEM-T Easy dan fragmen yang berukuran sama dengan fragmen GmMt2 yaitu sekitar 250 pb (Gambar 9), sehingga dapat dipastikan bahwa fragmen GmMt2 tersisip di dalam plasmid pGEM-T Easy.
Gambar 9 Hasil pemotongan plasmid dengan enzim restriksi EcoR1; M: marker 1 kb, p: pGEM®–T Easy + GmMt2.
Analisis fragmen GmMt2
Pengurutan DNA terhadap fragmen GmMt2 yang diperoleh dengan PCR menggunakan primer MF dan M7R menghasilkan 257 nukleotida yang mengandung 246 pb ORF (open reading frame) yang menyandi 81 asam amino dengan 14 Cys. GmMT2 memiliki berat molekul 8.2 kDa. Secara umum, MT tipe 2 pada tanaman tersusun dari 45-84 asam amino yang mengandung 12-17 Cys yang terkonservasi (Kojima 1991), dan dengan berat molekul yang rendah berkisar 4-8 kDa (Valle 1991).
GmMt2 yang memiliki ukuran 246 pb merupakan daerah ekson, yang sama dengan ekson yang ada pada AtMt2A. Gen AtMt2A dengan ukuran 538 pb (nomor akses NM_111773), memiliki satu ekson dan dua intron. Program Genewise dari EBI (European Bioinformatics Institute) digunakan untuk menganalisis daerah ekson dan intron dari urutan nukleotida GmMt2 dan AtMt2A.
Analisis terhadap cDNA juga menunjukkan bahwa fragmen GmMt2 mengandung cDNA lengkap yang mengandung kodon awal dan kodon akhir dari Mt2 (Gambar 10). Dengan demikian cDNA penyandi MT2 dari kedelai telah berhasil diisolasi. Hasil
vektor pGEM®-T Sisipan 3000 pb 1000 pb 250 p M 24
selengkapnya dari pengurutan fragmen GmMt2 menggunakan primer T7, disajikan pada lampiran 1.
Gambar 10 Urutan basa fragmen GmMt2 dan deduksi asam aminonya.
Hasil analisis urutan nukleotida menunjukkan bahwa promoter T7 terletak di hulu dari GmMt2 yang tersisip di gen lacZ. GmMt2 mempunyai arah yang berlawanan dengan lacZ (Gambar 11).
Gambar 11 Posisi GmMt2 di dalam MCS dari pGEM®–T Easy.
Sequence ID: GmMT2 Nuk AA
atg tct tgc tgt gga gga aac tgc gga tgt gga tct ggc tgc aag tgc ggc aac ggt 57
M S C C G G N C G C G S G C K C G N G 19
tgt gga ggt tgc aaa atg tac cct gac ttg gga ttc tcc ggc gag aca acc aca act 114
C G G C K M Y P D L G F S G E T T T T 38
gag act ttt gtc ttg ggc gtt gca ccg gcg atg aag aat cag tac gag gct tca ggg 171
E T F V L G V A P A M K N Q Y E A S G 57
gag agt aac aac gct gag aac gat gct tgc aag tgt gga tct gac tgc aag tgt gat 228
E S N N A E N D A C K C G S D C K C D 76
cct tgc acc tgc aag tga 246
P C T C K - 81 Sisipan Δ lac Z Δ 25
Analisis kesejajaran lokal berdasarkan urutan nukleotida dan asam amino dengan bank data di GenBank dilakukan dengan program BLAST (Basic Local Alignment Search Tool). BLAST adalah program berbasis bioinformatik dengan tujuan untuk mencari kesejajaran dari bagian urutan basa nukleotida atau asam amino (local alignment) yang memiliki nilai yang paling tinggi. BLAST dapat digunakan sebagai alat untuk menentukan identitas suatu fragmen DNA yang belum diketahui berdasarkan tingkat homologi dengan gen atau fragmen DNA yang telah diketahui di GenBank (Mount 2001).
Hasil penyejajaran nukleotida fragmen GmMt2 dengan program BLAST menunjukkan bahwa GmMt2 sama dengan AtMt2A dari A. thaliana. Karena nukleotidanya sama maka urutan asam amino antara GmMT2 dengan AtMT2A juga sama. Hasil penyejajaran selengkapnya disajikan pada lampiran 2 dan lampiran 3. Oleh karena itu, GmMT2mempunyai fungsi yang sama dengan AtMT2A yaitu berperan dalam pengikatan dan detoksifikasi logam dan membatasi kerusakan oksidatif (Zhou et al. 1995).
Hasil deduksi asam amino dari fragmen GmMt2 memperlihatkan bahwa motif urutan asam amino Cys dari GmMT2 terdiri dari Cys-Cys (residu 3-4), Cys-X-Cys (8-10, 14-16, 67-69, 73-75, 78-80) dan Cys-X-X-Cys (20-23) (Gambar 12). Karakteristik yang khas dari distribusi asam amino Cys dari GmMT2, memiliki kesamaan dengan protein MT tipe 2 dari tanaman yang telah dilaporkan dari berbagai penelitian (Robinson et al. 1993; Cobbett & Goldsbrough 2002). Tipikal komposisi Cys dari protein MT tipe 2 dari tanaman adalah motif Cys-Cys, Cys-X-Cys, dan Cys-X-X-Cys ( -X- adalah asam amino lain selain Cys) yang terdapat pada ujung amino
dan ujung karboksil.
Gambar 12 Urutan ORF dan motif asam amino Cys. ORF 1 1 fragment (s) 1 - 246 81 aa MSCCGGNCGCGSGCKCGNGCGGCKMYPDLGFSGETTTTETF ** *x* *x* *xx* VLGVAPAMKNQYEASGESNNAENDACKCGSDCKCDPCTCK- *x* *x* *x* 26
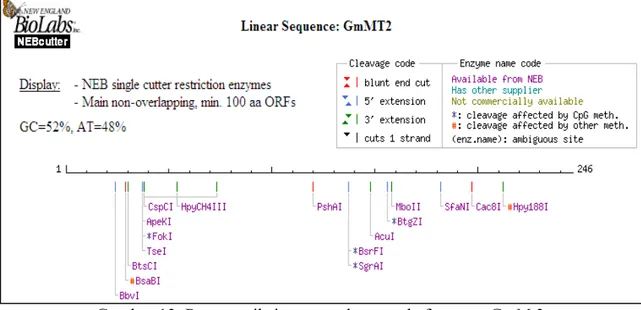
Analisis situs restriksi pada fragmen GmMt2 menunjukkan bahwa fragmen tersebut tidak mengandung situs pemotongan enzim restriksi endonuklease yang terdapat pada situs pengklonan (MCS = multi cloning sites) dari pGEM®–T Easy (Gambar 13) sehingga semua situs restriksi yang terdapat pada MCS tersebut dapat digunakan untuk mengisolasi sisipan GmMt2.
Situs restriksi yang terdapat pada fragmen GmMt2 adalah BbvI, BsaBI, BtsCI, TseI, FokI, ApeKI, CspCI, HpyCH4III, PshAI, BsrFI, SgrAI, AcuI, BtgZI, MboII, SfaNI, Cac8I dan Hpy188I. Situs-situs ini tidak dapat digunakan untuk pengklonan karena akan memotong cDNA utuh menjadi dua bagian atau lebih.
Gambar 13 Peta restriksi yang terdapat pada fragmen GmMt2.
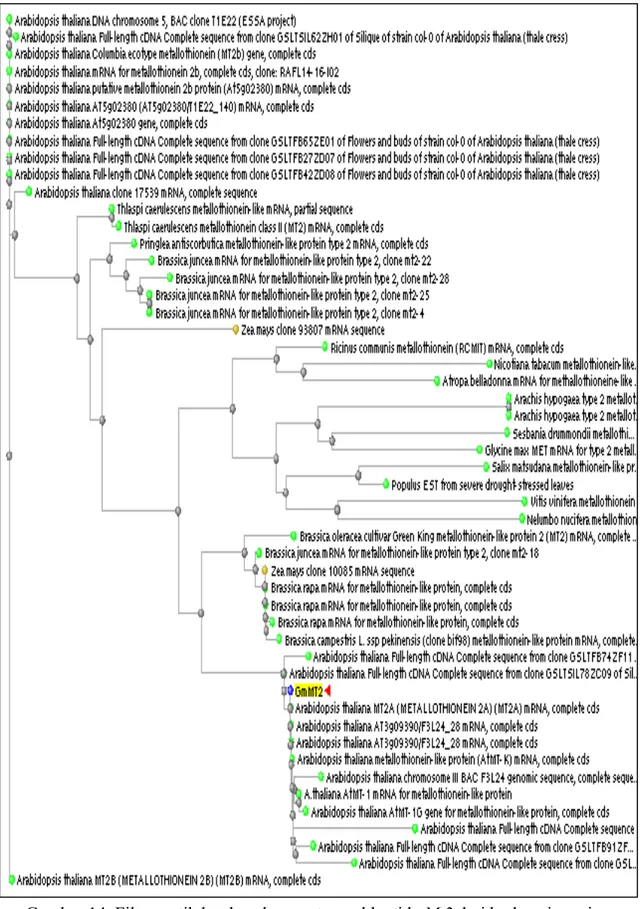
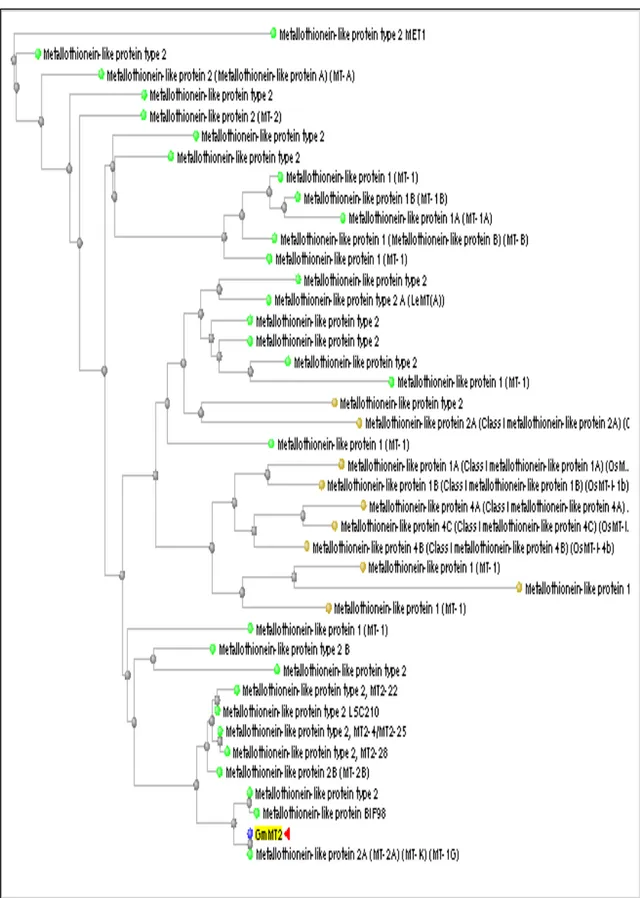
Tingkat kekerabatan antar individu dapat dilihat dari pohon filogenetik. Kekerabatan dalam filogenetik dapat menggambarkan kedekatan antara individu dalam taksonomi, selain itu juga dapat menunjukkan kesamaan peran dan spesifitas gen atau urutan nukleotida. Berdasarkan kesamaan urutan nukleotida Mt2, GmMt2 sama dengan AtMt2A dari Arabidopsis thaliana. Kesamaan antara GmMt2 dengan AtMt2A dapat mengindikasikan kesamaan peran. Gambaran filogenetik berdasarkan pada urutan nukleotida Mt2 dan urutan asam aminonya dari berbagai spesies ditunjukkan pada Gambar 14 dan Gambar 15.
Gambar 14 Filogenetik berdasarkan urutan nukleotida Mt2 dari berbagai spesies. 28
Gambar 15 Filogenetik berdasarkan urutan asam amino MT2 dari berbagai spesies. 29
Berdasarkan urutan nukleotida Mt2, GmMt2 yang diisolasi dari kedelai varietas Slamet tidak berada dalam satu kelompok dengan G. max MET2 (nomor akses AB176559.1) (Gambar 14). G. max MET2 memiliki ukuran 564 nukleotida yang mengandung 240 pb ORF dan menyandi 79 asam amino dengan 13 Cys. G.max MET2 memiliki berat molekul 7.9 kDa. Dengan demikian, GmMt2 memiliki perbedaan dengan G. max MET2 pada urutan nukleotida, asam amino dan berat molekulnya. Perbedaan ini dapat disebabkan oleh perbedaan varietas yang dianalisis.
Analisis Domain Fragmen GmMt2
Analisis domain asam amino GmMT2 dilakukan dengan menggunakan program interproscan dari EBI. GmMT2 memiliki 33 residu (asam amino ke 25 sampai 58) yang secara umum sejajar dengan domain MT tanaman, famili MT kelompok ke-15 (MT2_15p). GmMT2 memiliki 81 residu (asam amino ke 1 sampai 81) yang sama dengan domain dari subfamili MT kelompok tanaman yaitu MT tipe 2 (Gambar 16).
Gambar 16 Posisi fragmen GmMT2 pada MT tanaman famili ke-15 berdasarkan urutan asam amino; MT2_15p: domain MT tipe 2 dari famili ke-15 MT tanaman, GmMT2: domain GmMT2.
Fragmen GmMT2, mengandung satu domain tempat fosforilasi kasein kinase II yang terletak pada asam amino ke-35 sampai dengan 40; empat domain tempat miristoilasi yang terletak pada asam amino ke-9 sampai dengan 14, asam amino ke-17 sampai dengan 22, asam amino ke-23 sampai dengan 28 dan asam amino ke-48 sampai dengan 53; dan domain yang banyak mengandung asam amino Cys yang terletak pada asam amino ke-3 sampai dengan 23 dan asam amino ke-69 sampai dengan 80 ( Gambar 17).
Gambar 17 Profil domain yang terdapat pada GmMT2. (1) Domain fosforilasi kasein kinase II, (2) Domain miristoilasi, dan (3) Domain yang banyak mengandung Cys.
Fosforilasi kasein kinase II (CK-2) adalah domain yang memiliki asam amino serine (Ser) atau threonine (Thr) yang merupakan asam amino yang menjadi tempat fosforilasi. CK-2 menfosforilasi berbagai protein yang berbeda. CK-2 kemungkinan memiliki peran yang esensial di dalam pengontrolan terhadap pembelahan dan diferensiasi sel pada semua eukariot (Collinge & Walker 1994). Fosforilasi kemungkinan juga mengaktifkan metal transcription factor-1 (MTF-1) didalam respon terhadap logam berat (LaRochele et al. 2001; Saydam et al. 2002)
Miristoilasi adalah modifikasi lipid yang memastikan fungsi dan jalur intraseluler yang tepat dari protein dalam keterlibatannya pada berbagai jalur-jalur sinyal. Suatu
sekuen asam amino yang mempunyai domain miristolasi maka pada ujung N (N-terminal) pasti memiliki asam amino glysine (Gly). Gly adalah asam amino untuk
tempat miristolasi (Pierre et al. 2007).
Domain yang banyak mengandung asam amino Cys merupakan karakteristik umum dari protein MT. Berdasarkan komposisi asam amino Cys di dalam suatu sekuen
maka MT dibagi menjadi dua domain dalam mekanisme pengikatan logam, yaitu
β domain (N-terminal) dan α domain (C-terminal) (Valle & Auld 1993). Komposisi Cys yang dimiliki MT diduga berkaitan dengan kemampuan MT dalam mengikat logam untuk mekanisme detoksifikasi dan juga kestabilan protein (Duncan et al. 2006).
31
SIMPULAN
cDNA utuh (246 pb) Mt2 dari G. max (GmMt2) telah berhasil diisolasi. GmMt2 ini mempunyai urutan nukleotida yang sama dengan AtMt2A dari A. thaliana. Motif urutan asam amino Cys dari GmMT2 terdiri dari Cys-Cys (residu 3-4), Cys-X-Cys (8-10, 14-16, 67-69, 73-75, 78-80) dan Cys-X-X-Cys (20-23). GmMT2 diduga memiliki peranan yang sama dengan AtMT2A yaitu mengikat dan mendetoksifikasi unsur logam dan membatasi kerusakan akibat oksidatif pada tanaman.
SARAN
Primer untuk isolasi fragmen GmMt2 dapat digunakan sebagai alat deteksi ekspresi Mt2 pada kedelai terkait cekaman pH rendah dan Al melalui metode PCR atau untuk isolasi pelacak yang digunakan dalam hibridisasi northern. Analisis ekspresi MT2 kedelai dengan real time PCR dapat menggunakan urutan nukleotida GmMt2 sebagai dasar perancangan primer.
DAFTAR PUSTAKA
Akashi K, Nishimura N, Ishida Y, Yokota A. 2004. Potent hydroxyl radical-scavenging activity of drough-induced type-2 metallothionein in wild watermelon. Biochem Biophys Res Com 323: 72-78.
Armario A, Hidalgo J, Bas J, Restrepo C, Dingman A, Garvey JS. 1987. Age-dependent effects of acute and chronic intermittent stresses on serum metallothionein. Physiol Behav 39: 277–279.
Andrews GK, Gallant KR, Cherian MG. 1987. Regulation of the ontogeny of rat liver metallothionein mRNA by Zinc. Eur. J Biochem 166: 527-531.
Bayne BL, Brown DA, Burns K, Dixon DR, Ivanovici A, Livingstone DR, Lowe DM, Moore MN, Stebbing ARD, Widdows J. 1985. The effects of stress and pollution on marine animals. Praeger. Praeger scientific. New York. 384 hlm. Bebianno MJ, Langston WJ. 1992 a. Cadmium induction of metallothionein synthesis in
Mytilus galloprovicialis. Comp Biochem Physiol 103C (1): 79-85.
Bebianno MJ, Langston WJ. 1992 b. Metallothionein induction in Littorina littorea (Mollusca: Prosobranchia) on exposure to cadmium. United Kingdom. J Mar Biol 72: 392-342.
Bebianno MJ, Nott JA, Langston WJ. 1993. Cadmium metabolism in the clam Rudipes decussata: the role of metallothioneins. Aquat Toxic 27: 315-334.
Bennet RJ, Breen CM. 1991. The aluminum signal: new dimension to mechanism of aluminum tolerance. Plant Soil 134: 153-166.
Binz PA, Kagi JHR. 1999. Metallothionein: molecular evolution and classification. In: Metallothionein IV, C. Klaassen. Birkhauser-Verlag. Basel.
Bremner I, Mehra RK, Sato M. 1987. Metallothionein in blood, bile and urine. Experien Suppl 52: 507–517
Cai L, Koropatnick J, Cherian MG. 1995. Metallothionein protects DNA from copper-induced but not iron-copper-induced cleavage in vitro. Chem Biol 96: 143-155.
Cano-Gauci DF, Sarkar B. 1996. Reversible zinc exchange between metallothionein and the estrogen receptorzinc finger. FEBS Lett 386: l - 4.
Canpolat E, Lynes MA. 2001. In vivo manipulation of endogenous metallothionein with a monoclonal antibody enhances a t-dependent humoral immune response.