9 BAB II
PENGGUNAAN PENANDA DNA SPESIFIK BETINA DALAM PENENTUAN JENIS KELAMIN PADA BURUNG FAMILIA
COLUMBIDAE
A. Familia Columbidae
Familia Columbidae merupakan kelompok burung dengan panjang tubuh berkisar antara 15-75 cm dengan berat 30-2000 gram, memiliki kepala berukuran kecil dengan paruh dan kaki yang pendek. Sebanyak 44% bagian tubuh terdiri dari otot terbang, sehingga memiliki kemampuan terbang yang baik dan terarah. Ciri lainnya yaitu tubuh kokoh, leher pendek, paruh ramping, dan cere berdaging (Pertiwi, 2005). Distribusi burung Familia Columbidae tersebar luas di seluruh dunia, terutama hutan hujan tropis (Pereira et al., 2007).
Warna bulu pada umumnya memiliki gradasi pada bagian leher, dada, punggung, sayap, dan kepala. Kelompok ini terdiri dari jenis burung monomorfik dan dimorfik, dapat hidup pada hampir semua jenis habitat terestrial, mulai dari gurun hingga hutan hujan tropis dan area urban (Baptista, 1992). Hidupnya berpasang-pasangan dan bertelur dua, mempunyai tembolok (pemakan biji-bijian), Mempunyai alat yang dapat menutup hidung, sehingga tidak perlu mengangkat kepalanya pada saat minum. Burung jantan bertubuh dan bersuara lebih besar serta menyanyi atau berbunyi (bukan berkicau) untuk memikat betina. Suara nyanyian yang dihasilkan berasal dari selaput suara (syrinx) yang terletak pada bagian belakang tenggorokan yang berhubungan dengan paru-paru, yang tampak mengembung pada saat berbunyi (Solo, 2009).
1. Geopelia striata (burung perkutut)
Burung perkutut adalah burung yang memiliki ukuran tubuh kecil, panjangnya berkisar antara 20-25 cm. Kepalanya membulat kecil dan berwarna abu-abu (TN2, 1999). Bentuk paruhnya panjang meruncing dengan warna biru keabu-abuan. Bulu disekitar dada dan leher membentuk pola garis melintang berwarna hitam dan putih. Bulu yang menutupi badan perkutut berwarna kecokelatan. Pada bulu sayap terdapat garis melintang berwarna cokelat tua (Okto, 1999). Jumlah jari pada kaki burung perkutut ada empat, dengan kuku-kuku yang runcing. Tiga dari empat jarinya ada di depan dan satu jari di belakang. Jari-jari perkutut berguna untuk bertengger. Berikut gambar dan klasifikasi burung perkutut menurut Linnaeus, 1766 dalam ITIS (2009c):
Kingdom : Animalia Phylum : Chordata Subphylum: Vertebrata Class : Aves Order : Columbiformes Family : Columbidae Genus : Geopelia
Species : Geopelia striata Linnaeus
Gambar 2.1 Burung Perkutut (Sumber: dokumentasi pribadi)
2. Streptopelia bitorquata (burung puter)
Burung puter merupakan salah satu spesies dari Familia Columbidae yang tersebar di daerah Guam, Indonesia, Malaysia dan Filipina. Habitat aslinya adalah di daerah hutan dataran rendah subtropis atau tropis dan juga di daerah hutan mangrove tropis (Sukmantoro et al., 2007).
Burung puter termasuk burung pemakan biji-bijian dan bersifat monomorfik. burung puter memang tidak seternar burung perkutut, burung tekukur, dan burung merpati namun dikalangan peternak dan para penggemar burung, burung puter merupakan pengasuh yang handal bagi piyik burung perkutut. Seekor burung perkutut dapat mengasuh hingga 6 ekor piyik perkutut. Klasifikasi menurut Temminck, 1890 dalam ITIS (2009b) adalah sebagai berikut:
Kingdom : Animalia Phylum : Chordata Sub Phylum :Vertebrata Class : Aves
Order : Columbiformes Family : Columbidae Genus : Streptopelia
Spesies : Streptopelia bitorquata Temminck (Puter)
Gambar 2.2 Burung Puter (Sumber: dokumen- tasi pribadi)
3. Streptopelia chinensis (burung tekukur)
Burung tekukur merupakan burung pembiak yang berasal dari daerah Asia Barat yang menyebar ke daerah Australia, India, Srilanka, China, Asia Tenggara, dan Australia (TN1, 2008). Bulu di bagian ventral berwarna cokelat, sedangkan di daerah dorsal dan sayap berwarna kehitaman. Bulu di kepala berwarna abu dan bagian leher abu kecokelatan.
Ciri khusus burung tekukur adalah bulu dengan pola hitam-putih di bagian punggung lehernya. Panjang individu dewasa antara 27.5-31.0 cm dengan berat 128 gram. Burung tekukur dapat bertelur beberapa kali sepanjang tahun (Robbins, et al., 1989). Klasifikasi burung tekukur menurut Scopoli, 1786 dalam ITIS (2009a) adalah sebagai berikut:
Kingdom : Animalia Phylum : Chordata Sub Phylum : Vertebrata Class : Aves
Order : Columbiformes Family : Columbidae Genus : Streptopelia
Spesies : Streptopelia chinensis Scopoli (Tekukur)
Gambar 2.3 Burung Tekukur (Sumber: dokumentasi pribadi)
4. Columba livia (burung merpati)
Merpati termasuk dalam Familia Columbidae dari Ordo Columbiformes. Merpati Indonesia berasal dari jenis merpati lokal yang berasal dari merpati liar (Columba livia) yang telah lama dibudidayakan dan asal penyebarannya dari Eropa (Antawidjaja, 1988).
Merpati mempunyai sifat damai hampir tidak ada persaingan dan kanibalisme,walaupun ditempatkan pada satu kandang yang sama, mudah menyesuaikan diri dengan lingkungan, memilik pasangan sendiri, bersifat monogami, dan mempunyai sifat sense of location dalam waktu yang lama dan dalam jarak jauh (TN2, 1999). Klasifikasi menurut Gmelin, 1789 dalam ITIS (2009d): Kingdom : Animalia Phylum : Chordata Subphylum : Vertebrata Class : Aves Order : Columbiformes Family : Columbidae Genus : Columba Species : Columba livia
Gmelin
Gambar 2.4 Burung Merpati (Sumber: dokumentasi
B. Identifikasi jenis kelamin non-molekuler pada burung monomorfik Identifikasi jenis kelamin pada burung monomorfik, dapat dilakukan dengan cara konvensional (non-molekuler). Setiap cara identifikasi memiliki kekurangan dan kelebihannya masing-masing. Berikut pemaparan mengenai cara-cara konvensional untuk identifikasi jenis kelamin burung monomorfik:
1. Vent sexing
Vent sexing adalah suatu metode yang dipopulerkan di tahun 1930-an oleh seorang profesor Jepang, Kiyoshi Masui. Dengan metode ini bisa mendapatkan hasil sexing 95% akurat. Metode ini dapat dilakukan dengan cara memegang ayam yang berumur sehari dibaringkan pada satu tangan kemudian memeriksa lubang daerah (kloaka) untuk mengetahui ada atau tidak adanya bakal organ seks burung jantan. Orang awam yang mempelajari teknik dasar metode vent sexing ini dapat mencapai keberhasilan 60-70%. Meskipun seorang ahli bisa saja melakukan kesalahan dalam identifikasi (Bramwell, 2003).
2. Laparoskopi (pembedahan)
Cara pembedahan untuk identifikasi jenis kelamin pada burung Familia Columbidae memiliki resiko tertinggi, namun merupakan cara yang paling akurat karena dapat mendeteksi karakteristik fisik saluran reproduksi dan hasilnya dapat diketahui pada saat itu juga. Jaringan gonad burung dewasa lebih mudah terlihat dibandingkan dengan burung yang belum dewasa.
Untuk melihat organ seks menggunakan laparoskop atau otoskope, diperlukan pembedahan kecil di sisi kiri burung. Selama pemeriksaan, pada burung jantan muda, testis yang diamati ukurannya kecil dan biasanya berbentuk
avaskular, tapi pada burung jantan dewasa permukaannya lebih besar, dan bervariasi ukurannya. Pada burung betina muda ovariumnya belum terlihat. Pada burung betina yang menuju dewasa permukaan ovariumnya berbentuk granular. Pada burung betina dewasa folikel ovarium tampak seperti sekelompok anggur. Kelemahan utama dari laparoskopi adalah risiko cedera pada organ vital burung yang dibedah. Pemeriksaan ini dapat berbahaya dan bahkan dapat mematikan burung tersebut (Swengel, 1996).
3. Steroid sexing
Metode ini didasarkan pada kadar estrogen/testosteron (E/T) di kotoran burung. Kotoran burung betina memiliki rasio E/T tinggi dibandingkan dengan kotoran burung jantan. Diperlukan sampel feses segar untuk tes ini. Hasil terbaik dihasilkan hanya dari burung-burung dewasa selama musim kawin selama bulan April–Juli (Swengel, 1996).
4. Analisis steroid dalam telur
Telur unggas mengandung banyak kadar hormon induk. Melalui metode ini cara pengambilan sampel betul-betul harus diperhatikan, karena hormon tidak homogen didistribusikan dalam telur dan selama perkembangan embrio. Kadar hormon dapat menurunkan dan meningkatkan disebabkan oleh perubahan struktur telur dan sekresi atau pengambilan hormon oleh embrio.
Ekstraksi hormon dari kuning telur dan pemisahan kromatografi hormon yang berbeda dapat sangat mempengaruhi hasil karena mengganggu dalam sekresi zat seperti protein, lipid, hormon, dan lain-lain yang dapat bereaksi dengan antiserum yang digunakan. Metode ini membutuhkan penelitian lebih lanjut,
terutama berkenaan dengan akurasi dan spesifisitas pengukuran hormon (Von Engelhardt & Groothuis, 2005). Petrie et al. (2001) menemukan bahwa konsentrasi hormon dalam kuning telur jantan dan betina berbeda secara signifikan.
C. Polymerase Chain Reaction (PCR)
Polymerase Chain Reactions (PCR) merupakan suatu teknik replikasi DNA secara in vitro. Teknik PCR adalah suatu teknik dengan bantuan primer dan enzim DNA polymerase yang dapat mengidentifikasi segmen molekul DNA tertentu di dalam genom, dapat menggandakan segmen DNA tersebut dalam jumlah besar. Teknik PCR banyak digunakan dalam mengidentifikasi keragaman pada tingkat intraspesies maupun antarspesies (Qian et al., 2001).
1. Prinsip Kerja PCR
Pada proses penggandaan DNA, terdapat beberapa tahap, yaitu: tahap peleburan (melting) atau denaturasi. Pada tahap ini (berlangsung pada suhu tinggi, 94-96°C) ikatan hidrogen DNA terputus (denaturasi) dan DNA menjadi rantai tunggal. Biasanya pada tahap awal PCR tahap ini dilakukan agak lama (sampai 5 menit) untuk memastikan semua pilinan DNA terpisah. Pemisahan ini menyebabkan DNA tidak stabil dan siap menjadi template ("cetakan") bagi primer. Durasi tahap ini 1–2 menit.
Tahap penempelan atau annealing. Primer menempel pada bagian DNA template yang komplementer urutan basanya. Ini terjadi pada suhu antara 45– 60°C. Penempelan ini bersifat spesifik, suhu yang tidak tepat menyebabkan tidak
terjadinya penempelan atau primer menempel di sembarang tempat. Tahap ini berlangsung selama 1–2 menit.
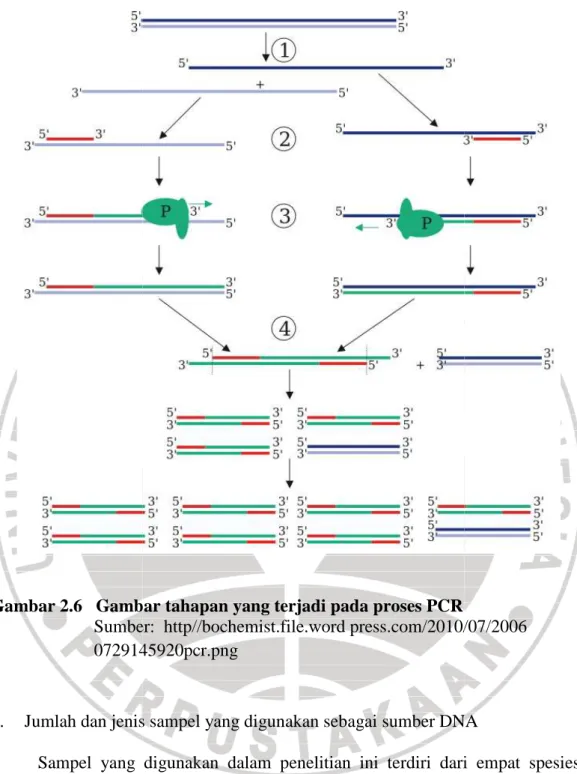
Tahap pemanjangan atau elongasi. Suhu untuk proses ini tergantung dari jenis DNA polymerase (P pada Gambar 2.6) yang dipakai. Dengan Taq-polymerase, proses ini biasanya dilakukan pada suhu 72°C. Durasi tahap ini biasanya 1 menit. Lepas tahap 3, siklus diulang kembali mulai tahap 1. Tahap 4 pada Gambar 2.6 menunjukkan perkembangan yang terjadi pada siklus-siklus selanjutnya. Akibat denaturasi dan renaturasi, beberapa untaian baru (berwarna hijau) menjadi template bagi primer lain. Akhirnya terdapat untai DNA yang panjangnya dibatasi oleh primer yang dipakai. Jumlah DNA yang dihasilkan berlimpah karena penambahan terjadi secara eksponensial. Tahapan-tahapan yang terjadi saat PCR dapat dilihat pada Gambar 2.5. dan Gambar 2.6.
Gambar 2.5 Proses yang terjadi selama PCR
(Sumber: http://www.mun.ca/biology/scarr/PCR_ simplified.html)
Gambar 2.6 Gambar tahapan yang terjadi pada proses PCR Sumber:
0729145920pcr.png
2. Jumlah dan jenis sampel yang digunakan sebagai s
Sampel yang digunakan dalam penelitian ini terdiri dar yaitu: Columba livia
Streptopelia bitorquata
masing-masing spesies terdiri dari 6 individu diisolasi oleh Pertiwi
Gambar tahapan yang terjadi pada proses PCR
Sumber: http//bochemist.file.word press.com/2010/07/2006 0729145920pcr.png
Jumlah dan jenis sampel yang digunakan sebagai sumber DNA
Sampel yang digunakan dalam penelitian ini terdiri dari empat spesies, livia (burung merpati), Streptopelia chinensis (burung tekukur) a bitorquata (burung puter), dan Geopelia striata (burung perkutut) masing spesies terdiri dari 6 individu. Seluruh sampel DNA tersebut telah diisolasi oleh Pertiwi (2009) & Nurtikasari (2009). Isolasi dilakukan kembali
press.com/2010/07/2006
umber DNA
i empat spesies, (burung tekukur), (burung perkutut) Seluruh sampel DNA tersebut telah ikasari (2009). Isolasi dilakukan kembali
terhadap dua ekor merpati, jantan dan betina yang akan digunakan sebagai kontrol. Seluruh DNA yang diisolasi berasal dari darah, karena sebelumnya pernah dilakukan isolasi dari bulu (Pertiwi (2009) & Nurtikasari (2009)) namun hasilnya belum optimal dari segi kuantitas DNA.
3. Optimasi
Optimasi dilakukan terhadap suhu annealing. Penempelan primer pada daerah DNA target menentukan keberhasilan proses amplifikasi dan salah satu faktor yang mempengaruhi keberhasilannya adalah suhu pada saat primer akan menempel. Sampel DNA yang digunakan berasal dari spesies berbeda-beda sehingga suhu annealing pun akan berbeda. Suhu annealing dengan menggunakan primer spesifik betina (TurSexOPAV17-F & TurSexOPAV17-R) termasuk tinggi yaitu berkisar 50-60oC. Tinggi rendahnya suhu annealing dipengaruhi juga oleh komposisi GC pada primer. Semakin banyak GC yang terdapat pada primer maka suhu annealingnya pun semakin tinggi (Sulandari et al., 2003). Selain itu untuk mendapatkan fragmen spesifik pada DNA target suhu yang diperlukan pun akan tinggi. DNA yang digunakan berkisar antara 100-200ng.
D. Elektroforesis
Elektroforesis gel agarosa merupakan metode standar yang digunakan untuk memisahkan, mengidentifikasi dan memurnikan fragmen DNA. Teknik ini sederhana, cepat terbentuk, dan mampu memisahkan campuran potongan DNA sesuai dengan ukurannya secara akurat, dibanding dengan densitas gradien
sentrifugasi. Selanjutnya, lokasi DNA dalam gel tersebut dapat diidentifikasi secara langsung dengan menggunakan pewarna yang berpendar (Fatchiyah, 2006). Pergerakan DNA pada agarosa selama elektroforesis berlangsung dipengaruhi oleh dua faktor utama, yaitu: ukuran molekul DNA dan konsentrasi gel agarosa, molekul DNA yang lebih besar akan bergerak lebih lambat, misal DNA linier lebih cepat dibanding DNA sirkuler. Fragmen DNA yang ukuran molekulnya bervariasi akan bergerak sesuai dengan konsentrasi dari gel agarosa yang digunakan. Hubungan antara konsentrasi gel agarosa dengan ukuran separasi pita DNA dapat dilihat pada Tabel 2.1.
Tabel 2. 1 Konsentrasi gel agarosa dan ukuran molekul DNA No Konsentrasi Gel Agarosa
(%)
Effisiensi Range Pemisahan pada DNA Linier (Kb)
1 0.3 60-5 2 0.6 20-1 3 0.7 10-0.8 4 0.9 7-0.5 5 1.2 6-0.4 6 1.5 4-0.2 7 2.0 3-0.1 (Sumber: Fatchiyah, 2006)
Setelah elektroforesis selesai, kita tidak dapat langsung melihat DNA hasil proses PCR pada agarosa, digunakan pewarna yang mengandung fluoresen dengan konsentrasi rendah, seperti intercalating agent EtBr (Ethidium Bromide) untuk mendeteksi potongan-potongan DNA berupa pita DNA pada gel agarosa. Hanya sedikit DNA ± 1 ng dapat dideteksi secara langsung dengan cara gel diletakkan pada media UV-transilluminator. Berikut Gambar 2.6 visualisasi DNA pada agarosa yang terlihat pada UV-transilluminator.
Gambar 2.6. Visualisasi DNA pada agarosa yang terlihat pada UV-transilluminator
(Sumber: http://www.cbs.dtu.dk/staff/dave/roanoke/genetics 980211.html)
E. Penanda Genetik
Variasi antar genotip dalam spesies adalah bahan dasar untuk enalisis genom sehingga suatu penanda genetik harus memiliki kemampuan untuk mendeteksi variasi antar individu. Variasi ini dapat berada pada tingkat biologi yang berbeda, mulai dari perbedaan fenotip hingga perbedaan pada nukleotida (Liu, 1998). Beberapa penanda pada tingkat DNA yang digunakan untuk menentukan jenis kelamin burung, yaitu Random Amplified Polymorphic DNA (RAPD), Mikrosatelit, Minisatelit, Amplified Fragment Length Polymorphism (AFLP), dan chromodomain helicase DNA binding protein gene (gen CHD) (Wu et al., 2007; Griffiths et al., 1998)
F. Penanda DNA 1. Penanda RAPD
Fragmen DNA yang dihasilkan dari primer yang terdiri dari 10 urutan basa disebut dengan RAPD. Penanda RAPD biasanya digunakan untuk melihat hubungan kekerabatan antar spesies dan inter spesies. Selain itu RAPD juga dapat digunakan untuk melihat keragaman atau polimorfisme DNA suatu spesies.
Penanda RAPD kurang cocok bila digunakan untuk mengenali fragmen spesifik jenis kelamin karena suhu annealing primer ini rendah (37-40oC) sehingga dapat menempel di daerah lain selain daerah target. Fragmen DNA yang dihasilkan banyak (tidak spesifik).
2. Mikrosatelit
Mikrosatelit merupakan fragmen DNA berukuran pendek, terdapat pada genom dan berulang (Russel, 2002). Penelitian yang dilakukan oleh () pita DNA yang dihaslkan lebih dari dua sehingga belum bisa menghasilkan fragmen spesifik pada betina. Kesalahan terjadi karena fragmen spesifik betina tidak terseparasi dengan baik sehingga akan dianggap sebagai fragmen DNA burung jantan (Ellegren, 1991)
3. Minisatelit
Minisatelit terdiri dari sejumlah sekuen DNA yang berulang, panjangnya sekitar 5-10 pb. Penggunaan penanda minisatelit jarang sekali digunakan karena fragmen yang dihasilkan tidak menunjukan ciri khas suatu spesies serta dinilai tidak efisien karena cara kerjanya yang rumit dan waktu yang dibutuhkan pun lama (Lessells & Mateman, 1998)
4. Penanda AFLP
Penanda AFLP ini pernah digunakan oleh Griffiths & Orr (1999) untuk penentuan jenis kelamin pada burung ostrich dan shag. Namun, jika dibandingkan dengan penanda RAPD, penanda AFLP ini cara kerjanya lebih rumit, membutuhkan konsistensi, peralatan-peralatan yang aman, persiapan yang matang
5. Primer sexing
Revolusi teknik molekuler untuk identifikasi jenis kelamin pada burung dimulai dengan ditemukannya gen pertama jenis kelamin pada kromosom W pada tahun 1995 oleh Griffiths & Tiwari. Gen yang sangat dekat dan berkorelasi dengan gen jenis kelamin yang ada pada kromosom W, ditemukan segera setelahnya pada kromosom Z (Griffiths & Korn, 1997).
Sejak ditemukannya perbedaan (dimorfik) pada gen jenis kelamin CHD-Z dan CHD-W yang merupakan gen conserved pada kebanyakan jenis burung, gen ini diamplifikasi dengan PCR (Griffiths et al. (1998); Kahn et al. (1998), Fridolfsson & Ellegren (1999)). Gen jenis kelamin ini terbuat dari DNA fungsional dan sangat conserved diantara taksa yang berbeda. Gen ini dinamai chromodomain helicase DNA binding protein (gen CHD). Pada sebagian besar jenis burung, gen CHD ini kemungkinan besar terdapat pada kromosom W dan Z, kecuali pada kelompok ratitae, tidak memiliki perbedaan ukuran kromosom sex (Ellegren, 1996; Griffiths et al., 1996).
Griffiths et al., (1998) merancang primer P2 &P8 (primer sexing) untuk mengenali daerah gen tersebut. Pada perkembangannya primer ini telah dapat
membedakan jenis kelamin pada 27 spesies dari 25 Familia (Struthionidae, Phasianidae, Anatidae, Alcedinidae, Meropidae, Psittacidae, Apodidae, Strigidae, Columbidae, Otididae, Burhinidae, Laridae, Alcidae, Accipitridae, Falconidae, Maluridae, Pardalotidae, Sylviidae, Corvidae, Callaeatidae, Paridae, dan Passeridae. Brikhead (2001) melaporkan bahwa P2 & P8 telah berhasil pula digunakan pada mure (Uria aagle).
Selain P2 & P8, terdapat primer lain yang juga dapat digunakan untuk identifikasi jenis kelamin yang paling sering ddigunakan untuk identifikasi jenis kelamin pada spesies burung, diantaranya:2550F/2718R (Fridolfsson & Ellegren, 1999; Dubiec & Zagalska-Neubauer, 2006; Woxvold & Magrath, 2008), 1237L/1272H (Kahn et al., 1998) dan sex1/sex2 (Wang & Zhang, 2009). Pasangan primer sex1/sex2 dirancang dari gen CHD Crossoptilon mantchuricum, digunakan untuk mengetahui jenis kelamin Pheasants (Burung Pegar) dan beberapa spesies Passeriformes (Wang & Zhang, 2009).
G. Perkembangan Penanda DNA spesifik Betina
Pada Perkembangannya primer sexing yang telah dipaparkan bukan tanpa kendala, sebagai contoh, terjadi kesalahan identifikasi pada beberapa spesies burung sehingga tidak dapat dibedakan jenis kelaminnya. Fragmen DNA pada burung betina dapat disalahartikan menjadi fragmen jantan karena sama-sama menghasilkan satu fragmen DNA (Fridolfsson & Ellegren, 1999).
Untuk mengatasi permasalahan ini, Wu et al. (2007) mencoba merancang primer spesifik pada Familia Columbidae. Primer ini dirancang dari Streptopelia
orientalis betina menggunakan PCR-RAPD OPAV17. Hasil dari rancangannya berupa primer TurSexOPAV17-F & TurSexOPAV17-R. Kesimpulan yang dapat diambil dari penelitiannya berupa fragmen DNA spesifik betina pada sampel DNA Columba livia 770 pb. Streptopelia chinensis 778 pb, Streptopelia chinensis formosa tidak terampllifikasi, dan Streptopelia oriemtaslis 777 pb.
Pada penelitian yang penulis lakukan dengan menggunakan primer yang sama (TurSexOPAV17-F & TurSexOPAV17-R) namun sampel DNA burungnya berbeda. Didapatkan fragmen DNA spesifik betina pada sampel DNA Streptopelia bitorquata 390 pb, Geopelia striata 275 dan 290 pb, Streptopelia chinensis 1060 pb, dan Columba livia 790 pb.
Pada tahun 2011 Huang et al. melakukan penelitian pula pada Familia Columbidae (Columba livia, Columba pulchricollis, dan Streptopelia tranquebarica) dengan kombinasi primer F & TurSexOPAV17-R dan P2 & P8. Primer ini diberi kode P2/dove-W & P2/dove-ZW. Primer ini dirancang untuk mengamplifikasi daerah ZW-common yang conserved pada sampel DNA burung jantan dan burung betina, serta daerah W-specific yang conserved pada sampel DNA burung betina. Namun, ketika dicoba dicocokan antara beberapa kemungkinan kombinasi primer dengan sekuen primer dan sekuen DNA sampel hasilnya tidak homolog.