BAB II
TINJAUAN PUSTAKA
2.1 Karotenoid
Karotenoid adalah suatu kelompok pigmen yang berwarna kuning, orange, atau merah orange, yang ditemukan pada tumbuhan, kulit, cangkang / kerangka luar (eksoskeleton) hewan air serta hasil laut lainnya seperti molusca (calm, oyster, scallop), crustacea (lobster, kepiting, udang) d an ikan (salmon, trout, sea beam, kakap merah dan tuna). Karotenoid juga banyak ditemukan pada kelompok bakteri, jamur, ganggang dan tanaman hijau. (Desiana, 2000).
Pigmen karotenoid mempunyai struktur alifatik atau alisiklik yang pada umumnya disusun oleh delapan unit isoprena, dimana kedua gugus metil yang dekat pada molekul pusat terletak pada posisi C1 dan C6, sedangkan gugus metil lainnya terletak pada posisi C1 dan C5 serta diantaranya terdapat ikatan ganda terkonjugasi.
Semua senyawa karotenoid mengandung sekurang-kurangnya empat gugus metil dan selalu terdapat ikatan ganda terkonjugasi diantara gugus metil tersebut. Adanya ikatan ganda terkonjugasi dalam ikatan karotenoid menandakan adanya gugus kromofora yang menyebabkan terbentuknya warna pada karotenoid. Semakin banyak ikatan ganda terkonjugasi, maka makin pekat warna pada karotenoid tersebut yang mengarah ke warna merah. (Heriyanto dkk, 2009. Wikipedia, 2010)
Karotenoid dibentuk oleh penggabungan delapan unit isoprene (C5H8) atau 2-metil-1,3-butadiena dimana isoprena yang membentuk karotenoid ini berikatan secara “kepala-ekor” kecuali pada pusat molekul berikatan secara “ekor-kor” sehingga menjadikan molekul kerotenoid simetris sesuai dengan struktur berikut :
Gambar 2.2 Ikatan kepala – ekor pada isoprena
Gambar 2.3 Ikatan ekor – ekor pada isoprena
(Rodriguez,1997, Gross, 1991, Dutta, 2005)
Istilah karoten digunakan untuk beberapa zat yang memiliki rumus molekul C40H56. Secara kimia, karoten adalah terpena yang disintesa secara biokimia dari delapan satuan isoprena C5H8
Karotenoid mempunyai sifat-sifat tertentu, diantaranya tidak larut dalam air, larut sedikit dalam minyak, larut dalam hidrokarbon alifatik dan aromatik seperti heksana dan benzene serta larut dalam kloroform dan metilen klorida. Karotenoid harus selalu disimpan dalam ruangan gelap (tidak ada cahaya) dan dalam ruangan vakum, pada suhu -20 0C. Karotenoid yang terbaik disimpan dalam bentuk padatan kristal dan didalamnya terdapat pelarut hidrokarbon seperti petroleum, heksana atau benzena. Hal ini bertujuan untuk meminimalkan resiko kontaminasi dengan air sebelum dianalisa lebih lanjut.
Berdasarkan unsur-unsur penyusunnya karotenoid dapat digolongkan dalam dua kelompok pigmen yaitu karoten dan xantofil. Karoten mempunyai susunan kimia yang hanya terdiri dari C dan H seperti α-karoten, β-karoten dan γ-karoten. Sedangkan xantofil terdiri dari atom-atom C, H dan O. Contoh senyawa yang termasuk dalam xantofil antara lain : cantaxanthin, astaxanthin, rodoxanthin dan torularhodin. (Gama, 2005)
Karotenoid alami (juga dikenal sebagai ekstrak karoten) secara alami memberikan pigmen warna pada berbagai tumbuhan termasuk buah-buahan dan sayuran. Karotenoid berperan penting bagi kesehatan dan kelangsungan hidup manusia. Karotenoid dapat meningkatkan sistem immun, perlindungan terhadap kanker dan juga berfungsi sebagai antioksidan. (Suwandi, 1991, Dutta, dkk., 2005)
Karotenoid mempunyai sifat sifat tidak larut dalam air, tetapi larut dalam lemak,
mudah diisomerisasi dan dioksidasi, menyerap cahaya, meredam oksigen singlet, memblok reaksi radikal bebas dan dapat berikatan dengan permukaan hidrofobik Karotenoid berada dalam lemak bersama-sama dengan klorofil. (Dutta, dkk., 2005.)
2.2 Minyak Kelapa Sawit.
Minyak yang dihasilkan dari bagian kulit atau sabut kelapa sawit dikenal dengan nama Crude Palm Oil ( CPO ). Minyak kelapa sawit digunakan sebagai bahan mentah minyak dan lemak pangan untuk menghasilkan minyak goreng, shortening, margarin, dan minyak makan lainnya. Minyak sawit mengandung asam lemak jenuh dan asam lemak tidak jenuh yang ikatannya mudah dipisahkan dengan alkali. (Pasaribu, 2004)
Minyak kelapa sawit yang diperoleh dari pengolahan buah kelapa sawit ( Elaeis
guinensis jacq ) terdiri dari gliserida campuran yang merupakan ester dari gliserol
dan asam lemak rantai panjang. Umumnya, komposisi asam lemak minyak sawit seperti terlihat pada Tabel 2.1 berikut ini :
Tabel 2.1 Komposisi Asam Lemak dalam Minyak Sawit
Nama Asam Lemak Rumus Asam Lemak Komposisi
Laurat C12:0 0,2 % Myristat C14:0 1,1 % Palmitat C16:0 44,0 % Stearat C18:0 4,5 % Oleat C18:1 39,2 % Linoleat C18:2 10,1 % Lainnya - 0,9 % (Pahan, I. 2008)
Selain dari asam lemak, minyak sawit masih memiliki komponen minor. Kandungan minor minyak kelapa sawit dapat dilihat pada Tabel 2.2 berikut ini.
Tabel 2.2 Kandungan Minor Minyak Sawit
No Komponen Konsentrasi ( ppm ) 1 Karoten 500 – 700 2 Tokoferol 400 – 600 3 Sterol Mendekati 300 4 Phospatida 500 5 Besi ( Fe ) 10 6 Tembaga ( Cu ) 0,5 7 Air 0,07 – 0,18 8 Kotoran-kotoran 0,01 (Ketaren,S. 2005)
2.3 Reaksi Adisi
Reaksi adisi adalah reaksi penjenuhan atau pemutusan ikatan rangkap menjadi ikatan tunggal. Jadi pada reaksi adisi, ikatan rangkap pada suatu molekul atau senyawa menerima atom atau gugus atom sehingga ikatan rangkapnya berubah menjadi ikatan tunggal. Jadi reaksi adisi terjadi pada molekul-molekul yang memiliki ikatan rangkap. Contoh : Reaksi adisi hidrogen ( Hidrogenasi ) pada etena dengan katalis logam Ni : CH2 = CH2 + H2 Ni CH3 – CH3
Pada reaksi adisi HX pada suatu alkena merupakan reaksi regioselektif yaitu suatu reaksi dimana adisi kepada suatu alkena tak simetris produknya akan melimpah dari pada arah yang lain. Jadi pada reaksi regioselektif akan diperoleh dua macam produk adisi isometrid namun produk yang satu akan lebih melimpah dari pada produk yang lain. (Fessenden, 1986)
Adisi HX pada alkena bersifat regioselektif karena H+ dari HX menjadi terikat pada karbon alkenil yang telah lebih banyak mengikat energi. Alasan selektifitas ini adalah bahwa jalur adisi ini menghasilkan karbokaktion antara yang lebih stabil diantara dua kemungkinan.
Mekanisme adisi HX pada alkena pembentukan sebuah karbokation pada alkena yang tidak simetris, misalnya propena.
Urutan kestabilan karbokation adalah tersier > sekunder > primer.
Untuk propena, kedua posisi adisi H+ akan menghasilkan dua kemungkinan : 1 Karbokation primer, berenergi tinggi dan kurang stabil.
2 Karbokation sekunder, bernergi rendah dan lebih stabil.
Keadaan transisi menuju ke zat antara ini mempunyai karakter karbokation. Oleh karena itu, karbokation sekunder memiliki keadaaan transisi yang berenergi lebih rendah dan dengan laju pembentukan yang lebih cepat. Adisi suatu pereaksi kepada suatu alkena tak simetris berlangsung lewat karbokation yang lebih stabil. Hal ini sesuai dengan aturan Markovnikov. (Polling, 1985)
2.4 Katalis
Salah satu cara lain untuk mempercepat laju reaksi adalah dengan jalan menurunkan energi pengaktifan suatu reaksi. Hal ini dapat dilakukan dengan menggunakan katalis.
Suatu katalis berperan dalam reaksi tapi bukan sebagai pereaksi ataupun sebagai produk. Katalis memungkinkan reaksi berlangsung lebih cepat atau memungkinkan reaksi pada suhu lebih rendah akibat perubahan yang dipicunya terhadap pereaksi.
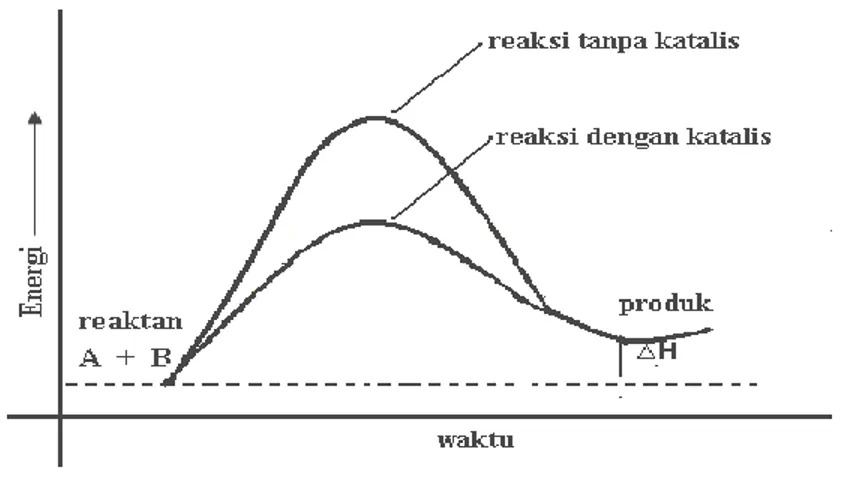
Katalis menyediakan suatu jalur pilihan dengan energi aktivasi yang lebih rendah. Katalis mengurangi energi yang dibutuhkan agar suatu reaksi dapat berlangsung.
Gambar 2.4 Energi pengaktifan reaksi dengan katalis dan tanpa katalis
Akhir akhir ini, katalis banyak digunakan untuk menghasilkan produk yang lebih banyak dan dengan kualitas yang lebih baik. Banyak reaksi hanya dapat berlangsung dengan adanya katalis. Beberapa produk kimia yang hanya dapat dihasilkan dengan proses katalisis adalah asam sulfat, amoniak, dan karet sintetis. (Damanik, 1997)
Dalam penggunaannya, katalis dapat dibedakan ke dalam dua golongan utama: yaitu katalis homogen dan katalis heterogen.
FeCl3Katalis homogen adalah katalis yang mempunyai fasa sama dengan zat yang dikatalisis. Biasanya katalis homogen adalah berupa kompleks logam yang larut dalam medium reaksi.
Katalis homogen dapat digunakan pada suhu dan tekanan rendah dan biasanya spesifik untuk reaksi tertentu.
Contohnya besi (III) klorida pada reaksi penguraian hidrogen peroksida menjadi air dan gas oksigen menurut persamaan :
2 H2O2 (l) 2 H2O (l) + O2 (g)
Katalis heterogen adalah katalis yang ada dalam fase berbeda dengan pereaksi dalam reaksi yang dikatalisisnya. Penggunaan katalis heterogen biasanya pada suhu dan tekanan tinggu. Umumnya katalis heterogen berupa zat padat yang terdiri dari logam atau oksida logam. Keuntungan penggunaan katalis heterogen adalah katalisnya dapat dipisahkan dengan penyaringan dari produk bila reaksi telah selesai. Banyak proses industri yang menggunakan katalis heterogen, sehingga proses dapat berlangsung lebih cepat dan biaya produksi dapat dikurangi.
Beberapa logam ada yang dapat mengikat cukup banyak molekul-molekul gas pada permukannya, misalnya Ni, Pt, Pd dan V. Gaya tarik menarik antara atom logam dengan molekul gas dapat memperlemah ikatan kovalen pada molekul gas, dan bahkan dapat memutuskan ikatan itu. Satu contoh sederhana untuk katalisis
MnO2heterogen yaitu bahwa katalis menyediakan suatu permukaan di mana pereaksi-pereaksi ( atau substrat ) untuk sementara terjerap. Ikatan dalam substrat-substrat menjadi sedemikian lemah sehingga memadai terbentuknya produk baru. Ikatan atara produk dan katalis lebih lemah, sehingga akhirnya terlepas.
Katalis dapat bekerja dengan membentuk senyawa antara atau mengabsorpsi zat yang direaksikan. Sehingga katalis dapat meningkatkan laju reaksi, sementara katalis itu sendiri tidak mengalami perubahan kimia secara permanen. Cara kerjanya yaitu dengan menempel pada bagian substrat tertentu dan pada akhirnya dapat menurunkan energi pengaktifan dari reaksi, sehingga reaksi berlangsung dengan cepat.
Suatu reaksi yang menggunakan katalis disebut reaksi katalis dan prosesnya disebut katalisme. misalnya :
2 KClO3(g) 2KCl (s) + 3 O2 (g) H2 (g) + Cl2 (g)
arang
2 HCl(g)
Secara umum proses suatu reaksi kimia dengan penambahan katalis dapat dijelaskan sebagai berikut. Zat A dan zat B yang direaksikan membentuk zat AB dimana zat C sebagai katalis. A + B AB (reaksi lambat)
Bila tanpa katalis diperlukan energi pengaktifan yang tinggi dan terbentuknya zat AB lambat. Namun, dengan adanya katalis C, maka terjadilah reaksi :
A + C AC (reaksi cepat) Energi pengaktifan diturunkan, maka AC terbentuk cepat dan seketika itu juga AC bereaksi dengan B membentuk senyawa ABC. AC + B ABC (reaksi cepat).
Energi pengaktifan reaksi ini rendah sehingga dengan cepat terbentuk ABC yang kemudian mengurai menjadi AB dan C. sesuai reaksi ABC AB + C (reaksi cepat)
Ada dua macam katalis, yaitu katalis positif (katalisator) yang berfungsi mempercepat reaksi, dan katalis negatif (inhibitor) yang berfungsi memperlambat laju reaksi. Katalis positif berperan menurunkan energi pengaktifan, dan membuat orientasi molekul sesuai untuk terjadinya tumbukan. Akibatnya molekul gas yang teradsorpsi pada permukaan logam ini menjadi lebih reaktif daripada molekul gas yang tidak terabsorbsi. Prinsip ini adalah kerja dari katalis heterogen, yang banyak dimanfaatkan untuk mengkatalisis reaksi-reaksi gas.
2.5 Logam Transisi Sebagai Katalis.
Logam transisi yang dapat mengkatalis reaksi kimia merupakan dasar yang sangat penting dalam proses industri seperti pada reaksi hidrogenasi, karbonilasi dan reaksi polimerisasi bertekanan rendah untuk etilena dan propena. Semua proses ini berlangsung secara heterogen dimana suatu bahan yang padat digunakan sebagai
Unsur unsur transisi mempunyai sifat-sifat tertentu yaitu : 1 Semua unsur transisi adalah logam.
2 Hampir semua unsur transisi bersifat keras, kuat, titik lelehnya tinggi, titik didih tinggi serta penghantar panas dan listrik yang baik.
3 Unsur tansisi dapat membentuk campuran satu dengan yang lain dan dengan unsur yang mirip logam
4 Banyak diantaranya cukup elektropositif sehingga dapat larut dalam asam mineral, walau beberapa diantaranya bersifat mulia sehingga tidak terpengaruh oleh asam.
5 Senyawa unsur transisi umumnya berwarna dengan valensi yang beragam dan memiliki beberapa macam valensi.
6 Karena kulit yang terisi elektron sebagian, maka unsur ini kebanyakan bersifat paramagnetik.
Pada beberapa kasus, logam transisi yang memiliki berbagai valensi dapat membentuk suatu senyawa intermediet yang tidak stabil, pada kasus lain, logam transisi memberikan reaksi permukaanyang sesuai. sehingga banyak logam logam unsur transisi dan senyawanya bersifat katalitik.
Beberapa logam transisi yang berguna sebagai katalis adalah sebagai berikut :
Ni Raney nikel, pada proses reduksi seperti pembuatan heksametilendiamin, pembuatan H2 dari NH3 dan mereduksi antraquinon menjadi antraquinol pada H2O2.
Komplek Ni digunakan pada sintesis Reppe ( polimerisasi alkena menghasilkan benzene atau siklooktatetraena).
Pd Digunakan untuk reaksi hidrogenasi
PdCl2 Pada proses Wacker untuk mengubah etilena menjadi methanol Cu Digunakan pada proses langsung untuk pembuatan (CH3)2SiCl2 CuCl2 Pada proses Deacon untuk membuat Cl2 dari HCl (Lee, J.D., 1994)
Salah satu kegunaan yang penting dari unsur-unsur transisi dalam reaksi katalitik adalah untuk mengatomisasi molekul-molekul diatomik dan menyalurkan atom-atom tersebut pada reaktan yang lain dan reaksi intermediet. Gas H2, O2, N2 dan Co adalah molekul diatomik yang penting. Kekuatan ikatan H, O, N dan C pada permukaan logam-logam transisi memberikan daya dorong temodinamik untuk atomisasi dan juga untuk pelepasan atom dalam reaksi dengan molekul-molekul yang lain. Permukaan logam juga memiliki sifat-sifat yang unik lainnya yang dapat mengkatalisis serangkaian reaksi-reaksi kompleks yang dimulai dengan disosiasi adsorbsi yang diikuti dengan penataan ulang kompleks melalui formasi dan pemutusan ikatan, yang terakhir proses adsorbsi dari produk (Hegedus, dkk. 1987)
2.6 Paladium Sebagai Katalis.
Paladium yang terletak pada golongan VIII B golongan logam transisi memiliki konfigurasi elektron (Kr) 4d10, 5s0. Berwarna agak putih keperakan dan merupakan
anggota dari logam platinum bersama dengan Platinum, Rhodium, Ruthenium, Iridium, dan paladium adalah salah satu logam mulia yang mudah mengalami korosi ketika terkena panas. Paladium banyak digunakan sebagai katalis. perhiasan dan juga digunakan sebagai salah satu bahan reaktor nuklir.
Salah satu senyawa paladium yang dapat digunakan sebagai katalis adalah paladium klorida PdCl2. Paladium klorida berupa padatan brwarna merah. Dalam tipe α, atom paladium yang berkoordinasi empat membentuk rantai 1-dimensi dengan jembatan ganda klorin. Dihidratnya menyerap air dan larut dalam air, etanol, aseton, dsb.
Bila PdCl2 dilarutkan dalam asam klorida, akan terbentuk [PdCl4]2- berkoordinasi empat bujur sangkar. PdCl2 digunakan dalam katalis proses Wacker dan juga sebagai katalis dalam berbagai reaksi organik. Salah satu diantaranya adalah pembuatan etanal dari etena. Reaksi yang terjadi adalah sebagai berikut :
(Miessler, 1990) Salah satu bidang yang penting dalam kimia anorganik saat ini antara lain sintesis organik yang menggunakan senyawa kompleks dan organologam, katalis homogen, bioanorganik untuk mengelusidasi reaksi biologis yang melibatkan logam dan mempelajari sifat padatan seperti katalisis padatan, hantaran, kemagnetan dan sifat optis.