PENELITIAN PERTANIAN TANAMAN PANGAN VOL. 27 NO. 3 2008
Efikasi Isolat
Pseudomonas fluorescens
terhadap
Penyakit Rebah Semai pada Kedelai
Mudji Rahayu
Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian Jl. Kendalpayak, km 8, PO Box 66 Malang, Jawa Timur
ABSTRACT. Efficasy of Pseudomonas fluorescens (Pf) Isolates to Control Seedling Damping off on Soybean. The antagonist microorganism i.e. Pseudomonas fluorescens was reported as having potential as a biocontrol agent against Sclerotium rolfsii, the causal agent of damping-off or wilt disease of soybean. This research was carried out in laboratory and greenhouse of ILETRI Malang in May to November 2006. Laboratory trial evaluated a total of five Pf isolates, collected from soybean rhizosphere, were assayed in dual cultures on PDA for their ability to inhibit in-vitro hyphal growth of S. rolfsii. Greenhouse trial consisted of two factor treatments, arranged in complete block design with three replications. First factor was application methods, namely: Pf as soil application, seed-coating, and seed-coating + soil application. The second factor was Pf concentrations, namely: 105 cfu/ml, 107 cfu/ml, and 109 cfu/ml. Results showed that four P. fluorescens isolated from soybean rhizosphere effectively inhibited the growth of S. rolfsii with 56-62% inhibition. The most effective isolate namely Pf-d, was used in greenhouse trial, indicated a significant control to the disease. Disease incidence on soil application method with various Pf concentrations was low (6.67%) as compared to that of untreated, which reached 47% on 16-21 days plant age. The same treatments reduced both the number and the germination rate of propagating organ, namely sclerotia in the soil. P. fluorescens, therefore could be expected as an effective antagonist micro organism to S. rolfsii.
Keywords: Biological control, Pseudomonas fluorescens, Sclerotium rolfsii, damping-off, soybean
ABSTRAK. Mikroorganisme antagonis seperti Pseudomonas fluorescens sangat potensial sebagai agensia pengendali hayati Sclerotium rolfsii, salah satu patogen penyebab penyakit rebah semai atau layu pada kedelai. Penelitian untuk mengetahui daya antagonis lima isolat Pf asal rizosfer kedelai, dan aplikasi isolat terpilih untuk menekan penyakit rebah S. rolfsii pada kedelai dilakukan di laboratorium dan rumah kaca Balitkabi, Malang, pada Mei-November 2006. Penelitian di rumah kaca terdiri atas dua perlakuan menggunakan rancangan acak kelompok dengan tiga ulangan. Faktor pertama adalah cara aplikasi Pf, yaitu aplikasi pada tanah, penyelaputan pada benih, dan penyelaputan benih + aplikasi pada tanah. Faktor kedua adalah konsentrasi bakteri yaitu 105 cfu/ml, 107 cfu/ml, dan 109 cfu/ml. Dari penelitian ini didapatkan empat isolat P. fluorescens asal rizosfer tanaman kedelai, yang memiliki daya antagonis tinggi terhadap S. rolfsii, dengan daya hambat 56-62%. Isolat dengan daya hambat tertinggi yaitu Pf-d yang selanjutnya diaplikasikan di rumah kaca, ternyata mampu menekan penyakit rebah semai hingga 6,7%. Sementara itu pada kontrol (tanpa pengendalian), intensitas penularan penyakit lebih tinggi, lebih dari 45%. Aplikasi Pf melalui ke tanah dikombinasi dengan konsentrasi tinggi (109 cfu/ml) lebih baik pengaruhnya dalam menekan penyakit. Di samping itu, aplikasi Pf melalui tanah menghambat pertumbuhan organ pembiakan patogen, yaitu sklerosia di tanah.
Kata kunci: Pengendalian hayati, Pseudomonas fluorescens, Sclerotium rolfsii, rebah semai, kedelai
R
ebah semai yang disebabkan oleh jamurSclerotium rolfsii merupakan penyakit penting tanaman kedelai, terutama pada musim hujan atau pada lahan yang drainasenya buruk. Infeksi S. rolfsiipada kedelai biasanya mulai terjadi di awal pertumbuhan tanaman dengan gejala busuk kecambah atau rebah semai. Pada tanaman kedelai berumur yang lebih tua 2-3 minggu, gejalanya berupa busuk pangkal batang dan layu, pada bagian terinfeksi terlihat bercak berwarna coklat pucat dan di bagian tersebut tumbuh miselia jamur berwarna putih (Punja 1988; Semangun 1993).
Kehilangan hasil kedelai akibat infeksi S. rolfsii di Indonesia diperkirakan mencapai 2.500 t/tahun. Di Nusa Tenggara Barat, intensitas kerusakan tanaman kedelai yang terinfeksi patogen tular tanah seperti S. rolfsii, Fusarium solani, dan Pythium sp. dapat mencapai 35% (Sudantha 1997). Di Amerika Serikat kehilangan hasil akibat infeksi cendawan ini mencapai 9.200 ton (Wrather et al. 2001).
Pengendalian S. rolfsii selama ini hanya secara mekanis dengan mencabut dan membuang tanaman yang sakit. Cara pengendalian tersebut kurang efektif karena patogen masih mampu bertahan lama di dalam tanah, dengan membentuk organ pembiakan, yaitu sklerosia. Sklerosia merupakan pemampatan dari himpunan miselia jamur, warnanya kecoklatan, berbentuk butiran kecil dengan diameter 1 mm, berkulit keras, dan mampu bertahan lama (dorman) di tanah dan residu tanaman. Punja (1988) menyatakan bahwa
S. rolfsii dapat dikendalikan melalui beberapa cara seperti aplikasi fungisida, solarisasi tanah, rotasi tanaman, dan penggunaan mikroorganisme antagonis dalam upaya pengendalian penyakit secara hayati.
Saat ini pengendalian hayati semakin mendapat perhatian dalam perlindungan tanaman dari serangan organisme pengganggu. Pengendalian hayati adalah cara pengendalian yang ramah lingkungan dan prospektif dikembangkan untuk mengurangi peng-gunaan fungisida kimia yang semakin mahal. Dalam pengendalian hayati digunakan berbagai jenis mikroba yang bersifat antagonis terhadap patogen, sehingga mampu berperan sebagai biopestisida. Mikroba antagonis secara alami telah ada di lingkungan habitat
tanaman, sehingga dapat dieksplorasi. Machmud et al. (2002) telah mengoleksi lebih dari 250 isolat alami ber-bagai mikroba antagonis yang potensial dikembangkan sebagai biopestisida meliputi jenis jamur, bakteri, dan mikroba kitinolotik (kamir). Bakteri berpigmen fluoresen
Pseudomonas fluorescens adalah salah satu mikroba antagonis yang intensif diteliti manfaatnya sebagai agensia hayati. Kemampuannya menekan patogen tanaman karena mampu memproduksi senyawa metabolit seperti siderofor fluoresen, antibiotik, atau enzim-enzim ekstraselluler yang toksik terhadap patogen (Hamdan et al. 1991; Bagnasco et al. 1998).
Keberhasilan pengendalian hayati sangat di-pengaruhi oleh daya antagonis atau daya hambat yang dimiliki suatu isolat, atau jumlah inokulum yang digunakan, dan cara aplikasinya (Cook and Baker 1996). Leeman et al. (1995) menyatakan bahwa aplikasi P. fluorescens melalui penyelaputan benih (seed coating), sangat sesuai dan praktis untuk pengendalian patogen tular tanah. Masalah yang perlu mendapat perhatian dalam penggunaan P. fluorescens selain daya hambat yang harus tinggi, adalah konsentrasi aplikasi yang efektif. Tujuan penelitian adalah untuk mendapatkan isolat
P. fluorescens asal rizosfer kedelai yang mampu menekan
S.rolfsii secara in vitro dan mempelajari pengaruh cara aplikasi dan konsentrasi P. fluorescens terhadap penularan S. rolfsii pada tanaman kedelai.
BAHAN DAN METODE
Penelitian dilaksanakan di laboratorium dan rumah kaca Balai Penelitian Tanaman Kacang-kacangan dan Umbi-umbian, Malang, pada bulan Mei-November 2006. S. rolfsii diisolasi dari tanaman kedelai sakit di lapangan. Jamur dipelihara berupa kultur murni pada media potato dextrose agar (PDA) di cawan.
Bakteri antagonis P.fluorescens diisolasi dari tanah yang diambil dari rizosfer kedelai di KP Kendalpayak-Malang. Isolasi, identifikasi dan uji daya antagonis Pf secara in vitro dilakukan dengan pengambilan contoh tanah secara acak dengan pola diagonal di petakan lahan. Tanah diambil dari rizosfer tanaman sehat pada kedalaman 5-15 cm, dengan tiga titik pengambilan/ petak. Kemudian tanah dicampur sehingga didapatkan 0,5 kg tanah/petak, dan dimasukkan ke kantung plastik. Isolasi dilakukan dengan menimbang 10 g contoh tanah, dimasukkan pada erlenmeyer yang berisi 90 ml larutan buffer fosfat 0,1 M dengan pH 7,0 selanjutnya dicampur larutan pepton 0,1%. Larutan tersebut dikocok selama 5 menit menggunakan vortex, lalu diendapkan, supernatan dipisahkan dan diencerkan
secara seri dengan tingkat pengenceran 1:10.000. Supernatan sebanyak 1 ml dibiakkan pada media King’s B dalam cawan dan diinkubasi pada suhu kamar selama 48 jam. Koloni-koloni bakteri yang tumbuh diamati di bawah sinar ultraviolet (UV) dengan panjang gelombang 366 nm (UV tipe Gamac). Koloni yang termasuk kelompok fluorescens akan memancarkan sinar hijau-kebiruan, selanjutnya dimurnikan dan diamati karakternya, meliputi pendaran pigmen fluoresen, reaksi oksidatif fermentatif (OF), dan uji KOH 3% untuk mengetahui penggolongan reaksi Gram dari isolat P. fluorescens
(Schaad 1988).
Daya antagonis dari setiap isolat P. fluorescens diuji dengan metode kultur oposisi antara koloni isolat Pf melawan S. rolfsii pada media King’s B dalam cawan pembiakan. Sebagai perlakuan adalah lima isolat Pf (Pfa, Pfb, Pfc, Pfd, Pfe), satu kontrol tanpa Pf (S. rolfsii murni), sehingga seluruhnya terdapat enam perlakuan. Percobaan dilaksanakan dengan rancangan acak lengkap dengan lima ulangan. Inokulum P. fluorescens
dan S. rolfsii, masing-masing berupa kultur murni berumur 48 jam dan 7 hari pada media PDA, disiapkan dengan menggunakan cork borer sehingga terbentuk koloni berdiameter 5 mm. Koloni tersebut ditumbuhkan secara berlawanan pada cawan berisi media PDA.
Pengamatan jari-jari koloni S. rolfsii diamati setiap hari. Penghambatan jamur dihitung dengan rumus berikut:
R1 – R2 I = x 100%
R1 I = Daya hambat (%)
R1 = Jari-jari koloni S. rolfsii yang arahnya berlawanan dengan koloni P. fluorescens
R2 = Jari-jari koloni S. rolfsii yang arahnya menuju pusat koloni P. fluorescens
Uji Daya Antagonis secara in Planta
Isolat yang tertinggi daya hambatnya terhadap S.rolfsii
selanjutnya diuji di rumah kaca untuk mengendalikan penyakit layu S. rolfsii pada kedelai. Perlakuan terdiri atas dua faktor yaitu: 1) cara aplikasi Pf (A) meliputi A1 = aplikasi langsung ke tanah, A2 = aplikasi dengan cara penyelaputan benih, A3 = aplikasi langsung ke tanah dan penyelaputan benih; 2) konsentrasi Pf (K) terdiri atas tiga taraf yaitu K1 = konsentrasi 105 cfu/ml, K2 =
konsentrasi 107 cfu/ml, K3 = konsentrasi 109 cfu/ml. Pada
uji ini terdapat 10 perlakuan termasuk kontrol (tanpa pengendalian). Percobaan dilaksanakan dengan rancangan acak kelompok dengan tiga ulangan.
Media tanam adalah campuran tanah dan kompos organik (30 g kompos/kg tanah), dan disterilkan menggunakan uap panas. Tanah steril selanjutnya dimasukkan ke dalam polybag diameter 30 cm sebanyak 5 kg/polybag. Patogen S. rolfsii diinokulasikan pada media tanah tersebut. Kedelai ditanam dua biji/lubang dengan jumlah biji 30/polybag untuk setiap perlakuan.
S. rolfsii untuk bahan penularan penyakit diper-banyak secara massal pada media organik, yaitu campuran sekam dan gabah (perbandingan 3: 7). Media dimasukkan ke dalam erlenmeyer sebanyak 150 g, dan setelah ditambah 5 ml air pepton 5% kemudian disteril-kan dalam autoclave. Setelah dingin media diinokulasi dengan kultur murni S. rolfsii, dan diinkubasi dalam suhu kamar selama sekitar seminggu. Apabila telah nampak koloni jamur berwarna putih tumbuh pada media tersebut, maka biakan massal siap diinokulasikan pada tanah steril di dalam polybag. Inokulasi dilakukan pada 7 hari sebelum tanam kedelai, dengan memberikan 15 g/polybag dan dibenam dalam tanah.
Isolat P. fluorescens hasil seleksi pada penelitian in vitro dikulturkan pada media cair Kings’ B 5% dengan kosentrasi sesuai yang ditentukan dalam perlakuan. Inokulum tersebut diinkubasi selama 2 x 24 jam, selanjutnya diaplikasikan pada tanaman kedelai dengan tiga cara aplikasi:
1. Aplikasi P. fluorescens melalui tanah
Kultur murni Pf diencerkan dengan air steril hingga dicapai konsentrasi 105cfu/ml
,konsentrasi 10
7 cfu/ml ,
konsentrasi 109 cfu/ml sesuai perlakuan. Volume aplikasi
untuk masing-masing konsentrasi adalah 200 ml/ polybag. Waktu aplikasi adalah dua hari sebelum tanam kedelai dengan cara disiramkan ke tanah.
2. Aplikasi P. fluorescens dengan cara penyelaputan benih
Benih kedelai sebelum ditanam terlebih dahulu diper-lakukan dengan P. fluorescens dengan cara pe-nyelaputan. Setelah itu 10 ml suspensi Pf dicampurkan pada benih, kemudian ditambahkan talk secukupnya dan diaduk rata agar lebih merekat. Sebagai kontrol adalah benih tanpa perlakuan. Hasil akhir adalah benih kedelai dilapisi pasta bakteri antagonis Pf (Rahayu 2006). 3. Aplikasi P.fluorescens melalui penyelaputan benih
dikombinasi dengan aplikasi pada tanah
Selanjutnya tanaman dipelihara dengan pengairan yang cukup menggunakan air PAM. Peubah yang diamati adalah:
1. Penularan penyakit rebah
Pengamatan dilakukan mulai 7 hari setelah tanam hingga beberapa waktu sampai jumlah tanaman rebah atau layu stabil. Persentase penyakit dihitung menggunakan rumus:
a
i = x 100% a + b
i = Persentase penyakit (%) a = Jumlah tanaman sakit b = Jumah tanaman sehat
2. Jumlah sklerosia dan perkecambahan sklerosia Pengamatan sklerosia dilakukan satu bulan setelah tanam (akhir penelitian) dengan cara mencabut seluruh tanaman di polybag. Pengamatan dilakukan dengan pengambilan sampel tanah sebanyak 10g/polybag, kemudian dihitung jumlah sklerosianya menggunakan
wet sieving technique (Punja et al. 1985). Tanah sampel dicuci dengan air mengalir dalam ayakan berdiameter 600 m, hasil ayakan dimasukkan dalam cawan dan dikeringanginkan. Sklerosia diambil dengan mengguna-kan pinset dimasukmengguna-kan ke dalam cawan petri yang lain dan dihitung. Selanjutnya organ pembiakan tersebut dikecambahkan, dari setiap perlakuan diambil 25 butir untuk diinokulasikan (ditanam) pada media PDA dalam cawan. Perkecambahan ditandai oleh munculnya hifa berwarna putih. Persentase perkecambahan dihitung menggunakan rumus:
a
b = x 100% a + b
b = Persentase perkecambahan a = Sklerosia yang berkecambah b = Sklerosia yang tidak berkecambah
HASIL DAN PEMBAHASAN
Karakteristik Isolat P. fluorescensPada uji pigmen fluoresen dari kelima isolat Pf nampak pendaran koloni berwarna hijau kebiruan, dengan kategori 5 B 7/1 (green blue) menurut indikator warna dalam Munshle Soil Color Chard. Ciri khas P. fluorescens
adalah kemampuannya memproduksi siderofor fluoresen ke dalam media King’s B yang nampak berpendar dengan warna hijau kebiruan bila dipapar sinar ultra violet. Siderofor adalah senyawa organik
ekstraseluler dengan berat molekul rendah dengan afinitas yang sangat kuat terhadap Fe, larut dalam air, berpendar di bawah penyinaran ultra violet, dan berperan sebagai antibiotik sehingga bermanfaat sebagai biokontrol untuk mengendalikan patogen (Howell and Stipanovic 1980; Bagnasco et al. 1998).
Hasil pengamatan reaksi Gram dengan mengguna-kan larutan KOH 3% menunjukmengguna-kan adanya massa bakteri yang kental, yang menunjukkan bahwa kelima isolat Pf bereaksi Gram negatif. Schaad (1988) menyatakan bahwa terbentuknya benang-benang kental suatu massa bakteri disebabkan oleh dinding sel bakteri hancur karena pengaruh KOH 3%. Pada uji oksidatif-fermentatif didapatkan reaksi bersifat oksidatif yang ditandai oleh perubahan warna koloni isolat Pf menjadi kuning pada media yang tidak ditutup dengan WA (water agar), dan tidak terjadi perubahan warna pada media tanpa WA. Perubahan warna merupakan reaksi bakteri terhadap oksigen yang diserapnya. P. fluorescens
termasuk bakteri aerob, menggunakan oksigen dalam metabolismenya sebagai aseptor elektron terminal.
Pf dapat diisolasi dari risosfer kedelai, mudah dibiakkan dan diidentifikasi dengan cepat karena pada media King’s B memproduksi siderofor fluoresen yang nampak secara visual berupa pendaran warna kehijauan di bawah penyinaran ultra violet (Alabouvette 1991). Kemampuan menghasilkan pigmen ini menjadi salah satu kriteria dalam memilih Pseudomonas yang bermanfaat, karena pigmen tersebut biasanya dikeluar-kan oleh jenis-jenis Pseudomonas yang menghasilkan antibiotik.
Antagonisme P.fluorescens terhadap S. rolfsii
secara in vitro
Pada penelitian in vitro, antagonisme P. fluorescens
terhadap S. rolfsii secara visual nampak sebagai zona bening yang terbentuk di sekitar koloni isolat Pf pada kultur oposisi dalam cawan. Zona tersebut mencermin-kan adanya suatu memencermin-kanisme antibiosis dari senyawa yang terdifusi dalam media, dan bersifat antijamur sehingga menghambat pertumbuhan koloni S. rolfsii. Penggunaan media PDA pada penelitian ini dengan pertimbangan media tersebut kaya nutrisi, sehingga dapat mengeliminasi terjadinya kompetisi antarmikroba. Dinyatakan oleh Edwards et al. (1994) bahwa antibiosis merupakan mekanisme yang umum terjadi pada bakteri antagonis akibat senyawa antibiotik yang dihasilkannya.
P. fluorescens mampu menghasilkan senyawa antibiotik seperti pyoluteorin (Howell and Stipanovic 1980), siderofor fluoresen, fenazin karboksilat, pyoverdin (Hamdan et al. 1991; Tomashow and Weller 1996) yang bersifat menghambat dan mematikan patogen.
Di antara kelima isolat Pf terdapat perbedaan daya hambat yang berkisar antara 18,4-62,0%. Isolat Pf-d sejak awal pengamatan menunjukkan daya hambat tertinggi mencapai 34,5%, kemudian meningkat menjadi 48,7% pada 3 hari setelah inkubasi (Tabel 1). Pada pengamatan terakhir (4 HSI), isolat Pf-d konsisten menunjukkan daya hambat tertinggi hingga mencapai 62,0%. Dari penelitian
in vitro ini didapatkan empat isolat P. fluorescens yang efektif dengan daya hambat lebih dari 50%, masing-masing adalah isolat Pf-a, Pf-b, Pf-c, dan Pf-d.
Interaksi mikroba tanah seperti P. fluorescens
dengan jamur tular tanah S. rolfsii menyebabkan jamur tersebut dirugikan karena pertumbuhannya dihambat, bentuk interaksi tersebut dinyatakan sebagai anta-gonisme (Graham and Mitchel 1998).
Penekanan P. fluorescens terhadap Penyakit Rebah Semai
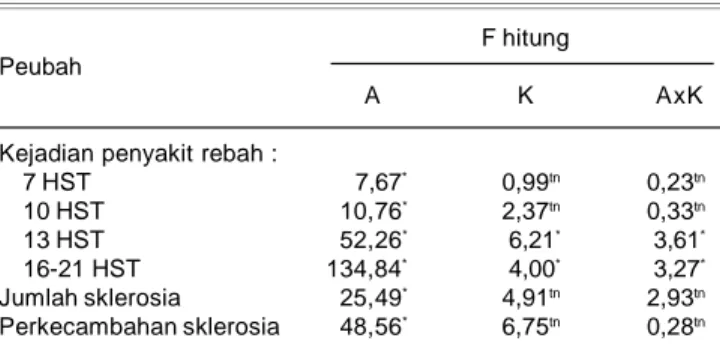
Infeksi S. rolfsii pada fase awal pertumbuhan kedelai berupa tanaman rebah atau layu. Hasil analisis peubah persentase penularan penyakit, jumlah sklerosia di tanah, dan perkecambahan sklerosia menunjukkan pengaruh nyata dari inokulasi Pf (Tabel 2). Cara aplikasi (A), konsentrasi Pf (K), dan interaksi A x K berpengaruh nyata terhadap peubah persentase penyakit rebah. Pada pengamatan 16-21 HST, penularan penyakit relatif tidak berubah, karena itu pengamatan diakhiri. Dinyatakan oleh Semangun (1993) bahwa tanaman berumur 2-3 minggu adalah masa rentan tanaman kedelai terhadap jamur tular tanah S. rolfsii.
Penularan Penyakit Rebah
Pada perlakuan kontrol rata-rata penularan S. rolfsii ber-kisar antara 10-47% (pada 21 HST), sedang pengendalian hayati menggunakan Pf pada berbagai perlakuan Tabel 1. Daya hambat lima isolat P. fluorescens terhadap S. rolfsii
secara in vitro. Balitkabi Malang, 2006. Daya hambat (%) Isolat Pf
1 HSI 2 HSI 3 HSI 4 HSI
Pf-a 30,3b 33,8b 46,3b 60,4c
Pf-b 24,8bc 36,2b 55,1b 60,4c
Pf-c 27,7bc 37,1b 54,1b 57,0c
Pf-d 34,5c 48,7c 53,8b 62,0c
Pf-e 18,4b 18,6c 20,1a 24,3b
Kontrol 4,6a 8,6c 6,2a 4,7a
Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata pada P = 0,05.
Kontrol = Perlakuan S. rolfsii tanpa Pf. HSI = hari setelah inkubasi
berpengaruh pada rendahnya penularan penyakit rebah S. rolfsii yang berkisar antara 6,7-28,9%.
Penularan terendah 6,7% terjadi pada perlakuan A1K3 yaitu aplikasi melalui tanah dengan konsentrasi tinggi 109 cfu (sel hidup)/ml (pada pengamatan 13 HST.
Selanjutnya hingga tanaman umur 16-21 HST penularan penyakit tidak mengalami kenaikan (stabil). Penularan tertinggi 28,9% didapatkan pada perlakuan penyelaputan benih dengan konsentrasi 105 cfu/ml. Perlakuan yang
paling menekan penyakit rebah adalah aplikasi Pf melalui tanah dengan konsentrasi tinggi 109 cfu/ml
(Gambar 1). Dengan cara aplikasi tersebut, bakteri P. fluorescens dapat lebih cepat beradaptasi di lingkungan tanah. Di samping itu aplikasi dengan konsentrasi tinggi akan meningkatkan populasi bakteri antagonis tersebut Gambar 1. Tingkat penularan penyakit rebah semai pada tanaman
kedelai.
A1 = aplikasi Pf melalui tanah, A2 = Pf pada benih,
A3 = Pf melalui tanah & benih. K1 = konsentrasi 105 cfu/ml, K2 = 107 cfu/ml, K3 = 109 cfu/ml.
Kontrol = diinokulasi S. rolfsii tanpa pengendalian
Tabel 2. Nilai F hitung masing-masing peubah pada uji P. fluorescens untuk pengendalian hayati penyakit rebah S. rolfsii pada kedelai. Rumah Kaca, Balitkabi Malang, 2006.
F hitung Peubah
A K AxK
Kejadian penyakit rebah :
7 HST 7,67* 0,99tn 0,23tn 10 HST 10,76* 2,37tn 0,33tn 13 HST 52,26* 6,21* 3,61* 16-21 HST 134,84* 4,00* 3,27* Jumlah sklerosia 25,49* 4,91tn 2,93tn Perkecambahan sklerosia 48,56* 6,75tn 0,28tn HST = hari setelah tanam, * = nyata; tn = tidak nyata;
A = cara aplikasi; K = konsentrasi,
AxK = interaksi antara faktor cara aplikasi dan konsentrasi Pf.
di tanah. Howel dan Stipanovic (1980) menyatakan bahwa konsentrasi suspensi P. fluorescens pada kisaran 1,25 x 105 hingga 109 cfu/g, dapat mencegah penularan
jamur tular tanah Pythium ultimum pada tanaman kapas.
Perkembangan Sklerosia
Viabilitas organ pembiakan S. rolfsii di tanah, dari peubah jumlah dan perkecambahan sklerosia, hanya dipengaruhi oleh cara aplikasi Pf (Tabel 2). P. fluorescens yang diaplikasikan melalui tanah dan kombinasinya dengan penyelaputan benih, masing-masing mampu menekan jumlah sklerosia yang terbentuk di tanah (10,33 butir dan 12,22 butir/10 g tanah) dan menekan perkecambah-an sklerosia (6,9% dperkecambah-an 8,6%). Pada perlakuperkecambah-an kontrol tanpa pengendalian kedua peubah tersebut mencapai nilai tertinggi (Tabel 3).
Aplikasi Pf dengan cara penyelaputan benih masih menunjukkan jumlah sklerosia lebih tinggi (19 butir/10g tanah) demikian juga perkecambahan sklerosia yang mencapai 12,9%. Penyelaputan benih ternyata belum mampu menekan viabilitas organ pembiakan S. rolfsii.
Hal itu mengindikasikan bahwa aplikasi pada benih hanya memberi perlindungan bagi benih dari patogen yang terdekat dengan benih, sedang patogen yang relatif jauh menyebar di tanah tetap viabel, mampu mencapai kemasakan dan berkecambah dengan nilai lebih tinggi. Pemanfaatan isolat Pf asal rizosfer kedelai dari penelitian ini memberi harapan cukup baik dalam upaya pengendalian hayati penyakit tular tanah seperti S. rolfsii. Aplikasi isolat Pf-d (yang paling antagonis secara in vitro) pada konsentrasi 105-109 cfu/ml dengan cara aplikasi
melalui tanah cukup baik pengaruhnya dalam menekan penyakit rebah kedelai hingga tingkat 6,7%. Antagonisme
in planta tersebut nampak belum optimal menekan S. rolfsii, karena organ pembiakan patogen masih viabel di rizosfer. Sudadi (2005) menyatakan masih terdapat beberapa kesulitan dalam pemanfaatan mikroba tanah sebagai biopestisida untuk mengendalikan penyakit asal tanah. Di samping itu belum ada metodologi yang baik 0 5 10 15 20 25 30 35 40 45 50 A1K1
Cara aplikasi (A) dan konsentrasi pf (K)
S e ra n g a n p e n y a k it (% ) P1 (7 HST) P2 (10 HST) P3 (13 HST) P4 (16-21 HST)
A1K2 A1K3 A2K1 A2K2 A2K3 A3K1 A3K2 A3K3 Kontrol 0 5 10 15 20 25 30 35 40 45 50 A1K1
Cara aplikasi (A) dan konsentrasi pf (K)
S e ra n g a n p e n y a k it (% ) P1 (7 HST) P2 (10 HST) P3 (13 HST) P4 (16-21 HST) P1 (7 HST) P2 (10 HST) P3 (13 HST) P4 (16-21 HST)
A1K2 A1K3 A2K1 A2K2 A2K3 A3K1 A3K2 A3K3 Kontrol
Tabel 3. Pengaruh P. fluorescens (Pf) terhadap jumlah organ sklerosia dari S. rolfsii dan persentase perkecambahan sklerosia. Rumah Kaca, 2007.
Cara aplikasi Organ Slerosia Perkecambahan P. fluorescens (Pf) (butir/10 g tanah) (%)
A1 (melalui tanah) 10,3 a 6,9 a
A2 (penyalutan pada benih) 19,0 b 12,9 b A3 (melalui tanah & benih) 12,2 a 8,6 a
Kontrol tanpa Pf 33,0 c 89,3 c
Angka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata pada P = 0,05.
untuk pengujian antagonisme di dalam tanah. Walau-pun penyakit rebah kedelai belum dapat ditekan tuntas, mikroba antagonis yang efektif memiliki prospek yang baik untuk dikembangkan sebagai pengendali ramah lingkungan pada komoditas kedelai. Menurut Suwanto (1994), pengendalian hayati adalah cara aman karena mikroorganisme antagonis yang digunakan tidak terakumulasi dalam rantai makanan, dan kemungkinan adanya proses reproduksi secara alamiah dari mikro-organisme yang digunakan.
KESIMPULAN
Pf yang diaplikasikan melalui tanah dengan konsentrasi tinggi (109 cfu/ml) berpengaruh positif dalam menekan
S. rolfsii. Aplikasi Pf juga menghambat perkembangan sklerosia dalam tanah.
Pf memiliki prospek untuk dikembangkan sebagai alternatif pengendalian ramah lingkungan terhadap penyakit rebah S. rolfii pada kedelai.
DAFTAR PUSTAKA
Alabouvette, C. 1991. Suppresive soils and practical application of biological control of Fusarium disease. In: The biological control of plant disease. Food and Fertilizer Technology Centre for the Asian and Pasific Regions. USA. p:120-126.
Cook, R.J. and K.F. Baker. 1996. The nature and practice of biological control of plant pathogens. APS Press. The American Phytophatological Society. St Paul. Minnesota, USA. 539 p.
Bagnasco, P., L. De La Fuente, G. Gualtieri, F. Noya, and A. Arias. 1998. Fluorescent Pseudomonas spp. as biocontrol agents against forage legume root pathogenic fungi. Soil Biology and Biochemistry 30:1317-1322.
Departemen Pertanian. 1997. Upaya pencapaian swasembada kedelai. Jakarta. 154 p.
Edward, S.G., T. McKay, and B. Seddon. 1994. Interaction of Bacillus species with phytopathogenic fungi-Methods of analysis and manipulation for biocontrol purposes. In: J.P. Blakeman and B. Williamson (Eds). Ecology of plant pathogens. p.101-118. CAB International, Oxon, UK.
Graham, J.H. and D.J. Mitchel. 1998. Biological control of soilborne plant pathogens and nemathodes. In: D.M. Sylvia, J.
Fuhrmann, P.G. Hartel, and D.A. Zuberer (Eds). Principles and applications of soil microbiology. Prentice-Hall Inc. New Jersey. p.427-446.
Hamdan, H. D.M. Weller, and L.S. Thomashow. 1991. Relative importance of fluorescent siderophores and other factors in biological control of Gaeumannomyces graminis var. tritici
by Pseudomonas fluorescens 2-79 and M4-80. Appl. Environ.
Microbiol. 57:3270-3277.
Howell, C.R. and R.D. Stipanovic. 1980. Supression of pytium
ultimum induced damping-off of cotton seedling by
Pseudomonas fluorescens and its antibiotic pyoluteorin.
Phytopathol. 70:712-715.
Leeman, M., J.A. van Velt, M.J. Hendrieck, R.J. Schiffer, P.A.H.M. Baker, and B. Schippers. 1995. Biocontrol of Fusarium wilt of radish in comercial greenhouse trials by seed treatment with
Pseudomonas fluorescens 374. Phytopath. 85:1301-1305.
Machmud, M., Jumanto, I. Manzila, M.A. Suhendar, dan M. Sudjadi. 2002. Koleksi dan karakterisasi mikroba antagonis. Laporan kegiatan penelitian tahun 2002. Balai Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. 13 p.
Punja, Z.K. 1988. Sclerotium (Athelia) rolfsii, a pathogen of many plant species. Advances in Plant Pathology. 6:523-535. Rahayu, M. 2006. Antagonisme antara dua isolat Pseudomonas
fluorescens dengan Sclerotium rolfsii dan Rhizoctonia solani
serta pengaruhnya terhadap penyakit rebah kedelai. Agrivita 28:79-86.
Schaad, N. W. 1988. Laboratory Guide for Identification of plant pathogenic bacteria. Second Edition. APS Press. USA. 160p. Semangun, H. 1993. Penyakit-penyakit tanaman pangan di Indonesia. Gadjah Mada University Press. Yogyakarta. 449 p. Sudadi. 2005. Interaksi mineral lempung-bahan organik-mikroba tanah. Pengaruh terhadap antagonisme dan pemanfaatannya dalam pengendalian hayati penyakit tanaman sal tanah. Jurnal Ilmu Tanah dan Lingkungan 5(1):18-29.
Sudantha, I.M. 1997. Pengendalian patogen tular tanah pada tanaman kedelai secara hayati menggunakan bahan organik
dan Trichoderma harzianum. Prosiding Kongres Nasinal XIV
dan Seminar Nasional. Perhimpunan Fitopatologi Indonesia. Palembang. 444 p.
Suwanto, A. 1994. Mikroorganisme untuk biokontrol. Strategi penelitian dan penerapan dalam bioteknologi pertanian. Agrotek 2:40-46.
Tomashow, L.S. and Weller. 1996. Molecular basis of pathogen supression by antibiosis in the rhizosphere. APS Press The American Phytophatological So. St Paul. Minnesota, USA. p. 80-103.
Wrather, J.A., T.R. Anderson, D.M. Arsyad, Y. Tan, L.D. Ploper, A. Porta-Pugila, H.H. Ram, and J.T. Yorinori. 2001. Soybean disease loss estimates for the top ten soybean producing countries in 1998. Can.J.Plant Pathol. 23:115-121