ISOLASI DAN KONJUGASI IMUNOGLOBULIN BURUNG
UNTA DENGAN
Horseradish peroxidase
(Isolation and Conjugation Ostrich Anti Immunoglobulin with
Horseraddish
peroxidase
)
ADIN PRIADI danLILY NATALIA
Balai Penelitian Veteriner, PO Box 151, Bogor 16114
ABSTRACT
Ostriches was farmed in Indonesia and the population reached 300.000 in mid 1997. As the rearing system intensified, health monitoring became an integral part of ostrich production. Enzyme-linked immunosorbent assay was usually used as a monitoring and diagnosis test. However, the use ELISA as a serological test was hampered by the unavailability of the commercial anti-ostrich immunoglobulin conjugate. To overcome this problem, an attempt to produce rabbit anti-ostrich immunoglobulin labeled with horseradish peroxidase conjugate was initiated. The developed conjugate successfully differentiated reactions among ostrich IgG, chicken IgY and duck IgY.
Key words: Ostriches, conjugate, ELISA
ABSTRAK
Pemeliharaan burung unta (Struthio camelus) sebagai ternak sudah banyak dilakukan di Indonesia dan pada pertengahan 1997 populasinya mencapai 300.000. Seiring dengan perkembangannya di Indonesia, faktor penyakit pada burung unta sudah mendapat banyak perhatian. Salah satu uji yang sering digunakan pemantauan hasil vaksinasi dan peneguhan diagnosis adalah uji serologis enzyme-linked immunosorbent assay (ELISA). Kendala yang sering ditemukan pada penggunaan metoda ELISA adalah sulitnya mendapatkan konjugat anti-immunoglobulin burung unta secara komersial. Untuk mengatasi kendala ini pada penelitian ini telah dilakukan isolasi dan purifikasi immunoglobulin (Ig) burung unta, pembuatan antibodi hiperimun anti imunoglobulin burung unta dan konjugasi anti-imunoglobulin burung unta dengan horseradish peroxidase. Konjugat rabbit-anti immunoglobulin burung unta yang dilabel horseradish peroxidase dapat membedakan dengan jelas reaksi terhadap IgG burung unta, IgY ayam dan itik.
Kata kunci: Burung unta, konjugat, ELISA
PENDAHULUAN
Burung unta (Struthio camelus) adalah hewan yang berasal dari Afrika dan sudah diternakkan selama ratusan tahun di Afrika Selatan (SMIT, 1963). Sejak tahun 1970-1980, permintaan akan kulit dan daging burung unta terus meningkat dengan kecenderungan sistim pemeliharaan bergerak dari jumlah kecil ke peternakan yang besar. Hingga tahun 1996 populasi burung unta di dunia sudah mencapai 1,1 juta ekor (DEEMING dan ANGEL, 1996). Di Indonesia pada pertengahan tahun 1997, populasi burung unta mencapai 300.000 ekor yang tersebar di Jawa Barat dan Nusa Tenggara Timur (BAHARSJAH, 1997).
Dengan makin intensifnya pola peternakan burung unta maka peternak juga mengembangkan pola kesehatan preventif yang meliputi monitoring serologis vaksinasi dan surveilan. Kebanyakan masalah kesehatan burung unta terjadi pada 3 bulan pertama dengan mortalitas dapat mencapai 30-40% (VERWOERD et al., 2000). Survei serologis burung unta di Zimbabwe menunjukkan bahwa serum bereaksi positif terhadap virus turkey rhinotracheitis, newcastle disease, reovirus, infectious bursal disease, encephalomyelitis, reticuloendotheliasis, leucosis, infectious bronchitis dan bakteri Mycoplasma gallisepticum, M. synoviae, Salmonella neteritidis, Pasteurella multocida sama seperti
yang ditemui pada ayam (CADMAN et al., 1994). Pada awal tahun 2000 burung unta di satu peternakan di Jawa Barat mendapat wabah anthrax dan sebanyak 3000 ekor burung unta dimusnahkan (DINAS PETERNAKAN JAWA BARAT, 2000). Vaksinasi yang umum dilakukan pada burung unta adalah vaksinasi antraks, botulismus, clostridial enterotoxemia, pox dan Newcastle disease (ERASMUS dan ERASMUS, 1995). Sebagai tindak lanjut dari vaksinasi, monitoring respon terhadap vaksin sangat diperlukan.
Enzyme-linked immunosorbent assay
(ELISA) merupakan uji serologis yang umum digunakan untuk monitoring penyakit pada burung unta (CADMANet al., 1997; EBELet al.,
2002; DE SOUSAet al., 2000). Karena sulitnya mendapatkan konjugat anti immunoglobulin (Ig) burung unta sebagai reagen ELISA maka pada penelitian ini dilakukan pembuatan konjugat ELISA dengan konjugasi anti imunoglobulin burung unta pada horseradish peroxidase.
MATERI DAN METODE Serum burung unta
Darah diambil dari burung unta yang dipotong di Balai Penelitian Veteriner dan ditampung dalam erlenmeyer. Darah diinkubasi selama 2 jam pada suhu 37oC, kemudian disimpan pada suhu 4oC semalam. Serum dipisahkan dari bekuan darah dengan sentrifugasi selama 15 menit pada 3000 x g dan disimpan pada suhu –20oC hingga digunakan untuk proses isolasi IgG.
Isolasi IgG burung unta
Isolasi IgG dilakukan sesuai dengan metode CADMANet al., (1994) dengan sedikit modifikasi. Sebanyak 36 ml serum burung unta dipresipitasi dengan amonium sulfat jenuh dengan perbandingan 1 : 1. Pelet hasil presipitasi kemudian dicuci 2 x dengan amonium sulfat. Sesudah pencucian, pelet dilarutkan kembali dengan 11 ml phosphate buffer saline (PBS pH 7,2) dan didialisis dengan column buffer (0.02 M Tris, 0,025 M NaCl) selama satu malam. Sebanyak 2 ml dari hasil dialisis difraksinasi melalui kolom DEAE
Affi-Gel Blue. Sepuluh fraksi 4 ml/tabung ditampung dan kandungan protein diestimasi pada absorbance 280 nm dan kandungan protein tiap fraksi dihitung.
Penentuan berat molekul IgG burung unta
IgG yang sudah didialisis dianalisis komposisinya dengan SDS-PAGE. Standar berat molekul protein (Pharmacia) terdiri dari
phosphorylase b (94 kDa), albumin (67 kDa), Ovalbumin (43 kDa), carbonic anhydrase (30 kDa), trypsin inhibitor (20 kDa) dan α -lacalbumin (14,4 kDa). Komposisi IgG burung unta dipisahkan dalam minigel vertical
tereduksi dengan kadar acrylamide 10% menurut metode LAEMMLI (1970).
Konjugate rabbit-anti ostrich IgG dengan enzyme horseradish peroxidase
Sebanyak 0,5 ml IgG burung unta murni diemulsikan dalam Freund’s complete adjuvant dengan perbandingan 1 : 1 disuntikkan pada 2 ekor kelinci. Sebulan sesudah sutikan pertama, kelinci disuntik ulang dengan 0,5 ml IgG yang diemulsikan dalam
Freund’s incomplete adjuvant. Dua minggu sesudah suntikan terakhir, darah kelinci diambil dan serum dipisahkan dengan sentrifugasi. Isolasi serum rabbit anti- IgG burung unta dilakukan dengan presipitasi menggunakan ammonium sulfate. Pelabelan antibodi anti-IgG burung unta dengan enzim peroksidase ilakukan menurut metoda NAKANE dan KAWAOI (1974). Ke dalam 40 mg ensim peroksidase yang dilarutkan dalam 10 ml aquades, ditambahkan 2 ml NaIO4 0,1 M dan dicampur selama 20 menit pada suhu ruangan. Campuran ini kemudian didialisis dengan 1 mM CH3COONa pH 4.4 selama semalam pada suhu 4oC, kemudian pH dinaiKkan hingga 9,0-9,5 dengan menambahkan 600µl sodium karbonat pH 9,5. Pada campuran hasil analisis, segera ditambahkan 80 mg imunoglobulin dalam 10 ml sodium carbonate 0.01 M pH 9,5. Stir selama 2 jam pada suhu ruangan. Tambahkan 1 ml larutan sodium borohydrate
(4 mg/ml aquades). Biarkan selama 2 jam pada suhu ruangan. Campuran kemudian didialisis dalam 0,1 M borate buffer pH 7,4. Konjugat yang terbentuk dicampur dengan gliserol 60%
dalam jumlah sama banyak dan disimpan pada suhu 4oC.
Reaksi silang konjugat rabbit-anti ostrich
(RAO) horseradish peroxidase dengan IgY ayam dan itik
Reaksi silang diamati dengan uji enzyme linked-immunosorbent assay (ELISA). Antigen yang berupa IgG burung unta, IgY ayam dan itik dalam berbagai pengenceran dilapiskan pada mikroplat dengan buffer bicarbonate pH 9,6 dan diinkubasi semalam. Sesudah dicuci dengan PBS-T, mikroplat kemudian diblok dengan PBS-Casein 0,3% selama 1 jam. Sesudah dilakukan pencucian kembali, mikroplat direaksikan dengan konjugat RAO dengan pengenceran 1/500 selama 60 menit. Aktivitas enzim dievaluasi dengan penambahan ABTS dalam buffer sitrat. Reaksi dibaca pada panjang gelombang 414 nm sesudah 60 menit.
HASIL DAN PEMBAHASAN
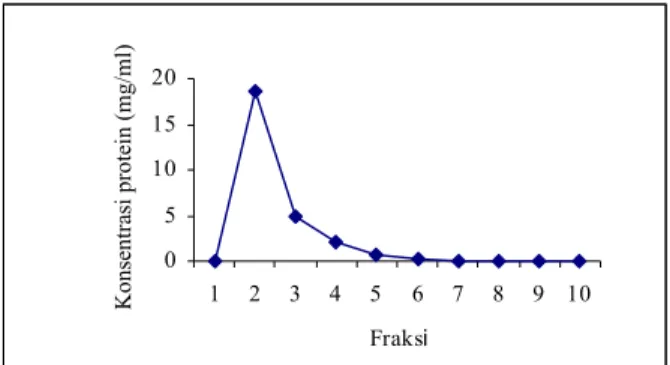
Presipitasi immunoglobulin burung unta dengan 50% ammonium sulfat menghasilkan presipitat yang cukup. Dari 36 ml serum burung unta dapat dihasilkan 11 ml larutan dari presipitat yang mengandung 32 mg/ml IgG murni sesudah pemurnian melalui kolom kromatografi. Gambaran rinci dari kandungan IgG burung unta hasil fraksinasi melalui kolom DEAE Affi-Gel Blue terlihat pada Gambar 1. Pada fraksi 1, 5 hingga fraksi 10 kandungan IgG burung unta dapat diabaikan. Fraksi 2, 3
dan 4 masing-masing mengandung IgG 19 mg/ ml, 5 mg/ml dan 2,5 mg/ml sehingga total IgG yang terkumpul sebanyak 106 mg dari 2 ml IgG hasil dialysis. Hal ini berbeda dengan yang dilaporkan oleh CADMANet al., (1994) dimana fraksinasi menggunakan kolom ion-exchange DEAE-cellulose Mono-Q menghasilkan 2 puncak yang masing-masing berberat molekul 67,5 dan 27 -kDa dan 65& 27-kDa. Analisis berat molekul IgG dengan SDS-PAGE dalam buffer tereduksi (Gambar 2) menunjukkan bahwa IgG terdisosiasi menjadi fraksi dengan berat molekul 65 kDa dan 27 kDa, sama seperti fraksi 16 dan 17 (puncak 2) yang disiolasi oleh CADMAN et al. (1994) dengan kolom ion-exchange DEAE-cellulose Mono-Q. Berat molekul ini sama dengan IgG spesies lain dimana protein 65 kDa mewakili heavy chain
IgM dan protein 27 kDa mewakili light chain
IgG maupun IgM.
Pelabelan rabbit-anti IgG burung unta dengan horseradish peroxidase menghasilkan 2 ml konjugat. Reaksi silang konjugat rabbit-anti ostrich (RAO) horseradish peroxidase
dengan IgY ayam dan itik menunjukkan bahwa konjugat bereaksi spesifik terhadap IgG burung unta. Pada konsentrasi yang sama, reaksi terhadap IgY ayam dan itik sangat rendah dibandingkan dengan reaksi terhadap IgG burung unta (Gambar 3). Rendahnya reaksi silang ini sama seperti yang dilaporkan oleh CADMAN et al. (1994). Walaupun demikian, IgG burung unta secara struktural lebih mendekati IgY ayam dari pada mamalia karena rendahnya reaktivitas terhadap protein A dan G (KELLYet al., 1993).
Gambar 1. Isolasi IgG ostrich dengan kolom DEAE Affi-Gel Blue column 0 5 10 15 20 1 2 3 4 5 6 7 8 9 10 Fraksi K ons en tra si prote in (mg/ml)
Gambar 2. Profil Ig G burung unta hasil SDS-PAGE Garis 1 penanda berat molekul (Kilo Dalton) dan garis 2, IgG burung unta
Gambar 3. Reaksi konjugat anti-IgG burung unta dengan IgG ayam dan itik
ELISA merupakan uji serologis yang umum digunakan untuk monitoring penyakit pada burung unta (CADMANet al., 1997; EBEL,
et al., 2002; DE SOUSAetal., 2000). Konjugat anti-burung unta yang berhasil dibuat ini akan merupakan langkah awal bagi penyediaan komponen dasar serodiagnostik untuk penyakit pada burung unta.
DAFTAR PUSTAKA
BAHARSJAH, S. 1997. Naikkan pajak Impor jagung. Kompas, 29 Mei 1997.
CADMAN, H.F.,P.J. KELLY, M. DIKANIFURA, S.D.
CARTER,S.M.AZWAI and E.P. WRIGHT. 1994. Isolation and characterization of serum immunoglobulin classes of the ostrich (Struthio camelus). Avian Dis., 38: 616-620
1 2 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 1 100 50 25 12.5 6.25 3.12 Konsentrasi imunoglobulin (ug/ml)
D ensi ta s o pt ik al ( 414 nm )
CADMAN,H.F., P.J. KELLY, N.D.DE ANGELIS, C.
ROHDE, N. COLLINS and T. ZULU. 1997. Comparison of enzyme-linked immunosorbent assay and haemagglutination inhibition test for the detection of antibodies against Newcastle disease virus in ostriches (Struthio camelus). Avian Pathology 26: 357−363.
DE SOUSA R.L.M.,H.J.MONTASSIER, and A. A. PINTO. 2000. Detection and quantification of
antibodies to Newcastle disease virus in ostrich and rhea sera using a liquid phase blocking enzyme-linked immunosorbent assay. Clin. Diag. Lab. Ummunol. 7: 940−944. DEEMING, D.C. and C.R. ANGEL. 1996. Introduction to the ratites and farming operations around the world. In: Improving our understanding of ratites in a farming Environment (D.C. Deeming, ed), Proc. Int. Conf., March, 1996, Manchester, UK, pp. 1−4.
DINAS PETERNAKAN JAWA BARAT 2000. Burung
unta terserang anthrax, diduga dikonsumsi penduduk. Kompas, 15 Januari 2000.
EBEL,G.D.,A.P.DUPUIS II,D.NICOLAS,D.YOUNG,
J.MAFFEI and L.D. KRAMER. 2002. Detection by enzyme-linked immunosorbent assay of antibodies to West Nile virus in birds. Emerging Infectious Diseases 8: 979−982
ERASMUS, J. and E.DE VAN ERASMUS. 1995. Ostrich
odyssey: a guide to ostrich farming in Southern Africa. p. 17.
KELLY,P.J.,M.TAGWIRA,L..MATTHEWMAN,P.R. MASON, and E.P. WRIGHT. 1993. Reaction of
sera from laboratory, domestic and wild animals in Africa with protein A and a recombinant chimeric protein A/G. Comp. Immunol. Microbiol. Infect. Dis. 16: 299−305. LAEMMLI, U.K. 1970. Cleave of structural proteins
during the assembly of the head of bacteriophage T4. Nature 227: 680−682. NAKANE P.K. and A. KAWOI. 1974. peroxidase
labeled antibody: a new method of conjugation. J. Histochem. Cytochem. 22: 1084−1091.
SMIT,D.J.V.Z. 1963. Ostrich farming in the Little Karoo. RSA Dept. of Agricultural Technical Services Bulletin no. 358.
VERWOERD, D.J.,A.J.OLIVER, M.M.HENTON and M.VAN DER WALT. 1998. Maintaining health
and performence in the young ostrich: Applications for a mannoligosaccharide. In: Passport to the year 2000. Lyons, T.P. and K.A. Jacques. Biotechnology in the feed industry. Proceedings of Alltech’s fourteenth annual symposium. Nottingham University Press. Nottingham, UK, 537−551.
DISKUSI Pertanyaan:
1. Bagaimana hasil penggunaan konjugat yang dibuat untuk pemantauan hasil vaksinasi dan peneguhan diagnosis penyakit?
2. Bagaimana pengujian konjugat yang dihasilkan? Bagaimana mengukur sensitifitas dan spesifisitasnya?
Jawaban:
1. Konjugat anti IgG burung unta yang merupakan salah satu komponen utama uji serologi ELISA yang sulit didapatkan secara komersial akan digunakan pada uji ELISA sebagai perangkat pemantauan hasil vaksinasi dan peneguhan diagnosis.
2. Hasil pengujian konjugat dapat dilihat pada Gambar 2 dan 3. Terlihat bahwa konjugat yang dihasilkan tidak bereaksi dengan IgG ayam dan itik.