BAB I PENDAHULUAN
A. Latar Belakang
Nyeri merupakan salah satu keluhan yang kerap dialami pasien yang datang untuk mendapatkan penanganan medis (Katz et al, 2007). Prevalensi penyakit dengan gejala nyeri culup tinggi terutama sakit kepala. Sakit kepala merupakan gejala yang umum dirasakan pasien dengan gangguan neurologi (Ziegler, 1990; Stewart et al., 1989; Osterhaus et al., 1994; Rasmussen, 1995). Berdasarkan studi epidemiologi, sakit kepala adalah penyakit yang umum terjadi pada populasi orang dewasa dengan angka prevalensi 2-5% (Hagen et al., 2000; Lanteri-Minet et al., 2003; Lu et al., 2000; Scher et al., 1998; Wang et al., 2000; Zwart et a.,l 2004).
Parasetamol merupakan analgesik dan antipiretik yang termasuk obat bebas yang sering digunakan oleh masyarakat. Parasetamol merupakan first-line terapi pengobatan nyeri (Schnitzer, 2008). Sebanyak 78% pengobatan nyeri menggunakan parasetamol (Deleu, 2002). Selain aman digunakan orang dewasa, parasetamol juga aman dikonsumsi anak-anak (Committee on Infectious Disease
AAoP. Aspirin and Reye’s syndrome. Pediatrics, 1982).
Efek parasetamol kurang poten untuk penanganan nyeri tertentu seperti nyeri pasca operasi dan nyeri dengan intensitas tinggi. Pada beberapa kasus,
karena efek parasetamol yang tidak cukup untuk meredakan nyeri. Penggunaan NSAID dapat megninduksi ulcerasi pada saluran gastrointestinal. Parasetamol yang digunakan dalam dosis besar dapat menginduksi terjadinya hepatotoksisitas.
Oleh karena itu, perlu disintesis suatu analgesik yang lebih poten daripada parasetamol sehingga dapat mengurangi rasa nyeri lebih baik dari parasetamol dan tidak menimbulkan efek samping seperti hepatotoksik dan ulcerasi 9bila digunakan sebagai kombinasi dengan NSAID).
Molecular docking merupakan salah satu metode yang dapat digunakan untuk mendesain suatu senyawa baru dan memprediksi aktivitasnya secara in
silico. Aktivitas suatu senyawa dikatakan lebih besar daripada suatu senyawa
pembanding apabila mempunyai ikatan lebih kuat dengan molekul target daripada ikatan senyawa pembanding dengan molekul target. Kekuatan ikatan dinilai dengan skor docking. Semakin kecil skor docking maka semakin kuat ikaan antara suatu senyawa dengan molekul target. molekul target dalam proses docking pada penelitian ini adalah 6COX.PDB yang merupakan salah satu enzim COX-2 (Purnomo, 2012)
Dalam penelitian ini, senyawa baru yang diduga mempunyai aktivitas
analgesik lebih besar daripada parasetamol adalah α-naftoil karbonil aminofenol.
Senyawa tersebut mempunyai skor docking lebih kecil daripada parasetamol yaitu
α-naftoil karbonil aminofenol -89,9128 dan parasetamol -67,4556. Hal tersebut bermakna ikatan antara α-naftoil karbonil aminofenol dengan 6COX.PDB lebih
Senyawa yang mempunyai aktivitas tertentu secara in silico belum tentu mempunyai aktivitas secara in vivo karena terdapat berbagai aspek fisiologis (absorpsi, distribusi, metabolisme, ekskresi) yang mempengaruhi aktivitas suatu senyawa. Oleh karena itu, perlu dilakukan uji aktivitas secara in vivo untuk mengetahui apakah senyawa tersebut mempunyai aktivitas sesuai yang diharapkan atau tidak.
B. Rumusan Masalah
1. Apakah α-naftoil karbonil aminofenol dapat disintesis dari urea, p-aminofenol,
dan α-naftol ?
2. Apakah produk hasil sintesis mempunyai aktivitas analgesik lebih besar daripada parasetamol?
C. Tujuan Penelitian
1. Mensintesis α-naftoil karbonil aminofenol yang merupakan senyawa baru turunan p-aminofenol.
2. Meneliti apakah produk hasil sintesis mempunyai aktivitas analgesik lebih besar daripada parasetamol.
D. Manfaat Penelitian
1. Untuk Masyarakat
Memberikan senyawa obat baru yang lebih poten daripada parasetamol. 2. Untuk Universitas Gadjah Mada
Sebagai salah satu penelitian yang dapat menjunjung tinggi nama baik Universitas Gadjah Mada.
3. Untuk Mahasiswa
Sebagai salah satu syarat kelulusan jenjang pendidikan sarjana.
E. Tinjauan Pustaka 1. Nyeri dan Mekanisme Nyeri
Nyeri merupakan pengalaman pribadi yang tidak menyenangkan yang merupakan suatu efek dari interaksi kompleks dari sistem syaraf ascending dan descending, melibatkan proses biokimia, fisiologi, psikologi, dan neokortikal (Chilsholm-Burns et al, 2008)
Nyeri merupakan fungsi protektif apabila terjadi kerusakan jaringan. Nosiseptor merupakan ujung syaraf bebas yang dapat ditemukan di seluruh jaringan tubuh kecuali otak. Nosiseptor dapat distimulasi dengan oleh rangsangan panas, mekanik dan kimia. Jaringan yang mengalami kerusakan akan melepaskan mediator-mediator nyeri seperti prostaglandin, prostasiklin, kinin dan K+yang dapat menstimulasi Nosiseptor (Tortora, 2009)
Nyeri dapat dibedakan menjadi dua macam, yaitu fast pain dan slow
pain. Fast pain atau nyeri akut terjadi sangat cepat, biasanya 0,1 detik setelah terjadi stimulasi. penghantaran rasa nyeri jenis ini melewati serabut Aδ yang
bermyelin. Slow pain atau nyeri kronis terjadi beberapa saat setelah terjadi stimulasi. Intensitas nyeri meningkat secara gradual selama periode beberapa detik atau menit. Penghantaran nyeri jenis ini melewati serabut C yang tidak
bermyelin (Tortora, 2009). Serabut Aδ merespon stimulus berupa tekanan
mekanik atau panas, sedangkan serabut C merespon stimulus kimiawi seperti H+, K+, histamin dan bradikinin (Lullmann et al., 2005). Nyeri yang distimulasi dari bagian kulit atau permukaan tubuh disebut superfacial
somatic pain. Nyeri yang distimualsi dari otot rangka, sendi, tendon, dan
fascia disebut deep somatic pain. Nyeri yang berasal dari organ visceral disebut visceral pain (Tortora, 2009). Selain itu, nyeri juga dapat diklasifikasikan berdasarkan mekanisme neurobiologi yaitu nyeri nosiseptiv, nyeri inflamasi dan nyeri neuropati (Beale & Block, 2011).
Mediator nyeri seperti prostanoid, leukotrien dan lipoksin merupakan golongan senyawa eicosanoid yang diderivat dari asam lemak eicosa-polienoat. Mediator nyeri yang termasuk dalam golongan prostanoid adalah prostaglandin, prostasiklin dan thromboxane (Murray et al., 2003)
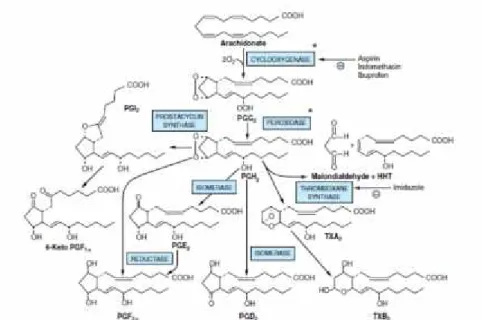
Prostanoid disintesis melalui jalur siklooksigenase yang membutuhkan dua molekul oksigen dan dikatalisis oleh prostaglandin H sintetase yang terdiri dari siklooksigenase dan peroksidase. Produk yang berupa endoperoksida akan dikonversi menajdi prostaglandin D, E, & F, thromboksane dan prostasiklin (Murray et al., 2003).
Gambar 1. Biosintesis mediator nyeri dengan jalur siklooksigenase (Murray et al., 2003)
Nyeri dapat dikurangi atau dimodifikasi dengan cara menghilangkan penyebab timbulnya rasa nyeri, menurunkan sensitivitas Nosiseptor dengan analgesik antipiretik atau anestesi lokal, menghambat transmisi impuls Nosiseptor ke medula spinalis dengan analgesik opioid, menghambat persepsi nyeri dengan anestesi umum atau opioid, dan mengatur respon emosional terhadap nyeri dengan co-analgesik seperti antidepresan (Lullmann et al., 2005).
2. Analgesik
Analgesik merupakan obat yang ditujukan untuk menghilangkan rasa nyeri dengan berbagai sebab. Intensitas nyeri menjadi dasar dalam pemilihan analgesik. Pengobatan nyeri dengan intensitas rendah menggunakan parasetamol dan NSAID. Untuk nyeri dengan intensitas sedang, kombinasi NSAID atau parasetamol dengan opioid lemah seperti codein dapat
digunakan. Morfin, fentanyl, dan opioid kuat lainnya hanya digunakan untuk meredakan rasa nyeri dengan intensitas berat (Beale & Block, 2011).
Penggolongan analgesik bermacam-macam. Salah satu penggolongan analgesik menurut Beale dan Block (2011) meliputi :
a. Opioid
Golongan obat ini sering juga disebut analgesik narkotik. Analgesik yang termasuk golongan obat ini adalah morfin, kodein, heroin, hidromorfone, hidrokodon, oksikodon, oksimorfon, levorfanol, dekstrometorfan, pentazosin, meperidin, difenoksilat, loperamid, fentanil, sufentanil, remifentanil, metadon dan tramadol.
b. Opioid Antagonis
Contoh analgesik golongan ini adalah naltrekson, nalokson, nalmefen, dan metilnaltrekson.
c. NSAID
1) Derivat aspirin dan asam salisilat
Terdiri dari asam salisilat, aspirin, disalisilat, diflunisal, Na-salisilat dan salisilamid.
2) Derivat Asam Heteroarilasetat
Indometasin, sulindak, tolmetin, ketorolak, nabumeton, etodolak, amfenak, bromfenak dan napafenak.
3) Derivat Asam Heteroarilpropanoat
Ibuprofen, naproksen, fenoprofen, ketoprofen, suprofen, flurbiprofen dan oksaprozin.
4) Derivat Asam N-arilantranilat
Terdiri dari asam mefenamat, meklofenamat, diklofenak dan lumirakoksib.
5) Derivat Anilin dan p-Aminofenol Terdiri dari parasetamol.
6) Derivat pirazolon dan pirazolidin
3. Parasetamol dan Pengembangan Parasetamol
Dari keseluruhan analgesik, parasetamol merupakan analgesik dan antipiretik yang termasuk obat bebas yang sering digunakan oleh masyarakat. Parasetamol merupakan first-line terapi pengobatan nyeri (Schnitzer, 2008).
Gambar 2. Struktur parasetamol
Pada tahun 1886 sampai 1887, asetanilida dan fenasetin merupakan analgesik antipiretik yang banyak digunakan masyarakat. Penggunaan kedua obat tersebut sangat populer karena tidak menyebabkan ulcerasi atau mengubah waktu pembekuan darah (Beale & Block, 2011). Situasi ini bertahan hingga sekitar tahun 1940 Brodie & Axelord (1949) menemukan bahwa fenasetin dimetabolisme menjadi parasetamol dan p-fenetidin.
Selanjutnya, Brodie & Axelord (1949) menyimpulkan bahwa efek methemoglobinemia akibat konsumsi fenasetin disebabkan oleh
bahwa parasetamol merupakan metabolit aktif dari asetanilida dan fenasetin sebagai analgesik antipiretik yang efektif dan tidak menyebabkan efek negatif terhadap darah seperti asetanilida dan fenasetin.
Parasetamol (C8H9NO2) mempunyai nama lain acetaminophen,
N-(4-hidroksifenil)asetamida dan N-asetil-p-aminofeol. Parasetamol berwujud kristal dan berwarna putih. Titik lebur parasetamol adalah 170oC (Anonim, 2015). parasetamol mempunyai pKa 9,5 pada temperatur 25oC. Parasetamol larut dalam 70 bagian air, 7 bagian etanol, 13 bagian aseton, 40 bagian gliserol dan 9 bagian propilenglikol (Anonim, 1979).
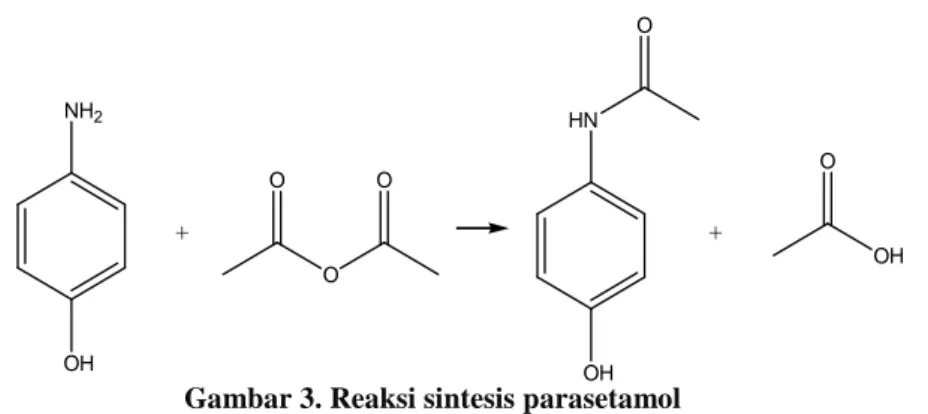
Parasetamol dapat disintesis dengan mudah menggunakan
p-aminofenol dan anhidrida asetat (Ellis, 2002). Reaksi sintesis parasetamol dari
p-aminofenol dan anhidrida asetat adalah sebagai berikut:
NH2 OH O O O + HN OH O + O OH
Gambar 3. Reaksi sintesis parasetamol
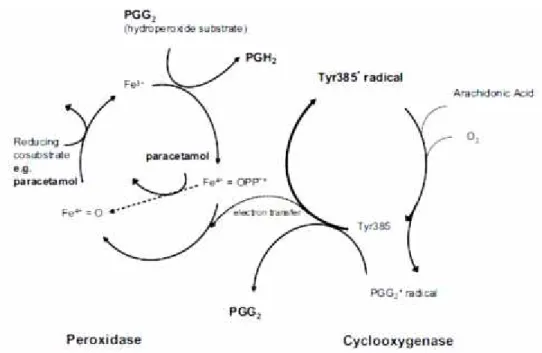
Parasetamol mempunyai aktivitas antinosiseptiv pada reseptor 5-hidroksi-triptamin tipe 3 pada sumsum tulang belakang (descending pathway) (Tjolasen et al., 1991; Alloui et al., 2002). Selain itu, parasetamol beraksi sebagai co-substrat pereduksi Fe4+= OPP*+ (radikal kation feril protoporfirin IX) menjadi Fe4+ = O pada jalur peroksidase yang merupakan salah satu langkah konversi asam arachidonat menjadi prostaglandin H2. Hal ini
berakibat pada kurangnya Fe4+ = OPP*+ yang dapat digunakan pada jalur siklooksigense. Sebagai konsekuensinya, jumlah Tyr385* yang tersedia untuk menstimulasi perubahan asam arachidonat menajdi prostaglandin G2
berkurang (Aronof et al., 2006; Smith et al., 2000). Parasetamol merupakan inhibitor COX-2 yang selektif (Patrignani et al, 1994).
Gambar 4. Mekanisme aksi parasetamol (Aronof et al., 2006)
Parasetamol digunakan pada pengobatan nyeri ringan atau sedang dan mengurangi demam. Parasetamol tersedia dalam bentuk tablet, kaplet, suspensi yang terkadang dikombinasikan dengan aspirin atau caffein (Beale & Block, 2011). Parasetamol digunakan per oral dengan dosis 325–1000 mg tiap 4 – 6 jam dengan dosis maksimal 4 g/hari. Parasetamol cepat diabsorpsi di saluran gastrointestinal. Konsentrasi tertinggi dalam plasma diperoleh 0,5 – 2 jam setelah administrasi. Vd parasetamol adalah 0,95±0,12 L/kg, Cl sebesar
Parasetamol mempunyai rasio ekstraksi hepatik yang rendah sehingga klirens instrinsik parasetamol rendah. Parasetamol dioksidasi oleh CYP450 yaitu CYP2E1 dan CYP3A4. Parasetamol dimetabolisme menjadi metabolit reaktif yang hepatotoksik dan nefrotoksik melalu berbagai mekanisme. Pada individu yang sehat, sebagian besar parasetamol dieliminasi dalam bentuk terkonjugasi dengan sulfat (sebagai O-sulfat) dan glukoronid (O-glukoronid), sedangkan bentuk terhidroksilasi sangat sedikit. Metabolit dalam bentuk O-sulfat yang terakumulasi dalam ginjal dan hati perlahan diubah menjadi metabolit reaktif N-asetil-p-benzokinon imina atau NAPQI. Metabolit tersebut mengalami deaktivasi oleh enzim glutathion secara cepat (Sinclair et al., 1998).
Parasetamol relatif lebih aman dibandingkan NSAID karena tidak mengiritasi saluran gastrointestinal ( Garcia et al., 2001), tidak mengganggu fungsi platelet ( Mielke, 1981; Catella-Lawson et al., 2001) dan tidak menginduksi brokokonstriksi pada individu yang sensitif terhadap NSAID seperti aspirin (Jenkins et al., 2004).
4. Molecular Docking
Prediksi kemampuan suatu senyawa untuk berikatan dengan protein target dapat dilakukan dengan docking. Docking dapat digunakan untuk menemukan konformasi dengan energi terendah pada sisi aktif protein. AUTODOCK, UCSF DOCK, ICM DOCK, GOLD, PLANTS, MOE DOCK, Flex X dan GLIDE merupakan beberapa contoh aplikasi docking. PLANTS merupakan aplikasi yang paling banyak digunakan (Purnomo, 2011).
Luaran molecular docking adalah skor yang menggambarkan energi total ikatan ligan-protein. Semakin kecil skor suatu hasil docking, semakin stabil ikatan ligan-protein tersebut. Potensi suatu senyawa baru untuk menghasilkan efek tertentu dapat ditentukan dengan membandingkan skor
docking senyawa tersebut dengan senyawa yang beredar di pasaran (Purnomo,
2011).
Protein target suatu senyawa dapat dilihat pada Protein Data Bank. 6COX.PDB merupakan salah satu enzim COX-2 yang mempunyai suatu inhibitor S58. Konformasi 6COX.PDB akan berubah apabila mengikat S58 sehingga tidak mampu mengubah asam arachidonat menjadi prostaglandin. Senyawa yang mempunyai ikatan dengan 6COX.PDB lebih kuat daripada
ikatan 6COX.PDB dan S58 berpotensi sebagai inhobitor yang lebih baik (Purnomo, 2012).
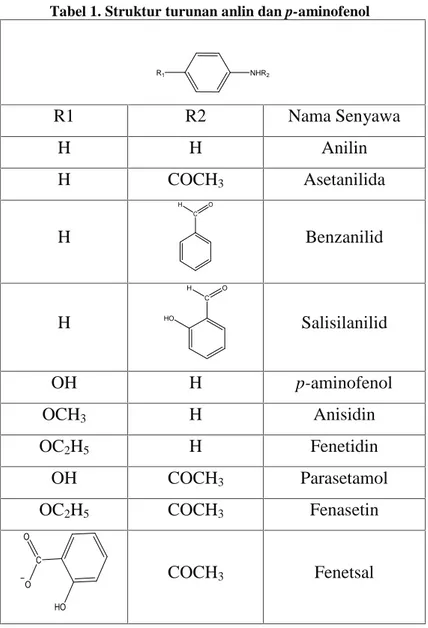
Beberapa analgesik turunan anilin dan p-aminofenol yang beredar di pasaran adalah sebagai berikut (Siswandono & Soekardjo, 2000) :
Tabel 1. Struktur turunan anlin dan p-aminofenol
NHR2 R1 R1 R2 Nama Senyawa H H Anilin H COCH3 Asetanilida H C O H Benzanilid H C O H HO Salisilanilid OH H p-aminofenol OCH3 H Anisidin OC2H5 H Fenetidin OH COCH3 Parasetamol OC2H5 COCH3 Fenasetin C O O HO COCH3 Fenetsal
Jerman (2009) melakukan beberapa modifikasi struktur parasetamol untuk mengurangi efek samping hepatotoksik yang akibat metabolit reaktif NAPQI.
N O H O N O H OH F OH N O H OH N O H OH N O H OH F F N O H O N O H NH2 HO OH N O H OH F F F F N O H O
Gambar 6. Struktur molekul hasil modifikasi parasetamol (Jerman, 2009)
5. Molekul Target
Struktur molekul senyawa didesain dan sifat fisikanya diprediksi dengan aplikasi ChemDraw Ultra version 7.0 pada Windows 7. Senyawa α-naftoil karbonil aminofenol mempunyai bobot molekul 279,29 gram/mol, titik lebur 585,62 K (312,62oC) dan logP 3,80.
O O
NH
HO
Gambar 7. Struktur α-naftoil karbonil aminofenol
α-naftoil karbonil aminofenol terdiri atas gugus karbonil yang mengikat gugus α-naftol dan p-aminofenol. α-naftol terdri atas 10 atom
cincin benzen yang tersubstitusi dengan gugus hidroksi dan amina pada posisi para.
Berdasarkan prediksi dengan ChemDraw Ultra versi 7.0, elusidasi dengan spektroskopi massa menghasilkan m/z 279,29 dan dengan 1H-NMR menghasilkan 11 lingkungan kimia proton yaitu pada geseran kimia 6,64 ppm, 7,17 ppm, 7,31 ppm, 7,68 ppm, 7,35 ppm, 7,38 ppm, 8,08 ppm, 8 ppm, 7,47 ppm, 6,71 ppm dan 5 ppm. Gugus fungsi yang mungkin muncul pada spektra IR adalah gugus karbonil ester, amina sekunder yang termasuk amida, hidroksi, cincin aromatik dan ikatan C=C aromatik.
6. Sintesis
Urea, amina primer dan alkohol primer atau sekunder dapat bereaksi membentuk suatu struktur umum R-NH-CO-OR’ pada temperatur lebih dari 100oC (disarankan lebih dari 120oC), R berasal dari amina dan R’ berasal dari
alkohol. R dari amina dapat berupa alkil, aril, arilalkil, alisiklik atau
heterosiklik. R yang disarakan terdiri dari 6 sampai 12 atom karbon. R’ dari
alkohol dapat berupa alkil, aril, arilalkil, alisiklik atau heterosiklik juga. R’ yang disarankan terdiri dari 1 sampai 12 atom karbon. Reaksi akan berjalan lebih cepat jika dilakukan pada temperatur 125oC-160oC dengan refluks beberapa jam, senyawa yang terbentuk dipisahkan dari pelarut dengan cara destilasi atau kristalisasi. Rasio reaktan dapat bervariasi. Urea dan alkohol berlebih untuk memperoleh rendemen yang diinginkan. Rendemen reaksi tergantung pada jumlah amina yang digunakan. Rasio yang dapat digunakan adalah 1 mol amina, 1 sampai 2 mol urea dan 1 sampai 5 mol alkohol. Rasio
molar yang disarankan adalah 1 mol amina; 1,2 mol urea dan 2 mol alkohol. (Brockway, 1955).
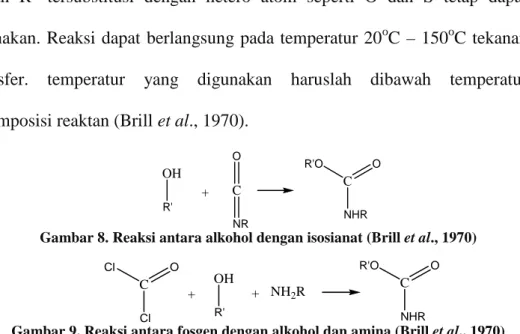
Senyawa dengan rumus molekul R-NH-CO-OR’ dapat disintesis dengan mereaksikan suatu isosianat dengan alkohol, gas fosgene dengan amina dan alkohol atau karbondioksida dengan amina dan alkohol. Kedua cara tersebut relatif tidak nyaman dilakukan mengingat sukarnya penanganan fosgen dan karbondioksida karena berwujud gas. Selain itu, gas fosgen bersifat toksik. Alternatif reaksi yang relatif nyaman dilakukan adalah mereaksikan dialkil karbonat (RO-CO-OR) atau organik karbonat dengan suatu amina. R pada senyawa tersebut dapat berupa alkil atau aril yang terdiri dari 6 sampai 12 atom karbon seperti fenil, naftil atau fenil yang tersusbtitusi alkil. Amina yang dapat digunakan adalah amina primer (R-NH2) atau
sekunder (R-NH-R’). R dan R’ pada amina dapat berupa alkil, aril atau arilalkil dengan atom C berjumlah 12 sampai 32 berinti benzen atau naftalen.
R dan R’ tersubstitusi dengan hetero atom seperti O dan S tetap dapat
digunakan. Reaksi dapat berlangsung pada temperatur 20oC – 150oC tekanan atmosfer. temperatur yang digunakan haruslah dibawah temperatur dekomposisi reaktan (Brill et al., 1970).
C NR O OH R' + C NHR R'O O
Gambar 8. Reaksi antara alkohol dengan isosianat (Brill et al., 1970)
C Cl Cl O + OH R' NH2R + C NHR R'O O
C O O + + OH R' NH2R C NHR R'O O
Gambar 10 Reaksi antara karbondioksida dengan alkohol dan amina (Brill et al., 1970) C OR' R'O O + NH2R C NHR R'O O
Gambar 11. Reaksi antara dialkil karbonat dengan amina (Brill et al., 1970)
Reaksi yang dilakukan oleh Brill et al. (1970) ini akan melepaskan alkohol yang dapat menghambat reaksi sehingga harus dihilangkan dari sistem. Pemisahan alkohol tersebut dapat dilakukan dengan refluks menggunakan kolom destilasi fraksional.
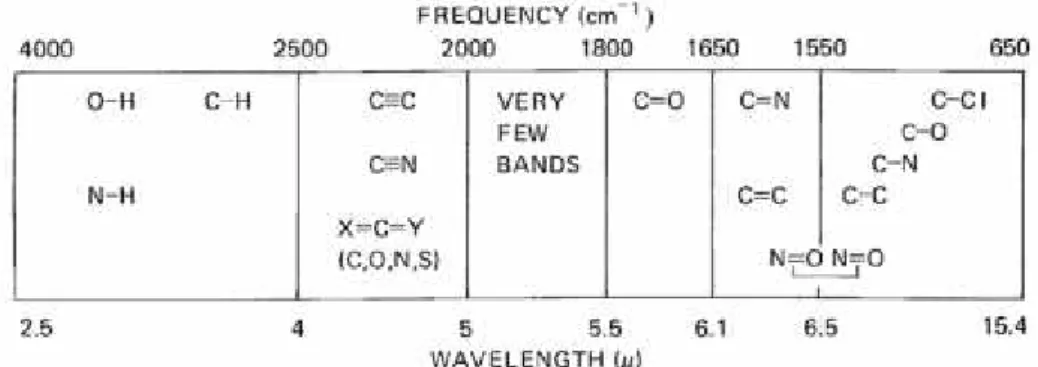
Suatu sintesis yang terkenal adalah sintesis fenil urea dan difenil urea. Fenil urea disintesis dari anilin HCl dan urea dengan perbandingan 1:1, sedangkan difenil urea disintesis dari anilin HCl dan urea dengan perbandingan 2:1. Urea yang dilarutkan dalam air mendidih dengan suasana asam akan membentuk amonium sianat. Amonium sianat bereaksi dengan anilin HCl membentuk fenil urea. Fenil urea dapat mengalami reaksi kedua membentuk fenil isosianat yang kemudian akan bereaksi dengan anilin HCl memebentuk difenil urea atau karbanilida ( Davis & Blanchard, 1923 ).
NH2HCl H 2N NH2 O H2O NH2 O NH NH2 O NH NH2 N H NH O HCl . . + NH4Cl
Gambar 12. Reaksi sintesis karbanilida
7. Starting Material
Starting material merupakan senyawa yang digunakan sebagai bahan
sintesis suatu senyawa. Pemilihan starting material didasarkan pada analisis dosikoneksi molekul target. Starting material harus berupa senyawa dengan struktur sederhana dan tersedia di pasaran. Berikut ini adalah karakter
fisiko-kimia senyawa yang digunakan dalam sintesis α-naftoil karbonil aminofenol :
a. p-aminofenol
NH2
HO
Gambar 13. Struktur p-aminofenol
Nama lain p-aminofenol adalah p-hidroksi ananilin, 4-amino-1-hidroksibenzen, activol, azol dan paranol merupakan kristal berwarna merah muda. Mempunyai bobot molekul 109,13 g/mol, titik lebur 189,6 – 190,2oC. Senyawa ini mempunyai pH sebesar 10. dapat mebentuk garan dnegan adanya asam maupun basa. Sukar larut dalam air; larut dalam ethanol, metanol, dan etil metil keton; praktis tidak larut dalam benzen dan kloroform (Anonim, 2015).
b. α-naftol
OH
Gambar 14. Struktur α-naftol
Nama lain naftol adalah 1-naftalenol, 1-naftol dan
α-hidroksinaftalen. Mempunyai bobot molekul 144,17 gram/mol, titik lebur 96oC. sensitif terhadap cahaya, dapat mereduksi perak amoniakal. Sedikit larut dalam air, larut dalam alkohol, benzen, kloroform, eter, dan alkali hidroksida (Anonim, 2015).
c. Urea
O
NH2
H2N
Gambar 15. Struktur urea
Mempunyai nama lain karbamida dan karbonildiamida, titik lebur 132,7oC. larut dalam air, ethanol, metanol dan gliserol. Sukar larut dalam kloroform dan eter (Anonim, 2015).
8. Analisis Kemurnian Senyawa
a. Rekristalisasi
Padatan atau kristal yang diperoleh dari hasil reaksi umumnya tidak murni dan masih mengandung pengotor-pengotor, yang dapat berasal dari reagen digunakan atau berasal dari produk samping hasil reaksi. Proses rekristalisasi secara umum terdiri dari empat tahap; pelarutan kristal hasil sintesis dalam pelarut yang dipanaskan, penyaringan larutan
panas untuk menghilangkan partikel-partikel pengotor yang tidak larut, pendinginan filtrat untuk mengkristalkan senyawa kembali, dan pemisahan kristal yang terbentuk dari pelarut. Proses rekristalisasi diulang beberapa kali hingga diperoleh kristal yang benar-benar murni (Furniss et al., 1989). Pelarut yang digunakan dalam rekristalisasi adalah pelarut yang dapat melarutkan kristal hasil sintesis, tidak bereaksi (inert) dengan senyawa yang akan dimurnikan, memiliki titik didih yang rendah, mudah dimodifikasi atau dikombinasikan, tidak toksik, tidak mudah terbakar, dan murah. Pelarut perlu memiliki titik didih yang rendah, sehingga mudah diuapkan untuk mendapatkan kristal murni yang kering. Beberapa pelarut yang sering digunakan dalam rekristalisasi adalah air (b.p. 100°C), metanol (b.p. 64,5°C), dan etanol (b.p. 78°C) (Furniss et al., 1989).
Arang aktif (carboadsorben) bisa digunakan untuk mengadsorbsi senyawa-senyawa pengotor dalam larutan, tetapi penggunaannya diusahakan sesedikit mungkin (1-2% dari bobot kasar kristal hasil sintesis). Penggunaan berlebihan dari arang aktif dapat menyebabkan senyawa yang dimurnikan ikut teradsorbsi, sehingga mengurangi rendemen hasil. Penyaringan larutan panas dilakukan menggunakan kertas saring. Penyaringan bisa dilakukan menggunakan corong Buchner untuk mempercepat proses penyaringan, dan perlu digunakan dua atau tiga lapis kertas saring. Kristal yang diperoleh dikeringkan di dalam oven untuk menguapkan secara sempurna pelarut yang masih tersisa pada kristal hasil penyaringan (Furniss et al., 1989).
b. Titik lebur
Titik lebur adalah perbedaan temperatur yang menyebabkan suatu padatan (kristal) mulai meleleh hingga padatan tersebut meleleh seluruhnya menjadi cair (Furniss et al., 1989). Temperatur titik lebur dari kristal murni adalah sama dengan titik bekunya. Panas yang diabsorbsi oleh 1 gram kristal ketika meleleh atau panas yang dilepaskan ketika cairan membeku disebut sebagai panas peleburan. Panas peleburan adalah panas yang oleh senyawa diubah menjadi energi molekul yang potensial untuk mengubah seluruh padatan menjadi cairan (Martin et al., 1983).
Kristal murni dari senyawa organik memiliki titik lebur yang pasti dan jarak leburnya sempit (tajam), yaitu tidak melebihi 0,5-1°C. Adanya pengotor dapat memperlebar jarak lebur kristal dan menyebabkan kristal meleleh pada temperatur yang lebih rendah daripada temperatur kristal murni yang seharusnya. Oleh karena itu, titik lebur merupakan kriteria penting dalam menetapkan kemurnian suatu senyawa; titik lebur yang tajam mengindikasikan kemurnian yang tinggi dari senyawa (Furniss et
al., 1989).
c. Kromatografi lapis tipis
Kromatografi merupakan suatu teknik yang digunakan untuk pemisahan senyawa organik maupun anorganik, menggunakan fase diam dan fase gerak dalam sistemnya. Kromatografi merupakan teknik pemisahan yang paling banyak dimanfaatkan dalam analisis, baik analisis kualitatif, kuantitatif, maupun preparatif dalam bidang farmasi, industri,
lingkungan, dan sebagainya (Gandjar dan Rohman, 2012). Di bidang farmasi, kromatografi digunakan untuk studi stabilitas dan kemurnian senyawa obat, juga untuk memonitor kadar obat dalam cairan biologis (Jaenchen, 1996).
Kromatografi Lapis Tipis termasuk dalam kromatografi planar, sistemnya menggunakan fase diam berupa lapisan seragam pada permukaan bidang datar yang dapat berupa lempeng kaca, alumunium, atau plastik. Fase gerak yang digunakan bergerak sepanjang fase diam secara menaik atau menurun karena adanya pengaruh gaya kapiler pada fase diam (Gandjar dan Rohman, 2012).
Pemisahan menggunakan KLT banyak dilakukan dengan sistem fase normal (fase diam polar dan fase diam lebih non-polar) menggunakan fase diam silika gel, atau bisa juga menggunakan fase diam yang lain seperti alumunium oksida dan selulosa (Jaenchen, 1996). Ukuran partikel fase diam pada KLT rata-rata berdiameter 10-30 µm, semakin kecil ukuran partikel fase diam, semakin baik efisiensi kinerja dan resolusi pemisahannya (Gandjar dan Rohman, 2012).
Aplikasi sampel dilakukan dengan menotolkan sampel dalam bentuk bercak pada fase diam menggunakan mikropipet. Untuk mencegah kerusakan fase diam dan agar bercak terposisikan dengan presisi pada fase diam, penotolan sampel dilakukan dengan posisi mikropipet tegak dan tip dari mikropipet diusahakan tidak terlalu menekan permukaan fase diam. Penotolan sampel bisa juga dilakukan menggunakan gelas kapiler, tetapi
volume sampel yang ditotolkan tidak terkuantifikasi (Jaenchen, 1997). Sampel yang ditotolkan terlalu banyak akan menurunkan resolusi pemisahan. Untuk memperoleh reprodusibilitas hasil pemisahan, volume sampel yang ditotolkan minimal adalah 0,5 µl. Jika volume sampel 2-10 µl atau lebih besar, penotolan sampel perlu dilakukan secara bertahap (Gandjar dan Rohman, 2012).
Pengembangan sampel dilakukan dalam bejana kromatografi yang sebelumnya telah dijenuhi oleh uap fase gerak. Bejana kromatografi harus selalu dalam keadaan tertutup rapat untuk mencegah keluarnya uap fase gerak (dapat mengurangi kejenuhan bejana). Kejenuhan bejana dapat dilihat dengan mencelupkan kertas saring setinggi bejana ke dalam fase gerak, bejana dikatakan telah jenuh ketika seluruh kertas saring telah terbasahi oleh fase gerak. Tepi bagian bawah lempeng fase diam kemudian dicelupkan dalam fase gerak, tinggi fase gerak harus berada di bawah titik penotolan bercak dan dilakukan hati-hati agar bercak sampel tidak tercelup dalam fase gerak. Fase gerak akan bergerak sepanjang lempeng fase diam secara menaik atau menurun, mengelusi analit-analit dalam sampel (Gandjar dan Rohman, 2012).
Analit-analit dalam sampel akan terelusi dengan jarak elusi yang berbeda (terpisah) pada fase diam, dikarenakan adanya interaksi antara analit dengan fase diam dan fase gerak secara partisi dan/atau adsorbsi (Gandjar dan Rohman, 2012) karena adanya kemiripan polaritas. Analit yang memiliki polaritas dekat dengan fase diam akan berinteraksi lebih
lama dengan fase diam dan analit dengan polaritas dekat dengan fase gerak berinteraksi lebih lama dengan fase gerak (like dissolve like). Pada KLT fase normal, analit yang polaritasnya tinggi akan lebih tertahan pada fase diam dan analit yang polaritasnya lebih rendah akan terelusi lebih jauh oleh fase gerak, sehingga terjadi pemisahan antar analit di dalam sampel.
9. Elusidasi Struktur
a. Spektroskopi IR
Hampir semua molekul yang memiliki ikatan kovalen, organik maupun anorganik, mengabsorbsi radiasi gelombang elektromagnetik di daerah panjang gelombang inframerah (IR), yaitu di daerah 2,5 µm hingga 25 µm. Radiasi IR berenergi lebih rendah daripada radiasi UV-Vis, menyebabkan terjadinya vibrasi (getaran) pada ikatan molekul tetapi tidak sampai menyebabkan transisi elektronik seperti pada radiasi UV-Vis. Unit radiasi IR yang lebih sering digunakan adalah bilangan gelombang ( ‾), daripada panjang gelombang (µ atau µm). Hal ini dikarenakan bilangan gelombang proporsional dengan energi (semakin tinggi bilangan gelombang semakin tinggi energi vibrasional), sehingga memudahkan intepretasi spektra IR (Pavia et al., 2001).
Ikatan-ikatan kovalen antaratom dalam suatu molekul mengalami vibrasi atau osilasi. Apabila molekul tersebut dikenai radiasi IR, maka ia akan mengabsorbsi energi radiasi IR pada frekuensi tertentu, dan energi yang diabsorbsi akan meningkatkan amplitudo vibrasi dari ikatan-ikatan
dalam molekul. Molekul yang mengalami peningkatan vibrasi ikatan disebut sebagai molekul dalam keadaan vibrasi tereksitasi (Fessenden dan Fessenden, 1982).
Tidak semua ikatan dalam molekul dapat mengabsorbsi energi radiasi IR, meskipun frekuensi sesuai dengan frekuensi vibrasional dari molekul. Hanya molekul-molekul yang dapat mengalami perubahan momen dipol yang dapat mengabsorbsi energi radiasi IR (IR aktif). Molekul-molekul simetris atau pseudosimetris umumnya tidak mengalami perubahan momen dipol, sehingga tidak dapat mengabsorbsi energi radiasi IR (IR inaktif) (Pavia et al., 2001). Ikatan non-polar tidak mengabsorbsi radiasi IR, ikatan semipolar menunjukkan absorbsi yang lemah, dan ikatan polar menunjukkan absorbsi yang kuat (Fessenden dan Fessenden, 1982).
Setiap jenis ikatan dalam molekul memiliki frekuensi vibrasional karakteristiknya masing-masing, jenis ikatan yang sama dalam molekul yang berbeda memiliki frekuensi vibrasional yang berbeda, dan tidak ada 2 molekul yang memiliki frekuensi vibrasional yang sama. Berdasarkan hal-hal tersebut, spektra IR dapat digunakan sebagai sidik jari molekul (Pavia et al., 2001).
Spektra IR dapat memberikan informasi mengenai struktur dari suatu molekul. Gugus-gugus fungsional dan jenis-jenis ikatan bervibrasi pada kisaran frekuensi tertentu (Gambar 10), sehingga puncak-puncak yang muncul pada frekuensi tertentu pada spektra IR dapat memberikan
informasi mengenai gugus fungsional atau jenis ikatan apa saja yang ada dalam molekul (Pavia et al., 2001).
Gambar 16. Kisaran frekuensi vibrasional dari berbagai gugus fungsional dan jenis ikatan (Pavia et al., 2009)
Molekul-molekul IR aktif memiliki 2 tipe vibrasi fundamental, yaitu ulur dan tekuk. Vibrasi ulur dibagi lagi menjadi 2 jenis vibrasi, yaitu ulur simetris dan ulur asimetris. Secara umum, vibrasi ulur asimetris terjadi pada frekuensi vibrasi yang lebih besar daripada vibrasi ulur simetris. Vibrasi tekuk dibagi lagi menjadi 4 jenis vibrasi, yaitu scissoring, rocking,
wagging, dan twisting (Pavia et al., 2001).
Instrumen yang digunakan untuk mengukur besar absorbsi energi radiasi IR suatu molekul adalah spektrofotometer IR. Ada 2 jenis spektrofotometer IR, yaitu spektrofotometer dispersif dan Fourier Transform IR (FTIR). FTIR memiliki sensitivitas dan kecepatan deteksi yang lebih baik dibandingkan spektrofotometer dispersif (Pavia et al., 2001). FTIR mampu menjangkau daerah-daerah pada molekul yang sulit atau bahkan tidak mungkin untuk dianalisis dengan spektrofotometer dispersif (Hsu, 1997).
Nuclear Magnetic Resonance (NMR) adalah metode spektroskopi
yang dapat melengkapi data spektroskopi IR. Spekstroskopi IR memberikan informasi mengenai gugus fungsional yang ada dalam suatu molekul, tetapi hanya memberi sedikit petunjuk mengenai kerangka hidrokarbon dari molekul tersebut. NMR melengkapi kekurangan ini; NMR memberikan informasi mengenai jumlah atom hidrogen (spektroskopi1H-NMR) atau karbon (spektroskopi13C-NMR) dalam suatu molekul (Fessenden dan Fessenden, 1982). Bahasan spektroskopi NMR disini dikhususkan hanya mengenai spektroskopi1H-NMR.
Inti-inti atom memiliki spin; inti-inti atom bergerak seolah ia berputar (Pavia et al., 2001). Spin dari inti atom akan menimbulkan suatu medan magnet kecil pada atom tersebut, dikatakan inti atom tersebut memiliki momen magnetik nuklir (Fessenden dan Fessenden, 1982). Hanya inti atom yang memiliki nomor massa ganjil, nomor atom ganjil, atau keduanya yang memiliki momen spin angular dan momen magnetik, beberapa diantaranya adalah , , , , , dan . Isotop dengan kelimpahan terbanyak di alam seperti dan tidak memiliki spin, dikarenakan nomor massa dan nomor atomnya tersebut adalah genap (Pavia et al., 2001).
Inti atom yang berspin memiliki orientasi (arah) spin yang jumlahnya ditentukan dari nomor kuantum spin (I). Jumlah orientasi spin menganut aturan 2I+1. Proton memiliki harga I= ½, sehingga proton memiliki dua orientasi spin; +½ dan -½ (Pavia et al., 2001). Dalam
spektroskopi NMR, atom-atom dikenai suatu medan magnet eksternal, yang besarnya dinyatakan sebagai H0. Bila molekul yang mengandung proton berada di dalam medan magnet eksternal, maka momen magnetik dari proton akan mengambil salah satu dari dua orientasi yang dimilikinya terhadap medan magnet eksternal. Kedua orientasi spin yang mungkin diambil oleh proton adalah paralel dan antiparalel terhadap medan magnet eksternal. Pada keadaan paralel, orientasi momen magnetik proton adalah sama (serarah) dengan medan magnet eksternal; sedangkan pada keadaan antiparalel, orientasi momen magnetik proton berlawanan arah dengan medan magnet eksternal. Proton pada keadaan paralel lebih stabil (energi lebih rendah) dibandingkan pada keadaan antiparalel (Fessenden dan Fessenden, 1982).
Apabila suatu gelombang radio dengan frekuensi yang cocok dilewatkan pada molekul yang mengandung proton, maka momen magnetik proton pada keadaan paralel akan mengabsorbsi energi dari gelombang radio tersebut. Energi yang diabsorbsi digunakan oleh proton untuk merubah orientasi spin-nya dari yang semula pada keadaan paralel menjadi antiparalel yang berenergi lebih tinggi. Proton yang berpindah dari keadaan paralel ke keadaaan antiparalel dikatakan mengalami resonansi, atau lebih tepatnya resonansi magnetik nuklir. Besar energi yang diperlukan untuk mengubah orientasi spin dari proton tergantung pada besarnya medan magnet eksternal yang diaplikasikan pada proton. Semakin besar H0, semakin sulit proton mengubah orientasi spin-nya,
sehingga dibutuhkan radiasi berfrekuensi lebih tinggi (berenergi lebih tinggi) (Fessenden dan Fessenden, 1982).
Proton-proton dalam satu molekul beresonansi pada frekuensi radio yang bervariasi, dan variabilitas inilah yang menjadikan spektra NMR bermanfaat dalam memberikan informasi mengenai jumlah atom hidrogen dalam suatu molekul dan menenetapkan struktur molekul tersebut. Variabilitas frekuensi resonansi ini dikarenakan proton-proton dalam molekul dikelilingi oleh elektron, yang menyebabkan lingkungan kimia (magnetik) antarproton dalam molekul yang sedikit berbeda satu sama lain. Proton dilingkupi oleh elektron, yang dalam medan magnet eksternal elektron-elektron tersebut akan berputar mengelilingi proton (mengorbit proton). Perputaran elektron mengelilingi proton akan menghasilkan medan magnet lokal, disebut arus diamagnetik lokal, yang arah dan besarnya melawan medan magnet eksternal. Arus diamagnetik lokal yang dihasilkan oleh elektron ini memberikan perlindungan pada proton terhadap medan magnet eksternal yang diaplikasikan, disebut dengan perlindungan diamagnetik. Semakin besar densitas elektron yang mengelilingi proton, maka semakin besar medan magnet lokal yang dihasilkan untuk melawan medan magnet eksternal, sehingga semakin kecil efek medan magnet eksternal yang dirasakan oleh inti atom. Hal ini menyebabkan inti atom berspin pada frekuensi yang lebih rendah, dan mengabsorbsi energi radiasi radio pada frekuensi yang lebih rendah tersebut (Pavia et al.,2001).
Perbedaan frekuensi resonansi dari tiap proton dalam molekul sangatlah kecil, sehingga sangat sulit untuk menentukan dan memisahkan frekuensi resonansi antarproton secara presisi. Oleh karena itu, digunakan suatu senyawa standar dan frekuensi resonansi tiap proton dalam molekul diukur relatif terhadap frekuensi resonansi dari senyawa standar, pengukuran ini disebut sebagai geseran kimia, yang besarnya dinyatakan
dalam δ (ppm). Senyawa standar yang digunakan adalah tetrametilsilan
[(CH3)3Si], atau disingkat sebagai TMS. Proton-proton dalam TMS
(berjumlah 12) adalah proton-proton yang sangat terlindungi (perlindungan diamagnetik), puncaknya pada spektra NMR akan muncul pada frekuensi resonansi dan H0 yang tinggi (upfield). Puncak TMS akan
muncul pada daerah yang paling kanan pada spektra NMR, dan letak di
mana puncak TMS muncul memiliki harga δ=0 (Pavia et al., 2001).
Semakin besar medan magnet eksternal yang diaplikasikan atau dirasakan oleh proton (efek perlindungan diamagnetik kecil), maka semakin besar energi yang perlu diabsorbsi oleh proton tersebut untuk beresonansi, maka proton akan mengabsorbsi radiasi radio pada frekuensi yang lebih tinggi; puncaknya pada spektra NMR akan berada lebih dekat (lebih ke kanan) dengan TMS (upfield). Semakin kecil medan magnet eksternal yang diaplikasikan atau dirasakan oleh proton (efek perlindungan diamagnetik besar), maka semakin kecil energi yang perlu diabsorbsi oleh proton tersebut untuk beresonansi, maka proton akan mengabsorbsi radiasi radio pada frekuensi yang lebih rendah; puncaknya pada spektra NMR
akan berada lebih jauh (lebih ke kiri) dari TMS (downfield) (Pavia et al., 2001).
c. Spektroskopi massa
Suatu spektrometer massa memiliki 5 komponen utama dalam instrumennya, yaitu inlet sampel, sumber ion, penganalisis massa, detektor, dan sistem data. Sampel inlet berfungsi untuk memasukkan sampel ke dalam spektrometer massa yang bertekanan hampir vakum menuju ke sumber ion; di sana molekul-molekul sampel diubah menjadi ion fase gas dan terfragmentasi. Penganalisis massa akan memisahkan ion-ion (fragmen) sampel berdasarkan besar rasio mass-to-charge (m/z). Ion-ion yang telah dipisahkan akan dihitung jumlahnya oleh detektor dan hasilnya akan diproses oleh sistem data, menghasilkan luaran berupa spektrum massa (grafik fungsi antara jumlah ion terdeteksi dengan rasio m/z-nya) (Pavia et al., 2001).
Metode ionisasi molekul oleh sumber ion sendiri secara umum dibagi menjadi dua, yaitu ionisasi elektron (EI) dan ionisasi kimia (CI). Pada EI-MS (Electron Ionization Mass Spectrometer), elektron berenergi tinggi yang dihasilkan dari suatu filamen ditembakkan ke molekul-molekul sampel, menyebabkan lepasnya elektron dari molekul, membentuk kation. Energi yang diperlukan untuk melepas elektron dari suatu molekul (energi ionisasi) berkisar antara 8-15 eV. Tetapi, pemnbentukan kation tidak efisien dan reprodusibel apabila energi ionisasi kurang dari 50-70 eV. Energi ionisasi pada EI adalah 70 eV. Sumber ion yang digunakan pada
CI-MS (Chemical Ionization Mass Spectrometer) berupa reagen-reagen pengionisasi yang akan mengionisasi molekul-molekul dalam sampel, dengan mekanisme transfer proton atau transfer elektron. Reagen pengionisasi yang sering digunakan pada CI-MS adalah metana, amonia, isobutana, dan metanol (Pavia et al., 2001). Fragmen-fragmen ion yang terbaca oleh detektor akan muncul sebagai puncak dengan intensitas tertentu pada spektra massa. Struktur molekul dapat ditetapkan berdasarkan perkiraan ion-ion apa saja yang memberi puncak tersebut, dengan membandingkan harga m/z tiap puncak dengan tabel standar. Perkiraan ion-ion yang diperoleh kemudian dirangkai, membentuk struktur molekul senyawa yang paling mungkin berdasarkan spektra massa yang dianalisis.
Kombinasi antara kromatografi kolom dengan MS dapat menghasilkan data spektra massa dari molekul-molekul senyawa dalam sampel yang sudah dipisahkan dulu sebelumnya. Syarat pengombinasian ini adalah kromatografi kolom yang digunakan harus memiliki efisiensi dan resolusi tinggi, seperti kromatografi cair kinerja tinggi (HPLC) atau kromatografi gas (GC). Pada GC-MS, sampel yang sudah diuapkan dalam alat GC akan diionisasi dan terfragmentasi dalam alat MS, menghasilkan luaran berupa spektra massa dari semua komponen dalam campuran sampel yang diinjeksikan ke dalam GC (Pavia et al., 2001).
10. Uji Aktivitas Analgesik
Pengujian akitivitas analgesik suatu senyawa atau campuran senyawa dapat dilakukan dengan beberapa metode. Turner (1965) membagi uji analgesik menjadi 2 metode berdasarkan tipe analgesiknya, yaitu uji untuk analgesik narkotik dan uji untuk analgesik non-narkotik. Parasetamol dan α-naftoil karbonil aminofenol merupakan analgesik non-narkotik sehingga uji aktivitasnya menggunakan metode uji untuk analgesik non-narkotik, yaitu : a. Metode geliat terinduksi zat kimia (writhing test)
Pada metode ini, hewan uji (mencit) diberi suatu zat kimia yang dapat menginduksi rasa nyeri, menyebabkan hewan uji menggeliat karena kesakitan. Zat kimia yang dapat menginduksi nyeri adalah fenilquinon, benzoquinon, dan asam asetat. Hewan uji diinjeksi dengan 0,1 ml senyawa uji secara subkutan, dan 20 menit kemudian hewan uji diinjeksi dengan salah satu zat kimia penginduksi nyeri secara intraperitoneal. Respon geliat dari hewan uji diamati dan dihitung selama 20 menit. Senyawa uji positif memiliki efek analgesik apabila dapat menurunkan frekuensi geliat dari hewan uji, dibandingkan dengan kelompok kontrol (diberi pelarut saline). Metode ini mudah dilakukan, sensitif, dan reprodusibel. Tetapi, metode ini kurang spesifik sehingga diperlukan ketelitian dan kehati-hatian dalam mengintepretasikan hasil pengamatan.
b. Metode pododolorimeter
Metode ini menggunakan arus listrik sebagai rangsang nyeri pada hewan uji. Hewan uji (mencit) diletakkan dalam kandang beralas
lempengan logam yang dapat menghantarkan arus listrik. Tegangan listrik yang menyebabkan hewan uji mencicit kesakitan (nilai kontrol) diukur setiap 10 menit selama 1 jam. Senyawa uji kemudian diberikan dan pengukuran dilakukan sama seperti sebelumnya. Senyawa uji positif memiliki efek analgesik apabila tegangan yang menyebabkan hewan uji mencicit lebih besar daripada nilai kontrol.
c. Metode rektodolorimeter
Hewan uji ditempatkan dalam kandang beralas lempeng tembaga yang terhubung dengan suatu kumparan induksi. Kumparan tersebut dihubungkan dengan sebuah elektroda tembaga berbentuk silinder yang dimasukkan ke dalam rektum. Prosedur kerja dan pengamatan sama seperti pada metode pododolorimeter. Voltmeter dengan sensitivitas 0,1 volt terhubung dengan kumparan induksi, berfungsi untuk mengukur tegangan listrik yang menyebabkan hewan uji mencicit. Tegangan listrik yang menyebabkan hewan uji mencit (nilai kontrol) umumnya adalah 1-2 volts.
F. Landasan Teori 1. Aktvitas analgesik α-naftoil karbonil aminofenol
Aktivitas alagesik α-naftoil karbonil aminofenol diprediksi secara in silico dengan aplikasi PLANTS. Suatu senyawa mempunyai aktivitas
analgesik lebih baik daripada parasetamol jika berikatan lebih kuat dengan enzim 6COX.PDB. Suatu ikatan dikatakan semakin kuat apabila skor
dockingnya semakin kecil (Purnomo, 2012). Berikut ini skor docking ikatan parasetamol dengan 6COX.PDB dan α-naftoil karbonil aminofenol dengan
6COX.PDB.
Tabel 2. Skor docking ikatan parasetamol-6COX.PDB dan α-naftoil karbonil aminofenol- 6COX.PDB
No Nama Senyawa Skor Docking
1 Parasetamol -67,4556
2 α-naftoil karbonil aminofenol -89,9128
Skor docking α-naftoil karbonil aminofenol kurang dari skor docking parasetamol. Berdasarkan skor docking tersebut, dapat diprediksi bahwa
ikatan α-naftoil karbonil aminofenol dengan 6COX.PDB lebih kuat daripada
ikatan parasetamol dengan 6COX.PDB.
Aktivitas analgesik α-naftoil karbonil aminofenol diuji dengan uji
analgesik non-narkotik Writhing Test. Writhing Test merupakan metode yang paling populer karena relatif lebih mudah dilakukan karena tidak memerlukan peralatan yang canggih. Respon yang diamati pada uji ini adalah geliat mencit. Geliat mencit kemudian digunakan dalam perhitungan % daya analgesik yang merupakan parameter aktivitas analgesik. Senyawa yang lebih poten daripada parasetamol dapat menurunkan jumlah geliat lebih banyak dari parasetamol.
α-naftoil karbonil aminofenol lebih poten daripada parasetamol secara in silico. Oleh karena itu, kemampuan α-naftoil karbonil aminofenol dalam
menghambat pembentukan mediator nyeri berupa PGH2dari asam arachidonat
pada jalur siklooksigenase diduga lebih baik daripada parasetamol sehingga
diprediksi kurang dari jumlah geliat mencit yang diberi asam asetat dan parasetamol. Senyawa dengan jumlah geliat sediikit mempunyai % daya analgesik yang tinggi sehingga lebih poten sebagai analgesik.
2. Sintesis α-naftoil karbonil aminofenol
Struktur molekul α-naftoil karbonil aminofenol sesuai dengan struktur umum R-NH-CO-OR’. R pada α-naftoil karbonil aminofenol adalah benzen yang tersubstitusi para dengan gugus hidroksi (-OH) dengan jumlah atom
karbon 6 dan R’ adalah gugus naftalena dengan jumlah atom karbon 10
membentuk cincin bisiklik. Ketiga senyawa harus berada dalam bentuk larutan untuk dapat bereaksi sehingga ketiga senyawa tersebut dilarutkan dalam air dan ditetesi HCl pekat hingga larut. Reaksi dilakukan pada temperatur 110oC selama 2 jam dengan refluks.
Starting material sintesis α-naftoil karbonil aminofenol dipilih atas
dasar reaksi diskoneksi atau retro sintesis. Analisis diskoneksi α-naftoil karbonil aminofenol dijabarkan dalam gambar 17.
Pembentukan α-naftoil karbonil aminofenol dapat melalui dua
mekanisme yaitu pembentukan suatu isosianat yang dilanjutkan dengan substitusi gugus -NH2 oleh α-naftol atau pembentukan dialkil karbonat
dilanjutkan dengan substitusi salah satu gugus pergi dengan p-aminofenol. Berikut ini merupakan mekanisme reaksi pembentukan α-naftoil karbonil aminofenol. Reaksi pembentukan α-naftoil karbonil aminofenol dijabarkan dalam gambar 18.
Gambar 17. Analisis diskoneksi α-naftoil karbonil aminofenol O H2N NH2 H O H2N N H H H O H H2N N H H O H H3N NH -NH3 C O NH O O NH HO HO NH O + O OH HO NH O NH2 + HO NH O NH2 HO NH2 O NH2 H2N
OH NH2 C O NH HO NH O NH H HO NH O NH H HO NH O NH2 HO N O NH2 H H H HO N O NH2 H H HO N O NH2 H H HO N O NH3 H HO N C O HO N C O OH HO N C O O H HO N C O O H HO NH C O O
G. Hipotesis
1. Senyawa α-naftoil karbonil aminofenol dapat disintesis dari urea,
p-aminofenol dan α-naftol.
2. Aktivitas analgesik produk hasil sintesis lebih besar daripada aktivitas analgesik parasetamol.