LAPORAN AKHIR
PENELITIAN UNGGULAN ITS
DANA LOKAL ITS TAHUN 2020
SINTESA DAN PENINGKATAN PERFORMA Li
4Ti
5O
12DENGAN PROSES
COATING DAN DOPING SEBAGAI ANODA BATEREI ION LITHIUM
Tim Peneliti:
Ketua : Lukman Noerochim, ST, MSc.Eng, Ph.D (Teknik Material/FT-IRS/ITS) Anggota 1 : Diah Susanti, ST, MT, Ph.D (Teknik Material/FT-IRS/ITS) Anggota 2 : Suwarno, ST, MSc., Ph.D (Teknik Mesin/FT-IRS/ITS) Anggota 3 : Yatim Lailun Ni'mah, Ph. D. (Kimia/FSAD/ITS)
DIREKTORAT PENELITIAN DAN PENGABDIAN KEPADA MASYARAKAT INSTITUT TEKNOLOGI SEPULUH NOPEMBER
SURABAYA 2020
BAB 1 RINGKASAN
Baterai ion lithium merupakan kandidat potensial untuk perangkat penyimpan energi hal ini disebabkan densitas energi yang tinggi, tidak adanya memori efek, dapat bertahan dalam waktu lama, ringan, dan ramah lingkungan. Sehingga sangat sesuai untuk aplikasi sumber energi bagi peralatan medis seperti biosensor. Saat ini bahan komersial anoda masih didominasi oleh grafit yang mempunyai beberapa kelemahan salah satunya penurunan kapasitas yang cukup signifikan selama proses charge-discharge. Diantara jenis material alternative pengganti grafit yang dapat menjadi kandidat terbaik yakni Li4Ti5O12 (LTO) sebab kapasitas teoritiknya mencapai 172 mAh g-1,
keberadaan melimpah, murah, proses pengolahan mudah dan sangat stabil. Dalam penelitian ini akan dilakukan proses sintesa Li4Ti5O12 menggunakan metode solid state (ball milling) dengan melakukan
variasi pelapisan carbon dan nitrogen serta doping dengan menggunakan TiO2 dan Fluorine untuk
meningkatkan konduktifitasnya. Hasil dari SEM/EDX, terlihat morfologi LTO berbentuk partikel tidak beraturan. Lapisan coating carbon yang terbentuk telah berhasil melapisi permukaan LTO dengan homogen. Hasil XRD menunjukkan fasa yang terbentuk telah sesaui dengan JCPDS. Dimana intensitas puncak yang dihasilkan menunjukkan kualitas kristalinitas dari LTO sangat tinggi. Hasil pengujian performa elektrokimia Li4Ti5O12 berupa cyclic voltammetry (CV menunjukkan puncak
redoks dari dua fasa yaitu LTO dan TiO2. Kurva charge-discharge dan electrochemical impedance
spectroscopy (EIS) juga menunjukkan peningkatan kapasitas yang dihasilkan.
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat, anugerah, serta karunia-Nya, sehingga penulis dapat menyelesaikan laporan akhir penelitian dengan judul “SINTESA DAN PENINGKATAN PERFORMA Li4Ti5O12 DENGAN PROSES COATING
DAN DOPING SEBAGAI ANODA BATEREI ION LITHIUM ”. Laporan ini merupakan gambaran perkembangan pelaksanaan akhir dari penelitian hingga Nopember 2020.
Penulis menyadari bahwa di dalam proses penyusunan laporan ini banyak berbagai pihak yang telah banyak membantu. Oleh karena itu dalam kesempatan ini, penulis ingin menyampaikan ucapan terima kasih kepada pihak-pihak yang terkait atas bimbingan, arahan dan panduannya sehingga terselesaikannya laporan kemajuan penelitian ini yaitu :
1. DPPM ITS
2. Tim anggota penelitian
Penulis berharap semoga dari hasil penelitian ini memberikan manfaat bagi pengembangan teknologi baterei ion lithium di Indonesia khususnya dan pengembangan teknologi baterei pada umumnya. Penulis juga menyadari masih banyak kekurangan di dalam proses penulisan laporan akhir ini, untuk itu saran dan kritik yang membangun dari semua pihak penulis harapkan agar kedepan dapat lebih baik lagi.
Surabaya, 20 Nopember 2020
DAFTAR ISI Halaman Judul i Halaman Pengesahan ii Ringkasan iii Prakata iv Daftar isi v Daftar tabel vi
Daftar gambar vii
Daftar lampiran viii
BAB I PENDAHULUAN 1
1.1 Latar Belakang 1
1.2 Perumusan dan Pembatasan Masalah 3
1.3 Target Luaran 4
1.4 Deskripsi laboratorium yang terlibat dalam penelitian 5 BAB II TINJAUAN PUSTAKA
2.1 Teori Penunjang 6
2.2 Studi Hasil Penelitian Sebelumnya 21
BAB III TUJUAN DAN MANFAAT PENELITIAN 24
BAB IV METODE PENELITIAN 25
BAB V HASIL YANG DICAPAI 34
BAB VI RENCANA TAHAPAN BERIKUTNYA 52
BAB VII KESIMPULAN DAN SARAN 53
DAFTAR PUSTAKA 54
LAMPIRAN 57
BAB 2 LATAR BELAKANG
2.1. Pendahuluan
Anoda pada baterai komersial umumnya terbuat dari bahan grafit. Namun, salah satu kelemahan dari bahan anoda grafit ini adalah tidak mampu diaplikasikan dalam kondisi high rate constant power, disamping itu ketika proses charging struktur grafit berubah. Jarak interlayer antar lapisan grafit meningkat sehingga mengalami ekspansi hebat akibat penyisipan lithium ke dalam struktur grafit (Sawai, 1994; Ohzuku, 2001). Hal ini akan mengakibatkan potensial sel akan drop dibawah tegangan cutoff baterai ketika arus dalam kondisi high rates (Kawamoto, 2010). Kurva kapasitasnya menjadi tidak stabil dan cenderung mengalami penurunan sehingga akan mengurangi kapasitas baterai, disamping itu faktor keamanan sel akibat gejala litiation (lapisan intermetalik lithium) pada interface sel anoda (Linden, 1994).
Salah satu material anoda yang tengah banyak menjadi perhatian adalah material Li4Ti5O12
(Lithium Titanate) atau LTO. Li4Ti5O12 memiliki potensi sebagai pengganti grafit untuk anoda. Hal
ini karena Li4Ti5O12 memiliki tegangan operasi yang stabil, tidak menyebabkan adanya dendrit ion
lithium pada anoda selama proses interkalasi (Guo-rong dkk, 2011), memiliki kapasitas tinggi, laju charging-discharging yang tinggi dan termasuk kedalam material zero-strain karena memiliki struktur spinel yang kuat (Wen, 2012) (Nordh, 2013). Namun, rendahnya konduktivitas listrik (10
-13 S/cm) menjadi salah satu kekurangan material Li
4Ti5O12. Sehingga dapat menghambat proses
pelepasan muatan, menyebabkan rendahnya laju pelepasan muatan dan proses difusi ion lithium ketika proses charging dan discharging.
Banyak metode yang digunakan untuk mensintesis material Li4Ti5O12 diantaranya adalah
solid state, hydrotermal, sol-gel, combution, spray pyrolysis dan high Temperature Ball Milling. Pada penelitian sebelumnya (Wei Fang, 2013), telah di dilakukan sintesis Li4Ti5O12/C dengan
metode sol-gel yang kemudian digunakan variasi temperatur saat kalsinasi. Selain itu, Fang juga membandingkan LTO/C dan LTO murni dalam segi performa elektrokimia. Ternyata hasil dari penelitian tersebut menunjukkan bahwa LTO/C mempunyai performa elektrokimia yang lebih bagus dibandingkan dengan LTO murni. Hal tersebut membuktikan bahwa keberadaan karbon sangat berpengaruh terhadap performa dari baterai ion lithium sendiri. Sumber carbon yang dapat digunakan antara lain, polyvinyl alcohol (PVA), citric acid, sucrose, glucose, polyacrylic acid, dan lain sebagainya. Carbon ini tidak hanya menaikkan nilai konduktivitas tetapi juga mengatur ukuran partikel dengan mengurangi aglomerasi.
Pada penelitian ini untuk tahun pertama akan dilakukan proses sintesis Li4Ti5O12 yang
dilapisi dengan carbon. Proses sintesis Li4Ti5O12 dengan menggunakan metode Solid State
Reaction dengan ball milling. Sedangkan proses pelapisan carbon menggunakan metode baru yakni dengan teknik karbonisasi polyaniline. Variasi yang digunakan waktu pemberian
polyanilline (sebagai sumber carbon) yang nantinya akan berpengaruh pada ketebalan lapisan carbon yang digunakan. Sedang untuk tahun kedua dan ketiga akan dilakukan proses doping Fluorine dan Iodine. Adanya variasi-variasi yang diberikan ini diharapkan dapat menghasilkan fasa spinel LTO dengan ukuran butir yang diinginkan serta dapat meningkatkan nilai konduktivitas sehingga mampu mendapatkan performa baterai yang lebih baik dari pada penelitian-penelitian yang telah dilakukan sebelumnya. Pengujian yang dilakukan pada penelitian ini adalah pengujian XRD dan SEM/EDX serta TEM untuk melihat struktur kristal dan morfologi dari Li4Ti5O12, TGA/Carbon Analyzer untuk
mengetahui kandungan karbon yang berhasil dilakukan dan pengujian cyclic voltametri, charge/discharge dan electrochemical impedance spectroscopy untuk mengetahui performa elektrokimianya.
2.2. Perumusan dan Batasan Masalah
Perumusan masalah dalam penelitian ini adalah:
1. Bagaimana pengaruh variasi prosentase polyaniline terhadap hasil coating carbon dan nitrogen pada performa elektrokimia anoda baterai dari Li4Ti5O12 dengan metode solid
state reaction.
2. Bagaimana pengaruh variasi doping TiO2 dan fluorine terhadap hasil sintesis dan
performa elektrokimia anoda baterai dari Li4Ti5O12 dengan metode solid state reaction.
Batasan masalah yang digunakan pada penelitian ini agar diperoleh hasil yang sesuai dan tidak menyimpang adalah sebagai berikut:
1. Ukuran butir pada prekusor dianggap homogen 2. Temperatur saat kalsinasi dianggap konstan
2.3. Tujuan khusus dari penelitian
Penelitian ini memiliki beberapa tujuan yaitu:
1. Menganalisis pengaruh variasi prosentase polyaniline terhadap hasil coating carbon dan nitrogen pada performa elektrokimia anoda baterai dari Li4Ti5O12
dengan metode solid state reaction
2. Menganalisis pengaruh variasi doping TiO2 dan fluorine terhadap hasil sintesis
dan performa elektrokimia anoda baterai dari Li4Ti5O12 dengan metode solid
2.4. Relevansi
Kontribusi bagi riset unggulan perguruan tinggi berkaitan dengan studi material dan nanoteknologi yaitu memberikan hasil bagi proses sintesa dan analisa Li4Ti5O12 yang belum
banyak diolah dan dimanfaatkan sebagai anoda baterei ion lithium yang selama ini biasanya menggunakan material grafit. Selain itu manfaat jangka panjang yang diperoleh adalah untuk keberlangsungan dan meningkatkan kehidupan ekonomi masyarakat dan industri menuju kemandirian teknologi nasional khususnya teknologi pembuatan material untuk baterei ion lithium.
2.5. Target Luaran
a. Temuan berupa material dengan metodologi baru untuk proses pelapisan karbon yang dapat memberikan kapasitas maksimal sebagai anoda baterei ion lithium
b. Publikasi di seminar internasional minimal 1 kali pertahun c. Publikasi satu buah paper di jurnal internasional Q1 pertahun
BAB III TINJAUAN PUSTAKA
3.1 Baterai Lithium
Awal mulai Baterai lithium non-rechargeable ditemukan pada tahun 1970. Berbagai usaha dilakukan dalam mengembangkan baterai lithium rechargeable sampai 1980 tetapi gagal karena masalah keselamatan, Hal ini dipengaruhi karena sifat yang tidak stabil dari lithium metal. Penelitian untuk memperoleh cell baterai terus dilakukan hingga pada tahun 1990 perusahaan sony mengkomersilakan baterai lithium ion. Berikut pada tabel 2.1 merupakan rangkuman sejarah perkembangan baterai. Beberapa baterai yang sering digunakan dan tersedia dipasaran dengan spesifikasi tertentu diataranya nickel-cadmium, nickel-metal hydride, dan baterai lithium-ion.
Tabel 3.1 Sejarah perkembangan baterai (Battery management system)
Year Researcher (Country) Method
1880 Volta Invention of the battery
1859 Plante (France) Invention of the lead-acid
battery
1899 Jungner (Sweden) Invention of the
nickel-cadmium battery
1901 Edison (USA) Invention of the nickel-iron
battery
1932 Schlecht and Ackermann (Germany) Invention of the sintered pole plate
1947 Neumann (France) Successful sealing of the nickel-cadmium battery
1990 Sanyo (Japan) First commercial introduction
of the NiMH battery
1990 Sony (Japan) First commercial introduction
of the Li-ion battery
Lithium merupakan metal yang ringan dan memiliki tegangan yang paling tinggi dibandingkan logam lainnya. Baterai Lithium memiliki kapasitas jenis (Specific capacity) yang cukup besar yakni 3.600 Ah/Kg. Baterai Lithium ion ditemukan pertama kali pada tahun 1970 oleh M.s Whittingham dengan memanfaatkan Titanium (II) Sulfide sebagai katoda dan lithium metal sebagai anoda.
Baterai lithium lebih populer digunakan sebab lebih ringan, berkapasitas besar, lebih awet dan yang terpenting tidak terdapatnya efek memory hingga tidak perlu menunggu hingga baterai benar-benar kosong untuk melakukan pengisian ulang. Disamping kelebihan yang dimiliki terdapat beberapa kelemahan dari baterai lithium antara lain sangat sensitif pada suhu tinggi, dapat meledak
dan sering tarjadi degradasi yang menyebabkan penurunan kapasitas, Namun tingginya kerapatan energi dan daya yang dimiliki baterai lithium dibandingkan baterai lainnya menyebabkan pengembangan dan penelitian terhadap baterai ini sangat potensial, hal ini dapat dilihat pada Gambar 2.1
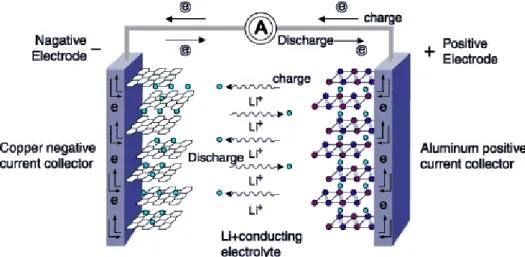
Gambar 3.1. Perbandingan beberapa teknologi baterai pada spesifik power dan spesifik energi density. (Rahman, 2011) Baterai lithium ion merupakan komponen yang paling banyak digunakan pada perangkat elektronik. Baterai lithium ion sendiri bekerja dengan konsep elektrokimia dimana energi kimia akan diubah menjadi energi listrik. Untuk memperoleh baterai dengan kapasitas dan performa yang baik perlu diperhatikan dalam penentuan material yang digunakan sebagai anoda dan katoda. Gambar 2.2 memperlihatkan kombinasi material anoda, elektrolit dan katoda yang biasanya digunakan pada baterai lithium ion.
Gambar 3.2 Kombinasi komponen baterai ion lithium (Advances in Lithium Ion Batteries, 2002)
Pada umumnya material yang digunakan sebagai material katoda dapat berupa Lithium atau paduannya sedangkan untuk bahan anoda dapat menggunakan karbon atau grafit. Namun kapasitas spesifik yang dimiliki oleh grafit sangat rendah berkisar 372 mAhg-1 dengan kapasitas tersebut grafit
tidak dapat memenuhi kebutuhana perangkat elektronik yang semakin hari membutuhkan kapasitas energi yang tinggi. Untuk menggantikan fungsi grafit maka yang menjadi kandidat potensial ialah penggunaan oksida logam transisi seperti Fe2O3, NiO, Co3O4 dan lainnya yang mampu
menghasilakan kapasitas tinggi hingga lebih dari 700 mAhg-1 (Minghao Wu, 2014). Diantara bahan-bahan tersebut Fe2O3 lebih menarik perhatian sebab secara teoritis kapasitas yang dimiliki cukup
besar 1007 mAhg-1, murah, ramah lingkungan, dan tersedia dalam jumlah besar (Wang, 2014)
3.2 Prinsip Kerja Baterai Lithium
Prinsip kerja Baterai Lithium memanfaatkan reaksi reduksi dan oksidasi untuk menghasilkan listrik pada kedua elektrodanya. Baterai Lithium menggunakan komposit yang berstruktur layer, dimana material Li atau dapat juga LiMn2O4 sebagai Katodanya dan material Fe2O3 sebagai Anoda.
Baterai Lithium-Ion terdiri dari Anoda, Elektrolit, Separator, dan Katoda. Pada umumnya, Katoda dan Anoda terdiri dari dua bagian, yaitu material aktif sebagai tempat keluar masuknya ion Lithium dan Pengumpul electron sebagai collector current.
Gambar 3.3 Struktur Baterai Lithium (Technology Lithium Battery)
Reaksi yang terjadi pada sistem litium ion baterai merupakan reaksi redoks atau reaksi reduksi dan oksidasi. Reaksi reduksi merupakan reaksi penambahan elektron sedangkan reaksi oksidasi merupakan reaksi pelepasan elektron. Pada proses saat penggunaan listrik atau discharging elektron akan mengalir dari anoda menuju katoda melalui kabel konektor sedangkan litium yang berada pada sistem akan terlepas dari anoda akibat kekurangan elektron dan berpindah menuju katoda melalui elektrolit. Sebaliknya pada proses pengisian atau Charging elektron dari katoda akan mengalir menuju anoda sedangkan ion litium dalam sistem akan berpindah dari katoda menuju anoda melalui elektrolit Prinsip kerja baterai lithium-Ion ini adalah sebagai berikut.
Gambar 3.4 Proses charging dan Discharging (Rohman, 2012)
Ketika Anoda dan Katoda terhubung maka electron akan mengalir dari Anoda menuju Katoda, maka listrik pun akan mulai mengalir. Dibagian dalam baterai terjadi sebuah proses pelepasan Ion lithium pada Anoda, kemudian Ion tersebut akan berpindah menuju Katoda melalui Elektrolit, untuk Proses pengisian baterai, berbanding terbalik dari proses ini.
3.2 Dasar-dasar elektrokimia
Elektrokimia merupakan sifat-sifat dan reaksi kimia yang melibatkan ion-ion didalam larutan atau padatan. Dalam rangka mempelajari sifat-sifat itu, pada umumnya elektrokimia dibangun dari sel-sel. Sebuah tipe sel terdiri dari dua elektrode, katode dan anode, didalam elektrolit ion-ion melakukan kontak. Sel galvanic adalah sel elektrokimia yang dapat mengkonversikan energi kimia menjadi energi listrik. Sel galvanic membangkitkan listrik yang disebabkan reaksi elektrode spontan didalamnya.
Pada tipe arus baterai lithium-ion, biasanya katoda (elektroda positif) terdiri dari material dengan struktur berlapis, seperti transisi lithium metal oxides dan anoda (elektroda negatif) terbuat dari material graphite berlapis karbon seperti natural graphite dan material karbon namun dalam penelitian ini akan digunakan bahan berupa oksida logam yakni Fe2O3. Sedangkan untuk Elektrolit
non-aqueous (contoh LiPF6 dalam ethylene carbonate/ dimethyl carbonate) dengan separator atau gel polimer atau selektrolit polimer padat yang ditempatkan antara elektroda sebagai tempat untuk transfer ion. Diagram skema proses charge/ discharge didalam baterai lithium-ion rechargeable ditunjukan pada gambar 2.5
Gambar 3.5 Prinsip operasi baterai lithium ion selama charge dan discharge (Wakihara, 2001; Nazri et al., 2009) Mekanisme dari baterai lithium-ion dapat di terlihat seperti aliran ion lithium dalam baterai antara anoda dan katoda, dan pada saat yang sama, transportasi elektron luar baterai (sirkuit eksternal) antara anoda dan katoda. Ion-ion lithium yang berada didalam katoda. Sel-sel tersebut memerlukan charge terlebih dahulu untuk mengalirkan ion-ion lithium menjadi de-interkalasi dari katode dan menyebar melalui elektrolit menuju anoda. selama proses discharge, ion-ion lithium keluar dari anoda dan menyisip kedalam katoda melalui elektrolit. Proses interkalasi merupakan proses saat suatu ion atau molekul tersisipkan di antara celah van der waals partikel padat atau molekul lain. Saat bekerja sebagai sumber listrik, elektroda positif akan bekerja sebagai tempat interkalasi ion lithium dan elektroda negatif sebagai tempat de-interkalasi ion lithium dimana terjadi oksidasi dengan melepas sejumlah elektron dan ion Li+. Sedangkan saat baterai mengalami pengisian ulang terjadi proses eletrolisis dimana terjadi oksidasi pada elektroda positif dan terjadi interkalasi pada elektroda negatif dimana ion lithium akan menyusup pada celah-celah anooda. Rangkaian dari ion-ion lithium dan elektron-elektron terjadi secara bersama-sama dari reaksi tersebut, Li → Li+ + e-, dimana katoda dioksidasi dan anoda direduksi selama proses charge. Reaksi-reaksi yang terlibat dalam proses charge dan discharge pada anoda Fe2O3 digambarkan seperti dibawah
Discharge
Fe2O3 + 6Li+ +6e 3Li2O + 2Fe (2.1)
6Li+ + 6e 6Li (2.2) Reaksi keseluruhan:
Fe2O3 + 6Li ↔ 3Li2O + 2Fe (2.3)
Kemampuan elektroda harus dapat mengalirkan ion-ion lithium dan elektron-elektron, dengan demikian elektroda harus memiliki konduktifitas ionik dan konduktifitas elektronik yang baik. Ion-ion lithium (Li+) bergerak bolak-balik antara katoda dan anoda selama proses charge dan discharge, yang mana dapat menyebabkan perbedaan potensial sekitar 3 volt antara dua elektroda, sedangkan kapasitas baterai tergantung jumlah ion lithium yang dapat keluar dari katoda. Nama lithium ion untuk baterai karena mekanisme yang sederhana yaitu transfer ion-ion lithium diantara anoda dan katoda.
Baterai lithium ion tersusun atas 4 kelompok utama yakni Katoda, anoda, elektrolit dan separator. baterai lithium saat ini banyak menggunakan bahan material LiCoO2 sebagai katoda, graphite sebagai anoda dan campuran LiPF6, EC, DEM, dan DMC sebagai elektrolit dan polypropylene sebagai separatornya. Yang penjadi perhatian saat ini ialah kapasitas energi yang dimiliki karbon yang relatif rendah, yakni hanya berkisar 372 mAhg-1. oleh sebab itu penelitian mulai beralih untuk memanfaatkan oksida logam sebagai pengganti karbon. Salah satunya yang memiliki potensi yakni penggunaan Fe2O3.
3.4. Karakteristik anoda baterai lithium ion
Anoda pada umumnya tersusun atas 2 bagian yaitu bagian pengumpul elektron dan material aktif. Untuk bagian pengumpul elektron biasanya menggunakan lapisan film tembaga, selain stabil, harga relatif murah. Sedangkan pada bagian material aktif, tidak menggunakan logam lithium secara langsung, namun menggunakan material karbon.
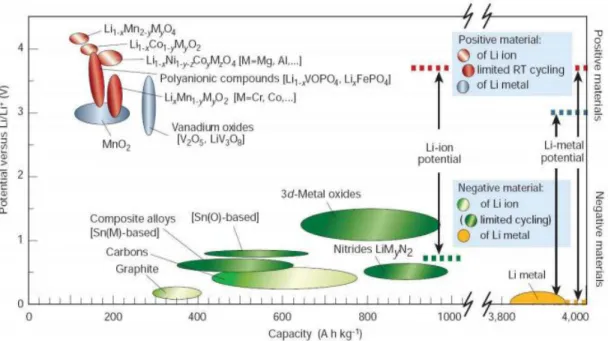
Potensial teoritis bergantung dari jenis bahan aktif yang digunakan dalam sel baterai. Kondisi ini dapat diketahui dari data energi bebas atau potensila elektroda standar pada gambar 2.6 terlihat ringkasan tegangan dan kapasitas dari beragam bahan eletroda.
Gambar 3.6 katoda dan anoda material untuk generasi selanjutnya baterai lithium (Ying wang, 2012)
Penggunaan bahan karbon sebagai elektroda negatif memiliki kekurangan yakni terjadi irreversible capacity. Yaitu, jika baterai dialiri listrik dari luar untuk pertama kalinya dari keadaan kosong, maka ketika digunakan, besar kapasitas/energi yang dilepas tidak sama ketika proses pengisian selain itu rendahnya kapasitas spesifik yang dimiliki oleh karbon hanya berkisar 372 mAhg-1 menyebabkan penggunaan oksida logam teransisi seperti Fe2O3 dapat menjadi solusi. Akan tetapi kunci dari
pengembangan anoda ini adalah tidak hanya pada kepadatan energi yang tinggi namun juga siklus pemakaian (cyclability). Fe2O3 memiliki stabilitas cycle yang rendah selain itu akibat konduktivitas
yang rendah menyebabkan degradasi kinerja dari Fe2O3 saat pengisian dan pemakaian pada
kepadatan arus yang tinggi.
3.5 Material Anoda Li4Ti5O12
Lithium Titanate ( Li4Ti5O12 ), merupakan salah satu material pengganti grafit sebagai
elektroda negatif ( anoda ) pada baterai lithium ion. Li4Ti5O12 yang bekerja pada 1.5V vs Li+/Li
dapat menghindari terjadinya pembentukan lapisan SEI yang biasa terjadi pada tegangan kerja anoda grafit. Selain itu Li4Ti5O12 memiliki sifat , zero strain material, yang mana hanya mengalamai
perubahan ukuran yang sangat kecil setelah proses charge/discharge.
2.4.1 Karakteristik LTO
LTO disebut dengan zero strain material, dikarenakan pada saat proses interkalasi/deinterkalasi hanya mengalami penyusutan sebesar 8.3595 menjadi 8.3538 A, atau hanya sekitar 0.2% perubahan volumenya. Ion Li+ yang memiliki ukuran yang sama dengan yang ada pada struktur kristal LTO, sehingga partikel LTO tidak perlu mengalami ekspansi berlebihan yang berarti dapat mencegah terjadinya fatigue pada material. Hal ini akan menghasilkan pada long cycle-life dan
rate capability yang lebih baik dibandingkan dengan baterai ion lithium konvensional (Sandhya,2014).
LTO memiliki struktur face-centered cubic spinel, dengan ukuran lattice parameternya sebesar antara 8.352 sampai 8.370 A. Struktur spinel ini memiliki dua kisi yang berfungsi sebagai tempat tinggal ion ion penyusunya, yaitu kisi tetrahedral ( A ) dan kisi octahedral ( B ). Kisi kisi tersebut dibedakan oleh bilangan koordinasi oksigen, dimana kisi A mempunyai tetangga 4 anion oksigen lainya, sedangkan kisi B mempunyai 6 anion tetangga oksigen. Pola susunan ion-ion LTO spinel adalah kubus pusat muka ( FCC ). Satu unit sel mengandung 32 anion oksigen dan kation-kation logamnya tersebar dalam dua kisi yang berbeda, yaitu 64 kisi tetrahedral dan32 kisi octahedral. Tetapi perlu diketahui bahwa dari 96 kisi ini hanya 24 kisi saja yang diisi oleh ion-ion logam, yaitu 8 kisi tetrahedral dan 16 kisi octahedral. Struktur kristal spinel dapat dilihat pada Gambar 2.11 (Subhan, 2011 ).
Gambar 2.11 Struktur Kristal LTO, yang terdiri dari tetrahedral 8a, octahedral 16c, octahedral 16d. ( Zhao,2015 )
2.4.2 Keuntungan dan kerugian LTO
Keuntungan penggunaan LTO sebagai anoda pada baterai berbasis ion lithium adalah sifatnya yang tidak mengalami penyusutan pada saat proses pemakaian dan pengisian ( Sandhya, 2014 ). Pada LTO tidak diperlukan ekspansi yang terlalu besar apabila ion Li+ akan melakukan proses interkalasi dan deinterkalasi, hal ini disebabkan karena ukuran ion pada LTO dan Li+ adalah sama. Selain karena sifat zero strain material nya, potensial elektrokimia yang berada pada 1,5V vs Li+/Li, dapat menghindari terjadinya proses reduksi elektrolit, yang dapat memicu terbentuknya lapisan SEI pada anoda, seperti yang terjadi pada anoda grafit. Dengan menjadikan morfologi dari LTO menjadi ukuran nanopartikel, dapat meningkatkan rate charge/discharge dari baterai ion
lithium, dikarenakan lintasan yang dilalui oleh ion Li+ selama proses interkalasi /deinterkalasi menjadi lebih kecil (Chao, 2014).
Selain keuntungan yang dimiliki oleh LTO sebagai anoda dalam baterai ion lithium, LTO juga memiliki kekurangan, diantaranya adalah konduktivitas ionik dan konduktivitas listrik yang relative rendah. Hal ini dapat menyebabkan rate capability yang rendah. Namun, hal ini dapat dihindari dengan berbagai cara diantaranya adalah dengan doping kation maupun pelapisan dengan karbon (Liu,2014).
2.5 Sintesis Li4Ti5O12
Sebelum munculnya baterai ion lithium, logam lithium digunakan untuk baterai primer. Ketika lithium digunakan sebagai anoda pada baterai lithium sekunder diperoleh densitas energi yang tinggi, karena lithium murni memiliki spesifik kapasitas yang tinggi. Namun menggunakan bahan ini masih tidak efisien, alasannya karena bahan yang digunakan yaitu logam lithium yang berbahaya bagi kesehatan. Pada siklus charge-discharge, lithium sering terdeposisi menjadi sebuah dendrit. Dendrit pada lithium ini memiliki pori, luas permukaan yang tinggi, dan sangat reaktif dalam elektrolit organik. Dendrit lithium secara bertahap tumbuh pada siklus baterai digunakan dan menembus separator setelah beberapa siklus pemakaian. Hal ini akan mengakibatkan arus pendek dan dapat menyebabkan kebakaran atau ledakan. Masalah yang berkaitan dengan penggunaan logam lithium sebagai anoda dapat diatasi dengan menggunakan paduan sebagai anoda baterai lithium. Bahan paduan yang paling umum digunakan sebagai anoda yaitu karbon (baik grafit maupun karbon non-grafit) dan paduan logam, seperti Sn, Al, Pb, Bi, As, dan lain-lain (Yueping, 2003).
Baterai lithium yang menggunakan anoda mengalami penurunan kapasitas dengan cepat setelah hanya beberapa siklus charge-discharge karena adanya perubahan volume yang besar sehingga mengakibatkan perubahannya paduan kisi kristal dan dengan demikian menimbulkan retak dan runtuh pada paduan (Zempachi et al, 2009).
Ada tiga persyaratan dasar untuk bahan anoda:
1. Potensial dari interkalasi dan deinterkalasi dari Li+/Li harus serendah mungkin.
2. Jumlah lithium yang dapat ditampung anoda harus setinggi mungkin untuk mencapai kapasitas yang tinggi.
2.5.3 Proses Kalsinasi
Proses kalsinasi adalah proses perlakuan panas yang diterapkan pada sebuah bahan yang bertujuan untuk dekomposisi termal, transisi fasa, dan penghapusan fraksi volatile, serta berfungsi untuk mengeliminasi senyawa yang berikatan secara kimia (Husni, 2010). Proses kalsinasi terjadi pada temperatur di bawah titik lebur bahan untuk menghilangkan kandungan bahan yang dapat menguap. Kalsinasi berperan dalam proses penghilangan air, karbon dioksida atau gas lain. Kalsinasi berbeda
dengan proses pemanggangan, dimana jika pada proses pemanggangan reaksi gas-solid lebih kompleks terjadi antara padatan dan atmosfer dari tungku (Sugiono, 2002).
Produk dari proses kalsinasi biasanya disebut secara umum sebagai kalsin. Kalsinasi diproses dalam sebuah tungku atau reaktor seperti furnace, rotary kiln, dan tungku perapian ganda. Semakin tinggi temperatur kalsinasi semakin besar ukuran partikel. Ini disebabkan karena proses kalsinasi akan menyebabkan reaksi zat padat, pengkristalan dan terjadi peleburan sehingga ikatan akan terlepas. Kalsinasi dilakukan pada suatu bahan untuk memutus ikatan molekul antar senyawa pada bahan tersebut (Wang,2003).
2.6 Bahan Pembentuk Li4Ti5O12
Li2CO3 (Lithium Carbonate)
Karakterisasi dari Li2CO3 diantaranya adalah serbuk berwarna putih, dengan titik lebur pada 735 0C,
terurai pada suhu 1200 0C, dan indeks refraksi 1.428 (Prihandoko, 2007). Bersifat hygroscopis, mampu menyerap H2O dari lingkungan, memiliki toksitas rendah. Dalam pembentukan keramik dan
gelas lithium karbonat digunakan sebagai katalis dan sebagai lapisan untuk menyatukan elektroda, sedangkan dalam medis sebagai anti depresan. Bentuk kristal Li2CO3 adalah monoklinik.
(Prihandoko, 2007)
TiO2 (Titanium Oxide)
Titania (TiO2) bersifat polimorfi dengan struktur kristal yaitu 2 fasa yang stabil pada suhu rendah
antara lain anatase dan brookit, sedangkan 1 fasa yang lain yaitu rutil stabil pada suhu tinggi. TiO2
memiliki struktur dasar quasi hexagonal closed packed (HCP) dari oksigen, sedangkan kationnya mengisi separuh sisipan oktahedral. Namun dalam kenyataannya strukturnya berbentuk tetragonal. Jadi Anatase, brookit dan rutil masing-masing memiliki bentuk struktur yang sama yaitu tetragonal dengan parameter kisinya. Bentuk struktur kristal TiO2 ditunjukkan pada gambar 2.10.
Karakteristik dari TiO2 diantaranya serbuk berwarna putih, memiliki titik lebur 1843 0C, densitas
4230 kg.m-3, tidak mudah terbakar dan tidak mengandung racun (Prihandoko, 2007). Berdasarkan bentuk struktur kristal TiO2 dapat menyebabkan difusi anisotropik dari kation Ti4+ ke arah sumbu
c lebih besar dari pada ke arah sumbu a. Memiliki konduktifitas listrik yang rendah dan konstanta dielektrik yang tinggi.
(a) (b)
Gambar 2.10 Struktur Kristal Oktahedral Dalam Tetrahedral (A). TiO2 Anatase,
2.8 Penelitian sebelumnya
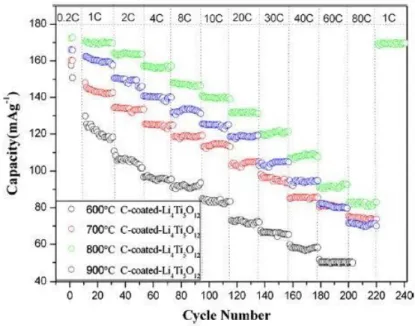
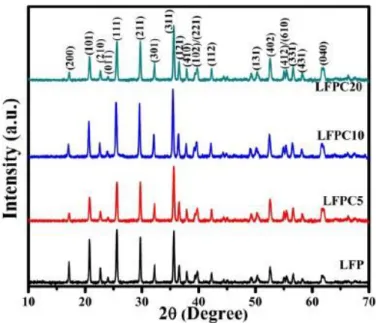
Pengujian mengenai pemakaian karbon untuk meningkatkan nilai konduktivitas sudah banyak dilakukan terbukti dengan adanya beberapa jurnal yang membahas mengenai hal tersebut (Fang dkk, 2013). Peneliti mensintesis LTO murni dan LTO/C dengan menggunakan metode sol-gel yang kemudian dikalsinasi pada temperature 600, 700, 800 dan 900 0C selama 12 jam. Karakteristik material dilakukan dengan menggunakan XRD, SEM, TEM dan HRTEM sedangkan untuk mendeteksi adanya karbon digunakan raman spectroscopy. Hasil penelitian mengidentifikasi bahwa dibandingkan dengan sintesis pada temperatur 600, 700, 900 0C dan LTO murni, LTO/C nanopartikel yang disintesis pada temperature 800 0C dapat meningkatkan rate performance dan cycling performance dari baterai ion lithium. Baterai ion lithium dengan nanocrystalline LTO digunakan sebagai anoda menunjukkan kapasitas reversible yang unggul dari 169, 141, 132, 106 dan 82 mAh/g pada current density dari 1, 10, 20, 40, dan 80 C. Hal ini ditunjukkaan pada gambar 2.5 dan tabel 2.6.
Gambar 2.5 Rate Performance Dari Komposit LTO/C Yang Dikalsinasi Pada Temperatur 600, 700, 800, 900 0C Dengan Range Tegangan Dari 1 Sampai 2,5 V.
(Fang, 2013)
Gambar 2.6 menunjukkan kurva performa tes sel (Li/LTO) dengan serbuk yang dikalsinasi pada temperatur 600, 700, 800 dan 900 0C. Pada kurva tersebut terlihat hubungan antara rate (C) dan kapasitas (mAg-1). Pada rate 1-10 C mempunyai arus density yang rendah, kapasitas peluruhan LTO/C lebih cepat dan arus discharge tinggi. Tingkat kapasitas discharge pada 10-80 C menjadi lebih teratur (Fang, 2013).
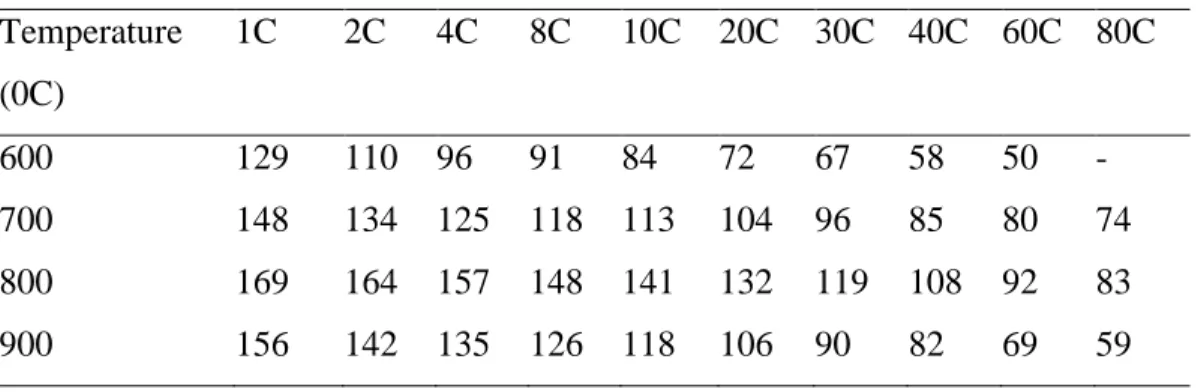
Tabel 2.4 Perbandingan Rata-Rata Perbedaan Dari Kemampuan Dischrge Pertama (Mahg-1) Dari Sintesis LTO/C Pada Temperatur 600, 700, 800 Dan 900 0C.
Temperature (0C) 1C 2C 4C 8C 10C 20C 30C 40C 60C 80C 600 129 110 96 91 84 72 67 58 50 - 700 148 134 125 118 113 104 96 85 80 74 800 169 164 157 148 141 132 119 108 92 83 900 156 142 135 126 118 106 90 82 69 59 Sumber :Fang, 2013
Pengujian lain yang menunjukkan bahwa sumber karbon acetylene gas memiliki pengaruh penting terhadap sifat dari baterai ion lithium. Pada penelitian yang dilakukan oleh Rakesh dan Amrish (2017). Peneliti mensintesis prekursor diantarnya yaitu LiOH.H2O, FeC2O4.2H2O dan H9N2O4P
dengan menggunakan planetary ball mill selama 6 jam pada 400 rpm. Setelah itu di dekomposisi pada temperatur 350 0C selama 5 jam yang kemudian dikalsinasi pada temperatur 750 0C selama 12 jam. Pada saat kalsinasi ini material di aliri gas acetilen dan Ar/H2 (95:5 V%) dengan variasi lama pengaliran gas yakni 5, 10,15, dan 20 menit.
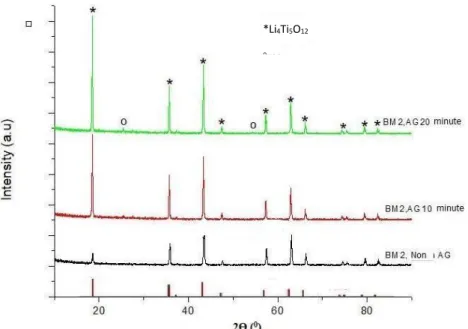
Gambar 2.7 adalah hasil XRD material yang telah dikalsinasi dan dialiri gas asetilen. Semua puncak pada XRD mengidentifikasi pada sistem Kristal yakni orthorombic dengan space group pnma. Tidak ditemukan puncak pengotor seperti Fe2O3 dan Li3Fe2(PO4)3 yang mungkin dapat diakibatkan oleh
oksidasi dari iron selama proses berlangsung (Lu dkk., 2009). Setelah dilapisi proses carbon-coating tidak ada puncak yang bertambah terkait carbon yang terdeteksi, indikasi bahwa keberadaan karbon pada sampel adalah kristalin yang rendah (Saroha dkk., 2017).
Gambar 2.7 Kurva Hasil XRD Material Yang Telah Dikalsinasi Dan Dialiri Gas Acetylene Selama 5,10,15 Dan 20 Menit.(Rakesh, 2017)
Gambar 2.8 (a)-(d) menunjukkan inisial kurva charge/discharge dari semua sintesis sampel penelitian pada perbedaan C-rates dari 0,1C-5C dengan rentang potensial 2,0-4,4 V dengan Li+/Li pada temperature ruag. Dapat dilihat bahwa dari grafik menunjukkan bahwa diantara semua sintesis sampel, LFP10 menghasilkan kapasitas discharge yang tinggi pada setiap rate, yang karena bertambahnya konduktivitas listrik. Jumlah karbon konduktif mempunyai peran penting dalam mendapatkan kinerja elektrokimia yang superior. Lapisan karbon menghambat pertumbuhan partikel dan dengan demikian menurunkan panjang difusi lithium-ion. Namun, karbon amorf bertindak sebagai unsur mati, yang tidak berkontribusi terhadap kinerja elektrokimia. Oleh karena itu, kehadiran karbon amorf lebih mengarah ke lapisan karbon yang lebih tebal, yang selanjutnya akan meningkatkan panjang difusi ion litium dan resistansi muatan-transfer dan karenanya, kinerja elektrokimia yang buruk.
2.9 Road Map Penelitian Mengenai Aplikasi Li4Ti5O12 sebagai bahan anoda
untuk baterei ion lithium
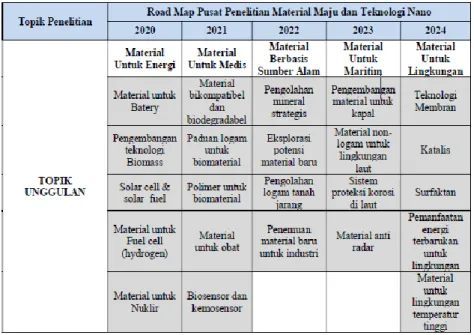
Berikut ini adalah Roadmap Pusat Studi Sains, Material dan Nanoteknologi ITS dimana salah satu bidang unggulannya adalah Material Energi yang di dalamnya terdapat bidang penelitian material aktif baterei ion lithium. Untuk itu topik pada penelitian ini sejalan dengan bidang unggulan pada Pusat Studi Sains, Material dan Nanoteknologi.
Gambar 3.8 Road map Pusat Studi Sains, Material dan Nanoteknologi
Sedang Penelitian yang dilakukan di laboratorium pada awal tahun 2018 bertujuan untuk mengetahui proses sintesa Li4Ti5O12 dengan menggunakan solid state seperti pada gambar 2.9.
BAB IV METODE
4.1 Alat dan Bahan Penelitian 4.1.1 Bahan Penelitian
1. Titanium Oksida (TiO2) anatase Merck 99%
Dalam bentuk serbuk
2. Lithium Hidroxide (LiOH) Merck 98% Dalam bentuk serbuk
3. Sodium Hidroxide (NaOH) SAP Chemical 98% Dalam bentuk serbuk
4. Hydrocloric Acid (HCl) SAP Chemical 98% Sebagai agen pertukaran ion (ion exchange)
5. Sukrosa (C12H22O11)
Sebagai sumber karbon pada proses carbon coating 6. Lithium Hexaflourophosphate (LiPF6)
Sebagai elektrolit pada pengujian electrochemical performance
7. Lithium Metal
Sebagai counter electrode dan working electrode
8. Copper foil
Sebagai current collector
9. Polypropilene (PP) Sebagai separator 10. Acetylene Black (AB)
Dalam bentuk serbuk berwarna hitam sebagai conductive agent
11. Polyvinylidene fluoride (PVDF)
Dalam bentuk serbuk berwarna putih sebagai binder agent bersama AB 12. N-Methyl-2-pyrrolidone (NMP) Merck 99.5%
Dalam bentuk larutan, sebagai pelarut AB dan PVDF 13. Aquades/Air Suling (H2O)
4.2 Peralatan dan Pengujian
Peralatan yang digunakan pada percobaan ini adalah 1. Autoclave
Digunakan untuk proses hidrotermal. 2. Neraca Analitik (Digital)
Digunakan untuk menimbang massa dari bahan-bahan penelitian seperti NaOH, TiO2 anatase, dan
LiOH 3. Kaca Arloji
Digunakan sebagai tempat penimbangan bahan-bahan saat proses penelitian 4. Mortar dan Pestle
Digunakan sebagai penghancur dan menghaluskan serta pencampuran dalam proses penelitian
5. Beaker Glass
Digunakan untuk wadah melarutkan bahan dalam proses penelitian 6. Gelas Ukur
Digunakan untuk mengukur volume larutan 7. Spatula
Digunakan sebagai pengaduk dalam proses penelitian 8. Hot plate with magnetic stirrer
Digunakan untuk mencampur dan mengaduk larutan agar menjadi homogen
9. Muffle Furnace
Digunakan untuk melakukan pemanasan dalam proses hidrotermal dan proses pengeringan 10. Crucible
Digunakan sebagai wadah specimen hasil sintesis hidrotermal dalam proses kalsinasi dan pengeringan
11. Gloves
Untuk melindungi tangan saat bekerja dengan bahan-bahan berbahaya 12. Alat uji karakterisasi morfologi dan struktur material
a. SEM (Scaning Electron Microscope)
b. XRD (X-ray Diffraction)
13. Alat uji electrochemical performance
a. Galvanostatic charge-discharge (CD) b. Cyclic Voltammetry (CV)
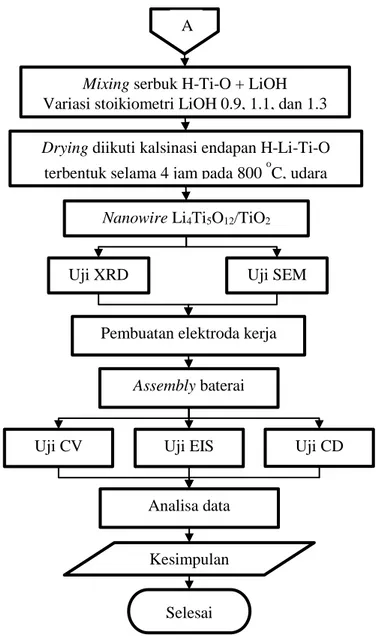
Diagram alir penelitian untuk tahun kedua
Assembly baterai
Uji CV Uji EIS Uji CD
Pembuatan elektroda kerja
Analisa data
Selesai Kesimpulan
Drying diikuti kalsinasi endapan H-Li-Ti-O terbentuk selama 4 jam pada 800 oC, udara
Uji XRD Uji SEM
Mixing serbuk H-Ti-O + LiOH Variasi stoikiometri LiOH 0.9, 1.1, dan 1.3
A
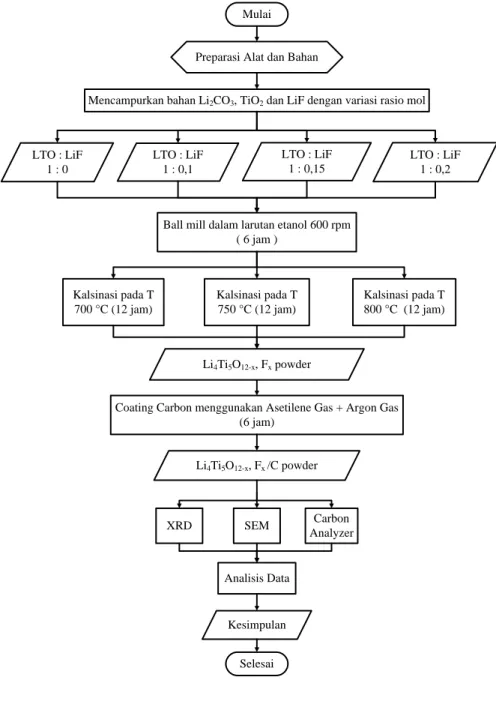
Diagram alir penelitian untuk tahun ketiga Mulai LTO : LiF 1 : 0 LTO : LiF 1 : 0,15 LTO : LiF 1 : 0,1
Ball mill dalam larutan etanol 600 rpm ( 6 jam )
Preparasi Alat dan Bahan
Selesai Kalsinasi pada T 700 °C (12 jam) Kalsinasi pada T 750 °C (12 jam) Kalsinasi pada T 800 °C (12 jam) LTO : LiF 1 : 0,2 Li4Ti5O12-x, Fx powder XRD SEM Carbon Analyzer Analisis Data
Mencampurkan bahan Li2CO3, TiO2 dan LiF dengan variasi rasio mol
Coating Carbon menggunakan Asetilene Gas + Argon Gas (6 jam)
Li4Ti5O12-x, Fx /C powder
Kesimpulan
Sintesis Anoda Li4Ti5O12/C
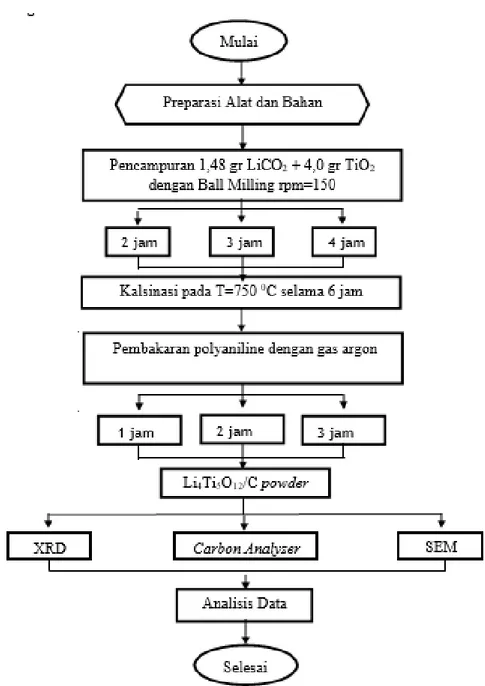
Penelitian ini menggunakan Li2CO3 (merck), dan TiO2 (merck) sebagai prekursor anoda baterai
Li-ion. Acetylene gas yang digunakan berperan sebagai sumber karbon. Tahap pertama yang harus dilakukan untuk sintesis Li4Ti5O12 adalah menimbang masing-masing serbuk yakni 14,778 gr
Li2CO3 dan 39,933 gr TiO2, setelah itu dilakukan pencampuran kedua serbuk dengan akohol (99%)
dalam High Temperature Ball Milling yang dilengkapi zirconia balls dan dikalsinasi pada temperatur 750 0C selama 6 jam. Variasi waktu yag digunakan ketika pencampuran adalah 2, 3 dan 4 jam dengan kecepatan 150 rpm kemudian dikeringkan dalam oven selama 24 jam.
2Li2CO3(S) + 5TiO2(S) = Li4Ti5O12(S) + 2CO2(g) (3.1)
Material yang telah dilakukan pencampuran menggunakan Ball Milling kemudian dilapisi dengan carbon yang bersumber dari acetylene gas. Variasi waktu pelapisan carbon dengan acetylene gas yang digunakan adalah 0, 10, 20 menit.
Pembuatan Working Electrode
Untuk membuat working elektroda dilakukan dengan mencampurkan 80% sampel Li4Ti5O12/C, 10%
acetelyne black (AB), dan 10% Polivinil Difluoride (PVDF) yang berfungsi sebagai pengikat (binder). Kemudian ketiga bahan tersebut dicampurkan melalui proses mixing dengan menggunakan mortar yang berbahan dasar agate hingga homogen. Kemudian hasil pencampuran, ditambahkan larutan N-methylpyrrolidone (NMP) yang berfungsi sebagai pelarut pada material anoda sedikit demi sedikit sampai membentuk slurry. Slurry yang telah terbentuk, dilapiskan ke current collector yang terbuat dari Tembaga dengan ketebalan 100 µm. Hasil pelapisan slurry ke current collector, dikeringkan pada temperatur 100˚C selama 10 jam sebelum di susun menjadi baterai full cell.
Pengujian Karakterisasi Material X –ray Diffraction (XRD)
Pada penelitian ini unutuk mengetahui fasa yang terbentuk pada sampel maka dilakukan pengujian XRD menggunakan instrument PANAnalytical dengan range sudut 10◦-90◦ dan menggunakan panjang gelombang CuKα sebesar 1.54056 Ȧ yang dilakuka di jurusan Teknik Material dan Metalurgi FTI-ITS. Sebelum dilakukan pengujian XRD dilakukan preparasi terhadap sampel berupa digerus terlebih dahulu menggunakan mortar agar didapatkan ukuran yang homogen, kemudian sampel diletakan di tengah-tengah plate agar tepat pada titik fokus hamburan sinar-X .
Secara umum prinsip kerja XRD ditunjukkan oleh Gambar 3.7 pengujian XRD. Generator tegangan tinggi berfungsi sebagai catu daya sumber sinar-X
1. Sampel berbentuk serbuk diletakkan diatas tatakan (palate) yang dapat diatur.
2. Berkas sinar-x didifraksikan oleh sampel dan difokuskan melewati celah, kemudan masuk ke alat pencacah. Apabila sampel berputar sebesar 2θ maka alat berputar sebesar θ.
3. Pola difraksi sinar-x direkam dalam bentuk kurva intensitas terhadap sudut difraksi
Untuk menentukan fasa yang terbentuk dapat dilakukan dengan metode pencocokan terhadap difraksi acuan. Pada penelitian ini digunakan data standar yang diperoleh melalui Joint Committee of Powder Difraction Standart (JCPDS)
Melalui bantuan software highscore plus pertama dilakukan pencarian puncak-puncak difraksi dari sampel (search peak), kemudian dilakukan pencocokan terhadap JCPDS refrensi dalam hal ini adalaha JCPDS No. 49-0207 Akan terlihat puncak yang bersesuaian terhadap acuan, dan apabila ditemukan puncak lain dengan intensitas tinggi namun tidak bersesuaian dengan acuan dapat dikatakan ada suatu pengotor yang harus diidentifikasi
Scanning Electron Microscop (SEM)
Pada penelitian ini menggunakan mesin SEM Inspect S50 menggunakan energy 20 kV dan diambil foto morfologi dengan perbesaran 5000x, 15000x dan 25000x. Preparasi specimen dilakukan dengan cara digerus menggnaka mortar. Pengujian SEM dilakukan di laboratorium karakterisasi jurusan Teknik Material dan Metalurgi ITS.
SEM (Scanning Electron Microscope) adalah salah satu jenis mikroskop electron yang menghasilkan gambar dari sampel dengan menggunakan electron yang terfokuskan. Electron berinteraksi dengan electron pada smpel, menghasilkan beberapa jenis sinyal yang dapat dideteksi dan mengandung informasi tentang topografi permukaan sampel dan komposisinya. Mengamati permukaan pada dengan perbesaran M= 10-100000 X, resolusi permukaan hingga kedalaman 3-100 nm. Gambar mesin SEM yang digunakan dapat dilihat pada Gambar 3.8
Prinsip kerja dari SEM adalah sebagai berikut:
1. Sebuah pistol elektron memproduksi sinar elektron dan dipercepat dengan anoda. 2. Lensa magnetik memfokuskan elektron menuju ke sampel.
3. Sinar elektron yang terfokus memindai (scan) keseluruhan sampel dengan diarahkan oleh koil pemindai.
4. Ketika elektron mengenai sampel maka sampel akan mengeluarkan elektron baru yang akan diterima oleh detektor dan dikirim ke monitor (CRT).
Pengujian Performa Elektrokimia Galvanostatic charge/discharge
Pengujian charge/discharge dilakukan di Laboratorium Baterai Lithium, Lembaga Ilmu Pengetahuan Indonesia - Fisika (LIPI – Fisika) menggunakan alat Automatic Battery Cycler WonATech WBCS3000, seperti pada Gambar 3.10. Pengujian charge discharge digunakan untuk mengetahui kemampuan suatu material untuk menyimpan energi. Kapasitas energi atau muatan dinyatakan dalam satuan mAh/gr. Tes charge-discharge dilakukan dengan kepadatan arus konstan. Kapasitas (Q) dapat dihitung berdasarkan waktu charge discharge menggunakan rumus Q = I x t, dimana I adalah kerapatan arus dan t adalah waktu. Pengaturan waktu dibagi menjadi 2 yaitu T1 sebagai waktu charging, dan T1 sebagai waktu discharging. Kemudian ∆T untuk mengatur waktu jeda antara charging dan discharging. Pengaturan dari ∆T diperlukan untuk mengamati tegangan dari baterai VOCV. Kemudian didapatkan pengamatan rekaman waktu (t / ms), arus (i / Ma), dan
tegangan (V / volt). Dari grafik itu dihasilkan grafik utama yang menunjukkan hasil dari proses charge - discharge yang menampilkan hubungan potensial (V / volt) dan waktu (t / ms seperti yang terlihat pada Gambar . Pengujian charge – discharge dilakukan di Lembaga Ilmu Pengetahuan Indonesia. Pada pengujian ini dihasilkan grafik antara kapasitas dan tegangan, seperti pada Gambar 3.9.
Electrochemical Impedance Spectroscopy
Pengujian EIS pada penelitian ini dilakukan dengan mesin HIOKI resistance meter RM3544 yang dilakukan di pusat studi fisika LIPI, Serpong dengan range frekuensi 0,1 – 20000 Hz seperti pada Gambar 3.11 (a).
Electrochemical Impedance Spectroscopy (EIS) adalah suatu metode untuk menganalisa suatu elektroda terhadap sinyal potensial AC pada amplitudo rendah (~10 mV) dengan frekuensi 0,1 – 20000 Hz dari rentang frekuensi yang sangat lebar.
Prinsip kerja alat ini adalah awalnnya investigasi karakteritik listrik reaksi dalam elektrokimia menggunakan potensial DC sebagai signal pengukuran. Namun penggunan signal DC ini menyebabkan kondisi sistem elektrokimia yang teramati tidak berasa pada fasa kesetimbangan reaksi sesungguhnya akibat potensial DC telah mengubah potensial reaksi yang terjadi. Dan informasi yang terekam pun merupakan kolektifitas seluruh kontribusi individual, sehingga kontribusi dari
tiap individu yang merupakan parameter internal dinamik reaksi elektrokimia tidak dapat diekstrak dari data dengan signal DC ini. Kemudian dicoba dengan menumpangkan signal AC pada tegangan DC. Hasil dari pengujian EIS ini berupa grafik seperti pada Gambar 3.11 (b)
Gambar 3.9 Contoh grafik hasil pengujian charge discharge α-MnO2 nanowire
Gambar 3.11 (a) Alat EIS HIOKI RM3544 (b) Hasil kurva dari pengujian spektroskopi impedansi elektrokimia dari sistem baterai lithium (Hong - Yi Cheng, 2011)
AC impedance spectrocospy merupakan teknik yang sangat bagus untuk menentukan parameter kinetik dari proses elektroda termasuk didalam elektrolit, pasivasi layer, charge transfer, dan Li+ diffusion. Charge-transfer resistance (Rct) salah satu parameter yang penting untuk
mengkarakterisasikan kuantitatif kecepatan sebuah reaksi elektroda. Pengukuran dilakukan dengan menggunakan signal pertubasi AC yang ditumpangkan pada tegangan DC bias, sehingga tidak mengganggu kesetimbangan dari reaksi elektrokimia sel. Spektrum frekuensi yang dibangkitkan akan mengidentifikasi perubahan impedansi komplek yang terkait dengan reaksi elektrokimia yang terjadi, yang menginterpretasikan gejala dinamika internal reaksi elektrokimia. Biasanya, resistansi charge-transfer yang besar menunjukan reaksi elektrokimia yang lambat. Rct dapat dihitung dari
electrochemical impedance Cyclic Voltametry
Pengujian cyclic voltammetry dilakukan di pusat studi fisika LIPI, serpong menggunakan alat voltammetry AutoLab PGSTAT tipe 302N Metrohm. Pure lithium digunakan sebagai elektroda pembanding, LiPF6 sebagai elektrolit dan copper foil sebagai elektroda pembantu. Initial voltage dan
cut-off voltage dari 0.0-3.0 volt dengan scan rate 0.1 mV/s
Prinsip kerja adalah dengan memberikan potensial tertentu pada elektroda kerja, maka akan diketahui arus yang terjadi. Plot antara arus yang diukur dengan potensial kerja yang diberikan disebut voltammogram. Arus yang dihasilkan dari reaksi reduksi disebut arus katodik dan arus yang dihasilkan dari reaksi oksidasi disebut arus anodik. Berdasarkan potensialnya, CV dilakukan sapuan bolak-balik sehingga informasi reduksi dan oksidasi dapat diketahui dengan baik. Dimulai dengan tanda polaritas negatif. Pada titik B potensial menjadi semakin negatif sehingga analit pada elektroda kerja dapat diteduksi, ditandai dengan munculnya arus katodik. Proses reduksi berlangsung hingga hampir semua analit tereduksi, ditandai dengan munculnya puncak arus katodik pada titik C. Arus akan berkurang hingga mencapai titik D, dan tanda polaritas negatifnya mulai berkurang. Arus katodik terus berkurang hingga potensial mencapai titik E, kemudian arus katodik mulai dominan.
Pada titik F arus anodik akan bertambah dengan berkurangnya konsentrasi analit yang tereduksi. Arus anodik berkurang dari puncak hingga kembali kepotensial awal.
A B
Gambar 3.12 (a) Voltamogram hubungan arus terhadap potensial (b) Contoh grafik CV α-MnO2
nanowire (Yi Zang, 2013)
BAB IV
HASIL YANG DICAPAI
4.1 Hasil Pengujian dan Analisis X-Ray Diffraction
Proses karakterisasi pola difraksi sinar-x Li4Ti5O12 dilakukan dengan menggunakan alat uji
XRD dengan tipe Philip Analytical, dimana menggunakan CuK-α sebesar 1.54056 Å sebagai sumber cahaya dengan mengaplikasikan scanning 20/menit dengan rentang sudut 100 sampai 900.
Serbuk Li4Ti5O12 yang disintesis dengan dilakukan variasi waktu pemberian gas asetilen 0,
10 dan 20 menit. Pada Gambar 4.1 ditunjukkan hasil pengujian XRD serbuk LTO dengan variasi waktu pemberian gas asetilen 0, 10 dan 20 menit pada waktu ball milling 2 jam dan setelah dikalsinasi pada temperature 750 0C selama 6 jam. Perbedaan dari ketiga variasi yang dilakukan adalah pada tingkat puncak difraksinya. Tingkat intensitas puncak dan nilai FWHM, berpengaruh pada kristalinitas dari suatu material. Semakin lama variasi waktu pemberian gas asetilen, maka intensitas puncak-puncak fasa yang terbentuk juga semakin tinggi dan nilai FWHM juga semakin kecil berarti menunjukkan material tersebut semakin kristalin. Masing-masing grafik XRD menunjukkan bahwa terdapat fasa dominan yang terbentuk yaitu Li4Ti5O12 tetapi pada waktu pemberian gas asetilen selama 20 menit terdapat
fasa baru yakni fasa TiO2 anatase. Dimana pada sudut sekitar 260 dan 580 terdapat puncak
yang terbentuk meskipun intensitas yang kecil. Fasa TiO2 anatase ini diduga adalah fasa
pengotor yang muncul karena disebabkan oleh waktu pemberian gas asetilen yang terlalu lama sehingga fasa yang awalnya sudah setimbang menjadi tidak setimbang. Unsur Ti yang awalnya berikatan dengan Li terlepas dan membentuk ikatan baru dengan oksigen.
Gambar 4.1 Perbandingan Hasil Pengujian XRD serbuk LTO dengan variasi waktu pemberian gas asetilen 0, 10, 20 menit pada waktu milling 2 jam.
Gambar 4.2 Perbandingan Hasil Pengujian XRD serbuk LTO dengan variasi waktu pemberian gas asetilen 0, 10, 20 menit pada waktu milling 3 jam.
40 *Li4Ti5O12 0TiO 2 Anatase *Li4Ti5O12 0TiO 2 Anatase
Gambar 4.3 Perbandingan Hasil Pengujian XRD serbuk LTO dengan variasi waktu pemberian gas asetilen 0, 10, 20 menit pada waktu milling 4 jam.
Gamabar 4.4 Perbandingan Hasil Pengujian XRD serbuk LTO dengan variasi waktu ball milling 2, 3, dan 4 jam tanpa gas asetilen
Pengamatan struktur kristal dengan XRD dilakukan sebagai tahap awal karakterisasi untuk mengidentifikasi sejauh mana fasa yang terbentuk seperti yang diinginkan dan fasa lain yang tidak diharapkan. Identifikasi material Li4Ti5O12 dari
41 *Li4Ti5O12 0TiO 2 Anatase *Li4Ti5O12 0TiO 2 Anatase
pola XRD memperlihatkan seluruh karakteristik puncak difraksi pada (111), (311), (400), (511) dan (440) yang merupakan fasa-fasa difraksi dari Li4Ti5O12 dengan
struktur kubik spinel dan space group Fd-3m (JCPDS card no 49-0207) (Ding et al, 2013). Pada sudut sekitar 260 dan 580 terdapat puncak yang terbentuk meskipun
mempunyai intensitas yang kecil. Puncak ini diduga adalah puncak dari fasa TiO2
sebagai puncak impuritas. Fasa TiO2 memiliki struktur kristal yaitu anatase dan rutile.
Fasa rutile merupakan fasa fasa TiO2 yang stabil pada suhu tinggi, sementara fasa TiO2
anatase adalah metastabil (Tao Yuan, 2010). Tao Yuan menyebutkan dengan temperatur kalsinasi 750 0C akan muncul impuritas TiO
2 anatase dan kemudian akan
hilang pada temperatur yang lebih rendah. Sampel dengan waktu milling 4 jam memiliki nilai intensitas yang tinggi pada sudut 180 sehingga kristalinitas juga dianggap lebih baik dari pada yang lainnya. Namun dengan lamanya waktu milling ini akan menghasilkan energi yang berlebihan sehingga akan membentuk senyawa baru yaitu TiO2 anatase.
Untuk mengetahui pengaruh waktu pemberian gas asetilen terhadap ukuran kristal, maka perhitungan dilakukan dengan menggunakan persamaan Debye Schrerrer sesuai dengan persamaan 4.1 sebagai berikut.
𝐷 = 0,9 𝜆
𝐵 cos Ɵ ... (4.1)
Dalam hal ini D adalah ukuran kristal (Å), λ adalah panjang gelombang yang digunakan dalam uji XRD yaitu 1,54056 Å, B adalah lebar setengah puncak (FWHM) dalam radian, Ɵ adalah posisi sudut terbentuknya puncak. Untuk perhitungannya mengambil puncak yang memiliki intensitas hampir sama pada masing-masing variasi. Didapat nilai ukuran pada masing-masing variasi pada tabel 4.1.
Tabel 4.1 Perhitungan Ukuran Kristal LTO menggunakan persamaan Debye Schrerrer dengan variasi waktu pemberian gas asetilen 0, 10, dan 20 menit pada waktu ball milling 2 jam.
GA (menit) 2 Ɵ (0) Ɵ (0) FWHM Cos Ɵ D (Å) D (nm)
0 43,5685 21,7843 0,1171 0,9286 12,7512 1,2751 10 43,3477 21,6739 0,1428 0,9293 10,4483 1,0448 20 43,3580 21,6790 0,1171 0,9293 12,7419 1,2742
Tabel 4.2 Perhitungan Ukuran Kristal LTO menggunakan persamaan Debye Schrerrer dengan variasi waktu pemberian gas asetilen 0, 10, dan 20 menit pada waktu ball milling 3 jam.
GA (menit) 2 Ɵ (0) Ɵ (0) FWHM Cos Ɵ D (Å) D (nm) 0 43,4878 21,7439 0,1171 0,9288 12,7477 1,2748 10 43,4801 21,7159 0,0836 0,9290 17,8554 1,7855 20 43,4319 21,7159 0,1506 0,9290 9,9101 0,9910
Tabel 4.3 Perhitungan Ukuran Kristal LTO menggunakan persamaan Debye Schrerrer dengan variasi waktu pemberian gas asetilen 0, 10, dan 20 menit pada waktu ball milling 4 jam.
GA (menit) 2 Ɵ (0) Ɵ (0) FWHM Cos Ɵ D (Å) D (nm)
0 43,4515 21,7257 0,1338 0,9290 11,1552 1,1155 10 43,4342 21,7171 0,1004 0,9290 14,8653 1,4865 20 43,3917 21,6958 0,1224 0,9292 12,1916 1,2192
Tabel 4.4 Perhitungan Ukuran Kristal LTO menggunakan persamaan Debye Schrerrer dengan variasi waktu ball milling 2, 3, dan 4 jam tanpa gas asetilen
BM(jam) 2 Ɵ (0) Ɵ (0) FWHM Cos Ɵ D (Å) D (nm)
2 43,5685 21,7842 0,1171 0,9286 12,7512 1,2751 3 43,4878 21,7439 0,1171 0,9288 12,7477 1,2748 4 43,4515 21,7257 0,1338 0,9290 11,1552 1,1155
Dapat dilihat pada tabel 4.1, material Li4Ti5O12 yang diball milling 2 jam dengan tanpa
diberi gas asetilen memiliki ukuran kristal paling besar yaitu 1,2751 nm. Waktu pemberian gas asetilen 20 menit memiliki ukuran kristal sebesar 1,2742 nm dan ukuran kristal yang paling kecil adalah pada variasi waktu pemberian gas asetilen 10 menit yaitu 1,0448 nm. Dari perhitungan pada tabel 4.2, didapatkan nilai ukuran kristal pada masing- masing variasi. Material Li4Ti5O12 dengan waktu pemberian gas asetilen
10 menit memiliki ukuran kristal terbesar yaitu 1,7855 nm, disusul material Li4Ti5O12 tanpa
gas asetilen sebesar 1,2748 dan material Li4Ti5O12 dengan waktu pemberian gas asetilen 20
menit memiliki ukuran kristal paling kecil yaitu 0,991 nm.
Dari tabel 4.3 diatas didapatkan nilai ukuran kristal tertinggi adalah pada material Li4Ti5O12 dengan variasi 10 menit waktu pemberian gas asetilen sebesar 1,4865 nm
kemudian turun ketika diberi waktu 20 menit pemberian gas asetilen yakni sebesar 1,2192 nm. Nilai ini masih lebih besar dibandingkan dengan nilai ukuran kristal yang tanpa gas asetilen sebesar 1,1155 nm.
Dari tabel 4.4 diatas didapatkan nilai ukuran kristal tertinggi adalah pada material Li4Ti5O12 dengan variasi tanpa pemberian gas asetilen sebesar 1,2751 nm kemudian
turun ketika diberi waktu 10 menit pemberian gas asetilen yakni sebesar 1,2748 nm. Penurunan ini hanya selisih sedikit dibandingkan dengan penurunan ketika waktu pemberian gas asetilen 20 menit yakni sebesar 1,1155 nm.
4.2 Hasil dan analisis SEM-EDX
Proses identifikasi permukaan partikel Li4Ti5O12 dilakukan dengan menggunakan alat
uji Field Emission Scanning Electron Microscope (FESEM). Alat ini membantu untuk mengetahui morfologi dari partikel. Gambar 4.5 menunjukkan hasil foto SEM dari serbuk Li4Ti5O12 dengan waktu pemberian gas asetilen. Pengamatan pembesaran
dilakukan 25000x.
Gambar 4.5 Hasil Uji SEM dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 2 jam
44
Gambar 4.6 Hasil Uji SEM dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 3 jam
Gambar 4.7 Hasil Uji SEM dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 4 jam
Hasil dari pengujian SEM pada material Li4Ti5O12 pada material-material yang dilapisi
dengan carbon dari pemberian gas asetilen. Perbesaran yang digunakan adalah 25000x. Morfologi dari senyawa Li4Ti5O12 secara umum sudah homogen baik waktu pemberian gas
asetilen 10 menit maupun 20 menit. Bentuk morfologi yang didapatkan adalah bentuk butiran dengan ukuran yang berbeda- beda pada setiap sampel. Semakin lama waktu pemberian gas asetilen maka ukuran diameter yang didapatkan juga semakin besar.
45
(a) (b)
Pada gambar 4.5 menunjukkan waktu milling 2 jam dengan (a) pemberian gas asetilen 10 menit rata-rata diameter partikelnya sekitar 0,309 µm. Sedangkan
(b) diameter partikel pada waktu pemberian gas asetilen 20 menit sebesar 0,326 µm. Untuk gambar 4.6 menunjukkan waktu milling 3 jam dengan (a) pemberian gas asetilen 10 menit rata-rata diameter partikelnya sekitar 0,246 µm. (b) diameter partikel pada waktu pemberian gas asetilen 20 menit sebesar 0,275 µm. Kemudian gambar 4.7 menunjukkan waktu milling 4 jam dengan (a) pemberian gas asetilen 10 menit rata-rata diameter partikelnya sekitar 0,298 µm. Sedangkan (b) diameter partikel pada waktu pemberian gas asetilen 20 menit sebesar 0,343 µm.
Bisa dilihat bahwa semakin lama waktu pemberian gas asetilen maka ukuran diameter yang didapatkan juga semakin besar baik pada waktu milling 2, 3 maupun 4 jam. Hal ini kemungkinan disebabkan karena temperatur yang dihasilkan dari pemberian gas asetilen 20 menit lebih lama sehingga terjadi pertumbuhan partikel Li4Ti5O12.
Gambar 4.8 Hasil uji EDX dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 2 jam.
46 (b) (a)
Gambar 4.9 Hasil uji EDX dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 3 jam
Gambar 4.10 Hasil uji EDX dengan variasi waktu pemberian gas asetilen (a) 10 menit dan (b) 20 menit pada waktu ball milling 4 jam
Gambar 4.8; 4.9; dan 4.10 menunjukkan hasil dari EDX material Li4Ti5O12 dengan variasi
waktu pemberian gas asetilen 10 dan 20 menit dengan waktu milling 2, 3 dan 4 jam. Dari gambar terlihat adanya spektrum warna yang menunjukkan adanya unsur-unsur tertentu. Seperti halnya warna kuning menunjukkan unsur C, hijau unsur O, merah unsur Ti dan ungu unsur Li. Unsur yang lebih dominan adalah unsur Ti dan O. Keduanya merupakan unsur utama dalam serbuk Li4Ti5O12. Sementara keberadaan unsur Li selalu lebih sedikit
dibandingkan unsur yang lainnya. Unsur Li tidak dapat terdeteksi oleh sinar X dari EDX dikarenakan Li
47
(a) (b)
(b) (a)
merupakan unsur yang sangat ringan hampir sama dengan unsur hidrogen yang juga tidak akan terdeteksi oleh EDX.
4.3 Hasil Pengujian dan Analisis Carbon Analyzer
Identifikasi kandungan karbon dalam serbuk Li4Ti5O12 di uji dengan mengunakan
Carbon Analyzer seperti yang terlihat pada tabel 4.5 berikut:
Tabel 4.5 Hasil Pengujian Carbon Analyzer LTO dengan waktu ball milling 2 jam dan lama pemberian gas asetilen 10 menit
Berat Bahan (gr) Kadar C (%) Keterangan (%)
0,1088 0,0612 Rerata 0,0629 ± 0,1516 0,0609 0,00224 0,1517 0,0631 0,2157 0,0626 0,2011 0,0623 0,5033 0,0671
Tabel 4.6 Hasil Pengujian Carbon Analyzer LTO dengan waktu ball milling 2 jam dan lama pemberian gas asetilen 20 menit
Berat Bahan (gr) Kadar C (%) Keterangan (%)
0,1198 0,0946 Rerata 0,0963 ±
0,0769 0,0969 0,00151
0,1540 0,0975
Tabel 4.5 menunjukkan hasil pengujian carbon analyzer yang dilakukan pada material dengan waktu ball milling 2 jam dan waktu pemberian gas asetilen 10 menit. Pada hasil tersebut terlihat bahwa kadar C (%) dalam 6 kali pengulangan memiliki nilai yang hampir sama yakni berkisar antara 0,0609% hingga 0,0671%. Hal ini membuktikan bahwa material yang diuji memiliki kandungan karbon yang cukup homogen. Rata-rata dari kandungan karbon ini adalah 0,0629%. Tabel 4.6 menunjukkan hasil pengujian carbon analyzer yang dilakukan pada material dengan waktu ball milling 2 jam dan waktu pemberian gas asetilen 20 menit. Pada hasil tersebut terlihat bahwa kadar C (%) dalam 3 kali pengulangan memiliki nilai yang hampir sama yakni berkisar antara 0,0946% hingga 0,0975%. Hal ini membuktikan bahwa material yang diuji memiliki kandungan karbon yang cukup homogen. Rata- rata dari kandungan karbon ini adalah 0,0963%. Jumlah kandungan karbon ini
dinilai terlalu sedikit untuk bisa dikatakan dapat melapisi material Li4Ti5O12 secara menyeluruh. 4.4 Hasil Pengujian dan Analisis Cyclic Voltammetry
Cyclic Voltammetry merupakan teknik voltametri dimana arus yang diukur selama penyapuan (scanning) potensial dari potensial awal ke potensial akhir kembali lagi kepotensial awal yang disebut 1 siklus. Dengan demikian arus katodik dan anodik dapat diukur. Prinsip dari cyclic Voltammetry adalah melihat hubungan potensial yang diberikan dan arus yang terukur karena melibatkan reaksi redoks diantara anoda dan katoda. Reaksi kedua elektroda tersebut dimonitor besarnya arus yang timbul pengukuran arus listrik dilakukan dengan rentang potensial awal dan akhir yang sama. Grafik cyclic volltammetry biasa disebut votamogram siklik.
Kurva cyclic voltametry adalah cycle pertama karena hasil yang didapatkan pada cycle pertama sudah menghasilkan puncak yang tinggi dan tajam. Hasil puncak yang tinggi dan tajam inilah yang diduga sudah terjadi kestabilan pada proses interkalasi dan deinterkalasi didalam baterai. Adanya puncak oksidasi menandakan proses deinterkalasi dan puncak reduksi menandakan adanya proses interkalasi. Puncak oksidasi terbentuk dengan penghilangan empat ion Li+ pada Li2O sesuai dengan persamaan 4.2 dibawah ini:
2Li2O + Ti TiO2 + 4Li (4.2)
(melepas ion Li+)
Sedangkan untuk reaksi yang terjadi saat discharge yaitu reaksi reduksi adalah sebagai berikut:
TiO2 + 4Li +4e- Ti + 2 Li2O (4.3)
(menerima ion Li)
Karakterisasi elektrokimia menggunakan Cyclic Voltammetry (CV) berfungsi untuk melihat adanya reaksi reduksi dan oksidasi yang terbentuk pada sampel. Hasil grafik CV dapat dilihat pada gambar 4.11 hingga 4.14.
Gambar 4.11; 4.12; 4.13; dan 4.14 menunjukkan bahwa material dengan berbagai variasi memiliki puncak oksidasi dan puncak reduksi. Puncak oksidasi dan
reduksi yang tinggi dan runcing menunjukkan bahwa material semakin kondukrif tetapi selain itu perlu dilihat dari energi polarisasi yang dihasilkan. ΔE polarisasi yang terendah adalah material Li4Ti5O12 dengan waktu milling 2 jam dan waktu pemberian
gas asetilen 10 menit. Rendahnya ΔE polarisasi ini mengartikan bahwa waktu ion Li dan elektron yang berpindah juga akan semakin cepat karena ΔE polarisasi juga semakin singkat atau kecil. Sama halnya dengan variasi waktu milling 2, 3, dan 4 jam tanpa pemberian gas asetilen. Waktu 2 jam milling mempunyai nilai ΔE polarisasi yang terendah hal ini menandakan milling 2 jam lebih efisien dibandingkan waktu milling 3 dan 4 jam. Hal tersebut juga dilandasi dengan hasil XRD bahwa waktu milling 2 jam memiliki satu fasa yakni Li4Ti5O12.
Gambar 4.11 Hasil Pengujian CV material Li4Ti5O12 dengan variasi waktu
pemberian gas asetilen 0, 10, dan 20 menit pada waktu ball milling 2 jam.
Gambar 4.12 Hasil Pengujian CV material Li4Ti5O12 dengan variasi waktu pemberian
gas asetilen 0, 10, dan 20 menit pada waktu ball milling 3 jam.
Gambar 4.13 Hasil Pengujian CV material Li4Ti5O12 dengan variasi waktu pemberian
gas asetilen 0, 10, dan 20 menit pada waktu ball milling 4 jam.
Gambar 4.14 Hasil Pengujian CV material Li4Ti5O12 dengan variasi waktu ball
milling 2, 3, dan 4 jam tanpa gas asetilen Untuk lebih jelasnya dapat dilihat pada tabel 4.7 berikut: Tabel 4.7 Hasil Uji Cyclic Voltammetry (CV)
Sampel Epa (V) Ipa (mA) Epc (V) Ipc (mA) ΔE (V)
BM 2, AG 0 1,64 0,92 1,44 -0,53 0,20
BM 2, AG 10 1,64 0,75 1,57 -0,41 0,17
BM 2, AG 20 1,64 1,42 1,46 -0,85 0,18
Tabel 4.8 Hasil Uji Cyclic Voltammetry (CV)
Sampel Epa (V) Ipa (mA) Epc (V) Ipc (mA) ΔE (V)
BM 3, AG 0 1,66 1,24 1,42 -1,12 0,24
BM 3, AG 10 1,68 0,90 1,44 -0,62 0,24
BM 3, AG 20 1,73 0,41 1,47 -0,46 0,26
Tabel 4.9 Hasil Uji Cyclic Voltammetry (CV)
Sampel Epa (V) Ipa (mA) Epc (V) Ipc (mA) ΔE (V)
BM 4, AG 0 1,65 0,94 1,44 -0,61 0,21
BM 4, AG 10 1,68 2,10 1,49 -1,17 0,19
BM 4, AG 20 1,66 1,87 1,47 -0,75 0,19
Tabel 4.10 Hasil Uji Cyclic Voltammetry (CV)
Sampel Epa (V) Ipa (mA) Epc (V) Ipc (mA) ΔE (V)
BM 2 1,64 0,92 1,44 -0,53 0,20
BM 3 1,66 1,24 1,42 -1,12 0,24
BM 4 1,65 0,94 1,44 -0,61 0,21
Tabel 4.7 menunjukkan nilai hasil pengujian CV material Li4Ti5O12 dengan ball milling 2
jam pada variasi waktu pemberian gas asetilen 0, 10 dan 20 menit. Tabel tersebut menunjukkan bahwa material Li4Ti5O12 pada variasi waktu pemberian gas asetilen 20 menit
dengan waktu milling 2 jam memiliki intensitas puncak oksidasi tertinggi sebesar 1,42 mA dan reduksi sebesar 0,85 mA. Disusul dengan material Li4Ti5O12 dengan waktu milling 2
jam tanpa gas asetilen memiliki intensitas puncak oksidasi sebesar 0,92 mA dan reduksi sebesar 0,53 mA. Sedangkan intensitas puncak oksidasi terendah adalah material Li4Ti5O12
pada variasi waktu pemberian gas asetilen 10 menit sebesar 0,75 mA dan reduksi sebesar 0,41 mA. Material LTO dengan waktu milling 2 jam yang memiliki energi polarisasi terendah adalah material LTO dengan waktu pemberian gas asetilen 10 menit sebesar 0,17 V, disusul dengan waktu pemberian gas asetilen 20 menit sebesar 0,18 V dan yang paling tinggi adalah material LTO tanpa gas asetilen.
Tabel 4.8 menunjukkan nilai hasil pengujian CV material Li4Ti5O12 dengan waktu milling
3 jam pada variasi waktu pemberian gas asetilen 0, 10 dan 20 menit. Tabel tersebut menunjukkan bahwa material Li4Ti5O12 tanpa gas asetilen dengan waktu milling 3 jam
memiliki intensitas puncak oksidasi tertinggi sebesar 1,24 mA dan reduksi sebesar 1,12 mA. Disusul dengan material Li4Ti5O12 pada variasi waktu pemberian gas asetilen 10 menit
dengan waktu milling 2 jam memiliki intensitas puncak oksidasi sebesar 0,90 mA dan reduksi sebesar 0,62 mA. Sedangkan intensitas puncak oksidasi terendah adalah material Li4Ti5O12 pada variasi waktu pemberian gas asetilen 20 menit sebesar 0,41 mA dan reduksi
sebesar 0,46 mA. Material LTO dengan waktu milling 3 jam yang memiliki energi polarisasi terendah adalah material LTO dengan tanpa waktu pemberian gas asetilen dan 10 menit waktu pemberian gas asetilen sebesar 0,24 V, disusul dengan waktu pemberian gas asetilen 20 menit sebesar 0,26 V.