INTISARI
Salah satu penyebab penyakit degeneratif adalah paparan radikal bebas yang menyebabkan kerusakan pada sel manusia. Antioksidan dapat mencegah kerusakan yang disebabkan radikal bebas. Tanaman jambu mete merupakan salah satu tanaman yang memiliki aktivitas antioksidan. Tujuan dari penelitian ini adalah untuk mengetahui seberapa besar aktivitas antioksidan dan kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak etanolik daun jambu mete (Anacardium occidentale L.).
Pengukuran aktivitas antioksidan dilakukan dengan metode deoksiribosa dan penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu yang nilainya dinyatakan dengan massa ekuivalen asam galat per massa fraksi. Deoksiribosa yang terdegradasi akan menghasilkan produk berupa malonaldehida yang ketika direaksikan dengan TBA pada pH rendah akan menghasilkan chromogen berwarna merah muda. Chromogen yang dihasilkan selanjutnya dibaca serapannya dengan spektrofotometer.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik daun jambu mete mempunyai kandungan fenolik total sebesar 632,6 ± 23,45 mg ekuivalen asam galat per g fraksi etil asetat ekstrak etanolik daun jambu mete dengan nilai IC15 sebesar 17,38 ± 3,1 μg/mL. Aktivitas antioksidan dari fraksi etil
asetat ekstrak etanolik daun jambu mete tidak berbeda bermakna dibandingkan dengan aktivitas antioksidan dari kuersetin dengan nilai IC15 sebesar 14,07 ± 0,70 μg/mL.
ABSTRACT
One of the causes of degenerative disease is due to free radicals exposure that causes damage to human cells. Antioxidants can prevent cells damage that cause by free radicals. Cashew is one of the plants that have antioxidant activity. This research aims to determine the antioxidant activity and the total phenolic content from ethyl acetate fraction of ethanolic extract of cashew leaf.
Determination of antioxidant activity performed by deoxyribose method and determinatin of total phenolic content performed by Folin-Ciocalteu method expressed by gallic acid equivalent mass per mass fraction. Deoxyribose which degraded will produce malonaldehyde that can reacted with TBA at low pH and will produce pink chromogen. Further, the chromogen will read with a spectrophotometer.
The results showed that the ethyl acetate fraction of ethanolic extract of cashew leaf contain a total phenolic content of 632,6 ± 23,45 mg gallic acid equivalent per g of ethyl acetat fraction of ethanolic extract of cashew leaf and IC15 values is 17,38 ± 3,1 µg/mL. The antioxidant activity of ethyl acetate fraction
of ethanolic extract of cashew leaf was not significantly different compared with the antioxidant activity of quercetin with IC15 values is 14,07 ± 0,70 µg/mL.
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DEOKSIRIBOSA DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
PADA FRAKSI ETIL ASETAT EKSTRAK ETANOLIK DAUN JAMBU METE ( Anacardium occidentale L. )
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
I Putu Abhiseka Pranajaya NIM : 118114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN MENGGUNAKAN METODE DEOKSIRIBOSA DAN PENETAPAN KANDUNGAN FENOLIK TOTAL
PADA FRAKSI ETIL ASETAT EKSTRAK ETANOLIK DAUN JAMBU METE ( Anacardium occidentale L. )
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm)
Program Studi Farmasi
Oleh:
I Putu Abhiseka Pranajaya NIM : 118114064
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
iv
HALAMAN PERSEMBAHAN
“Aku benci setiap menit dari latihan, tetapi saya katakan, jangan
berhenti! Menderitalah sekarang dan hidup pada sisa hidupmu sebagai
seorang juara”
(
Muhammad Ali)
vii PRAKATA
Puji syukur kehadirat Tuhan Yang Maha Esa yang telah memberikan rahmat dan karuniaNya, sehingga penulis dapat menyelesaikan penulisan skripsi yang berjudul “Uji Aktivitas Antioksidan Menggunakan Metode Deoksiribosa dan Penetapan Kandungan Fenolik Total Pada Fraksi Etil Asetat Ekstrak Etanolik Daun Jambu Mete (Anacardium occidentale L.)” sebagai salah satu syarat guna memperoleh gelar sarjana farmasi di Fakultas Farmasi Sanata Dharma Yogyakarta. Proses penyusunan skripsi ini banyak mendapat bantuan dan bimbingan dari berbagai pihak, sehingga penyusus ingin mengucapkan terimakasih kepada:
1. Yohanes Dwiatmaka, M.Si. sebagai Dosen Pembimbing yang telah memberikan bimbingan, pengarahan serta ilmu dalam penelitian dan penyusunan skripsi ini.
2. Prof. Dr. C. J. Soegihardjo, Apt. sebagai Dosen Penguji atas pengarahan dan kesediaannya menguji skripsi ini.
3. Dr. Erna Tri Wulandari, M.Si., Apt. sebagai Dosen Penguji atas pengarahan dan kesediaanya menguji skripsi ini.
4. Aris Widayati, M.Si., Ph.D., Apt. sebagai Dekan Fakultas Farmasi Universitas Sanata Dharma.
5. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma.
viii
7. Yoanes Kapistran Ervan Prasetio sebagai teman skripsi, terimakasih atas kerjasama yang telah dilewati bersama dalam penelitian ini.
8. Teman-teman FSM B dan FST A 2011 yang telah memberikan semangat dan dukungan kepada penulis selama penyusunan skripsi.
9. Teman-teman Farmasi angkatan 2011 yang telah memberikan dukungan dalam penyelesaian skripsi
10.Teman-teman kontrakan yang selalu memberi dukungan dan bantuan dalam proses penyelesaian skripsi.
11.Semua pihak yang telah memberi dukungan dan bantuan yang tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa penyusunan skripsi ini banyak kekurangan dan jauh dari sempurna, untuk itu dengan segala kerendahan hati penulis mengharapkan saran dan kritik guna perbaikan dan penyempurnaan skripsi ini. Harapan penulis semoga penelitian dan penyusunan skripsi ini bermanfaat bagi perkembangan ilmu pengetahuan khususnya di bidang Farmasi.
Yogyakarta, Juni 2015
ix DAFTAR ISI
Halaman
HALAMAN JUDUL... i
HALAMAN PERSETUJUAN PEMBIMBING... ii
HALAMAN PENGESAHAN... iii
HALAMAN PERSEMBAHAN... iv
PERNYATAAN KEASLIAN KARYA ... v
LEMBAR PERNYATAAN PERSETUJUAN PUBLIKASI ... vi
PRAKATA...vii
2. Keaslian penelitian... 4
3. Manfaat penelitian... 6
B. Tujuan penelitian... 6
1. Tujuan Umum... 6
2. Tujuan Khusus... 6
x
A.Jambu Mete... 7
B.Senyawa Fenolik... 9
C.Metode Folin-Ciocalteu... 11
D.Radikal Bebas... 11
E.Antioksidan... 12
F. Metode Deoksiribosa... 15
G.Ekstraksi... 16
H.Spektrofotometri... 18
I. Landasan Teori... 20
J. Hipotesis... 22
BAB III METODE PENELITIAN... 23
A.Jenis dan Rancangan Penelitian... 23
B.Variabel... 23
C.Definisi Operasional... 23
D.Bahan-Bahan Penelitian... 24
E.Alat-Alat penelitian... 25
F. Tatacara Penelitian... 25
1. Determinasi tanaman... 25
2. Pembuatan dan penyiapan sampel daun jambu mete... 25
3. Ekstraksi... 26
4. Fraksinasi ekstrak etanol daun jambu mete... 27
xi
6. Uji pendahuluan... 32
7. Optimasi metode penetapan kandungan fenolik total... 33
8. Penetapan kandungan fenolik total... 34
9. Optimasi metode uji aktivitas antioksidan... 35
10.Uji aktivitas antioksidan... 36
G.Analisis Hasil... 37
BAB IV HASIL DAN PEMBAHASAN... 39
A.Hasil Determinasi Tanaman... 39
B.Persiapan Sampel... 39
C.Hasil Ekstraksi... 42
D.Hasil Fraksinasi Ekstrak... 46
E.Uji Pendahuluan... 48
1. Uji pendahuluan senyawa fenolik... 48
2. Uji pendahuluan aktivitas antioksidan... 50
F. Optimasi Metode Uji Fenolik Total... 52
1. Penentuan operating time (OT)... 53
2. Penentuan panjang gelombang serapan maksimum ( maks)... 54
G.Estimasi kandungan fenolik total... 56
H.Optimasi Metode Uji Aktivitas Antioksidan... 60
1. Penentuan operating time (OT)... 60
2. Penentuan panjang gelombang serapan maksimum ( maks)... 62
I. Estimasi Aktivitas Antioksidan dengan Radikal Hidroksil... 63
xii
A.Kesimpulan... 74
B.Saran... 74
DAFTAR PUSTAKA... 75
LAMPIRAN... 82
xiii
DAFTAR TABEL
Halaman
Tabel I. Hasil pembacaan panjang gelombang maksimum asam
galat yang direaksikan dengan Folin-Ciocalteu... 55
Tabel II. Hasil penentuan jumlah fenolik total fraksi etil asetat
ekstrak etanolik daun jambu mete... 58
Tabel III. Hasil pembacaan panjang gelombang maksimum kromogen MDA-TBA... 63 Tabel IV. Hasil uji aktivitas antioksidan kuersetin dengan metode
Deoksiribosa... 66 Tabel V. Hasil uji aktivitas antioksidan fraksi etil asetat ekstrak
xiv
DAFTAR GAMBAR
Halaman
Gambar 1. Hasil uji pendahuluan fenolik (A = larutan blanko [air:metanol + Folin Ciocalteu + Natrium Karbonat]; B = kontrol positif [asam galat + Folin Ciocalteu + Natrium Karbonat]; C = larutan uji + Folin Ciocalteu + Natrium Karbonat; D = larutan asam galat; E = larutan
uji)... 50
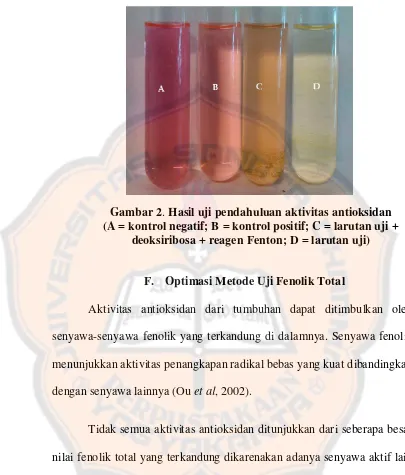
Gambar 2. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif; B = kontrol positif; C = larutan uji + deoksiribosa + reagen Fenton; D = larutan uji)... 52
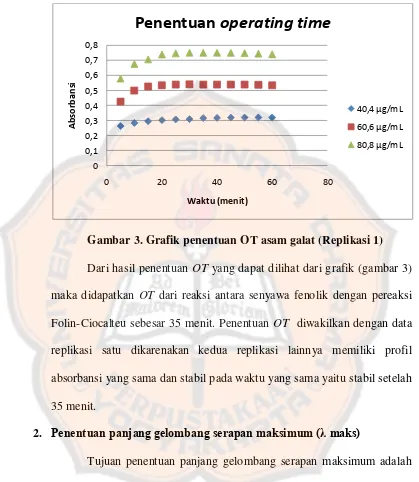
Gambar 3. Grafik penentuan OT asam galat (Replikasi 1)... 54
Gambar 4. Kurva baku asam galat dalam penetapan fenolik total (Rep. 1)... 57
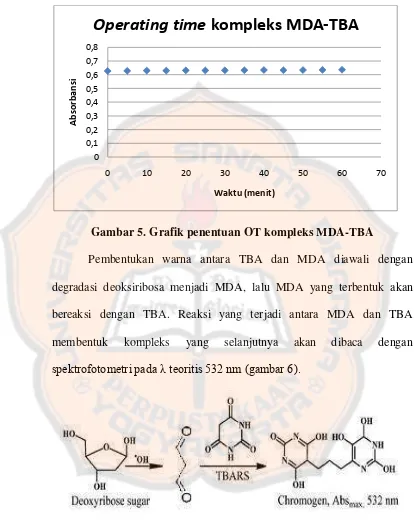
Gambar 5. Grafik penentuan OT kompleks MDA-TBA... 61
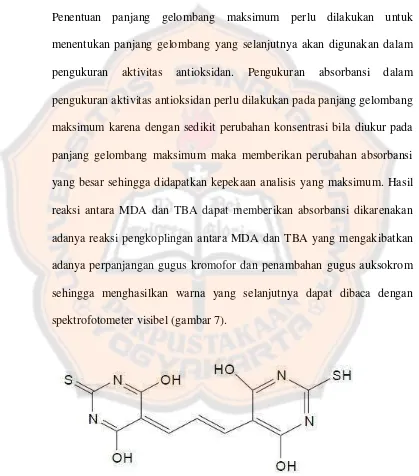
Gambar 6. Reaksi Pembentukan kromogen antara MDA-TBA... 61
Gambar 7. Kromogen MDA-TBA... 62
Gambar 8. Kurva persamaan regresi linier aktivitas antioksidan kuersetin (Replikasi 1)... 68
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman jambu mete
(Anacardium ocidentale L.)... 83
Lampiran 2. Gambar tanaman jambu mete yang diambil di perkebunan jambu mete Desa Mojolegi, Imogiri, Bantul, DIY... 84
Lampiran 3. Perhitungan rendemen ekstrak etanol daun jambu mete dan fraksi etil asetat ekstrak etanolik daun jambu mete... 85
Lampiran 4. Penimbangan uji kandungan fenolik total... 87
Lampiran 5. Optimasi penentuan kandungan fenolik total... 88
Lampiran 6. Penentuan kandungan fenolik total... 91
Lampiran 7. Data perhitungan konsentrasi reagen dan fraksi etil asetat aktivitas antioksidan... 94
Lampiran 8. Optimasi metode uji aktivitas antioksidan... 100
Lampiran 9. Uji aktivitas antioksidan menggunakan radikal hidroksil... 103
Lampiran 10. Perhitungan nilai IC15 kuersetin dan fraksi etil asetat ekstrak etnolik daun jambu mete... 106
xvi INTISARI
Salah satu penyebab penyakit degeneratif adalah paparan radikal bebas yang menyebabkan kerusakan pada sel manusia. Antioksidan dapat mencegah kerusakan yang disebabkan radikal bebas. Tanaman jambu mete merupakan salah satu tanaman yang memiliki aktivitas antioksidan. Tujuan dari penelitian ini adalah untuk mengetahui seberapa besar aktivitas antioksidan dan kandungan fenolik total yang terdapat dalam fraksi etil asetat ekstrak etanolik daun jambu mete (Anacardium occidentale L.).
Pengukuran aktivitas antioksidan dilakukan dengan metode deoksiribosa dan penetapan kandungan fenolik total dilakukan dengan metode Folin-Ciocalteu yang nilainya dinyatakan dengan massa ekuivalen asam galat per massa fraksi. Deoksiribosa yang terdegradasi akan menghasilkan produk berupa malonaldehida yang ketika direaksikan dengan TBA pada pH rendah akan menghasilkan chromogen berwarna merah muda. Chromogen yang dihasilkan selanjutnya dibaca serapannya dengan spektrofotometer.
Hasil penelitian menunjukkan bahwa fraksi etil asetat ekstrak etanolik daun jambu mete mempunyai kandungan fenolik total sebesar 632,6 ± 23,45 mg ekuivalen asam galat per g fraksi etil asetat ekstrak etanolik daun jambu mete dengan nilai IC15 sebesar 17,38 ± 3,1 g/mL. Aktivitas antioksidan dari fraksi etil
asetat ekstrak etanolik daun jambu mete tidak berbeda bermakna dibandingkan dengan aktivitas antioksidan dari kuersetin dengan nilai IC15 sebesar 14,07 ± 0,70
g/mL.
xvii ABSTRACT
One of the causes of degenerative disease is due to free radicals exposure that causes damage to human cells. Antioxidants can prevent cells damage that cause by free radicals. Cashew is one of the plants that have antioxidant activity. This research aims to determine the antioxidant activity and the total phenolic content from ethyl acetate fraction of ethanolic extract of cashew leaf.
Determination of antioxidant activity performed by deoxyribose method and determinatin of total phenolic content performed by Folin-Ciocalteu method expressed by gallic acid equivalent mass per mass fraction. Deoxyribose which degraded will produce malonaldehyde that can reacted with TBA at low pH and will produce pink chromogen. Further, the chromogen will read with a spectrophotometer.
The results showed that the ethyl acetate fraction of ethanolic extract of cashew leaf contain a total phenolic content of 632,6 ± 23,45 mg gallic acid equivalent per g of ethyl acetat fraction of ethanolic extract of cashew leaf and IC15 values is 17,38 ± 3,1 µg/mL. The antioxidant activity of ethyl acetate fraction
of ethanolic extract of cashew leaf was not significantly different compared with the antioxidant activity of quercetin with IC15 values is 14,07 ± 0,70 µg/mL.
1 BAB I
PENGANTAR
A. Latar Belakang
Dewasa ini, dunia kesehatan banyak membahas tentang radikal bebas (free radical) dan antioksidan. Penyakit-penyakit degeneratif diawali dengan adanya reaksi oksidasi berlebihan di dalam tubuh. Beberapa penyakit degeneratif berhubungan erat dengan oksidasi berlebihan akibat dari radikal bebas di antaranya kanker, penyakit jantung dan pembuluh darah, pikun, katarak dan penurunan fungsi kognitif, selain itu proses penuaan dini juga berhubungan erat dengan oksidasi berlebihan yang diakibatkan oleh senyawa-senyawa radikal bebas (Winarsi, 2007).
Radikal bebas itu sendiri merupakan suatu molekul yang kehilangan elektron terluarnya yang dengan cepat dapat bereaksi dengan atom-atom atau senyawa-senyawa di lingkungannya (Droge, 2002). Selain radikal bebas juga terdapat istilah antioksidan yang merupakan senyawa yang bertindak sebagai penangkal radikal bebas dan mencegah terjadinya kerusakan yang diakibatkan oleh senyawa radikal sehingga dapat meningkatkan pertahanan kekebalan tubuh dan menurunkan risiko penyakit kanker serta penyakit degeneratif lainnya (Pham-Huy, 2008).
produk dalam kemasan maupun sebagai zat aditif untuk memberikan efek antioksidan dalam tubuh. Penambahan antioksidan sintetik ini diberi batasan karena dicurigai bersifat karsinogenik bila dipakai berlebihan (Saikia, 2011).
Salah satu sumber antioksidan yang kaya di bumi ini adalah tanaman. Antioksidan yang berasal dari tanaman berfungsi untuk melindungi tanaman itu sendiri dari radikal bebas akibat terkena paparan sinar matahari (Khrisnaveni, 2013).
Daun tanaman jambu mete memiliki kandungan asam hidroksi benzoat, glikosida kaemferol, glikosida, dan kuersetin yang diketahui memiliki aktivitas antioksidan. Terdapat komponen minyak atsiri pada daun jambu mete yang terdiri dari golongan monoterpen (pinen, feladren, borneol, dan karvakrol) (Sudarsono et al, 2002).
Tanaman jambu mete akan tumbuh baik bila persyaratan tumbuhnya dipenuhi seperti tercukupinya paparan sinar matahari, suhu harian sekitar 27oC dengan kelembaban sekitar 70-80%, tumbuh pada tanah liat berpasir dan curah hujan antara 1.000-2.000 mm/tahun (Suhadi, 2007). Tanaman yang tumbuh pada lingkungan yang sesuai dengan syarat tumbuhnya memiliki kandungan fitokimia yang dapat berbeda dengan tanaman yang sama pada kondisi lingkungan yang tidak sesuai. Terdapat kandungan senyawa yang bisa saja hilang pada tanaman dengan tempat tumbuh yang tidak sesuai dengan syarat tumbuh tanaman tersebut (Rahardjo, 2006).
tidak. Prinsip dari metode deoksiribosa adalah degradasi dari 2-deoksiribosa oleh senyawa radikal hidroksil yang dihasilkan dari reagen Fenton yang telah dibuat sebelumnya (Giao et al, 2008).
Aktivitas antioksidan yang ada dalam daun jambu mete diperkirakan berasal dari golongan aglikon flavonoid (Fidrianny, 2012). Flavonoid yang dalam bentuk aglikonnya akan bersifat kurang polar, sehingga dengan fraksinasi dengan pelarut etil asetat dan air maka senyawa yang diharapkan berupa flavonoid aglikon akan tersari dalam fraksi etil asetat sehingga dapat menspesifikasikan penyarian. Dari latar belakang tersebut maka perlu dilakukan penelitian lebih lanjut terhadap aktivitas antioksidan dan fenolik total dari fraksi etil asetat ekstrak etanolik daun jambu mete.
1. Permasalahan
a. Berapakah kandungan fenolik total fraksi etil asetat ekstrak etanolik daun jambu mete yang diukur dengan metode Folin-Ciocalteu dan dinyatakan dengan massa ekuivalen asam galat ?
b. Berapakah besar nilai aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun jambu mete dengan metode deoksiribosa ?
2. Keaslian Penelitian
hutan Tungareshwar India yang memiliki karakteristik lingkungan dengan curah hujan tinggi. Uji aktivitas aktioksidan dilakukan dengan metode DPPH dan ditetapkan kandungan fenolik totalnya menggunakan metode Folin-Ciocalteu.
Penelitian tentang daun jambu mete juga dilakukan oleh Fidrianny, Ruslan, dan Saputra (2012). Penelitian menggunakan daun jambu mete yang diperoleh dari Desa Bencah Kelubi, Kecamatan Tapung, Kabupaten Kampar, Riau. Kemudian dalam keadaan kering diekstrak dengan metode refluks. Uji aktivitas aktioksidan dilakukan dengan metode DPPH dan ditetapkan kandungan fenolik totalnya menggunakan metode Folin-Ciocalteu.
3. Manfaat Penelitian
a. Manfaat teoritis : Penelitian ini diharapkan dapat memberi pengetahuan tentang aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun jambu mete dengan menggunakan metode deoksiribosa. b. Manfaat praktis : Penelitian ini diharapkan dapat memberikan
informasi tentang aktivitas antioksidan fraksi etil asetat ekstrak etanolik daun jambu mete sehingga dapat digunakan dan dimanfaatkan demi memelihara kesehatan manusia dengan cara menangkal radikal bebas.
B. Tujuan Penelitian 1. Tujuan umum
Untuk menetapkan kandungan fenolik total dan menguji aktivitas antioksidan menggunakan metode deoksiribosa pada fraksi etil asetat ekstrak etanolik daun jambu mete.
2. Tujuan khusus
a. Untuk mengetahui kadar kandungan fenolik total fraksi etil asetat ekstrak etanolik daun jambu mete dengan menggunakan metode Folin-Ciocalteu yang dinyatakan dalam mg ekuivalen asam galat. b. Untuk mengetahui besar aktivitas antioksidan fraksi etil asetat ekstrak
7 BAB II
PENELAAHAN PUSTAKA
A. Jambu Mete
Menurut United States Department of Agriculture (2014) klasifikasi dari tanaman jambu mete, yaitu:
Kerajaan : Plantae
Sub kerajaan : Tracheobionta Super divisi : Spermatophyta Divisi : Magnoliophyta Kelas : Magnoliopsida Sub kelas : Rosidae
Ordo : Sapindales Suku : Anacardiaceae Marga : Anacardium
Jenis : Anacardium occidentale L.
Pengembangan tersebut dimaksudkan untuk memenuhi permintaan terhadap kacang mete yang terus meningkat (Suprapti, 2003).
Tanaman jambu mete memiliki bagian vegetatif dan generatif. Bagian vegetatif tanaman jambu mete terdiri dari akar, batang, dan daun sedangkan bagian generatif terdiri dari bunga, buah, dan biji. Daun jambu mete berbentuk telur, bagian ujung berbentuk bulat namun pada pangkalnya berbentuk runcing. Jambu mete memiliki jenis daun tunggal dan memiliki letak tersebar di seluruh ranting. Bunga jambu mete berukuran kecil, harum, dan sangat banyak jumlahnya. Bunga jambu mete termasuk bunga majemuk yang berbentuk malai dan bermunculan pada setiap ujung ranting. Pada satu malai terdapat bunga jantan dan bunga hemafrodit (berkelamin dua). Dari sekian banyak bunga yang dibuahi, hanya 4-6% yang dapat bertahan hingga matang dan bunga lainnya berguguran pada berbagai tingkat umur (Suhadi, 2007).
Daun jambu mete sendiri memiliki banyak senyawa kimia yang masih belum terindentifikasi secara sempurna. Beberapa senyawa kimia dalam daun jambu mete terbukti memiliki efek biologis yang dapat membantu memperbaiki kesehatan manusia. Beberapa kandungan senyawa kimia dalam daun jambu mete adalah tanin-galat, flavonol, asam akardiol, asam elagat, senyawa fenol, kardol, dan metil kardol (Yuliarti, 2009).
Menurut penelitian dari Nugroho (2013), daun jambu mete memiliki kandungan fenolik total yang tinggi. Hasil penelitian menunjukkan bahwa ekstrak daun jambu mete memiliki kandungan fenolik sebesar 20 mg ekuivalen asam galat per 100 g ekstrak etanolik daun jambu mete. Kandungan senyawa fenolik dalam daun jambu mete ini diketahui memberikan efek biologis pada kesehatan manusia.
Beberapa bagian tanaman jambu mete memiliki khasiat dan kegunaan. Di daerah Jawa Barat, daun muda tanaman jambu mete dikonsumsi sebagai lalapan (Sulistyawati, 2009). Daun dan kulit batang tanaman jambu mete dapat digunakan untuk mengobati beberapa penyakit seperti hipertensi, diabetes mellitus, disentri, beberapa jenis radang, asma, dan bronkitis (Edet, 2013).
B. Senyawa Fenolik
hidroksil yang menempel. Senyawa fenolik dapat diklasifikasikan menjadi beberapa jenis, yaitu fenol sederhana, asam fenolat dan aldehid, asetopenon dan asam fenilasetat, asam sinamat, kumarin, flavonoid, bifalvonil, stilben dan benzofenon, benzoquinon, lignan, betacianin, tanin dan plobafen. Asam fenolat, flavonoid, stilben dan lignan merupakan senyawa fenolik yang paling melimpah pada tanaman (Vermerris dan Nicholson, 2006).
Senyawa fenolik bertindak sebagai metabolit yang sangat penting dalam tanaman. Selain sangat penting dalam pertumbuhan dan reproduksi, senyawa fenolik sangat penting dalam tanaman karena berguna sebagai agen pelindung terhadap berbagai patogen. Selain itu, senyawa fenolik dalam tanaman berkaitan dengan sifat tampilan tanaman itu sendiri, terutama mengenai warna tanaman apakah akan berwarna cerah atau gelap (Mujica, 2009).
C. Metode Folin – Ciocalteu
Metode Folin-Ciocalteu sering digunakan dalam penentuan total senyawa fenol dalam suatu tanaman atau buah (Hemingway, 1991). Metode ini didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Absorbansi yang terbentuk akibat fosfotungstat biru sebanding dengan jumlah senyawa fenolik yang terdapat dalam sampel, sehingga dapat diketahui seberapa besar jumlah kandungan senyawa dengan gugus fenol dalam suatu sampel tanaman yang dinyatakan dengan ekuivalen asam galat (Cindrić et al, 2011).
Banyak penelitian telah menggunakan reagen Folin-Ciocalteau untuk menentukan kandungan fenolik total yang terkandung dalam suatu tanaman, hal tersebut karena kelebihan dari metode ini. Kelebihan dari metode Folin – Ciocalteu adalah fleksibilitas metode sehingga beberapa rincian spesifik dari proses ini dapat dimodifikasi, sehingga dapat memudahkan dalam penggunaannya (Blainski, 2013).
D. Radikal Bebas
Dalam struktur atom dan molekul, elektron biasanya saling berpasangan, setiap pasangan bergerak dalam orbitnya. Namun dapat terjadi suatu elektron yang mampu bergerak dalam orbital namun dalam keadaan tanpa pasangan. Jenis elektron yang mampu bergerak dalam
orbitnya tanpa pasangan biasa masuk dalam istilah “free”. Atom yang
menstabilkan dirinya, sehingga akan bersifat radikal dan mudah berinteraksi dengan senyawa-senyawa lain. Senyawa dengan elektron tak berpasangan tersebut disebut radikal bebas (Nonhebel, 1974).
Senyawa radikal bebas bereaksi secara langsung dengan senyawa kimia dalam suatu sel pada tubuh manusia yang menyebabkan kerusakan reversibel maupun irreversibel pada sel tersebut. Semakin tinggi kadar radikal bebas dalam tubuh dapat mengakibatkan ketidakseimbangan antara jumlah antioksidan dalam tubuh dengan kadar radikal bebas sehingga terjadi kerusakan pada sebagian sel tubuh manusia, keadaan ini disebut dengan stres oksidatif (Trilaksani, 2003).
E. Antioksidan
Antioksidan adalah suatu senyawa yang mampu bereaksi secara mudah dengan senyawa-senyawa radikal bebas. Dalam konsentrasi rendah berada bersama substrat yang mudah teroksidasi, antioksidan secara signifikan mampu menunda atau menghambat reaksi oksidasi dari substrat tersebut (Cadenas dan Packer, 2002). Antioksidan merupakan senyawa pemberi elektron atau reduktan. Senyawa tersebut mampu menginaktivasi berkembangnya reaksi oksidasi. Antioksidan menghambat suatu radikal bebas dengan cara bereaksi dengan radikal bebas reaktif membentuk radikal bebas tak reaktif dan relatif stabil (Fessenden and Fessenden, 1982).
reaktif lain yang memiliki sifat oksidator. Kerusakan oksidatif terjadi karena kurangnya senyawa antioksidan dalam tubuh sehingga tidak dapat mengimbangi aktivitas dari senyawa oksidan (Tapan, 2005).
Antioksidan dibagi menjadi 2 kelompok, yaitu antioksidan enzimatis dan non-enzimatis. Contoh dari antioksidan enzimatis berupa enzim-enzim dalam tubuh manusia seperti enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non-enzimatis masih dibagi menjadi antioksidan larut lemak dan antioksidan larut air. Contoh antioksidan larut lemak, yaitu tokoferol, karotenoid, flavonoid, quinon, dan bilirubin, sedangkan antioksidan yang larut air adalah asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme. Kedua jenis antioksidan yang ada dalam tubuh bekerja sama mengurangi aktivitas senyawa oksidan ataupun radikal bebas dalam tubuh (Winarsi, 2007).
(SOD). Antioksidan sekunder disebut juga antioksidan eksogenus atau non-enzimatis. Antioksidan dalam kelompok ini biasanya didapat dari nutrisi yang masuk kedalam tubuh seperti vitamin c, vitamin e, dan beberapa jenis flavonoid yang mempertahankan tubuh dari senyawa radikal bebas dengan cara menangkap atau menjebak senyawa radikal (free radical scavenger), kemudian mencegah reaktivitas amplifikasinya serta memotong reaksi oksidasi berantai dari radikal bebas. Antioksidan tersier meliputi sistem enzim DNA-repair dan metionin sulfoksida reduktase yang berfungsi dalam perbaikan biomolekuler yang rusak akibat reaktivitas radikal bebas (Birangane, 2011).
Pada saat ini hampir semua makanan olahan telah ditambahkan antioksidan sintetik, beberapa jenis dilaporkan aman, meskipun beberapa studi menunjukkan sebaliknya. Dalam beberapa tahun terakhir, beberapa negara (Jepang dan beberapa negara Eropa) telah mengurangi penggunaan antioksidan sintetik dalam setiap produk industri makanannya karena mempunyai potensi karsinogenisitas. Pengggunaan antioksidan sintesik menyebabkan kekhawatiran konsumen akan keamanan pangan. Kekhawatiran ini mendorong beberapa produsen menggunakan antioksidan alami sebagai salah satu zat aditif (Mudawaroch, 2012).
degeneratif seperti kanker (Ito et al, 1983). Sebaliknya, permintaan produk alam secara umum telah meningkat. Kedua fakta ini memberikan dorongan terhadap identifikasi alternatif sumber antioksidan alami yang memiliki keamanan dalam penggunaan jangka panjang. Oleh karena itu, penelitian tentang sumber tanaman yang memiliki kandungan antioksidan tinggi sangat penting dilakukan demi mencari dan mengidentifikasi alternatif sumber antioksidan baru (Guimaraes, 2007).
F. Metode Deoksiribosa
Metode deoksiribosa juga dapat disebut sebagai hydroxyl radical scavenging assay merupakan salah satu metode sederhana dalam pengukuran aktivitas antioksidan. Metode deoksiribosa memiliki sensitivitas yang tinggi dan tidak memerlukan alat yang canggih dalam analisisnya. Prinsip dari metode deoksiribosa ini berdasarkan pemecahan oksidatif 2-deoksiribosa oleh senyawa radikal hidroksil dan hasil dari pemecahan tersebut akan bereaksi dengan asam tiobarbiturat dan menghasilkan warna. Penambahan senyawa yang memiliki aktivitas antioksidan, akan melindungi deoksiribosa dari radikal hidroksil sehingga pembentukan warna menjadi berkurang (Halliwell, 1987).
memiliki waktu yang sangat singkat, sehingga memiliki jalur difusi yang rendah untuk keluar dari organ, yang menunjukkan bahwa radikal OH bereaksi hanya pada tempat dimana radikal OH tersebut terbentuk. Metode deoksiribosa adalah metode yang paling umum dalam menghitung aktivitas OH radikal. Radikal yang dihasilkan melalui reaksi Fenton menggunakan sistem Fe3+-EDTA/asam askorbat/H2O2 pada pH 7,4.
Produk malondialdehid terbentuk dari degradasi 2-deoksiribosa, diukur setelah reaksi dengan penambahan asam tiobarbiturat menggunakan spektrofotometri visibel dengan deteksi pada panjang gelombang 532 nm. Namun meskipun sederhana, metode ini memiliki beberapa kelemahan, misalnya, metode ini sangat sensitif terhadap perubahan pH dan tidak kompatibel dengan pelarut organik (Decker, 2010).
Secara singkat, proses pembentukan warna merah muda akibat dari degradasi dari deoksiribosa menurut Halliwel (1987) dijelaskan melalui reaksi berikut :
Fe2+- EDTA + O2 Fe3+-EDTA + O2
-Fe3+-EDTA + ascorbate Fe2+- EDTA + oxidized ascorbate
Fe2+- EDTA + H2O2 OH- +
.
OH + Fe3+-EDTA.
OH + deoxyribose fragment heat with
TBA + acid MDA
2TBA + MDA chromogen
G. Ekstraksi
Pelaksanaan fraksinasi dapat dilakukan setelah ekstraksi yang bertujuan untuk mengisolasi suatu senyawa kimia yang lebih spesifik (Handa, 2008). Ekstrak merupakan suatu sediaan kental yang dapat diperoleh dengan cara mengekstraksi senyawa aktif dari simplisia nabati atau simplisia hewani menggunakan pelarut yang sesuai, kemudian semua atau hampir semua pelarut diuapkan. Dalam memilih penyari atau pelarut dalam metode ekstraksi, harus dipertimbangkan banyak faktor dan kriteria. Kriteria dari suatu pelarut yang baik adalah stabil secara fisika maupun kimia, selektif dalam melarutkan senyawa tertentu, tidak mempengaruhi zat yang berkhasiat dalam simplisia yang akan diekstrak, dan diperbolehkan oleh peraturan yang berlaku (Dirjen POM, 1995).
Penggunaan pelarut dalam suatu metode ekstraksi harus disesuaikan dengan kepolaran senyawa-senyawa yang diinginkan. Pelarut polar akan cenderung lebih melarutkan senyawa yang lebih polar dalam simplisia bahan alam dan pelarut non polar akan melarutkan senyawa yang lebih non polar sehingga ekstraksi akan lebih efisien dalam menyari senyawa alam yang diinginkan (Heinrich et al., 2012).
Salah satu teknik ekstraksi yang sering digunakan adalah maserasi. Maserasi dilakukan dengan cara merendam serbuk simplisia tanaman dalam cairan penyari. Cairan penyari akan menembus dinding sel dan masuk ke dalam rongga sel yang mengandung zat aktif, zat aktif akan larut dan karena adanya perbedaan konsentrasi antara larutan zat aktif di dalam sel dengan yang diluar sel, maka larutan yang terpekat didesak keluar. Maserasi dilakukan berulang kali sehingga keseimbangan larutan terjadi dan ekstrak yang didapatkan maksimal. Selain maserasi beberapa teknik ekstraksi yang lain adalah perkolasi, digesti, dan soxhletasi (Handa et al, 2008).
H. Spektrofotometri
Spektrofotometri UV/Visibel merupakan salah satu instrumen penting dalam penelitian analisis senyawa. Spektrofotometri UV/Vis memiliki prinsip radiasi pada rentang panjang gelombang 200 – 700 nm yang dilewatkan melalui suatu larutan senyawa. Elektron pada ikatan dalam molekul menjadi tereksitasi yang menyebabkan elektron berada pada keadaan energi yang lebih tinggi dalam proses menyerap sejumlah energi yang melewati larutan tersebut (Watson, 2010).
Metode pengukuran menggunakan prinsip spektrofotometri adalah berdasarkan absorbsi cahaya pada panjang gelombang tertentu melalui suatu larutan yang mengandung senyawa uji yang ingin ditentukan konsentrasinya. Proses absorbsi cahaya pada metode ini dapat disebut
digunakan adalah gelombang cahaya tampak, maka disebut sebagai
“kolorimetri”, karena senyawa dalam pelarut yang diuji memberikan
warna. Prinsip kerja dari metode ini adalah cahaya yang diabsorpsi oleh larutan sebanding dengan konsentrasi kontaminan dalam larutan. Prinsip ini dijabarkan dalam Hukum Beer-Lambert, yang menghubungkan antara konsentrasi dengan absorbansi cahaya yang terukur pada suatu bahan yang mengabsorpsi (Lestari, 2007). Persamaan dari hukum Beer-Lambert yang dapat menjelaskan prinsip dari metode spektrofotometri :
T = Transmittansi = Il/Io
a = Tetapan absorpsivitas molar b = Panjang jalur
c = Konsentrasi suatu bahan yang mengabsorpsi
analisis kuantitatif pada beberapa metode penelitan (Fessenden and Fessenden, 1982).
Molekul – molekul yang memerlukan energi lebih banyak untuk memindahkan elektron, akan menyerap pada panjang gelombang yang lebih pendek dan begitu sebaliknya. Senyawa yang menyerap cahaya dalam daerah tampak memiliki elektron yang lebih mudah untuk dipindahkan daripada senyawa yang menyerap pada panjang gelombang UV yang lebih pendek (Fesenden and Fessenden, 1982).
I. Landasan Teori
Radikal bebas merupakan suatu atom, molekul maupun senyawa yang kehilangan elektron terluarnya yang dengan cepat dapat bereaksi dengan atom-atom atau senyawa-senyawa di lingkungannya. Molekul yang bereaksi cepat dengan radikal bebas akan menjadi radikal bebas juga dan menghasilkan reaksi berantai. Apabila reaksi berlangsung di tubuh maka dapat merusak jaringan dan mengacaukan fungsi mereka. Industri-industri makanan serta obat-obatan dan suplemen kesehatan seringkali menambahkan antioksidan sintetik didalam produknya untuk memberikan efek penangkal radikal, namun penambahan antioksidan sintetik ini diberi batasan karena dicurigai bersifat karsinogenik bila dipakai berlebihan.
tradisional di Indonesia. Daun jambu mete digunakan untuk mengobati penyakit diabetes dan tekanan darah tinggi. Ekstrak etanol daun jambu mete diketahui dapat menurunkan hipertensi (Nugroho, 2013). Daun jambu mete memiliki senyawa kimia yang berperan penting dalam memberikan khasiat pada tubuh manusia seperti tanin-galat, flavonol, asam akardiol, asam elagat, senyawa fenol, kardol, dan metil kardol (Yuliarti, 2009). Flavonoid dalam bentuk aglikon merupakan salah satu senyawa yang berperan penting dalam aktivitas antioksidan daun jambu mete. Untuk mendapatkan senyawa yang lebih spesifik, yaitu flavonoid dalam bentuk aglikon maka perlu dilakukan proses fraksinasi menggunakan etil asetat. Flavonoid dalam bentuk aglikon akan cenderung masuk kedalam fase non polar, yaitu etil asetat dibandingkan masuk kedalam fase polar, yaitu air.
Metode Folin-Ciocalteu merupakan salah satu metode dalam penentuan kandungan fenolik total dalam tanaman, metode ini didasarkan pada reduksi asam fosfotungstat dalam larutan alkali menjadi fosfotungstat biru. Absorbansi yang terbentuk akibat fosfotungstat biru sebanding dengan jumlah senyawa fenolik aromatik yang terdapat dalam sampel, sehingga dapat diketahui seberapa besar jumlah kandungan senyawa dengan gugus fenol dalam suatu sampel tanaman yang dinyatakan dengan ekuivalen asam gallat sebagai pengkalibrasi.
efektif dengan prinsip pendegradasian deoksiribosa oleh radikal hidroksi yang terbentuk dari reagen fenton.
J. Hipotesis
1. Fraksi etil asetat ekstrak etanolik daun jambu mete memiliki kandungan senyawa fenolik yang diukur dengan metode Folin-Ciocalteu dan dinyatakan dalam mg ekivalen asam galat.
23 BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan jenis penelitian eksperimental murni dengan rancangan acak sederhana.
B. Variabel
1. Variabel bebas dalam penelitian ini berupa konsentrasi fraksi etil asetat ekstrak etanolik daun jambu mete.
2. Variabel tergantung yang ada dalam penelitian berupa aktivitas penangkapan radikal bebas oleh antioksidan (%IC) fraksi etil asetat ekstrak etanolik daun jambu mete.
3. Variabel pengacau dalam penelitian ini, yaitu :
a. Variabel pengacau terkendali, yaitu waktu pemanenan daun, cara panen, umur daun, waktu inkubasi, serta suhu dalam inkubasi penelitian.
b. Variabel pengacau tak terkendali berupa cuaca atau musim, curah hujan, kelembaban dan kestabilan bahan dalam pelarut.
C. Definisi Operasional
1. Daun Jambu mete adalah daun (folium) dari tanaman jambu mete yang telah dihilangkan bagian tangkainya.
3. Fraksi air dan etil asetat adalah hasil fraksinasi ekstrak etanolik jambu mete dengan menggunakan etil asetat dan air (1:1) yang selanjutnya dikeringkan dengan oven selama 24 jam.
4. Larutan kontrol merupakan larutan yang terdiri dari FeCl3, EDTA,
H2O2, buffer fosfat pH 7,4 dan asam askorbat tanpa penambahan fraksi
etil asetat sampel.
5. Larutan sampel merupakan larutan kontrol yang telah diberi fraksi etil asetat dengan berbagai konsentrasi.
6. Persen inhibition concentration (%IC) adalah persen yang menyatakan kemampuan fraksi etil asetat untuk menangkap suatu radikal bebas.
D. Bahan-bahan Penelitian
E. Alat-alat Penelitian
Seperangkat spektrofotometer UV-Vis Perkin Elmer Lamda 20, pH-meter Metrohm 632, vacuum rotary evaporator (Janke &Kunkel), timbangan elektrik BP 160 readability 0.10 mg, waterbath (Emerson), mikropipet 200-1000 µL (Acura 825, Socorex), tabung reaksi bertutup (Scott-Germany), hot plate (Heidolph), freezer (Toshiba), oven, maserator, termometer, corong pisah, blender, pengayak, software Minitab 7.1 trial dan alat-alat gelas yang lazim digunakan untuk penelitian di laboratorium analisis (Pyrex-Germany dan Iwaki).
F. Tata Cara Penelitian 1. Determinasi tanaman
Determinasi tanaman jambu mete dilakukan di Laboratorium Farmakognosi-Fitokimia Fakultas Farmasi Universitas Sanata Dharma dengan acuan Van Steenis (1981).
2. Pembuatan dan penyiapan sampel daun jambu mete
bahan yang tidak dibutuhkan lainnya dan lain-lain. Daun jambu mete dicuci dengan cara dialiri dengan air sambil dibersihkan kotoran yang melekat pada daun. Pencucian dilakukan sebanyak 3 kali. Daun jambu mete dirajang dengan ukuran seragam dengan panjang daun kurang lebih 1 cm. Daun jambu mete yang masih basah selanjutnya dikeringkan pada udara terbuka dan harus terlindung dari sinar matahari. Daun jambu mete dihamparkan di atas kertas atau alas yang telah disiapkan dan diatur agar tidak terlalu menumpuk. Posisi daun harus sering dibalik sehingga pengeringan dapat merata. Pengeringan berakhir ketika daun yang sedang dikeringkan mudah dipatahkan. Daun jambu mete yang telah kering (ditandai dengan mudah hancurnya daun ketika diremas) dipisahkan dari bahan-bahan pengganggu yang ikut serta ketika proses pengeringan terjadi seperti tanah, kerikil, bahan yang rusak dan lain-lain (tanpa pencucian). Daun jambu mete dibuat menjadi serbuk dengan bantuan alat penyerbuk, yaitu blender, kemudian dilakukan pengayakan dengan ayakan nomor mesh 40. Serbuk daun jambu mete kemudian disimpan dengan membungkus serbuk menggunakan wadah kedap udara. Penyimpanan setelah dibungkus dilakukan di suhu ruangan.
3. Ekstraksi
Campuran yang telah homogen dimaserasi dengan bantuan orbital shaker pada suhu ruangan selama satu hari. Setelah satu hari campuran diambil filtratnya melalui penyaringan dengan corong Buchner dengan bantuan pompa vakum. Maserasi tidak hanya dilakukan satu kali, tetapi dilakukan berulang. Ampas hasil penyaringan selanjutnya dimaserasi dengan pelarut yang sama yaitu etanol, ampas ditambah etanol sampai terendam sempurna dan dimaserasi hingga satu hari kemudian dilanjutkan dengan penyaringan menggunakan kertas saring dan bantuan corong Buchner dan pompa vaccum. Proses maserasi dan penyaringan dilakukan berulang hingga filtrat yang diperoleh hampir tidak berwarna. Seluruh filtrat hasil maserasi digabungkan menjadi satu. Pelarut yang masih ada pada filtrat diuapkan hingga volumenya berkurang menjadi sepersepuluh dari volume awal. Diperoleh ekstrak kental daun jambu mete.
4. Fraksinasi ekstrak etanol daun jambu mete
menggunakan vaccum rottary evaporator dimasukkan dalam cawan porselin yang sebelumnya telah ditimbang hingga bobot tetap. Cawan berisi fraksi kental dimasukkan dalam oven hingga 24 jam. Fraksi kering yang didapat digunakan untuk analisis lebih lanjut.
5. Pembuatan reagen Fenton, Deoksiribosa, TCA, TBA, Pembanding, dan Sampel
a) Pembuatan reagen Fenton 1) Larutan FeCl3 1 mM
Timbang seksama lebih kurang 13,52 mg FeCl3.6H2O,
dimasukkan ke dalam labu ukur 10 ml dan dilarutkan dengan akuades hingga tanda. Sebanyak 2,0 ml larutan tersebut diambil dan dimasukkan ke dalam labu ukur 10 ml. Selanjutnya diencerkan dengan akuades hingga tanda.
2) Larutan EDTA 1mM
EDTA ditimbang sebanyak 18,61 mg, dimasukkan ke dalam gelas beaker dan dilarutkan menggunakan akuades. Larutan dimasukkan ke dalam labu ukur 10 mL, kemudian tambahkan aquades hingga batas tanda. Ambil 2,0 mL larutan, masukkan ke dalam labu ukur 10 mL, tambahkan akuades hingga tanda.
3) Larutan vitamin C 1 mM
tanda. Larutan vitamin C tersebut diambil kembali sebanyak 1,0 ml lalu dimasukan kedalam labu ukur 10 ml dan kemudian ditambahkan akuades hingga mencapai tanda.
4) Larutan H2O2 20 mM
Sebanyak 0,091 ml larutan H2O2 30% diambil dan
dimasukkan kedalam labu ukur 10 ml lalu dilanjutkan dengan penambahan akuades hingga tanda. Dari larutan yang telah dibuat, diambil sebanyak 2,5 ml dan dimasukkan kedalam labu ukur 10 ml, kemudian encerkan hingga tanda dengan menggunakan akuades.
b) Pembuatan larutan deoksiribosa 2,5 mM
Sebanyak lebih kurang 20,95 mg deoksiribosa ditimbang dengan seksama, lalu dilarutkan dengan akuades dalam labu ukur 10 ml hingga tanda. Dari larutan tersebut, diambil 4,0 ml dan diencerkan dalam labu ukur 25 ml dengan menggunakan akuades hingga batas tanda.
c) Pembuatan larutan TCA 5%
d) Pembuatan larutan TBA 1%
Sebanyak 0,25 g TBA ditimbang dengan seksama dan dimasukkan kedalam beker glass 100 ml lalu ditambahkan akuades secukupnya, dilanjutkan dengan pemanasan diatas hot plate hingga seluruh TBA larut. Setelah itu, larutan TBA dipindahkan ke dalam labu ukur 25 ml dan tambahkan akuades hingga tanda.
e) Pembuatan larutan bufer fosfat
Sebanyak 1,4196 g Na2HPO4 ditimbang dengan seksama lalu
dimasukkan ke dalam labu ukur 500 ml dan dilarutkan dengan akuades hingga tanda. Kemudian sebanyak 0,6805 g KH2PO4
ditimbang secara seksama, lalu dilarutkan dengan akuades dalam labu ukur 250 ml hingga tanda. Selanjutnya larutan Na2HPO4 dimasukkan
secukupnya kedalam beker glass dan ditambahkan larutan KH2PO4
yang telah dibuat sebelumnya, penambahan KH2PO4 dilakukan
dengan cara penetesan hingga tercapai pH 7,4 dengan bantuan pH meter.
f) Pembuatan larutan baku asam galat
diperoleh konsentrasi larutan baku asam galat 40; 50; 60; 70; dan 80
g/mL.
g) Pembuatan larutan stok, intermediet kuersetin, dan larutan pembanding
Sebanyak 10,0 mg kuersetin dilarutkan dengan metanol p.a dalam labu ukur 10, 0 mL sampai tanda sebagai larutan stok. Larutan intermediet dibuat dengan mengambil 1,0 mL larutan stok kuersetin dan ditambahkan metanol p.a sampai 10,0 mL dalam labu ukur 10 mL, sehingga diperoleh larutan dengan konsentrasi sebesar 100,0
g/mL. Pembuatan larutan pembanding dilakukan dengan mengambil sebanyak 0,5; 0,75; 1,0; 1,25; 1,5 mL larutan kuersetin konsentrasi
100,0 g/mL, kemudian ditambahkan metanol p.a sampai 10,0 mL,
sehingga diperoleh konsentrasi larutan standar kuersetin sebesar 5,0;
7,5; 10,0; 12,5; dan 15,0 g/mL.
h) Preparasi larutan uji fraksi etil asetat
1. Larutan uji untuk penentuan kandungan fenolik total
Sebanyak 10,0 mg fraksi etil asetat ditimbang, lalu ditambahkan 10,0 mL metanol p.a dalam labu ukur 10 mL sehingga diperoleh konsentrasi sebesar 1000,0 g/mL. Kemudian larutan tersebut diambil 1,0 mL dan dimasukkan kedalam labu ukur 10 mL ditambahkan metanol p.a hingga batas sehingga diperoleh konsentrasi
2. Larutan uji untuk aktivitas antioksidan
Sejumlah 10,0 mg fraksi etil asetat ditimbang dan dimasukkan kedalam labu ukur 10 mL lalu ditambahkan metanol p.a sampai batas sebagai larutan stok. Kemudian dibuat larutan intermediet dengan mengambil 5,0 mL stok larutan uji kemudian dimasukkan kedalam labu ukur 50 mL lalu ditambahkan metanol p.a sampai batas, sehingga diperoleh larutan dengan konsentrasi sebesar 100,0 g/mL. Diambil sebanyak 1,0; 2,0; 3,0; 4,0; 5,0 mL larutan tersebut, kemudian dimasukkan kedalam labu ukur 10 mL lalu ditambahkan metanol p.a sampai batas tanda, sehingga diperoleh konsentrasi larutan uji sebesar 10,0; 20,0; 30,0; 40,0; 50,0 g/mL.
6. Uji pendahuluan
a. Uji keberadaan senyawa fenolik
Larutan uji dengan konsentrasi 500,0 g/mL dan larutan
b. Uji pendahuluan aktivitas antioksidan
Dalam 2 tabung reaksi, dimasukkan larutan uji fraksi etil asetat ekstrak etanolik daun jambu mete sebanyak 1000 µ l dengan konsentrasi sebesar 50,0 g/mL. Sebagai kontrol negatif, dimasukkan metanol pa kedalam tabung sebesar 1000 µ l. Sebagai kontrol positif selanjutnya dimasukkan 1000 µ l larutan standar kuersetin dengan konsentrasi sebesar 15,0 g/mL kedalam tabung. Selanjutnya masing-masing tabung dipanaskan dalam waterbath dengan suhu tidak lebih dari 60°C hingga seluruh metanol menguap. Kemudian pada masing-masing tabung ditambahkan 3400 µ l buffer fosfat pH 7,4, 600 µ l larutan deoksiribosa 2,5 mM, 500 µ l FeCl3 1 mM, 500 µl EDTA 1
mM, 500 µ l H2O2 20 mM, dan 500 µ l asam askorbat 1 mM sehingga
volume akhir campuran adalah 6 ml. Selanjutnya campuran diinkubasikan pada temperatur 37°C selama 60 menit. Setelah inkubasi lalu campuran ditambahkan 1 ml TCA 5% dan 1 ml TBA 1%. Campuran yang ada kemudian dipanaskan diatas waterbath selama 30 menit dengan temperatur 80°C. Setelah dipanaskan, dilakukkan pendinginan selama 5 menit di bawah air mengalir. Ketiga kontrol dibandingkan satu sama lainnya.
7. Optimasi metode penetapan kandungan fenolik total a. Penentuan operating time (OT)
diencerkan dengan akuades (1:10 v/v), kemudian larutan didiamkan selama 5 menit. Setelah 5 menit larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Setelah itu dibaca absorbansinya dengan spektrofotometer visibel pada panjang gelombang 750 nm selama 60 menit. Dilakukan demikian juga untuk
larutan uji 100 g/mL dengan waktu pengamatan selama 60 menit.
b. Penentuan panjang gelombang maksimum ( maks)
Sebanyak 0,5 mL larutan asam galat 40; 50; dan 60 g/mL ditambahkan dengan 2,0 mL reagen Folin-Ciocalteu yang telah diencerkan dengan air (1:10 v/v) ), kemudian larutan didiamkan selama 5 menit. Larutan selanjutnya ditambahkan dengan 4,0 mL natrium karbonat 1 M. Diamkan selama operating time, dibaca panjang gelombang pada absorbansi maksimum dengan spektrofotometer visibel pada panjang gelombang 600-800 nm.
8. Penetapan kandungan fenolik total a. Pembuatan kurva baku asam galat
didapat terhadap blanko yang terdiri atas akuades : metanol p.a (1:1), reagen Folin-Ciocalteu dan larutan natrium karbonat 1M. Dilakukkan replikasi pengerjaan sebanyak tiga kali.
b. Estimasi kandungan fenolik total larutan uji
Diambil 0,5 mL larutan uji 100 g/mL, lalu dilanjutkan
sebagaimana perlakuan pada pembuatan kurva baku asam galat. Kandungan fenolik total dinyatakan sebagai mg ekuivalen asam galat per g fraksi etil asetat. Dilakukan tiga kali replikasi.
9. Optimasi metode uji aktivitas antioksidan a. Penentuan operating time (OT)
Sebanyak 300 µL larutan deoksiribosa 2,5 mM dimasukkan kedalam tabung reaksi kemudian ditambahkan 300 µl FeCl3 1 mM,
300 µ l EDTA 1 mM, 300 µ l H2O2 20 mM, 4200 µ l buffer fosfat pH
b. Penentuan panjang gelombang serapan maksimum ( maks)
Masukkan berturut-turut 200, 300, dan 400 µ l larutan deoksiribosa 2,5 mM pada tabung reaksi tertutup, pada setiap tabung kemudian diberikan 300 µ l FeCl3 1 mM, 300 µ l EDTA 1 mM, 300 µ l H2O2 20
mM, 4200 µ l buffer fosfat pH 7,4 dan 300 µ l asam askorbat 1 mM (penambahan buffer fosfat disesuaikan dengan volume deoksiribosa sehingga volume akhir campuran adalah 6 ml). Selanjutnya campuran diinkubasikan selama 60 menit pada temperatur 37°C, setelah inkubasi dilakukan penambahan 1 ml TCA 5% dan 1 ml TBA 1%. Campuran yang ada kemudian dipanaskan diatas waterbath selama 30 menit dengan temperatur 80°C. Larutan didinginkan dengan bantuan air mengalir selama 5 menit. Dilakukkan scanning absorbansi pada panjang gelombang 400-600 nm.
10.Uji aktivitas antioksidan
Dalam 11 tabung reaksi, dimasukkan larutan uji fraksi etil asetat ekstrak etanol jambu mete sebanyak 1000 µ l dengan konsentrasi sebesar 10,0; 20,0; 30,0; 40,0; 50,0 g/mL. Sebagai kontrol negatif, dimasukkan metanol pa kedalam tabung sebesar 1000 µl. Sebagai kontrol positif selanjutnya dimasukkan 1000 µ l larutan standar kuersetin dengan konsentrasi sebesar 5,0; 7,5; 10,0; 12,5; dan 15,0
seluruh metanol menguap. Kemudian pada masing-masing tabung ditambahkan 3400 µ l buffer fosfat pH 7,4, 600 µl larutan deoksiribosa 2,5 mM, 500 µ l FeCl3 1 mM, 500 µ l EDTA 1 mM, 500 µ l H2O2 20
mM, dan 500 µ l asam askorbat 1 mM sehingga volume akhir campuran adalah 6 ml. Selanjutnya campuran diinkubasikan pada temperatur 37°C selama 60 menit. Setelah inkubasi lalu campuran ditambahkan 1 ml TCA 5% dan 1 ml TBA 1%. Campuran yang ada kemudian dipanaskan diatas waterbath selama 30 menit dengan temperatur 80°C. Setelah dipanaskan, dilakukkan pendinginan dan dibaca absorbansinya pada daerah operating time dan panjang gelombang maksimum yang didapatkan dari hasil pengukuran sebelumnya. Hasil absorbansi yang didapat dapat digunakan untuk menghitung % inhibiton concentration (%IC) dan dibuat persamaan regresi linier yang merupakan hubungan antara konsentrasi fraksi etil asetat vs % IC.
G. Analisis Hasil 1. Aktivitas antioksidan
Aktivitas penangkapan radikal hidroksil dari larutan uji daun jambu mete dilaporkan sebagai % inhibisi degradasi deoksiribosa yang dihitung sebagai :
% IC = − x 100 %
A uji = Absorbansi campuran larutan uji
Nilai IC ditetapkan menggunakan persamaan regresi linier, dengan sumbu x adalah konsentrasi fraksi etil asetat daun jambu mete dan sumbu y adalah % inhibition concentration.
2. Fenolik total
Penetapan kandungan fenolik total ditentukan dengan nilai yang didapat dari hasil pengukuran absorbansi. Absorban yang didapat selanjutnya dimasukkan kedalam rumus persamaan regresi linier yang didapat dari kurva baku asam galat. Selanjutnya, setelah didapat konsentrasi hasil perhitungan dari absorbansi sampel, hasil yang didapat dimasukkan kedalam rumus yaitu :
Kandungan fenolik total = x .
x = konsentrasi hasil perhitungan dari absorbansi yang didapat v = volume senyawa uji
39 BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi tanaman dilakukan untuk memastikan kebenaran dari suatu tanaman yang akan digunakan dalam penelitian. Pemastian identitas dalam penelitian perlu dilakukan untuk menghindari terjadinya kesalahan pada saat pengambilan sampel pada analisis fitokimia. Determinasi tanaman dilakukan di Laboratorium Kebun Obat Fakultas Farmasi Universitas Sanata Dharma dengan acuan dari van Steenis (1981). Berdasarkan hasil determinasi tanaman yang dilakukan, dapat dipastikan bahwa tanaman yang digunakan adalah Anacardium occidentale L. atau secara umum dikenal dengan jambu mete.
B. Persiapan sampel
dan unsur hara dari tempat tanaman berasal (Rahardjo, 2006). Sampel daun jambu mete yang diambil berupa daun yang tidak terlalu muda hingga daun yang tidak terlalu tua, yaitu daun yang berada pada ruas ketiga hingga keenam cabang ranting pohon. Pengambilan daun pada ruas tertentu dikarenakan daun yang digunakan dan diolah oleh masyarakat sebagai sayuran adalah daun yang tidak terlalu tua. Selain itu penggunaan daun yang terlalu muda tidak akan menghasilkan aktivitas antioksidan yang optimal karena metabolit sekunder yang dihasilkan belum terlalu banyak kuantitasnya dan belum sempurna pembentukannya. Umumnya kandungan metabolit sekunder pada tanaman belum terbentuk maksimal pada daun yang sangat muda dan akan berkurang pada daun yang sudah tua. Pengambilan daun dilakukan sebelum tanaman berbunga atau berbuah, hal tersebut dikarenakan kemungkinan besar bila tanaman telah berbunga banyak metabolit sekunder yang berpindah menuju bunga dan buah sehingga kandungan metabolit sekunder pada daun akan berkurang dibandingkan dengan pohon yang belum berbunga atau berbuah.
menghindari kelembaban yang tinggi. Kelembaban yang kecil dapat meminimalisir jamur yang kemungkinan tumbuh pada daun dan mempermudah proses pengeringan (Agoes, 2007).
yang sudah kering selanjutnya disortasi kering untuk memisahkan bahan-bahan pengganggu yang mungkin ikut masuk ketika proses pengeringan. Kemudian daun kering diserbuk menggunakan mesin penyerbuk, namun karena keterbatasan alat, digunakan blender untuk menyerbukkan daun yang telah kering. Proses penyerbukan dilakukan untuk memperbesar luas permukaan daun yang akan kontak dengan cairan penyari sehingga senyawa kimia yang terkandung dalam daun akan tersari secara sempurna dan akan masuk kedalam penyari secara optimal. Daun kering yang telah menjadi serbuk selanjutnya diayak dengan ayakan mesh No. 40 agar serbuk yang selanjutnya akan disari dengan penyari memiliki ukuran partikel seragam. Serbuk yang telah diayak siap digunakan untuk tahap selanjutnya yaitu tahap ekstraksi.
C. Hasil Ekstraksi
yang lebih besar dan kontak dengan pelarut menjadi meningkat, efektifitas dalam ekstraksi pun menjadi tinggi (Gupta, 2010).
Metode ekstraksi yang digunakan untuk mengekstraksi daun jambu mete adalah metode maserasi (Heinrich et al., 2012). Metode maserasi merupakan metode yang sederhana dengan perendaman bahan tanaman serta pelarut yang sesuai dengan pengadukan pada suhu kamar. Menurut Williamson (1996), penggunaan metode maserasi dalam ekstraksi bahan alam dikarenakan metode ini tidak memerlukan pemanasan dalam proses ekstraksi sehingga tidak terjadi dekomposisi senyawa kimia yang terkandung di dalamnya. Selain itu, metode maserasi memiliki keuntungan dalam mengekstraksi senyawa dari sampel, karena dengan metode maserasi dapat mengakibatkan membran sel dan dinding sel dari sampel yang terendam oleh pelarut pecah karena perbedaan tekanan dari dalam dan luar sel sehingga senyawa kimia yang terkandung dalam sel akan dapat keluar sel dan larut dalam pelarut dan proses ekstraksi menjadi maksimal (Sambamurthy, 2005).
maksimal (Dai, 2010). Digunakan pelarut etanol 70% dikarenakan senyawa fenolik yang diduga memiliki aktivitas antioksidan dapat tersari dan masuk kedalam penyari secara maksimal (Dai, 2010). Pemilihan etanol dibandingkan metanol sebagai penyari dikarenakan metanol mempunyai ketoksikan yang lebih tinggi dibandingkan dengan etanol, baik untuk lingkungan maupun untuk tubuh sehingga bila menggunakan metanol dalam ekstraksi akan dirasakan kurang aman apabila digunakan untuk tujuan konsumsi.
senyawa metabolit sekunder yang terkandung dalam serbuk kering daun jambu mete telah tersari dengan sempurna. Hasil filtrat dari tiap pengulangan maserasi dikumpulkan menjadi satu. Tujuan dari maserasi berulang adalah untuk menarik sebanyak mungkin kandungan kimia yang terkandung dalm serbuk kering daun jambu mete sehingga hasil ekstraksi akan menjadi maksimal.
bobot 18,747 g dari 100 g bahan serbuk kering yang digunakkan. Dari hasil perhitungan rendemen yang diperoleh adalah 18,74 %.
D. Hasil Fraksinasi Ekstrak
dipisahkan, kedua larutan yang tidak saling campur yaitu ekstrak etanol daun jambu mete yang dilarutkan dalam air dan etil asetat dimasukan kedalam Erlenmeyer lalu digojog dengan bantuan shaker selama 24 jam, hal ini dilakukan agar kontak antar cairan dan partikel yang belum larut menjadi lebih maksimal sehingga perpindahan senyawa yang memiliki kepolaran berbeda akan menjadi maksimal. Setelah 24 jam selanjutnya dilakukan penyaringan terhadap air dan etil asetat yang ada dalam erlenmeyer dengan bantuan kertas saring, corong Buchner, dan pompa vakum. Penyaringan dilakukan untuk menyaring beberapa partikel ekstrak yang tidak larut dalam air. Selanjutnya filtrat dimasukkan ke dalam corong pisah. Etil asetat akan berada di atas permukaan air dikarenakan berat jenis yang lebih kecil dibandingkan berat jenis air.
Fraksi etil asetat yang ada dalam corong pisah dikeluarkan dan dipisahkan dari air. Fraksi etil setat yang dihasilkan berupa fraksi cair berwarna hijau pekat. Selanjutnya fraksi yang didapat diuapkan pelarutnya dengan vacuum rotary evaporator. Setelah proses penguapan, fraksi kental yang didapat selanjutnya dikeringkan pada suhu 60oC dengan menggunakan waterbath. Setelah didapat fraksi kering, selanjutnya fraksi kering disimpan dan ditutup dengan alumunium foil agar tidak terpapar sinar UV yang dapat mendegradasi senyawa yang terkandung dalam fraksi etil asetat tersebut. Fraksi kering yang didapat selanjutnya ditimbang dengan bobot fraksi, yaitu 1,66 g. Setelah dihitung rendemen dari proses fraksinasi, didapat hasil rendemen sebesar 1,66 %.
E. Uji Pendahuluan
Uji pendahuluan bertujuan untuk mengetahui secara kualitatif apakah didalam fraksi etil asetat ekstrak etanolik daun jambu mete memiliki kandungan senyawa fenolik dan aktivitas antioksidan. Uji pendahuluan dilakukan untuk orientasi kandungan senyawa dalam fraksi etil asetat ekstrak etanolik daun jambu mete.
1. Uji pendahuluan senyawa fenolik
Gambar 1. Hasil uji pendahuluan fenolik (A = larutan blanko [air:metanol + Folin Ciocalteu + Na2CO3]; B = kontrol positif [asam galat + Folin Ciocalteu + Na2CO3]; C = larutan uji + Folin Ciocalteu +
Na2CO3; D = larutan asam galat; E = larutan uji)
2. Uji pendahuluan aktivitas antioksidan
Gambar 2. Hasil uji pendahuluan aktivitas antioksidan (A = kontrol negatif; B = kontrol positif; C = larutan uji +
deoksiribosa + reagen Fenton; D = larutan uji)
F. Optimasi Metode Uji Fenolik Total
Aktivitas antioksidan dari tumbuhan dapat ditimbulkan oleh senyawa-senyawa fenolik yang terkandung di dalamnya. Senyawa fenolik menunjukkan aktivitas penangkapan radikal bebas yang kuat dibandingkan dengan senyawa lainnya (Ou et al, 2002).
2012). Oleh karena itu perlu ditetapkan kandungan fenolik total dalam fraksi etil asetat ekstrak etanolik daun jambu mete.
1. Penentuan operating time (OT)
Tujuan dari penentuan OT pada penetapan fenolik total adalah untuk mendapatkan waktu yang diperlukan agar reaksi antara senyawa fenolik dengan pereaksi Folin-Ciocalteu yang terjadi dapat berlangsung optimal. Hasil reaksi antara senyawa fenolik dengan pereaksi Folin-Ciocalteu akan menghasilkan warna biru yang selanjutnya diukur dengan spektrofotometer visibel. Reaksi dianggap optimal jika absorbansi dari tiap selang waktu yang diujikan telah stabil. Absorbansi yang stabil terlihat dari makin kecilnya selisih absorbansi antar selang waktu. Pengukuran OT dilakukan selama satu jam dengan waktu pengamatan setiap 5 menit sekali dengan asam galat sebagai baku. Asam galat digunakan sebagai baku dikarenakan asam galat merupakan senyawa fenolik.
Gambar 3. Grafik penentuan OT asam galat (Replikasi 1) Dari hasil penentuan OT yang dapat dilihat dari grafik (gambar 3) maka didapatkan OT dari reaksi antara senyawa fenolik dengan pereaksi Folin-Ciocalteu sebesar 35 menit. Penentuan OT diwakilkan dengan data replikasi satu dikarenakan kedua replikasi lainnya memiliki profil absorbansi yang sama dan stabil pada waktu yang sama yaitu stabil setelah 35 menit.
2. Penentuan panjang gelombang serapan maksimum (λ maks)
Tujuan penentuan panjang gelombang serapan maksimum adalah untuk mengetahui panjang gelombang dari hasil reaksi antara senyawa fenolik dengan pereaksi Folin-Ciocalteu yang memberikan serapan maksimum. Pembacaan panjang gelombang dilakukan setelah asam galat direaksikan dengan pereaksi Folin-Ciocalteu dan didiamkan selama 35 menit. Penentuan panjang gelombang serapan maksimum sangat penting dalam sensitifitas suatu analisis dengan menggunakan spektrofotometer.
Perubahan sedikit pada konsentrasi analit bila diukur dalam panjang gelombang serapan maksimum maka akan memberikan perubahan absorbansi yang besar. Penentuan panjang gelombang maksimum menggunakan tiga konsentrasi yang berbeda dari asam galat agar dapat mempresentasikan panjang gelombang pada konsentrasi yang berbeda-beda, konsentrasi asam galat yang digunakan adalah 40; 50; dan 60 µg/mL. Pengukuran panjang gelombang maksimum dilakukan dengan membaca absorbansi pada daerah panjang gelombang antara 600-800 nm. Pembacaan pada area panjang gelombang antara 600-800 nm tersebut dikarenakan panjang gelombang maksimum teoritis berada di sekitar area panjang gelombang 600-800 nm.
Tabel I. Hasil pembacaan panjang gelombang maksimum asam galat yang direaksikan dengan Folin-Ciocalteu
konsentrasi yang berbeda adalah 739 nm (Tabel I) mendekati panjang gelombang maksimum teoritis yaitu 740 nm.
G. Estimasi Kandungan Fenolik Total
Metode Folin-Ciocalteu merupakan metode yang sudah lama dan sering digunakan dalam mengestimasi kandungan fenolik total dari suatu produk maupun dari suatu bahan alam. Penggunaan metode Folin-Ciocalteu dalam mengestimasi kandungan fenolik total dalam fraksi etil asetat ekstrak etanolik daun jambu mete dikarenakan metode Folin-Ciocalteu merupakan metode yang baku dalam menetapkan kandungan fenolik total pada produk alam selain itu metode ini sederhana dan efektif (Prior, 2005). Prinsip penentuan total fenolik menggunakan metode Folin-Ciocalteau adalah transfer elektron dalam kondisi medium basa dari senyawa fenolik ke asam fosfomolibdat dan fosfotungstat yang terdapat di dalam reagen Folin-Ciocalteau dan akan membentuk kompleks warna biru yang diukur nilai absorbannya. Warna biru yang terbentuk akan semakin pekat setara dengan konsentrasi ion fenolat yang terbentuk, artinya semakin besar konsentrasi senyawa fenolik maka semakin banyak ion fenolat yang akan mereduksi fosfomolibdat dan fosfotungstat sehingga warna biru yang dihasilkan semakin pekat (Singleton dan Rossi, 1965).
lebih murah dalam bentuk senyawa murni dan memiliki stabilitas yang baik (Waterhouse, 2005).
Gambar 4. Kurva baku asam galat dalam penetapan fenolik total (Rep. 1)
hasil penghitungan adalah nilai ekuivalen asam galat yang terkandung dalm fraksi.
Tabel II. Hasil penentuan jumlah fenolik total fraksi etil asetat ekstrak etanolik daun jambu mete
Replikasi Fenolik total selanjutnya direaksikan dengan pereaksi Folin-Ciocalteu pada suasana basa. Sampel diukur pada maksimum yang telah didapat sebesar 739 nm dan setelah waktu operating time tepat pada 35 menit setelah direaksikan. Absorbansi yang didapatkan selanjutnya dihitung secara intrapolasi pada persamaan regresi linier y = 0,007x + 0,0335. Dari hasil perhitungan didapat rata-rata kandungan fenolik total fraksi etil asetat ekstrak etanolik daun jambu mete sebesar 632,6 ± 23,45 mg ekuivalen asam galat per g fraksi etil asetat (Tabel II).
Nugroho (2013). Penelitian oleh Nugroho (2013) menggunakan ekstrak etanolik daun jambu mete memiliki kandungan fenolik total sebesar 19.78 ± 0.62 g ekuivalen asam galat per 100 g ekstrak. Perbandingan kandungan senyawa fenolik total terhadap penelitian Nugroho (2013) menunjukkan bahwa perbedaan kondisi tumbuh dan persyaratan tumbuh dari suatu tanaman dapat berpengaruh secara signifikan terhadap kandungan senyawa yang ada di dalamnya.