INTISARI
Buah nanas (Ananas comosus (L.) Merr.) memiliki kandungan enzim bromelain. Bromelain merupakan salah satu enzim protease yang bisa digunakan dalam perawatan luka yang berhubungan dengan radikal bebas. Antioksidan merupakan senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh. Penelitian ini bertujuan untuk menetapkan kadar enzim dan menguji aktivitas antioksidan ekstrak bromelain daging buah nanas.
Identifikasi enzim ditentukan secara kualitatif dengan metode uji warna ninhidrin yang memiliki prinsip pembentukan warna biru-ungu dari reaksi antara ninhidrin dan asam amino, dan secara kuantitaif dengan metode spektrofotometri ultraviolet dan baku standar berupa bovine serum albumine (BSA) yang memiliki prinsip pengukuran absorbansi dari cincin aromatik yang dimiliki oleh enzim. Aktivitas antioksidan ditentukan dengan metode DPPH yang memiliki prinsip penurunan intensitas absorbansi DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan yang dinyatakan dalam IC50 (Inhibition Concentration 50).
Penelitian menunjukan bahwa kadar enzim ekstrak bromelain buah nanas sebesar 8,4967±0,0289 % b/b dan aktivitas antioksidan ekstrak bromelain buah nanas dengan nilai IC50 sebesar 4,7221±0,0287 mg/mL.
Kata kunci: enzim, bromelain, Ananas comosus (L.) Merr., aktivitas antioksidan,
ABSTRACT
Pineapple fruits (Ananas comosus (L.) Merr.) contain bromelain enzyme. Bromelain is one of proteases that have been used for wound treatment which associated with free radical. Antioxidant is a compound that can inhibit the reaction of free radicals within the body. The aims of this study are to determine enzyme content and antioxidant activity of bromelain extracted from pineapple fruit.
Enzyme identification was determined qualitatively using ninhydrin, in which it’s principle is a production of Ruhemann’s purple from the reaction between ninhydrin and amino acids. UV spectrophotometric method was applied to determine the enzyme content based on bovine serum albumine (BSA) as the reference. The principle of this method is according to the aromatic ring of enzyme’s absorbance measurement. Antioxidant activity was determined using DPPH radical scavenging method based on the principle that the DPPH absorbance intensity is decreasing proportionaly with the increasing of the compound’s concentration. Antioxidant activity was expressed as IC50 (Inhibition
Concentration 50).
Research demonstrated that the enzyme content of the pineapple fruit bromelain extract is 8,4967±0,0289 % b/b and it’s antioxidant activity with the IC50 value is 4,7221±0,0287 mg/mL.
Keywords: enzyme, bromelain, Ananas comosus (L.) Merr., antioxidant activity,
UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl) EKSTRAK BROMELAIN BUAH NANAS
(Ananas comosus (L.) Merr.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Richard Andrison Sadeli NIM : 128114120
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
i
UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl) EKSTRAK BROMELAIN BUAH NANAS
(Ananas comosus (L.) Merr.)
SKRIPSI
Diajukan untuk Memenuhi Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi (S.Farm.)
Program Studi Farmasi
Oleh:
Richard Andrison Sadeli NIM : 128114120
FAKULTAS FARMASI
UNIVERSITAS SANATA DHARMA YOGYAKARTA
ii
Persetujuan Pembimbing
UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl) EKSTRAK BROMELAIN BUAH NANAS
(Ananas comosus (L.) Merr.)
Skripsi yang diajukan oleh:
Richard Andrison Sadeli NIM : 128114120
telah disetujui oleh:
Pembimbing Utama
iii
Pengesahan Skripsi Berjudul
UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl) EKSTRAK BROMELAIN BUAH NANAS
(Ananas comosus (L.) Merr.)
Oleh:
Richard Andrison Sadeli NIM : 128114120
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sanata Dharma Pada tanggal : 23 Agustus 2016
Mengetahui Fakultas Farmasi Universitas Sanata Dharma
Dekan
(Aris Widayati, M.Si., Apt., Ph.D.)
Panitia Penguji : Tanda tangan
1. Dr. Yustina Sri Hartini, Apt. ...
2. Maywan Hariono, Ph.D., Apt. ...
iv
Karya ilmiah ini
kupersembahkan untuk: Tri Tunggal Mahakudus dan
v
PERNYATAAN KEASLIAN KARYA
Saya menyatakan dengan sesungguhnya bahwa skripsi yang saya tulis ini tidak memuat karya atau bagian karya orang lain, kecuali yang telah disebutkan
dalam kutipan dan daftar pustaka, sebagaimana layaknya karya ilmiah.
Apabila di kemudian hari ditemukan indikasi plagiarisme dalam naskah ini, maka saya bersedia menanggung segala sanksi sesuai peraturan
perundang-undangan yang berlaku.
Yogyakarta, 20 Mei 2016 Penulis
vi
LEMBAR PERNYATAAN PERSETUJUAN
PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN AKADEMIS
Yang bertanda tangan di bawah ini, saya mahasiswa Universitas Sanata Dharma :
Nama : Richard Andrison Sadeli
Nomor mahasiswa : 128114120
Demi pengembangan ilmu pengetahuan, saya memberikan kepada Perpustakaan
Universitas Sanata Dharma karya ilmiah saya yang berjudul:
“UJI AKTIVITAS ANTIOKSIDAN DENGAN METODE DPPH (1,1-diphenyl-2-picrylhydrazyl) EKSTRAK BROMELAIN BUAH NANAS
(Ananas comosus (L.) Merr.)”
Beserta perangkat yang diperlukan (bila ada). Dengan demikian saya memberikan kepada Perpustakaan Universitas Sanata Dharma hak untuk menyimpan, mengalihkan dalam bentuk media lain, mengelolanya dalam bentuk pengkalan data, mendistribusikan secara terbatas, dan mempublikasikannya di internet atau media lain untuk kepentingan akademis tanpa perlu meminta ijin dari saya maupun memberikan royalti kepada saya selama saya tetap mencantumkan nama saya sebagai penulis.
Dengan demikian penyataan ini saya buat dengan sebenarnya.
Dibuat di Yogyakarta
Pada tanggal : 20 Mei 2016 Yang menyatakan
vii
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa atas berkat, kasih, dan penyertaany-Nya yang begitu besar, sehingga penulis dapat menyelesaikan skripsi
yang berjudul “Uji Aktivitas Antioksidan dengan Metode DPPH (1,1-diphenyl-2-picrylhydrazyl) Ekstrak Bromelain Buah Nanas (Ananas comosus
(L.) Merr.)” dengan baik. Skripsi ini disusun untuk memenuhi salah satu syarat dalam memperoleh gelar Sarjana Farmasi (S.Farm.) di Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
Dalam proses penelitian dan penyusunan skripsi, penulis mendapatkan banyak bantuan, bimbingan, saran, kritik, dan dukungan dari banyak pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, pada kesempatan ini,
penulis ingin mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Ibu Aris Widayati, M.Si., Apt., Ph.D., selaku Dekan Fakultas Farmasi
Universitas Sanata Dharma Yogyakarta.
2. Ibu Dr. Sri Hartati Yuliani, Apt., selaku Ketua Program Studi Fakultas
Farmasi Universitas Sanata Dharma Yogyakarta.
3. Ibu dr. Fenty, M.Kes., Sp.PK., selaku Dosen Pembimbing Akademik penulis atas bimbingan dan nasehat yang diberikan selama ini.
4. Ibu Dr. Yustina Sri Hartini, Apt., selaku Dosen Pembimbing Skripsi atas kesabaran dalam memberikan bimbingan, saran, kritik, dan dukungan hingga
viii
5. Bapak Maywan Hariono, Ph.D., Apt., selaku Dosen Penguji Skripsi atas saran dan kritik yang membangun, serta atas kesediaannya dalam menguji skripsi
ini.
6. Bapak Florentinus Dika Octa Riswanto, M.Sc., selaku Dosen Penguji Skripsi
atas saran dan kritik yang membangun, serta atas kesediaannya dalam menguji skripsi ini.
7. Segenap dosen dan karyawan Fakultas Farmasi Universitas Sanata Dharma
Yogyakarta.
8. Mas Wagiran dan Pak Musrifin, selaku laboran di Laboratorium
Farmakognosi-Fitokimia dan Laboratorium Formulasi Teknologi Sediaan Farmasi Fakultas Farmasi Universitas Sanata Dharma Yogyakarta atas bantuan yang telah banyak diberikan kepada penulis saat proses penelitian.
9. Yohanes Bintang Pambudi, sebagai teman seperjuangan dalam penelitian, atas semangat, kerjasama, dan diskusi selama ini.
10.Maria Septi Iriana, atas semangat, dukungan, dan kasih sayang yang selalu menyertai perjalanan penulis.
11.Sona Karisnata Inriano dan Adis Pranaya Yakin, sebagai tim At a Glance, sahabat dan partner dalam menjalani perkuliahan, atas semangat, dukungan, saran, kritik, dan hal-hal lainnya.
12.Teman-teman FKK B angkatan 2012 atas kebersamaan dan keceriaan selama ini.
ix
Internet yaitu Robert E. Kahn dan Vinton G. Cerf, penemu Google yaitu Larry Page dan Sergey Brin, penemu alat cetak yaitu Johann Gutenberg, dan
penemu kertas yaitu Cai Lun. Tanpa keberadaan mereka maka skripsi ini pun tidak akan pernah terwujud.
14.Semua pihak yang tidak dapat penulis sebutkan satu per satu, atas doa dan dukungan yang telah diberikan kepada penulis.
Penulis menyadari bahwa dalam penyusunan skripsi ini masih jauh dari
kesempurnaan. Oleh karena itu, dengan kerendahan hati penulis bersedia menerima saran dan kritik dalam menyempurnakan skripsi ini. Penulis berharap
skripsi ini dapat bermanfaat bagi para pembaca dan pengembangan ilmu pengetahuan, khususnya di bidang farmasi.
Yogyakarta, 20 Mei 2016 Penulis
x
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PERSETUJUAN PEMBIMBING ... ii
HALAMAN PENGESAHAN ... iii
HALAMAN PERSEMBAHAN ... iv
LEMBAR PENYATAAN KEASLIAN KARYA ... v
LEMBAR PENYATAAN PERSETUJUAN PUBLIKASI KARYA ... vi
PRAKATA ... vii
DAFTAR ISI ... x
DAFTAR TABEL ... xv
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
INTISARI ... xviii
ABSTRACT ... xix
BAB I PENGANTAR ... 1
A. Latar Belakang ... 1
1. Permasalahan ... 3
2. Keaslian penelitian ... 3
3. Manfaat penelitian ... 4
a. Manfaat teoritis ... 4
b. Manfaat praktis ... 4
xi
1. Tujuan umum ... 5
2. Tujuan khusus ... 5
BAB II PENELAAHAN PUSTAKA ... 6
A. Nanas ... 6
1. Taksonomi ... 6
2. Morfologi ... 6
3. Kegunaan ... 8
4. Kandungan kimia ... 8
B. Bromelain ... 8
1. Sifat fisika dan biokimia ... 8
2. Sifat farmakologi ... 9
3. Bioavailabilitas dan toksisitas ... 10
4. Isolasi ... 10
C. Metode Ninhidrin ... 11
D. Radikal Bebas ... 12
E. Antioksidan ... 13
F. Metode DPPH ... 14
G. Landasan Teori ... 15
H. Hipotesis ... 17
BAB III METODE PENELITIAN ... 18
A. Jenis dan Rancangan Penelitian ... 18
B. Variabel dan Definisi Operasional ... 18
xii
a. Variabel bebas ... 18
b. Variabel tergantung ... 18
2. Variabel pengacau ... 18
a. Variabel pengacau terkendali ... 18
b. Variabel pengacau tidak terkendali ... 18
3. Definisi operasional ... 19
a. Aktivitas antioksidan ... 19
b. Ekstrak bromelain ... 19
c. Kadar enzim ... 19
d. Persen inhibition concetration (%IC) ... 19
e. Inhibition concetration 50 (IC50) ... 19
C. Bahan Penelitian ... 19
D. Alat Penelitian ... 20
E. Tata Cara Penelitian ... 20
1. Determinasi buah nanas ... 20
2. Pengumpulan buah nanas ... 21
3. Pembuatan ekstrak bromelain daging buah nanas ... 21
a. Ekstraksi buah nanas ... 21
b. Purifikasi ekstrak bromelain dengan teknik ethanol precipitation ... 21
4. Analisis kualitatif bromelain ... 22
a. Reaksi warna ... 22
xiii
a. Pembuatan larutan uji ... 22
b. Pembuatan larutan baku ... 23
c. Penentuan operating time (OT) ... 23
d. Penetapan panjang gelombang maksimum ... 23
e. Pengukuran absorbansi larutan baku dan uji ... 23
f. Estimasi kadar enzim ... 24
6. Pembuatan larutan uji aktivitas antioksidan ... 24
a. Pembuatan larutan DPPH... 24
b. Pembuatan larutan rutin ... 24
c. Pembuatan larutan uji ... 24
7. Uji aktivitas antioksidan ... 25
a. Uji pendahuluan ... 25
b. Penentuan operating time (OT)... 25
c. Penetapan panjang gelombang maksimum ... 25
d. Pengukuran absorbansi larutan kontrol DPPH... 26
e. Pengukuran absorbansi larutan rutin dan uji ... 26
f. Estimasi aktivitas antioksidan ... 26
F. Analisis Hasil ... 27
BAB IV HASIL DAN PEMBAHASAN ... 28
A. Hasil Determinasi Tanaman ... 28
B. Hasil Pengumpulan Bahan ... 28
C. Hasil Isolasi Bromelain ... 29
xiv
E. Hasil Optimasi Metode Penatapan Kadar Bromelain ... 36
1. Penentuan operating time (OT)... 36
2. Penetapan panjang gelombang maksimum ... 37
F. Hasil Penetapan Kadar Bromelain ... 38
G. Hasil Optimasi Uji Aktivitas Antioksidan dengan Radikal DPPH .... 42
1. Penentuan operating time (OT)... 42
2. Penetapan panjang gelombang maksimum ... 44
H. Hasil Uji Pendahuluan Aktivitas Antioksidan ... 46
I. Hasil Estimasi Aktivitas Antioksidan dengan Radikal DPPH ... 47
BAB V KESIMPULAN DAN SARAN ... 56
A. Kesimpulan ... 56
B. Saran ... 56
DAFTAR PUSTAKA ... 57
LAMPIRAN ... 61
xv
DAFTAR TABEL
Halaman
Tabel I. Hasil scanning panjang gelombang serapan maksimum
BSA ... 38
Tabel II. Hasil pengukuran seri baku BSA ... 40 Tabel III. Kadar bromelain ekstrak bromelain daging buah nanas ... 41 Tabel IV. Hasil scanning panjang gelombang serapan maksimum
DPPH ... 45 Tabel V. Hasil pengukuran aktivitas antioksidan rutin dengan metode
DPPH ... 51 Tabel VI. Hasil pengukuran aktivitas antioksidan ekstrak bromelain
daging buah nanas dengan metode DPPH... 51
xvi
DAFTAR GAMBAR
Halaman
Gambar 1. Struktur ninhidrin ... 12
Gambar 2. Reaksi penangkapan radikal DPPH oleh antioksidan ... 15
Gambar 3. Proses ekstraksi dan isolasi enzim bromelain ... 33
Gambar 4. Reaksi asam amino dengan ninhidrin ... 34
Gambar 5. Hasil uji ninhidrin dan perubahan warnanya ... 35
Gambar 6. Grafik penentuan OT BSA ... 36
Gambar 7. Kurva baku BSA untuk penetapan kadar bromelain ekstrak bromelain daging buah nanas ... 41
Gambar 8. Grafik penentuan OT Rutin ... 43
Gambar 9. Gugus kromofor dan auksokrom radikal DPPH ... 44
Gambar 10. Hasil uji pendahuluan aktivitas antioksidan ... 47
Gambar 11. Perubahan warna larutan DPPH akibat reaksi dengan antioksidan ... 48
xvii
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Surat pengesahan determinasi tanaman nanas ... 61
Lampiran 2. Gambar buah nanas ... 62
Lampiran 3. Perhitungan rendemen ... 63
Lampiran 4. Penimbangan analisis kualitatif bromelain ... 64
Lampiran 5. Penimbangan penetapan kadar enzim bromelain ... 64
Lampiran 6. Optimasi penetapan kadar bromelain ... 65
Lampiran 7. Penetapan kadar enzim bromelain ... 68
Lampiran 8. Penimbangan pengujian aktivitas antioksidan. ... 72
Lampiran 9. Perhitungan konsentrasi DPPH, larutan pembanding, dan larutan uji ... 73
Lampiran 10. Optimasi metode uji aktivitas antioksidan ... 75
Lampiran 11. Uji aktivitas antioksidan menggunakan radikal DPPH ... 80
Lampiran 12. Perhitungan nilai IC50 rutin dan ekstrak bromelain daging buah nanas ... 82
xviii
INTISARI
Buah nanas (Ananas comosus (L.) Merr.) memiliki kandungan enzim bromelain. Bromelain merupakan salah satu enzim protease yang bisa digunakan dalam perawatan luka yang berhubungan dengan radikal bebas. Antioksidan merupakan senyawa yang dapat menghambat reaksi radikal bebas dalam tubuh. Penelitian ini bertujuan untuk menetapkan kadar enzim dan menguji aktivitas antioksidan ekstrak bromelain daging buah nanas.
Identifikasi enzim ditentukan secara kualitatif dengan metode uji warna ninhidrin yang memiliki prinsip pembentukan warna biru-ungu dari reaksi antara ninhidrin dan asam amino, dan secara kuantitaif dengan metode spektrofotometri ultraviolet dan baku standar berupa bovine serum albumine (BSA) yang memiliki prinsip pengukuran absorbansi dari cincin aromatik yang dimiliki oleh enzim. Aktivitas antioksidan ditentukan dengan metode DPPH yang memiliki prinsip penurunan intensitas absorbansi DPPH yang sebanding dengan kenaikan konsentrasi senyawa antioksidan yang dinyatakan dalam IC50 (Inhibition Concentration 50).
Penelitian menunjukan bahwa kadar enzim ekstrak bromelain buah nanas sebesar 8,4967±0,0289 % b/b dan aktivitas antioksidan ekstrak bromelain buah nanas dengan nilai IC50 sebesar 4,7221±0,0287 mg/mL.
Kata kunci: enzim, bromelain, Ananas comosus (L.) Merr., aktivitas antioksidan,
xix
ABSTRACT
Pineapple fruits (Ananas comosus (L.) Merr.) contain bromelain enzyme. Bromelain is one of proteases that have been used for wound treatment which associated with free radical. Antioxidant is a compound that can inhibit the reaction of free radicals within the body. The aims of this study are to determine enzyme content and antioxidant activity of bromelain extracted from pineapple fruit.
Enzyme identification was determined qualitatively using ninhydrin, in which it’s principle is a production of Ruhemann’s purple from the reaction between ninhydrin and amino acids. UV spectrophotometric method was applied to determine the enzyme content based on bovine serum albumine (BSA) as the reference. The principle of this method is according to the aromatic ring of enzyme’s absorbance measurement. Antioxidant activity was determined using DPPH radical scavenging method based on the principle that the DPPH absorbance intensity is decreasing proportionaly with the increasing of the compound’s concentration. Antioxidant activity was expressed as IC50 (Inhibition
Concentration 50).
Research demonstrated that the enzyme content of the pineapple fruit bromelain extract is 8,4967±0,0289 % b/b and it’s antioxidant activity with the IC50 value is 4,7221±0,0287 mg/mL.
Keywords: enzyme, bromelain, Ananas comosus (L.) Merr., antioxidant activity,
1
BAB I PENGANTAR
A. Latar Belakang
Istilah antioksidan dan radikal bebas merupakan istilah yang cukup populer di kalangan ahli gizi dan tenaga kesehatan profesional lainnya. Dalam beberapa tahun ini, istilah tersebut semakin sering digunakan dan mulai menyita
perhatian publik, khususnya masyarakat yang memiliki kepedulian pada kesehatan dan gaya hidup. Beberapa penelitian juga mengungkapkan peran dari stress
oksidatif yang disebabkan oleh radikal bebas dalam berbagai penyakit yang berbahaya, seperti penyakit kanker, penyakit yang berhubungan dengan kardiovaskular, dan penyakit degeneratif. Penelitian-penelitian tersebut juga
menyampaikan bahwa antioksidan memiliki nilai terapetik pada penyakit-penyakit tersebut (Barhe dan Tchouya, 2014).
Radikal bebas adalah suatu atom atau molekul yang mempunyai elektron tidak berpasangan. Elektron tidak berpasangan tersebut menyebabkan radikal
bebas sangat reaktif yang kemudian akan menangkap atau mengambil elektron dari senyawa lain seperti protein, lipid, karbohidrat, dan DNA untuk menetralkan diri. Radikal bebas dapat masuk ke dalam tubuh dan menyerang sel-sel yang sehat
dan menyebabkan sel-sel tersebut kehilangan fungsi dan strukturnya. Akumulasi dari kerusakan tersebut berkontribusi terhadap beberapa penyakit dan
Efek negatif radikal bebas terhadap tubuh dapat dicegah dengan senyawa yang disebut antioksidan. Antioksidan memiliki kemampuan memberikan
elektron, mengikat dan mengakhiri reaksi berantai radikal bebas (Halliwell, 2012). Antioksidan dibagi menjadi dua kelompok, yaitu antioksidan alami dan
antioksidan sintetik. Antioksidan alami berasal dari hasil ekstraksi bahan alami yang berpotensi menangkap radikal bebas, sedangkan antioksidan sintetik diperoleh dari hasil sintesis secara kimia (Isfahlan, dkk., 2010). Namun, adanya
kekhawatiran terhadap efek samping penggunaan antioksidan sintetik menyebabkan banyak penelitian tentang potensi antioksidan alami yang berasal
dari tanaman (Saleh, Clark, Woodard, dan Deolu, 2010).
Nanas (Ananas comosus (L.) Merr.) adalah salah satu dari tiga buah tropis yang paling penting setelah pisang dan jeruk. Nanas merupakan buah yang
mempunyai kandungan sangat kompleks, kaya akan mineral baik makro maupun mikro, zat organik, air dan juga vitamin. Nanas mengandung gula, asam, asam
askorbat, senyawa fenolik, mineral, dan enzim bromelain (Yahia, 2011). Enzim bromelain termasuk ke dalam golongan enzim protease yang mampu memecah
protein rantai panjang menjadi fragmen protein yang lebih kecil bahkan sampai ke bentuk asam amino (Ali, Milala, dan Gulani 2015).
Enzim bromelain adalah salah satu enzim protease yang digunakan dalam
perawatan luka dan mempercepat proses regenerasi jaringan (Maurer, 2001). Enzim protease yang digunakan secara luas dalam bidang kosmetik untuk
regenerasi jaringan karena pembentukan keloid disebabkan oleh adanya akumulasi dari jaringan kolagen dan pembentukan jaringan pyridinoline yang
dihubungkankan dengan radikal bebas (Pendzhiev, 2002). Untuk melihat potensi antioksidan dari bromelain yang telah digunakan untuk perawatan luka, dalam
penelitian ini dilakukan pemeriksaan aktivitas antioksidan dengan metode DPPH (1,1-diphenyl-2-picrylhydrazyl) secara spektrofotometri. Metode DPPH dipilih karena sederhana, mudah, cepat, dan peka serta hanya memerlukan sedikit
sampel. Parameter yang digunakan untuk uji penangkapan radikal DPPH adalah
IC50 yaitu konsentrasi ekstrak atau fraksi uji yang dibutuhkan untuk menangkap
radikal DPPH sebanyak 50% (Zou, Lu, dan Wei, 2004). Pengukuran kadar enzim dari ekstrak bromelain daging buah nanas dilakukan dengan menggunakan metode spektrofotometri ultraviolet (uv) yang merupakan salah satu metode yang cepat
dan sederhana dalam menentukan kandungan enzim bromelain (Chaurasiya dan Hebbar, 2013).
1. Permasalahan
a. Berapa nilai aktivitas antioksidan ekstrak bromelain daging buah nanas
yang dinyatakan dengan IC50?
b. Berapa kadar enzim ekstrak bromelain daging buah nanas yang dinyatakan dengan persen (% b/b)?
2. Keaslian penelitian
Sejauh penelusuran peneliti, penelitian yang serupa pernah dilakukan
Latex and Bromelain from Pineapple Fruits”. Penelitian ini menggunakan buah nanas yang diperoleh di Chiang Mai (Thailand), purifikasi menggunakan etanol
95% dengan perbandingan 1:1 selama 30 menit, uji kualitatif dan pengukuran kadar enzim menggunakan HPLC (high performance liquid chromatography),
dan uji aktivitas antioksidan dengan metode DPPH
(1,1-diphenyl-2-picrylhydrazyl).
Perbedaan penelitian ini dengan penelitian yang pernah dilakukan
tersebut teletak pada letak pemanenan buah nanas, metode purifikasi, dan metode uji kualitatif dan penetapan kadar enzim. Penelitian ini menggunakan buah nanas
yang diperoleh di pasar Stan (Yogyakarta), purifikasi menggunakan etanol 90% dengan perbandingan 1:3 selama 24 jam, uji kualitatif menggunakan uji ninhidrin, dan penetapan kadar enzim menggunakan metode spektrofotometri uv.
3. Manfaat penelitian
a. Manfaat Teoritis
Penelitian ini diharapkan dapat bermanfaat bagi perkembangan ilmu pengetahuan khususnya ilmu kefarmasian tentang aktivitas antioksidan
ekstrak bromelain daging buah nanas. b. Manfaat Praktis
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat
B. Tujuan Penelitian 1. Tujuan umum
Penelitian ini bertujuan untuk mengeksplorasi kemanfaatan daging buah nanas sebagai antioksidan.
2. Tujuan khusus
Penelitian ini bertujuan untuk mengetahui nilai aktivitas antioksidan ekstrak bromelain daging buah nanas dengan metode DPPH yang dinyatakan
dengan IC50 dan kadarnya dengan baku standar BSA yang dinyatakan dengan
6
BAB II
TINJAUAN PUSTAKA
A. Nanas 1. Taksonomi
Klasifikasi tanaman menurut Pullaiah (1998) sebagai berikut: Kingdom : Plantae
Subkingdom : Viridiplantae Superdivision : Embryophyta
Division : Tracheophyta
Class : Magnoliopsida
Superorder : Lilianae
Order : Poales
Family : Bromeliaceae
Genus : Ananas Mill.
Species : Ananas comosus (L.) Merr.
2. Morfologi
Tanaman nanas berbentuk semak dan hidupnya bersifat tahunan (parenial). Susunan tubuh tumbuhan nanas terdiri dari bagian utama meliputi:
akar, batang, daun, bunga, dan tunas-tunas. Biji nanas berkeping tunggal. Bentuk batang nanas mirip gada, berukuran panjang antara 20-25 cm atau lebih, tebal
buah merupakan perpanjangan batang. Daun nanas tumbuh memanjang sekitar 130-150 cm, lebar antara 3-5 cm atau lebih, pinggir daun ada yang berduri atau
tanpa duri, permukaan daun sebelah atas halus mengkilap berwarna hijau tua atau merah tua bergaris atau coklat kemerah-merahan, sedangkan permukaan daun dan
bagian bawah berwarna keputih-putihan atau keperak-perakan. Daun mahkota lepas bentuk garis memanjang, panjang lebih kurang 2 cm, putih dan ungu, dari dalam dan pangkalnya dengan dua pinggiran menonjol, berkuku. Buah semu
berdaging, hijau sampai orange, biji kecil dan kerap kali tidak menonjol. Jumlah daun tiap batang (tanaman) amat bervariasi antara 70-80 helai yang tata letaknya
seperti spiral, yakni mengelilingi batang mulai dari bawah ke arah atas kanan dan kiri (Van Steenis, 1992).
Bunga atau buah nanas muncul pada ujung tanaman. Bunga nanas
tersusun dalam tangkai berukuran panjang antara 7-5 cm atau lebih. Tiap tangkai bunga terdiri dari 100-200 kuntum bunga yang melekat saling berhimpitan
(berdempetan). Sifat pembungaan nanas termasuk menyerbuk silang, tanpa melalui penyerbukan silang buah nanas tidak akan menghasilkan biji. Kumpulan
kuntuk buanga dengan adanya proses penyerbukan akan menghasilkan kumpulan buah kecil berjumlah 100-200 buah. Buah-buahan kecil tersebut bergabung menjadi satu dan dihubungkan oleh batang tengah yang disebut hati, sehingga
3. Kegunaan
Cairan buah nanas berkhasiat sebagai obat rasa penuh di lambung,
sembelit, radang tenggorokan, menurunkan berat badan, beri-beri, keseleo, bengkak terpukul, darah mudah menggumpal, penyempitan pembuluh darah,
menghambat pertumbuhan tumor, meningkatkan penyerapan obat, mempercepat haid, dan cacingan. Hal yang menjadi catatan khusus adalah ibu hamil dilarang meminum perasan buah nanas muda. Buah nanas dalam saluran cerna akan
difermentasi menjadi alkohol yang dapat menimbulkan kambuhnya rematik gout (Pavan, Jain, Shraddha, dan Kumar, 2012).
4. Kandungan kimia
Buah, daun, dan akar nanas mengandung saponin, flavonoid, dan polifenol, ergosterol, peroksida, asam annasat, asam sitrat, enzim bromelain,
vitamin (A dan C), kalsium, fosfor, magnesium, besi, natrium, kalium, kalsium oksalat, dekstrosa, sukrosa, dan pectic substances. Buah nanas juga mengandung
selulosa, hemiselulosa dan karbohidrat lain (Bartholomew, Paull, dan Rohrbach, 2002).
B. Bromelain 1. Sifat fisika dan biokimia
Bromelain tergolong jenis enzim protease sulfhidril yang mampu menghidrolisis ikatan pepetida pada protein atau polipeptida menjadi molekul
selulase, glikoprotein, karbohidrat, dan protease inhibitor. Berdasarkan sumbernya, bromelain dibagi menjadi stem bromelain dan fruit bromelain.
Terdapat perbedaan berat molekuler, titik isoelektrik, rantai asam amino, dan aktivitas proteolitik antara kedua tipe bromelain tersebut. Bromelain ini berbentuk
serbuk amorf dengan warna putih bening sampai kekuning-kuningan, berbau khas, larut sebagian dalam: aseton, eter, stabil pada pH: 5,0-7,0. Suhu optimum enzim bromelain adalah 50˚C-60˚C (Maurer, 2001).
2. Sifat farmakologi
Bromelain memiliki beberapa sifat farmakologi yang disebabkan oleh
aktivitas proteolitiknya maupun non-proteolitiknya. Dari berbagai uji in vitro dan
in vivo, maupun dari uji klinik yang terkontrol dan tidak terkontrol, bromelain
memiliki kemampuan sebagai berikut:
Mencegah pembentukan edema dan mengurangi edema
Mengurangi kadar fibrinogen dalam darah
Membantu proses fibrinolisis
Mengaktifkan plasmin
Memperpanjang waktu protrombin dan parsial tromboplastin
Mencegah agregasi platelet darah dan adesi dari platelet ke sel endotelial
pembuluh darah
Mengurangi kadar plasmakinin dalam darah
Mengurangi kadar prostaglandin E2 dan tromboksan A2 pada inflamasi
Menginduksi sekresi dari interleukin (Il)-1, Il-6, Il-8, dan tumor necrosis
factor (TNF)-α dari monosit dan granulosit
Meningkatkan permeabilitas jaringan dari antibiotik
Mencegah metastasis
Membantu proses debridemen kulit pada luka bakar (Bhattacharyya,
2008).
3. Bioavailabilitas dan toksisitas
Bromelain diabsorbsi di saluran cerna dan masuk ke dalam peredaran
darah sebanyak 40% setelah penggunaan oral pada tikus. Konsentrasi tertinggi bromelain dalam darah didapatkan setelah 1 jam dengan waktu paruh selama 6-9 jam. Penelitian melaporkan bahwa tidak ada efek toksik pada mencit, tikus, dan
kelinci bila diberikan dosis sebesar 10 mg/kgBB. Pada pemberian secara intravena diperoleh LD50 pada mencit 30 mg/kgBB dan kelinci 20 mg/kgBB,
sedangkan pada pemberian secara intraperitonial diperoleh LD50 pada mencit 37
mg/kgBB dan tikus 85 mg/kgBB. Penelitian toksistas kronis pada tikus pada satu periode selama 3 bulan memperlihatkan tidak adanya perubahan patologi pada
organ-organ vital (Moss, Frazier, dan Martin, 1963).
4. Isolasi
Bromelain terdapat pada tangkai, kulit, daun, buah, maupun batang
dalam jumlah yang berbeda. Kandungan enzim bromelain lebih banyak pada batang namun selama ini kurang dimanfaatkan. Distribusi bromelain pada nanas
bahkan kadang-kadang tidak ada sama sekali, sedangkan bagian tengah batang mengandung bromelain lebih banyak dibandingkan bagian tepinya. Pada buah
nanas, kandungan bromelain lebih banyak pada buah nanas yang masih hijau atau belum matang dibandingkan buah nanas segar yang sudah matang (Harrach,
Schulze, Nuck, Grunow, dan Maurer, 1995).
Salah satu metode yang digunakan untuk mengisolasi bromelain adalah penambahan pelarut organik. Bromelain diisolasi dari bagian tanaman nanas yang
sudah berupa sari buah atau perasannya dengan menambahkan pelarut organik sebagai bahan pengendap, biasa yang digunakan adalah alkohol, aseton, dan
ammonium sulfat. Cara pengendapannya berbeda-beda, ada beberapa peneliti yang melakukan pengendapan dengan menambahkan larutan pada pH tertentu dan ada yang melakukan pengendapan dengan membuat kondisi pada suhu tertentu.
Hasil isolasi dengan metode ini disebut dengan crude bromelain extract (Nadzirah, Zainal, Noriham, dan Normah, 2013).
C. Metode Ninhidrin
Uji kualitatif dari protein dilakukan dengan menggunakan senyawa ninhidrin. Prinsip dari metode ini adalah ninhidrin yang mula-mula berwarna kuning akan bereaksi dengan asam amino dan berubah warna menjadi biru-ungu.
Warna biru-ungu yang terbentuk kepekatannya setara dengan konsentrasi asam amino, artinya semakin besar konsentrasi asam amino, maka semakin banyak
Ruhemman yang berwarna ungu, sehingga warna biru yang dihasilkan semakin pekat (Boyer, 2011).
Ninhidrin bereaksi dengan gugus amino alfa yang terdapat dalam semua asam amino, peptida, dan protein. Uji ini merupakan uji yang cepat dan sensitif
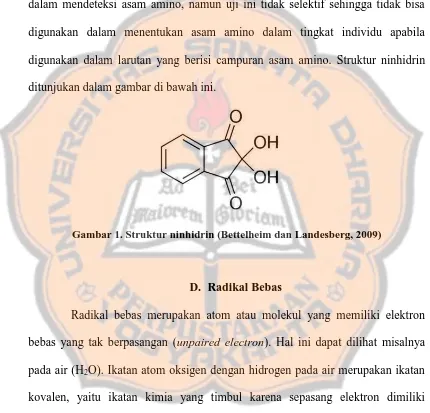
dalam mendeteksi asam amino, namun uji ini tidak selektif sehingga tidak bisa digunakan dalam menentukan asam amino dalam tingkat individu apabila digunakan dalam larutan yang berisi campuran asam amino. Struktur ninhidrin
[image:34.595.85.515.226.639.2]ditunjukan dalam gambar di bawah ini.
Gambar 1. Struktur ninhidrin (Bettelheim dan Landesberg, 2009)
D. Radikal Bebas
Radikal bebas merupakan atom atau molekul yang memiliki elektron
bebas yang tak berpasangan (unpaired electron). Hal ini dapat dilihat misalnya pada air (H2O). Ikatan atom oksigen dengan hidrogen pada air merupakan ikatan
kovalen, yaitu ikatan kimia yang timbul karena sepasang elektron dimiliki
bersama oleh dua atom. Elektron yang tidak memiliki pasangan cenderung akan menarik eletron dari senyawa lainnya, sehingga elektron tersebut akan dimiliki
senyawa radikal bebas menjadi lebih mudah untuk menyerang sel-sel sehat dalam tubuh. Jika pertahanan tubuh lemah maka sel-sel tersebut menjadi sakit atau rusak
(Uppu, Murthy, Pryor, dan Parinandi, 2010).
Radikal bebas tersebut memiliki 2 sifat yaitu:
1. Reaktivitasnya yang tinggi karena akan cenderung menarik elektron dari senyawa yang lainnya lagi.
2. Memiliki kemampuan untuk mengubah suatu molekul, atom, atau senyawa
untuk menjadi suatu radikal baru (Morello, Shahidi, Ho, 2002).
Target utama radikal bebas adalah protein, karbohidrat, asam lemak tak
jenuh dan lipoprotein, serta unsur-unsur DNA. Dari molekul-molekul target tersebut, yang paling rentan terhadap serangan radikal bebas adalah asam lemak tak jenuh. Senyawa radikal bebas di dalam tubuh dapat merusak asam lemak tak
jenuh ganda pada membran sel sehingga dinding sel menjadi rapuh, merusak basa DNA sehingga mengacaukan sistem genetika, dan berlanjut pada pembentukan sel
kanker. Radikal bebas akan terus mencari elektron dari molekul-molekul di sekitarnya dan apabila tidak dikendalikan reaksi berantai ini dapat berlangsung
secara terus menerus (Halliwell dan Gutteridge, 2000).
E. Antioksidan
Antioksidan merupakan senyawa pemberi elektron (electron donor) atau reduktan. Senyawa ini mampu menginaktivasi berkembangnya reaksi oksidasi,
yang dapat teroksidasi, dapat menunda atau menghambat oksidasi senyawa tersebut (Sunardi, 2007).
Berdasarkan mekanisme kerjanya, antioksidan diklasifikasikan menjadi dua kategori, yaitu antioksidan pencegah dan antioksidan pemutus rantai.
Antioksidan pencegah bekerja dengan menghambat pembentukan reactive oxygen
species (ROS), seperti enzim katalase, peroksidase, superoksida dismutase, dan
transferin. Antioksidan pemutus rantai merupakan senyawa yang menangkap
radikal oksigen kemudian memutus rangkaian rantai reaksi radikal, contohnya vitamin C, vitamin E, asam urat, bilirubin, polifenol, dan sebagainya. Antioksidan
pemutus rantai memiliki dua jaul reaksi. Jalur pertama merupakan jalur transfer atom hidrogen dengan mekanisme radikal oksigen menangkap hidrogen dari antioksidan sehingga terbentuk kompleks antioksidan radikal yang bersifat stabil.
Jalur kedua, antioksidan mendeaktivasi radikal bebas dengan transfer elektron tunggal. Transfer elektron tunggal sangat dipengaruhi oleh kestablilan pelarut
pada muatan tertentu (Ou, Huang, Woodill, Flanagan, dan Deemer, 2002).
F. Metode DPPH
Metode DPPH merupakan metode yang cepat, sederhana, dan tidak
membutuhkan biaya tinggi dalam menentukan kemampuan antioksidan menggunakan radikal bebas 2,2-diphenyl-1-picrylhydrazyl (DPPH). Metode ini sering digunakan untuk menguji senyawa yang berperan sebagai free radical
scavengers atau donor hidrogen dan mengevaluasi aktivitas antioksidannya, serta
DPPH dapat digunakan untuk sampel yang berupa padatan maupun cairan (Prakash, Rigelhof, dan Miller, 2001).
Gugus kromofor dan auksokrom pada radikal bebas DPPH memberikan absorbansi maksimum pada panjang gelombang 517 nm sehingga menimbulkan
warna ungu. Warna DPPH akan berubah dari ungu menjadi kuning seiring penambahan antioksidan yaitu saat elektron tunggal pada DPPH berpasangan dengan hidrogen dari antioksidan. Hasil dekolorisasi oleh antioksidan setara
[image:37.595.89.510.208.623.2]dengan jumlah elektron yang tertangkap. Mekanisme penangkapan radikal ditunjukan pada reaksi di bawah ini.
Gambar 2. Reaksi penangkapan radikal DPPH oleh antioksidan (AH=Antioksidan, ox=Oksidasi, red=Reduksi) (Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009)
G. Landasan Teori
Reaksi oksidasi berlebihan yang terjadi di dalam tubuh dapat memicu
terbentuknya radikal bebas. Radikal bebas merupakan suatu senyawa yang memiliki elektron tidak berpasangan, sehingga tidak stabil. Untuk mencapai kestabilan, elektron tidak berpasangan akan mencari pasangan elektron di
dan dapat memicu penyakit degeneratif (Uppu, Murthy, Pryor, dan Parinandi, 2010). Senyawa antioksidan dapat meredam radikal bebas dan menghambat reaksi
oksidatif, sehingga kerusakan sel akibat radikal bebas dapat dicegah (Ou, Huang, Woodill, Flanagan, dan Deemer, 2002).
Nanas merupakan tanaman yang mudah ditemukan di daerah tropis. Kandungan buah nanas yang sudah banyak diteliti dan dipublikasikan salah satunya adalah bromelain (Bartholomew, Paull, dan Rohrbach, 2002). Bromelain
merupakan salah satu enzim protease yang umum digunakan dalam perawatan luka. Enzim protease yang digunakan dalam perawatan luka untuk regenerasi
jaringan dan mencegah timbulnya keloid berpotensi memiliki aktivitas antioksidan (Bhattacharyya, 2008).
Kandungan enzim dalam suatu sampel dapat dianalisis secara kualitatif
dengan menggunakan metode uji ninhidrin dan kuantitatif dengan menggunakan metode spektrofotometri uv. Prinsip uji ninhidrin yaitu pembentukan warna
biru-ungu dari reaksi antara ninhidrin dan asam amino (Boyer, 2011). Prinsip spektrofotometri yaitu protein yang memiliki cincin aromatik seperti fenilalanin,
triptofan, histidin, dan tirosin memiliki serapan yang kuat pada panjang gelombang 280 nm. Intensitas serapan pada panjang gelombang tersebut sebanding dengan jumlah enzim dalam sampel (Walker, 2002).
Metode DPPH merupakan metode pengujian aktivitas antioksidan yang sederhana dan cepat. Metode ini menggunakan radikal bebas DPPH untuk
gelombang 517 nm dengan warna ungu. Warna ungu akan berubah menjadi kuning ketika terdapat senyawa antioksidan yang meredam radikal bebas DPPH
(Dehpour, Ebrahimzadeh, Fazel, dan Mohammad, 2009).
H. Hipotesis
1. Ekstrak bromelain daging buah nanas (Ananas comosus (L.) Merr.) memiliki aktivitas antioksidan yang dinyatakan dengan IC50.
18
BAB III
METODE PENELITIAN
A. Jenis dan Rancangan Penelitian
Penelitian ini merupakan penelitian eksperimental murni dengan rancangan acak lengkap pola searah.
B. Variabel dan Definisi Operasional
Variabel – variabel yang digunakan pada penelitian ini adalah:
1. Variabel utama
a. Variabel bebas
Variasi konsentrasi ekstrak bromelain daging buah nanas.
b. Variabel tergantung
Aktivitas antioksidan (%IC) dan kadar enzim ekstrak bromelain daging buah
nanas.
2. Variabel pengacau
a. Variabel pengacau terkendali
Jenis tanaman, tempat tumbuh tanaman, waktu pemanenan, umur buah yang dipanen, cara panen, jumlah (g) buah yang digunakan, suhu evaporasi, waktu
pengendapan, dan lama penyimpanan ekstrak bromelain. b. Variabel pengacau tidak terkendali
3. Definisi operasional
a. Aktivitas antioksidan
Aktivitas antoksidan adalah kemampuan ekstrak bromelain untuk menangkap radikal DPPH dibandingkan dengan kontrol negatif.
b. Ekstrak bromelain
Ekstrak bromelain adalah crude bromelain extract yang diperoleh dari presipitasi dan pengeringan ekstrak daging buah nanas.
c. Kadar enzim
Kadar enzim adalah suatu nilai yang dinyatakan dalam bentuk persen yang
menyatakan kadar enzim bromelain dalam ekstrak bromelain. d. Persen inhibition concetration (%IC)
Persen inhibition concetration adalah suatu nilai yang dinyatakan dalam
bentuk persentase yang menyatakan kemampuan ekstrak bromelain dalam menangkap radikal DPPH.
e. Inhibition concetration 50 (IC50)
Inhibition concetration 50 adalah nilai dosis ekstrak bromelain yang dapat
menghasilkan penangkapan 50% radikal DPPH.
C. Bahan Penelitian
Bahan uji yang digunakan adalah daging buah nanas yang dibeli pada bulan Februari - Maret 2016 dan diperoleh dari pasar Stan, kabupaten Sleman,
dan deionized water; bahan kimia kualitas pro analitik (E. Merck) berupa metanol dan ninhidrin; bahan kimia kualitas pro analitik (Sigma Chem. Co.) berupa rutin
dan DPPH; bahan kimia kualitas pro analitik (DiaSys) berupa bovine serum
albumine (BSA).
D. Alat Penelitian
Alat yang digunakan dalam penelitian ini, antara lain: blender (Maspion),
corong Buchner (Desaga), mikropipet 50-200 µL (Socorex), vortex (Stuart Scientific), sentrifuge (Hettich), magnetic stirrer (Thermo Scientific), vacuum
rotary evaporator (Butchi), waterbath (Memmert), spektrofotometer UV-Vis
(Shimadzu UV mini-1240 UV-Vis Spektrofotometer), neraca analitik ketelitian 0,1 mg (Mettler Toledo), serta alat-alat gelas yang lazim digunakan di
laboratorium (Pyrex-Germany).
E. Tata Cara Penelitian 1. Determinasi buah nanas
Determinasi buah nanas dilakukan di Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta berdasarkan Backer dan Bakhuizen van Den Brink (1963) dengan mencocokan karakteristik
2. Pengumpulan buah nanas
Buah nanas diperoleh dari desa pasar Stan, kabupaten Sleman,
Yogyakarta, dan buah yang diambil memiliki jenis dan tingkat kematangan yang sama.
3. Pembuatan ekstrak bromelain daging buah nanas
Metode yang digunakan berdasarkan pada penelitian oleh Soares, Vaz, Correia, Pessoa, dan Carneiro-da-Cunha (2012) dengan beberapa modifikasi.
a. Ekstraksi buah nanas
Buah nanas dicuci dengan air mengalir, dikeringkan, dan dikupas.
Daging buah sebanyak 70,0 g dipotong kecil-kecil kemudian dicampur dengan deionized water 4°C (1:1 w/w) dan dihaluskan menggunakan
blender. Larutan jus disaring dengan menggunakan kain katun tipis lalu
disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit. Supernatan dikumpulkan dalam gelas beker sebagai ekstrak daging buah nanas.
b. Purifikasi dengan teknik ethanol precipitation
Ekstrak daging buah nanas sebanyak 100,0 mL didinginkan sampai
suhunya 4°C lalu ditambahkan dengan etanol (90%;4°C) dengan perbandingan 1:3 sebanyak 300,0 mL. Campuran diaduk menggunakan
magnetic stirrer selama 5 menit dan didiamkan selama 24 jam pada suhu
4°C sehingga didapatkan endapan koloidal putih hingga kuning muda. Setelah terjadi pengendapan, campuran diuapkan menggunakan vacuum
rotary evaporator dengan suhu 50°C selama 30 menit. Endapan
waterbath dengan suhu 50°C selama 3 jam. Cairan kental berwarna
kekuningan dikumpulkan sebagai ekstrak bromelain.
4. Analisis kualitatif bromelain
Metode yang digunakan berdasarkan pada penelitian oleh Panda (2000)
dengan beberapa modifikasi. a. Reaksi Warna
Senyawa BSA sebanyak 0,5 mL dengan konsentrasi 50 mg/mL
dilarutkan ke dalam 10,0 mL deionized water, ekstrak bromelain sebanyak 250,0 mg dilarutkan ke dalam 50,0 mL deionized water, dan
ninhidrin sebanyak 350,0 mg dilarutkan ke dalam 100,0 mL etanol 90%. Larutan BSA diambil sebanyak 1 mL lalu dimasukan ke dalam tabung reaksi dan ditambah dengan larutan ninhidrin sebanyak 5 mL. Campuran
dipanaskan pada suhu 100°C selama 15 menit sehingga muncul warna biru-ungu yang menandakan terjadi reaksi antara asam amino dengan
ninhidrin. Analisis yang sama juga dilakukan untuk larutan bromelain dan air deionisasi. Replikasi dilakukan sebanyak 3 kali.
5. Penetapan kadar enzim bromelain
Metode yang digunakan berdasarkan pada penelitian oleh Ahmed (2005) dengan beberapa modifikasi.
a. Pembuatan larutan uji
Ekstrak bromelain sebanyak 250,0 mg ditimbang dan dilarutkan ke
b. Pembuatan larutan baku
Senyawa BSA sebanyak 0,5 mL dengan konsentrasi 50 mg/mL
dilarutkan ke dalam 25,0 mL aquadest (5°C). Larutan tersebut diambil sebanyak 4,0; 5,5; 7,0; 8,5 dan 10,0 mL lalu ditambah dengan aquadest
(5°C) hingga 10,0 mL, sehingga diperoleh konsentrasi larutan baku bromelain sebesar 400, 550, 700, 850 dan 1000 µg/mL.
c. Penentuan operating time (OT)
Larutan baku BSA dengan konsentrasi 400, 700, dan 1000 µg/mL divortex selama 30 detik dan dibaca serapannya dengan menggunakan
spektrofotometer uv pada panjang gelombang 280 nm tiap 5 menit selama 30 menit. Replikasi dilakukan sebanyak 3 kali.
d. Penetapan panjang gelombang maksimum
Larutan baku BSA dengan konsentrasi 400, 700, dan 1000 µg/mL dimasukan ke dalam tabung reaksi dan divortex selama 30 detik, lalu
didiamkan selama OT. Larutan diukur serapannya pada panjang gelombang 200-400 nm.
e. Pengukuran absorbansi larutan baku dan uji
Larutan BSA dengan konsentrasi 400, 550, 700, 850 dan 1000 µg/mL diukur serapannya pada panjang gelombang maksimum terhadap
blanko yang terdiri dari aquadest (5°C). Replikasi dilakukan sebanyak 3 kali. Kemudian, larutan uji dengan konsentrasi 10000 µg/mL diukur
f. Estimasi kadar enzim
Berdasarkan hasil dari prosedur 5 d untuk BSA dan ekstrak
bromelain kemudian dihitung nilai % kadar enzim.
6. Pembuatan larutan uji aktivitas antioksidan
Metode yang digunakan berdasarkan pada penelitian oleh Thangaraj (2016) dengan beberapa modifikasi.
a. Pembuatan larutan DPPH
Senyawa DPPH sebanyak 15,8 mg ditimbang dan dilarutkan ke dalam metanol p.a hingga 100,0 mL, sehingga diperoleh kosentrasi
larutan DPPH sebesar 0,4 mM. Larutan tersebut ditutup dengan alumunium foil dan harus selalu dibuat baru.
b. Pembuatan larutan rutin
Senyawa rutin sebanyak 5,0 mg dilarutkan ke dalam metanol p.a hingga 100,0 mL. Larutan tersebut diambil sebanyak 2,0; 3,0; 4,0; 5.0
dan 6,0 mL lalu ditambah dengan metanol p.a hingga 10,0 mL, sehingga diperoleh konsentrasi larutan standar rutin sebesar 10, 15, 20, 25, dan 30
µg/mL.
c. Pembuatan larutan uji
Ekstrak bromelain sebanyak 250,0 mg ditimbang dan dilarutkan ke
dalam aquadest hingga 25,0 mL. Larutan tersebut diambil sebanyak 3,0; 3,5; 4,0; 4,5 dan 5,0 mL lalu ditambah dengan aquadest (5°C) hingga
7. Uji aktivitas antioksidan
Metode yang digunakan berdasarkan pada penelitian oleh Thangaraj (2016)
dengan beberapa modifikasi. a. Uji pendahuluan
Dalam tiga buah tabung reaksi, masing-masing ditambah dengan larutan DPPH dan air deionisasi, larutan rutin 25 µg/mL, dan larutan bromelain 5 mg/mL sebanyak 1,0 mL kemudian ditambah dengan
metanol p.a sebanyak 3 mL. Larutan tersebut kemudian divortex selama 30 detik dan didiamkan selama 30 menit. Setelah 30 menit, warna larutan
diamati. Replikasi dilakukan sebanyak 3 kali. b. Penentuan operating time (OT)
Dalam tiga buah labu ukur 5 mL, masing-masing ditambah dengan
larutan DPPH dan larutan rutin 5, 15, dan 25 µg/mL sebanyak 1,0 mL kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan
divortex selama 30 detik dan dibaca serapannya dengan menggunakan spektrofotometes visibel pada panjang gelombang 517 nm tiap 5 menit
selama 1 jam. Replikasi dilakukan sebanyak 3 kali. c. Penetapan panjang gelombang maksimum
Dalam tiga buah labu ukur 10 mL, masing-masing ditambah
dengan larutan DPPH sebanyak 0,5; 1,0; dan 1,5 mL, kemudian ditambah dengan metanol p.a hingga tanda batas, sehingga diperoleh konsentrasi
tabung reaksi dan divortex selama 30 detik, lalu didiamkan selama OT. Larutan diukur serapannya pada panjang gelombang 400-600 nm.
d. Pengukuran absorbansi larutan kontrol DPPH
Larutan DPPH sebanyak 2,0 mL dimasukan ke dalam labu ukur 10
mL dan ditambah dengan metanol p.a hingga tanda batas. Setelah OT, larutan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang maksimum. Replikasi dilakukan sebanyak 3
kali. Larutan ini digunakan sebagai larutan kontrol untuk menguji larutan pembanding dan uji.
e. Pengukuran absorbansi larutan rutin dan uji
Larutan DPPH sebanyak 2,0 mL dimasukan ke dalam labu ukur 10 mL dan ditambah dengan 2 mL larutan pembanding dan larutan uji pada
berbagai seri konsentrasi yang telah dibuat, kemudian ditambah dengan metanol p.a hingga tanda batas. Larutan divortex selama 30 detik, lalu
didiamkan selama OT. Setelah OT, larutan dibaca serapannya dengan menggunakan spektrofotometer visibel pada panjang gelombang
maksimum. Replikasi dilakukan sebanyak 3 kali. f. Estimasi aktivitas antioksidan
Berdasarkan hasil dari prosedur 7 d dan e untuk rutin dan ekstrak
F. Analisis Hasil
Kadar enzim dalam ekstrak bromelain dinyatakan dalam persen. Nilai
absorbansi larutan uji dimasukan ke dalam persamaan regresi linier kurva baku BSA dengan sumbu x adalah konsentrasi larutan baku, sedangkan sumbu y adalah
absorbansi sehingga diperoleh konsentrasi enzim yang kemudian dikonversi menjadi persen kadar enzim dalam ekstrak bromelain.
Aktivitas penangkapan radikal DPPH (%IC) dihitung berdasarkan rumus:
Data aktivitas tersebut dianalisis dan dihitung nilai IC50 menggunakan persamaan
regresi linear dengan sumbu x adalah konsentrasi larutan uji maupun pembanding,
sedangkan sumbu y adalah %IC.
Data lalu dianalisis secara statistik untuk menentukan ada atau tidaknya
perbedaan bermakna antara nilai IC50 larutan pembanding dan larutan uji. Analisis
statistik dilakukan dengan panduan Bolton dan Bon (2010) dan dengan software R 3.2.5. Nilai IC50 diuji dengan Shapiro-Wilk pada taraf kepercayaan 95% untuk
mengetahui distribusi data tiap kelompok. Hasil analisis berupa distribusi data yang normal selanjutnya dianalisis dengan uji F pada taraf kepercayaan 95%
untuk mengetahui homogenitas data kelompok. Hasil analisis berupa data yang tidak homogen selanjutnya dianalisis dengan uji T-Independent unequal variances (Welch’s T-test) pada taraf kepercayaan 95% untuk melihat perbedaan antar
28
BAB IV
HASIL DAN PEMBAHASAN
A. Hasil Determinasi Tanaman
Determinasi merupakan langkah awal yang dilakukan dalam suatu penelitian dengan menggunakan tanaman. Determinasi tanaman ini bertujuan untuk mengetahui dan memastikan kebenaran identitas tanaman yang akan
digunakan dalam penelitian serta untuk menghindari terjadinya kesalahan dalam pengambilan sampel untuk analisis fitokimia. Determinasi tanaman nanas
dilakukan di Laboratorium Farmakognosi-Fitokimia, Fakultas Farmasi Universitas Sanata Dharma pada tanggal 20 Maret 2016 dengan acuan Backer dan Bakhuizen van Den Brink (1963), yang membuktikan bahwa tanaman yang
digunakan untuk penelitian adalah tanaman nanas (Ananas comosus (L.) Merr.). Pembuktian dipertegas dengan surat determinasi (lampiran 1) tanaman yang
dikeluarkan oleh Laboratorium Kebun Tanaman Obat Fakultas Farmasi Universitas Sanata Dharma Yogyakarta.
B. Hasil Pengumpulan Bahan
Nanas yang digunakan sebagai bahan penelitian bentuknya kecil dan
diambil dari pasar Stan, kabupaten Sleman, Yogyakarta. Batang nanas tidak dipilih karena ketersediaannya yang relatif tidak banyak dibandingkan dengan
bromelain buah nanas. Usaha yang dilakukan untuk meminimalkan variasi kandungan bromelain dalam buah nanas adalah sampel diambil dari satu kios
buah sama sehingga sampel buah nanas tersebut memiliki varietas, umur, dan berasal dari suplier yang sama. Buah nanas yang digunakan adalah buah nanas
yang kulitnya masih hijau dengan kondisi belum matang. Hal ini bertujuan untuk mendapatkan kandungan bromelain yang masih tinggi. Berdasarkan penelitian yang pernah dilakukan sebelumnya, buah nanas yang belum matang memiliki
kandungan bromelain yang lebih banyak dibandingkan dengan buah nanas yang sudah matang (Chaurasiya dan Hebbar, 2013).
C. Hasil Isolasi Bromelain
Proses pembuatan ekstrak bromelain daging buah nanas dimulai dengan
proses pengupasan buah nanas dan pemotongan daging buah menjadi bentuk yang lebih kecil yang bertujuan untuk memperkecil ukuran partikel sehingga luas
pemukaan daging buah yang mengalami kontak dengan pelarut semakin besar. Kontak dengan pelarut yang semakin besar dapat meningkatkan proses penarikan
senyawa kimia yang diinginkan sehingga hasil ekstraksi menjadi lebih optimal. Pelarut yang digunakan adalah deionized water dengan suhu 4˚C.
Deionized water merupakan pelarut yang mampu digunakan dalam ekstraksi
bromelain karena sifat enzim bromelain yang hidrofilik, memiliki pH 6 yang cenderung netral, dan dapat mencegah denaturasi bromelain selama proses
Rawdkuen, dan Chaiwut (2010), dan Devakate, Patil, Waje, dan Thorat (2008). Suhu dingin yaitu 4˚C digunakan dengan tujuan mencegah proses denaturasi
bromelain, memperlambat terjadinya reaksi enzimatik yang dapat merusak bromelain, dan meningkatkan kelarutan bromelain dalam proses ekstraksi.
Walaupun begitu, ada penelitian oleh Chaurasiya dan Hebbar (2013) yang menyatakan bahwa efek dari suhu selama proses ekstraksi bromelain terhadap perubahan kadar dan aktivitas enzimatik bromelain tidak signifikan sehingga ekstraksi bisa dilakukan pada suhu ruangan (25˚C).
Daging buah yang sudah dipotong kecil kecil kemudian dicampur dengan
pelarutnya dan dihomogenkan dengan blender. Proses homogenisasi bertujuan untuk mengeluarkan enzim dari sel-sel jaringan buah nanas. Enzim biasanya terletak di dalam dinding sel sehingga proses perusakan dinding sel diperlukan
agar enzim bisa dilarutkan dan diekstraksi secara sempurna. Homogenisasi menggunakan blender merupakan mechanical lysis yang dipilih karena prosesnya
yang ekonomis, cepat, mudah dilakukan, dan tidak memerlukan penambahan senyawa kimia. Metode ini juga merupakan salah satu metode terbaik dalam
merusak sel jaringan tanaman (Tolldra dan Nollet, 2013). Kelemahan dari metode ini adalah terjadinya peningkatan suhu dan munculnya busa dalam proses ekstraksi yang dapat merusak enzim di permukaan cairan. Campuran yang sudah
dihomogenkan kemudian disaring menggunakan kain katun tipis dan corong buchner dengan bantuan pompa vakum yang berguna untuk mempercepat proses
Campuran yang sudah didinginkan kembali kemudian disentrifugasi dengan kecepatan 10.000 rpm selama 15 menit. Sentrifugasi merupakan proses
fraksinasi yang bertujuan untuk memisahkan enzim bromelain dengan senyawa lainnya dalam suatu campuran. Prinsip fraksinasi dari metode sentrifugasi adalah
perbedaan pergerakan senyawa dalam gaya sentrifugal yang disebabkan oleh perbedaan berat molekul, ukuran, dan bentuk dari senyawa (Cutler, 2004). Metode ini dipilih karena sentrifugasi adalah metode fraksinasi enzim dan protein yang
paling mudah dilakukan. Kelemahan dari metode ini adalah spesifisitasnya rendah dibandingkan dengan metode lain seperti kromatografi dan elektroforesis.
Setelah proses sentrifugasi selesai, supernatan dikumpulkan dan didinginkan kembali. Supernatan kemudian dicampur etanol 90% dengan perbandingan 1: 3 dan diaduk secara konstan dengan bantuan magnetic stirrer.
Pengadukan yang konstan berfungsi untuk mencegah terkonsentrasinya etanol pada bagian tertentu saja dan meratakan pencampuran antara etanol dengan
deionized water. Campuran kemudian didiamkan selama 24 jam pada suhu 4°C
hingga menghasilkan endapan koloidal yang mengandung enzim bromelain.
Proses ini merupakan proses purifikasi yang bertujuan untuk memurnikan enzim bromelain dan memisahkannya dari senyawa lain yang tidak diperlukan. Metode purifikasi yang digunakan adalah metode presipitasi dengan pelarut organik.
Prinsip dari metode ini perubahan kelarutan dari protein dengan penambahan pelarut lainnya. Bromelain merupakan enzim yang hidrofil sehingga larut dalam
pelarut deionized water, apabila kepolaran pelarut berkurang karena deionized
akan berkurang. Ketika protein menjadi kurang larut, maka protein akan cenderung untuk berkumpul dan mengendap (Hatti-Kaul dan Mattiasson, 2003).
Pelarut organik yang dipilih adalah etanol karena kepolaran etanol lebih rendah dibandingan dengan deionized water, mampu bercampur dengan deionized water
secara sempurna, tidak bereaksi dengan enzim bromelain, dan memiliki efek presipitasi yang cukup baik. Kelemahan dari metode ini adalah waktu pengerjaan yang cukup lama (24 jam) sehingga tidak cocok untuk enzim yang tidak tahan
lama dalam penyimpanan, hasil presipitasi susah untuk dikumpulkan karena berbentuk endapan koloidal, dan perlu dilakukan metode lanjutan untuk
mengisolasi enzim dan protein yang lebih spesifik (Dennison,2003).
Endapan koloidal kemudian dikeringkan dengan menggunakan vacuum
rotary evaporator dengan suhu dan tekanan rendah. Suhu dijaga pada 50 °C untuk
mencegah proses denaturasi enzim dan protein akibat suhu yang terlalu tinggi (Chaurasiya dan Hebbar, 2013). Tekanan yang rendah akan mempercepat proses
penguapan karena pelarut yang digunakan yaitu campuran antara deionized water dan etanol 90% akan menguap di bawah titik didihnya. Setelah sebagian besar
pelarut teruapkan, cairan koloidal berwana kuning ditaruh dalam cawan porselen dan diletakan di atas waterbath agar pelarut yang tersisa dapat menguap. Penguapan dilakukan hingga didapatkan bobot tetap ekstrak kental bromelain.
Bobot tetap menurut Farmakope Indonesia (1979) yaitu dua kali penimbangan berturut-turut berbeda tidak lebih dari 0,5 mg tiap gram sisa yang ditimbang.
merusak enzim bromelain karena proses hidrolisis. Bobot ekstrak bromelain daging buah nanas yang didapatkan yaitu 3,5567 gram. Rendemen yang didapat
[image:55.595.87.511.195.621.2]yaitu 1,6937 % b/b. Proses ekstraksi dan isolasi enzim bromelain dapat dilihat pada gambar di bawah ini.
Gambar 3. Proses ekstraksi dan isolasi enzim bromelain
(1=Daging buah nanas; 2=Hasil blender; 3=Supernatan; 4=Campuran supernatan dan etanol; 5=Endapan koloidal; 6=Ekstrak kental bromelain)
D. Hasil Analisis Kualitatif Ekstrak Bromelain
Analisis kualitatif dimaksudkan untuk mengetahui secara kualitatif
keberadaan enzim bromelain dalam ekstrak bromelain daging buah nanas. Pengujian secara kualitatif ini penting dilakukan sebelum melakukan pengujian
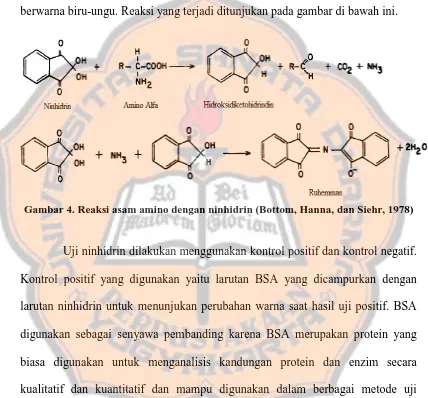
bisa secara singkat bisa dijelaskan sebagai berikut: pertama, terjadi oksidasi amino alfa oleh ninhidirin dan dihasilkan hidroksidiketohidrindin, aldehid,
amoniak, dan karbondioksida. Kedua, terjadi kondensasi antara amoniak, ninhidrin, dan hidroksidiketohidrindin dan dihasilkan senyawa Ruhemman yang
[image:56.595.93.521.219.617.2]berwarna biru-ungu. Reaksi yang terjadi ditunjukan pada gambar di bawah ini.
Gambar 4. Reaksi asam amino dengan ninhidrin (Bottom, Hanna, dan Siehr, 1978)
Uji ninhidrin dilakukan menggunakan kontrol positif dan kontrol negatif. Kontrol positif yang digunakan yaitu larutan BSA yang dicampurkan dengan larutan ninhidrin untuk menunjukan perubahan warna saat hasil uji positif. BSA
digunakan sebagai senyawa pembanding karena BSA merupakan protein yang biasa digunakan untuk menganalisis kandungan protein dan enzim secara
kualitatif dan kuantitatif dan mampu digunakan dalam berbagai metode uji (Murachi, 1970). Kontrol negatif yang digunakan yaitu pelarut deionized water yang dicampurkan dengan larutan ninhidrin untuk menunjukan warna saat
hasilnya negatif dan memastikan tidak ada intervensi dari pelarut yang digunakan. Pengujian dilakukan menggunakan tabung reaksi dengan replikasi 3 kali.
larutan ninhidrin sebanyak 5 mL. Campuran dipanaskan pada suhu 100°C selama 15 menit sehingga muncul warna biru-ungu yang menandakan terjadi reaksi
antara asam amino dengan ninhidrin. Pemanasan bertujuan untuk memecah protein dan enzim menjadi asam amino sehingga dapat bereaksi dengan ninhidrin.
Pengujian yang dilakukan menunjukan hasil yang positif untuk sampel dan kontrol positif yaitu terbentuknya warna biru ungu. Hal ini menunjukan bahwa sampel hasil isolasi bromelain dari daging buah nanas mengandung enzim
[image:57.595.87.512.219.667.2]bromelain. Hasil uji ninhidrin dan proses perubahan warnanya bisa dilihat pada gambar di bawah ini.
Gambar 5. Hasil uji ninhidrin dan perubahan warnanya
E. Hasil Optimasi Metode Penetapan Kadar Bromelain 1. Penentuan operating time (OT)
Penentuan OT bertujuan untuk mengetahui waktu yang dibutuhkan untuk tepat habis bereaksi. Pengukuran pada saat OT ditujukan untuk meminimalkan
kesalahan dalam hal pengukuran BSA dan bromelain. Penentuan OT dilakukan dengan cara mengukur absorbansi larutan baku BSA dengan tiga tingkat konsentrasi yaitu rendah, sedang, dan tinggi menggunakan spektrofotometer uv
pada panjang gelombang serapan maksimum teoritis sesuai dengan metode yang digunakan (absorbsi ultraviolet) yaitu 280 nm (Layne, 1957). OT ditentukan
berdasarkan waktu ketika nilai absorbansi mulai stabil atau selisih nilai absorbansi tiap selang waktu mulai kecil. Pengukuran absorbansi untuk penentuan OT ini dilakukan tiap selang 5 menit selama 30 menit. Hasil pengukuran OT ditunjukan
[image:58.595.87.511.230.663.2]pada grafik di bawah ini.
Gambar 6. Grafik penentuan OT BSA 0
0,2 0,4 0,6 0,8 1
5 10 15 20 25 30
A
b
so
rb
a
n
si
Waktu (Menit)
Dari penentuan OT pada larutan baku BSA pada tiga tingkat konsentrasi yang tertera pada gambar 5, terlihat bahwa absorbansi stabil pada menit ke-5
hingga menit ke-30. Dengan demikian, secara teoritis dapat disimpulkan bahwa pada menit ke-5 senyawa BSA sudah bereaksi dengan pelarutnya secara sempurna
sehingga OT untuk reaksi BSA dengan pelarutnya adalah 5 menit. Secara praktis, dapat disimpulkan bahwa pengukuran larutan BSA akan memberikan hasil yang reprodusibel bila diukur antara menit ke-5 hingga menit ke-30.
2. Penentuan panjang gelombang maksimum
Penentuan panjang gelombang serapan maksimum ini bertujuan untuk
menentukan panjang gelombang pada saat senyawa yang ingin diukur memberikan absorbansi yang paling optimum. Pada saat senyawa memberikan absorbansi yang paling optimum, maka pengukuran akan memiliki sensitifitas
yang tinggi dan linear sehingga adanya sedikit perubahan pada konsentrasi senyawa akan memberikan perubahan yang besar pada absorbansi yang
dihasilkan, dan perubahan konsentrasi senyawa sebanding dengan perubahan absorbansi senyawa yang dihasilkan. Penentuan panjang gelombang serapan
maksimum ini menggunakan senyawa BSA karena BSA memiliki cincin aromatik dengan jumlah yang cukup untuk menghasilkan pengukuran yang sensitif dan linear pada metode yang digunakan.
Panjang gelombang serapan maksimum ditentukan menggunakan larutan kontrol yaitu larutan baku BSA yang dilarutkan dalam deionized water dengan
larutan baku BSA, yaitu konsentrasi 400, 700, dan 1000 µg/mL. Penggunaan tiga konsentrasi tersebut diharapkan dapat merepresentasikan panjang gelombang
serapan maksimum dari konsentrasi yang berbeda. Scanning panjang gelombang serapan maksimum larutan baku BSA dilakukan pada panjang gelombang
[image:60.595.87.517.223.641.2]ultraviolet, yaitu rentang antara 200-400 nm.Hasil penentuan panjang gelombang serapan maksimum ditunjukan pada tabel di bawah ini.
Tabel I. Hasil scanning panjang gelombang serapan maksimum BSA
Konsentrasi larutan BSA
λ maksimum hasil
scanning λ maksimum rata-rata λ maksimum teoritis
400 µg/mL 278,0 nm
278,0 nm 280,0 nm
700 µg/mL 278,0 nm
1000 µg/mL 278,0 nm
Hasil scanning tiga konsentrasi larutan baku BSA yang tertera pada tabel I didapatkan hasil panjang gelombang serapan maksimum rata-rata adalah 278,0 nm. Panjang gelombang ini berbeda dengan panjang gelombang teoritis metode
ini, yaitu 280 nm. Hal ini diperbolehkan sesuai dengan ketentuan yang tercantum dalam Farmakope Indonesia edisi IV (1995), yaitu batas pergeseran yang
diperkenankan adalah maksimum sebesar 2 nm. Oleh karena itu, panjang gelombang maksimum yang digunakan pada penelitian ini adalah 278,0 nm.
F. Hasil Penetapan Kadar Bromelain
Penetapan kadar bromelain bertujuan untuk mengetahui kadar enzim
bromelain dalam ekstrak bromelain daging buah nanas yang diperkirakan memiliki aktivitas antioksidan. Penetapan kadar bromelain dilakukan
dalam penelitian ini adalah pengukuran absorbansi dari cincin aromatik yaitu
tryptophan, tyrosine, phenylamine, dan histidine yang dimiliki oleh protein dan
enzim yang absorbansinya diukur menggunakan spektrofotometer uv pada OT dan panjang gelombang serapan maksimum yang telah ditetapkan sebelumnya
(Walker, 2002). Prinsip reaksi yang terjadi pada penetapan kadar bromelain ini yaitu, protein memiliki dua panjang gelombang maksimum, yaitu 280 nm dan 200 nm. Elektron yang tereksitasi pada panjang gelombang 280 nm menyerap energi
yang lebih rendah dibandingkan pada panjang gelombang 200 nm karena cincin aromatik yang dimiliki oleh protein