ADSORPSI BIRU METILENA PADA KAOLIN DAN
NANOKOMPOSIT KAOLIN/TiO
2SERTA UJI SIFAT
FOTOKATALISIS
SHOFWATUN NISAA
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
ABSTRAK
SHOFWATUN NISAA. Adsorpsi Biru Metilena pada Kaolin dan Nanokomposit
Kaolin/TiO
2serta Uji Sifat Fotokatalisis. Dibimbing oleh SRI SUGIARTI dan
ZAENAL ABIDIN.
Penggunaan kaolin sebagai adsorben kurang diminati akibat daya jerapnya
yang kecil. Oleh karena itu dilakukan modifikasi kaolin menjadi nanokomposit
dengan mencampurkan serbuk kaolin dan TiO
2secara fisik dengan bahan
pengikat. Hasil pencirian difraktometer sinar-X kaolin Bangka Belitung (BNK)
dibandingkan dengan kaolin dari Japan Clay Science Society (JCSS). Hasil
pencirian kaolin Bangka Belitung menunjukkan puncak yang sama dengan JCSS
(2θ=12,36 dan 24,88). Kedua kaolin dan nanokomposit diuji daya jerapnya
dengan larutan biru metilena pada konsentrasi 25, 50, 75, 100, 150, 200, dan 300
mg/L. Kapasitas maksimum adsorpsi kedua kaolin terjadi pada konsentrasi 150
mg/L dengan nilai kapasitas adsorpsi Bangka Belitung sebesar 28,93 mg/g,
sedangkan JCSS lebih rendah, yaitu sebesar 24,27 mg/g. Konsentrasi maksimum
untuk nanokomposit mengalami penurunan bila dibandingkan dengan kaolin,
yaitu menjadi 100 mg/L dengan kapasitas adsorpsi nanokomposit BNK/TiO
212,65 mg/g dan nanokomposit JCSS/TiO
28,58 mg/g. Nanokomposit kemudian
diuji sifat fotokatalisnya menggunakan lampu ultraviolet (UV) pada panjang
gelombang 254 nm. Hasil pengujian dengan lampu UV menunjukkan bahwa
nanokomposit dapat mengurai biru metilena 12,5 mg/L, ditunjukkan dengan filtrat
hasil pengujian yang tidak berwarna dan endapan yang lebih pudar bila
dibandingkan dengan kontrol di tempat gelap. Hasil ini menunjukkan bahwa
nanokomposit dapat digunakan untuk proses adsorpsi-fotodegradasi biru metilena.
ABSTRACT
SHOFWATUN NISAA. Adsorption-Photodegradation of Methylene Blue by
Kaolin and Nanocomposite Kaolin/TiO
2and their Photocatalyst Properties.
Supervised by SRI SUGIARTI and ZAENAL ABIDIN.
Kaolin is rarely used as an adsorbent due to its small adsorption capacity.
Therefore, kaolin was modified into a nanocomposite by physically mixing TiO
2powder with binder. Diffractometer X-ray characterization of Bangka Belitung
kaolin (BNK) was done for comparison with Japan Clay Science Society (JCSS).
The investigation showed the Bangka Belitung kaolin to have the same peaks as
JCSS (2θ=12,36 and 24,88). Both kaolin and nanocomposite were tested for
adsorption with methylene blue solution at concentrations of 25, 50, 75, 100, 150,
200, and 300 mg/L. Maximum adsorption capacity in both kaolins occurred at a
concentration of 150 mg/L with a capacity of adsorption by Bangka Belitung
kaolin of 28,93 mg/g, while that of the JCSS was lower (24,27 mg/g). The
maximum concentration decreased for the nanocomposites as compared to the
kaolin to 100 mg/L with the adsorption capacity for the BNK/TiO
2nanocomposite
at 12,65 mg/g and JCSS/TiO
2nanocomposite at 8,58 mg/g. The photocatalytic
properties of the nanocomposite was then tested using ultraviolet light (UV) at a
wavelength of 254 nm. The test results with UV light showed that the
nanocomposite could degrade methylene blue 12,5 mg/L, as indicated by the
colorless filtrate and pale precipitate when compared with controls in the dark
treatment. This result showed that nanocomposite can be used for
adsorption-photodegradation of methylene blue.
ADSORPSI BIRU METILENA PADA KAOLIN DAN
NANOKOMPOSIT KAOLIN/TiO
2SERTA UJI SIFAT
FOTOKATALISIS
SHOFWATUN NISAA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN ILMU KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul : Adsorpsi Biru Metilena pada Kaolin dan Nanokomposit
Kaolin/TiO
2serta Uji Sifat Fotokatalisis
Nama
: Shofwatun Nisaa
NIM
: G44061816
Menyetujui,
Pembimbing I,
Dr. Sri Sugiarti
NIP 19701225 199512 2 001
Pembimbing II,
Dr. Zaenal Abidin
NIP 19710614 199512 1 001
Mengetahui
Ketua Departemen Kimia,
Prof. Dr. Ir. Tun Tedja Irawadi, M.S.
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Tuhan Yang Maha Esa atas
rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini.
Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan
April sampai Desember 2010 di Laboratorium Kimia Anorganik, Departemen
Kimia FMIPA IPB dan Laboratorium Bersama, IPB. Karya ilmiah yang berjudul
Adsorpsi Biru Metilena oleh Kaolin dan Nanokomposit Kaolin/TiO
2serta Uji
Sifat Fotokatalisis ini merupakan salah satu syarat untuk memperoleh gelar
sarjana sains pada Departemen Kimia FMIPA IPB.
Penulis mengucapkan terima kasih kepada Ibu Dr. Sri Sugiarti selaku
pembimbing pertama dan Bapak Dr. Zaenal Abidin selaku pembimbing kedua
yang telah memberikan arahan, saran, dan dorongan selama pelaksanaan
penelitian dan penulisan karya ilmiah ini. Ungkapan terima kasih penulis berikan
kepada keluarga tercinta, Bapak, Ibu, kakak (Kartika) dan adik-adikku (Farih dan
Hania) yang selalu memberikan semangat, doa, dan kasih sayang. Terima kasih
juga kepada Bapak Sawal, Bapak Sunarsa, Bapak Mulyadi, Nurul, Bapak Eman,
Mas Eko atas fasilitas dan bantuan yang diberikan selama penelitian. Ucapan
terima kasih juga disampaikan kepada seluruh teman-teman kimia angkatan 43
terutama Evi, Nova, Vitha, Noe, Gita, Irma, Indri, Saki, Erika yang turut
membantu, memberikan semangat dan dukungannya dalam penyusunan karya
ilmiah.
Semoga karya ilmiah ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, Februari 2011
RIWAYAT HIDUP
Penulis dilahirkan di Cirebon pada tanggal 15 Januari 1989 sebagai anak
kedua dari empat bersaudara dari pasangan Dawud Ardisela dan Roisah Minnatul
Maula. Tahun 2006, penulis lulus dari SMA Negeri 2 Bekasi dan pada tahun yang
sama lulus seleksi masuk Institut Pertanian Bogor (IPB) melalui jalur Undangan
Seleksi Masuk IPB (USMI) pada Departemen Kimia, Fakultas Matematika dan
Ilmu Pengetahuan Alam, IPB. Tahun 2008, penulis mengikuti kegiatan praktik
lapang di Laboratorium Pemastian Mutu PT Indofarma, Cibitung, Bekasi dengan
judul Uji Stabilitas Fisik dan Kimia Sediaan Amoksisilin. Selama mengikuti
perkuliahan, penulis pernah menjadi asisten praktikum Kimia Anorganik Layanan
tahun ajaran 2009/2010, Kimia Dasar pada tahun ajaran 2009/2010.
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ...
1
BAHAN DAN METODE
Bahan dan Alat ...
2
Metode...
2
HASIL
Pencirian XRD Kaolin ...
3
Penentuan Panjang Gelombang Maksimum Biru Metilena ...
3
Kapasitas Adsorpsi Kaolin ...
4
Pemodelan Isoterm Adsorpsi Kaolin ...
4
Pencirian XRD nanokomposit Kaolin/TiO
2...
4
Kapasitas Adsorpsi Nanokomposit Kaolin/TiO
2...
5
Pemodelan Isoterm Nanokomposit Kaolin/TiO
2...
5
Uji Sifat Fotokatalisis ...
6
PEMBAHASAN
Pencirian XRD Kaolin ...
7
Kapasitas Adsorpsi Kaolin ...
7
Pemodelan Isoterm Adsorpsi Kaolin ...
7
Pembuatan Nanokomposit Kaolin/TiO
2...
8
Pencirian XRD Nanokomposit Kaolin/TiO
2...
8
Kapasitas Adsorpsi Nanokomposit Kaolin/TiO
2...
8
Pemodelan Isoterm Nanokomposit Kaolin/TiO
2...
8
Uji Sifat Fotokatalisis ...
9
SIMPULAN DAN SARAN
Simpulan ... 10
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Nilai tetapan isoterm Langmuir pada kaolin ... 4
2 Nilai tetapan isoterm Langmuir pada nanokomposit kaolin/TiO
2...
6
DAFTAR GAMBAR
Halaman
1 Struktur kaolinit ...
1
2 Struktur kation biru metilena ...
1
3 Spektrum XRD JCSS ...
3
4 Spektrum XRD kaolin BNK ...
3
5 Kurva kapasitas adsorpsi kaolin, TiO
2, dan bahan pengikat ...
4
6 Kurva isoterm Langmuir kaolin ...
4
7 Kurva isoterm Freundlich kaolin ...
4
8 Spektrum XRD nanokomposit JCSS/TiO
2...
5
9 Spektrum XRD nanokomposit BNK/TiO
2...
5
10 Kurva kapasitas adsorpsi nanokomposit terhadap larutan biru metilena ...
5
11 Kurva isoterm Langmuir nanokomposit ...
5
12 Kurva isoterm Freundlich nanokomposit ...
5
13 Filtrat dalam gelap...
6
14 Filtrat hasil penyinaran ...
6
15 Spektrum UV-tampak filtrat uji fotodegradasi nanokomposit BNK/TiO
2...
6
16 Spektrum UV-tampak filtrat uji fotodegradasi nanokomposit JCSS/TiO
2....
6
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 12
2 Panjang gelombang maksimum biru metilena ... 13
3 Konsentrasi dan absorbans larutan biru metilena pada kurva standar ... 13
4 Penentuan kapasitas adsorpsi biru metilena oleh kaolin Bangka Belitung .... 14
5 Penentuan kapasitas adsorpsi biru metilena oleh JCSS ... 15
6 Penentuan kapasitas adsorpsi biru metilena oleh TiO
2... 16
7 Penentuan kapasitas adsorpsi biru metilena oleh bahan pengikat TB1 ... 17
8 Penentuan pola isoterm adsorpsi kaolin Bangka Belitung ... 18
9 Penentuan pola isoterm adsorpsi JCSS ... 18
10 Penentuan kapasitas adsorpsi biru metilena oleh nanokomposit BNK/TiO
2. 19
11 Penentuan kapasitas adsorpsi biru metilena oleh nanokomposit JCSS/TiO
2. 20
12 Penentuan pola isoterm adsorpsi nanokomposit BNK/TiO
2... 21
13 Penentuan pola isoterm adsorpsi nanokomposit JCSS/TiO
2... 21
PENDAHULUAN
Indonesia merupakan negara yang kaya akan bahan tambang, baik bahan tambang mineral maupun non mineral. Salah satu bahan tambang non mineral adalah kaolin. Tercatat bahwa di Indonesia terdapat cadangan kaolin untuk diekspor sebesar 224.300.000 ton (LPSE BABEL 2010). Kaolin lazim disebut sebagai “lempung cina” karena pertama kali ditemukan di daerah Kao-Lin, Cina (Zheng et al. 2005). Mineral kaolinit ditemukan dalam lempung kaolin sebanyak 85–95%. Kaolin dapat berwarna putih, merah muda, atau abu-abu bergantung pada komposisinya.
Kaolin di antaranya terdapat di daerah Bangka Belitung, Cicalengka, dan Wonosari. Kaolin merupakan campuran dari beberapa mineral berbeda yang komponen utamanya adalah kaolinit. Kaolin banyak digunakan di industri cat, plastik, keramik, kosmetik, industri obat-obatan dan dalam pembuatan kertas sebagai pengisi. Pemanfaatan kaolin sebagai adsorben, misalnya untuk limbah zat warna kurang diminati karena daya adsorpsinya yang kecil. Hal ini disebabkan oleh struktur kaolin yang berupa lapisan 1:1, yaitu untuk setiap satuan mineral terdiri atas satu lapisan oksida-Si (lapisan silikat) dan satu lapisan hidroksioksida-Al (lapisan aluminat) (Gambar 1). Satuan-satuan ini berikatan kuat satu sama lain dengan ikatan hidrogen dan Van Der Waals. Hal ini mengakibatkan kation atau anion dan molekul air tidak dapat masuk ke lapisan silikat maupun aluminat sehingga efektivitas penjerapannya terbatas hanya di permukaan. Sifat penukar kation atau anion hanya berasal dari bagian ujung mineral yang mengalami pemutusan/pematahan (Muhdarina dan Linggawati 2003).
Gambar 1 Struktur kaolinit. (Thammavong 2003).
Perkembangan industri di Indonesia banyak memberikan dampak bagi kehidupan
baik dampak positif maupun dampak negatif. Dampak negatif perkembangan industri salah satunya adalah pencemaran air akibat limbah zat warna. Zat warna banyak digunakan pada industri pakaian, kertas, plastik, kulit, makanan, dan kosmetik untuk menghasilkan produk yang berwarna. Zat warna biasanya memiliki struktur molekul kompleks aromatik yang membuatnya lebih stabil sehingga sulit untuk diurai secara hayati (Christina et al. 2007). Oleh karena itu, diperlukan penanganan yang serius untuk mengatasi masalah pencemaran lingkungan yang disebabkan oleh zat warna. Zat warna dikelompokkan menjadi kationik, anionik, dan netral bergantung pada disosiasinya dalam larutan berair. Zat warna kationik antara lain biru metilena, hijau metilena, dan dinitro biru metilena. Zat warna anionik contohnya D&C
Green 8, dan congo red sedangkan zat warna
netral antara lain D&C violet 2 dan D&C
green 6 (Epling & Lin 2001).
Zat warna yang digunakan dalam penelitian ini adalah biru metilena (C16H18ClN3S), merupakan bahan pewarna
dasar yang sangat penting dan relatif murah dibandingkan dengan pewarna lainnya (Gambar 2). Biru metilena digunakan sebagai model pewarna kationik yang berwarna biru dengan bobot molekul 319,86 g/mol. Biru metilena banyak digunakan untuk pewarna kapas, kertas, dan rambut (Alzaydien 2009).
Pengukuran biru metilena secara kualitatif dapat dilihat dari intensitas warna yang dimilikinya dan secara kuantitatif umumnya dilakukan dengan spektroskopi sinar tampak pada kisaran panjang gelombang 609-668 nm.
Gambar 2 Struktur kation biru metilena. Beberapa jenis metode digunakan untuk pengolahan limbah secara konvensional diantaranya klorinasi, pengendapan, dan adsorpsi oleh karbon aktif atau adsorben lainnya termasuk kaolin. Metode pengolahan ini akan menghasilkan lumpur yang kemudian dibakar atau diproses secara mikrobiologi. Proses pembakaran lumpur akan memicu terbentuknya senyawa klorin oksida yang berbahaya, sedangkan proses mikrobiologi hanya dapat mengurai senyawa biodegradabel, sedangkan senyawa nonbiodegradabel tetap berada dalam lumpur dan akan kembali ke lingkungan (Christina et al. 2007). Oleh
karena itu, diperlukan teknik pengolahan limbah khususnya zat warna yang efisien dan mampu menanggulangi masalah tanpa menimbulkan masalah baru.
Teknik pengolahan limbah yang digunakan untuk mengatasi kekurangan dari proses adsorpsi adalah penggabungan proses adsorpsi dengan proses fotodegradasi. Metode adsorpsi-fotodegradasi didasarkan pada proses adsorpsi senyawa organik oleh permukaan padatan yang sekaligus mampu mengurai senyawa organik tersebut. Adsorpsi merupakan peristiwa terakumulasinya partikel pada suatu permukaan (Atkins 1999). Adsorpsi terjadi karena adanya gaya tarik menarik antarmolekul adsorbat dengan tapak-tapak aktif di permukaan adsorben. Fotodegradasi adalah proses peruraian suatu senyawa (biasanya senyawa organik) dengan bantuan energi foton. Proses fotodegradasi memerlukan suatu semikonduktor yang memiliki sifat fotokatalis.
Beberapa jenis semikonduktor dapat dipakai untuk proses fotokatalisis. Dari kelompok oksida antara lain TiO2, Fe2O3,
ZnO, WO3, atau SnO2, sedangkan dari
kelompok sulfida adalah CdS, ZnS, CuS, FeS, dan lain-lain. Di antara sekian banyak jenis semikonduktor, hingga saat ini serbuk TiO2
(terutama dalam bentuk kristal anatase) yang dipilih sebagai semikonduktor karena memiliki aktivitas fotokatalitik yang tinggi dan stabil (Slamet et al. 2003).
Penggabungan kedua metode dilakukan dengan cara membuat nanokomposit. Nanokomposit merupakan suatu bahan yang dibuat dari penggabungan antara dua komponen berbeda yang salah satu atau keduanya berskala nanometer (10-9) atau setara dengan ukuran atom dan molekul (Netcomposites 2006). Bahan material semikonduktor yang dikompositkan dengan kaolin adalah serbuk titanium oksida (TiO2).
Penggabungan antara adsorben dan TiO2 telah
dilakukan oleh Fatimah dan Wijaya (2005) yang menggabungkan zeolit dan TiO2 untuk
pengolahan limbah industri tapioka dan Wijaya et al. (2006) yang menggabungkan zeolit dan TiO2 untuk fotodegradasi congo
red. Kedua penelitian tersebut membuat
komposit dengan cara mereaksikan zeolit dengan larutan TiCl4 dan HCl dalam waktu
yang lama.
Pembuatan nanokomposit pada penelitian ini dilakukan dengan mencampurkan kaolin dan serbuk TiO2 dengan penambahan bahan
pengikat. Pencampuran secara fisik mudah dalam pengerjaan dan membutuhkan waktu
yang lebih singkat. Kaolin yang memiliki kemampuan menjerap zat warna digabungkan dengan TiO2 yang memiliki sifat fotokatalis
sehingga dihasilkan adsorben yang dapat menjerap sekaligus mampu mengurai bahan yang terjerap menjadi senyawa yang aman di lingkungan.
Penelitian ini bertujuan memodifikasi sifat kaolin sebagai adsorben dengan mensintesisnya menjadi nanokomposit kaolin/TiO
2 agar memiliki sifat fotokatalis
sehingga dapat digunakan untuk proses adsorpsi-fotodegradasi.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan adalah kaolin dari Bangka Belitung dan material pembanding kaolin Jepang dari Japan Clay
Science Society (JCSS), akuades, serbuk biru
metilena (Merck), bahan pengikat TB1, dan serbuk TiO2 anatase 7 nm.
Alat-alat yang digunakan antara lain neraca analitik, alat-alat kaca, oven, sentrifuga, lampu UV 9 watt, spektrofotometer UV-tampak, dan difraktometer sinar-X.
Metode Penelitian
Metode penelitian terbagi menjadi beberapa tahap ditunjukkan pada Lampiran 1.
Pencirian Kaolin dan Nanokomposit Sampel kaolin yang digunakan berasal dari Bangka Belitung (BNK) dan material pembanding, yaitu JCSS. Sampel mentah kaolin dianalisis dengan menggunakan difraktometer sinar-X (XRD). Nanokomposit BNK/TiO2 dan nanokomposit JCSS/TiO2 juga
dicirikan dengan XRD.
Pembuatan Larutan Stok Biru Metilena Larutan stok biru metilena (MB) 1000 mg/L dibuat dengan cara melarutkan 1000 mg serbuk biru metilena dalam air destilata dan diencerkan hingga 1 L. Kemudian dibuat larutan standar dari larutan biru metilena tersebut dengan konsentrasi 0,5; 1; 1,5; 2; 2,5; 3 mg/L.
Penentuan Panjang Gelombang Maksimum Panjang gelombang maksimum ditentukan dengan mengukur serapan larutan biru metilena dengan spektrofotometer UV-tampak pada rentang panjang gelombang 600–700 nm.
Penentuan Kapasitas Adsorpsi Larutan Biru Metilena oleh Kaolin, TiO2, dan
Bahan Pengikat TB1
Sebanyak 50 mg kaolin dimasukkan ke dalam vial kemudian ditambahkan larutan biru metilena 25, 50, 75, 100, 150, 200 dan 300 mg/L sebanyak 15 mL. Larutan kemudian digojok selama 2 jam. Setelah itu, larutan disentrifuga selama 10 menit dan konsentrasi dari supernatan (biru metilena Ceq) ditentukan dengan spektrofotometer UV-tampak pada panjang gelombang maksimum. Metode yang sama juga dilakukan untuk TiO2, dan bahan
pengikat.
Pembuatan Nanokomposit Kaolin/TiO2 Campuran kaolin, bahan pengikat dan TiO2 dibuatdengan komposisi 7:2:1 dan 8:1:1.
Campuran kemudian dibuat pasta dengan cara menambahkan akuades. Pasta tersebut kemudian diaduk hingga homogen, lalu dikeringkan pada suhu 1000C. Nanokomposit yang terbentuk kemudian digerus menjadi bentuk serbuk. Nanokomposit yang terbentuk kemudian diuji stabilitasnya dengan dilarutkan dalam air. Nanokomposit yang stabil kemudian dianalisis dengan XRD.
Penentuan Kapasitas Adsorpsi Larutan Biru Metilena oleh Nanokomposit
Kaolin/TiO2
Sebanyak 50 mg nanokomposit dimasukkan ke dalam vial kemudian ditambahkan larutan biru metilena 25, 50, 75, 100, 150, 200 dan 300 mg/L sebanyak 15 mL. Larutan kemudian digojok selama 2 jam. Setelah itu, larutan disentrifuga selama 10 menit dan konsentrasi dari supernatan (biru metilena Ceq) ditentukan dengan spektrofotometer UV-tampak pada panjang gelombang maksimum.
Uji Sifat Fotokatalis
Sebanyak 100 mg nanokomposit dimasukkan ke dalam cawan petri kemudian ditambahkan 15 mL larutan biru metilena 12,5
mg/L. Sampel kemudian diletakkan dalam kotak tertutup dan disinari dengan lampu UV pada panjang gelombang 254 nm selama 6 jam. Filtrat sampel dianalisis serapannya dengan spektrofotometer UV-tampak pada panjang gelombang 200 sampai 700 nm. Uji fotodegradasi nanokomposit, juga dilakukan pada kaolin, bahan pengikat, biru metilena. Sebagai kontrol juga dilakukan pengujian tanpa disinari oleh lampu UV.
HASIL
Pencirian XRD Kaolin
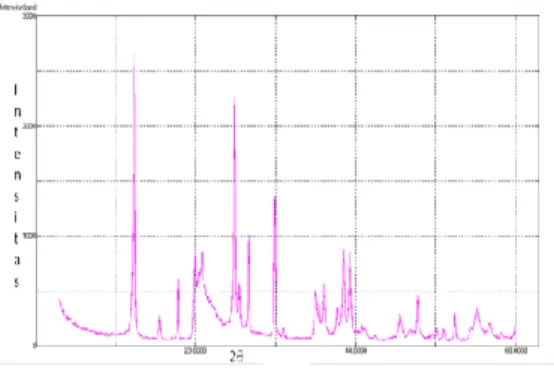
Kaolin standar yang menjadi material pembanding dalam penelitian ini adalah JCSS. Spektrum XRD kaolin Jepang menunjukkan puncak-puncak khas yang muncul pada 2θ= 12,36 dan 24,88 seperti yang ditunjukkan pada Gambar 3.
Gambar 3 Spektrum XRD JCSS.
Spektrum XRD kaolin BNK (Gambar 4) memperlihatkan puncak-puncak dengan nilai 2θ yang sama dengan kaolin Jepang, tetapi pada kaolin BNK terlihat puncak lain muncul di 2θ=8,86. Puncak ini merupakan puncak dari mineral ikutan yang terkandung pada kaolin BNK.
Gambar 4 Spektrum XRD kaolin BNK. Spektrum XRD JCSS memiliki puncak yang lebih tajam daripada kaolin BNK.
Penentuan Panjang Gelombang Maksimum Biru Metilena
Larutan biru metilena dengan konsentrasi 5 mg/L dianalisis panjang gelombang maksimumnya dengan spektrofotometer UV-tampak. Hasil pemayaran menunjukkan panjang gelombang maksimum biru metilena adalah 664 nm dengan absorban terbesar, yaitu 0,978 (Lampiran 2).
Kapasitas Adsorpsi Kaolin, TiO2 dan Bahan Pengikat TB1
Penentuan kapasitas adsorpsi larutan biru metilena dilakukan menggunakan tujuh konsentrasi larutan biru metilena yang berbeda. Semakin tinggi konsentrasi biru metilena yang digunakan maka akan semakin tinggi pula nilai kapasitas adsorpsinya. Konsentrasi larutan biru metilena pada sampel didapatkan dari absorban kemudian dimasukkan ke dalam persamaan garis dari standar larutan biru metilena (Lampiran 3).
Konsentrasi maksimum larutan biru metilena yang dijerap oleh kedua kaolin adalah 150 mg/L (Lampiran 4 dan 5). Gambar 5 menunjukkan kapasitas adsorpsi kaolin BNK sebesar 28,93 mg/g lebih tinggi daripada JCSS, yaitu 24,27 mg/g. Kapasitas adsorpsi dari bahan lain pada pembuatan nanokomposit, yaitu TiO2 adalah sebesar 3,28
mg/g (Lampiran 6), sedangkan bahan pengikat sebesar 1,32 mg/g (Lampiran 7).
Gambar 5 Kurva kapasitas adsorpsi kaolin, TiO2, dan bahan pengikat:
= kaolin BNK, = JCSS, = TiO2, = bahan pengikat.
Pemodelan Isoterm Adsorpsi Kaolin Hasil pengukuran kapasitas adsorpsi digunakan untuk menentukan tipe isoterm adsorpsi dari kaolin. Tipe isoterm adsorpsi
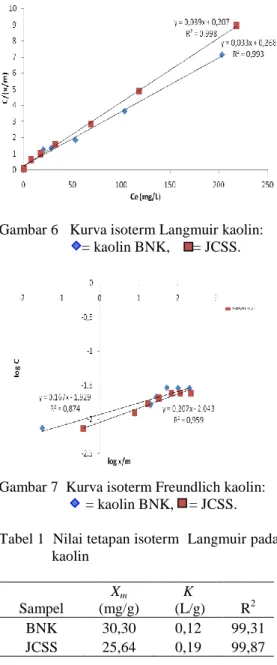
untuk kaolin BNK dan JCSS adalah isoterm Langmuir (Gambar 6). Nilai koefisien determinasi (R2) isoterm Langmuir lebih besar daripada isoterm Freundlich (Gambar 7). Perhitungan isoterm Langmuir kaolin serta nilai tetapan isoterm terdapat pada Lampiran 8 untuk kaolin BNK dan Lampiran 9 untuk JCSS. Nilai R2 serta nilai tetapan Xm dan K untuk kaolin BNK dan JCSS dapat dilihat pada Tabel 1.
Gambar 6 Kurva isoterm Langmuir kaolin: = kaolin BNK, = JCSS.
Gambar 7 Kurva isoterm Freundlich kaolin: = kaolin BNK, = JCSS. Tabel 1 Nilai tetapan isoterm Langmuir pada
kaolin Sampel Xm (mg/g) K (L/g) R2 BNK 30,30 0,12 99,31 JCSS 25,64 0,19 99,87
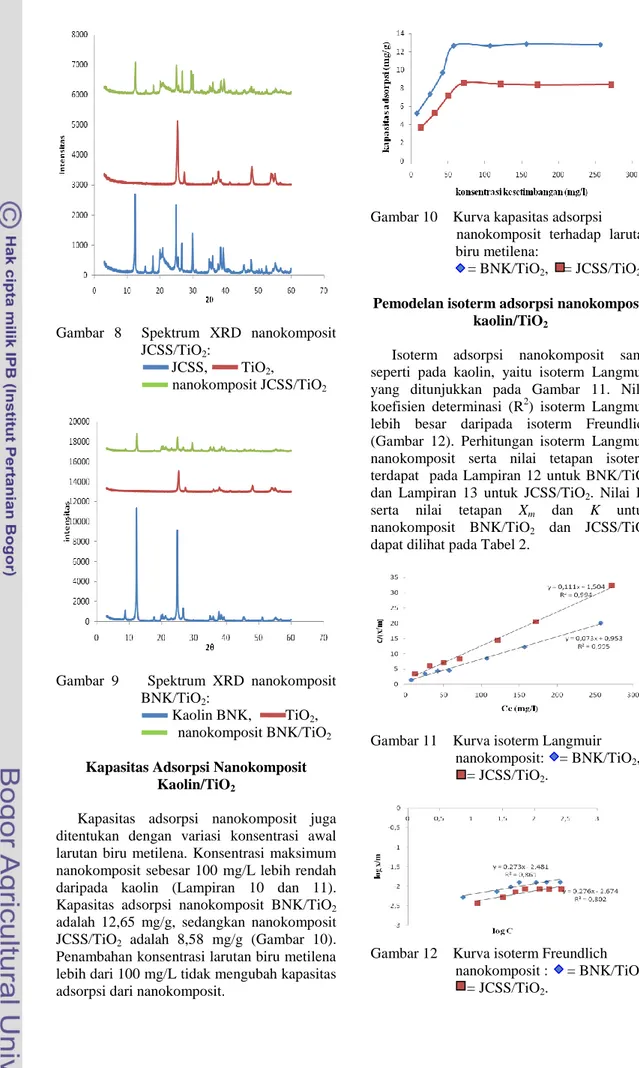
Pencirian XRD Nanokomposit Kaolin/TiO2 Nanokomposit kaolin BNK/TiO2 dan
JCSS/TiO2 juga dicirikan dengan XRD
kemudian dibandingkan dengan hasil XRD kaolin dan TiO2. Hasil pencirian
nanokomposit JCSS/TiO2 dapat dilihat pada
Gambar 8, sedangkan nanokomposit kaolin BNK/TiO2 ditunjukkan pada Gambar 9.
Gambar 8 Spektrum XRD nanokomposit JCSS/TiO2:
JCSS, TiO2,
nanokomposit JCSS/TiO2
Gambar 9 Spektrum XRD nanokomposit BNK/TiO2:
Kaolin BNK, TiO2,
nanokomposit BNK/TiO2
Kapasitas Adsorpsi Nanokomposit Kaolin/TiO2
Kapasitas adsorpsi nanokomposit juga ditentukan dengan variasi konsentrasi awal larutan biru metilena. Konsentrasi maksimum nanokomposit sebesar 100 mg/L lebih rendah daripada kaolin (Lampiran 10 dan 11). Kapasitas adsorpsi nanokomposit BNK/TiO2
adalah 12,65 mg/g, sedangkan nanokomposit JCSS/TiO2 adalah 8,58 mg/g (Gambar 10).
Penambahan konsentrasi larutan biru metilena lebih dari 100 mg/L tidak mengubah kapasitas adsorpsi dari nanokomposit.
Gambar 10 Kurva kapasitas adsorpsi
nanokomposit terhadap larutan biru metilena:
= BNK/TiO2, = JCSS/TiO2.
Pemodelan isoterm adsorpsi nanokomposit kaolin/TiO2
Isoterm adsorpsi nanokomposit sama seperti pada kaolin, yaitu isoterm Langmuir yang ditunjukkan pada Gambar 11. Nilai koefisien determinasi (R2) isoterm Langmuir lebih besar daripada isoterm Freundlich (Gambar 12). Perhitungan isoterm Langmuir nanokomposit serta nilai tetapan isoterm terdapat pada Lampiran 12 untuk BNK/TiO2
dan Lampiran 13 untuk JCSS/TiO2. Nilai R2
serta nilai tetapan Xm dan K untuk nanokomposit BNK/TiO2 dan JCSS/TiO2
dapat dilihat pada Tabel 2.
Gambar 11 Kurva isoterm Langmuir nanokomposit: = BNK/TiO2,
= JCSS/TiO2.
Gambar 12 Kurva isoterm Freundlich nanokomposit : = BNK/TiO2,
Tabel 2 Nilai tetapan isoterm Langmuir pada nanokomposit kaolin/TiO2 Sampel Xm (mg/g) K (L/g) R2 BNK/TiO2 13,70 0,08 99,56 JCSS/TiO2 9,01 0,07 99,47
Uji Sifat Fotokatalis
Filtrat dan endapan hasil uji fotodegradasi digunakan sebagai indikator terjadinya proses adsorpsi-fotodegradasi. Pengujian sifat fotokatalis nanokomposit dilakukan dengan membandingkan hasil perlakuan penyinaran UV dengan kontrol yang diletakkan dalam gelap. Pengujian dalam gelap ditunjukkan pada Gambar 13. Larutan biru metilena, bahan pengikat, dan TiO2 tetap berwarna biru,
sedangkan filtrat kaolin dan nanokomposit tak berwarna.
Gambar 13 Filtrat dalam gelap : A=biru
metilena, B= biru
metilena+bahan pengikat, C= biru metilena+TiO2, D= biru
metilena+kaolin BNK, E= biru metilena+ BNK/TiO2, F=
biru metilena+JCSS/TiO2.
Hasil pengujian sifat fotokatalis dengan penyinaran UV menunjukkan hasil yang sama namun untuk TiO2 dengan UV, filtrat menjadi
tidak berwarna (Gambar 14).
Gambar 14 Filtrat hasil penyinaran : A=biru
metilena, B= biru
metilena+bahan pengikat, C= biru metilena+TiO2, D= biru
metilena+kaolin BNK, E= biru metilena+ BNK/TiO2, F= biru
metilena+JCSS/TiO2.
Uji sifat fotokatalisis menunjukkan bahwa larutan biru metilena yang ditambahkan nanokomposit BNK/TiO2 (Gambar 15) dan
JCSS/TiO2 (Gambar 16) serta penyinaran
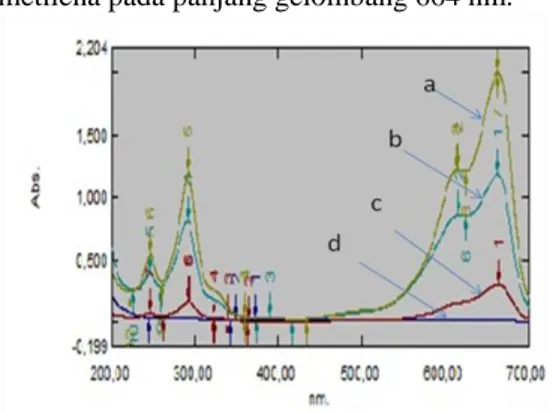
lampu UV dapat mengurai biru metilena tersebut. Hal ini terlihat dari spektrum UV yang dihasilkan datar akibat hilangnya puncak serapan biru metilena di 664 nm, berbeda dengan nanokomposit yang tanpa disinari UV yang masih menunjukkan adanya biru metilena pada panjang gelombang 664 nm.
Gambar 15 Spektrum UV-tampak filtrat uji fotodegradasi: a= larutan biru metilena; b= bahan pengikat UV; c= BNK/TiO2; d=
BNK/TiO2 UV.
Gambar 16 Spektrum UV-tampak filtrat uji fotodegradasi: a= larutan biru metilena; b= bahan pengikat UV; c= JCSS/TiO2; d=
JCSS/TiO2 UV.
Endapan (Gambar 17) juga merupakan salah satu indikator terjadinya fotodegradasi. Hasil pengujian dengan UV menunjukkan bahwa endapan TiO2 berwarna putih, endapan
bahan pengikat, kaolin dan nanokomposit tetap berwarna biru. Edapan nanokomposit tetap berwarna biru, namun lebih pudar bila dibandingkan dengan endapan nanokomposit tanpa UV.
Gambar 17 Endapan hasil fotodegradasi.
PEMBAHASAN
Pencirian XRD Kaolin
Pencirian kaolin dilakukan dengan menggunakan difraktometer sinar-X. Spektrum sinar-X kaolin BNK kemudian dibandingkan dengan kaolin standar JCSS.
Kaolinit memiliki puncak difraksi sinar-X yang khas pada 2θ= 12,36 dan 24,88 seperti pada Gambar 3 dan 4. Puncak-puncak yang muncul pada spektrum XRD JCSS lebih tajam daripada kaolin BNK. Hal ini mengindikasikan bahwa kristalinitas kaolinit JCSS lebih tinggi daripada kaolin BNK. Pada spektrum kaolin BNK terlihat puncak yang muncul pada 2θ= 8,86 tetapi tidak ada pada kaolin Jepang. Mineral lain yang lazim ada dalam kaolin adalah kuarsa, besi, mika, feldspar, bauksit, smektit, anatase, rutil, grafit, dan montmorilonit (Murray 2006). Mineral lain yang terkandung dalam kaolin akan berbeda-beda bergantung pada daerah tempat pengambilan.
Kapasitas Adsorpsi Kaolin, TiO2 dan Bahan Pengikat TB1
Kaolin memiliki kemampuan menjerap senyawa organik seperti zeolit dan monmorilonit, namun dalam jumlah yang lebih kecil. Gambar 5 menunjukkan kapasitas adsorpsi kaolin dalam menjerap biru metilena pada berbagai konsentrasi. Kaolin BNK memiliki nilai kapasitas adsorpsi sebesar 28,93 mg/g lebih besar dari JCSS yang memiliki nilai kapasitas adsorpsi sebesar 24,27 mg/g. Kaolin BNK juga memiliki kapasitas adsorpsi yang lebih besar dari kaolin Assam (India), yaitu 20,49 mg/g (Gosh & Battrachayya 2002). Kaolin BNK memiliki nilai kapasitas adsorpsi yang lebih besar
daripada JCSS dan kaolin India dikarenakan terdapat material lain yang terkandung dalam kaolin BNK yang juga memiliki kemampuan dalam menjerap biru metilena. Material lain yang biasa terkandung dalam kaolin misalnya montmorilonit, feldspar, dan kuarsa.
Prinsip kaolinit dalam menjerap molekul biru metilena adalah pertukaran kation atau anion. Kaolinit merupakan aluminosilikat berbentuk lembaran dengan tipe 1:1 sehingga rongga antar lembarannya kecil yang menyebabkan sifat pertukaran kation atau anion hanya terjadi di permukaan dari stukturnya. Aluminosilikat pada kaolin mempunyai sifat kelebihan elektron, sehingga akan diimbangi oleh kehadiran kation-kation H+. Larutan biru metilena di dalam air akan mengion menjadi kation, sehingga kation ini yang akan menggantikan ion H+ dari struktur kaolin sehingga biru metilena akan terjerap.
Penentuan kapasitas adsorpsi juga dilakukan untuk serbuk TiO2 dan bahan
pengikat TB1 yang akan digunakan dalam pembuatan nanokomposit. Hal ini dilakukan untuk melihat pengaruh penambahan bahan pengikat dan TiO2 dalam proses adsorpsi
nanokomposit. Kapasitas adsorpsi maksimum TiO2 adalah 3,28 mg/g. Kapasitas adsorpsi
bahan pengikat TB1 lebih rendah daripada TiO2, yaitu sebesar 1,32 mg/g.
Pemodelan Isoterm Adsorpsi Kaolin Penjerapan biru metilena pada permukaan kaolin mengikuti tipe isoterm Langmuir. Hal ini terlihat pada Gambar 6, yaitu kurva isoterm Langmuir memiliki nilai koefisien determinasi (R2) yang lebih besar daripada isoterm Freundlich (Gambar 7). Nilai koefisien determinasi digunakan untuk menentukan tipe dari isoterm adsorpsi.
Tipe isoterm Langmuir menandakan bahwa ikatan yang terjadi antara biru metilena dengan permukaan kaolin merupakan ikatan kimia. Hal ini menunjukkan bahwa adsorben kaolin memiliki permukaan yang homogen dan hanya dapat mengadsorpsi satu molekul adsorbat untuk setiap molekul adsorbennya. Bentuk logaritma dari persamaan Langmuir:
c Xm XmK m x c 1 1 /
Nilai tetapan Xm dan K dari kaolin BNK dan JCSS dapat dilihat pada Tabel 1 .
Nilai Xm menggambarkan jumlah yang dijerap atau kapasitas adsorpsi maksimum untuk membentuk satu lapisan yang sempurna pada permukaan adsorben. Nilai Xm kaolin
BNK lebih besar daripada JCSS. Hal ini menunjukkan jumlah biru metilena yang dijerap oleh kaolin BNK lebih banyak daripada JCSS. Nilai K merupakan tetapan yang bertambah dengan kenaikan ukuran molekuler yang menunjukkan kekuatan ikatan molekul adsorbat pada permukaan adsorben. Molekul biru metilena lebih kuat terikat pada JCSS daripada kaolin BNK. Hal ini terlihat dari nilai K untuk JCSS yang lebih besar. JCSS merupakan kaolin standar yang kemurniannya lebih tinggi daripada kaolin BNK sehingga pengikatan biru metilena pada JCSS menjadi lebih kuat. Berbeda halnya dengan kaolin BNK yang masih mengandung mineral ikutan. Mineral ikutan ini dapat memperbesar kapasitas adsorpsi kaolin BNK, namun pengikatannya dengan biru metilena lebih lemah daripada kaolin.
Pembuatan Nanokomposit Kaolin/TiO2 Nanokomposit kaolin/TiO2 dibuat dengan
mencampurkan serbuk kaolin, bahan pengikat, dan TiO2 dengan perbandingan 7:2:1 da 8:1:1.
Pencampuran secara fisik biasa tidak akan membuat TiO2 menempel pada kaolin jika
nanokomposit tersebut terlarut dalam air. Oleh karena itu untuk membuat keduanya menempel dibutuhkan senyawa lain yang bertindak sebagai pengikat. Penambahan bahan pengikat dan TiO2 diusahakan dalam
jumlah yang kecil. Hal ini dikarenakan bahan pengikat TB1 tidak memiliki kemampuan sebagai penjerap yang baik, sehingga penambahan bahan pengikat diusahakan sedikit agar tidak banyak mengganggu proses adsorpsi nanokomposit. Penambahan bahan pengikat kurang dari 20% bobot nanokomposit, yaitu 10% tidak dapat membuat TiO2 menempel pada kaolin
(Lampiran 14). Hal ini diuji dengan cara melarutkan nanokomposit tersebut dalam air destilata. Nanokomposit dengan penambahan bahan pengikat kurang dari 20% akan hancur saat dilarutkan dalam air dan serbuk TiO2
akan lepas sehingga membuat air menjadi keruh.
Pencirian XRD Nanokomposit Kaolin/TiO2
Hasil spektrum XRD nanokomposit JCSS/TiO2 (Gambar 8) dan BNK/TiO2
(Gambar 9) menunjukkan puncak-puncak khas yang sama dengan kaolin namun dengan intensitas yang lebih rendah. Hal ini dikarenakan pada pembuatan nanokomposit,
sebanyak 20% komposisi kaolin digantikan oleh bahan pengikat dan 10% digantikan oleh TiO2. Pada nanokomposit terdapat puncak
pada 2θ= 25,08. Puncak ini merupakan puncak dari TiO2 yang akan muncul pada 2θ=
25,28. Hasil ini menunjukkan bahwa TiO2
menempel pada nanokomposit.
Kapasitas Adsorpsi Nanokomposit kaolin/TiO2
Kapasitas adsorpsi nanokomposit diukur untuk melihat perubahan kapasitas adsorpsi nanokomposit bila dibandingkan dengan kaolin. Nanokomposit memiliki konsentrasi optimum dan nilai kapasitas adsorpsi yang lebih rendah daripada kaolin. Kapasitas adsorpsi untuk nanokomposit BNK/TiO2
adalah 12,65 mg/g dan nanokomposit JCSS/TiO2 adalah 8,58 mg/g. Penurunan
kapasitas adsorpsi dan konsentrasi optimum nanokomposit ini dikarenakan faktor penambahan bahan yang memiliki kemampuan menjerap yang kecil, yaitu bahan pengikat TB1 sebesar 20%. Pengurangan jumlah kaolin dan penambahan bahan pengikat serta TiO2 mengakibatkan sisi aktif
dari tiap gram kaolin pada nanokomposit akan berkurang sehingga kapasitas adsorpsinya akan lebih kecil dari pada kaolin.
Pemodelan Isoterm Nanokomposit Kaolin/TiO2
Tipe isoterm adsorpsi nanokomposit BNK/TiO2 dan JCSS/TiO2 adalah isoterm
Langmuir sama seperti pada kaolin. Kurva isoterm Langmuir dari nanokomposit dapat dilihat pada Gambar 11, sedangkan isoterm Freundlich pada Gambar 12. Pembuatan nanokomposit tidak mengubah tipe penjerapan yang terjadi di dalamnya, yaitu penjerapan secara kimia bila dilakukan tanpa penyinaran dengan sinar ultraviolet. Nilai tetapan Xm dan K dari isoterm Langmuir nanokomposit terlihat pada Tabel 2. Seluruh nilai tetapan isoterm Langmuir nanokomposit lebih kecil daripada kaolin. Hal ini menunjukkan kapasitas adsorpsi maksimum nanokomposit lebih rendah daripada kaolin. Hal ini disebabkan sisi aktif untuk pengikatan dengan biru metilena telah ditempati oleh bahan pengikat dan TiO2 sehingga jumlah biru
metilena yang terjerap berkurang. Kekuatan ikatan antara nanokomposit dengan biru metilena juga lebih rendah bila dibandingkan dengan kekuatan ikatan biru metilena dengan kaolin.
Uji Sifat Fotokatalis
Pengujian fotodegradasi nanokomposit kaolin/TiO2 dilakukan untuk melihat
kemampuan nanokomposit dalam menjerap sekaligus mendegradasi zat dengan bantuan radiasi sinar ultraviolet. Nanokomposit ini merupakan campuran antara kaolin yang memiliki kemampuan menjerap zat warna dan TiO2 yang memiliki kemampuan untuk
mengurai zat warna. Gabungan keduanya diharapkan dapat bekerja secara sinergis dalam mengatasi zat warna dengan cara menjerap sekaligus mengurai zat warna tersebut sehingga dapat digunakan untuk mengatasi limbah zat warna biru metilena. Zat warna biru metilena digunakan sebagai model dari zat warna kationik yang mudah diamati dari perubahan warna yang terjadi.
Pada penelitian ini dilakukan uji sifat fotokatalisis dari nanokomposit kaolin/TiO2
tanpa penyinaran UV (di tempat gelap) dan dengan penyinaran UV pada panjang gelombang 254 nm. Konsentrasi larutan biru metilena yang digunakan sebesar 12,5 mg/L dengan lama penyinaran 6 jam.
Filtrat hasil uji fotodegradasi tanpa sinar UV oleh nanokomposit BNK/TiO2 dan
JCSS/TiO2 menghasilkan filtrat yang tak
berwarna (Gambar 13). Larutan biru metilena yang tidak disinari UV masih berwarna biru, dan yang ditambahkan bahan pengikat juga masih berwarna biru. Hasil uji sifat fotokatalisis (Gambar 14) menunjukkan bahwa nanokomposit BNK/TiO2 dan
JCSS/TiO2 menghasilkan filtrat tak berwarna.
Filtrat hasil pengujian kemudian dianalisis dengan spektrofotometer UV-tampak untuk melihat serapan larutan biru metilena. Hilangnya puncak khas biru metilena pada panjang gelombang 664 nm menunjukkan bahwa di dalam filtrat tidak lagi tersisa biru metilen. Filtrat yang diperoleh telah berubah menjadi senyawa lain yang bila degradasinya sempurna akan menghasilkan karbondioksida dan air.
Pada filtrat nanokomposit kaolin/TiO2 baik
BNK maupun JCSS menghasilkan kurva yang datar atau tidak terlihat lagi puncak serapan pada panjang gelombang 664 nm. Hal ini menunjukkan bahwa di dalam filtrat sudah tidak tersisa lagi biru metilena. Filtrat nanokomposit kaolin/TiO2 dalam gelap masih
menghasilkan puncak pada 664 nm walaupun larutannya tak berwarna (Gambar 15 dan 16). Hal ini menandakan bahwa biru metilena masih terdapat dalam filtrat walaupun dengan konsentrasi yang lebih kecil. Penurunan
konsentrasi ini disebabkan oleh proses adsorpsi pada nanokomposit dalam gelap, sedangkan pada nanokomposit dengan penyinaran UV terjadi proses adsorpsi-fotodegradasi biru metilena sehingga biru metilena hilang.
Proses fotodegradasi juga dapat terlihat dari endapan nanokomposit hasil penyinaran. Endapan yang berwarna biru menunjukkan bahwa pada sistem hanya terjadi proses adsorpsi, sedangkan bila endapan berwarna seperti awal atau putih, maka pada sistem terjadi proses adsorpsi-fotodegradasi. Hasil uji fotodegradasi biru metilena menunjukkan bahwa serbuk TiO2 yang disinari UV
menghasilkan endapan yang berwarna putih. Hal ini dikarenakan TiO2 mampu mengurai
senyawa biru metilena sehingga tidak ada lagi warna biru baik pada filtrat maupun endapan.
Nanokomposit dengan UV ternyata tidak menghasilkan endapan berwarna putih, namun masih berwarna biru. Bila warna endapannya dibandingkan dengan nanokomposit dalam gelap, terlihat warna birunya lebih pudar (Gambar 17). Hasil penelitian menunjukkan bahwa nanokomposit kaolin/TiO2 yang dibuat
dengan pencampuran secara fisik dengan penambahan bahan pengikat memiliki sifat fotokatalis sehingga dapat mempercepat penghilangan biru metilena.
Mekanisme adsorpsi-fotodegradasi yang terjadi pada nanokomposit adalah penjerapan zat warna biru metilena oleh kaolin, kemudian dengan adanya TiO2 dan sinar ultraviolet
menyebabkan terjadinya proses fotodegradasi. Prinsip fotodegradasi adalah adanya loncatan elektron dari pita valensi ke pita konduksi pada logam semikonduktor jika dikenai suatu energi foton. Loncatan elektron ini menyebabkan timbulnya hole (lubang elektron) yang dapat berinteraksi dengan pelarut (air) membentuk radikal OH (HO*) yang merupakan oksidator kuat. Elektron pada pita konduksi akan bereaksi dengan oksigen di lingkungan menghasilkan radikal superoksida (O2 - * ) yang bersifat sebagai reduktor.
Radikal bersifat aktif dan dapat terus terbentuk sehingga bereaksi dan menguraikan senyawa organik target (Fatimah & Wijaya 2005).
Mekanisme reaksi yang terjadi pada proses fotodegradasi dengan TiO2 adalah sebagai
berikut :
TiO2 + UV TiO2 (e- + h+) TiO2 (h+) + H2O TiO2 + HO* + H+ TiO2 (e
-) + O2 TiO2 + O2
Proses pembentukan radikal akan terus menerus terjadi selama nanokomposit kaolin/TiO2 masih dikenai radiasi sinar UV
dan akan menyerang biru metilena sehingga terjadi penguraian. Semakin bertambahnya radiasi sinar UV maka foton yang mengenai nanokomposit tersebut akan semakin banyak sehingga biru metilena yang terurai akan semakin banyak pula (Wijaya et al. 2006).
SIMPULAN
Kapasitas adsorpsi kaolin Bangka Belitung adalah 28,93 mg/g lebih besar daripada JCSS, yaitu 24,27 mg/g. Pembuatan nanokomposit kaolin/TiO2 dapat menurunkan kapasitas
adsorpsi menjadi 12,65 mg/g untuk BNK/TiO2 dan 8,580 mg/g untuk JCSS/TiO2.
Tipe isoterm adsorpsi kaolin dan nanokomposit adalah isoterm Langmuir yang menunjukkan terjadinya kimisorpsi dalam proses penjerapannya. Pembuatan nanokomposit kaolin/TiO2 dapat dilakukan
dengan penambahan bahan pengikat TB1 sebesar 20 % dari bobot nanokomposit. Nanokomposit kaolin/TiO2 memiliki sifat
fotokatalisis sehingga dapat mendegradasi larutan biru metilena 12,5 mg/L selama 6 jam dengan radiasi sinar UV dengan catatan kekuatan sumber lampu radiasi sangat berpengaruh pada kecepatan proses degradasi.
SARAN
Penelitian lanjutan yang perlu dilakukan adalah analisis kandungan mineral pada kaolin dan senyawa hasil degradasi. Penelitian selanjutnya dapat dilakukan dengan menggunakan pewarna anionik dan menggunakan pereaksi kimia dalam pembuatan nanokompositnya.
DAFTAR PUSTAKA
[LPSE BABEL] Layanan Pengadaan Elektronik Bangka Belitung. 2010. Sektor Pertambangan. [terhubung berkala]. http://babelprov.go.id/sektorpertambangan .html [20 Des 2010].
Alzaydien AS. 2009. Adsorption of methylene blue from aqueous solution onto a low cost natural Jordanian tripoli. Am Environ Sci 5: 197-208.
Atkins PW. 1999. Kimia Fisik Jilid 1. Kartohadiprojo I, penerjemah; Rohhadyan
T, Hadiyana K, editor. Jakarta: Erlangga. Terjemahan dari: Physical Chemistry. Christina, Mu’nisatun, Saptaaji R, Marjanto
D. 2007. Studi pendahuluan mengenai degradasi zat warna azo (metil orange) dalam pelarut air menggunakan mesin berkas elektron 359 KeV/10 mA. JFN 1: 31-44.
Epling, Lin. 2001. Photoassisted bleaching of dyes utilizing TiO2 and visible light.
Chemosphere 46: 561-570.
Fatimah Is, Wijaya K. 2005. Sintesis TiO
2/zeolit sebagai fotokatalis pada
pengolahan limbah cair industri tapioka secara adsorpsi-fotodegradasi. Teknoin. 10: 257-267.
Gosh D, Bhattacharyya K. 2002. Adsorption of methylene blue on kaolinite. Apply Clay
Sci. 20: 295-300.
Muhdarina, Linggawati A. 2003. Pilarisasi kaolinit alam untuk meningkatkan kapasitas tukar kation. J Natur Indones 6: 20-23.
Murray. 2006. Clays. Indiana: Wiley Interscience.
Netcomposite. 2006. [terhubung berkala]. http://www.netcomposite.com/image/mont morillonite.html [13Desember 2009]. Slamet, Syakur R, Danumulyo W. 2003.
Pengolahan limbah logam berat chromium
(vi) dengan fotokatalis TiO2. Makara
Teknol 7: 1.
Thammavong S. 2003. Studies of synthesis, kinetics and particle size of zeolite x from narathiwat kaolin [tesis]. Thailand: Master Degree, Suranaree University of Technology.
Wijaya, Sugiharto, Fatimah, Sudiono, Kurniyasih. 2006. Utilisasi TiO2-zeolit dan
sinar UV untuk fotodegradasi zat warna
congo red. Berkala MIPA. 16(3).
Zheng, Sun, Zhang, Gao, Xu. 2005. Effect of properties of calcined microspheres of kaolin on the formation of NaY zeolite.
Lampiran 1 Diagram alir penelitian
Kaolin
Bangka
Belitung dan
JCSS
Pencirian
dengan XRD
Pembuatan nanokomposit
kaolin/TiO
2Uji sifat fotokatalisis
Penentuan kapasitas adsorpsi
kaolin, TiO
2, bahan pengikat, dan
nanokomposit dengan variasi
konsentrasi awal biru metilena
Lampiran 2 Panjang gelombang maksimum biru metilena
panjang
gelombang (nm)
absorbans
655
0,906
656
0,918
657
0,93
658
0,941
659
0,951
660
0,96
661
0,967
662
0,973
663
0,976
664
0,978
665
0,976
666
0,972
667
0,964
668
0,953
669
0,938
670
0,918
Lampiran 3 Konsentrasi dan absorbans larutan biru metilena pada kurva standar
Larutan Absorbans Konsentrasi Biru Metilena (mg/L) std 1 0,083 0,50 std 2 0,183 1,00 std 3 0,287 1,50 std 4 0,373 2,00 std 5 0,461 2,50 std 6 0,548 3,00
Lampiran 4 Penentuan kapasitas adsorpsi biru metilena oleh kaolin Bangka
Belitung
C
o(mg/L)
Massa
(gram) Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0506
0,004
0,0308
24,9692
7,4019
7,42
25
0,0504
0,005
0,0359
24,9641
7,4298
50
0,0511
0,159
7,8588
42,1412
12,3702
12,27
50
0,0519
0,160
7,9076
42,0924
12,1654
75
0,0506
0,101
20,2993
54,7007
16,2156
16,31
75
0,0502
0,100
20,1023
54,8977
16,4037
100
0,0502
0,138
28,2930
71,7070
21,4264
21,37
100
0,0502
0,140
28,6972
71,3028
21,3056
150
0,0503
0,247
52,6745
97,3255
29,0235
28,93
150
0,0502
0,251
53,5207
96,4793
28,8285
200
0,0507
0,21
101,8587
98,1413
29,0359
28,47
200
0,0507
0,218
105,7025
94,2975
27,8987
300
0,0514
0,206
203,9216
96,0784
28,0385
28,52
300
0,0502
0,205
202,9412
97,0588
29,0016
Contoh perhitungan:
g mg ml l ml ml l m Ce Co V Q / 4019 , 7 1000 1 0506 , 0 ) 0308 , 0 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 5 Penentuan kapasitas adsorpsi biru metilena oleh JCSS
C
o(mg/L)
Massa
(gram)
Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0504
0,076
0,4004
24,5996
7,3213
7,31
25
0,0506
0,069
0,3645
24,6355
7,3030
50
0,0509
0,314
7,7124
42,2876
12,4620
12,50
50
0,0504
0,321
7,8832
42,1168
12,5347
75
0,0508
0,086
17,3431
57,6569
17,0247
17,12
75
0,0506
0,084
16,9489
58,0510
17,2088
100
0,0504
0,152
31,1223
68,8777
20,4993
20,13
100
0,0503
0,165
33,7496
66,2505
19,7566
150
0,0500
0,328
69,8096
80,1904
24,0571
24,27
150
0,0503
0,319
67,9057
82,0943
24,4814
200
0,0504
0,241
116,7532
83,2468
24,7758
24,23
200
0,0506
0,248
120,1164
79,8836
23,6809
300
0,0506
0,219
216,6667
83,3333
24,7036
24,36
300
0,0502
0,222
219,6079
80,3922
24,0216
Contoh perhitungan:
g mg ml l ml ml l m Ce Co V Q / 3213 , 7 1000 1 0504 , 0 ) 4004 , 0 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 6 Penentuan kapasitas adsorpsi biru metilena oleh TiO
2C
o(mg/L)
Massa
(gram)
Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0500
0,183
18,3382
8,9376
2,6813
2,61
25
0,0501
0,186
18,6793
8,4799
2,5389
50
0,0500
0,108
40,3945
10,9409
3,2823
3,28
50
0,0502
0,108
40,3473
10,9946
3,2852
75
0,0505
0,175
69,9202
5,4813
1,6281
1,91
75
0,0502
0,171
68,1911
7,3470
2,1953
100
0,0504
0,232
97,8184
2,3776
0,7076
0,82
100
0,0501
0,231
97,1612
3,0938
0,9263
150
0,0505
0,190
147,7654
2,3134
0,6871
0,53
150
0,0500
0,191
148,7754
1,2678
0,3803
200
0,0501
0,236
197,1723
3,0381
0,9096
0,84
200
0,0504
0,237
197,5750
2,6055
0,7755
300
0,0502
0,181
297,4592
2,7883
0,8332
0,76
300
0,0500
0,182
297,8933
2,3119
0,6936
Contoh perhitungan : g mg ml l ml ml l m Ce Co V Q / 6813 , 2 1000 1 0500 , 0 ) 3382 , 18 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 7 Penentuan kapasitas adsorpsi biru metilena oleh bahan pengikat TB1
C
o(mg/L)
Massa
(gram)
Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0500
0,078
21,9828
3,0172
0,9052
0,77
25
0,0505
0,080
22,8448
2,1551
0,6402
50
0,0508
0,151
45,9259
4,0741
1,2029
1,32
50
0,0502
0,149
45,1852
4,8148
1,4387
75
0,0510
0,233
70,8716
4,1284
1,2142
1,17
75
0,0507
0,234
71,2156
3,7844
1,1196
100
0,0508
0,340
97,8125
2,1875
0,6459
0,74
100
0,0502
0,338
97,1875
2,8125
0,8404
150
0,0514
0,254
146,1373
3,8627
1,1272
0,85
150
0,0513
0,257
148,0687
1,9313
0,5647
200
0,0508
0,318
197,2881
2,7119
0,8007
0,80
200
0,0503
0,314
194,5763
5,4237
1,6174
300
0,0514
0,243
295,8904
4,1096
1,1992
1,00
300
0,0510
0,244
297,2603
2,7397
0,8058
Contoh perhitungan : g mg ml l ml ml l m Ce Co V Q / 9052 , 0 1000 1 0500 , 0 ) 9828 , 21 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 8 Penentuan pola isoterm adsorpsi kaolin Bangka Belitung
isoterm Langmuir isoterm Freundlich Co (mg/L) Ce (mg/L) Ct (mg/L) m (g) x (g) x/m (mg/g) C/(x/m) (l/g) log c log x/m 25 0,0334 24,9666 0,0505 0,0004 7,4158 0,0045 -1,476 0,8702 50 7,8832 42,1168 0,0515 0,0006 12,2685 0,6421 0,8964 1,0888 75 20,2008 54,7992 0,0504 0,0008 16,3005 1,2411 1,3060 1,2122 100 28,4951 71,5049 0,0502 0,0011 21,3345 1,3406 1,4564 1,3291 150 53,0976 96,9024 0,0502 0,0015 28,9309 1,8381 1,7257 1,4614 200 103,7806 96,2194 0,0507 0,0014 28,5216 3,6322 2,0153 1,4552 300 203,4313 96,5686 0,0508 0,0014 28,5144 7,1344 2,3084 1,4551 Nilai x = Cteradsorpsi (ppm) x Volume larutan (L) xmg 1000
g 1
Persamaan garis isoterm Langmuir yang diperoleh y = 0,033x + 0,268 dengan r2 = 99,31%
maka dari persamaan c
Xm XmK m x c 1 1 /
, diperoleh nilai Xm = 30,30 dan K = 0,12
Persamaan garis isoterm Freundlich yang diperoleh y = 0,167x + 0,107 dengan r2 = 87,42% maka dari persamaan log
m x
= log k +
n
1
log C, diperoleh nilai n = 5,99 dan k = 11,75
Lampiran 9 Penentuan pola isoterm adsorpsi JCSS
isoterm Langmuir isoterm Freundlich Co (mg/L) Ce (mg/L) Ct (mg/L) m (g) x (g) x/m (mg/g) C/(x/m) (l/g) log c log x/m 25 0,3824 24,6176 0,0505 0,0004 7,3121 0,0523 -0,4174 0,8640 50 7,7978 42,2022 0,0507 0,0006 12,5111 0,6229 0,8917 1,0973 75 17,1460 57,8540 0,0507 0,0009 17,1166 1,0032 1,2348 1,2334 100 32,4359 67,5641 0,0504 0,0010 20,4993 1,5881 1,5126 1,3117 150 68,8577 81,1423 0,0502 0,0012 24,2457 2,8443 1,8386 1,3846 200 118,4348 81,5652 0,0505 0,0012 24,2273 4,8798 2,0727 1,3843 300 218,1373 81,8627 0,0504 0,0012 24,3639 8,9533 2,3387 1,3867
Persamaan garis isoterm Langmuir yang diperoleh y = 0,039x + 0,207 dengan r2 = 99,87%
maka dari persamaan c
Xm XmK m x
c 1 1
/ , diperoleh nilai Xm = 25,64 dan K = 0,19
Persamaan garis isoterm Freundlich yang diperoleh y = 0,207x + 0,956 dengan r2 = 95,90% maka dari persamaan log
m x
= log k +
n
1
Lampiran 10 Penentuan kapasitas adsorpsi biru metilena oleh nanokomposit
BNK/TiO
2C
o(mg/L)
Massa
(gram)
Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0504
0,242
7,2849
17,7151
5,2723
5,24
25
0,0503
0,251
7,5269
17,4731
5,2107
50
0,0504
0,078
25,0000
25,0000
7,4405
7,36
50
0,0501
0,081
25,7009
24,2991
7,2752
75
0,0505
0,128
41,9039
33,0961
9,8305
9,71
75
0,0505
0,131
42,7046
32,2954
9,5927
100
0,0505
0,199
57,8680
42,1320
12,5145
12,65
100
0,0503
0,196
57,1066
42,8934
12,7913
150
0,0512
0,372
105,8979
44,1021
12,9205
12,65
150
0,0509
0,38
108,0106
41,9894
12,3741
200
0,0511
0,237
155,5556
44,4444
13,0463
12,84
200
0,0507
0,24
157,3099
42,6901
12,6302
300
0,051
0,226
255,8528
44,1472
12,9845
12,71
300
0,0508
0,228
257,8595
42,1405
12,4431
Contoh perhitungan : g mg ml l ml ml l m Ce Co V Q / 2723 , 5 1000 1 0504 , 0 ) 2849 , 7 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 11 Data penentuan kapasitas adsorpsi biru metilena oleh nanokomposit
JCSS/TiO
2C
o(mg/L)
Massa
(gram)
Absorbans
C
e(mg/L)
C
t(mg/L)
Q
(mg/g)
Q
rata-rata
(mg/g)
25
0,0511
0,441
12,6344
12,3656
3,6298
3,68
25
0,0509
0,430
12,3387
12,6613
3,7312
50
0,0513
0,116
33,8785
16,1215
4,7139
5,28
50
0,0510
0,100
30,1402
19,8598
5,8411
75
0,0512
0,163
51,2456
23,7544
6,9593
7,18
75
0,0509
0,158
49,9110
25,0890
7,3936
100
0,0503
0,258
72,8426
27,1574
8,0986
8,58
100
0,0500
0,246
69,7970
30,2030
9,0609
150
0,0512
0,431
121,4789
28,5211
8,3558
8,46
150
0,0509
0,429
120,9507
29,0493
8,5607
200
0,0510
0,262
170,1754
29,8246
8,7719
8,37
200
0,0507
0,267
173,0994
26,9006
7,9588
300
0,0501
0,246
275,9197
24,0803
7,2097
8,40
300
0,0502
0,238
267,8930
32,1070
9,5937
Contoh perhitungan : g mg ml l ml ml l m Ce Co V Q / 6298 , 3 1000 1 0511 , 0 ) 3656 , 12 25 ( 15 1000 1 ) (
Keterangan :
C
o: Konsentrasi awal larutan biru metilena (mg/L)
C
e: Konsentrasi akhir larutan biru metilena (mg/L)
C
t: Konsentrasi terjerap larutan biru metilena (mg/L)
Lampiran 12 Penentuan pola isoterm adsorpsi nanokomposit BNK/TiO
2 isoterm Langmuir isoterm Freundlich Co (mg/L) Ce (mg/L) Ct (mg/L) m (g) x (g) x/m (mg/g) C/(x/m) (l/g) log c log x/m 25 7,4059 17,5941 0,0504 0,0003 5,24151,4129
0,8696 0,7195 50 25,3505 24,6495 0,0503 0,0004 7,35813,4453
1,4040 0,8668 75 42,3043 32,6957 0,0505 0,0005 9,71164,3561
1,6264 0,9873 100 57,4873 42,5127 0,0504 0,0006 12,65264,5435
1,7596 1,1022 150 106,9542 43,0458 0,0511 0,0006 12,64818,4561
2,0292 1,1020 200 156,4327 43,5673 0,0510 0,0007 12,813912,2080
2,1943 1,1077 300 256,8562 43,1438 0,0505 0,0006 12,815020,0434
2,4097 1,1077 Nilai x = Cteradsorpsi (ppm) x Volume larutan (L) xmg 1000
g 1
Persamaan garis isoterm Langmuir yang diperoleh y = 0,073x + 0,953 dengan r2 = 99,56%
maka dari persamaan c
Xm XmK m x
c 1 1
/ , diperoleh nilai Xm= 13,70 dan K= 0,08
Persamaan garis isoterm Freundlich yang diperoleh y = 0,273x + 0,518 dengan r2 = 86,12% maka dari persamaan log
m x
= log k +
n
1
log C, diperoleh nilai n = 3,66 dan k = 3,30
Lampiran 13 Penentuan pola isoterm adsorpsi nanokomposit JCSS/TiO
2isoterm Langmuir isoterm Freundlich Co (mg/L) Ce (mg/L) Ct (mg/L) m (g) x (g) x/m (mg/g) C/(x/m) (l/g) log c log x/m
25
12,4866
12,5134 0,0510
0,0002 3,6804
3,3927
1,0964 0,5659
50
32,0094
17,9907 0,0512
0,0003 5,2759
6,0672
1,5053 0,7223
75
50,5783
24,4217 0,0511
0,0004 7,1758
7,0484
1,7040 0,8559
100
71,3198
28,6802 0,0502
0,0004 8,5783
8,3140
1,8532 0,9334
150
121,4789 28,7852 0,0511
0,0004 8,4579 14,3627 2,0845 0,9273
200
171,6347 28,3626 0,0509
0,0004 8,3665 20,5144 2,2346 0,9225
300
271,9064 28,0936 0,0502
0,0004 8,3945 32,3910 2,4344 0,9240
Persamaan garis isoterm Langmuir yang diperoleh y = 0,111x + 1,504 dengan r2 = 99,47%
maka dari persamaan c
Xm XmK m x
c 1 1
/ , diperoleh nilai Xm = 9,00 dan K = 0,07
Persamaan garis isoterm Freundlich yang diperoleh y = 0,276x + 0,325 dengan r2 = 80,23% maka dari persamaan log
m x
= log k +
n
1