ISOLASI DAN KARAKTERISASI FRAGMEN cDNA
DARI GEN PENYANDI SITRAT SINTASE
PADA Melastoma malabathricum
ULFAH MUSHOFA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Sitrat Sintase pada Melastoma malabathricum adalah karya bersama saya dengan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2011 Ulfah Mushofa
ABSTRACT
ULFAH MUSHOFA. Isolation and Characterization cDNA Fragment of Gene Encoding Citrate Synthase in Melastoma malabathricum . Supervised by SUHARSONO and UTUT WIDYASTUTI SUHARSONO.
Melastoma malabathricum is one of tropical plant origin from South East Asia, and grows well in the acid soil with high Aluminum (Al) solubility. Plant chelating Al ion forms complex to deal with high Al solubility. Organic acid could chelate soluble Al. In plant these organic acids usually are found as: citric acid, oxalic acid, and malic acid. The objective of this research is to isolate and to characterize cDNA of the gene encoding for Citrate Synthase in M. malabathricum. We have successfully isolated total RNA from the root tips of M. malabathricum. Total cDNA had been synthesized by reverse transcription by using total RNA as template. By using specific primer designed based on conserve region from Nicotiana tabacum, Beta vulgaris, Populus hybrid and Daucus carota. We had successfully isolated the fragment of cDNA of the gene encoding of Citrate Synthase (MmFCS) containing 885 nucleotides, deducing 295 amino acids. Local aligment analysis based on nucleotide showed that this fragment is 80% identical to part of Citrate Synthase in Populus trichocarpa (XM_002330859.1) and Populus hybrid (X84227.1), 79% to Vitis vinifera (XM_002271415.1), Citrus sinensis (G03728 80.1), Citrus junos (AY428532.1) and Arabidopsis lyrata (XM_002880061.1). Based on amino acid sequence, the amino acid sequence deduced from the cDNA fragment is 99% identical to part of Citrate Synthase of: Populus trichocarpa (XP_002330895.1), Citrus sinensis (ACU42176.1), Citrus junos (AAR88248.1), Vitis vinifera (XP_002271451.1), Arabidopsis thaliana (AAM62868.1), Populus hybrid (CAA59009.1), Prunus persica (AAL11504.1), Beta vulgaris (CAA590 10.1), Sorghum bicolor (XP_002453470.1), Nicotiana tabacum (CAA59008.1) and Oryza sativa (AAG28777.1).
Keywords : Melastoma malabathricum, isolation, cDNA, citrate synthase, alignment.
RINGKASAN
ULFAH MUSHOFA. Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Sitrat Sintase pada Melastoma malabathricum. Dibimbing oleh SUHARSONO dan UTUT WIDYASTUTI SUHARSONO.
Sitrat sintase adalah enzim yang memiliki peranan penting di dalam tanaman. Enzim ini memiliki fungsi untuk menyintesis sitrat. Sitrat adalah senyawa utama yang diperlukan dalam siklus Krebs, oksidasi-β dari asam lemak, lintasan glikolat fotorespirator dan pengkelatan ion beracun. Sitrat pada tanaman mampu meningkatkan toleransi tanaman terhadap toksisitas Al, dimana toksisitas menjadi permasalahan pada lahan asam. Untuk mengoptimumkan pemanfaatan lahan marjinal yang asam dan memiliki kelarutan Al yang tinggi, varietas tanaman yang toleran asam dan Al sangat diperlukan. Varietas unggul yang toleran dapat diperoleh dengan perbaikan genetik, baik melalui penyilangan secara konvensional maupun melalui teknologi DNA rekombinan. Melastoma malabathricum adalah salah satu tanaman yang mampu tumbuh dengan baik pada lahan asam dengan kelarutan Al yang tinggi. Salah satu gen yang diduga berperan dalam ketahanan M. malabathricum terhadap pH rendah dan Al adalah gen penyandi citrate sintase (CS).
Penelitian ini bertujuan untuk melakukan isolasi dan karakterisasi fragmen cDNA gen sitrat sintase dari tanaman M. malabathricum. Untuk itu RNA total diisolasi dari akar M. malabathricum, lalu digunakan sebagai cetakan untuk sintesis cDNA total. Isolasi gen sitrat sintase dilakukan dengan metode PCR menggunakan primer yang didesain secara spesifik berdasarkan conserve region dari sitrat sintase Nicotiana tabacum, Beta vulgaris, Populus hybrid dan Daucus carota, menggunakan cDNA sebagai cetakan. Hasil isolasi RNA total dan isolasi gen sitrat sintase divisualisasi dengan menggunakan elektroforesis pada gel agarosa.
RNA total yang telah berhasil diisolasi dari akar M. malabathricum diuji secara kuantitas dan kualitas, hasil yang diperoleh menunjukkan RNA total murni terbebas dari protein, bebas kontaminasi DNA genom dan memiliki keutuhan yang baik. Hasil pengurutan dari cDNA diperoleh nukleotida dengan panjang 885 pb yang menyandikan 295 asam amino. Kesejajaran lokal pada urutan nukleotida dengan beberapa spesies lain menunjukkan kesamaan sebesar 80% dengan bagian cDNA dari sitrat sintase: Populus trichocarpa (XM_002330859.1) dan Populus hybrid (X84227.1), 79% dengan Vitis vinifera (XM_002271415.1), Citrus sinensis (G0372880.1), Citrus junos (AY428532.1) dan Arabidopsis lyrata (XM_002880061.1). Kesejajaran urutan asam amino menunjukkan kesamaan sebesar 99% dengan bagian sitrat sintase Populus trichocarpa (XP_002330 895.1), Citrus sinensis (ACU42176.1), Citrus junos (AAR88248.1), Vitis vinifera (XP_002271451.1), Populus hybrid (CAA59009.1), Prunus persica (AAL11 504.1), Arabidopsis thaliana (AAM62868.1), Beta vulgaris (CAA59010.1) Sorghum bicolor (XP_002453470.1), Oryza sativa (AAG28777.1), dan Nicotiana tabacum (CAA590 08.1). Hasil analisis tingkat protein menunjukkan bahwa dalam sekuen tersebut terdapat domain terkonservasi dan daerah penanda sitrat sintase.
© Hak cipta milik IPB, tahun 2011 Hak cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tesis tanpa mencantumkan atau menyatakan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah.
b. Pengutipan tidak merugikan kepentingan yang wajar Institut Pertanian Bogor.
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh tulisan dalam bentuk apa pun tanpa izin Institut Pertanian Bogor.
ISOLASI
DAN KARAKTERISASI FRAGMEN cDNA
DARI GEN PENYANDI SITRAT SINTASE
PADA Melastoma malabathricum
ULFAH MUSHOFA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2011
Judul Tesis : Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Sitrat Sintase pada Melastoma malabathricum Nama Mahasiswa : Ulfah Mushofa
NIM : P055050041
Program Studi : Bioteknologi
Disetujui Komisi Pembimbing
Dr. Ir. Suharsono, DEA Dr. Ir. Utut W. Suharsono, M.Si. Ketua Anggota
Diketahui
Ketua Program Studi Bioteknologi Dekan Sekolah Pascasarjana
Dr. Ir. Suharsono, DEA Prof. Dr. Ir. Khairil A. Notodiputro, MS.
RIWAYAT HIDUP
Penulis dilahirkan di Blitar – Jawa Timur pada tanggal 21 Juni 1982 dari pasangan M.H Imron Noor dan Hj. Ellys Budaya. Penulis merupakan putri bungsu dari tiga bersaudari. Pada 18 Oktober 2008 penulis menikah dengan Teguh Prasetyo.
Pendidikan sarjana ditempuh penulis di Program Studi Hortikultura, Jurusan Budidaya Pertanian, Fakultas Pertanian, Universitas Brawijaya, Malang dan lulus pada tahun 2005. Pada tahun yang sama, penulis terdaftar sebagai mahasiswa program Magister Sains di Program Studi Bioteknologi, Sekolah Pascasarjana Institut Pertanian Bogor dengan beasiswa mandiri.
Tahun 2008-2009 penulis mengambil cuti selama 1 tahun untuk mengikuti training “Industrial Biotechnology” di Jerman dengan beasiswa dari Pemerintah Republik Federal Jerman. Selama melaksanakan penelitian, penulis menjadi asisten praktikum mata kuliah Genetika Dasar pada tahun ajaran 2009/2010, serta mata kuliah Genetika Molekuler pada tahun ajaran 2007/2008 dan 2009/2010. Tahun 2010, bersama dengan alumni training “Industrial Biotechnology” yang lain, penulis berperan aktif dalam merintis organisasi AJI Biotek (Alumni Jerman Indonesia Bioteknologi).
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah pencipta alam semesta atas segala limpahan rahmat-Nya sehingga penelitian dan penulisan tesis ini berhasil diselesaikan. Tesis dengan judul Isolasi dan Karakterisasi Fragmen cDNA dari Gen Penyandi Sitrat Sintase pada Melastoma malabathricum ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Prograsm Studi Bioteknologi, Sekolah Pascasarjana, Institut Pertanian Bogor.
Selama menjalani perkuliahan hingga terselesaikannya tesis ini, penulis banyak mendapat bantuan moral maupun material dari berbagai pihak. Oleh karena itu penulis menyampaikan terimakasih kepada : Bapak Dr. Ir. Suharsono, DEA dan Ibu Dr. Ir. Utut W. Suharsono, M.Si selaku komisi pembimbing atas arahan dan bimbingan selama penelitian dan penulisan tesis dengan penuh kesabaran dan ketelitian. Penulis juga menyampaikan terimakasih kepada Hibah Kompetensi dari Ditjen Pendidikan Tinggi (DIKTI), Kementrian Pendidikan Nasional dengan judul “Isolasi dan ekspresi gen dalam rangka perakitan tanaman terhadap cekaman asam dan aluminium” dan JSPS-DGHE Joint Research Project dengan judul “Molecular adaptation of Jatropha curcas to acid soil for reforestation of tropical wasteland” atas nama Bapak Dr. Suharsono yang telah membiayai penelitian ini. Terimakasih kepada Bapak Prof.Dr.Ir. Iskandar Z. Siregar, M.For.Sc selaku Penguji Luar Komisi pada Ujian Tesis, yang telah memberikan saran dan bantuan untuk perbaikan Tesis.
Ungkapan terimakasih juga disampaikan kepada seluruh dosen pengajar, staf dan rekan mahasiwa Program Studi Bioteknologi terutama angkatan 2005. Pak Muzuni dan Syarifin Firdaus, yang telah banyak membantu dalam penelitian dan penulisan tesis. Pak Radite, Bu Ratna, Bu Hanum, Bu Srilis, Pak Ulung, Mbak Pepy, Pak Mulya, Bahrelfi, Budi, Popy, Ammay, Mbak Agustin, Mbak Niken, Bang Yassier serta seluruh anggota Biorin angkatan lama lainnya sampai dengan angkatan terbaru, untuk proses saling menguatkan semangat.
Terimakasih penulis sampaikan kepada Ayahanda M.H Imron Noor, Ibunda Hj. Ellys Budaya, suami tercinta Teguh Prasetyo, Syifa Noor Mz, Laili Shofia dan seluruh keluarga Blitar atas dukungan do’a, moral sampai dengan bantuan finansial. Semoga semua amal kebaikan akan dikembalikan oleh Allah dengan berlipat ganda.
Penulis menyadari bahwa tesis ini masih belum sempurna. Namun penulis berharap laporan tesis ini dapat bermanfaat.
Bogor, Januari 2011 Ulfah Mushofa
DAFTAR ISI
Halaman DAFTAR GAMBAR ... x DAFTAR LAMPIRAN ... xi PENDAHULUAN ... 1 Latar Belakang... 1 Tujuan Penelitian ... 2 TINJAUAN PUSTAKA... 3Lahan Asam dan Permasalahannya ... 3
Pengaruh Aluminium terhadap Tanaman ... 4
Toleransi Tanaman Menghadapi Cekaman Aluminium ... 5
Peranan Asam Organik dalam Toleransi Tanaman terhadap Aluminium .... 6
Sitrat Sintase ... 8
Isolasi gen dari Melastoma malabathricum ... 10
BAHAN DAN METODE ... 13
Waktu dan Tempat Penelitian ... 13
Bahan Penelitian ... 13
Metode Penelitian ... 13
Isolasi RNA Total ... 13
Kuantifikasi dan kualifikasi RNA total ... 14
Sintesis cDNA Total ... 15
Isolasi Fragmen Gen Sitrat Sintase ... 15
Analisis Fragmen Gen Sitrat Sintase ... 16
HASIL DAN PEMBAHASAN ... 17
Isolasi RNA Total ... 17
Sintesis cDNA Total ... 17
Isolasi Fragmen Gen Sitrat Sintase ... 18
Analisis MmFCS ... 19
Analisis Domain MmFCS ... 22
Analisis Hidrofobisitas ... 23
KESIMPULAN DAN SARAN ... 24
Kesimpulan... 24
Saran ... 24
Ucapan Terimakasih ... 24
DAFTAR PUSTAKA ... 25
DAFTAR GAMBAR Halaman 1 2 3 4 5 6 7 8 9 10 11 12 13
Reaksi pembentukan asam sitrat ... 8
Tanaman Melastoma malabathricum, skala penggaris 30 cm... 10
Hasil elektroforesis RNA total dari akar M. malabathricum di gel agarosa .... 16
Hasil elektroforesis produk PCR aktin dengan menggunakan cDNA sebagai cetakan ... 17
MmFCS hasil PCR dengan menggunakan cetakan cDNA ... 17
Hasil pengurutan nukleotida dari fragmen MmFCS... 18
Filogenetik berdasarkan cDNA sitrat sintase beberapa spesies ... 19
Peta situs enzim restriksi yang terdapat dalam MmFCS ... 20
Deduksi asam amino dari MmFCS... 21
Domain terkonservasi yang berada pada MmFCS ... 21
Urutan asam amino sitrat sintase dari berbagai spesies ... 22
Profil hidrofobisitas sitrat sintase utuh P. trichocarpa ... 23
Perbandingan hidrofobisitas antara MmFCS dengan fragmen sitrat sintase P. trichocarpa. ... 23
DAFTAR LAMPIRAN
Halaman
1 Hasil pengurutan nukleotida MmFCS menggunakan primer forward ... 30 2 Hasil pengurutan nukleotida MmFCS menggunakan primer reverse ... 33 3 Hasil analisis kesejajaran nukleotida MmFCS berdasarkan BLASTn ... 36 4 Matrik kesamaan urutan nukleotida penyandi sitrat sintase dari beberapa
spesies ... 37 5 Penyejajaran nukleotida MmFCS dengan nukleotida beberapa spesies lain .... 38 6 Hasil analisis kesejajaran urutan asam amino MmFCS berdasarkan
BLASTp ... 43 7 Penyejajaran asam amino MmFCS dengan asam amino beberapa spesies lain 44
PENDAHULUAN
Latar Belakang
Sitrat sintase merupakan enzim yang sangat penting, memiliki fungsi mengkatalis reaksi kondensasi dari residu asetat berkarbon 2 dari asetil KoA dan sebuah molekul oksaloasetat berkarbon 4 untuk membentuk sitrat berkarbon 6. Sitrat sintase ditemukan hampir pada semua sel hidup, pada sel eukariot umumnya terdapat pada bagian matriks mitokondria dan memiliki peranan yang penting di dalam siklus Krebs. Selain dalam siklus Krebs sitrat memiliki peranan penting dalam oksidasi-β dari asam lemak, lintasan glikolat fotorespirator dan pengkelatan ion beracun (Zhang et al., 2005). Hasil penelitian menunjukkan bahwa sekresi sitrat dari tanaman memegang peranan yang penting dalam toleransi terhadap Aluminium (Al) (Hue et al., 1986; Kasim, 2000; Miyasaka et al., 1991; Ma et al., 1998; Pellet et al., 1995;).
Secara umum mekanisme toleransi tanaman terhadap Al adalah dengan cara melakukan kompartementasi pada bagian tertentu sehingga Al tidak bersifat toksik dan atau dengan cara melakukan eksklusi Al keluar jaringan. Asam organik seperti sitrat, malat dan oksalat memiliki peranan yang penting untuk mengelat Al sehingga Al tidak lagi bersifat toksik bagi tanaman (Delhaize dan Ryan, 1995). Peranan asam organik dalam toleransi Al dapat melalui toleransi internal maupun toleransi eksternal. Sitrat sintase merupakan protein yang berperan untuk membentuk asam organik sitrat.
Gen penyandi sitrat sintase dari beberapa tanaman telah berhasil diisolasi, misal dari Nicotiana tabacum, Beta vulgaris, Populus hybrid (Takita et al., 1999), Arabidopsis thaliana (Unger et al., 1989), Oryza sativa (Zhang et al., 2005) dan Daucus carota (La Cognata et al., 1996).
Introduksi gen penyandi sitrat sintase juga telah dilakukan seperti over ekspresi gen sitrat sintase dari bakteri Pseudomonas aeruginosa pada tanaman pepaya dan tembakau, yang menghasilkan tanaman transgenik yang lebih toleran terhadap Al dibanding tanaman kontrol (de la Fuente et al., 1997). Tanaman Eucalyptus yang merupakan salah satu pohon utama dalam produksi kehutanan juga telah berhasil ditransformasi dengan menggunakan gen penyandi sitrat
sintase dari Daucus carota. Hasil penelitian menunjukkan bahwa tanaman transgenik lebih toleran terhadap Al dan sumber fosfat terbatas dibandingkan tanaman kontrol (Kawazu et al.,2003).
Melastoma malabathricum adalah salah satu tanaman yang mampu tumbuh dengan baik pada lahan asam dengan kelarutan Al yang tinggi, bahkan pertumbuhannya dapat terpacu dengan adanya Al pada media tanam (Osaki et al., 2003). Hasil penelitian Muhaemin (2008) menunjukkan bahwa M. malabathricum mampu tumbuh pada pH 4 dengan kelarutan Al 3,2 mM. Gen-gen yang diduga memegang peranan pada ketahanan M. malabathricum terhadap Al telah berhasil diisolasi, antara lain metallothionein type 2 (Mt2) (Suharsono et al., 2008), multidrug resistance associated protein (MRP) (Suharsono et al., 2009), copper/zinc-superoxide dismutase (CuZn-SOD) (Hanum, 3 Juni Komunikasi Pribadi) dan H+-ATPase membran plasma (MmPMA) (Muzuni et al., 2010).
Untuk mengoptimumkan pemanfaatan lahan marjinal yang asam dengan kelarutan Al yang tinggi, varietas tanaman yang toleran asam dan Al sangat diperlukan. Varietas unggul yang toleran pada lahan ini dapat diperoleh dengan perbaikan genetik, baik melalui penyilangan secara konvensional maupun melalui teknologi DNA rekombinan. Perakitan tanaman yang toleran asam dan Al ini membutuhkan gen-gen ketahanan Al. Salah satu gen yang diduga memegang peranan besar dalam toleransi Al adalah gen penyandi sitrat sintase. Dari hasil-hasil penelitian sebelumnya maka dapat disimpulkan bahwa M. malabathricum memiliki potensi yang kuat untuk dapat digunakan sebagai sumber daya genetik dalam rangka memperoleh tanaman toleran Al.
Tujuan Penelitian
Penelitian ini bertujuan untuk melakukan isolasi dan karakterisasi fragmen cDNA gen sitrat sintase dari tanaman M. malabathricum.
TINJAUAN PUSTAKA
Lahan Asam dan Permasalahannya
Ultisol merupakan salah satu jenis tanah yang memiliki sebaran luas di Indonesia, yaitu 45.798.000 ha, meliputi hampir 25% dari total daratan Indonesia (Subagyo et al., 2004). Tanah Ultisol umumnya mempunyai nilai kejenuhan basa < 35%, reaksi tanah ini pada umumnya sangat asam (pH 3,10 – 5). Nilai kejenuhan Al yang tinggi terdapat pada tanah Ultisol dari bahan sedimen dan granit, mencapai > 60%. Seperti yang dijelaskan oleh Prasetyo dan Suriadikarta (2006), kesuburan alami tanah Ultisol umumnya terdapat pada horizon A yang tipis dengan kandungan bahan organik yang rendah. Unsur hara makro seperti fosfor dan kalium yang sering kahat, reaksi tanah asam hingga sangat asam, serta Al jenuh yang tinggi merupakan sifat-sifat tanah Ultisol yang sering menghambat pertumbuhan tanaman. Toksisitas Al juga menjadi masalah utama yang menghambat produktifitas pertanian pada lahan asam di dunia, dimana luasan lahan asam mencapai 40% dari luasan bumi (Kochian, 1995).
Konsentrasi mikromolar senyawa Al yang larut dalam tanah sudah dapat mengakibatkan toksisitas yang serius pada tanaman. Produksi tanaman juga dapat menurun secara drastis karena uptake air dan unsur hara terganggu (Kochian, 1995). Tidak semua bentuk dari Al bersifat toksik, masing-masing bentuk memiliki tingkat toksisitas yang berbeda. Pada umumnya kation trivalen bersifat toksik bagi tanaman dan Al3+ merupakan bentuk yang paling toksik, meskipun Al dalam bentuk divalen dan monovalen juga bersifat toksik. Larutan dengan pH yang lebih rendah dari 5,0 menyebabkan ion Al berada dalam bentuk oktahedral heksahidrat, Al(H2O)63+, sering disingkat dengan Al3+. Pada pH 5 – 7 Al(H2O)63+ mengalami deprotonasi menjadi Al(OH)2+ dan Al(OH)2+. pH yang meningkat akan mengakibatkan Al berbentuk solid Al(OH)3 dan mengendap. Pada keadaan basa Al akan membentuk tetrahedral, Al(OH)4- (Delhaize dan Ryan, 1995; Kochian, 1995).
Keracunan ion Al3+ merupakan hambatan yang paling nyata terhadap produksi pertanian di tanah asam. Keracunan Al ini mampu mengakibatkan produksi tanaman menurun 25% sampai 85% (Kochian, 1995). Rendahnya
produktivitas menyebabkan tanah asam yang luas ini masih belum bisa dimanfaatkan secara optimal sebagai lahan pertanian.
Pengaruh Aluminium terhadap Tanaman
Keracunan Al merupakan salah satu kendala dalam produksi tanaman pada tanah asam. Pada kondisi tersebut umumnya ketersediaan hara dan kemampuan tanaman untuk menyerap hara sangat terbatas. Dari beberapa percobaan diketahui bahwa penyerapan P, Ca, Mg, dan K oleh tanaman berkurang secara nyata. Pada tanaman barley yang ditanam pada media yang mengandung Al, kandungan Ca2+ dan K+ hanya setengahnya jika dibandingkan dengan kontrol (Matsumoto et al.,1988). Defisiensi P dapat diinduksi oleh kandungan Al yang tinggi. Komplek Al-fosfat yang berada di larutan tanah ataupun di dalam sel, mengakibatkan P tidak tersedia bagi tanaman. Kation trivalen Al3+ juga menghambat transpor Ca2+ secara efektif ke dalam akar, protoplas dan membran. Hasil studi pada lapisan lipida menunjukkan bahwa Al dapat memblok Ca2+ dan saluran K+ (Ryan et al., 1997). Kelebihan konsentrasi Al dalam larutan tanah pada umumnya berakibat buruk terhadap pertumbuhan tanaman, kecuali beberapa tanaman seperti teh yang mampu bertahan pada konsentrasi Al tinggi. Menurut Jansen et al. (2002) selain teh ada tanaman lain yang toleran terhadap Al yaitu Melastomataceae yang merupakan tanaman akumulator unsur logam diantaranya adalah Al.
Gangguan penyerapan hara mineral di dalam tanah asam disebabkan dua hal yang sangat berkaitan, yaitu efek langsung yaitu penghambatan penyerapan hara, dan efek tidak langsung dengan menghambat pertumbuhan akar melalui penghambatan penyerapan hara (Marschner, 1995).
Aluminium dapat mengubah struktur dan fungsi membran plasma serta menghalangi pembelahan sel pada ujung akar primer. Gejala awal keracunan aluminium yang paling mudah diamati adalah terhambatnya pertumbuhan akar, yaitu ujung akar menebal dan pertumbuhannya memendek. Aluminium banyak terakumulasi pada ujung akar yang menyebabkan daerah tersebut mengalami banyak kerusakan fisik dibandingkan jaringan akar dewasa (Ryan et al., 1993).
Ion trivalen Al3+ tidak larut dalam lipid sehingga membran plasma merupakan penghalang bagi masuknya Al ke dalam sitoplasma, namun beberapa penelitian membuktikan Al juga terdapat dalam sitoplasma. Al yang terakumulasi
dalam sitoplasma inilah yang bersifat toksik, sehingga memberikan asumsi bahwa toksisitas Al terjadi karena terbentuknya kompleks Al dengan ligan yang menyebabkan terhambatnya fungsi penting dari molekul-molekul yang diikat (misal : enzim, calmodulin, tubulin, ATP, GTP, DNA), atau kompleks Al-ligan yang menghambat proses-proses metabolisme lainnya (Ryan et al., 1995). Matsumoto (1991) menyatakan bahwa Al yang berada dalam bentuk ion trivalen (Al3+) memiliki muatan positif yang besar serta memiliki banyak situs pengikatan. Al3+dapat mengikat fosfat pada kedua utas DNA, mengakibatkan gagalnya utas ganda DNA berpisah pada saat replikasi.
Marschner (1995) melaporkan bahwa Al dapat menggantikan kedudukan Ca pada lamela tengah dinding sel. Ikatan Al dengan gugus karboksil pada pektin akan menimbulkan ikatan yang kuat dan kaku pada dinding sel sehingga tidak dapat membesar. Al juga dapat menghambat transport Mg2+ yang merupakan unsur penting pada proses fisiologis.
Toleransi Tanaman Menghadapi Cekaman Aluminium
Terdapat tiga kelompok tanaman toleran cekaman Al (Foy et al. 1978). Kelompok pertama adalah kandungan Al di akar tanaman toleran lebih rendah daripada tanaman yang sensitif sedangkan bagian atasnya sama, contohnya pada gandum, barley dan kedelai. Kelompok kedua adalah tanaman toleran memiliki kandungan Al lebih tinggi pada akarnya dan lebih rendah pada organ bagian atas, contohnya padi dan alfalfa. Kelompok ketiga adalah tanaman toleran memiliki kandungan Al sangat tinggi di bagian atas terutama pada daun, misalnya teh yang mengakumulasi Al 600 mg.kg-1 berat kering daun muda (Matsumoto et al. 1976), pada Hydrangea mencapai 3.000 mg.kg-1 berat kering sepal (Ma et al. 1997).
Mekanisme toleransi terhadap cekaman Al dikelompokkan menjadi mekanisme eksternal (eksklusi Al ) dan internal (inklusi Al) (Taylor, 1991). Mekanisme eksternal tanaman dilakukan dengan immobilisasi Al di dinding sel, mengatur selektifitas membran plasma terhadap sel, meningkatkan pH di daerah rizosfir atau apoplas akar serta melakukan eksudasi senyawa-senyawa pengkelat dan effluks Al. Mekanisme internal meliputi kelatisasi Al di sitosol, kompartementasi Al di vakuola, mensintesis protein spesifik pada membran plasma yang akan menurunkan serapan Al maupun peningkatan effluks Al.
Tanaman yang toleran terhadap keracunan Al memiliki kemampuan untuk menekan pengaruh buruk keracunan Al tersebut. Kriteria tanaman yang toleran terhadap Al antara lain: akar sanggup tumbuh terus dan ujung akar tidak rusak, mengurangi kelebihan serapan ion Al oleh akar, memiliki berbagai cara untuk menetralkan pengaruh racun Al setelah diserap tanaman, sanggup menciptakan keadaan yang kurang asam di daerah perakaran, translokasi ion Al ke bagian atas tanaman, sebagian besar ditahan di akar karena suatu mekanisme tertentu maka ion aluminium tidak sanggup menghambat serapan Ca, Mg dan K (Matsumoto et al.,1988).
Ujung akar merupakan bagian tanaman dimana gen-gen yang berperan dalam mekanisme toleransi terhadap cekaman Al terekpresi. Detoksifikasi Al pada ujung akar dapat dilakukan oleh tanaman dengan menghasilkan atau mengekspresikan suatu molekul atau ligan yang dapat mengkelat Al3+, mengimobilisasi Al pada dinding sel, meningkatkan pH di sekitar akar, serta mengaktifkan transport Al ke luar sitoplasma (Taylor, 1991).
Mekanisme fisiologi toksisitas dan toleransi Al telah dipelajari dan dibagi menjadi beberapa kelompok. Salah satu mekanisme toleransi tanaman terhadap Al yang sudah banyak dipelajari adalah pengeluaran anion asam organik seperti malat, sitrat dan oksalat, dari akar tanaman yang toleran Al. (Delhaize et al., 1993; Pellet et al., 1996; Ma et al., 1998).
Peranan Asam Organik dalam Toleransi Tanaman terhadap Al
Beberapa asam organik dapat membentuk ikatan kompleks dengan Al3+, sehingga Al tidak lagi bersifat racun bagi tanaman. Hue et al. (1986) menemukan bahwa asam organik dengan gugus hidroksil dan karboksil mampu membentuk ikatan yang stabil dengan Al3+. Peranan asam organik dalam toleransi Al dapat melalui toleransi internal maupun toleransi eksternal.
Salah satu cara mekanisme eksklusi adalah sekresi substansi pengkelatan Al. Al dalam bentuk kelat kurang toksik dibandingkan dengan bentuk ionik Al3+ (Hue et al., 1986). Asam organik berperan dalam eksklusi Al melalui pelepasannya dari akar dan detoksifikasi Al dalam simplas dimana asam organik tersebut dapat mengkelat Al dan mereduksi atau mencegah pengaruh racunnya
pada tingkat seluler (Pellet et al., 1995). Asam organik ini diduga mampu mengkelat Al3+ di luar membran plasma yang selanjutnya dapat mencegah Al masuk ke tanaman (Delhaize & Ryan, 1995). Hasil penelitian Kasim (2000) terhadap beberapa jenis kedelai, menunjukkan bahwa Al merangsang terbentuknya asam sitrat dan malat baik yang diakumulasikan di dalam sel maupun disekresikan. Genotipe-genotipe yang toleran menyintesis asam organik lebih tinggi daripada genotipe yang peka. Hanya genotipe toleran yang menyekresikan malat walaupun dalam jumlah sedikit, sehingga sekresi malat dapat dijadikan indikator untuk tingkat toleransi kedelai terhadap cekaman Al.
Beberapa genotipe tanaman adalah toleran Al karena dapat mengeluarkan Al dari apikal akar. Gandum yang toleran mengakumulasi Al lebih sedikit daripada gandum yang peka. Asam organik mengkelat Al sehingga akar terlindungi dari toksisitas Al. Gandum mengeksudasi malat sebagi responnya terhadap paparan Al, kedelai mengeksudasi sitrat dan malat, sedangkan oksalat dieksudasi oleh buckwheat (Fagopyrum esculentum). Effluks asam organik umumnya terjadi pada bagian apikal akar, karena bagian inilah yang paling rawan terhadap toksisitas Al. Hal ini menjadi dasar mengapa jumlah asam organik yang dieksudasi dari ujung akar tidak harus mampu mendetoksifikasi keseluruhan Al yang berada di sekitar akar, namun cukup untuk mendetoksifikasi Al yang berada di sekitar ujung akar saja (Ma et al., 1998). Hue et al. (1986) menyatakan bahwa di dalam kultur in vitro, asam organik benar-benar mampu menurunkan efek toksik dari Al, sitrat lebih efektif dibandingkan suksinat atau malat. Hasil penelitian Miyasaka et al. (1991) menunjukkan bahwa setelah ditumbuhkan selama 8 hari pada media yang mengandung Al, sistem akar pada tanaman buncis kultivar resisten mengeluarkan sitrat 70 kali lebih banyak dibandingkan tanpa perlakuan Al dan 10 kali lebih banyak dibandingkan kultivar peka.
Asam-asam organik telah dibuktikan memiliki kemampuan mengkelat atau mendetoksifikasi Al, namun masih diperdebatkan apakah mekanisme tersebut terjadi secara internal dan eksternal.
Sitrat Sintase
Sitrat sintase merupakan enzim yang sangat penting, memiliki fungsi mengatalis reaksi kondensasi dari residu asetat berkarbon 2 dari asetil KoA dan sebuah molekul oksaloasetat berkarbon 4 untuk menghasilkan sitrat berkarbon 6 (Gambar 1). Sitrat sintase ditemukan hampir pada semua sel hidup, pada sel eukariot umumnya terdapat pada bagian matriks mitokondria. Sintesis sitrat sintase terjadi di dalam sitosol dan kemudian ditransport ke mitokondria. Sitrat sintase adalah kunci utama pada siklus asam sitrat atau siklus Krebs.
Gambar 1 Reaksi pembentukan asam sitrat (Campbell et al., 2002).
Selain dalam siklus Krebs sitrat memiliki peranan penting dalam oksidasi-β dari asam lemak, lintasan glikolat fotorespirator dan pengkelatan ion beracun (Zhang et al., 2005).
Takita et al. (1999) telah berhasil mengisolasi gen penyandi sitrat sintase dari tanaman wortel (Daucus carota), gen tersebut memiliki ukuran penuh sepanjang 1.859 pb. La Cognata et al.(1996) juga telah berhasil mengisolasi gen sitrat sintase dari N. tabacum, B. vulgaris dan P. hybrid. Secara berurutan me-miliki nukelotida sepanjang 1.747 pb, 1.551 pb dan 1.387 pb. Arabidopsis thaliana memiliki gen sitrat sintase utuh sepanjang 1416 pb (Unger et al., 1989).
Gen sitrat sintase pada tanaman padi juga telah berhasil diiosolasi dan dikarakterisasi oleh Zhang et al. (2005). Gen utuh yang diperoleh memiliki ukuran 1.477 pb yang menyandikan 474 asam amino. Sekuen protein yang dihasilkan memiliki kemiripan yang tinggi (lebih dari 70%) dengan Daucus carota, N. tabacum, B. vulgaris, A. thaliana dan Citrus junos.
Larson et al. (2009) menyatakan bahwa protein sitrat sintase pada babi memiliki ukuran 437 asam amino dan berat molekul sekitar 50 kDa. Sitrat sintase tersusun dari sebuah domain alfa helik besar dan sebuah domain alfa helik kecil (Larson et al., 2009; Arnott et al, 2000). Domain besar berfungsi dalam kontak
inter-subunit, sedangkan domain kecil memiliki fungsi katalitik (Arnott et al., 2000).
Overekspresi gen sitrat sintase dari bakteri Pseudomonas aeruginosa pada tanaman tembakau menghasilkan tanaman transgenik yang mengandung sitrat 10 kali lebih banyak dibanding tanaman non transgenik (kontrol) pada akarnya, dan menyekresikan sitrat 4 kali lebih banyak dibandingkan kontrol (de la Fuente et al,.1997). Penghambatan laju pertumbuhan akar pada tanaman transgenik juga lebih rendah daripada kontrol.
Gen sitrat sintase telah diisolasi dari D. carota yang selanjutnya diintroduksikan ke dalam tanaman A. thaliana dengan menggunakan Agrobacterium tumefaciens sebagai media transformasi (Koyama et al., 2000). Tanaman transgenik yang dihasilkan menyekresikan sitrat sekitar 2,5 kali lipat lebih tinggi dibanding tanaman kontrol dan tumbuh lebih baik pada media yang mengandung fosfor terbatas dan Al.
Tanaman alfafa (Medicago sativa) adalah tanaman yang dikenal sangat peka terhadap Al. Introduksi gen sitrat sintase dari P. aeruginosa pada tanaman alfafa yang dilakukan oleh Barone et al. (2008) menunjukkan bahwa tanaman alfafa transgenik yang ditumbuhkan pada tanah asam yang mengandung Al mengekspresikan gen sitrat sintase dan secara signifikan memiliki akar dan pertumbuhan yang lebih baik dibandingkan kontrol. Hal ini kemungkinan disebabkan oleh eksklusi Al3+ dari ujung akar. Peningkatan ekspresi gen sitrat sintase dan aktifitas sitrat sintase pada media yang mengandung Al juga ditunjukkan oleh tanaman kanola transgenik dibandingkan tanaman kontrol (Anoop et al., 2003).
Introduksi gen sitrat sintase dari wortel pada Eucalyptus hybrid menggunakan Agobacterium sebagai media transformasi juga telah dilakukan oleh Kawazu et al. (2003). Hasil penelitian menunjukkan aktifitas sitrat sintase pada daun dan akar tanaman transgenik meningkat 5 kali lipat dibandingkan dengan tanaman kontrol. Konsentrasi sitrat sintase di dalam akar juga mengalami peningkatan sebagaimana peningkatan aktifitas sitrat sintase. Tanaman transgenik yang yang ditumbuhkan secara hidroponik pada media yang mengandung Al-fosfat sebagai sumber tunggal unsur P, menunjukkan hasil yang sama
dibandingkan tanaman dengan media Na-fosfat, sedangkan pada tanaman kontrol menunjukkan penurunan pertumbuhan akar.
Isolasi gen dari Melastoma malabathricum
M. malabathricum biasa disebut sengganen atau harendong (Jawa), sikadoekdoek (Sumatera), atau cengkodok (Kalimantan). M. malabathricum (Gambar 2) merupakan tanaman yang termasuk dalam superdivisi Spermatophyta (tanaman berbiji), divisi Magnoliophyta (tanaman berbunga), group dikotil, ordo Myrtales, famili Melastomaceae (PROSEA, 2010).
M. malabathricum adalah salah satu akumulator Al yang tumbuh di tanah asam daerah tropis dan sub tropis dan merupakan salah satu dari spesies tanaman berkayu yang mampu tumbuh pada tanah asam sulfat dengan keasaman yang tinggi dan konsentrasi unsur hara yang sangat rendah (misal : N, P dan kation basa). Biasanya tanaman ini tumbuh dengan baik di Asia, Australia dan Polysenia
(Osaki et al., 1998).
Gambar 2Tanaman M. malabathricum
Mekanisme internal dari hiperakumulator Al di dalam M. malabathricum telah banyak dipelajari (Watanabe et al., 1997, 1998, 2005a, 2005b). Konsentrasi Al pada daun M. malabathricum seringkali tinggi, bahkan pada tanah gambut dengan daya tukar Al yang rendah (Osaki et al., 1998). Hasil penelitian Muhaemin (2008) menunjukkan bahwa M. malabathricum mampu tumbuh pada pH 4 dengan kelarutan Al 3,2 mM. Tanaman diklasifikasikan sebagai akumulator bila mengakumulasi sedikitnya 1.000 mg/kg daun (Jansen et al, 2002). M.
malabathricum mampu mengakumulasi lebih dari 10.000 mg Al/kg pada daun tua dan lebih dari 7.000 mg Al/kg pada daun muda tanpa mengalami keracunan (Watanabe et al., 1997). Pertumbuhan M. malabathricum juga lebih cepat pada media yang mengandung Al daripada yang tidak mengandung Al (Watanabe dan
Osaki, 2001). Salah satu metode detoksifikasi Al di dalam M. malabathricum adalah
eksudasi asam organik dari akar ke daerah rizosfer, dimana Al dan asam organik dapat membentuk ikatan yang stabil. Selain itu asam organik juga berfungsi untuk toleransi internal di dalam M. malabathricum. Ada 2 senyawa di dalam akar M. malabathricum yang dimungkinkan mampu membentuk kompleks dengan Al, Al-oksalat merupakan bentuk yang berada di dalam daun dan Al-sitrat merupakan bentuk yang digunakan untuk translokasi Al dari akar ke daun (Watanabe et al, 2005; Watanabe dan Osaki, 2001). Watanabe dan Osaki (2002) menyatakan bahwa kompleks Al-sitrat memiliki ikatan 1:1 dan pada xylem sap M. malabathricum ditemukan malat dengan konsentrasi yang tinggi apabila tidak ada perlakuan Al, namun ketika diberi perlakuan Al maka ditemukan sitrat dengan konsentrasi yang tinggi. Kemampuan toleransi Al yang tinggi pada M. malabathricum ini menjadi dasar pemilihan tanaman ini sebagai sumber gen dan model bagi ketahanan Al terutama pada tanaman dikotil.
Beberapa cDNA dari gen yang berhubungan dengan toleransi Al telah diisolasi dari Melastomaceae. Gen penyandi metallothionein type 2 (Mt2) (Suharsono et al., 2008), multidrug resistance associated protein (MRP) (Suharsono et al., 2009), major facilitator superfamily (MFS) (Widyartini, 2007), dan H+-ATPase membran plasma (MmPMA) (Muzuni et al., 2010) dan copper/zinc-superoxide dismutase (CuZn-SOD) (Hanum 3 Juni 2010, komunikasi pribadi) telah diisolasi dari M. malabathricum. Selain dari M. malabathricum, gen penyandi Methallothionein tipe 2 telah diisolasi oleh Fauziah (2009) dari Tibouchina langsdorffiana, salah satu jenis melastoma. Selain cDNA, pustaka genom M. malabathricum (Hadisunarso, 2009) dan T. langsdorffiana (Wulandari, 2009) juga telah dikonstruksi.
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan Januari 2010 hingga Juni 2010 di Laboratorium BIORIN (Biotechnology Research Indonesian – The Netherlands), Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Dramaga Bogor. Pengurutan DNA dilakukan di Nara Institute of Science and Technology (NAIST) Nara, Jepang.
Bahan Penelitian
Bahan tanaman yang digunakan untuk isolasi RNA adalah akar tumbuhan M. malabathricum yang tumbuh di lahan asam daerah Jasinga – Bogor – Jawa Barat. Agilent Plant RNA Isolation Kit digunakan untuk isolasi RNA total. Primer aktin actF ATGGCAGATGCCGAGGATAT-3’) dan actR (5’-GTTGTGCGACCACTTGCA-3’) didesain dari Shah et al. (1982) yaitu aktin kedelai, digunakan sebagai alat untuk mengetahui hasil kemurnian cDNA total. Primer spesifik cspF (5’-CTGTCACTGCTCATCCAATGACTCA-3’) dan cspR (5’-CCATTGTAACACTCTTTGGCCTCTC-3’) yang didesain dari N. tabacum (Nomor aksesi : X84226.1), B. vulgaris (X84228.1), P. hybrid (X84227.1) dan D. carota (AB017159) digunakan untuk mengisolasi fragmen gen sitrat sintase. Primer spesifik csp didesain berdasarkan daerah terkonservasi pada mRNA penyandi sitrat sintase.
Metode Penelitian
Kegiatan penelitian ini meliputi lima tahapan utama, yaitu : (1) isolasi RNA total, (2) kuantifikasi dan kualifikasi RNA total, (3) sintesis cDNA total , (4) isolasi fragmen gen sitrat sintase, (5) analisis fragmen gen sitrat sintase.
Isolasi RNA Total.
Isolasi RNA mengikuti metode Agilent Plant RNA Isolation Mini Kit (Agilent, 2005). Sampel berupa 100 mg akar M. malabathricum digerus sampai menjadi serbuk halus di dalam mortar dengan menggunakan bantuan nitrogen cair. Kemudian serbuk yang telah dimasukkan dalam tabung ditambah dengan 1
ml larutan ekstraksi (mengandung 1% β-mercaptoetanol). Larutan dimasukkan ke dalam kolom prefiltrasi (berwarna bening) kemudian disentrifugasi dengan kecepatan 16.000 xg selama 3 menit. Isopropanol dengan volume yang sama ditambahkan pada larutan hasil filtrasi, dicampur sampai larutan menjadi homogen dan diinkubasi pada suhu ruang selama 5 menit. Larutan disentrifugasi menggunakan kolom isolasi dengan kecepatan 16.000 xg selama 30 detik. Kolom dibilas dengan 500 µl larutan pencuci dan disentrifugasi dengan kecepatan 16.000 xg selama 30 detik. Kolom dicuci sekali lagi dengan 500 µl larutan pencuci dan disentrifugasi dengan kecepatan 16.000 xg selama 2 menit. Kolom dipindahkan ke dalam tabung 1,5 ml baru yang bebas RNAse, dan ditambahi 10-50 µl air bebas nuklease, diinkubasi selama 1 menit dan kemudian disentrifugasi dengan kecepatan 16.000 xg selama 1 menit.
Kuantifikasi dan kualifikasi RNA total.
Kemurnian dan kuantitas RNA total hasil isolasi ditentukan dengan spektrofotometer UV-VIS (Cecil CE 2020) pada panjang gelombang 260 nm dan 280 nm. Konsentrasi RNA ditentukan dengan asumsi satu satuan absorban pada panjang gelombang 260 nm setara dengan 40 μg/ml RNA (Manchester 1996). Kemurnian RNA total dilihat melalui nilai perbandingan absorban pada panjang gelombang 260 nm dengan 280 nm (rasio). RNA total yang murni memiliki nilai rasio antara 1.8 sampai 2 (Manchester 1996; Wilfinger 1997). Kualitas dan kuantitas hasil isolasi RNA dikonfirmasi dengan elektroforesis pada gel agarosa 1b/v (FMC, USA) terdenaturasi formaldehid dengan larutan penyangga MOPS [4,2 g/l MOPS (3-(N-morpholino)propanesulfonic acid), 0,41 g/l Na-asetat, 0,37 g/l EDTA (2NA)H2O]. Untuk itu sebanyak 1 μl (0,25 μg) RNA dicampur dengan 12 μl larutan premiks [MOPS, 50% (v/v) formamida, 17,5% (v/v) formaldehid dan 27,5% (v/v) air DEPC] dipanaskan 65 °C selama 10 menit, didinginkan di es selama 5 menit dan diberi 1/6 kali volume loading dye (0,25% bromophenol blue, 0.25% xylene cyanol FF, 30% gliserol) dan dielektroforesis pada tegangan 100 volt selama 30 menit. Visualisasi RNA dilakukan di atas UV transluminator GelDoc (Labquip) setelah diwarnai dengan EtBr (0,5 μg/ml) selama 10 menit dan direndam dalam H2O selama 15 menit, kemudian difoto menggunakan kamera
digital. Adanya dua pita subunit RNA ribosom menunjukkan bahwa RNA total memiliki integritas yang baik.
Sintesis cDNA Total.
cDNA total disintesis menggunakan SuperScript II RT (Invitrogen). Komposisi sintesis cDNA total adalah 550 ng RNA total , 1X first strand buffer, 0,5 µM oligo(dT), 0,2 M DTT, 0,2 mM dNTP mix, 40 U enzim SuperScriptTMII RT, dan ddH2O yang diperlakukan DEPC sehingga mencapai volume akhir 20 µl. Campuran direaksikan pada suhu 30 °C selama 10 menit, diikuti dengan 42 °C selama 50 menit, 95 °C selama 5 menit, dan 15 °C selama 10 menit dengan meng- gunakan mesin PCR (MJ Research TM 100). Keberhasilan terbentuknya cDNA dan kemurnian RNA total dari DNA genom diperiksa menggunakan PCR dengan primer spesifik aktin. Komposisi reaksi PCR adalah 0,5 µl cDNA, 1X taq buffer (Invitrogen), 0,2 mM dNTP mix, 4% DMSO, 1,25 U taq DNA polymerase (Invitrogen), 0,5 µM primer ActF, 0,5 µM primer ActR dan ddH2O hingga mencapai volume akhir 10 µl. PCR dilakukan dengan kondisi pra-PCR 94 °C selama 5 menit, denaturasi 94 °C selama 30 detik, penempelan primer 55 °C selama 30 detik, pemanjangan 72 °C selama 1,5 menit, dengan 35 siklus, dan pasca-PCR 72 °C selama 5 menit.
Isolasi Fragmen Gen Sitrat Sintase.
Fragmen cDNA sitrat sintase diisolasi dengan PCR dengan menggunakan primer spesifik csp. Primer spesifik cspF (5’-CTGTCACTGCTCATCCAATGAC TCA-3’) dan cspR (5’-CCATTGTAACACTCTTTGGCCTCTC-3’) yang didesain dari N. tabacum, B. vulgaris, P. hybrid dan D. carota digunakan untuk mengisolasi fragmen gen sitrat sintase. Dilakukan alignment pada sekuen mRNA penyandi sitrat dari keempat spesies tersebut, sehingga ditemukan daerah terkonservasi, kemudian dari daerah tersebut didesain primer spesifik untuk mengisolasi gen penyandi sitrat sintase dari M. malabathricum. Komposisi reaksi PCR adalah 1,5 µl cDNA, 1X taq buffer, 0,2 mM dNTP mix, 4% DMSO, 1,25 U taq DNA polymerase (Fermentas), 0,5 µM primer cspF, 0,5 µM primer cspR dan ddH2O hingga mencapai volume akhir 10 µl. Kondisi PCR adalah 94 °C selama 5 menit, denaturasi 94 °C selama 30 detik, penempelan primer 51 °C selama 30
detik, pemanjangan 72 °C selama 1 menit, dengan 35 siklus, dan pasca-PCR 72 °C selama 5 menit. Hasil PCR dapat dilihat dengan cara visualisasi menggunakan metode elektroforesis pada gel agarosa.
Analisis Fragmen Gen Sitrat sintase.
Pengurutan DNA dilakukan dengan menggunakan mesin sekuenser. Analisis kesejajaran lokal (local alignment) sitrat sintase berdasarkan nukleotida dan asam amino dilakukan dengan menggunakan data yang ada di GeneBank, dengan program BLAST (Basic Local Alignment Search Tools) yang disediakan NCBI (National Center for Biotechnology Information) melalui http://www.ncbi.nlm.nih. gov/blast. Analisis peta restriksi dilakukan dengan menggunakan program NEBcutter (http://www.tools.neb.com/NEBcutter2/) dan Bioedit versi 7.0.0. Domain konservatif dianalisis dengan menggunakan program Conserved Domain (http://www.ncbi.nlmh. gov/Structure/cdd/). Domain potensial dianalisis dengan program motif scan (http://au. expasy.org/prosite/). Filogenetik disusun menggunakan program MEGA4. Hidrofobisitas asam amino dianalisis dengan menggunakan program Bioedit versi 7.0.0.
HASIL DAN PEMBAHASAN
Isolasi RNA Total
RNA total telah berhasil diisolasi dari akar M. malabathricum. Kuantifikasi RNA total dengan spektrofotometer pada panjang gelombang 260 nm menunjukkan bahwa rendemen isolasi RNA adalah 250 µg tiap gram akar segar. Nilai rasio OD260/OD280 dari RNA total pada hasil penelitian adalah 1,9. Hal ini menunjukkan bahwa RNA total yang diisolasi dalam penelitian ini murni, tidak terkontaminasi oleh protein. Manchester (1996) menyatakan bahwa rasio OD260/OD280 dengan nilai antara 1,8 sampai 2,0 menunjukkan RNA total yang diisolasi mempunyai kemurnian yang tinggi , bebas dari kontaminan protein.
Integritas RNA total dianalisis dengan melakukan elektroforesis pada gel agarosa terdenaturasi oleh formaldehid. Hasil elektroforesis RNA total menunjukkan adanya 2 pita RNA yang merupakan RNA ribosomal (rRNA) 28S dan 18S (Gambar 1). Adanya pita rRNA pada RNA total akar berhubungan dengan keutuhan rRNA yang tinggi. Kuantitas rRNA di dalam suspensi RNA total adalah yang tertinggi dibandingkan dengan tRNA dan mRNA, sehingga rRNA lebih mudah terdeteksi bilamana RNA total dimigrasikan di gel agarosa.
Gambar 3 Hasil elektroforesis RNA total dari akar M. malabathricum di gel agarosa
Sintesis cDNA Total
RNA total yang telah berhasil diisolasi selanjutnya digunakan sebagai cetakan cDNA melalui proses transkripsi balik (reverse transcription). Transkripsi balik menggunakan primer oligo(dT) sehingga hanya mRNA yang dapat disintesis menjadi cDNA, karena mempunyai ekor poly(A), sedangkan rRNA dan tRNA tidak mempunai ekor poly(A). Keberhasilan sintesis cDNA dikonfirmasi oleh hasil PCR dengan menggunakan primer spesifik untuk ekson1-
ekson2 dari gen aktin (actF dan actR), yang berukuran 450 pb (Gambar 4). Hasil ini menunjukkan bahwa daerah yang diamplifikasi adalah cDNA ekson1-ekson2 dan bukan ekson1-ekson2 dari DNA genom. Amplifikasi ekson1-ekson2 dari DNA genom akan menghasilkan pita dengan ukuran lebih besar dari 450 pb karena diantara ekson1 dan ekson 2 terdapat daerah intron. Pita yang menggunakan DNA genom sebagai cetakan akan menghasilkan pita berukuran 540 pb, karena adanya intron dengan ukuran 90 pb seperti pada kedelai (Shah et al., 1982).
M aktin
Gambar 4 Hasil elektroforesis PCR aktin dengan menggunakan cDNA sebagai cetakan
Teramplifikasinya cDNA dengan primer actF dan actR yang hanya berukuran 450 pb menunjukkan bahwa sintesis cDNA total melalui proses transkripsi balik telah berhasil dengan baik. Selain itu, hasil ini juga membuktikan bahwa RNA total yang telah diisolasi mempunyai kualitas yang sangat bagus, karena selain dapat digunakan untuk menyintesis cDNA juga terbebas dari kontaminasi DNA genom.
Isolasi Fragmen Gen Sitrat Sintase
PCR dengan cDNA total sebagai cetakan dan primer spesifik cspF dan cspR menghasilkan fragmen berukuran sekitar 900 pb (Gambar 5). Fragmen tersebut selanjutnya disebut MmFCS (Melastoma malabathricum Fragmen Citrate Synthase) yang merupakan kandidat fragmen gen penyandi itrat sintase dari M. malabathricum. Adanya DNA yang berukuran sekitar 900 pb yang dihasilkan oleh PCR menunjukkan bahwa sitrat sintase diekspresikan pada akar.
M MmFCS
Gambar 5 MmFCS hasil PCR dengan menggunakan cetakan cDNA 1.000 pb
Analisis MmFCS
Pengurutan MmFCS produk PCR menggunakan primer spesifik menunjukkan bahwa cDNA target berukuran 885 nukleotida (Gambar 1, Lampiran 1 dan Lampiran 2).
Gambar 6 Hasil pengurutan nukleotida dari fragmen MmFCS. Nukleotida yang terdapat di dalam kotak menunjukkan primer dan komplemen primer yang digunakan untuk isolasi MmFCS
Analisis kesejajaran lokal dengan BLASTn menunjukkan bahwa MmFCS mempunyai kesamaan sebesar 80% dengan bagian sitrat sintase dari Populus trichocarpa (XM_002330859.1) dan P. hybrid (X84227.1), 79% dengan bagian sitrat sintase dari Vitis vinifera (XM_002271415.1), Citrus sinensis (G0372880.1), Citrus junos (AY428532.1) dan Arabidopsis lyrata (XM_002880061.1) (Lampiran 3).
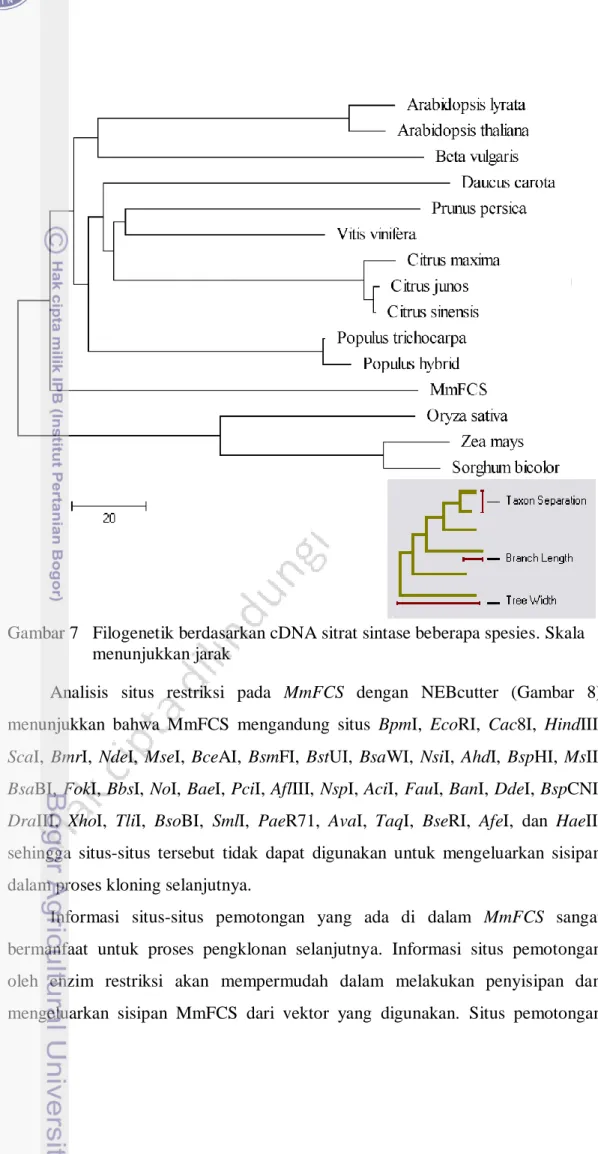
Berdasarkan urutan nukleotida MmFCS dari berbagai spesies maka dapat disusun sebuah pohon filogenetik yang didasarkan pada urutan nukleotida baik pada daerah terkonservasi maupun daerah tervariasi (Gambar 7). Persentase kesamaan antar nukleotida gen sitrat sintase dari berbagai spesies adalah antara 80,8% hingga 73,7% (Lampiran 4). Analisis kesejajaran MmFCS dengan gen sitrat sintase dari spesies lain disajikan pada Lampiran 5.
CTGTCACTGC TCATCCAATG ACTCAATTTG CATCTGGAGT GATGGCCCTT CAGGTTCAAA GTGAATTCCA GCAAGCTTAT GAAAAGGGTA TTGCTAAATC CAAGTACTGG GAACCAACAT ATGAAGATTC TCTTAATCTA ATTGCACGGC TTCCGTTGGT TGCTGCTTAT GTCTATCGGA GGATATATAA GGGAGGTCAA TCTGTCCCGG TTGATGATTC CTTGGATTAT GGAGCGAATT TCGCGCAAAT GTTAGGATTA GATGATCCGG TAATGCATGA GCTGATGAGA CTTTATGTCA CGATCCACAG CGATCATGAG GGTGGTAATG TCAGTGCACA CACTGGCCAT CTTGTTGCTA GTGCACTGTC AGATCCTTAT CTTTCATTTG CAGCTGCATT GAATGGTTTA GCTGGGCCAC TGCATGGGTT AGCTAATCAG GAGGTTCTGC TTTGGATAAA GTCTGTTGTG GATGAATGTG GAGAGAACAT TACAAAGGAA CAACTGAAGG ACTATGTTTG GAAGACACTG AATAGTGGCA AGGTGGTTCC GGGTTTTGGC CATGGCGTTC TTCGTAAAAC AGATCCCAGA TACACATGTC AGCGAGAATT TGCCCTGAAA CACCTTCCCA ATGACCCGCT TTTCCAGCTG GTTTCAAAGC TCTACGAAGT GGTGCCTCCT GTACTGACTC AGCTCGGAAA GGTCAAGAAC CCGTGGCCTA ATGTTGATGC ACACAGTGGA GTCCTGCTAA ATTATTTTGG TTTGACTGAA GCGAGGTATT ATACTGTCCT TTTCGGTGTC TCGAGGAGCA TCGGAATATG CTCCCAGCTG ATATGGGATA GAGCGCTAGG ATTGCCTTTG GAGAGGCCAA AGAGTGTTAC AATGG
Gambar 7 Filogenetik berdasarkan cDNA sitrat sintase beberapa spesies. Skala menunjukkan jarak
Analisis situs restriksi pada MmFCS dengan NEBcutter (Gambar 8) menunjukkan bahwa MmFCS mengandung situs BpmI, EcoRI, Cac8I, HindIII, ScaI, BmrI, NdeI, MseI, BceAI, BsmFI, BstUI, BsaWI, NsiI, AhdI, BspHI, MsII, BsaBI, FokI, BbsI, NoI, BaeI, PciI, AflIII, NspI, AciI, FauI, BanI, DdeI, BspCNI, DraIII, XhoI, TliI, BsoBI, SmlI, PaeR71, AvaI, TaqI, BseRI, AfeI, dan HaeII, sehingga situs-situs tersebut tidak dapat digunakan untuk mengeluarkan sisipan dalam proses kloning selanjutnya.
Informasi situs-situs pemotongan yang ada di dalam MmFCS sangat bermanfaat untuk proses pengklonan selanjutnya. Informasi situs pemotongan oleh enzim restriksi akan mempermudah dalam melakukan penyisipan dan mengeluarkan sisipan MmFCS dari vektor yang digunakan. Situs pemotongan
berguna dalam rekayasa gen yaitu dalam memotong urutan nukleotida tertentu dan menyambungkan kembali.
Gambar 8 Peta situs enzim restriksi yang terdapat dalam MmFCS
Deduksi asam amino dari nukleotida MmFCS ini menghasilkan 295 asam amino (Gambar 9). Analisis kesejajaran lokal berdasarkan urutan asam amino menggunakan BLASTp menunjukkan bahwa MmFCS memiliki kesamaan 99% dengan bagian sitrat sintase P. trichocarpa (XP_002330895.1), C. sinensis (ACU42176.1), C. junos (AAR88248.1), V. vinifera (XP_002271451.1), P. hybrid (CAA59009.1), Prunus persica (AAL11504.1), A. thaliana (AAM62868.1), B. vulgaris subsp.vulgaris (CAA59010.1), Sorghum bicolor (XP_002453470.1), Oryza sativa (AAG28777.1), N. tabacum (CAA59008.1) dan beberapa spesies yang lain (Lampiran 6). Kesamaan pada tingkat asam amino memiliki nilai lebih besar dibandingkan pada nukleotida. Hal ini disebabkan beberapa kodon dapat menyandikan asam amino yang sama. Kesamaan yang tinggi antara asam amino hasil deduksi MmFCS dengan asam amino sitrat sintase dari spesies lain memperkuat bukti bahwa MmFCS merupakan fragmen gen yang penyandi sitrat sintase. Hasil penyejajaran asam amino dari MmFCS dengan sitrat sintase dari spesies lain disajikan pada Lampiran 7.
Gambar 9 Deduksi asam amino dari MmFCS. Asam amino di dalam kotak adalah daerah penanda sitrat sintase.
Analisis Domain MmFCS
Sitrat sintase terdiri dari 2 domain, yaitu sebuah domain alfa-helik besar (inter-subunit contact) dan sebuah alfa-helik domain kecil (bagian katalitik) (Arnott et al.,2000, Larson et al., 2009). Urutan deduksi dari 295 asam amino MmFCS memiliki residu-residu yang diperlukan sebagai domain katalitik, yaitu 3 residu catalytic triad, 11 residu oxaloacetate binding site,18 residu coenzyme A binding site dan 14 residu cytrilcoA binding site (Gambar 10). Empat macam situs tersebut adalah situs utama sekaligus penanda sitrat sintase sesuai dengan yang dijelaskan oleh Roccatano et al. (2001). Ketiga binding site di atas sangat penting karena merupakan tempat penempelan substrat dan juga produk. Catalytic triad adalah 3 asam amino kunci yang berada di dalam situs aktif sitrat sintase, yaitu His274, His320 dan Asp375, berada pada asam amino ke 142, 187 dan 243. Situs aktif mutlak diperlukan di dalam suatu enzim, supaya dapat mengkatalis proses perubahan substrat menjadi produk.
Gambar 10 Domain terkonservasi yang berada pada MmFCS
1 VTAHPMTQFA SGVMALQVQS EFQQAYEKGI AKSKYWEPTY EDSLNLIARL 51 PLVAAYVYRR IYKGGQSVPV DDSLDYGANF AQMLGLDDPV MHELMRLYVT 101 IHSDHEGGNV SAHTGHLVAS ALSDPYLSFA AALNGLAGPL HGLANQEVLL 151 WIKSVVDECG ENITKEQLKD YVWKTLNSGK VVPGFGHGVL RKTDPRYTCQ 201 REFALKHLPN DPLFQLVSKL YEVVPPVLTQ LGKVKNPWPN VDAHSGVLLN 251 YFGLTEARYY TVLFGVSRSI GICSQLIWDR ALGLPLERPK SVTMX
Hasil analisis domain dengan menggunakan program scan pada Prosite menunjukkan bahwa terdapat sekuen penanda atau penciri bagi enzim sitrat sintase yang terdapat pada asam amino ke 194-206 (Gambar 9).
Daerah penanda sitrat sintase dari hasil scanning pada Prosite selanjutnya digunakan sebagai acuan untuk membandingkan dengan urutan asam amino sitrat sintase dari spesies lainnya. Hasil penyejajaran asam amino deduksi MmFCS dan beberapa asam amino dari spesies lain menunjukkan bahwa penanda sitrat sintase dari beberapa spesies tersebut juga mengikuti konsensus G-[FYAV]-[GA]-H -x - [IV]-x(1,2)-[RKTQ]-x(2)-[DV]-[PS]-R (Gambar 11). Penanda sitrat sintase ini memiliki konsensus yang sama untuk prokariot dan juga eukariot. Urutan nukleotida yang menyandikan daerah penanda sitrat sintase terdapat pada nukleotida antara posisi 549 sampai dengan 588 (Lampiran 6).
Gambar 11. Urutan asam amino sitrat sintase dari berbagai spesies. Asam amino di dalam kotak adalah daerah.
Analisis Hidrofobisitas
Analisis hidrofobisitas telah dilakukan dengan metode Kyte and Doolittle (1982). Analisis pola hidrofobisitas sitrat sintase utuh dari P. trichocarpa dan analisis perbandingan pola hidrofobisitas yang dibentuk oleh MmFCS dan bagian dari sitrat sintase P. trichocarpa. Analisis hidrofobisitas menunjukkan bahwa MmFCS, sitrat sintase P. trichocarpa utuh dan fragmennya bersifat hidrofilik (Gambar 12, Gambar 13). Hal ini sesuai dengan sifat sitrat sintase yang larut di dalam air serta di dalam reaksinya memerlukan air untuk merubah oksaloasetat dan asetil-KoA menjadi sitrat. Pola hidrofobisitas dengan bagian tengah sampai belakang dari sitrat sintase utuh P. trichocarpa dan MmFCS adalah sama (Gambar 13)
. .
Gambar 12 Profil hidrofobisitas sitrat sintase utuh P. trichocarpa. Kurva di atas 0 pada sumbu x menunjukkan sifat hidrofobik dan di bawah 0 bersifat hidrofilik
Gambar 13 Perbandingan hidrofobisitas antara MmFCS dengan fragmen sitrat sintase P. trichocarpa. Kurva di atas 0 pada sumbu x menunjukkan sifat hidrofobik dan di bawah 0 bersifat hidrofilik.
Fragmen CS P. trichocarpa berwarna merah
MmFCS berwarna biru
KESIMPULAN DAN SARAN
Kesimpulan
cDNA fragmen gen penyandi sitrat sintase dari M. malabathricum telah berhasil diisolasi yang berukuran 885 pb dan menyandi 295 asam amino. Berdasarkan BLASTn MmFCS memiliki kesamaan nukleotida sebesar 80% dengan bagian sitrat sintase dari : P. trichocarpa (XM_002330859.1) dan P. hybrid (X84227.1), 79% dengan V. vinifera (XM_002271415.1), C. sinensis (G03 72880.1), C. junos (AY428532.1) dan A. lyrata (XM_002880061.1). Berdasarkan urutan asam amino yang dideduksi dari cDNA, MmFCS memiliki kesamaan sebesar 99% dengan bagian sitrat sintase P. trichocarpa (XP_002330895.1), C. sinensis (ACU42176.1), C. junos (AAR88248.1), V. vinifera (XP_002271451.1), P. hybrid (CAA59009.1), P. persica (AAL11504.1), A. thaliana (AAM62868.1), B. vulgaris (CAA59010.1) S. bicolor (XP_002453470.1), O. sativa (AAG287 77.1), dan N. tabacum (CAA59008.1).
Saran
Untuk mengetahui kesamaan dan peran MmFCS dari M. malabathricum dengan spesies lain, cDNA dari gen MmCS yang utuh harus diisolasi. MmFCS dapat digunakan sebagai dasar desain primer untuk isolasi cDNA MmCS utuh menggunakan metode RACE (rapid amplified cDNA end). MmFCS perlu diklon ke dalam vektor untuk penyimpanan, perbanyakan dan analisis selanjutnya.
Ucapan Terimakasih
Terimakasih disampaikan kepada Hibah Kompetensi dari Ditjen Pendidikan Tinggi (DIKTI), Kementrian Pendidikan Nasional dengan judul “Isolasi dan ekspresi gen dalam rangka perakitan tanaman terhadap cekaman asam dan aluminium” dan JSPS-DGHE Joint Research Project dengan judul “Molecular adaptation of Jatropha curcas to acid soil for reforestation of tropical wasteland” atas nama Dr. Suharsono yang telah membiayai penelitian ini. Terimakasih juga disampaikan kepada Nara Institute of Science and Technology (NAIST) Jepang, untuk fasilitas pengurutan DNA (DNA sequencing).
DAFTAR PUSTAKA
Anoop VM, Basu U, McCammon MT, McAlister-Henn L, Taylor GJ. 2003. Modulation of citrate metabolism alters aluminum tolerance in yeast and transgenic canola overexpressing a mithocondrial citrate synthase. Plant Physiol 132:2205-2217.
Arnott MA, Michael RA, Thompson CR, Hough DW, Danson MJ. 2000. Thermostability and thermoactivity of citrate synthase from the thermophilic and hyperthermophilic archaea, Thermoplasma acidophilum and Pyrococcus furiosus. J Mol Biol 304(4):657-668.
Barone P et al. 2008. Bacterial citrate synthase expression and soil aluminum tolerance in transgenic alfafa. Plant Cell Rep 27:893-901.
BPS. 2010. Distribusi persentase luas dan penduduk menurut pulau.
http://www.datastatistik-indonesia.com/component/ option,com_tabel/
kat,1/idtabel,1110/Itemid,165/ [2 Juli 2010]
Campbell NA, Reece JB, Mitchell LG. 2002. Biologi. Edisi Kelima. Jilid 1. Jakarta: Penerbit Erlangga. Hlm 169. Terjemahan dari : Biology, fifth edition.
de la Fuente JM, Ramirez-Rodriguez V, Cabrera-Ponce JL, Herrera-Estrella. 1997. Aluminum tolerance in transgenic plants by alteration of citrate synthase. Science 276:1566-1568.
Delhaize E, Ryan PR, Randall PJ. 1993. Aluminum tolerance in wheat (Triticum aestiveum L.). II. Aluminum-stimulated excretion of malic acid from root apices. Plant Physiol 103:695-702.
Delhaize E dan Ryan PR. 1995. Aluminum toxicity and tolerance in plants. Plant Physiol 107:315-321.
Fauziah TD. 2009. Isolasi dan karakterisasi cDNA gen penyandi Metallothonein tipe 2 dari Melastoma malabathricum. [Skripsi]. Bogor : Program Studi Biologi, Fakultas Matematika dan IPA, Institut Pertanian Bogor.
Foy CD, Chaney RL, White MC. 1978. The physiology of metal toxicity in plant. Ann Rev Plant Physiol 29:511-566.
Hadisunarso. 2009. Konstruksi pustaka genom Harendong (Melastoma malabathricum L.) [Tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
Hue N.V, Craddock G.R, Adams F. 1986. Effect of organic acids on aluminum toxicity in subsoil. Soil Sci Sac Am J 50:28-34.
Jansen S, Watanabe T, Smets E. 2002. Aluminum accumulation in leaves of 127 species in Melastomataceae, with comments on the order Myrtales. Ann Bot 90:53-64.
Kasim N. 2000. Eksudasi dan akumulasi asam organik pada beberapa kedelai (Glycine max (L.) Merr.) genotipe toleran aluminium [Tesis]. Bogor : Program Pascasarjana, Institut Pertanian Bogor.
Kawazu et al. 2003. Overexpression of mitochondrial citrate synthase in Eucalyptus trees improved growth when cultured by Al phosphate as a sole phosphate source. Plant Cell Physiol 44:91-98.
Kochian LV. 1995. Cellular mechanism of aluminum toxicity and resistance in plants. Annu Rev Plant Physiol Mol Biol 46:237-260.
Koyama H et al. 2000. Overexpression of mithocondrial citrate synthase in Arabidopsis thaliana improved growth on a phosphorus-limited soil. Plant Cell Physiol 41(9):1030-1037.
Kyte J, Doolittle RF. 1982. A simple method for displaying the hydrophobic character of a protein. J Mol Biol 157:105-142.
La Cognata U, Landschütze V, Willmitzer L, Müller-Röber B. 1996. Structure and expression of mitochondrial citrate synthase from higher plants. Plant Cell Physiol 37:1022-1029.
Larson SB, Day JS, Nguyen C, Cudney R, McPherson A. 2009. Structure in pig heart citrate synthase at 1.78 Å resolution. Acta Cryst F65:430-434.
Ma JF, Hiradate S, Matsumoto H. 1998. High aluminum resistance in buckwheat. II. Oxalic acid detoxifies aluminum internally. Plant Physiol 117: 753-759. Ma JF, Hiradate S, Nomoto K, Iwoshita T, Matsumoto H. 1997 Internal
detoxification mechanism of Al in hydrangea: identification of Al forms in the root apices. Plant Physiol 113:1033-1039.
Manchester KL. 1996. Use of UV methods for measurement of protein and nucleic acid concentrations. Bio Tech 20:968-970.
Marschner H. 1995. Mineral Nutrition of Higher Plant. 2nd Ed. London: Academic Press Harcourt Brace & Company.
Matsumoto H, Hiraseva E, Morimura S, Takahashi E. 1976. Localization of aluminum in tea leaves. Plant Cell Physiol 17:627-631.
Matsumoto H, et al.. 1988. Inhibition of proton transport activity of microsomal membrane vesicles of barley root by aluminum. Soil Sci Plant Nutr 34:499-506.
Matsumoto H. 1991. Biochemical mechanism of the toxicity of aluminum and sequestration of aluminum in plant cell. Plant Physiol 21: 825-838.
Miyasaka SC, Buta JG, Howell RK, Foy CD. 1991. Mechanisms of aluminum tolerance in snapbeans. Root exudation of citric acid. Plant Physiol 96:737-43.
Muhaemin. 2008. Analisis pertumbuhan Melastoma (Melastoma malabathricum auct. Non L. dan M.affine D.Don yang mendapat cekaman pH rendah dan aluminium [Tesis]. Bogor : Program Pascasarjana, Insitut Pertanian Bogor. Muzuni, Sopandie D, Suharsono UW, Suharsono. 2010. Isolasi dan pengklonan
framen gen penyandi H+-ATPase membran plasma dari Melastoma malabathricum L. J Agr Ind 38(1):67-74.
Osaki M et al. 1998. Nutritional characteristics in leaves of native plants grown in acid sulfate peat, sandy podzolic, and saline soils distributed in Peninsular Thailand. Plant Soil 201:175-182.
Osaki et al. 2003. Nutritional characteristic of the leaves of native plants growing in adverse soils of humid tropical lowlands. Plant Foods for Human Nutrition 58:93-115.
Pellet DM , Papernik LA, Kochian LV. 1996. Multiple aluminum-resistance mechanism in wheat. Roles of root apical phosphate and malate exudation. Plant Physiol 112:591-597.
Prasetyo BH, Suriadikarta DA. 2006. Karakteristik, potensi dan teknologi pengelolaan tanah ultisol untuk pengembangan pertanian lahan kering di Indonesia. J Lit Pert 25(2):39-47.
PROSEA. 2010. Melastoma malabathricum Linn. SP.pl.1 : 390 (1753)
Roccatano D, Mark AE, Hayward S. 2001. Investigation of the mechanism of domain closure in citrate synthase by molecular dynamics simulation. Mol Biol 310:1039-1053.
Ryan PR, Delhaize E, Randall PJ. 1995. Malate efflux from root apices and tolerance to aluminum are highly correlated in wheat. Plant Physiol 22:531-536.
Ryan PR, Ditomoso JM, Kochian LV. 1993. Aluminum toxicity in roots: An investigation of spatila sensitivity and the role of the root cap. J Exp Bot 44:437-446.
Ryan PR, Skeret M, Findlay GP, Delhaize E, Tyerman SD. 1997. Aluminum activates an anion channel in the apical cells of wheat roots. Proc Natl Acad Sci 94:6547-6552.
Shah DM, Hightower RC, Meagher RB. 1982. Complete nucleotide sequence of a soybean actin gene. Proc Natl Acad Sci 79:1022-1026.
Subagyo H, Suharta N, Siswanto AB. 2004. Tanah-tanah pertanian Indonesia. Dalam: Prasetyo BH, Suriadikarta DA. Karakteristik, potensi dan teknologi pengelolaan tanah ultisol untuk pengembangan pertanian lahan kering di Indonesia. J Lit Pert 25(2):39-47.
Suharsono, Firdaus S. Suharsono UW. 2008. Isolasi dan pengklonan fragmen cDNA dari gen penyandi multidrug resistance associated protein dari Melastoma affine. Makara Sains 12(2):102-107.
Suharsono, Trisnaningrum N, Sulistyaningsih LD, Widyastuti U. 2009. Isolation and cloning of cDNA of gene encoding for metallothionein type 2 from Melastoma affine. Biotropia 16(1):28-37.
Takita et al. 1999. Structure and expresson of the mitochondria citrate synthase gene in carrot cells using utilizing Al-phosphate. Soil Sci Plant Nutr 45:197-205.
Taylor GJ. 1991. Current views of the aluminum stress respons; the pshyological basis of tolerance. Curr Top Plant Biochem Physiol 10:57-93.
Unger EA, Hand JM, CashmoreAR, Vasconcelos AC. 1989. Isolation of a cDNA encoding mitochondrial citrate synthase from Arabidopsis thaliana. Plant Mol Biol 13:411-418.
Watanabe T, Osaki M, Tadano T. 1997. Aluminum_induced growth stimulation in relation to calcium, magnesium, and silicate nutrition in Melastoma malabathricum L. Soil Sci Plant Nutr 43(4):827-837.
Watanabe T, Osaki M, Yoshihara T, Tadano T. 1998. Distribution and chemical speciation of aluminum in the al accumulator plant, Melastoma malabathricum L. Plant and Soil 210:165-173.
Watanabe T, Osaki M. 2001. Influence of aluminum and phosphorus on growth and xylem sap composition in Melastoma malabathricum. Plant and Soil 273:63-70.
Watanabe T, Osaki M. 2002. Mechanism of adaptation to high aluminum condition in native plant species growing in acid soils: a review. Soil Sci Plant Anal 33(7&8):1247-1260
Watanabe T, Jansen S, Osaki M. 2005a. The beneficial effect of aluminum and the role of the citrate in al accumulation in Melastoma malabathricum. New Phytologist 165:773-780.