Kode/Nama Rumpun Ilmu
: 362 / Bidang Kesehatan Umum Lain yang belum tercantum Tema : Kesehatan, penyakit tropis, gizi
dan obat-obatan
LAPORAN
PENELITIAN STRATEGIS NASIONAL
LAMA WAKTU KOLONISASI
LACTOBACILLUS
SP F213 PADA
SALURAN PENCERNAAN DIANALISIS MENGGUNAKAN
SIDIK DNA MIKROBIOMIK FESES DALAM PENGEMBANGAN
PROBIOTIK UNTUK MENURUNKAN KOLESTEROL
Ketua/Anggota Tim
Ir. I Nengah Sujaya, M.Agr.Sc., Ph.D.
NIDN: 00312 6651 (Ketua)
Drs. Yan Ramona, M.App.Sc, Ph.D.
NIDN: 0022106401 (Anggota)
Ir. K. Ayu Nocianitri, M.Agr.Sc.
NIDN: 0008036801 (Anggota)
HALAMAN PENGESAHAN
Judul Penelitian : Lama waktu kolonisasi Lactobacillus sp F213 pada saluran pencernaan dianalisis menggunakan sidik DNA mikrobiomik feses dalam pengembangan probiotik untuk menurunkan kolesterol
Tema Isu Stragtegis Nasional : Kesehatan, Penyakit Tropis, Gizi dan Obta-obatan (Health, Tropocal Diseases, Nutrition and Medicine)
Kode/Nama Rumpun Ilmu : 363/Bidang Kesehatan Umum Lain yang Belum Tercantum
Peneliti / Pelaksana
Prof. Dr. Ir. I Nyoman Gede Antara, M.Eng. NIP/NIK : 196408071992031002
Ketua Peneliti
RINGKASAN
Penyakit tidak menular akibat pola makan dan gaya hidup seperti penyakit jantung koroner (PJK) dan tekanan darah tinggi semakin meningkat di Indonesia. Diperkirakan sebanyak 150 orang dalam 10.000 penduduk meninggal akibat PJK. Oleh karena itu diperlukan upaya-upaya pemanfaatan biodivesitas Indonesia guna menurunkan PJK. Penelitian ini secara umum bertujuan untuk mengembangkan probiotik endogen Indonesia dalam pencegahan PJK melalui penurunan dan atau pengendalian kandungan kolesterol darah. Secara khusus, pada tahun pertama penelitian ini bertujuan untuk mengembangkan sistem deteksi spesifik untuk melancak kolonisasi dan populasi Lactobacillus sp F213 pada saluran pencernaan manusia, melalui pendekatan berbasis DNA mikrobiomik pada feses. Pengembangan sekuen pelacak khusus Lactobacillus sp F213 didasarkan pada susunan nukleotida pada bagian intrageneic spacer region (IGS) pada rDNA Lactobacillus sp F213 atau sekuen pita khusus yang diperoleh dari random amplified DNA polymorphism (RAPD).
Pada tahap pengembangan pendeteksi khusus ini dilakukan PCR terhadap IGS
Lactobacillus sp F213 yang dibandingkan dengan Lactobacillus rhamnosus, Pediococcus spp, serta strain dari kelompok non-bakteri asam laktat. Hasil penelitian menujukkan bahwa Lactobacillus sp F213 mempunyai panjang IGS yang spesifik, berbeda dengan L rhamnosus, Pediocoocus serta strain non-BAL, namun demikian IGS Lactobacillus sp F213, L rhamanosus, dan Pediococcus spp menunjukkan pita ganda / 2 buah IGS dengan panjang yang berbeda.
Lactobacillus sp F213 mempunayi dua buah IGS dengan susunan nukleotda yang berbeda. Homologi yang dilakukan pada GenBank menunjukkan bahwa IGS tipe I mempunyai panjang 290bp dan menunjukkan homologi sebesar 97%
( 283/290bp) dengan Weissella confusa 16S rRNA and 23S (AY342323|AY342323.1).
Sementara IGS tipe II dari LbF213 mempunyai ukuran 298bp dengan homologi
260/283bp (91%), W. confusa 16S rRNA and 23S sebesar >AY342323|AY342323.1.
Adanya sekuen nukleotida dengan variasi yang tinggi dibandingkan dengan galur menyebabkan bagian IGS ini merupakan target yang baik untuk alat deteksi spesifik (primer dan probe spesifik). Beberapa primer telah dirancang dan diuji dan diperoleh primer bahwa B2FR mempunyai spesifisitas yang baik. Probe spesifik LbF213P juga sudah didesign dan dilabel dengan label flourescens dengan satu set primer spesifik untuk pengujian RT-PCR. Spesifisitas primer B2FR dapat mendeteksi 1.400 sel yang
setara dengan 3,4 pmol (3 x 10-9 gr) DNA. Hasil penelitian ini menunjukkan bahwa
primer B2FR dapat dipergunakan untuk mendeteksi Lactobacillus sp F213 pada feses
PRAKATA
Puji syukur kami panjatkan, karena atas rachmat-Nya laporan ini dapat diselesaikan.
Laporan ini merupakan capaian dari serangkaian rencana penelitian pada tahun 2015.
Tim peneliti mengucapkan terimakasih kepada Dirjen DIKTI melalui Litabmas, yang
telah membiayai penelitian ini, Ketua Lembaga Penelitian dan Pengabdian Kepada
Masyarakat, Univ. Udayana yang telah memfasilitasi dari pengusulan proposal sampai
pada pencairan dana. Pada laporan ini, masih banyak hal yang belum tercapai,
sehingga peneliti akan bekerja keras untuk merampungkan penelitian tahun pertama
ini sesuai kontrak yang etlah disepakati.
Semoga laporan ini bermanfaat bagi kita semua.
Bukit Jimbaran, 8 Nopember 2015
DAFATR ISI
Halaman
HAL PENGESAHAN --- ii
RINGKASAN --- iii
PRAKATA --- iv
DAFTAR ISI --- v
DAFTAR GAMBAR --- vi
DAFTAR TABEL --- vii
BAB I. Pendahuluan --- 1
BAB II. Tinjauan Pustaka --- 5
BAB III. Metode --- 12
BAB IV. Hasil dan Pembahasan --- 17
BAB V. Simpulan --- 31
DAFTAR PUSTAKA --- 32
DAFTAR GAMBAR
Halaman
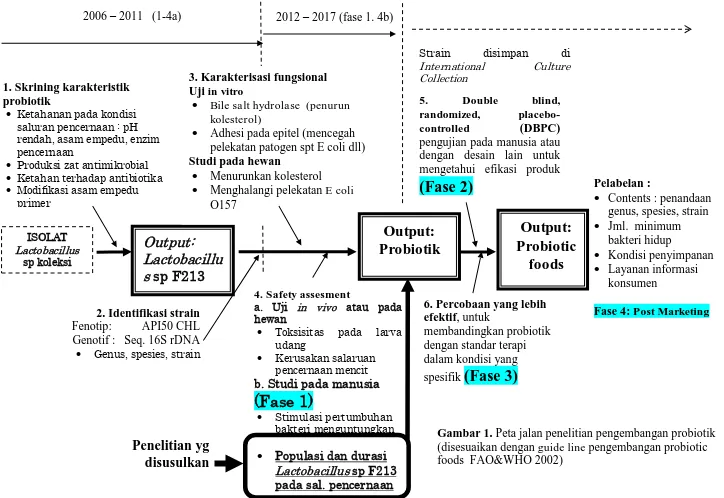
Gambar 1 Peta jalan penelitian pengembangan probiotik (disesuaikan dengan guide line pengembangan probiotic foods
FAO&WHO 2002)
11
Gambar 2 Ilustrasi target gen sebagai strategi dalam pengembangan sistem deteksi molekuler Lactobacillus sp F213.
12
Gambar 3 Ilustrasi design primer/probe dari seukuen IGS
Lactobacillus sp F213
14
Gambar 4A Morfologi koloni Lactobacillus sp F213 pada media MRS agar
17
Gambar 4B Morfologi mikroskopik Lactobacillus sp F213 pada media MRS both
17
Gambar 5 Genomik DNA dari Lactobacillus sp F213 18 Gambar 6A Hasil PCR IGS Lactobacillusrhamnosus, Lactobacillus sp
F213, Pedioccocus spp, dan non LAB (isolat B3).
29
Gambar 6B Optimasi PCR dengan termal gradient. 20 Gambar 7 Panjang IGS Lactobacillus sp F213, L. rhamnosus
SKG34 dan Pediococcus spp.
21
Gambar 8 Teknik elusi DNA dengan memberikan muatan magnetik 22 Gambar 9
IGS dari Lactobacillus sp F213, L rhamnosus SKG34 dan hasil PCR pita tunggal dari Lactobacillus sp F213 dan L rhamnosus SKG34
Spesifisitas primer spesifik IGS LbF213.
Spesifisitas primer B2FR terhadap beberapa species bakteri asam laktat dan non-bakteri asam laktat.
Spesifisitas primer B2FR terhadap DNA feses.
Deteksi LbF213 pada DNA feses dengan primer B2FR.
DAFTAR TABEL
Halaman
Tabel 1 Primer yang dipergunakan untuk RAPD 15
Tabel 2 Tabel 2. Sekuen primer yang dipakai pada PCR IGS
Lactobacillus sp F213
19
Tabel 3 . Susuan primer spesifik yang untuk mendeteksi
BAB I. PENDAHULUAN
Latar Belakang
Modernisasi memberikan andil pada pergeseran pola makan masyarakat dari
makanan tradisional berserat tinggi ke makanan gaya barat dengan lemak tinggi dan
rendah serat. Konsumsi makanan dengan kandungan asam lemak jenuh (asal hewani)
yang tinggi merupakan salah satu faktor resiko penyebab penyakit jantung koroner
(PJK), pembunuh nomor satu di dunia, sebagai akibat penimbunan kolesterol pada
pembuluh darah. Data WHO menunjukkan bahwa pada tahun 2002 diperkirakan PJK
menyebabkan 7 juta kematian di seluruh dunia dan pada tahun 2020 diperkirakan
akan naik menjadi 11 juta jiwa. Dan di Indonesia diperkirakan 150 orang dalam
10.000 penduduk meninggal akibat PJK (Anon, 2008).
Pembentukan asam empedu merupakan mekanisme utama untuk
megekskresikan kolesterol dari tubuh. Garam empedu (tauro-kolat dan gliko-kokolat)
merupakan produk antara metabolisme kolesterol. Hidrolisis garam empedu oleh
mikroorganisme saluran pencernaan yang mempunyai enzim bile salt hidrolase
(BSH) menghasilkan taurin atau glisin serta asam empedu bebas. Asam empedu
bebas ini berisfat tidak larut dan tidak direabsorbsi tubuh sehingga akan
diekskresikan melalui feses (Kurdi et al., 2000). Semakin banyak asam empedu yang dibuang melalui siklus enterohepatik semakin banyak pula kolesterol darah
digunakan untuk sintesis asam empedu baru (Brisson, 1981).
Penurunan kolesterol darah dilaporan dapat dilakukan dengan mengkonsumsi
susu terfermentasi oleh Lactobacillus (Agerbaek et al., 1995; Bertolami et al, 1999; Larsen et al, 2000; Schaafsma et al., 1998), walaupun secara mekanistik belum diketahui secara pasti bagaiaman Lactobacillus berperan dalam proses ini di dalam tubuh (De Rose dan Katan, 2000). Dari serangkaian hasil penelitian in vitro, diduga bahwa mekanisme penurunan kolesterol oleh Lactobacillus dan Bifidobacterium
meliputi efek fisiologis dari asam lemak rantai pendek (short chain fatty acids) dalam saluran pencernaan (Kurdi et al, 2000; 2003), asimilasi kolesterol oleh Lactobacillus
kolesterol pada permukaan sel Lactobacillus dan Bifidobacterium (Lin dan Cheh, 2000) serta dekonjugasi enzimatis garam empedu oleh Lactobacillus dan
Bifidobacterium (Tahri et al., 1985; Tahri et al., 1996).
Mengingat bahaya dari kandungan kolesterol yang terlalu tinggi pada darah
sebagai penyebab utama penyempitan pembuluh darah dan PJK sementara di terapi
medis yang dilakukan dengan mempergunakan obat-obatan yang sangat mahal, maka
dipandang perlu dilakukan penelitian untuk menggali potensi mikrobial alam
Indonesia guna menanggulangi masalah kolesterol dan PJK. Probiotik merupakan
salah satu pilihan yang menjanjikan.
Serangkaian penelitian untuk mengembangkan probiotik telah dilakukan
secara in vitro dan in vivo. Penelitian in vitro dari aspek ketahan pada kondisi saluran pencernaan meliputi ketahan Lactobacillus sp F213 pH rendah, enzim pencernaan, dan asam empedu. Dari aspek keamanan meliputi bahwa Lactobacillus sp F213 tidak melakukan transformasi asam empedu primer (tidak memicu kolon kanker), tidak
menyebabkan kerusakan pada saluran pencernaan, sifat tidak beracun (tidak me-lisis
sel darah meras) serta Lactobacillus sp F213 tidak akut pada larva udang. Aspek fungsional meliputi kemampuan Lactobacillus sp F213 melekat pada epitel saluran pencernaan mencit untuk mencegah diare dan stimulasi sistem imun serta
Lactobacillus sp F213 mampu menghidrolsisi garam empedu sebagai potensi dalam menurunkan kolesterol darah. Potensi in vitro telah teruji dalam penelitian in vivo seperti kemampuan berkompetisi untuk melekat apda saluaran pencernaan mencit
yang diinfeksi dengan E coli O157, sehingga Lactobacillus sp F213 berpotensi untuk mencegah diare (Sujaya et al. 2010); Lactobacillus sp F213 mampu bertahan dalam saluran pencernaan tikus putih (Nocianitri et al., 2010) dan menurunkan 35% dari
total kolesterol tikus (Nursini et al., 2010). Penelitian pada subjek manusia
menujukkan bahwa Lactobacillus sp F213 terdeteksi pada sidik DNA mikrobiomik feces, serta dapat menurunkan 6,29% kolesterol dan dapat menurunkan TNF alfa
sebanyak 35,87% (dari 9,2 pg menjadi 0,59 pg, sebelum dan setelah pemberian
meningkatkan kenyamanan buang air besar (mencegah konstipasi) (Sujaya et al.,
2012, 2013).
Rumusan Masalah
Setelah melakukan serangkaian penelitian untuk mengembangankan Lactobacillus sp F213 sebagai probiotik dengan potensi dapat menurunkan kolesterol, serta
berdasarkan persyaratan WHO bahwa probiotik adalah mikroorganisme hidup yang
dikonsusmsi dan dapat memberikan manfaat kesehatan bagi host, maka probiotik harus mampu bertahan dan berkembang biak pada saluran pencernaan. Oleh karena
itu, rumusan masalah dalam penelitian ini adalah :
Apakah Lactobacillus sp F213 dapat tumbuh pada saluran pencernaan dan berapakah populasi Lactobacillus sp F213 pada feses?
Berapa lamakah Lactobacillus sp F213 dapat berada pada saluran pencernaan manusia sehat ?
Bagaimankan efek pemberian Lactobacillus sp F213 terhadap profile lipid darah subjek yang diberikan Lactobacillus sp F213 ?
Tujuan Penelitian
Tujuan Umum :
Penelitian ini bertujuan untuk mengembangkan probiotik endogen Indonesia
dalam pencegahan PJK melalui penurunan dan atau pengendalian kandungan
kolesterol darah.
Tujuan khusus penelitian :
Untuk mengembangkan metode deteksi spesifik yang dapat diperguankan untuk diagnostik Lactobacillus sp F213 pada saluran pencernaan ?
Untuk mengetahui lama waktu kolonisasi dan populasi Lactobacillus sp F213 pada saluran pencernaan (feses)?
Manfaat khusus:
Manfaat dari penelitian ini adalah, secara teoritis, dapat menjelaskan
bagaimana prilaku (aktivitas) dan pengaruh Lactobacillus sp F213 terhadap kesehatan saluran pencernaan serta profile lipid pada darah.
Manfaat aplikasinya adalah dapat menjadi salah satu pilihan dalam terapi biologis dalam penanggulangan masalah kolesterol darah dan berkontribusi
BAB II. STUDI PUSTAKA
Kasus Penyakit Jantung Koroner
Penyakit jantung koroner (PJK) telah menjadi penyebab utama kematian di dunia
dewasa ini. Badan Kesehatan Dunia (WHO) mencatat lebih dari 7 juta orang
meninggal akibat PJK di seluruh dunia pada tahun 2002. Angka ini diperkirakan
meningkat hingga 11 juta orang pada tahun 2020. Di Indonesia, kasus PJK semakin
sering ditemukan karena pesatnya perubahan gaya hidup. Meski belum ada data
epidemiologis pasti, angka kesakitan/kematiannya terlihat cenderung meningkat.
Hasil Survei Kesehatan Nasional tahun 2001 menunjukkan 3 dari 10.000 penduduk
Indonesia menderita PJK (Anon., 2008).
Penyakit jantung koroner (PJK) terjadi karena penyempitan/ penyumbatan
pembuluh darah koroner yang berfungsi mendistribusikan darah dan oksigen ke otot
jantung. Penyumbatan (plak aterosklerosis) disebabkan tertumpuknya endapan lemak
(terutama kolesterol LDL), sel-sel otot polos pembuluh darah dan matriks
ekstraseluler lainnya di sepanjang dinding arteri sebagai hasil proses yang
berlangsung bertahun-tahun. Jika aliran darah berkurang secara bermakna, maka
penderita perlu segera mendapat tindakan medis. Karena pentingnya penyakit ini dan
kecendrungan peningkatan kasus dari tahun ke tahun maka telah diterbitkan pedoman
teknis penemuan dan penatalaksanaan penyakit hipertensi yang merupakan salah satu
faktor resiko dari PJK (Anon 2006, Depkes)
Kejadian PJK bervariasi antar negara dan lebih umum terjadi di negara-negara
industrialis sehingga penyakit ini juga dipandang sebagai akibat gaya hidup dan pola
makan. Western diet dengan kandungan lemak jenuh tinggi cenderung berasosiasi
pada PJK. Di Inggris (UK) ditemukan bahwa 27% kematin disebabkan oleh PJK serta
12% disebabkan oleh strok, walaupun mortality rate PJK bervariasi antar negara.
Mortality rate PJK ii Jepang dilaporkan sebesar 15 per 100.000 penduduk, sementara di Finland sebanyak 198 per 100.000 penduduk (Marila-Sandholm dan Saarela, 2003).
Beberap studi epidemiologi menunjukkan bahwa ada korelasi positif antara
kandungan kolesterol khususnya low dencity lippprotein (LDL) dengan PJK. Akumulasi LDL pada plasma menyebabkan penumpukan kolesterol pada dinding
pembuluh darah arteri, proses yang berhubungan dengan oksidasi LDL. LDL
teroksidasi akan diambil oleh makrofag yang segera menjadi gelembung sel yang
merupakan plak awal. Sehingga diperkirakan setiap kenaikan 1% LDL kolesterol
setara dengan peningkatan 2-3% resiko PJK (Lovegrove dan Jackson, 2003). Tetapi
sebaliknya, high dencity lipoprotein (HDL) memberikan efek yang berlawanan dengan LDL terhadap resiko PJK sehingga HDL dianggap sebagai kolesterol baik.
Kolesterol merupakan penyebab utama hipertensi dan PJK, oleh karena itu
dalam penatalaksanaan PJK dan hipertensi kadar kolesterol dalam serum menjadi
salah satu acuan. Individu dengan kandungan kolesterol darah 8.0 mmol/lt dan atau
triasil gliserol di atas 3.0 mmol/lt tidak hanya memerlukan modifikasi diit tetapi juga
disarankan mengkonsumsi obat penurun kandungan lemak dalam darah untuk
membantu menurunkan faktor resiko PJK dan hipertensi. Pemberian obat yang ada
efektif pada beberapa hal yaitu: menurunkan sintesis very low dencity lippprotein
(VLDL) dan LDL, meningkatkan penghilangan VLDL, meningkatkan penghilangan
LDL dan penghambatan enzim hidroksi metil glutaril CoA reduktase
(Martilla-Sandholm dan Saarela, 2003).
Sintesis dan metabolisme kolesterol merupakan jalur metabolik utama dalam
penaggulangan PJK. Kolesterol homeostatis dipelihara dalam tubuh mamalia melalui
pengaturan tiga jalur metabolisme. Dua jalur metabolik adalah bagaimana mensuplai
kolesterol ke dalam sel yang meliputi endogenus sintesis kolesterol dari prekursornya
(asetat) dan eksogenus sintesis dimana LDL yang merupakan pembawa kolesterol
pada darah (Ramirez et al., 1994). Ketiga jalur metabolik adalah konversi kolesterol yang melibatkan konversi kolesterol menjadi asam empedu. Kelainan pada regulasi
metabolisme kolesterol berimplikasi pada penyakit karena jalur metabolisme utama
dalam ekskresi kolesterol pada mamalia adalah melalui pembentukan asam empedu.
atherosclerosis, gallstone diseases, dan penyakit selain pada penyimpanan lemak
(Ramirez et al., 1994).
Empedu merupakan produk utama metabolisme kolesterol yang tersimpan di
dalam kantung empedu yang terdiri dari asam empedu, kolesterol, pospolipid dan
pigmen bilirubin. Empedu disintetsis dalam sel hati dan akan disekresikan ke usus
dua belas jari setelah adanya makanan yang masuk. Sehingga fungsi utama dari
empedu adalah sebagai detergent biologis dan pelarut lemak dalam tubuh. Empedu
juga berfungsi sebagai salah satu zat antimikrobial dalam tubuh (Begley et al., 2006).
Probiotik dan kolesterol
Persyaratan pengembangan probiotik baru
Probiotik didefinisikan sebagai bakteri hidup yang apabila dikonsumsi dalam
jumlah yang memadai akan memberikan efek yang menguntungkan bagi yang
mengkonsumsinya (FAO-WHO, 2001). Pada awal perkembangan era probiotik,
L.casei strain Shirota (Yakult) serta L. rhamnosus GG, merupakan dua strain
lactobacilli yang mengawali (pionir) perkembangan probiotik bakteri. Seiring dengan kemajuan teknologi, beberapa strain baru dikembangkan sebagai probiotik dengan
berbagai keunggulan spesifik pada aspek kesehatan yang diharapkan (Klaenhammer
dan Kullen, 1999).
Probiotik memberikan dampak menyehatkan pada individu yang
mengkonsumsinya. Beberapa aspek menyehatkan probiotik antara lain: ekslusi,
antagonis terhadp patogen, sebagai imun stimulator dan modulator, antikarsinogenik
dan mutagenik, peningkatan simpton laktosa intoleran, menurunkan kolestrol darah,
menurunkan tekanan darah, menghambat dan mencegah diare, mencegah vaginitis
dan memelihara integritas mukosa usus (Sanders, 1998; Tannock, 1999;
Mattilla-Shandholm et al., 1999). Adanya berbagai aspek menyehatkan tersebut, maka memberi potensi baru dalam pengembangan makanan fungsional dan bahkan formula
makanan khusus untuk bayi dan manusia usia lanjut seperti yang telah dikembangkan
Dalam pengembangan probiotik, strain yang dipergunakan sebaiknya telah
teridentifikasi dengan baik, umumnya dengan susunan gen 16S rDNA sudah
terdepositkan di bank data internasional. Adanya data genetik memungkinkan untuk
mengembangkan sistem monitoring untuk menentukan secara spesifik populasi
probiotik bakteri yang dikonsumsi di dalam saluran pencernaan agar efek fungsional
yang ditimbulkan bisa dijelaskan dengan lebih baik. Disamping identifikasi strain dan
sistem deteksi, ada beberapa kriteria yang diharapkan dalam pengembangan probiotik
baru seperti: (1) kecocokan (untuk probiotik konsumsi manusia sebaiknya diisolasi
dari saluran pencernaan manusia sehingga mengurangi resiko toksisitasnya); (2)
kecocokan dalam teknologi pengembangan/produksi dimana diharapkan mudah
diproduksi secara masal/skala besar, viabilitas yang tinggi, tidak mengganggu nilai
sensoris bahan pangan apabila diikutkan dalam bahan pangan tertentu, stabil secara
genetis dan memungkinkan dilakukan rekayasa genetika; (3) kemampuan bersaing
(competitiveness) seperti mampu bertahan dan berkembang biak di dalam saluran pencernaan, tahan terhadap kondisi saluran pencernaan (asam empedu, pH rendah),
mampu bersaing dengan flora normal di dalam saluran pencernaan, dan mampu
melakukan adhesi pada sel epitel saluran pencernaan; (4) efek fungsional seperti
mampu menimbulkan dampak menyehatkan, antagonis terhadap patogen, produksi
zat antimikrobial, imunstimulator, anti karsinogenik dan anti mutagenik, produksi
bioaktif (enzyme, vaccines, peptida) (Klaemhammer dan Kullen, 1999).
Guna memahami peranan dari probiotik Lactobacillus sp F213 pada kesehatan manusia dan marker biologi, merupakan hal penting untuk mengetahui
efeknya terhadap komunitas bakteria pada saluran pencernaan manusia yang
diberikan Lactobacillus sp F213. Pada penelitian ini perhatian difokuskan pada deteksi Lactobacillus sp F213 dan lama waktu kolonisasinya pada saluran pencernan yang dilihat dari DNA mikrobiomik feses serta pengaruh fungsional kesehatan yang
ditimbulkannya.
Probiotik dan mekanisme penurunan kolesterol
Hiperkolesterolemia (peningkatan kadar kolesterol di dalam darah) telah
untuk mengobati PKJ, namun demikian masih dipandnag belum optimal karena
harganya yang relatif mahal serta adanya efek samping yang tidak diinginkan.
Konsumsi oral dari probiotik mampu menurunkan 22-33% dari total kolesterol darah
(De Smet et al. 1994:1998: Torano et al., 1998). Efek penurunan kolesterol ini dapat disebabkan oleh aktivitas BSH (Kluver et al., 1993; Liong dan Saha, 2005). Asam empedu yang telah mengalami dekonjugasi mempunyai kelarutan yang lebih rendah
dari pada bentuk garamnya sehingga menyebabkan ekskresi asam empedu bebas
lebih banyak dalam feses. Asam empedu bebas juga mempunyai kemampuan yang
kurang baik dalam melarutkan lemak serta kurang bisa diabsorbsi untuk
dipergunakan kembali (siklus enterohepatik). Dengan demikian dekonjugasi garam
empedu mempunyai peranan penting dalam menurunkan kolesterol di dalam darah.
Karakter inilah menyebabkan adanya BSH dalam strain probiotik memberikan
keuntungan ganda guna menurunkan kolesterol darah dan menjaga keseimbangan
bakteri saluran pencernaan.
Pemberian susu terfermentasi dengan mempergunakan Lactobacillus
menurunkan kolesterol darah dari pasukan Masai pria sebanyak 9.8% (Lovegrove dan
Jackson, 2003). Disamping itu, yoghurt yang difermentasi dengan mempergunakan
Lactobacillus bulgaricus dan Streptococcus thermophilus dapat menurunkan total serum kolesterol dan LDL (Jasper et al., 1984). Hal ini menunjukkan bahwa probiotik memberikan kontribusi dalam penurunan kolesterol darah.
Beberapa mekanisme telah diusulkan, yang meliputi efek fisiologis dari asam
lemak rantai pendek yang terbentuk akibat aktivitas probiotik, kolesterol asimilasi,
pengikatan kolesterol pada sel bakteri, serta aktivitas dekonjugasi garam empedu
(Lovegrove dan Jackson, 2003). Mekanisme lain yang diperkirakan erat kaitannya
dengan penurunan kolesterol darah adalah melalui transport kolat oleh Lactobacillus
dan Bifidobacterium (Kurdi et al., 2000:2003), dimana asam kolat dapat terakumulasi di dalam sel dan kemudian ikut terbawa feses. Aktifitas fermentatif probotik
cenderung menyebabkan pH saluran pencernaan menjadi lebih asam. Asam empedu
kolat dan deoksi kolat). Sehingga pada pH saluran pencernaan relatif rendah (lebih
rendah dari pH 6,4) maka asam empedu akan mengendap dan terbawa feses. Hal ini
akan menyebabkan penurunan kolestrol darah.
Studi pendahulaun dan Hasil yang sudah dicapai
Serangkaian penelitian untuk mengembangkan probiotik telah dilakukan.
Penelitian in vitro dari aspek ketahanan pada kondisi saluran pencernaan meliputi ketahan Lactobacillus sp F213 terhadap pH rendah di lambung, enzim pencernaan, dan asam empedu. Dari aspek keamanan ditemukan bahwa Lactobacillus sp F213 tidak dapat mentransformasi asam empedu primer (sehingga diduga tidak memicu
kolon kanker), tidak menyebabkan kerusakan pada saluran pencernaan (histolgi
saluran pencernaan mencit), bersifat tidak beracun (tidak me-lisis sel darah) serta
tidak akut diuji menggunakan larva udang. Aspek fungsional meliputi kemampuan
Lactobacillus sp F213 melekat pada epitel saluran pencernaan mencit untuk mencegah diare dan diduga dapat menstimulasi sistem imun. Ditemukan juga bahwa
Lactobacillus sp F213 mampu menghidrolisis garam empedu dan berpotensi menurunkan kolesterol darah.
Potensi in vitro tersebut di atas telah teruji dalam penelitian in vivo seperti kemampuan berkompetisi untuk melekat (competetive exclusion) pada saluran pencernaan mencit yang diinfeksi dengan E coli O157, sehingga Lactobacillus sp F213 berpotensi untuk mencegah diare (Sujaya et al. 2010); Lactobacillus sp F213 mampu bertahan dalam saluran pencernaan tikus putih (Nocianitri et al., 2010) dan
menurunkan 35% dari total kolesterol pada tikus hiperkolesteromik (Nursini et al.,
2010). Penelitian pada subjek manusia menujukkan bahwa Lactobacillus sp F213 terdeteksi pada sidik DNA mikrobiomik feces, serta dapat menurunkan 6,29%
kolesterol darah, serta menurunkan TNF alfa sebanyak 35,87% (dari 9,2 pg menjadi
0,59 pg, sebelum dan setelah pemberian Lactobacillus sp F213). Lebih jauh diperoleh bahwa pemberian Lactobacillus sp F213 pada subjek manusia dapat meningkatkan kenyamanan buang air besar (berpotensi untuk mencegah konstipasi) (Sujaya et al.,
Output:
Bile salt hydrolase (penurun kolesterol)
Adhesi pada epitel (mencegah pelekatan patogen spt E coli dll)
Studi pada hewan
Gambar 1. Peta jalan penelitian pengembangan probiotik
BAB III. METODE PENELITIAN
Usulan Tahun 1. Pengembangan metode deteksi Lactobacillus sp F213
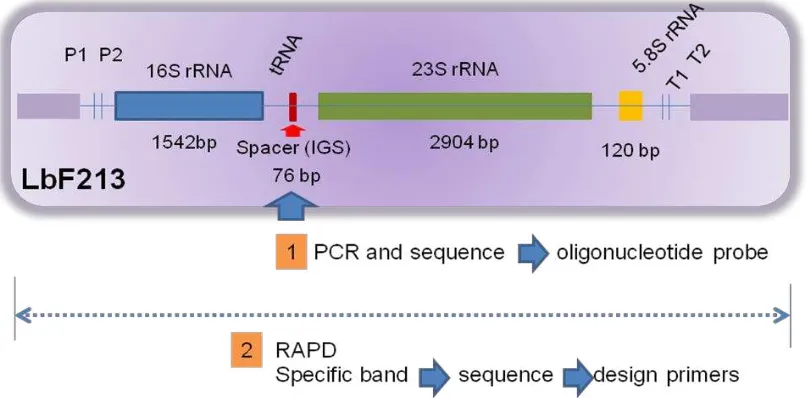
Untuk mengembangkan metode diagnostik Lactobacillus sp F213 ada beberapa target gen yang akan dipergunakan (Gambar 2).
Gambar 2. Ilustrasi target gen sebagai strategi dalam pengembangan sistem deteksi molekuler Lactobacillus sp F213.
Pada ilustrasi Gambar 2 terlihat bahwa kemungkinan target adalah berdasarkan variasi
susunan basa nukleotida seperti variable region 1-3 pada 16S rDNA pada
Lactobacillus sp F213. Namun dalam penelitian sebelumnya 16S rDNA dari
Lactobacillus sp F213 menunjukan 99.9% homology dengan strain lain sehingga pendekatan yang akan dipergunakan adalah bagian intragenik spacer region (IGS),
molekul 23S rDNA, 5,8S rDNA dan bahkan bagian tertentu dari keseluruhan DNA
genom Lactobacillus sp F213. Pada penelitian ini akan dicoba beberapa kemungkinan yaitu (1) sekuensing IGS serta (2) pita spesifik yang diperoleh dengan Random Amplified DNA Polymorpism (RAPD).
Strain dan kondisi pembiakan strain bakteri
merupakan strain potensial probiotik. Selain strain Lactobacillus sp F213 juga dipergunakan strain lain yang merupakan koleksi UNUDCC.
Strain Lactobacillu spp. dibiakkan dalam MRS broth, dalam keadaan anaerob (menggunakan anaerobic OXOID gas pouch) dan diinkubasi selama 24-48 jam pada
suhu 37oC.
Isolasi Genomic DNA dari Lactobacillus sp F213
DNA diisolasi dengan mepergunakan Kit Isolasi DNA (Promega) sesuai petunjuk dalam
kit. Sebanyak 2 uL suspesi DNA dielektroforesis pada 1,2% agarose dan divisualisasikan
pada UV transiluminator untuk mengkonfirmasi keberhasia proses isolasai DNA.
Selanjutnya DNA dilarutkan dengan TE-buffer dan disimpan pada suhu -20oC sampai
dilakukan analisis selanjutnya.
PCR dan Sequencing IGS
Typing Lactobacillus sp dilakukan dengan sekuensing intragenic spacer region (IGS), bagian rDNA dengan susunan nukleotida yang sangat variatif pada seluruh prokaryota
menggunakan primer: FGPS1490F- TGC GGC TGG ATC ACC TCC TT dan
FGPS132R- CCG GGT TTC CCC ATT CGG (Laguere et al., 2006) dan primer lain
sesuai dneagn kebutuhan. Reaksi campuran PCR dilakukan pada total volume 12,5 μl
yang mengandung: 10 mM masing-masing dNTPs, primer 27F dan 520R (25 pmol), 1X
PCR Buffer II, 75 mM MgCl2, 0.45 U AmpliTaq, 1 μl DNA. Reaksi amplifikasi dilakukan sebagai berikut: satu kali siklus pada 94oC selama 5 menit, diikuti dengan 35
kali siklus pada 94oC selama 20 detik, 55oC selama 2 menit, dan 72oC selama 30 detik.
Tahap akhir ditambahkan dengan satu kali siklus pada suhu 72oC selama 5 menit. Produk
PCR selanjutnya dielektroforesis dengan menggunakan 1% agarosa dengan 1X TAE
bufer, dilakukan pewarnaan dengan EtBr (50 ng/ml), divisualisasikan pada UV
iluminator dan difoto.
Produk PCR dimurnikan dengan menggunakan PCR SUPRECTM PCR (Takara
Biomedicals, Otsu, Japan) dan selanjutnya disekuen dengan menggunakan Big Dye
menggunakan sekuensing automatis 3100 Genetic Analyzer (PE Applied Biosystems).
Untuk studi homologi, sekuen dilakukan di NCBI/GenBank.
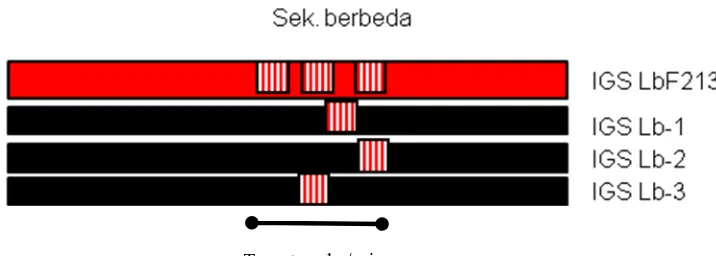
Untuk men-desing primer/probe spesifik untuk deteksi Lactobacillus sp F213 dengan target IGS dilakukan dengan melalukan multiple alligment dari sequence IGS dari
Lactobacillus sp F213 dengan IGS strain species yang sama yang dapat di ambil dari GenBank (NCBI/DDBJ). Dari multiple alligment akan diketahui sekuen nucleotida yang paling berbeda diantara sekuen IGS yang ada. Selanjutnya sekuen yang berbeda ini dapat
dijadikan probe/dapat juga di pakai sebagai primer spesifik (ilustrasi Gambar 4)
Gambar 3. Ilustrasi design primer/probe dari seukuen IGS Lactobacillus sp F213 setelah di align dengan IGS dari Lactobacillus lain (misal: IGS Lb-1, IGS Lb-2, IGS Lb-3 dst).
RAPD dan sekuensing pita spesifik
Tahapan RAPD dilakukan mengacu pada prosedur Ivanova et al., (2008). Campuran reaksi RAPD dilakukan pada total volume 12,5µl dengan komposisi 6,25µl Master Mix Solution Intron Biotechnology, 1,25µl primer (Tabel 2), 1µl DNA dan 4µl air steril sehingga total volume reaksi 12,5µl. Amplifikasi dilakukan pada mesin Infinigen thermocycler, dengan kondisi satu siklus pada 940C selama 5 menit, diikuti dengan 40 siklus pada 940C selama 20 detik, 400C selama 2 menit dan 720C selama 30 detik, dan
tahap akhir yaitu elongasi tambahan pada 720C selama 5 menit. Setelah reaksi selesai
sampel dikeluarkan dari mesin dan diambil sebanyak 5µl untuk dielektroforesis.
Tabel 1. Primer yang dipergunakan untuk RAPD
Primer Susunan primer (5´-> 3´)
sebagai pembanding. Pita yang paling berbeda ini menunjukkan sesuan basa basa
nukleotida yang paling khas yang ada pada genom Lactobacillus sp F213. Selanjutnya di pita pada gel di potong, dimurbikan dan disekuen untuk mendapatkan susunan
nuklotidanya yang dapat dijadikan primer/probe spesifik untuk deteksi Lactobacillus sp F213 (Gambar 3).
Optimasi Primer
Primer didesign memeprgunakan susuan nukleotida specifi dari Lactobacillus sp F213, yang kemungkinan terletak pada sesuan nukleotida IGS atau pita RAPD. Primer
di-design memeprgunakan software Primer express.
Optimasi dan spesifisitas primer dilakukan sesuai kondisi penelitian/percobaan yang
tergantung dari jenis reagent PCR yang dipakai. Dengan demikian optimasi spesificitas
PCR dilakukan dengan mengatur konsentrasi suhu annealing (pelekatan/hibridisasi) primer dengan target sekeun pada DNA yang di-amplifikasi, serta dengan mengatur
stringency reaksi polimerasi dengan mangatur konsentrasi ion MgCl2 pada campuran reaksi PCR (Innis et al., 1990).
Setelah didapatkan kondisi spesifik untuk Lactobacillus sp F213 maka selanjutnya dilakukan PCR dengan mempergunakan DNA yang diisolasi dari feces yang sengaja
ditambahkan dengan Lactobacillus sp F213. Isolasi DNA feces dilakukan untuk mengetahui konsentrasi/populsi Lactobacillus sp F213 minimal di mana DNA
Lactobacillus sp F213 dapat di-recovery dengan protokol isolasi DNA yang dipergunakan. Dengan demikian akan diketahui kosntrasi sel Lactobacillus sp F213 yang ada pada feces yang mungkin dapat di deteksi deangan primer spesifik ini. Disamping itu dilakukan pula
optimasi dengan mempergunakan RT-PCR dengan pewarna cyber green untuk mengetahui hubungan antara intenstitas flourisensi dengan kosnntrasi DNA/sel. Dari
langkah ini akan diketahui jumlah sel yang ada pada sampel berdasarkan tingkat intensitas
flouresensi dari cyber green.
Analisis data
Data dianalisis secara deskriptif berdasarkan ada tidaknya produk PCR yang dihasilkan
IV. HASIL DAN PEMBAHASAN
Penyegaran strain Lactobacillus sp F213
Lactobacillus sp F213 disegarkan dari stok beku (-50oC). Strain di segarkan dalam MRS broth dan diinkubasi dalam keadaaan anaerob selama 24 jam pada suhu 37oC.
Setelah tumbuah, strain di streak pada MRS agar dan koloni yang tumbuah (Gambar 4A) diisolasi secara tunggal (single colony isolation) untuk menjamin kemurnian strain yang dipergunakan dalam penelitian ini. Konfirmasi strain dilakukan dengan
mengamati pembutukan gas pada MRS broth serta pengecatan Gram (Gambar 4B).
Gambar 4A. Morfologi koloni
Lactobacillus sp F213 pada media MRS agar
Gambar 4B. Morfologi mikroskopik
Lactobacillus sp F213 pada media MRS both
Isolasi Genomic DNA
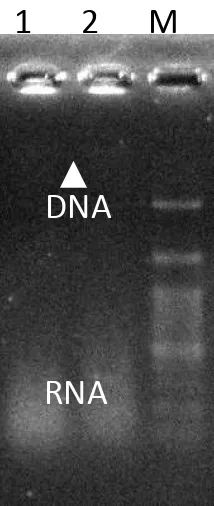
Genomik DNA diisolasi dari 2,5 ml kultur Lactobacillus sp F213 (strain no 1 dan no 6). Dengan metode isolasi sekala kecil ini, diperoleh DNA yang masih mengandung RNA,
walaupun pita DNA genomik pada gel tidak tampak dengan jelas (Gambar 5), tetapi
hasil analisis menunjukkan bahwa konsentrasi DNA Lactobacillus sp F213 (2) dan
Gambar 5. Genomik DNA dari Lactobacillus sp F213 (no 1 adalah
Lactobacillus sp F213 strain no 2); no 2 adalah Lactobacillus sp F213 strain no 6. M : DNA ladder (100 bp). Pita DNA genom (ditunjukkan dengan tanda panah, tidak begitu jelas pada foto gel), sementara RNA tampak seperti smear
pada bagian bawah gel.
Amplifikasi Intragenic Spacer Region (IGS) Lactobacillus sp. F213
Primer yang dipergunakan dalam amflifikasi IGS Lactobacillus sp F213 dapat dilihat pada Tabel 2.
1 2 M
Tabel 2. Sekuen primer yang dipakai pada PCR IGS Lactobacillus sp F213. Name Seq 5’->3’ Referensi
FGPS1490F TGC GGC TGG ATC ACC TCC TT Laguere et al., 2006 FGPS132R CCG GGT TTC CCC ATT CGG
L1F GAA GTC GTAACA AGG Jensen et al., 1993
Lt1-R CAA GGC ATCCAC CGT
Nour 514F TGG ATC ACC TCC TTT CTA Nour, 1998(*)
Nour 601R GTG CGC CCT TTA TTA ACT T
(*) belum dilakukan karena primer sedang disintesis oleh suplier
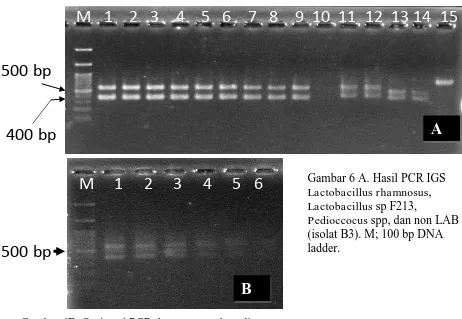
Hasil PCR dengan primer FGPS1490F/FGPS132R terlihat bahwa Lactobacillus
sp. F213, Lactobacillus rhamnosus dan Pediococcus spp., menunjukkan pita ganda, sementara hanya non bakteri asam laktat (Isolat B3) menunjukkan pita tunggal
(Gambar 6A). Lactobacillus sp. F213 menghasilkan pita dnegan ukuran 500bp dan 400 bp; Lactobacillus rhamnosumenghasilkan pita 500 bp dan 350; Pediococcus spp. Menhasikan pita dengan ukuran 400 bp dan 350bp, semantar non bakteri asam laktat
(Isolat B3) menghasilkan pita tunggal dnegan estimasi ukuran 700 bp.
Laguere et al 2003) juga menemukan pita ganda dan tunggal pada beberapa
species bakteri Rhyzobium yang diteliti. Dalam peleitian ini dilakukan konfirmasi kembali khususnya optimasi suhu annealing guna menghindari terjadinya miss-priming
pada primer FGPS1490F/FGPS132R.
Peningkatan suhu annealing primer, denagn gradient 1oC, dari suhu tengah
55oC dari suhu 48oC sampai 62oC, denan 12 jenis suhu annealing dimuali dari: 48;
48,7; 49,8;51,1; 52,6;54,2;55,8; 57,5; 58,9; 60,2; 61,3; dan 62oC. Dari 12 jenis suhu
annealing ini dilakukan PCR Lactobacillsus sp F213 dilakukan pada suhu 55,8 sampai
62oC. Hasil gradient PCR menggunakan primer ini menujukkan bahwa amplifikasi
dengan primer FGPS1490F/FGPS132R semakin berkurang apabila suhu annealing
primer FGPS1490F/FGPS132R adalah 55oC sesuai yang dilaporkan oleh
FGPS1490F/FGPS132R dimana produk IGS dari Lactobacillus sp F213 selalu ditemukan dua pita. Hasil ini menujukkan bahwa dengan primer ini selalu diperoleh 2
pita IGS dari Lactobacillus sp F213.
Gambar 6B. Optimasi PCR dengan termal gradient.
Keterangan gambar 6B:M: 100 bp DNA ladder. No 1,2 3 4 5,6 adalah suhu annelaing primer FGPS1490F/FGPS132R untuk amplifikasi DNA Lactobacilus sp F213 masing-masing 55,8oC; 57,4oC; 58,9oC; 60,2oC; 61,3oC; 62oC.
Konfirmasi Intragenic Spacer Region (IGS) Lactobacillus sp. F213
Untuk meyakinkan bahwa Lactobacillus sp F213 mempunayi 2 buah IGS yang berbeda, dilakukan PCR dengan mempergunakan primer yang lain. Amplifikasi IGS
Lactobacillus sp F213 dengan primer L1-F (GAA GTC GTAACA AGG) / Lt1-R
500 bp
500 bp
M 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15
400 bp
M 1 2 3 4 5 6
500 bp
A
B
Gambar 6 A. Hasil PCR IGS
Lactobacillusrhamnosus,
Lactobacillus sp F213,
(CAA GGC ATCCAC CGT) juga menghasilkan produk IGS dua pita dengan panjang
pita sekitar 500 bp dan 400 bp sementara L rahmnosus SKG34 dengan panjang pita
sekitar 500 bp dan 350 bp, serta Pediococcus sp dengan pajang pita IGS sekitar 400 bp
dan 350 bp (Gambar 7). Hal ini menjukkan kembali bahwa IGS Lactobacillus sp F213 terdiri dari dua buah pita. Hal ini memperkuat dugaan bahwa Lactobacillsus sp F213, L rhamnosus SKG34, dan Pediococcus spp mempunyai 2 helai IGS dengan panjang yang berbeda.
Gambar 7. Panjang IGS Lactobacillus sp F213 (1, 2), L. rhamnosus SKG34 (3) dan
Pediococcus spp (4,5)
Adanya pita IGS ganda dengan ukuran panjang yang berbeda menyebabkan
kesulitan kalau dilakukan direct sequencing, sehingga harus dipisahkan terlebih daulu melalui subcloning masing-masing pita atau cara lainnya. Pita IGS dapat dipisahkan menjadi pita tunggal sehingga dilakukan Direct Sequening PCR dengan me-motong gel mengandung IGS selanjutnya DNA pada gel dimurnikan atau di-elusi dari dalam
matrik gel. Dalam penelitian ini dicoba dengan meng-elusi DNA dengan memberikan
daya magnet sehingga DNA yang bermuatan negatif di tarik dengan magnet kutub
positif (Gambar 8). Elusi dilakukan dengan merendam gel di dalam 25 ul buffer TE
dan diberikan magnet pada satu sisinya. Elusi dilakukan pada suhu 5oC selama 12 jam
(semalam) dan selanjutnya DNA yang telah keluar gel di PCR dengan mempergunakan
primer yang sama dengan primer yang dipergunakan pada saat PCR (L1-F / Lt1-R
(Gambar 9).
500 bp
Hasil PCR dari DNA yang telah dielusi dari gel dapat dilihat pada Gambar 9.
Setelah re-PCR justru menghasilkan pita tunggal dengan ukuran yang lebih pendek
(sekitar 350 bp) dibandingkan dengan panjang pita sebekumnya. Belum diketahui
secara pasti kenapa hal ini terjadi dan akan dilakukan sequencing guna memanstikan
IGS dari Lactobacillus sp F213 dan IGS L rhamnosus SKG34.
Gambar 8. Teknik elusi DNA dengan memberikan muatan magnetik.
Gambar 9. IGS dari Lactobacillus sp F213 (A), L rhamnosus (B) dan hasil PCR pita tunggal dari LbF213(C dan D) dan Lrhamnosus (E dan F). Terlihat PCR pita dengan panjang 500 bp pada A dan B menghasilkan produk PCR dengan ukuran 300 bp (C dan E).
M A B C D E F
500 bp
300 bp
Susunan Nukleotida Intragenic Spacer dari Lactobacillus sp F213
Hasil sekuensing IG Lactobacillus sp F213 pita IGS 1 dan 2 diberikan seperti di bawah
ini.
>Lactobacillus sp F213 IGS band no 1.
ttgatgatataagtttgagtatgtggctcaaaggccacaagcgattttaaactaattta aaaaactcaaaaaattacgcggggtattttttcggctcaatttatattgattaacaata ttaaatgaatttaaaaatttacaattatgattcagttttcaaagaactaattttgagtg taaatcactcaaaactgaatatcgtttcaacgaatgtgtaggtttcccattttccttat aaaggaggtgatccacccccaggttctcctacggctaccttgttacaacttcaca
Homology BLAST untuk menentukan susunan nukleotida yang paling dekat dengan IGS 1.
Score E Sequences producing significant alignments: (bits) Value
AY342323|AY342323.1 Weissella confusa 16S ribosomal RNA and 23S ... 519 e-144 JX118838|JX118838.1 Lactobacillus brevis strain GDA-4 16S riboso... 446 e-122 KJ880099|KJ880099.1 Weissella cibaria strain C34 16S ribosomal R... 444 e-121 JX118839|JX118839.1 Lactobacillus brevis strain GDA-1 16S riboso... 444 e-121 AF158558|AF158558.1 Lactobacillus sp. GTH2 16S-23S ribosomal RNA... 363 9e-97
>AY342323|AY342323.1 Weissella confusa 16S ribosomal RNA and 23S ribosomal RNA genes, partial sequence.Length = 918
Score = 519 bits (262), Expect = e-144 Identities = 283/290 (97%)
Strand = Plus / Minus
Query: 8 ttgatgatataagtttgagtatgtggctcaaaggccacaagcgattttaaactaatttaa 67 Sbjct: 389 ttgatgatataagtttgagtatgtggctcaaaggccacaagcgattttaaactaatttaa 330
Aligment IGS I dari LbF213 dengan data yang ada pada genbank (BLAST),
Sekuen nukleotida Lactobacillus sp F213 IGS band no 2. 304
Homology BLAST untuk menentukan susunan nukleotida yang paling dekat dengan IGS 1.
s
Score E Sequences producing significant alignments: (bits) Value
AY342323|AY342323.1 Weissella confusa 16S ribosomal RNA and 23S ... 355 2e-94 F158558|AF158558.1 Lactobacillus sp. GTH2 16S-23S ribosomal RNA... 317 5e-83 JX118839|JX118839.1 Lactobacillus brevis strain GDA-1 16S riboso... 315 2e-82 JX118838|JX118838.1 Lactobacillus brevis strain GDA-4 16S riboso... 315 2e-82 KJ880099|KJ880099.1 Weissella cibaria strain C34 16S ribosomal R... 307 5e-80 AF158570|AF158570.1 Lactobacillus sp. GTH24 16S-23S ribosomal RN... 307 5e-80 AF158569|AF158569.1 Lactobacillus sp. GTH22 16S-23S ribosomal RN... 295 2e-76
Aligment IGS I dari LbF213 dengan data yang ada pada genbank (BLAST),
Hasil sekuensing pita IGS I dan II pada LbF213 menunjukkan persen homologi yang
berbeda. Pita IGS-I menunjukkan homologi sebesar 97% dengan
AY342323|AY342323.1 Weissella confusa 16S ribosomal RNA and 23S ...sementara IGS-type II menujukkan homologi sebesar 91%. Hal ini menujukkan bahwa LbF213
membawa dua IGS dengan ukuran dan sekuen yang berbeda. Perbedaan sekuan yang
tinggi ini menjadi target yang baik dalam pengembangan nukleotida untuk mendeksi
LbF213.
Diagnostik spesifik F213 yang dapat dikembangkan adalah primer spesifik dan
probe spesifik. Untuk tahap awal, dikembangankan beberapa set primer spesifik
dnegan mempergunakan berdasarkan apda IGS tipe I dan Tipe II (Table 3). Primer ini
selanjutnya dipergunakan untuk mengamplifikasi IGS pada LbF213. Hasil PCR
menunjukkan bahwa primer yang dikembangkan mengamplifikisi dua IGS yang
berbeda, karena IGS mempunyai susunan nukleetida yang sama /komplementer dengan
susunan nukleotida primer, tetapi pada posisi yang berbeda sehingga menghasilkan
pita yang berbeda (Gambar 10). Dari set primer yang dikembangkan tersebut (Tabel ...)
diperoleh bahwa primer dnegan target IGS-type II menunjuukan hasil yang paling
spesifik dimana terbenu 2 pita, yang satu dengan ukuran 300 p dan yang kedua dnegan
ukuran sekitar 200 bp. Design primer B2F-R ini dihitung berdasarkan posisi prier pada
susuan IGS type II, secara teoritis menghasilkan panjang produk PCR 197bp.
Berdasarkan data ini, maka B2F-R secara spesifik dapat mengamplifikasi IGS type II
(Gambar ..).
SUSUNAN PRIMER SPESIFIK LbF213
Beberapa set primer spesifik dicoba dikembangakna dari susunan nukleotida pada IGS
1 dan IGS 2 dari LbF213. Primer disusun berdasarkan rekomendasi melalui
www.ncbi.nlm.nih.gov/tools/primer-blast (Tabel ...).
Sekuen nukleotida IGS1 pada Lactobacillus sp F213
belakang hijau.
TTGATGATATAAGTTTGAGTATGTGGCTCAAAGGCCACAAGCGATTTTAAACTAATTTAAAAAACTCAAAAAATTACGCGGGGTATTTTT TCGGCTCAATTTATATTGATTAACAATATTAAATGAATTTAAAAATTTACAATTATGATTCAGTTTTCAAAGAACTAATTTTGAGTGTAA
ATCACTCAAAACTGAATATCGTTTCAACGAATGTGTAGGTTTCCCATTTTCCTTATAAAGGAGGTGATCCACCCCCAGGTTCTCCTACGG
CTACCTTGTTACAACTTCACA
Sekuen nukleotida IGS2 pada Lactobacillus sp F213
Targt primer (wrana merah, 197 bp), Susunan nukleotida primer yang diberi latar
belakang hijau.
CCATCTTACTGACGTTGATGATATAAGTTTGAGTATGTGGCTCAAGGCCCAAGCGATTTTAAACTAATTAAAAAACTCAAAAAATAACGC GGGGTATTTTTTCGGCTCATTTTATATTGCTAAACAATATTAAATGAATTTAAAAATTTACAATTTTGATTCAGTTTTCAAAGACCTAAG
TTTGAGCGTAAATCCCTCAAAACTGATTATCGTTTCAACGAATGTGGAGGTTTCCCATTTTCCTTAGAAAGGGGGGGATCCACCCCCCCG
TTCTCCTCCGGCTCCCTTGTTCCACCTCCACAAT
Tabel 3 . Susuan primer spesifik yang untuk mendeteksi Lactobacillus sp F213.
TARGET Name Seq. 5’ 3’ Produc size
BAND-1 F213B1F1 TTGAGTATGTGGCTCAAAGGC
F213B1R1 GGGGTGGATCACCTCCTTTA 241
F213B1F2 TCAAAGGCCACAAGCGATTTTA
F213B1F3 CTCAAAGGCCACAAGCGATTTTA
F213B1F4 GTTTGAGTATGTGGCTCAAAGGC
F213B1R4 AGGAGAACCTGGGGGTGGAT
BAND-2 F213B2F CTCAAGGCCCAAGCGATTTT 197 bp
SPESIFISITAS PRIMERS
Spesifisitas primer diuji dengan mempergunakan DNA LbF213. PCR dilakukan
mempergunakan PCR kit (Kappa PCR Master Mix 2X) dengan campuran reaksi PCR
sebegai berikut : PCR master mix 12,5 ul; DNA 1 ul; primer F dan primer R
masing-masing 2,5 ul (konsntrasi primer 2 mM), dan akuades sampai volume 25 ul. PCR
dilakukan pada pre-denaturasi pada suhu 94oC selama menit, diikuti sebanak 30 siklus
yang terdiri dari denaturasi 2 menit pada suhu 94oC, annealng pada suhu 60oC selama
30 detik; elongasi pada suhu 72oC selama 30 detik. Siklus terkahir diikuiti dengan
ekstensi selama 2 menit pada suhu 72oC. Hasil PCR dielektrofooresisi pada agarose gel
2%, diwarnai dnegan EtBr dan divisualisasi dengan UV iluminator.
Gambar 10. Spesifisitas primer spesifik IGS LbF213. Hhanya primer B2FR yang memberikan panjang produk PCR sesuai dengan yang diharapkan (berdasarkan susuan nukleotida IGS2)
Dari 6 set primer yang diuji, tenraynata hanaya B2FR (primer dnegan target IGS2 dari
LbF213) menunjukkan hasil ynag spesifik dansesuai dengan ukuran pandajnag DNA
yang diharapkan (197 bp).
M : 100 bp DNA Ladder 1. B1F1-B1R1 2. B1F2-B1R4 3. B1F3-B1R4 4. B2F-B2R 5. B1F2 –B1R4 6. B1F3-B1R4 4 3 2 1 M 4 6 5 M
SPESIFISITAS PRIMER B2FR PADA SPESIES LAINNYA
Spesifisitas B2FR selanjutnya diuji pada DNA dari beberapa spesies BAL lainnya (L
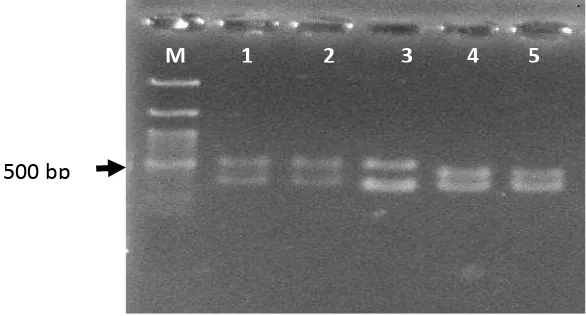
rhamnosus, Pediococcus) an non BAL (Gambar 11).
Gambar 11. Spesifisitas primer B2FR terhadap beberapa species bakteri asam laktat dan non-bakteri asam laktat. Terlihat primer B2FR hanya memberikan hasil positif dnegan LbF213 (tanda panah).
Gambar 12. Spesifisitas primer B2FR terhadap DNA feses. Terlihat primer B2FR memberikan hasil positif dengan eberapa DNA feses yytetapi hasil hanya dneagn DNA LbF213 diperoleh ukuran pita yang berbeda dneagn DNA lainnhya (tanda panah).
8 7 6 5 4 3 2 1 M
1. L rhamnosus GME10 2. L rhamnosus SMM53 3. Pediococcus sp M58 4. Pediococcus sp GMB30 5. L rhamnosus SMM55 6. L rhamnosus Skg34 7. B3 (non LAB) 8. F213
9. M ladder
11 10 9 8 7 6 5 4 3 2 1 M
1. F213
Pada kondisi pennelitian, dimana annealing pada suhu 60oC primer B2FR tidak
menghasilkan pita dengan strain lain selain LbF213. Selanjutnya ditemukan bahwa
B2FFR mengasilkan pita dari DNA yang diisolasi dari feses manusia, tetapi dengan pola
yang berbeda dengan DNA LbF213 (Gambar 12). Hal ini menunjukkan bahwa B2FR
dapat dipakai sebagai pendeteksi spesifik keberadaan LbF213 dalam konsorsium
mikroorganisme.
Selanjutnya untuk lebih meyakinkan kehandalan dari primer ini serta limit deteksi B2FR
(konsnetrasi DNA yang masih dapat di amplifikasi) maka dilakuakn isolasi DNA feses
yang telah ditambahkan dengan LbF213. Dengan memeprgunakan B2FR tdiak terdeteksi
keberadaan LbF213 pada DNA feses, walaupun sebelum diisolasi dnegan MoBioSOOIL
KIT feses sudah ditambahkan 50 dan 100 ul kultur LbF213 (setelah diinkubasis leama 48
jam). Seanjutnya setelah dilakukan PCR ternyata masih terbentuk pita pada konsnetrasi
DNA 3,75 piko gram (Gambar 13). Hal ini menjukkan bahwa hasil negatif pada Gambar
13., disebabkan karena DNA LbF213 todak daat diektraksi pada campuran konsorsium
mikorb feses (DNA lebih rendah dari 3,7 piko gram). Hal ini mungkin sbeagia akibat
Deteksi LbF213 pada DFNA feses
1. DNA feses 2. DNA Feces 3. PCR DNA F213
4. PCR DNA feses dgn B2FR 5. PCR DNA feses +F213 dgn B2FR
6. PCR DNA fese dgn 27F-520R 7. PCR DNA fese dgn 27F-520R 8. PCR DNA feses dgn B2FR 9. PCR DNA feses dgnB2FR 10. PCR DNA F213 dgn B2FR M : 100 bp DNA marker
Gambar 13. Deteksi LbF213 pada DNA feses dengan primer B2FR. Primer B2FR tidak memberikan hasil positif pada DNA yang diisolasi dari feses yang ditambahkan LbF213. Hal ini menunjukkan bahwa DNA dari LbF213 tidak dapat ter-ekstraski.
Gambar 14. Limit deteksi primer B2FR.
Gambar 14 di atas menunjukkan bahwa B2FR masih menunjukkan pita positif pada
kosnnetrasi LbF213 sebedar 3,75 pg. Jika satu (1) sel bakteri mengandung 1,6-2,4 fg
DNA (1 fg = 1x10-12 g). (Lars Reier Bakken, Rolf Arnt Olsen. Soil Biology and
1 2 M 3 4 5 6 7 8 9 10 M
1. 3,75 pg 2. 37,5 pg 3. 375 pg 4. 3,75 ng 5. 37,5 ng
Biochemistry, 21(6): 789–793 (1989) maka 3,57 pg = 3.570 f gr yang setara dnegna +-
1.487 sel. Tetai, walaupun LbF213 ditamvahkab pada feses tetapi tdiak menunjukkan pita
dnegan B2FR. Hal ini menunjukkan recovery DNA LbF213 pada feses dangat rendah.
VI. SIMPULAN DAN SARAN
Simpulan dari hasil penelitian ini adalah :
1. Lactobacillus sp F213 merupakan strain probiotik yang unik yang mempunyai 2 buah Interagentic spacer regions (IGS) dengan ukuran yang berbeda dnegan L rhamnosus dan Pediococcus spp.
2. Lactobacillus sp F213 mempunyai dua buah IGS dnegan susuann ukleotida yang berbeda dan menunjukkan homologi yang rendah dneagn strain lainnya
sehingga potensial sebaa target pengemabnag sistem deteksi spesifik.
3. Primer spesifik telah dikembangkan B2FR dan dapat membedakana LbF213
dengan straian BAL dan non BAL lainnya.
Saran
Perlu dilakukan optimasi primer/probe spesifik Lactobacillus sp F213 pada kondisi feses manusia.
DAFTAR PUSTAKA
Agerbaek, M. Gerdes, L.U., Richeslsen, B. 1995. Hyphoschelesterolemic effect of a new sfermented milk product in healthy middle-aged men. Eur.J. Clin, Nutr., 49: 346-352.
Anonimous. 2001. Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria, Food and Agriculture Organization for the United Nations (FAO) and World Health Organization (WHO).
Anonimus. 2006. Pedoman teknis penemuan dan tatalaksana penyakit hipertensi. Direcktoral Pegendalian Tidak Menular, Direktoral Jenderal PP dan PL, Departemen Kesehatan Republik Indonesia.
Aryantini, P.D. 2008. Isolasi dan karakterisasi bifidobacterium dari feces bayi. PS Ilmu Kesehatan Mayarakat. Univiersitas Udayana, Denpasar.Skripsi.
Artatai, LPSA. 2009. Karakteristik Probiotik dari Lactobacillus sp F212 dan F213 serta kemampuan kompetisi pelekatannya dengan Eschericia coli O157 pada enterosit Mencit. Skrip PS Farmasi, FMIPA Unud.
Begley, M., Hill, C., Gahan, C.G.M. 2006. Bile salt hydrolase activity in probiotics. Appl. Environ. Microbiol. 72: 1729-1738.
Bertolami, M.C., Faludi, A.A., Batlouni, M. 1999. Evaluation of the effect of a new fermented milk product (Gaico) on rimary hypercholesterolemia. Eur.J. Clin, Nutr., 53: 97-101.
Debruyne, P.R., Bruyneel, E.A., Li, X., Zimber, A., Gespach, C., Mareel., M.M. 2001. The role of bile acids in carcigonesis. Mutation Res. 359-369.
De Smet, I., van Hoorde, I., De Saeyer, M., Vande, W.M., Verstraete, W. 1994. In vitro study of bile salt hydrolase (bsh) activity of bsh isogenic Lactobacillus plantarum 80 strains and estimation of cholesterol lowering through enhanced BSH activity.
Microbiol. Ecol. Haelth Dis., 7:315-329.
De Smet, I., De Boever, P., and Versetraete, W. 1998. Cholesterol lowering in pigs through enhanced bacterial bile salt hydrolase activity. Br. J. Nutr. 79:185-194.
De Rose, Nicole M and Martijin B. Katan. 2000. Effect of probiotic bacteria on diarrhea, lipid metabolism, and carcinogenesis: a review of papers published between 1988 and 1998. Am J. Clin. Nutr. 71: 405-411.
Dwipayanti, N.M., Suariani, Pt., K.A. Nocianitri. 2007. Isolasi dan karakterisasi bakteri asam laktat dari susu kuda sumbawa. PS Ilmu Keseahatn MAsyarakat Universitas Udayana. Laporan Penelitian Dosen Muda-DIKTI. Tidak Dipublikasikan.
Dwipayanti, N.M., Suariani, Pt., K.A. Nocianitri. 2008. Identifikasi bakteri asam laktat dari susu kuda sumbawa. PS Ilmu Keseahatn Masyarakat Universitas Udayana. Laporan Penelitian Dosen Muda-DIKTI. Tidak Dipublikasikan.
Gilliand, S.E., Nelso, C.R. and Maxwell, C. 1985. Assimilataion of cholesterol by
Lactobacillus acidophilus. Appl. Environ. Microbiol. 49: 377-381.
Jasper, D.A., Massey,, L.K., and Luedecke, L.O. 1984. Effect of consuming yoghurt prepared with three culture strains on human serum lipoproteins. J. Food Sci.,
49:1178-1181.
Jensen, M.A., Webstr, J.A., Straus, N. 1993. Rapid Identification of Bacteria on the Basisi of Polymeras eChain Reaction-Amplified Ribosomal DNA Spaser Polymorphisms.
Appl. Environ. Microbiol. 59: 945-952.
Klaenhammer, T.R. and Kullen, M.J. 1999. Selection and design of probiotics. Int. J. Food Microbiol. 50: 45-57.
Klaver, F.A.M. and van der Meer, R. 1993. The assume assiliation cholesterol by lactobacilli dan Bifidobacterium bifidum is due to their bile salt-deconjugation activity.
Appl. Environ. Microbiol. 59: 1120-1124.
Kurdi, P., Tanaka, H., van Veen, H., Asano, K., Tomita, F., Yokota, A 2003. Cholic acid accumulation and its deminuation by short chain fatty acids in bifidobacteia.
Microbiology 149:2031-2037.
Kurdi, P., Van Veen, H, Tanaka, H., Mierau, I, Konings, W.N., Tannock, G.W., Tomita, F., Yokota, A. 2000. Cholic acid is accumulated spontaneously, driven by membrane
▲pH, in many lactobacilli. J. Bact. 182:6525-6528.
Larson, L.A., Raben, A., Haulrik, N., Hansen, A.S., Manders, M., Astrop, A. 2000. Effetct of 8 weeks intake of probiotic milk products on risk factors for cardiovascular diseases.
Eur.J. Clin, Nutr., 54: 288-297.
Liong, M.T. and Saha, N.P. 2005. Bile slat deconjugation ability, bile salt hydrolase activity and cholesterol co-precipitation ability of lactobacilli strains. Int. Dairy J., 15:391-398. Lovegrove, J. and Jackson, K. 2003. Coronary heart diseases. In: Mattila-Sandholm, T. and
Saarela, M. (Ed), Functional Dairy Products. Woodhead Pub.Limited, Sambridge, Englan. Pp: 54-87.
Mattilla-Shandholm, T., Blum, S., Collins, J.K., Crittenden, R., de Vos, W., Dunne, C., Fonden, R., Grenov, G., Isolaury, E., Kiely, B., Marteau, P., Morelli, L., Ouwehand, A., Reniero, R., Saarela, M., Salminen, S., Shanahan, F., Vaughan, E., von Wright, A. 1999. Probiotics: towards demosntrating efficacy. Trend Food. Sci. Technol., 10:393-399.
Nocianitri, K. A., dan I.D.G.M. Permana. 2006. Seleksi Bakteri Asam Laktat Sebagai Galur Probiotik Untuk Bayi Alergi Susu Formula. Fakultas Teknologi Pertanian Universitas Udayana. Laporan Penelitian Dosen Muda-DIKTI. Tidak Dipublikasikan
Nocianitri, K. A., dan I.D.G.M. Permana. 2008. Identifikasi Lactobacilus sp. F16 dan
Lactobacillus sp. BY85 dan kemampuan adhesinya pada epitel saluran pencernaan mencit. Fakultas Teknologi Pertanian Universitas Udayana. Laporan Penelitian Dosen Muda-DIKTI. Tidak Dipublikasikan.
Nocianitri, K.A., Aoyama, Y. 2001. Different response to choline deficiency of the serum ornithine carbamoyltransferase activity in four strains of rats. J. Biosci. Biophysics Biochem. 65: 935-938.
Nocianitri, K.A. Sakata, S., Kanno, T., Kikuchi, H., Kurasaki, M., Aoyama, Y. 2002. Influence of dietary methionine level on the liver metallothionein mRNA level in rats.
J. Biosci. Biophysics Biochem. 66:2465-2470.
Nursini, W., NP. Desy Aryantini, K.A. Nocianitri, Y. Ramona, W. Redi Aryanta and I N Sujaya. Colonization of Lactobacillus sp. F2 in the Intestinal Tract and its Functional Effect to Reduce Blood Cholesterol Content of Rats (Rattus Norvegicus). The 2nd International Conference on Bioscience and Biotechnology, Udayana University, Bali, Indonesai, 23-24 Sept. 2010.
Ramirez, M.I., Karaoglu, D., Haro, D., Barrilas, C., Bashirzadeh, Gil, G. 1994. Cholesterol and bile acid regulate cholesterol 7a-hydroxylase expression at the ranscriptional level in culture and in transgenic mice. Mol. Cell. Biolog. 14: 2809-2821.
Rayuda, M.A. 2006. Isolasi dan karakterisasi bakteri asam laktat dari berbagai sumber alami. Jur. Biologi, FMIPA, Universiats Udayana. Denpasar. Skripsi.
Sanders, M.E. 1998. Overview of functional foods: emphasis on probiotic bacteria. Int. Dairy J. 8: 341-349
Schaafsma, G., Meuling, W.J.A., van Dokkum, W., Bouley, C. 1998. Effect of a milk product , fermented by Lactobacillus acidophilus and with fructo-oligosaccharides added, on blood lipid in male volunteers. Eur.J. Clin, Nutr., 52: 436-440.
Sugita, I.M., Wijaya, N.K., Sujaya, I N. 2007. Rekayasa Starter dan Pembuatan Tablet Kunyah DAKULI , Untuk Menekan Pertumbuhan Kanker Dan Penurun Kolesterol Darah.Ditjen Dikti, Penelitian Hibah Bersaing.
Sujaya, I N, Ramona, Y. , Widarini, NP., Suariani, NP, Dwipayanti, N.M.U, Nocianitri, K.A., Nursini, N.W. 2008a. Isolasi dan Karakterisasi Bakteri Asam Laktat dari Susu Kuda Sumbawa. J. Vet. 9:33-40.
Sujaya, I.N., Dwipayanti, N.M.U., Suariani, N.L.P., Widarini, N.P., Nocianitri, K.A., Nursini, N.W., 2008b. Uji in vitro ketahanan Lactobacillus spp. isolat susu kuda Sumbawa pada model saluran pencernaan. J. Vet. 9:52-59.
Sujaya, I N. Amachi, S. Yokota, A. Asano, K. and Tomita, F. 2001. Identification and characterization of lactic acid bacteria in ragi tape. W. J. .Microbiol. Biotechnol., 17: 349-357.
Sujaya, I N., D.M. Sukrama, K.J.P. Pinatih. 2006. Efek bifidogenik pisang secara in vitro
dalam usaha pengembangan probiotic bifidobacterium. Laporan hasil penelitian Riset Pembinaan Ilmu dan Teknologi Kedokteran (RISBIN IPTEKDOK-2006) (unpublished)
Sujaya, I N. 2010. Development of Probiotic for Diarrheagenic Pathogens. International Symposium on Bioscinece and Biotechnology, Udayana University, 14-17 Sepet. 2010
Sujaya, I.N, DWM Sukrama, Y. Ramona, K.A Nocianitri, T Sone, K Asano. 2012. Resistantce of Lactobacillus sp. F213 in human gastrointestinal tract as reveal by Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis of fecal microbiome. (Hlaporan peneklitian Kerja sama luar negeri, Unud).
Sujaya, I.N, DWM Sukrama, Y. Ramona, K.A Nocianitri, T Sone, K Asano. 2013. Resistantce of Lactobacillus sp. F213 in human gastrointestinal tract as reveal by Polymerase Chain Reaction-Denaturing Gradient Gel Electrophoresis of fecal microbiome. (Hlaporan peneklitian Kerja sama luar negeri, Unud).
Torano, M.P., Medici, M., Perdigon, G., Ruiz Holgado, A.P., Valdae, G.F. 1998. Efidennce of hypocholesterolemic effect of Lactobacillus reuteri in hypercholesterolemic mice. J. Dairy Sci., 81:2336-2340.
Lampiran: UNDANGAN SEBAGAI PEMBICARA the 5th IC-ISLAB
Hasil penelitian ini akan dipresentasi dalam The 5th International Conference of Indonesian Society for Lactic Acid Bacteria (5th IC-ISLAB)
Guest Speaker Invitation for The 5th International Conference of Indonesian Society for
Lactic Acid Bacteria (5th IC-ISLAB)
Islab Islab
Dear Dr. I Nengah Sujaya,
Indonesian Society for Lactic Acid Bacteria (ISLAB) would like to organize its 5th International Conference at Faculty of Agricultural Technology, Universitas Gadjah Mada, Yogyakarta, Indonesia in November 13-14, 2015, and now being proposed to be Scopus indexed. During this conference we would like to invite you as a guest speaker in this conference.
However since we are limited in budget, we are truly sorry that we couldn't afford your airfare from your country to Indonesia, but we will provide your local transportation and accommodation during your stay in Yogyakarta.
We also would like to ask your permission to put your name as our guest speaker in the conference's publication.
We are looking forward to your positive respond. Thank you and I look forward to hearing from you.
CC: Prof. Dr. Endang S. Rahayu (Chairperson of Indonesian Society for Lactic Acid Bacteria)
With kind Regards, Linda Windiarti
Organizing Committee
The 5th International Conference of Indonesian Society for Lactic Acid Bacteria (5th IC-ISLAB) Faculty of Agricultural Technology, Gadjah Mada University,
Bulaksumur, Yogyakarta, 55281. Indonesia Phone/Fax : +62-274-549650,
Resistance of Lactobacillus sp F213 in Human Gastrointestinal Tract and Its Health Promoting Effects.
I Nengah Sujaya
Lab. Bioscience and Biotechnology, School of Public Health, Fact. Medicine Udayana University, Badung Bali Indonesia
ABSTRACT
Increasing death causing by noncommunicable diseases (NCD) is not only more common in modern societies but also in developing countries. Tis disease is thought associated with unhealthy life style. Probiotic offers opportunities in managing NCD and becoming popular world wide. This research was aimed to determine the resistance of Lactobacillus sp F213 (LbF213) in human gastrointetstinal tract and its health promoting effects. Fifteen healthy human subjects participated in this study were administered with a capsule containing 7.5 x 108 cfu for 28 days. Fecal and blood samples were collected before, during and after 28 days administration. The population of lactic acid bacteria and anerobes in fecal samples was enumerated by culture methods, while the LbF213 in fecal samples were detected using PCR-DGGE of fecal microbiomic DNA. Health promoting parameters such as lipid profile and TNF alfa were analysed in blood samples.
The results showed that administration of 7.5 x 108 cfu for 4 weeks increased LAB population, 2.19X109 cfu/g before administration to 1.58x1010 after 28 days adminstration, while total anaerob decreased from 4.47x1010 before admnistration to 1.78x1010 cfu/g after 28 days. Lactobacillus sp F213 was detected in fecal samples suggested that the LbF213 survived in the human GI and play role in modulation of human intestinal microbiota. The LbF213 altered lipid profile of human subjects, which likely to be subject dependent. The F213 reduced 6,29% cholesterol, 7,70% HDL and 8,54% LDL and increased 0,19% of TG after 28 days administration. The effect of LbF213 in lowering blood cholesterol was found to be higher in high blood cholesterol subjets compared to normal blood cholesterol subjects, 8.1% and 4.06%, respectively. Administration of F213 for 28 days lowered about 36% of TNF alfa titer in serum, 0.91 pg/dL before and 0.59 pg/dL after adinistration. Those results demosntrated that LbF213 resisted in human GI, slightly modify human normal intestinal microbiota and excerted health promoting effects.