AKTIVITAS ENZIM PENDEGRADASI KARBOFURAN DARI Pseudomonas aeruginosa Strain M111 DAN
P. aeruginosa Strain TS2
SKRIPSI
RIZKI FERNANDO SARAGIH 150805039
PROGRAM STUDI S1 BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
UNIVERSITAS SUMATERA UTARA
AKTIVITAS ENZIM PENDEGRADASI KARBOFURAN DARI Pseudomonas aeruginosa Strain M111 DAN
P. aeruginosa Strain TS2
SKRIPSI
DIAJUKAN UNTUK MELENGKAPI TUGAS DAN MEMENUHI SYARAT MENCAPAI GELAR SARJANA SAINS
RIZKI FERNANDO SARAGIH 150805039
PROGRAM STUDI S1 BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
MEDAN 2020
UNIVERSITAS SUMATERA UTARA
PERNYATAAN ORISINALITAS
AKTIVITAS ENZIM PENDEGRADASI KARBOFURAN DARI Pseudomonas aeruginosa Strain M111 DAN
P. aeruginosa Strain TS2
SKRIPSI
Saya menyatakan bahwa skripsi ini adalah hasil karya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, November 2020
Rizki Fernando Saragih 150805039
UNIVERSITAS SUMATERA UTARA
i
UNIVERSITAS SUMATERA UTARA
ii AKTIVITAS ENZIM PENDEGRADASI KARBOFURAN
DARI Pseudomonas aeruginosa Strain M111 DAN P. aeruginosa Strain TS2
ABSTRAK
Karbofuran merupakan bahan aktif dalam pembuatan insektisida yang banyak digunakan dalam industri pertanian. Penelitian ini bertujuan mengetahui jenis enzim yang dihasilkan bakteri Pseudomonas aeruginosa Strain M111 dan P. aeruginosa Strain TS2 serta aktivitasnya dalam mendegradasi karbofuran. Jenis enzim pendegradasi karbofuran dapat diketahui berdasarkan produk (senyawa turunan) yang terbentuk dari hasil degradasi karbofuran. Pengukuran kurva pertumbuhan kedua bakteri menggunakan media LB. Identifikasi enzim karbofuran hidrolase dilakukan dengan Gas Chromatography-Mass Spectrometry (GC-MS). Produksi enzim ekstraseluler dan intraseluler menggunakan media MGM yang mengandung karbofuran. Aktivitas enzim karbofuran hidrolase ditentukan dengan menggunakan spektrofotometer pada panjang gelombang 700 nm. Hasil penelitian ini menunjukkan bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 memiliki waktu pertumbuhan optimum 24 jam dan hasil analisis GC-MS menunjukkan bahwa kedua isolat menghasilkan enzim karbofuran hidrolase secara intraseluler dan ekstraseluler.
Bakteri P. aeruginosa Strain M111 memiliki nilai aktivitas enzim intraseluler sebesar 0,043 U/ml dengan waktu inkubasi optimum lima hari, sedangkan nilai aktivitas ekstraselulernya sebesar 0,023 U/ml dengan waktu inkubasi optimum enam hari.
Bakteri P. aeruginosa Strain TS2 memiliki nilai aktvitas enzim intraseluler sebesar 0,041 U/ml sedangkan aktivitas ekstraselulernya sebesar 0,022 U/ml pada waktu inkubasi optimum yang sama yaitu lima hari.
Kata Kunci: Degradasi, Karbofuran, Karbofuran Hidrolase, Strain Pseudomonas aeruginosa
UNIVERSITAS SUMATERA UTARA
iii ENZYMATIC DEGRADATION OF CARBOFURAN ACTIVITY BY
Pseudomonas aeruginosa strain M111 AND P. aeruginosa strain TS2
ABSTRACT
Carbofuran is an active compound of many insecticides commonly applied in the agricultural industries. This study aimed to determine the type of enzyme produced by Pseudomonas aeruginosa strain M111 and P. aeruginosa TS2 following their activity in carbofuran degradation. Type of enzyme was identified based on the product (derivative compound) of enzymatic degradation of carbofuran. Measurement of the growth curves of the two bacteria was done using LB medium. Carbofuran hydrolase enzyme identification was carried out by Gas Chromatography-Mass Spectrometry (GC-MS). The bacteria were grown in MGM medium containing carbofuran to produced extracellular and intracellular enyzme. Activity of the carbofuran hydrolase enzymes were measured using spectrophotometer at A700 nm. The results of this study indicated that the bacteria P. aeruginosa Strain M111 and P. aeruginosa Strain TS2 had optimum growth at 24 hours of incubation and were detected to produced the carbofuran hydrolase enyzme extracellularly and intracellularly. P. aeruginosa bacteria strain M111 has an intracellular enzyme activity value of 0.043 U/ml with five days as optimum incubation time mean while the extracellular enyzme activity was 0.023 U/ml with six days as optimum incubation time. P. aeruginosa bacteria Strain TS2 has an intracellular enzyme activity value of 0.041 U/ml mean while extracellular 0.022 U/ml at the same optimum incubation time of five days.
Keywords: Carbofuran, Carbofuran Hydrolase, Degradation, Strains Pseudomonas aeruginosa
UNIVERSITAS SUMATERA UTARA
iv PENGHARGAAN
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa atas kasih dan karunia- Nya penulis dapat menyelesaikan skripsi yang berjudul “Aktivitas Enzim Pendegradasi Karbofuran dari Pseudomonas aeruginosa Strain M111 dan P.
aeruginosa Strain TS2 ” yang merupakan salah satu syarat untuk meraih gelar Sarjana Sains di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sumatera Utara.
Dalam kesempatan ini penulis ingin mengucapkan terimakasih kepada kedua orang tercinta, Ayah Jaya Saragih dan Ibunda Darliana Br. Sinaga yang telah memberikan kesempatan kepada penulis untuk meraih cita-cita menjadi seorang Sarjana Biologi. Doa, kasih sayang, pengorbanan serta dukungan moril maupun materil selalu penulis rasakan selama menjalani perkuliahan. Terimakasih juga penulis ucapkan kepada Bang Eri, Bang Rizal dan Ade selaku saudara yang selalu memberikan semangat dan tempat berbagi keluh-kesah.
Terimakasih penulis sampaikan kepada Ibu Dra. Nunuk Priyani, M.Sc sebagai pembimbing penulis yang telah banyak memberikan arahan, waktu, nasihat serta motivasi kepada penulis dalam menyelesaikan skripsi ini. Penulis juga mengucapkan terimakasih kepada Bapak Prof. Dr. Erman Munir, M.Sc dan Ibu Dr. Yurnaliza, M. Si sebagai penguji yang telah banyak memberikan waktu, perbaikan dan saran kepada penulis dalam penyelesaian skripsi ini.
Ucapan terimakasih juga penulis sampaikan kepada Ibu Dr. It Jamilah, M. Sc selaku Dosen Pembimbing Akademik penulis, Ibu Dr. Saleha Hannum, M.Si dan Bapak Riyanto Sinaga M.Si selaku Ketua dan Sektretaris Departemen Biologi FMIPA USU yang telah memberikan banyak kemudahan kepada penulis. Penulis juga mengucapkan terimakasih kepada laboran Kak Pia, Kak Siti dan Bang Yudha serta kepada pegawai Departemen Biologi FMIPA USU Bang Ewin dan Kak Winda yang telah membantu penulis dalam keperluan laboratorium dan administrasi selama perkuliahan. Terimakasih penulis ucapkan kepada seluruh Bapak dan Ibu Dosen yang
UNIVERSITAS SUMATERA UTARA
v tidak dapat penulis sebutkan satu-persatu, terimakasih atas segala ilmu yang bermanfaat, arahan, nasihat dan kemurahan hati selama masa perkuliahan.
Ucapan terimakasih juga penulis ucapkan kepada Anna yang selalu memberikan dukungan, semangat serta bantuan kepada penulis, yang selalu ada bagi penulis baik suka maupun duka. Penulis juga mengucapkan terimakasih kepada Asisten Mikrobiologi (Bang Randi, Bang Irfan, Anna, Jetor, Jema, Betri, Wita, Novita, Ruth, Cici, Edi, Diki, CG dan Nusaibah) yang telah menghadirkan tawa selama penulis melakukan penelitian. Kepada teman-teman Spirit of Youth (SOY) Angkatan 2015 yang telah memberikan kesan selama masa perkuliahan dan praktikum, terkhusus kepada para lelaki veteran yang tergabung dalam Demonic Wolves (Mujab, Agum, Ardi, Fajar, Farchan dan Erdy) yang telah menjadi rekan berpetualang penulis selama masa perkuliahan. Kepada teman-teman PKBKB’15 (Ardi, Erdi, Destiny, Novita, Ayu, Juwita, Mika, Anna, Jetor, Jema, Betri, Novita, Ruth dan Marvelyn) yang telah menjadi wadah untuk membangun kerohanian penulis dan menjadi tempat untuk bertukar pikiran. Penulis juga mengucapkan terimakasih kepada Kakak Asuh kak Anita dan adik asuh (Laura dan melati) yang selalu memberikan semangat kepada penulis dan kepada Fajar, Jo, Aldi, Tanaka, Farhan, Almed dan Bang Bagus yang selalu memberikan keceriaan di Kos Cempaka VII.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan oleh karena itu penulis mengharapkan kritik dan saran yang bersifat membangun dari semua pihak demi kempurnaan skripsi ini. Atas partisipasi dan dukungan penulis ucapkan terimakasih.
Medan, November 2020
Rizki Fernando Saragih
UNIVERSITAS SUMATERA UTARA
vi DAFTAR ISI
Halaman
Lembar Pengesahan i
Abstrak ii
Abstract iii
Penghargaan iv
Daftar Isi vi
Daftar Tabel viii
Daftar Gambar ix
Daftar Lampiran x
Daftar Singkatan xi
BAB 1 PENDAHULUAN
1.1 Latar belakang 1
1.2 Permasalahan 3
1.3 Tujuan 3
1.4 Manfaat 3
BAB 2 TINJAUAN PUSTAKA
2.1 Pestisida Karbofuran 4
2.2 Pseudomonas aeruginosa 5
2.2.1 Klasifikasi 5
2.2.2 Karakteristik 6
2.3 Degradasi Pestisida Karbofuran 6
2.4 Karbofuran Hidrolase 9
BAB 3 METODE PENELITIAN
3.1 Waktu dan Tempat 11
3.2 Penentuan Kurva Pertumbuhan Pseudomonas aeruginosa
Strain M111 dan P. aeruginosa Strain TS2 11 3.3 Penentuan Jenis Enzim Pengurai Karbofuran yang
Dihasilkan Bakteri Pseudomonas aeruginosa Strain M111
dan P. aeruginosa Strain TS2 11
3.3.1 Preparasi Sampel 11
3.3.2 Pengujian Sampel dengan GC-MS 12
3.4 Produksi Enzim Ekstraseluler dan Intraseluler 12 3.5 Pengukuran Aktivitas Enzim Karbofuran Hidrolase dari
Pseudomonas aeruginosa Strain M111 dan P. aeruginosa
Strain TS2 13
3.6 Penentuan Kadar Protein Metode Bradford 14
UNIVERSITAS SUMATERA UTARA
vii BAB 4 HASIL DAN PEMBAHASAN
4.1 Kurva Pertumbuhan Bakteri pada Media Luria-Bertani (LB) 15 4.2 Penentuan Jenis Enzim Pnegurai Karbofuran 17 4.3 Aktivitas Enzim Ekstraseluler dan Intraeluler
Karbofuran Hidrolase 22
BAB 5 KESIMPULAN DAN SARAN
5.1 Kesimpulan 25
5.2 Saran 25
DAFTAR PUSTAKA 26
LAMPIRAN 29
UNIVERSITAS SUMATERA UTARA
viii DAFTAR TABEL
Nomor Tabel
Judul Halaman
4.1 Hasil Identifikasi Senyawa pada Kontrol dengan GC- MS
19 4.2 Hasil Identifikasi Senyawa Hasil Degradasi
Karbofuran oleh Bakteri P. aeruginosa Strain M111 dengan GC-MS
20
4.3 Hasil Identifikasi Senyawa Hasil Degradasi Karbofuran oleh Bakteri P. aeruginosa Strain TS2 dengan GC-MS
20
4.4 Aktivitas Enzim, Konsentrasi Protein dan Aktivitas Spesifik Karbofuran Hidrolase pada Waktu Inkubasi 10 menit
23
UNIVERSITAS SUMATERA UTARA
ix DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Struktur Karbofuran 5
2.2 Jalur Degradasi Pestisida Karbofuran 9
4.1 Kurva Pertumbuhan Bakteri di media LB pada Suhu Ruang
15
4.2 Kromatogram Kontrol 18
4.3 Kromatogram Senyawa Hasil Degradasi Karbofuran oleh bakteri P. aeruginosa Strain M111
18 4.4 Kromatogram Senyawa Hasil Degradasi Karbofuran
oleh bakteri P. aeruginosa Strain TS2
18 4.5 Hidrolisis Karbofuran menjadi Karbofuran 7-Phenol
oleh Enzim Karbofuran Hidrolase yang dihasilkan oleh P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2
21
4.6 Aktivitas Enzim Karbofuran Hidrolase Ekstraseluler dan Intraseluler pada pH 7,5 dan suhu 30°C
22
UNIVERSITAS SUMATERA UTARA
x DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1 Komposisi Media 29
2 Kurva Standar Karbofuran Fenol dan BSA 30
3 Pengukuran Akivitas Karbofuran Hidrolase 31
4 Penentuan Kadar Protein (Bradford, 1976) 32
UNIVERSITAS SUMATERA UTARA
xi DAFTAR SINGKATAN
LB = Luria Bertani
MGM = Medium Garam Mineral
GC-MS = Gas Chromatography- Mass Spektrometry BSA = Bovine Serum Albumin
UNIVERSITAS SUMATERA UTARA
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Karbofuran (2,3-dihydro-2,2-dimethyl-7-benzofuranoyl-N-methylcarbamate) pertama kali diperkenalkan pada tahun 1967 sebagai pestisida. Karbofuran merupakan pestisida karbamat dengan spektrum luas yang digunakan untuk mengendalikan hama serangga yang menyerang tanaman seperti jagung, kentang dan stroberi (Feng et al., 1997). Pestisida ini telah digunakan secara luas dalam bidang pertanian karena keefektifannya dalam mengendalikan berbagai hama serangga. Pestisida ini dalam beberapa tahun terakhir telah menjadi perhatian karena toksisitasnya yang relatif tinggi terhadap mamalia serta memiliki mobilitas yang tinggi di tanah. Oleh karena itu, pestisida ini sudah diklasifikasikan menjadi pestisida yang sangat berbahaya. Nilai LD50 karbofuran pada tikus dan hewan lain juga telah dilaporkan dan memiliki variasi nilai dari 2-9 mg/kg berat badan. Di lingkungan, pestisida ini memiliki polaritas yang tinggi namun absorpsivitas yang rendah sehingga menyebabkan kontaminasi pada sungai, danau dan air tanah (Bano dan Musarat, 2004).
Massiha et al. (2011) menyebutkan hanya 2-3% pestisida secara efektif digunakan untuk mencegah, mengendalikan dan membunuh hama serangga, sedangkan sisanya tetap berada di lingkungan. Kurangnya perhatian dalam penanganan residu pestisida ini menyebabkan terjadinya akumulasi residu pestisida di lahan pertanian. Menurut Chaudry dan Ali (1988), serangga target yang sering terpapar residu pestisida ini dapat mengembangkan resistensi analog dengan evolusi gen resistensi antibiotik dalam serangga, sehingga menyebabkan pestisida tersebut tidak efektif lagi.
Senyawa kimia yang terkandung dalam pestisida khususnya karbofuran, selain memiliki toksisitas yang tinggi, juga memilki sifat rekalsitran dan cenderung membentuk soil-bounded residues yang sangat sulit terurai secara alami (Widyati et al., 2001). Sejumlah mikroorganisme yang terpapar residu pestisida secara terus- menerus, memiliki kemampuan untuk menguraikan residu pestisida tersebut dan
UNIVERSITAS SUMATERA UTARA
2
menggunakannya sebagai sumber energi. Kemampuan ini berhubungan dengan adaptasi panjang mikroorganisme pada lingkungan dimana residu pestisida berada (Porto et al., 2012). Proses adaptasi ini bisa jadi telah mempengaruhi ekspresi gen, regulasi, dan rekombinasi genetik diantara mikroorganisme (Chaudry dan Ali, 1988).
Sejumlah bakteri telah diketahui memiliki kemampuan dalam mendegradasi karbofuran, yang paling terkenal berasal dari genus Pseudomonas, Flavobacterium, Achromobacterium, Sphingomonas dan Arthrobacter. Beberapa spesies dari genus- genus tersebut telah berhasil diisolasi dan dikarakterisasi dalam upaya untuk lebih memahami peran bakteri dalam mendegradasi karbofuran dari lingkungan (Kim et al., 2004).
Biodegradasi senyawa pestisida oleh mikroorganisme umumnya melalui sistem enzimatis (Hernandez et al., 2013). Setiap tahapan degradasi dikatalis oleh enzim spesifik yang diproduksi pada lingkungan eksternal maupun internal sel.
Degradasi pestisida melalui salah satu enzim akan berhenti pada tahapan tertentu jika tidak terdapat enzim yang tepat untuk mendegradasinya. Ketidaktersediaan enzim yang tepat merupakan salah satu alasan mengapa suatu pestisida daat bertahan lama (persisten) di dalam tanah (Nawaz et al., 2011).
Jalur biodegradasi karbofuran terjadi melalui hidrolisis ikatan labil metil karbamat, menghasilkan karbofuran-7-fenol dan methylamine (Chapalamadugu dan Chaudhry, 1992). Kim et al. (2004) telah berhasil mengisolasi Sphingomonas sp. strain SB5 yang mampu mendegradasi karbofuran-7-fenol menjadi 2-hydroxy-3- (3- methlypropan-2-ol) fenol sebagai produk hasil degradasi. Produk tersebut digunakan mikroorganisme sebagai sumber tunggal karbon dan nitrogen. Menurut Chapalamadugu dan Chaudhry (1992) dan Chaudhry et al. (2002), karbofuran juga dapat terdegradasi melalui oksidasi di cincin furanil atau cincin benzen menghasilkan metabolit oksidatif karbofuran berupa 3-hidroksikarbofuran, 3-ketokarbofuran, 3- hidroksikarbofuran, 4-hidroksikarbofuran, 5-hidroksikarbofuran dan bersifat lebih toksik dibandingkan produk hasil hidrolisis karbofuran.
Zupliker (2015) telah berhasil mengisolasi beberapa bakteri penghasil surfaktan dari lahan pertanian Berastagi yang mampu mendegradasi pestisida berbahan aktif karbofuran secara efektif. Isolat tersebut diantaranya yaitu Pseudomonas aeruginosa Strain M111 dan Pseudomonas aeruginosa Strain TS2.
UNIVERSITAS SUMATERA UTARA
3
Prastyo (2017) juga telah mengimobilisasi kedua isolat bakteri tersebut dalam alginate maupun dalam matriks polyurethane dan dujikan kemampuannya dalam menguraikan pestisida berbahan aktif karbofuran. Hasil penelitian menunjukkan bahwa kemampuan sel terimobilisasi tersebut tidak berbeda jauh dengan kemampuan sel bebasnya. Uji viabilitas juga menunjukkan bahwa setelah masa simpan selama 3 bulan dalam bentuk terimobilisasi, isolat–isolat tersebut masih menunjukkan viabilitas yang tinggi (95%).
1.2 Permasalahan
Bakteri Pseudomonas aeruginosa Strain M111 dan P. aeruginosa Strain TS2 telah diketahui memiliki efektivitas yang tinggi dalam mendegradasi karbofuran.
Kedua isolat ini nantinya diharapkan dapat dijadikan sebagai agen biodegradasi pestisida karbofuran dilingkungan, sehingga perlu diketahui jenis enzim apa yang dihasilkan kedua isolat tersebut serta aktivitasnya dalam mendegradasi karbofuran.
1.3 Tujuan
Tujuan dari penelitian ini adalah:
a. Untuk mengetahui jenis enzim yang dihasilkan oleh P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 dalam mendegradasi karbofuran dan aktivitasnya
b. Untuk mengetahui aktivitas enzim ekstraseluler dan intraseluler dari enzim yang dihasilkan P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 dalam mendegradasi pestisida karbofuran.
1.4 Manfaat
Manfaat dari penelitian ini adalah memberikan informasi tentang jenis enzim dan aktivitasnya dari P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 yang terlibat dalam mendegradasi karbofuran serta produk samping yang dihasilkan.
UNIVERSITAS SUMATERA UTARA
BAB 2
TINJAUAN PUSTAKA
2.1 Pestisida Karbofuran
Pestisida adalah bahan kimia yang digunakan untuk membunuh hama, baik insekta, jamur maupun gulma. Pestisida dikelompokkan menjadi insektisida (pembunuh serangga), fungisida (pembunuh jamur) dan herbisida (pembunuh tanaman pengganggu). Pestisida telah digunakan secara luas untuk tujuan memberantas hama dan penyakit tanaman dalam bidang pertanian. Pestisida juga digunakan dalam rumah tangga untuk memberantas nyamuk, kecoa dan berbagai serangga pengganggu lainnya (Ware, 1983).
Karbamat merupakan salah satu golongan pestisida yang paling banyak digunakan dalam bidang pertanian. Karakteristik dari pestisida turunan karbamat adalah memiliki sifat polaritas yang tinggi, mudah larut di air dan sifat panasnya yang tidak stabil (thermal instability). Karakteristik tersebut yang menyebabkan pestisida turunan karbamat memiliki sifat toksik yang akut. Secara kimia, pestisida karbamat merupakan kelompok ester dan karbamat serta senyawa organik turunan dari asam karbamat. Kelompok pestisida ini dapat dibagi ke dalam jenis benzimidazole, N-metil, N-fenil dan thiokarbamat. Karbamat adalah inhibitor dari enzim AchE (asetilkolinesterase) dan merupakan senyawa yang menyebabkan kasus keracunan di lingkungan masyarakat (Porto et al., 2012).
Karbofuran (2,3-dhydro-2,2-dhydro-2,2-7-benzofuranyl-n-methylcarbamat) merupakan salah satu pestisida dari golongan karbamat yang berspektrum luas untuk pengendalian hama pada tanaman padi, jagung, jeruk, alfalfa dan tembakau. Struktur karbofuran yang terdiri dari hidrokarbon aromatik atau cincin benzen membuat karbofuran bersifat persisten dan sukar terdegradasi di alam (Gambar 2.1). Karbofuran merupakan insektisida yang bersifat sistemik dan berspektrum luas sebagai nematosida dan akarisida. Efektivitas pestisida karbofuran dalam memberantas hama pada lahan pertanian menyebabkan pestisida ini menjadi salah satu pestisida yang paling sering diaplikasikan pada lahan pertanian. Pestisida karbofuran yang
UNIVERSITAS SUMATERA UTARA
5
merupakan turunan dari asam karbamat pertama kali disintesis pada tahun 1967 di Amerika Serikat dengan nama dagang Furadan. Karbofuran bersifat sangat toksik pada unggas dengan kisaran nilai LD 50 sebesar 0,37-6,0 mg/kg BB tergantung pada masing-masing spesies unggas. Unggas umumnya sangat peka terhadap karbofuran melalui kontak langsung baik melalui penyemprotan (spraying), menelan granul karbofuran, minuman tercemar dan memakan serangga yang mati akibat karbofuran (Indraningsih, 2008). Sementara pada manusia, adanya penumpukan pestisida karbofuran di dalam darah dapat menyebabkan terganggunya metabolisme enzim asetilkolinesterase (AChE), serta bersifat karsinogenik yang dapat merangsang sistem syaraf menyebabkan parestesia, iritabilitas, tremor, terganggunya keseimbangan, kejang-kejang serta dapat menyebabkan kematian (Lu, 1995).
Gambar 2.1 Struktur Karbofuran (Trotter et al., 1991)
Penggunaan pestisida karbofuran untuk memberantas hama pertanian tidak dapat disangkal memang telah memberikan sumbangan sangat besar dalam meningkatkan hasil produksi tanaman pertanian. Semakin intensifnya penggunaan pestisida karbofuran telah mengakibatkan akumulasi residu pestisida pada lingkungan akuatik dan teresterial serta kematian biota bukan sasaran. Residu pestisida dalam lingkungan pertanian juga menyebabkan tanah bersifat asam serta menurunkan produktivitas lahan (Nofyan, 2009).
2.2 Pseudomonas aeruginosa 2.2.1 Klasifikasi
Kingdom : Bacteria Phylum : Proteobacteria
UNIVERSITAS SUMATERA UTARA
6
Class : Gamma Proteobacteria Order : Pseudomonadales Family : Pseudomonadaceae Genus : Pseudomonas
Spesies : Pseudomonas aeruginosa
2.2.2 Karakteristik
Pseudomonas aeruginosa merupakan bakteri Gram negatif yang bersifat motil dan berbentuk batang, dengan ukuran sekitar 0,6 × 2 μm. Bakteri ini dapat muncul dalam bentuk penataan tunggal, berpasangan atau kadang-kadang dalam bentuk rantai pendek. Bakteri ini dalam biakan membentuk koloni besar dan halus dengan permukaan yang datar dan meninggi. P. aeruginosa adalah bakteri obligat yang dapat tumbuh dengan mudah pada berbagai jenis media pembiakan, terkadang mengeluarkan bau manis atau menyerupai bau buah-buahan seperti anggur atau seperti jagung. Beberapa strain menyebabkan hemolisis darah (Brooks et al., 2013).
Bakteri ini juga sering menghasilkan pigmen piosianin, pigmen kebiru-biruan yang tidak berfluoresensi, yang berdifusi kedalam agar. Spesies Pseudomonas yang lain tidak menghasilkan piosianin. Banyak strain Pseudomonas aeruginosa juga memproduksi pigmen pioverdin yang befluoresensi, yang memberikan warna kehijauan pada agar. Beberapa strain menghasilkan pigmen piorubin yang berwarna merah gelap atau pigmen piomelanin yang berwarna hitam (Brooks et al., 2013).
2.3 Degradasi Pestisida Karbofuran
Secara umum degradasi pestisida adalah proses terjadinya penguraian pestisida oleh mikroba, reaksi kimia, dan sinar matahari. Prosesnya dapat terjadi setiap saat dari hitungan jam, hari, sampai tahunan bergantung pada kondisi lingkungan dan sifat-sifat kimia pestisida (Susanti, 2015). Sifat kimiawi dan fisik pestisida seperti kelarutan, polaritas, volatilitas dan stabilitas merupakan faktor penentu jalur dan laju degradasi pestisida (Fushiwaki dan Urano, 2001). Berbagai teknik reduksi residu atau cemaran insektisida dalam produk pangan dan lingkungan telah berkembang melalui berbagai metode. Pengurangan residu/cemaran insektisida umumnya dibagi dalam tiga
UNIVERSITAS SUMATERA UTARA
7
kelompok yaitu secara fisik (pemanasan dan penguapan), kimia dan biologi (Indraningsih, 2008).
Menurut Susanti (2015), degradasi secara biologi (biological degradation) adalah degradasi pestisida oleh mikroorganisme seperti fungi dan bakteri. Proses degradasi oleh mikroba ini akan mengalami peningkatan bila kelembaban, temperatur dan pH tanah cocok untuk pertumbuhan mikrob serta ketersediaan oksigen, dan fertilitas tanah yang cukup baik. Degradasi secara kimia (chemical degradation) adalah proses degradasi akibat reaksi kimia. Tipe dan kecepatan reaksi yang terjadi dipengaruhi oleh ikatan antara pestisida dengan tanah, temperatur dan pH tanah.
Degradasi secara fisik (physical degradation) adalah degradasi pestisida oleh adanya sinar matahari. Tingkat degradasi akibat sinar matahari ini dipengaruhi oleh intensitas dan spektrum sinar matahari, lamanya terpapar, dan sifat pestisida.
Biodegradasi sempurna dari pestisida melibatkan proses oksidasi dari senyawa utama membentuk karbondioksida dan air. Proses ini menyediakan karbon dan energi untuk pertumbuhan dan reproduksi mikroba. Setiap tahapan degradasi dikatalis oleh enzim spesifik yang diproduksi melalui degradasi sel atau enzim yang ada pada lingkungan eksternal sel. Degradasi pestisida melalui salah satu enzim eksternal atau internal akan berhenti pada tahapan tertentu jika tidak terdapat enzim yang tepat untuk mendegradasinya. Ketidaktersediaan enzim yang tepat merupakan salah satu alasan mengapa suatu pestisida daat bertahan lama (persisten) di dalam tanah. Jika mikroorganisme yang sesuai tidak ada di dalam tanah atau jika populasi mikroorganisme pendegradasi jumlahnya berkurang maka mikroorganisme spesifik dapat ditambahkan atau diintroduksi ke dalam tanah untuk meningkatkan aktivitas atau kemampuan mikroorganisme yang sudah ada dalam mendegradasi pestisida (Nawaz et al., 2011).
Beberapa penelitian tentang degradasi pestisida karbofuran oleh mikroorganisme yang dilakukan, telah menunjukkan degradasi sempurna dari struktur cincin aromatik. Feng et al. (1997) melaporkan strain CF06 dari genus Sphingomonas mampu sepenuhnya memineralisasi cincin aromatik dari karbofuran. Kim et al. (2004) berhasil mengidentifikasi strain SB5a dari genus Sphingomonas yang diisolasi dari tanah yang telah diaplikasikan karbofuran selama lima tahun, dan menunjukkan aktivitas metabolit pada cincin aromatik dengan menghidrolisis karbofuran-7-fenol,
UNIVERSITAS SUMATERA UTARA
8
menghasilkan metabolit intermediet 2-hidroksi-3- (3-methylpropan-2-ol) –phenol yang kemudian diubah menjadi red metabolite. Selanjutnya, Park et al. (2006) mengkarakterisasi red metabolite ini menggunakan spektrometri massa dan analisis resonansi magnetik nuklir (NMR) sebagai 5- (2-hidroksi-2-metilpropil) -2, 2-dimetil- 2,3-dihidro-nafto [2,3-6] furan-4,6,7,9-tetrone, lebih lanjut penelitian ini menunjukkan bahwa red metablite ini berasal dari kondensasi beberapa metabolit dari degradasi 2- hidroksi-3-(3 methylpropan-2-ol) -phenol (Park et al., 2006). Selain itu, Yan et al.
(2007) telah berhasil mengisolasi dan mengkarakterisasi isolat Strain FND-3 dari genus Novosphingobium yang diisolasi dari sistem pengolahan air limbah di sebuah perusahaan manufaktur pestisida di Cina. Hasil penelitian menunjukkan bahwa selain mendegradasi cincin aromatik karbofuran dengan melalui jalur hidrolitik dan menghasilkan metabolit 2-hidroksi-3- (3-methylpropan-2-ol) fenol, bakteri ini juga memiliki kemampuan untuk menghidrolisis ikatan eter cincin furanyl dari karbofuran, yang menghasilkan metabolit 2-hidroksi-3- (3- methylpropan-2-ol) benzena-N- metilkarbamat.
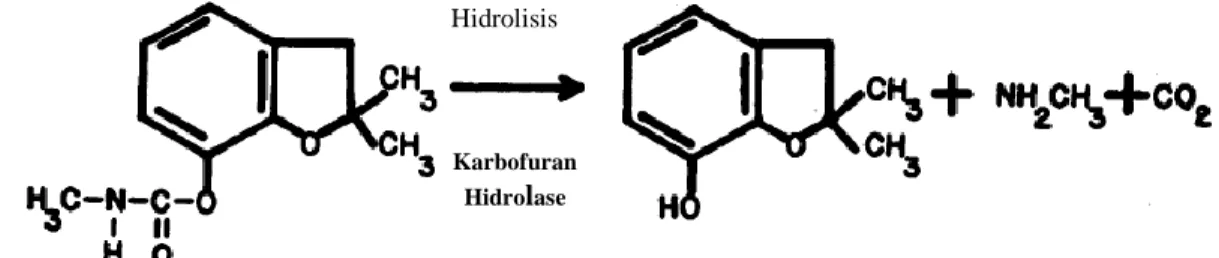
Menurut Rozo et al. (2013), proses hidrolisis karbofuran terjadi melalui dua tahap, yaitu pemutusan ikatan ester pada gugus karbonil dari asam N-metilkarbamat yang menempel pada fenol atau ikatan amida dari asam N-metilkarbamat yang keduanya akan menghasilkan senyawa karbofuran-7-fenol (2,3-dihidro-2,2-dimetil-7- benzofuranol), karbondioksida dan metilamin. Hasil metabolit tersebut kemudian akan digunakan sebagai sumber karbon dan nitrogen oleh sejumlah bakteri yang menghidrolisis karbofuran.
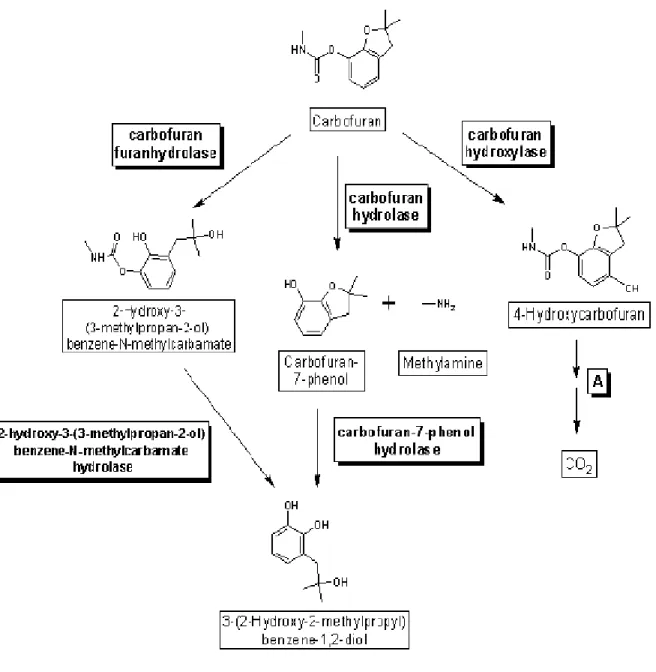
Ortiz-Hernández et al. (2011), menyebutkan setidaknya ada 3 kelompok enzim yang berperan dalam proses degradasi awal pestisida karbofuran, yaitu karbofuran furanhidrolase, karbofuran hidrolase dan karbofuran hidroksilase. Enzim karbofuran furanhidrolase mengubah karbofuran menjadi senyawa 2-hidroksi-3-(3-metilpropan- 2-ol) benzen-N-metilkarbamat. Enzim karbofuran fenol menghidrolis karbofuran menjadi karbofuran-7-fenol sedangkan enzim karbofuran hidroksilase mengubah karbofuran menjadi 3-hidroksikarbofuran. Jalur degradasi pestisida karbofuran dapat dilihat pada Gambar 2.2.
UNIVERSITAS SUMATERA UTARA
9
Gambar 2.2 Jalur Degradasi Pestisida Karbofuran (Ortiz-Hernández et al., 2011)
2.4 Karbofuran Hidrolase
Degradasi pestisida terjadi terutama melalui hidrolisis ikatan metilkarbamat oleh enzim yang disebut karbofuran hidrolase, enzim ini dikodifikasi oleh gen mcd, yang terletak pada plasmid yang pertama kali dideskripsikan dalam Achromobacter sp.. Penelitian lebih lanjut menunjukkan bahwa berbagai bakteri dapat mendegradasi karbamat menggunakan enzim karbofuran hidrolase, antara lain berasal dari genus Pseudomonas, Meshorhizobium, Ralstonia, Rhodococcus, Ochrobactrum dan
UNIVERSITAS SUMATERA UTARA
10
Bacillus. Degradasi karbamat oleh jamur Aspergillus niger juga telah dilaporkan karena kemampuannya dalam memproduksi enzim hidrolase jenis baru, jamur ini mampu menghidrolisis beberapa insektisida N-metilkarbamat (Bharagava, 2019).
Bakteri seperti Sphingomonas sp. dan Arthrobacter sp. mendegradasi karbofuran terlebih dahulu menjadi karbofuran fenol dengan bantuan enzim karbofuran hidrolase, yang selanjutnya didegradasi menjadi 2-hidoksi-3 (3- metilpropan-2-ol) fenol. Telah dilaporkan juga bahwa fungisida carbendazim didegradasi oleh konsorsium mikrob yang diperoleh dari beberapa sampel tanah sawah di Jepang dengan pengayaan kultur berkelanjutan. Setelah itu, karbamat-karbendazim diubah menjadi 2 aminobenzimidazole oleh isolat Pseudomonas sp. (Kim et al., 2004).
UNIVERSITAS SUMATERA UTARA
BAB 3
METODE PENELITIAN
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan dari bulan September 2019 sampai dengan Mei 2020 di Laboratorium Mikrobiologi Fakultas Matematika dan Ilmu pengetahuan Alam, Universitas Sumatera Utara. Analisis GC-MS dilakukan di Laboratorium Forensik POLDA Sumatera Utara.
3.2 Penentuan Kurva Pertumbuhan P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2
Suspensi bakteri dibuat dari koloni bakteri yang berusia 24 jam kemudian disuspensikan dalam NaCl fisiologis 0,9% hingga nilai Optical Density (OD) mencapai 0,5 Abs pada panjang gelombang 600 nm. Sebanyak 1 ml suspensi bakteri dimasukkan ke dalam 100 ml media Luria-Bertani (LB) (komposisi di Lampiran 1 halaman 30). Media diinkubasi di atas orbital shaker dengan kecepatan 120 rpm pada suhu ruang. Untuk mengetahui fase pertumbuhan setiap bakteri, dilakukan pengukuran nilai OD setiap 4 jam selama masa inkubasi hingga diperoleh penurunan nilai OD.
Nilai OD yang diperoleh dibuat dalam bentuk kurva.
3.3 Penentuan Jenis Enzim Pengurai Karbofuran yang dihasilkan bakteri P.
aeruginosa Strain M111 dan P. aeruginosa Strain TS2
3.3.1 Preparasi Sampel
Bakteri diremajakan dalam media Nutrient Agar (NA) selama 1 x 24 jam.
Sebanyak 1 ml suspensi bakteri (OD= 0,5 Abs pada λ 600 nm) dimasukkan ke dalam 9 ml media LB yang mengandung 100 ppm karbofuran. Kultur diinkubasi pada orbital shaker dengan kecepatan 120 rpm pada suhu ruang hingga mencapai fase eksponensial (24 jam). Kultur bakteri kemudian disentrifugasi pada kecepatan 5.000g selama 5 menit. Supernatan yang diperoleh dimasukkan ke dalam 100 ml Media
UNIVERSITAS SUMATERA UTARA
12
Garam Mineral (MGM) (komposisi di Lampiran 1 halaman 29) yang mengandung 100 ppm karbofuran sebagai satu-satunya sumber karbon. Kultur bakteri pada media MGM kemudian diinkubasi di atas orbital shaker pada kecepatan 120 rpm selama 1x24 jam.
Sebanyak 10 ml kultur bakteri pada media MGM dimasukkan ke dalam erlenmeyer yang berisi 50 ml diklorometan (CH2CL2), dibiarkan selama 10 menit, lalu ditambahkan Natrium Sulfat (Na2SO4) hingga membentuk gumpalan pada dasar erlenmeyer. Selanjutnya campuran larutan disaring dengan kertas saring Whattman No.1. Filtrat yang terbentuk diletakkan di atas water bath pada suhu 100°C selama 30 menit atau hingga larutan menjadi pekat untuk dianalisis menggunakan GC-MS (Yan et al., 2007).
3.3.2 Pengujian Sampel dengan GC-MS
Sebanyak 1 μl filtrat dari metode sebelumnya diinjeksikan ke dalam GC-MS menggunakan syringe. GC-MS yang digunakan dalam penelitian ini yaitu GC-MS Agilent 7890A/5975C menggunakan kolom kapiler (0,25mmx30mx0,25μm). Gas pembawa yang digunakan adalah helium (99,9 %) dengan laju aliran 1 ml/menit.
Injeksi sampel menggunakan metode split 50:1. Suhu kolom diatur 2 menit pada suhu 70°C dengan kenaikan suhu 20°C/menit hingga mencapai suhu 280°C. Spektroskopi Masa dioperasikan dengan metode ionisasi elekron (IE) pada mode 70 eV. Sementara nilai massa dipindai mulai dari 50 hingga 500 unit massa atom (amu) dengan kecepatan 1,3 detik/scan (Yan et al., 2007). Hasil dari Spektroskopi Massa (MS) dibaca menggunakan library Wiley versi 14.
3.4 Produksi Enzim Ekstraseluler dan Intraseluler
Produksi enzim ekstraseluler dan intraseluler dari bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 dilakukan dengan cara menumbuhkan kedua bakteri dalam medium MGM yang mengandung 100 ppm karbofuran sebagai satu- satunya sumber karbon. Sebelumnya bakteri dibuat kultur starter pada medium yang sama dengan medium produksi enzim. Medium starter adalah medium MGM (9 ml) yang ditambah 1 ml suspensi bakteri (OD 0,5 pada λ 600 nm). Kultur starter kemudian diinkubasi di atas orbital shaker dengan kecepatan 120 rpm pada suhu ruang selama 1x24 jam.
UNIVERSITAS SUMATERA UTARA
13
Medium produksi enzim pendegradasi karbofuran dibuat dengan menambahkan sebanyak 10 ml kultur starter bakteri ke dalam 90 ml MGM. Kultur bakteri diinkubasi di dalam inkubator shaker dengan kecepatan 120 rpm pada suhu 30°C selama 7 hari. Setiap 24 jam selama masa inkubasi, diambil sebanyak 10 ml cairan kultur untuk diukur aktivitas enzimnya. Cairan kultur disentrifugasi pada kecepatan 10.000g selama 15 menit. Supernatan yang diperoleh merupakan crude enzim yang kemudian diukur aktivitas enzim ekstraselulernya.
Pelet yang terbentuk dikoleksi dan kemudian dicampur dengan Dithiothreitol 1 mM, MnCl2 1 mM, potassium phosphate buffer (pH 7,0) 50 mM dan 5% gliserol.
Campuran pelet kemudian disonikasi dengan sinyal sebesar 20 KHz selama 30 menit.
Suspensi pelet kemudian disentrifugasi pada kecepatan 12.000g selama 60 menit.
Supernatan yang terbentuk merupakan crude enzim yang akan diukur aktivitas enzim intraselulernya.
3.5 Pengukuran Aktivitas Enzim Karbofuran Hidrolase dari P. aeruginosa Strain M111 dan P. aureginosa Strain TS2
Pengukuran aktivitas karbofuran hidrolase dilakukan berdasarkan metode Chaudhry dan Ali (2002), pengukuran dilakukan berdasarkan pada kemampuan phenol untuk berikatan dengan garam diazonium membentuk zat warna azo, yang dapat dideteksi menggunakan spektrofotometer pada panjang gelombang (λ) 700 nm.
Komponen reaksi enzimatis terdiri atas enzim, karbofuran, potassium phosphate buffer 10 mM (pH 7,5) dan pewarna azo. Pewarna diazonium (Fast Blue RR Salt, Sigma Chemica Co) digunakan sebagai penanda dari hasil peruraian karbofuran oleh enzim karbofuran hidrolase. Ikatan azo dari pewarna diazonum akan bereaksi dengan gugus 7-fenol dari produk hasil peruraian karbofuran sehingga akan terjadi perubahan warna medium dari kuning menyadi oranye.
Uji aktivitas enzim karbofuran hidrolase dilakukan dengan mereaksikan sebanyak 1 ml enzim, 1 ml karbofuran 2 mM sebagai substrat, 1 ml potassium phosphate buffer 10 mM (pH 7,5) dan 1 ml pewarna azo 1 mg/ml pada suhu 30°C selama 10 menit. Waktu inkubasi dimulai setelah penambahan substrat pada komponen reaksi enzimatis. Reaksi enzimatis dihentikan dengan memasukkan sampel ke dalam lemari pendingin -20°C selama 10 menit. Nilai absorbansi dari perubahan
UNIVERSITAS SUMATERA UTARA
14
warna yang terbentuk dari hasil reaksi enzim diukur pada panjang gelombang 700 nm.
Aktivitas enzim dihitung dengan cara menghubungkan persamaan regresi dari kurva standar. Kurva standar produk karbofuran menggunakan karbofuran 7-fenol. Satu unit aktivitas enzim (U/ml) didefinisikan sebagai banyaknya enzim yang dapat menghasilkan 1 µmol karbofuran 7-phenol per menit per ml larutan enzim dengan karbofuran sebagai substrat. Aktivitas spesifik enzim (U/mg) ditentukan berdasarkan perbandingan aktivitas enzim (U/ml) terhadap kadar protein dalam sampel yang telah ditentukan. Pengukuran kadar protein dilakukan dengan metode Bradford.
3.6 Penentuan Kadar Protein Metode Bradford
Pengukuran kadar protein enzim dilakukan berdasarkan metode Bradford (1976) dan menggunakan bovine serum albumin (BSA) sebagai standar. Pengukuran diawali dengan pembuatan kurva standar dengan rangkaian konsentrasi (0, 20, 40, 60, 80 dan 100 ppm) dalam akuades dan reagen Bradford (Sigma). Larutan kemudian dihomogenkan dan diukur nilai absorbansinya pada panjang gelombang 595 nm.
Pengukuran dilakukan dengan mencampurkan 1 ml enzim dengan 3 ml reagen Bradford, lalu dihomogenkan dan diukur nilai absorbansinya dengan spektrofotometer UV-VIS mini (Shimadzu) pada panjang gelombang 595 nm. Nilai absorbansi yang diperoleh dimasukkan ke dalam persamaan regresi kurva standar untuk mengetahui kadar konsentrasi protein enzim.
UNIVERSITAS SUMATERA UTARA
BAB 4
HASIL DAN PEMBAHASAN
4.1 Kurva Pertumbuhan Bakteri pada Media Luria-Bertani (LB)
Pengukuran nilai absorbansi pertumbuhan bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 pada medium LB yang dilakukan setiap empat jam sekali selama 48 jam menunjukkan pola pertumbuhan yang sama pada kedua bakteri (Gambar 4.1).
Gambar 4.1 Kurva pertumbuhan isolat bakteri di media LB pada suhu ruang
Berdasarkan Gambar 4.1, dapat diketahui bahwa bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 memiliki pola pertumbuhan yang sama. Nilai absorbansi media kultur bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS-2 pada masa awal inkubasi adalah sama yaitu 0,076. Fase lag atau fase adaptasi ke dua bakteri diperkirakan terjadi pada rentang waktu 0 sampai 4 jam masa inkubasi, namun tidak terdeteksi dikarenakan medium LB yang digunakan merupakan medium yang mengandung semua nutrisi yang diperlukan sehinga menyebabkan singkatnya fase adaptasi kedua isolat. Faktor yang mempengaruhi panjang atau pendeknya fase lag/fase adaptasi sangat ditentukan oleh jumlah sel yang diinokulasikan, kondisi
0.256 1.531
2.039 1.984
0.259 1.571
2.057 1.992
0 0.5 1 1.5 2 2.5
0 4 8 12 16 20 24 28 32 36 40 44 48
Absorbansi (λ=600 nm)
Waktu Inkubasi (Jam)
Pseudomonas aeroginosa Strain M111
Pseudomonas aeruginosa Strain TS2
UNIVERSITAS SUMATERA UTARA
16
fisiologis dan morfologis yang sesuai serta nutrisi yang terkandung dalam media (Dahlan et al., 2017).
Menurut Yuliana (2008), jika mikroba dipindahkan ke dalam suatu medium, mula-mula akan mengalami fase adaptasi untuk menyesuaikan diri dengan kondisi lingkungan sekitarnya. Kenaikan nilai absorbansi menunjukkan bahwa terjadi peningkatan jumlah mikoorganisme dalam media. Nilai absorbansi bakteri P.
aeruginosa Strain M111 setelah empat jam masa inkubasi adalah 0,256 sementara nilai absorbansi bakteri P. aeruginosa Strain TS2 adalah 0,259. Hal ini menunjukkan bahwa kedua bakteri mampu beradaptasi dan menggunakan media LB sebagai sumber nutrisinya. Menurut Wizna et al. (2013), bakteri menjadikan medium pertumbuhannya sebagai bahan makanannya dengan cara mensekresikan enzim-enzim ekstraseluler hidrolitik sehingga dapat menghidrolisis senyawa kimia dalam medium yang diperlukan untuk metabolisme dan pertumbuhan sel.
Isolat bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 mulai memasuki fase logaritmik (eksponensial) setelah 4 jam masa inkubasi. Hal ini ditandai dengan terjadinya peningkatan nilai absorbansi yang signifikan yaitu sebesar 1,531 pada bakteri P. aeruginosa Strain M111dan 1,571 pada bakteri P. aeruginosa Strain TS2 pada jam ke 8. Peningkatan nilai absorbansi media bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 terus terjadi hingga masa inkubasi 32 jam. Pada fase eksponensial mikroba membelah dengan cepat dan konstan. Menurut Middlebeek et al. (1992), kecepatan pertumbuhan pada fase ini sangat dipengaruhi oleh media tempat tumbuhnya seperti pH dan kandungan nutrien, juga kondisi lingkungan termasuk suhu dan kelembaban udara. Fase eksponensial adalah keadaan pertumbuhan yang cepat dengan laju pertumbuhan spesifik (μ) konstan, komposisi selular tetap, sedangkan komposisi kimiawi media biakan berubah akibat terjadinya sintesis produk dalam penggunaan substrat (Puspawati et al., 2010). Menurut Kane dan Kandel (1998) pada fase eksponensial ini nutrisi tersedia dalam jumlah yang banyak, sehingga sel membelah dengan cepat dan mensekresikan berbagai metabolit primer berupa enzim untuk menyediakan sumber energi untuk pertumbuhan sel. Kondisi pertumbuhan bakteri pada fase ini seimbang dan konstan.
Fase stasioner dari kedua bakteri terlihat setelah masa inkubasi 32 hingga 36 jam. Fase stasioner tercapai saat laju pertumbuhan bakteri sama dengan laju
UNIVERSITAS SUMATERA UTARA
17
kematiannya, sehingga jumlah bakteri keseluruhan akan tetap. Keseimbangan jumlah keseluruhan bakteri ini terjadi karena adanya pengurangan derajat pembelahan sel. Hal ini disebabkan oleh kadar nutrisi yang berkurang dan terjadi akumulasi produk toksik sehingga mengganggu pembelahan sel. Fase stasioner ini dilanjutkan dengan fase kematian yang ditandai dengan peningkatan laju kematian yang melampaui laju pertumbuhan (Volk dan Wheeler, 1993).
Fase kematian kedua bakteri ini terjadi setelah masa inkubasi 36 hingga 48 jam. Hal ini sesuai dengan yang disebutkan Fardiaz (1988), bahwa ketika terjadi penurunan nilai absorbansi maka bakteri tersebut sudah memasuki fase kematian.
Menurut Nurhajati et al. (2009), beberapa faktor yang mempengaruhi kematian sel adalah habisnya nutrisi dalam media, populasi yang semakin padat serta kurangnya kadar oksigen dalam media. Sumarsih (2003), menyatakan bahwa pada fase kematian, kecepatan kematian sel terus meningkat sedangkan pembelah sel tidak terjadi, sehingga jumlah sel hidup menurun dengan cepat. Walaupun demikian penurunan jumlah sel hidup tidak akan mencapai nol, dalam jumlah minimum tertentu sel mikroba akan tetap bertahan sangat lama dalam medium tersebut. Berdasarkan kurva pertumbuhan di atas, dapat diketahui bahwa waktu pemanenan sel bakteri P.
aeruginosa Strain M111 dan P. aeruginosa Strain TS2 yang tepat yaitu pada jam ke- 24. Hal ini dikarenakan pada saat ini sel sedang berada pada akhir fase logaritmik yang memiliki aktivitas pertumbuhan yang lebih tinggi dibandingkan dengan fase lainnya.
4.2 Penentuan Jenis Enzim Pengurai Karbofuran
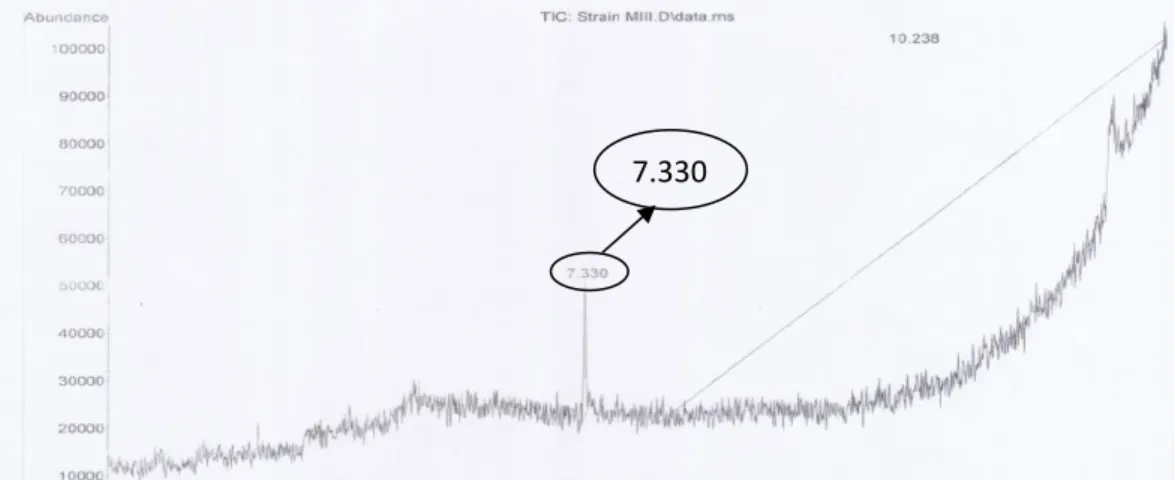
Jenis enzim pengurai karbofuran yang diperoleh dari hasil analisis GC-MS adalah karbofuran hidrolase. Jenis enzim ini diketahui dari data kromatogram dan analisis spektrum massa dari pengujian GC-MS. Pada kromatogram kontrol, tidak ditambahkan suspensi bakteri, sehingga tidak degradasi karbofuran tidak terjadi (dapat dilihat pada Gambar 4.1). Kromatogram senyawa hasil degradasi karbofuran oleh bakteri P. aeruginosa Strain M111 terdeteksi sebagai senyawa 7-Benzofuranol, 2,3- dihydro-2, 2 dimethyl- pada waktu retensi 7.330 menit (Gambar 4.3), sedangkan senyawa hasil degradasi karbofuran oleh bakteri P. aeruginosa Strain TS2 terdeteksi sebagai fenol, 2-methoxy-4-(1-propenyl)- (Z) dengan waktu retensi 7.333 (Gambar 4.4).
UNIVERSITAS SUMATERA UTARA
18
Gambar 4.2 Kromatogram kontrol
Gambar 4.3 Kromatogram senyawa hasil degradasi karbofuran oleh bakteri P.
aeruginosa Strain M111
Gambar 4.4 Kromatogram senyawa hasil degradasi karbofuran oleh bakteri P.
aeruginosa Strain TS2
7.330
7.333 7.326
6
UNIVERSITAS SUMATERA UTARA
19
Hasil kromatogram senyawa degradasi karbofuran oleh bakteri P.
aeruginosa Strain M111 muncul dua puncak yang memiliki waktu retensi yang berbeda. Hal ini menunjukkan bahwa terdapat 2 senyawa kimia yang diduga merupakan hasil degradasi karbofuran oleh enzim ekstrak kasar bakteri P. aeruginosa Strain M11. Sedangkan pada kromatogram senyawa degradasi karbofuran oleh bakteri P. aeruginosa Strain TS2 muncul tiga puncak dengan waktu retensi yang tidak jauh berbeda. Untuk mengidentifikasi senyawa yang ditunjukkan oleh tiap puncak dari masing-masing kromatogram, maka dilakukan analisis spektrum massa tiap puncak tersebut.s Analisis identitas senyawa pada spektrum massa dibatasi pada komponen senyawa yang dominan dari masing-masing kromatogram dan kemiripan spektrum massa yang dicari berdasarkan indeks kemiripan, kesamaan ion molekul, dan puncak dasar (Matsjesh dan Runtuwene, 2002). Analisis spektrum massa tiap puncak dilakukan dengan membandingkan spektrum massa sampel dengan Library. Library adalah alat yang berguna untuk mengidentifikasi puncak kromatografi dari kromatogram dan database yang digunakan dalam identifikasi spesifikasi massa (MS) yang dikenal sebagai perpustakaan MS. Identifikasi metabolit dapat dilakukan melalui perpustakaan dan dengan menggunakan alat yang memungkinkan analisis, pemrosesan dan identifikasi data (Srivastava et al., 2016). Hasil analisis spektrum massa tiap puncak pada kromatogram kontrol dapat dilihat pada Tabel 4.1.
Tabel 4.1 Hasil identifikasi senyawa pada kontrol dengan GC-MS
Hasil analisis spektrum masa pada medium kontrol setelah masa inkubasi 24 jam menunjukkan bahwa masih terdapat karbofuran. Karbofuran (7-Benzofuranol, 2,3-dihydro-2,2-dimethyl-N-methylcarbamate) muncul pada puncak kedua dengan waktu retensi 7.326 menit. Sementara itu, hasil analisis spektrum masa pada medium yang mengandung supernatan kedua bakteri tidak lagi ditemukan karbofuran, hal ini
Nomor Puncak
Waktu Retensi (menit)
% Area Jenis Senyawa Qual
1 6.755 293.2 Benzeneethanamine, N,
alpha. –dimethyl-, (S)-
90
2 7.326 13.42 7-Benzofuranol, 2,3-
dihydro-2,2-dimethyl-N- methylcarbamate
96
3 10.237 40.6 p-Heptyloxyaniline 76
UNIVERSITAS SUMATERA UTARA
20
dikarenakan karbofuran telah didegradasi oleh bakteri. Hasil analisis dapat dilihat pada Tabel 4.2 dan Tabel 4.3
Tabel 4.2 Hasil identifikasi senyawa hasil degradasi karbofuran oleh bakteri P.
aeruginosa Strain M111 dengan GC-MS
Tabel 4.3 Hasil identifikasi senyawa hasil degradasi karbofuran oleh bakteri P.
aeruginosa Strain TS2 dengan GC-MS
Dari hasil analisis spektrum massa pada Tabel 4.2 dapat diketahui bahwa dalam sampel terdapat senyawa 7-Benzofuranol, 2,3-dihydro-2, 2 dimethyl- yang dideteksi pada waktu retensi 7.331 dan 4-(2’,6’Dichlorophenylmethylene)-1,2,3,4- tetraisoquiline-1,3-dion yang dideteksi pada waktu retensi 10.237. Sedangkan dari Tabel 4.3 dapat diketahui bahwa dalam sampel terdapat senyawa Phenol, 2-methoxy- 4-(1-propenyl)- (Z) pada waktu retensi 7.331, Cyclotrisiloxane, hexamethyl pada waktu retensi 12.146 dan Benzo(h)quinoline, 2,4-dimethyl pada waktu retensi 12.375.
Dari keseluruhan senyawa yang berhasil diidentifikasi, diketahui hanya dua senyawa yang merupakan senyawa turunan dari hasil degradasi karbofuran, yaitu 7- Benzofuranol, 2,3-dihydro-2, 2 dimethyl- atau lebih dikenal dengan karbofuran-7- phenol yang ditemukan pada sampel yang diberi enzim ekstrak kasar bakteri P.
aeruginosa Strain M111 dan phenol, 2-methoxy-4-(1-propenyl)- (Z) yang ditemukan pada sampel yang diberi enzim ekstrak kasar bakteri P. aeruginosa Strain TS2. Kedua
Nomor Puncak
Waktu Retensi (menit)
% Area Jenis Senyawa Qual
1 7.331 0,67 7-Benzofuranol, 2,3-
dihydro-2, 2 dimethyl-
91
2 10.237 10,67 4-(2’,6’-
Dichlorophenylmethylene) -1,2,3,4-tetraisoqunoline-
1,3-dion
64
Nomor Puncak
Waktu Retensi (menit)
% Area Jenis Senyawa Qual
1 7.331 39.78 Phenol, 2-methoxy-4-(1-
propenyl)- (Z)
38
2 12.146 56.10 Cyclotrisiloxane,
hexamethyl
52
3 12.375 4.12 Benzo(h)quinoline, 2,4-
dimethyl
49
UNIVERSITAS SUMATERA UTARA
21
senyawa ini merupakan hasil degradasi karbofuran melalui jalur hidrolitik dengan bantuan enzim karbofuran hidrolase.
Menurut Chaudhry dan Ali (1988), terdapat dua jalur utama bakteri dalam mendegradasi pestisida karbamat terutama karbofuran yaitu melalui oksidatif dan hidrolitik. Trabue et al. (2001), menambahkan proses hidrolisis karbofuran dapat terjadi melalui dua jalur, yaitu dengan memutuskan ikatan ester dari gugus karbonil dari asam N-metil karbamat yang melekat pada fenol atau ikatan amida dari asam N- metilkarbamat. Kedua jalur tersebut menghasilkan Carbofuran 7-fenol (2,3-dihidro- 2,2-dimethyl-7-benzofuranol), metabolit yang kurang toksik daripada karbofuran, karbon dioksida dan metilamin. Jalur hidrolisis karbofuran menjadi karbofuran 7- phenol oleh enzim karbofuran hidrolase dapat dilihat pada Gambar 4.5
Gambar 4.5 Hidrolisis Karbofuran menjadi Karbofuran 7-Phenol oleh Enzim Karbofuran Hidrolase yang dihasilkan oleh P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2
Feng et al. (1997), telah melaporkan bahwa strain CF06 dari genus Sphingomonas memiliki kemampuan untuk memineralkan cincin aromatik
karbofuran. Chaudhry et al. (2002), mengidentifikasi bakteri Pseudomonas sp. 50432 yang memiliki kemampuan dalam mendegradasi karbofuran menjadi karbofuran fenol.
Hasil yang sama juga diperoleh Kim et al. (2004), berhasil mengidentifikasi Sphingomonas sp. Strain SB5a yang diisolasi dari tanah yang telah terpapar pestisida karbofuran selama bertahun-tahun. Penelitian ini menunjukkan aktivitas pada cincin aromatik dengan hidrolisis karbofuran 7-phenol yang menghasilkan metabolit intermediet 2-hydroxy-3-(3-methylpropan-2-ol)-phenol. Menurut Slaoui et al. (2018),
Karbofuran Karbofuran
7-Phenol
Hidrolisis
Metilamin
Karbofuran Hidrolase
UNIVERSITAS SUMATERA UTARA
22
proses hidrolisis karbofuran selain menghasilkan karbofuran 7-phenol juga menghasilkan metilamin dan karbon dioksida yang dapat digunakan bakteri sebagai sumber karbon dan nitrogen.
4.3 Aktivitas Enzim Ekstraseluler dan Intraseluler Karbofuran Hidrolase Aktivitas karbofuran hidrolase dari bakteri P. aeruginosa Strain M111 dan P.
aeruginosa Strain TS2 selama 7 hari masa inkubasi dapat dilihat pada Gambar 4.6.
Gambar 4.6 Aktivitas Enzim Karbofuran Hidrolase Ekstraseluler dan Intraseluler pada pH 7,5 dan suhu 30°C
Aktivitas enzim intraseluler karbofuran hidrolase dari bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 memiliki waktu inkubasi optimum yang sama yaitu pada hari ke 5 dengan masing-masing nilai aktivitas sebesar 0,043 U/ml dan 0,040 U/ml. Sedangkan aktivitas ekstraseluler karbofuran hidrolase, kedua strain bakteri memiliki waktu inkubasi optimum yang berbeda. Aktivitas enzim P.
aeruginosa Strain M111 optimum pada waktu inkubasi hari ke 6 dengan nilai aktivitas sebesar 0,0232 U/ml, sementara P. aeruginosa Strain TS2 optimum pada hari ke 5 dengan aktivitas sebesar 0,0221 U/ml. Niai aktivitas enzim yang diperoleh pada penelitian ini tidak menunjukkan perbedan yang signifikan, hal ini dikarenakan kedua bakteri diisolasi dari sumber yang sama yaitu tanah pertanian Berastagi sehingga
0.043 0.040
0.0232
0.0221
0 0.01 0.02 0.03 0.04 0.05
1 2 3 4 5 6 7
Aktivitas Enzim (U/ml)
Hari Ke-
P. aerugniosa Strain M111 Intraseluler P. aeruginosa Strain TS-2 Intraseluler P. aerugniosa Strain M111 Ekstraseluler P. aeruginosa Strain TS-2 Ekstraseluler
UNIVERSITAS SUMATERA UTARA
23
diasumsikan kedua bakteri memiliki kemampuan yang sama dalam mendegradasi karbofuran.
Pseudomonas aeruginosa Strain M111 dan P. aeruginosa Strain TS2 mampu menghasilkan enzim ekstraseluler dan intraseluler. Berdasarkan hasil pengukuran aktivitas karbofuran hidrolase, dapat diasumsikan bahwa bakteri P. aeruginosa Strain M111 dan P. aeruginosa Strain TS2 mampu menghidrolisis karbofuran baik di dalam maupun di luar sel. Hal ini ditunjukkan dengan lebih besarnya aktivitas enzim intraseluler dibandingkan aktivitas enzim ekstraseluler dari kedua bakteri. Besarnya aktivitas enzim intraseluler disebabkan karena sebelum proses sonikasi, pelet terlebih dahulu disuspensikan ke dalam larutan yang mengandung 1 mM Dithiothreitol (DTT) sebagai senyawa pereduksi dan 1 mM MnCl2 sebagai kofaktor, sehingga aktivitas enzim intraseluler menjadi lebih besar. Menurut Murray et al. (2009), DTT dan beberapa senyawa pereduksi lainnya seperti TCEP (tris(2-carboxyl)phosphine), 2- merkaptoetanol, aprotinin, 1,4 dithioerythritol/DTE, sodium borohydride (NaBH4) dapat meningkatkan aktivitas enzim (aktivator) atau dapat menurunkan aktivitas enzim (inhibitor). Penelitian Yin et al. (2010) membuktikan bahwa penambahan senyawa pereduksi DTT dapat meningkatkan aktivitas salah satu enzim dari kelas hidrolase yang diproduksi Bacillus subtilis YJ1. Penelitian tentang pengaruh penambahan ion logam sebagai kofaktor juga telah dilakukan oleh Baehaki (2011), hasil penelitian menujukkan bahwa kemampuan MnCl2 dalam meningkatkan total aktivitas salah satu enzim dari kelas hidrolase masih lebih baik bila dibandingkan ion logam lainnya seperti FeCl2, KCl dan ZnCl2.
Tabel 4.4 Aktivitas enzim, konsentrasi protein dan aktivitas spesifik karbofuran hidrolase pada waktu inkubasi 10 menit
Jenis Bakteri Enzim
Aktivitas Enzim (U/ml)
Konsentrasi Protein (mg/ml)
Aktivitas Spesifik
(U/mg) P. aeruginosa Strain
M111
Intraseluler 0,0430 98,921 0,000401 Ekstraseluler 0,0233 101,81 0,000229 P. aeruginosa Strain
TS2
Intraseluler 0,0406 96,289 0,000422 Ekstraseluler 0,0222 98,132 0,000226
Ket. pH 7,5 dan suhu 30°C
UNIVERSITAS SUMATERA UTARA
24
Berdasarkan Tabel 4.4 dapat diketahui bahwa konsentrasi protein pada enzim intraseluler dari kedua bakteri lebih rendah dibandingkan dengan konsentrasi protein pada enzim ekstraseluler, sementara aktivitas enzim intraseluler lebih tinggi dibandingkan aktivitas enzim ekstraseluler. Hal ini berbeda dengan pernyataan Gunam et al. (2011) apabila konsentrasi protein yang dihasilkan tinggi maka aktivitas enzim juga tinggi, dan sebaliknya pada kondisi konsentrasi protein rendah maka aktivitas enzim yang dihasilkan juga rendah. Perbedaan ini diasumsikan terjadi karena adanya senyawa interferensi yang terbaca pada saat pengukuran kadar protein yang menyebabkan tingginya nilai absorbansi pada enzim eksraseluler. Menurut Hadinoto dan Syukroni (2019), nilai absorbansi pada sampel menunjukkan dua kemungkinan, yaitu jumlah protein sebenarnya yang dapat diukur dengan metode Bradford atau jumlah protein sekaligus adanya senyawa interferensi yang menyebabkan meningkatnya absorbansi. Senyawa interferensi tersebut dapat berupa sel bakteri yang tidak sengaja terikut pada saat pengukuran. Berbeda dengan konsentrasi protein pada enzim intraseluler yang sel bakteri telah dilisiskan terlebih dahulu menggunakan sonikator. Sonikasi merupakan metode pemecahan sel yang memanfaatkan getaran dari gelombang suara dengan frekuensi tinggi untuk melisiskan sel (Roostalu et al., 2008).
Nilai aktivitas spesifik merupakan perbandingan antara nilai aktivitas enzim terhadap konsentrasi protein sehingga semakin kecil konsentrasi protein maka aktivitas spesifik enzim akan besar. Nilai aktivitas spesifik karbofuran hidrolase yang diperoleh dalam penelitian ini masih lebih kecil bila dibandingkan dengan penelitian Chapalmadugu dan Chaudhry (1993) aktivitas spesifik hidolase dari Pseudomonas aeruginosa 50581 sebesar 0,68 U/mg. Chaudhry et al. (2002) Pseudmonas sp. 50432 sebesar 0,50 U/mg serta Pseudomonas Strain CRL-OK sebesar 0,013 U/mg (Mulbry dan Eaton, 1991). Hal ini dikarenakan enzim karbofuran hidrolase dalam ketiga penelitian tersebut telah dipurifikasi dengan berbagai metode.
UNIVERSITAS SUMATERA UTARA
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari penelitian yang dilakukan dapat disimpulkan bahwa:
a. Jenis enzim yang dihasilkan dari bakteri P. aeruginosa Strain M111 dan P.
aeruginosa Strain TS2 adalah enzim karbofuran hidrolase.
b. Aktivitas intraseluler karbofuran hidrolase dari bakteri P. aeruginosa Strain M111 diperoleh pada hari inkubasi kelima yaitu sebesar 0,043 U/ml, sementara pada enzim ekstraseluler aktivitas terbesar diperoleh pada hari inkubasi keenam yaitu sebesar 0,023 U/ml. Sedangkan pada bakteri P. aeruginosa Strain TS2 aktivitas enzim intraseluler yaitu 0,041 U/ml, sementara aktivitas enzim ekstraseluler yaitu 0,022 U/ml pada masa inkubasi yang sama yaitu hari kelima.
5.2 Saran
Perlu dilakukan penelitian lebih lanjut mengenai purifikasi dan karakterisasi enzim karbofuran hidrolase sehingga dapat meningkatkan aktivitas enzim karbofuran hidrolase dari kedua isolat tersebut dalam mendegradasi karbofuran.
UNIVERSITAS SUMATERA UTARA
DAFTAR PUSTAKA
Baehaki A, Rinto, Budiman A, 2011. Isolasi dan Karakterisasi Protease dari Bakteri Tanah Rawa Indralaya, Sumatera Selatan. J. Teknol dan Industri Pangan, 22(1):
40-45.
Bano N dan Musarrat J, 2004. Characterization of a Novel Carbofuran Degrading Pseudomonas sp. with Collateral Biocontrol and Plant Growth Promoting Potential. FEMS Microbiologi Letters, 2(31): 13-17.
Bharagava RN, 2019. Recent Advanced in Environmental Management. CRC Press.
Florida.
Bradford MM, 1976. A Rapid and Sensitive Method for the Quantification of Microgram Quantities of Proteins Utilizing the Principle of Protein-dye Binding. J Analy Biochem. 72.
Brooks GF, Carroll KC, Butel JS, Morse, 2013. Mikrobiologi Kedokteran. In Jawetz, Melnick, Adelberg, (Eds). Ed ke 25. Buku Kedokteran EGC. Jakarta.
Chapalamadugu S, Chaudhry GR, 1992. Microbiological and Biotechnological Aspects of Metabolism of Carbamates and Organophosphates. Crit. Rev.
Biotech, 12: 357-389.
Chapalmadugu S dan Chaudhry, 1993. Isoation of Constitutively Expressed Enzymefor Hydrolisis of Carbaryl in Pseudomonas aeruginosa. Journal of Biotechnology, 175(20): 6711-6716.
Chaudhry GR, Mateen A, Kaskar B, Sardessai M, Bloda M, Bhatti AR, Satish K, Walia, 2002. Induction of Carbofuran Oxidation to 4-hydroxycarbofuran by Pseudomonas sp. 50432. FEMS Microbiology Letters, 2(14): 171-16.
Chaudhry GR, Mateen M, Kaskar B, Bloda B, Sheikh R, 2002. Purification and Biochemical Characterization of the Carbamate Hydrolase from Pseudomonas sp. 50432. Biotechnol. Appl. Biochem in press.
Chaudhry GR dan Ali AN, 1988. Bacterial Metabolism of Carbofuran. Applied and Environmental Microbiology, 54(6): 1414-1419.
Dahlan A, Wahyuni S, Ansharullah, 2017. Morfologi dan Karakterisasi Pertumbuhan Bakteri Asam Laktat (UM 1.3A) dari Proses Fermentasi Wikau maombo untuk Studi Awal Produksi Enzim Amilase. J. Sains dan Teknologi Pangan, 2(4): 657- 663.
Fardiaz S, 1988. Fisiologi Fermentasi. Pusat Antar Universitas Lembaga Sumber Daya Informasi. Institut Pertanian Bogor. Bogor.
Feng X, Ou L, Ogram A, 1997. Plasmid-Mediated Mineralization of Carbofuran by Sphingomonas sp. Strain CF06. Applied and Environmental Microbiology, 63(4): 1332-1337.
Fushiwaki Y dan Urano K, 2001. Adsorption of Pesticide and Their Biodegraded Products on Clay Minerals and Soils. Journal Health Science, 47: 429-432.
Gunam IBW, Aryanta WR, Darma IBNS, 2011. Produksi Selulase Kasar dari Kapang Trichoderma viride dengan Perlakuan Konsentrasi Substrat Ampas Tebu dan Lama Fermentasi. Jurnal Biologi Udayana, 15(2): 29-33.
Hadinoto S dan Syukroni I, 2019. Pengukuran Protein Terlarut Air Cucian Gelembung Renang dan Kulit Ikan Tuna Menggunakan Metode Bradford. Majalah Biam, 1: 15-20.
UNIVERSITAS SUMATERA UTARA
27
Hernandez MLO, Sanchez S, Maria LCG, Edgar DG, Elida CPU, 2013. Mechanisms and Strategies for Pesticide Biodegradation: Opportunuty For Waste, Soil and Water Cleaning. Revista Internacional de Contaminacion Ambiental, 29: 85- 104.
Indraningsih, 2008. Pengaruh Penggunaan Insektisida Karbamat terhadap Kesehatan Ternak dan Produknya. Jurnal Wartazoa, 18(2).
Kane LM dan Kandel J, 1998. Microbiology Essentials and Applications. Mc Grwa- Hill. New York.
Kim IS, Ryu JY, Hur HG, Gu MB, Kim SD, Shim JH, 2004. Sphingomonas sp. Strain SB5 Degrades Carbofuran to a New Metabolite by Hydrolysis at the Furanyl Ring. J. Agric. Food Chem, 52(8): 2309-2314.
Lu FC, 1995. Toksikologi Dasar (Azas, Organ Sasaran dan Penilaian Resiko).
Universitas Indonesia. Jakarta.
Massiha A, Pahlaviani M, Issazadeh RK, 2011. Microbial Degradation of Pesticides in Surface Soil Using Native Strain in Iran. Singapore. International Conference on Biotechnology and Environment Management, 18.
Matsjesh S dan Runtuwene JS, 2002. Isolasi dan Identifikasi Senyawa Antibakteri dari Ganggang Laut Dictyoata dichotoma (Hudson) Lamoroux. Buletin of the Indonesian Society of Natural Products Chemistry, (2): 56-60.
Middlebeek EJ, Jenkins RO, Drijver-de Haas JS, 1992. Growth in batch culture. In Vitro Cultivation of Microorganisms. Biotechnology by Open Learning.
Mulbry WW dan Eaton RW, 1991. Purification and Characterization of the N- Methylcarbamate Hydrolase from Pseudomonas Strain CRL-OK. Applied and Environmental Microbiology, 57: 3679-3682.
Murray RK, Granner DK, Rodwell VW, 2009. Biokimia harper (27 ed.). Buku Kedokteran EGC. Jakarta.
Nawaz K, Hussain K, Choudary N, Majeed A, Ilyas U, Ghani A, Lin F, Ali K, Afghan S, Raza G, Lashari MI, 2011. Eco-Friendly Roleof Biodegradation Againts Agricultural Pesticides Hazards. African Journal of Microbiology Research, 5:
177-179.
Nofyan E, 2009. Pengaruh Insektisida Karbofuran Terhadap Produksi danViabilitas Kokon Cacing Tanah Pontoscolex corethrurus Fr Mull. Jurnal Penelitian Sains, 12: 44.
Nurhajati JS, Sulistijowati R, Amaliah I, 2009. The Influence of Giving Various Concentrations and Method of Inoculum Lactobacillus acidophillus According to Immersion Time for Total Escherichia coli in Swordfish Stew (Auxis rochei).
International Seminar Biotechnology. Unpad. Bandung.
Ortiz-Hernández ML, Sánchez-Salinas E, Dantán-González E, Castrejón- Godínez ML, 2011. Pesticide Biodegradation: Mechanisms, Genetics and Strategies to Enhance the Process. Mexico: Biotechnology Research Center, Autonomous University of State of Morelos, Colombia. Chamilpa, Cuernavaca, Morelos.
Park, Ryeol M, Lee SA, Han T, Oh B, Shim JH, 2006. New Intermediate in the Degradation of Carbofuran by Sphingomonas sp. Strain SB5. J. Microbiol.
Biotechnol, 16(8): 1306-1310.
Porto ALM, Melgar GZ, Kasemodel MC, Nitschke M, 2012. Biodegradation of Pesticides. Universidade de São Paulo, Institutode Química de São Carlos.
Brazil.
UNIVERSITAS SUMATERA UTARA