UNTUK MENDAPATKAN MUTAN PUTATIF JERUK
KEPROK GARUT ( Citrus reticulata L. ) MELALUI
IRADIASI SINAR GAMMA
KARYANTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul Induksi Keragaman Kalus Embriogenik untuk Mendapatkan Mutan Putatif Jeruk Keprok Garut (Citrus
reticulata L.) melalui Iradiasi Sinar Gamma adalah karya saya dengan arahan
komisi pembimbing dan belum diajukan dalam bentuk karya apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dicantumkan dalam daftar pustaka di bagian akhir tesis ini.
Bogor, Januari 2013
Karyanti
KARYANTIInducing the Variability of Embryogenic Callus of Mandarin Citrus cv. Garut to Obtained Putative Mutants through Gamma Rays Irradiation. Supervised by AGUS PURWITO and ALI HUSNI
Mandarin Citrus cv. Garut is one of local citrus which has some several superioritysuch as easy to peel, fresh and sweet flavour, yellowish green skin and containt 12-15 seeds per fruit, but can it not compete with citrus from other countries. Quality improvement have been the subject of citrus breeding programme. The objective of this research is to increase genetic variability of Mandarin Citrus cv. Garut through gamma rays irradiation on embryogenic callus. Callus was irradiated at doses of 0, 20, 30, 40, 50, 60, 70, 80, 90 and 100 Gy and regenerated through somatic embryogenesis. The result of radiosensitivity dose for Growth Reduction (GR50) analyzed by Curve Expert 1.4 software was 75.31
Gy. Observation on the growth of callus showed variation on morphology and weight of callus. At doses 0–50 Gy callus growth was not inhibited, but at doses 60–100 Gy callus growth was inhibited. Gamma irradiation also affected the formations of somatic embryos. After six weeks on maturation medium produced the highest of embryo somatic at dose of 20 and 100 Gy and on germination medium produced planlet highest at dose of 20 and 40 Gy. Based on morphological characters selected 10 regenerants with variability of 0–58% and genetic variability with ISSR markers by 0–26%. The number of mutan putative produced were M30/2, M50/1, M80/3 and M100/1 comformed by ISSR. After four week grafting between putative mutan shoots as scion and Japansche Citroen as rootstock it was obtainted the growth percentage 37.5-50% on Ex Vitro Grafting and 75% on In Vitro Grafting.
Keywords: mutation breeding, somatic embryo, Growth Reduction (GR50),
RINGKASAN
KARYANTI. Induksi Keragaman Kalus Embriogenik untuk Mendapatkan Mutan Putatif Jeruk Keprok Garut (Citrus reticulata L.) Melalui Iradiasi Sinar Gamma. Dibimbing oleh AGUS PURWITO and ALI HUSNI
Buah jeruk merupakan salah satu buah komoditas unggulan. Buah jeruk banyak digemari karena rasanya dan kandungan vitamin A dan C yang tinggi. Buah jeruk dapat dikonsumsi segar ataupun dibuat makanan olahan. Jeruk keprok banyak digemari karena karakternya sesuai dengan selera konsumen seperti warna buahnya menarik, kulitnya mudah dikupas, rasanya manis asam menyegarkan dan bijinya sedikit (Seedless). Peningkatan kualitas jeruk dapat dilakukan melalui seleksi varietas-varietas unggul lokal. Salah satu varietas unggul lokal yang dapat dimanfaatkan adalah jeruk keprok Garut. Untuk meningkatkan kualitas jeruk keprok Garut sesuai selera konsumen dapat melalui pendekatan bioteknologi dan pemuliaan mutasi. Kombinasi metode kultur jaringan menggunakan sel somatik dan mutasi menggunakan mutagen sinar gamma diharapkan mampu meningkatkan keragaman dan memunculkan karakter-karakter yang diharapkan.
Penelitian ini bertujuan untuk meningkatkan keragaman genetik tanaman jeruk keprok Garut menggunakan mutagen sinar gamma, memperoleh Growth
Reduction (GR50) kalus embriogenik jeruk keprok Garut dan menghasilkan tunas
mutan putatif. Penelitian terdiri atas empat tahap. Tahap pertama yaitu proliferasi kalus dalam media dasar MS (Murashige dan Skoog) yang dikombinasikan dengan vitamin MW (Morel & Wetmore) dan 300 mgL-1 Casein hydrolisat. Kalus hasil proliferasi selanjutnya diberikan perlakuan iradiasi sinar gamma dengan memasukan kalus ke dalam alat Gamma Chamber Co-60. Kalus diberikan iradiasi pada dosis 0, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 Gy. Kalus hasil iradiasi ditanam dalam media MS tanpa zat pengatur tumbuh. Tahap dua, kalus hasil iradiasi diregenerasi dalam media pendewasaan yaitu media dasar MS yang ditambahkan vitamin MW, 2.5 mgL-1 ABA dan 300 mgL-1 Casein hydrolisat. Embrio somatik yang terbentuk ditanam dalam media perkecambahan yaitu media dasar MS yang ditambahkan vitamin MW dan 2.5 mgL-1 GA3. Kecambah yang
dihasilkan ditanam dalam media MS tanpa zat pengatur tumbuh dan menghasilkan tunas regeneran dengan morfologi beragam. Tahap tiga, identifikasi tunas regeneran berdasarkan penanda morfologi dan molekuler. Tahap empat, penyambungan secara in vitro dan ex vitro. Penyambungan dengan batang atas yang digunakan adalah tunas mutan putatif hasil iradiasi dan batang bawah yang digunakan adalah jeruk Japansche Citroen (JC). Hasil pengamatan dan analisis yang dilakukan diperoleh bahwa peningkatan dosis iradiasi sinar gamma pada kalus yang ditanam dalam media tanpa zat pengatur tumbuh menyebabkan terjadinya perubahan warna kalus dan menurunya berat kalus pada minggu ke-6 setelah tanam. Data hasil pengamatan proliferasi kalus di analisis dengan program Curve Expert 1.4 dan diperoleh Growth Reduction (GR50). Kalus embriogenik
jeruk hasil iradiasi menghasilkan GR50 di sekitar dosis 75.31 Gy. Pada tahap
regenerasi tidak semua kalus mampu membentuk embrio somatik dan berkecambah. Jumlah embrio somatik terbanyak dihasilkan pada dosis 20 dan 100
pengatur tumbuh dihasilkan 46 tunas regeneran yang dapat diidentifikasi secara morfologi. Dipilih 10 tunas regeneran yang mewakili karakter-karakter yang diamati. Keragaman dari 10 tunas regeneran berdasarkan analisis UPGMA pada penanda morfologi adalah sebesar 0–58% dan keragaman genetik berdasarkan penanda ISSR sebesar 0–26%. Hasil konfirmasi melalui penanda ISSR diperoleh tunas mutan putatif yaitu individu M30/2, M50/1, M80/3 dan M100/1. Metode penyambungan antara tunas mutan putatif sebagai batang atas dan Japansche
Citroen sebagai batang bawah secara in vitro menghasilkan persentase
pertumbuhan tanaman sambung sebesar 75% dan secara ex vitro sebesar 37.5 – 50%.
Kata kunci: Pemuliaan mutasi, embrio somatik, Growth Reduction (GR50),
©Hak Cipta Milik IPB, tahun 2013
Hak Cipta Dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karyatulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya tulis ini dalam bentuk apapun tanpa izin IPB.
KEPROK GARUT( Citrus reticulata L. ) MELALUI
IRADIASI SINAR GAMMA
KARYANTI
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Mayor Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2013
Nama : Karyanti
NIM : A253100221
Disetujui, Komisi Pembimbing
Dr. Ir. Agus Purwito, M.Sc.Agr Dr. Drs. Ali Husni, M.Si
Ketua Anggota
Mengetahui,
Ketua Mayor Dekan Sekolah Pascasarjana Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Trikoesoemaningtyas, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
xvii
DAFTAR TABEL... xix DAFTAR GAMBAR... DAFTAR LAMPIRAN... xxi xxiii PENDAHULUAN Latar Belakang... 1 Tujuan... 2 Hipotesis... Kerangka Berpikir... 3 3 TINJAUAN PUSTAKA
Botani Tanaman Jeruk... 5 Jeruk Keprok...
Japanesche Citroen...
7 8 Pemuliaan Mutasi... 9 Pemuliaan Mutasi Tanaman Jeruk... 10 Mutagen Sinar Gamma... 11 Teknik Kultur Jaringan pada Tanaman Jeruk...
Penyambungan (Grafting)... Analisis Keragaman...
12 13 14 BAHAN DAN METODOLOGI
Waktu dan Tempat Penelitian... 17 Bahan dan Alat... 17 Metode Penelitian... 17 HASIL DAN PEMBAHASAN
Proliferasi Kalus Embriogenik... 25 Pengaruh Iradiasi Sinar Gamma terhadap Pertumbuhan Kalus... 26 Regenerasi Kalus Hasil Iradiasi Sinar Gamma...
Analisis Keragaman Tunas Regeneran berdasarkan Penanda Morfologi... Analisis Keragaman Tunas Regeneran berdasarkan Penanda Molekuler...
29 36 44 Penyambungan Tunas Mutan Putatif dengan Japanesche Citroen... 48 PEMBAHASAN UMUM... 53 SIMPULAN DAN SARAN
Simpulan... Saran... DAFTAR PUSTAKA ... 65 65 67
xviii
xix
Halaman 1 Kandungan vitamin dan zat mineral lainnya setiap 100 gram buah jeruk... 7 2 3 4 5 6 7 8 9 10 11
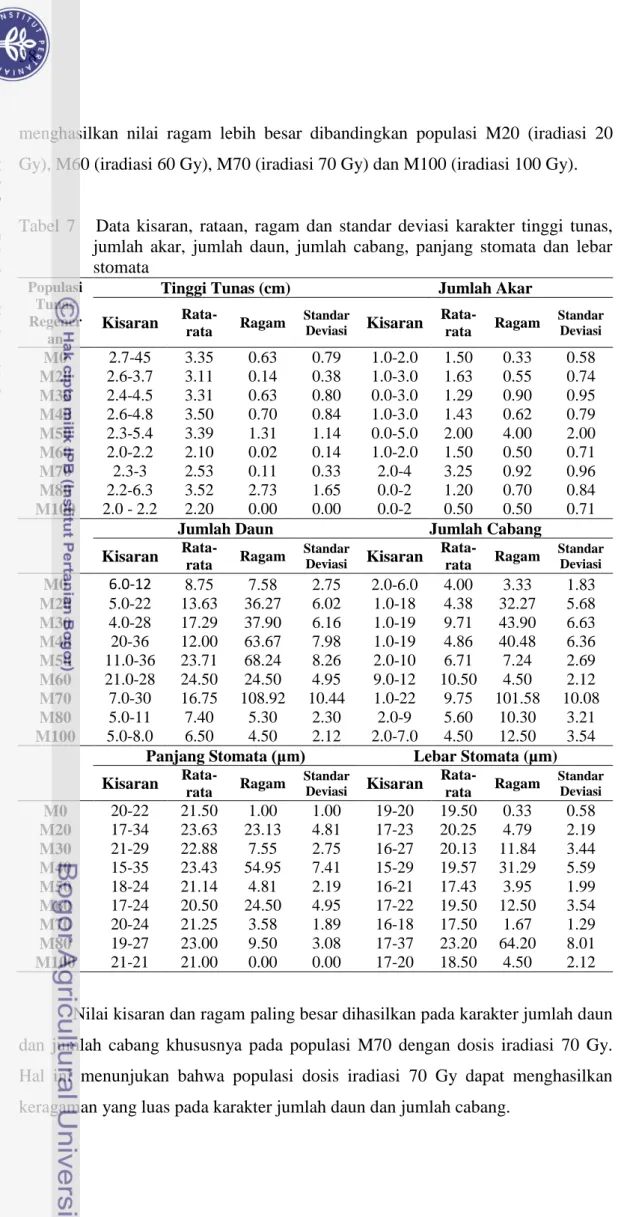
Nama dan susunan basa primer yang digunakan analisis ISSR... Pertumbuhan kalus embriogenik jeruk keprok Garut dalam media proliferasi... Persentase perubahan warna kalus 6 minggu setelah iradiasi sinar gamma... Rata-rata jumlah dan efisiensi pembentukan embrio somatik umur 6 MST... Jumlah embrio somatik, embrio berkecambah dan persentase embrio berkecambah hasil iradiasi sinar gamma... Data kisaran, rataan, ragam dan standar deviasi karakter tinggi tunas, jumlah akar,
Jumlah daun, jumlah cabang, panjang stomata dan lebar stomata... Hasil pengamatan keragaman morfologi tunas regeneran... Rata-rata jumlah, kerapatan, panjang dan lebar stomata 10 tunas regeneran... Rekapitulasi jumlah amplifikasi pita DNA 10 tunas regeneran jeruk keprok Garut pada 7 primer... Data hasil penyambungan secara in vitro dan ex vitro ...
22 25 27 31 33 38 40 41 45 48
xxi
DAFTAR GAMBAR
Halaman 1 2 3 4Skema kerangka pemikiran penelitian... Tahapan dan alur penelitian induksi mutasi pada kalus embriogenik jeruk keprok Garut dengan iradiasi sinar gamma... Kalus dan perlakuan iradiasi sinar gamma... Kalus embriogenik jeruk keprok Garut...
4 18 19 25 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19
Perubahan warna kalus hasil iradiasi ... Grafik rata-rata pertambahan berat kalus jeruk keprok Garut umur 6 minggu setelah iradiasi... Kurva pengaruh iradiasi terhadap persentase proliferasi kalus... Pertumbuhan proembrio dalam media pendewasaan... Perkembangan kalus hasil iradiasi sinar gamma dalam media pendewasaan... Grafik persentase kalus membentuk embrio somatik dalam media pendewasaan... Pertumbuhan dan perkembangan embrio somatik ... Keragaman pertumbuhan populasi kecambah... Jumlah tunas regeneran yang dihasilkan SK1 –SK4... Perkembangan kecambah menjadi tunas regeneran... Keragaman morfologi sepuluh tunas regeneran terpilih... Perbedaan morfologi daun tunas regeneran... Perbedaan ketegakan tunas regeneran... Jumlah stomata tunas regeneran pada ukuran 100 µm dengan pembesaran 400 x... Stomata tunas regeneran hasil iradiasi sinar gamma...
26 27 28 29 29 30 32 34 35 36 39 40 41 42 43
xxii 21 22 23 24 25 26 27 28
Karakter pola pita 10 tunas regeneran hasil iradiasi ... Karakter pola pita 10 tunas regeneran hasil iradiasi... Dendogram kemiripan berdasarkan penanda molekuler melalui ISSR dari 10 tunas regeneran in vitro dengan menggunakan 7 primer... Hasil penyambungan in vitro... Hasil penyambungan ex vitro... Penyambungan gagal dan potongan melintang bagian sambungan... Penampang potongan melintang tanaman jeruk batang atas dan bawah ... Penyambungan berhasil dan potongan melintang ...
45 46 47 49 50 50 51 51
Syukur alhamdulilah penulis panjatkan kepada ALLAH SWT, karena atas rahmat dan pertolongan-Nya sehingga penelitian dan penulisan tugas akhir ini dapat diselesaikan. Tesis ini merupakan syarat untuk mendapatkan gelar Magister di Institut Pertanian Bogor (IPB), dengan judul “Induksi Keragaman Kalus Embriogenik Untuk Mendapatkan Mutan Putatif Jeruk Keprok Garut (Citrus reticulata L.) Melalui Iradiasi Sinar Gamma”.
Pada kesempatan ini penulis mengucapkan terima kasih yang tulus kepada: 1. Dr. Ir. Agus purwito, M.Sc. Agr dan Dr. Drs. Ali Husni, M.Si atas bimbingan,
saran, ilmu, waktu, dana dan perhatiannya dalam pelaksanaan penelitian sampai penulisan tesis ini dapat diselesaikan dengan baik.
2. Dekan Sekolah Pascasarjana IPB dan Dr. Ir. Trikoesoemaningtyas, M.Sc selaku ketua program studi Pemuliaan dan Bioteknologi Tanaman, IPB, seluruh staf pengajar dan semua teknisi yang telah memberikan bantuan selama penulis belajar di IPB.
3. Kegiatan Hibah Pasca LPPM IPB, atas dukungan dana penelitian sehingga penelitian ini dapat berjalan dan diselesaikan dengan baik.
4. Kepala BB-Biogen Pertanian, atas izin dan bantuannya dalam melakukan evaluasi molekuler di Laboratorium Biologi Molekuler.
5. Kepala Balai Pengkajian Bioteknologi-BPPT dan Kepala Seksi Pertanian Balai Pengkajian Bioteknologi-BPPT yang telah memberikan izin untuk melanjutkan studi S2.
6. Kepala Pusdiklat Badan Pengkajian dan Penerapan Teknologi dan Bapak Bony Benyaminatas beasiswa dan arahannya selama masa studi di IPB.
7. Bapak dan ibu tercinta atas doa yang ikhlas, dorongan, bantuan, keringat dan semangatnya yang tak ternilai. Dengan hati yang tulus seiring kupanjatkan doa untuk almarhumah ibu mertuaku yang selalu memberi semangat dan menjadi inspirasiku untuk menjadi ibu dan istri yang terbaik.
8. Suamiku Masduki, M.Si dan kedua putriku yang cantik Shafira Aliifa dan Shaliha Azzahra atas dukungan, doa, pengorbanan, kritikan dan semangatnya sehingga tesis ini dapat diselesaikan.
9. Adik-adik ku (Aris, Yuli dan Yudi) yang selalu memberi warna dalam perjalanan hidupku, kakak iparku (Kak Wati, Kak Syarifah) dan adik iparku (Rohimah dan Chairiyah) yang selalu membantu dalam suka maupun duka.
10. Teman-teman terbaikku PBT angkatan 2010, Aida Wulansari, M.Si, Irni Furnawanthi, SP, Linda Novita S.Si, Juwartina Ida Royani, M.Si, Rismayanti, SP, Hayat Khairiyah, SP, Mbak Tati Sukarnih, teh Juju Juariyah, teh Iif, Mas Joko dan Mas Yudi.
11. Prof.Dr. Nadirman Haska, M.Si , Drs.Minaldi, Dr. Teuku Tajuddin, Yusuf Sigit, S.Hut dan tim sagu atas kerjasama, dukungan, bantuan dan dorongan semangatnya.
10 Rekan-rekan seperjuangan yang saling mendukung dan memberikan semangat selama masa studi di IPB.
Penulis berharap seluruh kegiatan yang dilakukan selama studi bernilai ibadah dan menjadi ilmu yang bermanfaat. Semoga tulisan ini dapat menjadi inspirasi untuk perkembangan penelitian tanaman jeruk di masa depan.
Bogor, Januari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Solo tanggal 03 April 1975 dari ayah Ngatimin dan ibu Suwarsih. Penulis merupakan anak pertama dari empat bersaudara. Jenjang pendidikan penulis adalah lulusan sekolah dasar SD Negeri Bondongan III Bogor tahun 1986, lulusan SMP Negeri 9 Bogor tahun 1990, lulusan Sekolah Menengah Analis Kimia Bogor (SMAKBo) tahun 1994 dan tahun 2001 mendapatkan gelar S1 dari Universitas Muhammadiyah Jakarta. Penulis bekerja di Balai Pengkajian Bioteknologi BPPT sejak tahun 1994 sampai sekarang. Tahun 1999 penulis menikah dengan H. Masduki, M.Si dan dikaruniai dua orang putri, yaitu Shafira Aliifa (12 tahun) dan Shaliha Azzahra (7 tahun). Tahun 2010 penulis melanjutkan studi S2 pada Sekolah Pascasarjana IPB dengan program studi Pemuliaan dan Bioteknologi Tanaman.
xxiii
DAFTAR LAMPIRAN
Halaman Lampiran 1. Media dasar Murashige dan Skoog, vitamin MW...
Lampiran 2. Hasil analisis sidik ragam data berat kalus dan jumlah embrio somatik... Lampiran 3. Matrik kemiripan 10 tunas regeneran berdasarkan penanda morfologi dan molekuler... Lampiran 4. Data biner hasil pengamatan morfologi tunas regeneran... Lampiran 5. Data biner hasil pengamatan berdasarkan penanda ISSR ... Lampiran 6. Tahapan analisis stomata...
77 78 79 80 81 82
PENDAHULUAN
Latar Belakang
Jeruk keprok Garut merupakan salah satu jenis jeruk unggulan nasional. Berdasarkan SK Menteri Pertanian No.760 tahun 1999 menetapkan jenis jeruk tersebut sebagai varietas unggul. Deskripsi keprok Garut mempunyai rasa asam manis menyegarkan, kulitnya mudah dikupas, warna kulit hijau kekuningan dan mempunyai lebih dari 12-15 biji per buah (Balitbangtan 1999). Berdasarkan agroklimatnya varietas tersebut menghasilkan buah terbaik jika ditanam di dataran tinggi sekitar 700 -1200 meter di atas permukaan laut. Hal ini merupakan salah satu pembatas produksi varietas jeruk tersebut sehingga ketersediaannya tidak selalu ada setiap tahun (AAK 1994).
Menurut Spiegel-Roy dan Goldschmidt (1996), kriteria buah jeruk yang digemari oleh konsumen dan pasar global adalah buah jeruk yang mempunyai biji sedikit atau tanpa biji (seedless), mudah dikupas dan memiliki warna yang menarik. Beberapa kriteria tersebut belum dimiliki oleh keprok Garut sehingga kalah bersaing di pasar global. Untuk meningkatkan kualitas mutu buah jeruk keprok Garut yang telah memiliki karakter buah unggul dapat memanfaatkan teknik pemuliaan mutasi.
Aplikasi pemuliaan mutasi dapat dilakukan secara in vitro dan in vivo. Aplikasi pemuliaan mutasi secara kultur in vitro memiliki keunggulan karena dapat menggunakan bahan tanaman seperti kalus embriogenik. Beberapa keuntungan menggunakan bahan tanaman kalus embriogenik yaitu dapat mengurangi terjadinya kimera, dapat dilakukan pada populasi yang besar, dan dapat dikerjakan dalam ruang yang terbatas (Witjaksono & Litz 2002). Setiap individu kalus embriogenik akan menghasilkan embrio somatik dan tumbuh menjadi satu tanaman.
Mutasi dapat terjadi secara spontan dan buatan. Mutasi spontan merupakan mutasi yang terjadi secara alami dengan peluang kejadian sangat kecil yaitu 10-6 - 10-7 (IAEA 1977 dalam Aisyah 2006). Sedangkan mutasi buatan merupakan mutasi yang terjadi karena terinduksi oleh mutagen. Beberapa mutagen yang mampu menginduksi keragaman adalah mutagen fisik dan kimia. Untuk mutagen
fisik umumnya dapat digunakan sinar gamma (cobalt 60) sedangkan untuk mutagen kimia dapat digunakan EMS (Ethyl Methane Sulphonate) (Van Harten 1998). Induksi mutasi secara fisik dapat menyebabkan terjadinya mutasi struktur dan jumlah kromosom, sedangkan mutasi secara kimia dapat menyebabkan terjadinya mutasi gen. Evaluasi keragaman genetik yang muncul dapat dilakukan secara morfologi dan molekuler.
Perlakuan mutagen dengan kultur in vitro dapat meningkatkan peluang terjadinya mutasi. Aplikasi induksi mutasi dengan kultur in vitro pada tanaman telah banyak menghasilkan keragaman genetik. Beberapa tanaman yang berhasil diinduksi keragamannya dengan memanfaatkan mutagen fisik dan kimia di antaranya pada tanaman pisang (Imelda 2000), gandum (Ali 2002), alpukat (Yenisbar 2005), manggis (Qosim 2006), jeruk (Grosser 2007).
Mutan “Mor” merupakan salah satu mutan hasil induksi mutasi pada jeruk mandarin Murcott dengan sinar gamma pada dosis 35 Gy. Dihasilkan varian baru dengan rata-rata jumlah biji sekitar 0-2 biji per buah, dari rata-rata jumlah biji awal sekitar 20- 25 biji per buah pada tanaman aslinya dan produktivitasnya tetap sama dengan tanaman aslinya (Vardi et al. 1993).
Dalam peningkatan kualitas tanaman melalui teknik pemuliaan mutasi dengan memanfaatkan kultur in vitro, hal utama yang harus dikuasai adalah teknik regenerasi tanaman tersebut. Kalus jeruk keprok telah berhasil diregenerasi (Merigo 2011) dan pola regenerasinya telah dapat diulang dengan hasil yang sama.
Tujuan
Penelitian ini dilakukan dengan tujuan sebagai berikut:
1. Mendapatkan GR50 (Growth Reduction 50) kalus embriogenik keprok Garut
melalui iradiasi sinar gamma.
2. Meningkatkan keragaman genetik tanaman jeruk keprok Garut menggunakan iradiasi sinar gamma.
3
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Dosis di sekitar GR50 (Growth Reduction 50) pada kalus embriogenik jeruk
keprok Garut hasil iradiasi sinar gamma dapat menginduksi keragaman yang tinggi.
2. Iradiasi sinar gamma berpengaruh terhadap pertumbuhan dan regenerasi kalus embriogenik jeruk keprok Garut.
3. Penanda morfologi dan molekuler dapat mengidentifikasi keragaman tunas regeneran yang dihasilkan.
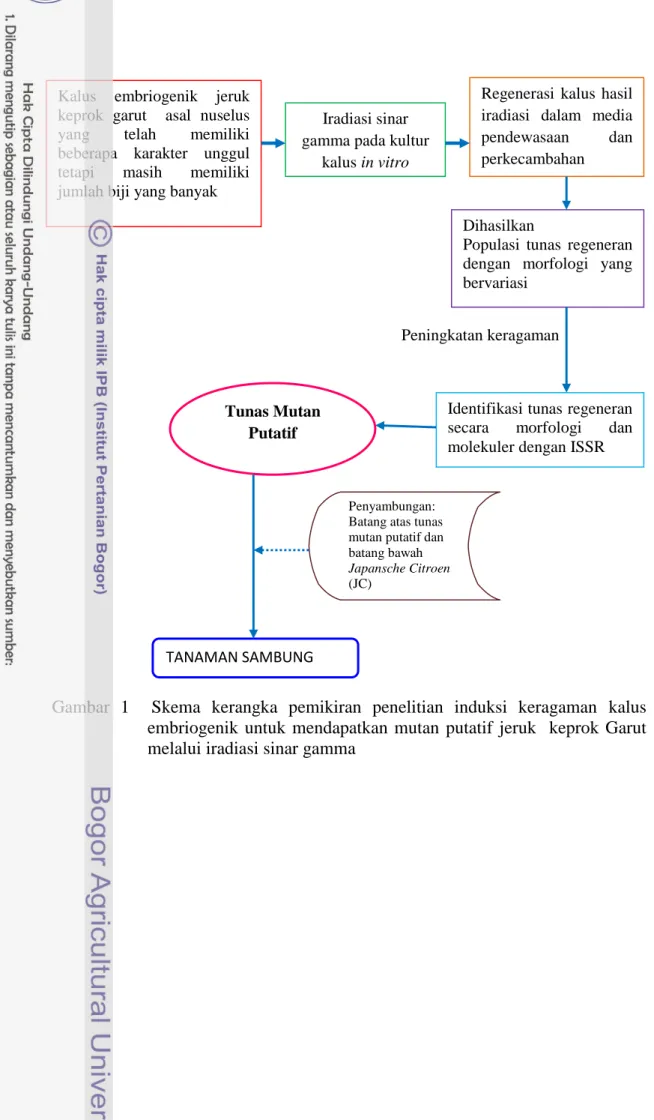
Kerangka Berpikir
Buah jeruk keprok Garut merupakan salah satu buah komoditas unggulan. Jeruk keprok Garut memiliki karakter unggul tetapi masih memiliki biji yang cukup banyak. Peningkatan kualitas jeruk keprok Garut agar sesuai dengan selera konsumen dapat melalui pendekatan Bioteknologi dan Pemuliaan tanaman melalui mutasi. Kombinasi metode kultur jaringan menggunakan kalus somatik dengan mutasi menggunakan mutagen sinar Gamma berpotensi untuk menghasilkan mutan solid. Media pendewasaan dan perkecambahan yang tepat mampu meregenerasi kalus hasil iradiasi menjadi tunas regeneran. Identifikasi melalui pengamatan secara morfologi dan molekuler dengan penanda ISSR (Inter
Simple Sequence Repeat) dapat membedakan keragaman yang dihasilkan.
Berdasarkan identifikasi molekuler dapat dihasilkan tunas-tunas mutan putatif yang memiliki karakter berbeda. Pertumbuhan tunas mutan putatif akan lebih cepat dengan melakukan penyambungan. Penyambungan dengan batang bawah
Japansche Citroen (JC) akan dihasilkan tanaman sambung yang memiliki
Gambar 1 Skema kerangka pemikiran penelitian induksi keragaman kalus embriogenik untuk mendapatkan mutan putatif jeruk keprok Garut melalui iradiasi sinar gamma
Kalus embriogenik jeruk keprok garut asal nuselus yang telah memiliki beberapa karakter unggul tetapi masih memiliki jumlah biji yang banyak
Iradiasi sinar gamma pada kultur
kalus in vitro
Regenerasi kalus hasil iradiasi dalam media pendewasaan dan perkecambahan
Dihasilkan
Populasi tunas regeneran dengan morfologi yang bervariasi
Identifikasi tunas regeneran secara morfologi dan molekuler dengan ISSR Peningkatan keragaman
Tunas Mutan Putatif
TANAMAN SAMBUNG
Penyambungan: Batang atas tunas mutan putatif dan batang bawah
Japansche Citroen
TINJAUAN PUSTAKA
Botani Tanaman Jeruk
Buah jeruk merupakan salah satu buah yang digemari, saat ini kebutuhannya semakin meningkat seiring dengan tumbuhnya kesadaran masyarakat akan pentingnya nilai gizi. Tanaman jeruk banyak tumbuh di daerah tropis dan sub tropis, menurut sejarah penyebarannya meliputi wilayah Asia Tenggara, India, Cina Selatan, Semenanjung Indo-Cina dan Malaya kemudian menyebar ke benua lain (Chapot 1975 dalam Nicolasi 2007).
Menurut Hodgson (1967) tanaman jeruk yang penting secara komersial dapat dikelompokan menjadi empat kelompok yaitu : orange (jeruk manis),
mandarin (jeruk keprok), pummelo (jeruk besar) dan grapefruit, serta kelompok common acid (yang terdiri dari citron, lemon dan lime).
Tanaman jeruk mempunyai banyak kultivar, setiap kultivar mempunyai sifat-sifat tersendiri sehingga tanaman ini dapat ditanam dimana saja baik di dataran rendah maupun di dataran tinggi. Tanaman jeruk rata-rata berbunga setiap tahun sehingga buah jeruk dapat tersedia setiap saat (AAK 1994). Taksonomi tanaman jeruk menurut (Swingle & Reece 1967 dalam Ortiz 2002),
Divisio : Spermatophyta Subdivisio : Angiospermae Class : Dicotyledonae Ordo : Rutales Familia : Rutaceae SubFamili : Aurantioideae Genus : Citrus
Spesies : Citrus reticulata/nobilis L.(keprok)
Menurut Swingle (1967) dalam Ortiz (2002), genus citrus dapat dibagi menjadi dua subgenus yaitu subgenus papeda dan subgenus eucitrus. Tanaman jeruk yang diklasifikasikan dalam subgenus eucitrus adalah: C. aurantium, C.
sinensis, C. reticulata, C. limon, C. medica, C. aurantifolia, C. grandis, C. paradisi, C. indica dan C. tachibana.
Secara Agronomi subgenus eucitrus dapat dikelompokan menjadi spesies seperti: jeruk manis (C. sinensis), mandarin (di kelompokan menjadi 4 spesies), lemon (C. limon), grapefruit (C. paradisi), limes (Aurantifolia), jeruk asam (C.
aurantium), pummelos (C. Grandis), citrons (C. medica) (Ortiz 2002).
Untuk subgenus jeruk manis yang termasuk spesies Citrus sinensis yaitu jeruk navel, jeruk common, jeruk merah. Sedangkan beberapa spesies yang termasuk subgenus jeruk mandarin yaitu jeruk satsuma, jeruk tangerine, jeruk
mandarin mediterranean dan jeruk mandarin lain. Spesies mandarin lain seperti C. reticulata Blanco atau Ponkan, C. temple Hort dan C. nobilis Lour (Ortiz
2002).
Biji tanaman jeruk dapat digolongkan dalam kelompok apomiksis. Apomiksis adalah reproduksi aseksual yaitu proses reproduksi tanpa terjadinya fusi gamet betina dan jantan (Nugroho 2006). Apomiksis merupakan penyimpangan dalam suatu proses reproduksi yang mekanisme perkembangannya sangat kompleks (Koltunow 1993). Apomiksis menghasilkan embrio yang memiliki konstitusi genetik yang sama dengan induknya (Koltunow 1993). Apomiksis dapat dikategorikan menjadi fakultatif dan obligat (Den Nijs & Van Dijk 1993). Apomiksis obligat adalah bentuk apomiksis yang bijinya terbentuk tanpa proses fusi gamet betina dan gamet jantan, seperti pada manggis (Koltunow 1996). Apomiksis fakultatif pada biji jeruk disebut sebagai fenomena poliembrioni, yaitu terjadinya beberapa embrio dalam satu biji. Embrio yang dihasilkan terdiri dari embrio zigotik dan embrio nuselar. Embrio zigotik dihasilkan dari fusi gamet jantan dan betina, sedangkan embrio nuselar terbentuk dari jaringan kantung embrio. Kedua embrio yang dihasilkan memiliki konstitusi genetik yang berbeda. Dalam perkembangannya kedua embrio tersebut tumbuh secara beriringan tanpa saling mengganggu (Koltunow 1996).
7
Jeruk Keprok
Jeruk keprok (Citrus Reticulata L.) di Indonesia merupakan jeruk yang paling populer dan banyak di konsumsi sebagai buah segar dengan rasa manis menyegarkan. Di Indonesia sejarah asal usulnya jeruk keprok tidak banyak diketahui. Berbagai jenis keprok saat ini sebagian besar merupakan warisan yang ditinggalkan Belanda (Sarwono 1994). Saat ini jeruk keprok mulai digemari dan banyak dicari oleh masyarakat. Jeruk keprok banyak digemari karena warna buahnya yang menarik, rasanya manis asam menyegarkan, kandungan vitamin A dan C yang lebih tinggi dibanding jenis jeruk yang lain (Tabel 1).
Indonesia memiliki beragam jeruk keprok varietas unggul lokal yang berkualitas. Jenis jeruk keprok tersebut seperti jeruk keprok SoE (NTT), Batu 55, Pulung dan Madura (Jawa Timur), Garut (Jawa Barat), Tejakula (Bali), Siompu (Sulawesi Tenggara) dan Kelila (Papua). Selain itu terdapat pula beberapa varietas yang baru dikembangkan seperti keprok Madu Terigas (Kalimantan Barat), Jeruk Kacang (Sumatera Barat) dan Borneo Prima (Kalimantan Timur) (Ditjen Hortikultura 2008).
Tabel 1 Kandungan Vitamin dan Zat Mineral Setiap 100 gram Buah Jeruk
Kadar Keprok Manis Nipis Grape Fruit
Vitamin A (I. U.) 400 200 - -
Vitamin B (I. U.) 60 60 60 60
Vitamin C (I. U.) 60 30 40 50
Protein (gram) 0.5 0.5 0.5 0.5
Lemak (gram) 0.1 0.1 - -
Hidrat arang (gram) 8 10 3 4
Besi (mgr) - 0.3 0.1 0.1
Kapur (mgr) 40 40 10 20
Phosphor (mgr) 20 20 10 20
Sumber : AAK 1994
Tanaman jeruk keprok rata-rata mempunyai tinggi 2 - 8 meter. Tanaman ini ada yang berduri dan ada yang tidak. Tajuk pohon tidak beraturan, dahan kecil dengan cabang banyak dan tajuknya rindang. Daun berbentuk tunggal, kecil dan
bertangkai pendek, warnanya hijau tua mengkilat pada permukaan atas dan hijau muda pada permukaan bawah, tangkai daun tidak bersayap. Tanaman jeruk keprok berbunga majemuk, bunga keluar pada ketiak daun atau pada ujung cabang. Bunganya kecil-kecil dan berbau harum. Berbunga pada akhir musim kering. Buah jeruk keprok mempunyai ruang antara 9-19 ruangan, tangkai buah pendek, kulit buah mudah dikupas. Buah yang sudah tua warna kulitnya ada yang hijau tua, hijau muda dan kuning orange. Tekstur kulitnya mengkilat, licin, penuh pori-pori dan sedikit berbau harum. Daging buahnya berwarna orange, banyak mengandung air, baunya enak dengan rasa manis sedikit asam. Tiap ruang (septa buah) mengandung banyak biji, septa ini mudah dipisah-pisahkan. Tanaman jeruk jenis ini sangat baik diusahakan ditempat-tempat dengan ketinggian 700-1200 meter di atas permukaan laut (Sarwono 1994). Tanaman jeruk keprok dapat diperbanyak secara generatif dan vegetatif. Tanaman jeruk umumnya diperbanyak melalui okulasi dan penyambungan (Sunarjono 2009).
Japansche Citroen
Jeruk Citroen berasal dari Birma Utara dan Cina Selatan. Jeruk ini dapat tumbuh baik mulai dari dataran rendah sampai tinggi. Tanaman jeruk ini mampu berbuah sepanjang tahun dengan kadar air tanah yang mencukupi. Tanaman berupa perdu setinggi 2–3.5 meter, dengan batang yang pendek dan tidak berbulu. Letak daun berpencar dengan tangkai yang sangat pendek. Daun tipis bertulang dan jika diremas baunya wangi sekali. Bunganya terletak di ketiak daun dan jarang muncul di ujung cabang. Bunganya besar dan baunya sangat harum, sebagian besar bunganya adalah bunga jantan. Jumlah bunga dalam satu tandan sekitar 1-10 bunga. Bentuk buahnya ada yang bulat panjang dan ada bulat membesar. Kulit buahnya berpori-pori, berwarna kuning kemerahan, tebal dan sulit dikupas. Daging buah berwarna kuning muda, berbau harum, rasanya sangat asam dan berbiji banyak (Sarwono 1994).
Jeruk Japansche Citroen (JC) merupakan varietas hibrid hasil persilangan antara Citroes nobilis (keprok) dengan Citroes medica (lemon). Japansche
Citroen mempunyai karakter mirip dengan Rough Lemon, tahan terhadap
9
tinggi dengan kualitas yang baik serta tahan terhadap serangan virus Exocortis (Sugiyanto 1994). Japansche Citroen memiliki kevigoran yang tinggi, memiliki jumlah biji lebih dari 10 per buah, mudah beradaptasi, buah yang dihasilkan rasanya sangat asam sehingga tidak layak konsumsi. Japansche Citroen memiliki kompatibilitas yang tinggi dan lebih vigor dibandingkan Rough Lemon (Susanto 2003).
Pemuliaan Mutasi
Pemuliaan tanaman pada dasarnya merupakan aktivitas menyeleksi tanaman dari populasi yang memiliki keragaman genetik untuk mendapatkan tanaman yang mempunyai sifat tertentu. Tujuan dari kegiatan pemuliaan tanaman yaitu menghasilkan varietas tanaman dengan sifat-sifat yang sesuai dengan sistem budidaya yang ada dan tujuan ekonomi yang diinginkan (Syukur 2009). Untuk menghasilkan tanaman unggul melalui teknik pemuliaan tanaman dapat melalui beberapa metode seperti melalui introduksi tanaman dari luar wilayah, melalui persilangan antar dua spesies, melalui rekayasa genetika dengan memasukan gen yang diinginkan ke dalam organisme dan melalui mutasi dengan menggunakan mutagen (Syukur 2009).
Pemuliaan mutasi merupakan perbaikan tanaman melalui aplikasi teknik mutasi dalam upaya meningkatkan keragaman genetik (Suranto 2003). Menurut Soeranto (2003) mutasi adalah perubahan secara tiba-tiba dan acak pada materi genetik yang dapat memunculkan keragaman genetik. Mutasi dapat terjadi pada setiap bagian tanaman dan fase pertumbuhan tanaman, namun lebih banyak terjadi pada bagian yang sedang aktif melakukan pembelahan sel seperti tunas dan biji.
Secara umum mutasi dapat dibedakan menjadi dua yaitu mutasi alami (spontan) dan mutasi buatan. Mutasi alami terjadi secara spontan yang tidak diketahui penyebabnya dan terjadi secara acak tanpa diketahui kapan terjadinya. Peluang terjadinya mutasi alami sangat kecil yaitu 10-6 –10-7 (IAEA 1977 dalam Aisyah 2006). Mutasi alami ini terjadi secara lambat dan terus menerus sehingga memerlukan waktu yang lama untuk mengakumulasi dalam menghasilkan mutan. Sedangkan mutasi buatan merupakan mutasi yang terjadi karena adanya perlakuan
tertentu baik secara fisik dan kimia. Bahan yang menyebabkan terjadinya mutasi disebut mutagen.
Mutagen fisik seperti sinar UV, α, ß, γ dan fast neutron sedangkan mutagen kimia seperti colchisin, dietil sulfat (DES), etilenamin (EI), nitroso etil urea (ENH) (Van Harten 1998). Mutasi dapat dibedakan berdasarkan beberapa kategori dan yang paling umum untuk membedakan yaitu berdasarkan besarnya sekuen DNA yang berubah baik pada tingkat genom, kromosom dan gen (Soeranto 2003). Mutasi genom merupakan perubahan pada tingkat jumlah kromosom (ploidi) dan perubahan dapat menyebabkan terjadi poliploid dan uneuploid. Mutasi kromosom merupakan perubahan pada struktur kromosom yang mengakibatkan terjadinya delesi, translokasi, substitusi dan inversi. Mutasi gen merupakan perubahan pada tingkat gen yang menyebabkan terjadinya penambahan atau pengurangan satu atau beberapa pasangan basa (Van Harten 1998).
Keberhasilan program pemuliaan mutasi sangat tergantung pada pemilihan mutagen, metode aplikasi, dosis yang digunakan, regenerasi atau pertumbuhan tanaman tersebut, bagian tanaman yang digunakan dan teknik seleksi pada generasi berikutnya (Van Harten 1998).
Pemuliaan Mutasi pada Jeruk
Peningkatan kualitas jeruk dengan aplikasi sinar gamma saat ini telah banyak digunakan. Pemberian mutagen sinar gamma pada biji jeruk limau langkat dan limau madu menghasilkan informasi bahwa kandungan air dalam biji sangat berpengaruh pada tingkat kerusakan akibat mutasi (Noor et al. 2009). Di Iran, mutagen sinar gamma yang diaplikasikan pada tunas aksilar jeruk mandarin lokal pada dosis 40 Gy dan diperbanyak secara in vitro menghasilkan 6 tanaman dengan buah tanpa biji dan 5 tanaman tahan suhu dingin (Majid et al. 2009). Pengembangan jeruk tanpa biji di Israel dengan memanfaatkan jeruk Murcot yang diinduksi sinar gamma menghasilkan jeruk tanpa biji dengan tetap memiliki produktivitas yang tinggi (Vardi et al. 1993). Peningkatan kualitas jeruk mandarin Kinnow varietas lokal di Pakistan telah menghasilkan jeruk tanpa biji melalui aplikasi iradiasi sinar gamma (Altaf 2004). Di Afrika Selatan dihasilkan
11
jeruk mandarin varietas Nova tanpa biji melalui iradiasi sinar gamma pada dosis disekitar 20 Gy (Vos 2009). Di Cina telah dikembangkan pula jeruk tanpa biji melalui persilangan tanaman tetraploid dengan diploid, teknologi fusi protoplas dan pemuliaan mutasi dengan iradiasi (Zhong 2007).
Di Indonesia peningkatan kualitas jeruk telah dilakukan melalui pemuliaan mutasi dan fusi protoplas. Tunas aksilar jeruk keprok dan jeruk besar asli Indonesia yang diberikan sinar gamma pada dosis 20 – 40 Gy menghasilkan buah tanpa biji (Sutarto et al. 2009). Tanaman jeruk keprok Soe, Garut dan Batu 55 yang telah berumur 3 tahun hasil induksi iradiasi sinar gamma di karakterisasi, dan dihasilkan pada dosis iradiasi 20 Gy tiga tanaman keprok Soe tanpa biji (Martasari et al. 2005). Kalus embriogenik jeruk siam yang diberikan perlakuan iradiasi sinar gamma menghasilkan perubahan morfologi daun, pertumbuhan, anatomi stomata dan tingkat ploidi (Husni & Kosmiatin 2011). Diperoleh tanaman jeruk dan masih dalam tahap pendewasaan di lapang hasil fusi protoplas jeruk siam simadu dengan jeruk mandarin satsuma (Husni 2010).
Mutagen Sinar Gamma
Mutagen fisik yang umum digunakan yaitu sinar gamma. Pemilihan sinar gamma dikarenakan sinar ini mempunyai kelebihan dibandingkan dengan sinar radioaktif lainnya. Sinar gamma memiliki panjang gelombang yang paling kecil (0.01 sampai 10 nm) dan energi terbesar dibandingkan spektrum gelombang elektromagentik yang lain. Selain itu, sinar gamma memiliki daya ionisasi yang paling rendah namun jangkauan tembus yang paling besar dibandingkan sinar α dan ß. Karena daya tembusnya yang begitu tinggi, sinar gamma mampu menembus berbagai jenis bahan kecuali beton. Sejauh ini ada tiga pemancar sinar gamma yang paling sering digunakan yakni cobalt-60, cesium-137 dan
technetium-99 (Nuke 2009).
Sinar gamma merupakan gelombang elektromagnetik yang mempunyai sifat radiasi pengion yang mampu mengionisasi materi yang dilewatinya. Radiasi ionisasi ini mampu menghasilkan energi yamg tinggi dan aktif yang dapat merusak setiap molekul yang dilewatinya secara langsung dan tidak langsung.
Pengaruh radiasi secara langsung yaitu jika ionisasi terjadi didekat kromosom maka dapat langsung menyebabkan terjadinya mutasi. Pengaruh iradiasi secara tidak langsung terjadi ketika energi hasil ionisasi berupa elektron bebas dan radikal positif bereaksi terlebih dahulu dengan air dan oksigen yang ada dalam sel. Reaksi tersebut menghasilkan radikal positif dan peroksida yang sangat reaktif sehingga dapat merusak setiap molekul yang ditemuinya dan menyebabkan mutasi. Adanya kerusakan pada tingkat molekuler inilah yang memunculkan keragaman pada tanaman yang diberikan perlakuan iradiasi, namun pada keadaan tertentu kerusakan dapat diperbaiki selama siklus hidupnya, hal ini disebut sebagai kerusakan fisiologis (Van Harten 1998).
Dalam perkembangannya mutasi dengan mutagen sinar gamma telah banyak diaplikasikan seperti pada tunas muda kentang, perlakuan iradiasi pada dosis 2-6 Gy dapat meningkatkan kandungan protein dalam kentang (Li et al. 2005), pada tanaman jeruk, iradiasi biji jeruk pada dosis 50 Gy mampu meningkatkan total protein terlarut dalam buah jeruk (Ling et al. 2008), iradiasi kalus manggis pada dosis 25 Gy (Qosim 2006) dan biji manggis pada dosis 50 Gy (Widiastuti 2010), dapat meningkatkan keragaman tunas regeneran manggis yang dihasilkan.
Teknik Kultur Jaringan pada Tanaman Jeruk
Teknik kultur jaringan telah banyak diaplikasikan dengan tujuan perbanyakan bibit tanaman bernilai ekonomis dan peningkatan kulitas tanaman. Dalam peningkatan kualitas tanaman melalui rekayasa genetik maupun pemuliaan mutasi melalui teknik kultur jaringan, hal penting yang harus dikuasai adalah sistem regenerasi dari tanaman tersebut. Metode regenerasi dalam teknik kultur jaringan dapat melalui embriogenesis. Pola pembentukan embriogenesis terdiri dari embriogenesis langsung dan tidak langsung. Embriogenesis langsung yaitu pembentukan embrio somatik langsung dari eksplan, sedangkan embriogenesis tidak langsung yaitu pembentukan embrio somatik melalui induksi kalus terlebih dahulu. Embriogenesis somatik merupakan pembentukan embrio dari sel somatik tunggal. Embrio somatik berasal dari proembrio masses (PEM) yang berasal dari individu sel yang memiliki struktur bipolar yang akan membentuk tunas dan akar.
13
Pada embriogenesis somatik, embrio berkembang melalui beberapa tahap yaitu globular, jantung, torpedo, kotiledon dan planlet (Gray 2005).
Jalur embriogenesis banyak digunakan dalam penelitian tanamanan jeruk. Nuselus jeruk siam Simadu dan Pontianak menghasilkan kalus embriogenik setelah diinduksi dalam media MS yang dikombinasikan dengan vitamin MW, 3 mgL-1 BA dan 500 mgL-1 malt ekstrak. Kalus embriogenik diregenerasikan dalam media MS ditambahkan vitamin MW dan 0.5 mgL-1 ABA selanjutnya embrio somatik yang dihasilkan ditumbuhkan dalam media MS yang ditambahkan vitamin MW dan 0.5 mgL-1 GA3 (Husni et al. 2010). Begitu pula yang dihasilkan
oleh Merigo (2011) dengan menggunakan nuselus jeruk keprok Batu 55 dihasilkan kalus embriogenik yang diinduksi dalam media MS yang dikombinasi dengan vitamin MW, 3 mgL-1 BAP dan 300 mgL-1 casein hydrolisat. Kalus embriogenik ditanam dalam media MS yang dikombinasikan dengan 2.5 mgL-1 ABA, selanjutnya embrio somatik yang dihasilkan ditumbuhkan dalam media MS yang dikombinasikan dengan vitamin MW dan 2.5 mgL-1 GA3. Embrio jeruk
batang bawah Japansche Citroen (JC) diinduksi dalam media MS yang dikombinasikan dengan 0.5 mgL-1 2.4D dan 0.05-0.1 mgL-1 BAP dan menghasilkan kalus embriogenik (Triatminingsih et al. 2003). Regenerasi kalus menjadi tunas jeruk batang bawah Citromelo optimal dalam media MS modifikasi yang ditambahkan 0.5 mgL-1 BAP, 0.02 mgL-1 NAA dan 40 mgL-1 adenin sulfat, sedangkan pada jeruk Japansche Citroen (JC) optimal dalam media MS modifikasi yang ditambahkan 0.5 mgL-1 BAP, 0.02 mgL-1 NAA (Triatminingsih et al. 2004). Embrio biji jeruk Japansche Citroen (JC) yang ditanam dalam media MS yang dikombinasikan dengan vitamin Gambrog-B5, 0.5 mgL-1 2.4 D dan 0.05-0.15 mgL-1 BAP (Karmanah 2009).
Penyambungan (Grafting)
Grafting merupakan metode konvensional yang telah lama digunakan
untuk memperbaiki kualitas dan kuantitas hasil tanaman. Grafting dapat menghasilkan kombinasi baru dari dua jenis tanaman yang digunakan. Grafting
adalah penggabungan dua bagian tanaman yang berlainan sehingga menjadi satu kesatuan yang utuh dan tumbuh sebagai satu tanaman (Mangoendidjojo 2003).
Penyambungan dapat dilakukan secara in vitro (dalam botol kultur) dan ex
vitro (di lapang). Penyambungan secara in vitro umumnya disebut sebagai
sambung mikro sedangkan penyambungan secar ex vitro umumnya disebut sebagai sambung pucuk. Dalam budidaya teknik penyambungan yang umum dilakukan adalah sambung pucuk. Tujuan dilakukannya sambung pucuk adalah untuk mempercepat waktu berbunga dan berbuah, meningkatkan kualitas dan kuantitas tanaman, peremajaan tanaman dan menguji keberadaan penyakit akibat virus (Mangoendidjojo 2003). Tujuan dilakukannya sambung mikro adalah mempersingkat waktu untuk meremajakan tanaman, meregenerasi tanaman, menghasilkan tanaman bebas penyakit, menyediakan bibit siap lapang, dapat mengetahui lebih dini ketidaksesuaian tanaman (Estrada et al. 2002).
Dalam penyambungan hal terpenting adalah kemampuan daya gabung (kompatibilitas) dari kedua batang yang disambungkan. Kompatibilitas mempengaruhi kelangsungan hidup tanaman hasil sambungan dan kemampuan produksinya. Pada penyambungan yang kompatibel, maka kedua bagian yang disambungkan akan berhasil membentuk suatu kesatuan dan dapat berkembang menjadi kesatuan yang utuh. Sebaliknya dapat pula terjadi inkompatibilitas yang disebabkan oleh respon fisiologi yang tidak sesuai antara kedua bagian yang disambungkan (Handayani 2012).
Teknik penyambungan banyak digunakan dalam perbanyakan tanaman buah seperti pada alpukat yang bertujuan untuk mempercepat pertumbuhan tanaman alpokat hasil transformasi (Raharjo & Litz 2003), tanaman cerry untuk meremajakan tanaman dan menghasilkan tanaman bebas penyakit (Amiri 2006), tanaman jeruk untuk menghasilkan tanaman bebas virus (Naz et al. 2007), Tanaman manggis untuk mengatasi kesulitan perakaran (Handayani 2012), Jeruk besar Nambangan dan Cikoneng untuk mempercepat pertumbuhan (Putri 2006).
Analisis Keragaman
Peningkatan kualitas dapat dilakukan melalui kombinasi pemuliaan mutasi dan teknik kultur jaringan. Dengan teknik ini akan dihasilkan tanaman yang
15
beragam. Untuk melihat seberapa besar keragaman yang dihasilkan dapat dilakukan identifikasi baik secara morfologi dan molekuler. Untuk membedakan pada tahap awal dapat dilakukan secara morfologi sedangkan untuk lebih memastikan keragaman yang dihasilkan dapat melalui analisis molekuler.
Deteksi morfologi in vitro dilakukan melalui pengamatan secara visual terhadap perkembangan yang dihasilkan. Dalam pengamatan ini diperlukan kejelian dan kecermatan untuk dapat membedakan. Pengamatan dilakukan pada karakter-karakter kualitatif dan kuantitatif. Untuk memastikan keragaman yang dihasilkan dapat dilakukan secara molekuler.
Salah satu penanda molekuler yang dapat dimanfaatkan yaitu penanda ISSR. Penanda ISSR (Inter Simple Sequence Repeats) merupakan marker yang berkembang lebih akhir dibanding RAPD (Random Amplified Polymorphic DNA), RFLP (Restriction Fragment Lenght Polymorphisme) dan SSR (Simple
Sequence Repeats) (Azrai 2005). ISSR merupakan penanda DNA berbasis PCR
yang menggunakan sekuen mikrosatelit. Penanda ISSR memiliki keunggulan seperti aplikasinya sangat sederhana, mudah dilakukan, cepat, melibatkan kuantitas cetakan DNA rendah (10-30 bp), dapat diulang dan konsisten, tidak memerlukan banyak informasi untuk mendesain primer, dan mampu membedakan individu-individu yang memiliki kekerabatan (Zietkiewicz et al. 1994). Penanda ISSR telah banyak digunakan dalam identifikasi tanaman jeruk seperti pada keragaman jeruk lemon (Capparelli et al. 2004), beberapa genotipe jeruk (Shahsavar 2007), keragaman jeruk Soe hasil iradiasi sinar gamma (Yulianti et al. 2010), jeruk Siam hasil iradiasi sinar gamma (Agisimanto et al. 2007) dan jeruk Siam hasil fusi protoplas (Husni 2010).
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari Bulan Oktober 2011 sampai Bulan September 2012. Induksi kalus, proliferasi dan regenerasi dilakukan di Laboratorium Kultur Jaringan, identifikasi stomata dan pemotongan jaringan dilakukan di Laboratorium Mikroteknik, Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB. Identifikasi ISSR dilakukan di Laboratorium Molekuler BB-Biogen. Sedangkan untuk perlakuan iradiasi sinar gamma di lakukan di Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Nuklir Nasional (PATIR-BATAN).
Bahan dan Alat
Bahan yang digunakan adalah kalus embriogenik jeruk keprok Garut asal nuselus yang telah berumur 4 tahun. Media dasar MS yang digunakan sebagai sumber hara makro dan mikro (Murashige & Skoog) (Lampiran 1), vitamin MW (Morel & Wetmore) (Lampiran 1), zat pengatur tumbuh BAP (Benzil Amino
Purin), ABA (Absisic Acid) , GA3 (Giberelin Acid), Casein Hydrolisat, gula,
gelrite, dan alkohol 70%, daun tunas regeneran hasil iradiasi in vitro, Japansche Citroen (JC), solatif, primer ISSR1- ISSR 8.
Alat yang digunakan seperti peralatan iradiasi 60Co, piala gelas, timbangan analitik, pipet, labu ukur, kompor atau hot plate, botol kultur, pinset, scalpel, gunting, laminar air flow, mikroskop dan kamera digital (Sony super steady shot-DSC T10-7.2 pixels).
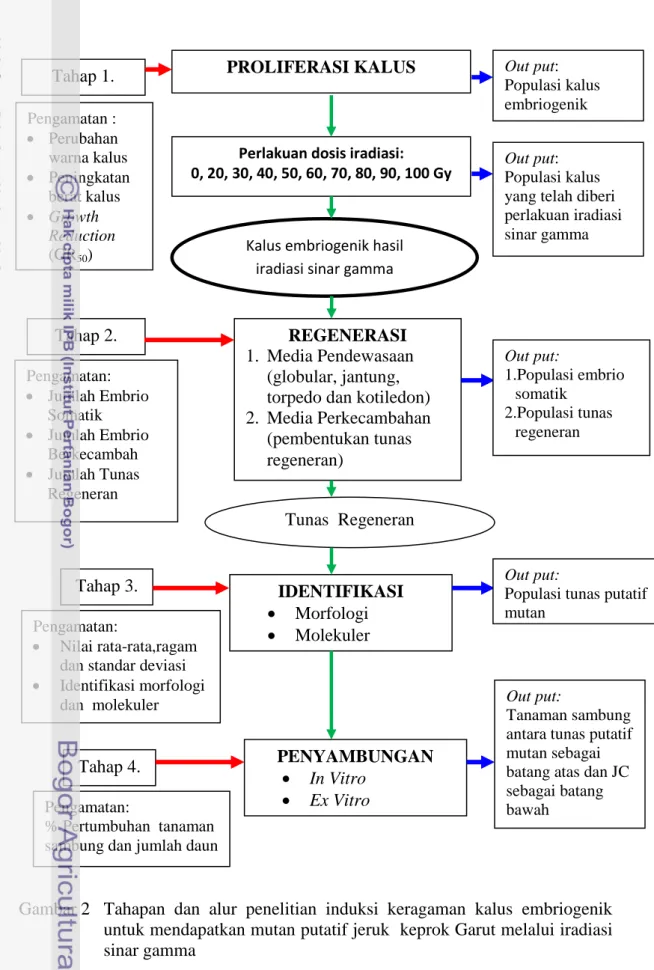
Metode Penelitian
Penelitian yang dilakukan terdiri dari empat tahap yaitu 1) proliferasi kalus embriogenik dan induksi iradiasi sinar gamma, 2) regenerasi kalus hasil iradiasi melalui tahapan embriogenesis somatik, 3) identifikasi secara morfologi dan molekuler, 4) penyambungan tunas mutan putatif dengan batang bawah secara
18
Gambar 2 Tahapan dan alur penelitian induksi keragaman kalus embriogenik untuk mendapatkan mutan putatif jeruk keprok Garut melalui iradiasi sinar gamma
PROLIFERASI KALUS
Perlakuan dosis iradiasi: 0, 20, 30, 40, 50, 60, 70, 80, 90, 100 Gy
REGENERASI
1. Media Pendewasaan (globular, jantung, torpedo dan kotiledon) 2. Media Perkecambahan (pembentukan tunas regeneran) IDENTIFIKASI Morfologi Molekuler Kalus embriogenik hasil
iradiasi sinar gamma
Tunas Regeneran PENYAMBUNGAN In Vitro Ex Vitro Tahap 1. Tahap 2. Tahap 3. Tahap 4. Pengamatan : Perubahan warna kalus Peningkatan berat kalus Growth Reduction (GR50) Pengamatan: Jumlah Embrio Somatik Jumlah Embrio Berkecambah Jumlah Tunas Regeneran Pengamatan: Nilai rata-rata,ragam dan standar deviasi
Identifikasi morfologi dan molekuler
Pengamatan:
% Pertumbuhan tanaman sambung dan jumlah daun
Out put:
Populasi kalus embriogenik
Out put:
Populasi kalus yang telah diberi perlakuan iradiasi sinar gamma Out put: 1.Populasi embrio somatik 2.Populasi tunas regeneran Out put:
2. Populasi tunas putatif mutan
Out put:
1. Tanaman sambung antara tunas putatif mutan sebagai batang atas dan JC sebagai batang bawah
Tahap 1. Proliferasi kalus dan induksi iradiasi sinar gamma
Kalus diperbanyak dalam media proliferasi yaitu media dasar MS yang dikombinasikan dengan vitamin MW dan Casein Hydrolisat 300 mgL-1 (Merigo 2011). Kalus diinkubasi selama 4 minggu dan digunakan pada tahap selanjutnya (Gambar 3). Kalus hasil proliferasi diberikan perlakuan iradiasi sinar gamma dalam Gamma Chamber 60Co (laju dosis saat perlakuan 0.648 KGy per jam) dengan dosis perlakuan 0 (kontrol), 20, 30, 40, 50, 60, 70, 80, 90, 100 Gy (Gambar 3). Kalus selanjutnya ditanam dalam media tanpa zat pengatur tumbuh dan diinkubasi dalam ruang kultur pada suhu 24-25 0C dengan intensitas cahaya 1000-1500 lux selama 6 minggu (Gambar 3). Pengamatan dilakukan setiap minggu sampai minggu ke-6. Peubah yang diamati yaitu perubahan warna kalus, peningkatan berat kalus dan persentase proliferasi kalus. Data proliferasi kalus dianalisis dengan software Curve Expert 1.4 (Finney 1998 dalam Soeranto 2003) dan diperoleh rekomendasi Growth Reduction GR50.
Gambar 3 A. Kalus hasil proliferasi, B. Gamma chamber Co-60, C. Kalus hasil iradiasi dalam media tanpa zat pengatur tumbuh
Penelitian tahap ini menggunakan rancangan acak lengkap dengan satu faktor yaitu dosis iradiasi sinar gamma. Setiap perlakuan diulang masing-masing 5 botol, setiap botol berisi 5 clumps kalus, setiap clumps terdiri atas 20 proembrio dengan diameter sekitar 0.5 cm dan berat sekitar 0.1 gram. Data yang diperoleh dianalisis program SAS Release 6.12 (Mattjik & Sumertajaya 2006).
Tahap 2. Regenerasi kalus hasil iradiasi sinar gamma
Kalus hasil iradiasi sinar gamma selanjutnya diregenerasi dalam media pendewasaan dan perkecambahan. Kalus yang berisi sekitar 20 proembrio pada setiap clumps ditanam pada media pendewasaan yaitu kombinasi media dasar MS
20
yang ditambahkan vitamin MW, ABA 2.5 mgL-1, Casein Hydrolisat 300 mgL-1 (Merigo 2011). Kalus diinkubasi dalam ruang kultur pada suhu 24-25 0C dengan intensitas cahaya 1000-1500 lux selama 6 minggu. Pengamatan dilakukan setiap minggu dan diamati perkembangan proembrio yang berubah menjadi embrio. Embrio pada media pendewasaan akan berubah dari fase globular menjadi fase jantung, fase torpedo dan fase kotiledon (embrio dewasa). Selanjutnya embrio somatik ditanam dalam media perkecambahan yaitu media dasar MS yang dikombinasikan dengan vitamin MW dan ditambahkan GA3 2.5 mgL-1 (Merigo
2011) kemudian diikubasi selama 6 minggu. Kecambah yang dihasilkan selanjutnya ditanam dalam media tanpa zat pengatur tumbuh sebanyak 4 kali dengan interval waktu setiap 4 minggu. Penanaman berulang dalam media tanpa zat pengatur tumbuh bertujuan untuk memaksimalkan pertumbuhan kecambah sehingga dihasilkan planlet atau tunas regeneran yang dapat diidentifikasi lebih lanjut.
Peubah yang diamati yaitu jumlah embrio somatik, efisiensi pembentukan embrio somatik, jumlah embrio berkecambah dan jumlah tunas regeneran. Sejumlah tunas regeneran yang dihasilkan diberikan kode huruf “M” menunjukan perlakuan iradiasi, angka dibelakang huruf menunjukan dosis iradiasi dan angka setelah tanda garis miring (/) merupakan ulangan perlakuan. Kode tunas regeneran seperti M0(tanpa iradiasi atau kontrol), M20 (20 Gy), M30 (30 Gy), M40 (40 Gy), M50 (50 Gy), M60 (60 Gy), M70 (70 Gy), M80 (80 Gy), M90 (90 Gy), M100 (200 Gy).
Tahap 3. Identifikasi tunas regeneran hasil iradiasi
Tunas regeneran yang dihasilkan selanjutnya diidentifikasi untuk mengamati keragaman yang dihasilkan. Identifikasi dilakukan berdasarkan penanda morfologi dan molekuler.
Identifikasi penanda morfologi
Karakter morfologi diamati berdasarkan pengamatan visual. Pengamatan dilakukan pada tahap in vitro setelah kecambah tumbuh menjadi tunas regeneran. Pengamatan dilakukan setiap minggu pada karakter kualitatif dan kuantitatif. Pada karakter kuantitatif peubah yang diamati adalah tinggi tunas, jumlah daun, jumlah
cabang, jumlah akar, jumlah stomata, panjang dan lebar stomata. Karakter kualitatif yang diamati adalah karakter bentuk batang, bentuk daun, warna daun, pertegakan tunas. Pengamatan pada karakter jumlah, panjang dan lebar stomata diamati menggunakan daun yang diiris secara paradermal (Lampiran 6).
Penghitungan jumlah stomata dilakukan pada beberapa bidang pandang di dalam satu preparat. Jumlah stomata setiap perlakuan merupakan hasil rata-rata jumlah stomata per bidang pandang dari daun tunas regeneran. Kerapatan stomata yaitu jumlah stomata dibagi satuan luas bidang pandang. Ukuran stomata diukur berdasarkan panjang dan lebar stomata.
Identifikasi menggunakan penanda ISSR
Sampel daun diambil dari tunas regeneran hasil seleksi. Tahapan analisis ISSR : isolasi DNA dengan menggunakan metode Doyle dan Doyle (1990); pengukuran kualitas dan kuantitas DNA berdasarkan metode Sambrook et al. (1989) serta optimasi program PCR dan amplifikasi DNA berdasarkan pada penelitian Martasari et al. (2012).
Isolasi DNA total
Daun sebanyak 500 mg ditambahkan nitrogen cair, kemudian digerus sampai menjadi serbuk. Ditambahan 700 μl buffer ekstrasi CTAB. Sampel yang telah bercampur seluruhnya dipindahkan ke dalam microtube ukuran 1.5 ml. Selanjutnya microtube yang berisi sampel di rendam dalam waterbath pada suhu 65 0C selama 30 menit. Inkubasi sampel pada suhu ruang selama 10 menit. Ditambahkan 700 µl CIA (Cloroform isoamil alkohol) kemudian dihomogenkan. Sampel disentrifugasi dalam kecepatan 10.000-15.000 rpm pada suhu 4 0C selama 10-15 menit. Larutan DNA yang berwarna bening di bagian atas akan memisah dari larutan cloroform yang tercampur dengan bagian sel lainnya yang berwarna hijau. Larutan DNA dipindahkan kurang lebih 500- 650 μl ke dalam microtube baru. Ditambahkan 2/3 kali volume isopropanol dingin, aduk dengan membolak balik secara perlahan. Selanjutnya diinkubasi pada suhu ruang selama 10 menit. Sampel disentrifugasi dalam kecepatan 10.000-15.000 rpm pada suhu 4 0C selama 10-15 menit. Supernatan dibuang dan DNA akan mengendap diujung tube.
22
Endapan DNA dicuci dengan 100 µl etanol 70% dengan menggerak-gerakan tube secara perlahan-lahan, lakukan 2-3 kali. Endapan DNA kemudian ditiriskan di atas tisue kemudian dikeringkan dalam esikator selama 15-20 menit. Endapan DNA dilarutkan dalam 50-100 μl aquades dan simpan pada suhu minus 20 0C.
Pengukuran kualitas dan kuantitas DNA
Uji kualitas DNA total dilakukan dengan menggunakan larutan agarose 0.8% dan dielektroforesis. Elektroforesis menggunakan larutan buffer TAE 1x yang dialiri arus listrik, dimana muatan negatif akan bergerak menuju muatan positif selama 50 menit pada 50 voltase. Visualisasi hasil elektroforesis dilakukan di atas UV transluminator dan didokumentasikan. Nilai konsentrasi atau kuantitas DNA diketahui dengan menggunakan spektrofotometer. Sampel diukur pada absorbansi 260 nm dan 280 nm.
Optimasi program reaksi PCR dan amplifikasi DNA dengan PCR
Sebelum dilakukan amplifikasi DNA, terlebih dulu dilakuan optimasi program reaksi PCR. Optimasi dilakukan untuk memperoleh kondisi optimum PCR yang dapat digunakan untuk amplifikasi DNA pada primer mikrosatelit yang telah ditentukan. Optimasi reaksi PCR adalah satu siklus denaturasi awal pada suhu 94 0C selama 3 menit, dan diikuti dengan 35 siklus denaturasi awal pada suhu 94 0C selama 54 detik, annealing suhu 43 0C selama 45 detik dan ekstensi suhu 72 0C selama 2 menit. Siklus PCR diakhiri dengan satu siklus ekstensi akhir suhu 72 0C selama 5 menit (Martasari et al. 2012). Primer yang digunakan yaitu primer ISSR 1 – ISSR 8 (Tabel 2). Reaksi amplifikasi PCR dilakukan menggunakan total volume larutan 25 µl yang terdiri atas DNA 1 µl, primer 2 μl (40 μM), PCR mix 5.7 μl kemudian ditambahkan air bebas ion 16.3 μl.
Tabel 2 Nama dan susunan basa primer yang digunakan analisis ISSR
No Nama Primer Susunan Basa
1 ISSR 1 5’-CAACACACACACACACA-3’ 2 ISSR 2 5’-ACACACACACACACACCA-3’ 3 ISSR 3 5’-ACACACACACACACACTG-3’ 4 ISSR 4 5’-TAATCCTCCTCCTCCTCC-3’ 5 ISSR 5 5’-TCCTCCTCCTCCTCCGC-3’ 6 ISSR 6 5’-CGTTCCTCCTCCTCCTCC-3’ 7 ISSR 7 5’-GTGTGTGTGTGTGTGTTC-3’ 8 ISSR 8 5’-AGAGAGAGAGAGAGAGTC-3’
Visualisasi hasil PCR
Elektroforesis dilakukan untuk mengetahui hasil amplifikasi DNA dengan menggunakan PCR, dilakukan melalui elektroforesis horizontal dengan 1.8 – 4% agarose yang dilarutkan dalam 100 ml buffer TAE 1X, pada tegangan 57 voltase selama 3 jam. Visualisasi hasil elektroforesis dilakukan di atas UV transluminator dan didokumentasikan.
Data morfologi dan molekuler yang dihasilkan dirubah menjadi data biner dengan menggunakan skor. Karakter morfologi dan pita polimorfik yang dimiliki oleh individu tunas regeneran diberikan skor “1“ sedangkan karakter yang tidak dimiliki individu tunas regeneran diberikan skor “0”. Selanjutnya data biner yang dihasilkan dianalisis menggunakan UPGMA (Unweighted Pair Group Method
with Arithmetic Means) dengan fungsi SIMQUAL menjadi dendogram melalui
program NTSYS (Numerical Taxonomy and Multivariate Analysis System) versi 2.02 (Rohlf 1998). Tingkat keselarasan koefisien kemiripan antara penanda dibandingkan dengan menggunakan MCCOMP program NTSYS versi 2.0. Tingkat keselarasan pengelompokan ditentukan oleh nilai goodness of fit yaitu
kesesuaian antara nilai koefisien kemiripan dengan kriteria, sangat sesuai (r > 0.9), sesuai (0.8 < r < 0.9), tidak sesuai (0.7 < r < 0.8) dan sangat tidak
sesuai (r < 0.7).
Tahap 4. Penyambungan secara in vitro dan ex vitro
Penyambungan ini bertujuan untuk mendapatkan teknik yang optimal khususnya untuk tanaman hasil induksi mutasi. Untuk batang atas digunakan tunas mutan putatif sedangkan untuk batang bawah digunakan jeruk Japansche
Citroen (JC). Sebelum dilakukan penyambungan dilakukan persiapan baik batang
atas maupun batang bawah sebagai berikut:
Persiapan batang bawah:
Batang bawah yang disiapkan untuk penyambungan secara in vitro adalah kecambah steril jeruk Japansche Citroen (JC) yang berumur sekitar 2 bulan. Batang bawah dipotong kurang lebih 3 cm dari media tanam, dan dilakukan
24
pemotongan secara vertikal sedalam 0.5 cm, selanjutnya batang bawah siap untuk disambung dengan batang atas.
Batang bawah yang disiapkan untuk penyambungan secara ex vitro adalah kecambah jeruk Japansche Citroen (JC) umur sekitar 3 bulan dan bibit umur 9 bulan. Batang bawah umur 3 bulan dipotong sekitar 5 cm dari media tanam sedangkan pada bibit umur 9 bulan dipotong sekitar 15 cm dari media tanam, selanjutnya dilakukan pemotongan secara vertikal sedalam 0.5 -1 cm. Batang bawah siap untuk disambung dengan batang atas.
Persiapan batang atas:
Tunas mutan putatif hasil in vitro dalam kondisi vigor dikeluarkan dari botol kultur, kemudian dibersihkan bagian akarnya dari sisa-sisa agar media. Batang atas dipotong sekitar 3 – 4 cm dan dibuang seluruh bagian daunnya. Selanjutnya disayat tipis miring pada kedua sisinya sekitar 0.5-1 cm dengan menggunakan pisau scapel steril dan siap untuk disambungkan dengan batang bawah.
Penyambungan:
Penyambungan in vitro dilakukan secara steril dalam laminar air flow, batang atas diselipkan pada potongan vertikal batang bawah. Setelah batang atas dan batang bawah tersambung, secara hati-hati calon tanaman sambung ditanam dalam media tanam (Gambar 4). Tanaman sambung in vitro diinkubasi dalam ruang kultur.
Penyambungan Ex vitro dilakukan di luar laminar air flow, penyambungan dilakukan dengan menempelkan bagian potongan batang atas dan batang bawah secara tepat dan benar. Selanjutnya pada bagian sambungan ditutup dengan parafilm agar rapat untuk menghindari masuknya air atau kontaminan (Gambar 4). Seluruh bagian tanaman sambungan ditutup dengan plastik sampai menutupi sebagian ukuran polibag dan diadaptasikan di bawah rumah paranet. Perawatan dilakukan setiap hari untuk memastikan kondisi tanaman tidak rusak karena angin atau hujan. Pengamatan dilakukan setiap minggu dan setiap bulan terhadap persentase pertumbuhan tunas sambungan dan jumlah daun yang dihasilkan.
HASIL DAN PEMBAHASAN
Proliferasi Kalus Embriogenik
Kalus jeruk keprok Garut berasal dari kultur nuselus yang diinduksi dalam media dasar MS dengan kombinasi vitamin MW, 1 mgL-1 2.4 D, 3 mgL-1 BAP, 300 mgL-1 Casein Hydrolisat dan dihasilkan kalus embriogenik dengan warna putih kekuningan yang berstruktur remah. Kalus jeruk keprok Garut yang digunakan dalam penelitian ini adalah kalus embriogenik yang telah berumur 4 tahun.
Kalus diperbanyak dalam media proliferasi yaitu media dasar MS yang dikombinasikan dengan vitamin MW, 300 mgL-1 Casein Hydrolisat dan diinkubasi selama 4 minggu. Kalus hasil proliferasi menunjukan kualitas yang sama dengan kalus pada penelitian sebelumnya. Peningkatan berat kalus pada minggu ke-4 setelah tanam, setiap clumps yang ditanam dengan berat awal sekitar 0.105 gram dan diameter 0.55 cm menghasilkan rata-rata peningkatan berat kalus 5 kali (0.565 gram) dari berat awal dan 3 kali (1.60 cm) dari diameter awal (Tabel 3). Warna kalus yang dihasilkan berwarna putih kekuningan dan berstruktur remah seperti pada Gambar 4.
Tabel 3 Pertumbuhan kalus embriogenik jeruk keprok Garut dalam media proliferasi
0 MST 2 MST 4 MST
Warna kalus Putih
kekuningan
Putih kekuningan
Putih kekuningan
Struktur kalus Remah Remah Remah
Berat kalus (gram) 0.105 0.318 0.565
Diameter kalus (cm) 0.55 1.117 1.600
Gambar 4 Kalus embriogenik jeruk keprok Garut dalam media proliferasi, A. Kalus awal sebelum proliferasi, B. Kalus hasil proliferasi
B A
Pengaruh Iradiasi Sinar Gamma terhadap Pertumbuhan Kalus
Kalus hasil proliferasi yang berwarna putih kekuningan dan berstruktur remah diberikan perlakuan iradiasi pada dosis 0, 20, 30, 40, 50, 60, 70, 80, 90 dan 100 Gy. Kalus ditanam dalam media MS (Lampiran 1) tanpa zat pengatur tumbuh dan diinkubasi dalam ruang kultur. Penanaman kalus dalam media tanpa zat pengatur tumbuh bertujuan untuk mengetahui tingkat sensitivitas kalus yang telah diberikan perlakuan iradiasi.
Kalus yang diamati pada minggu ke-1 dan ke-2 masih dalam tahap adaptasi dan belum menunjukan adanya perubahan. Kalus mulai berkembang pada minggu ke-3 dan ke-4, kalus mulai berproliferasi dan terjadi perubahan warna pada dosis iradiasi tinggi. Perubahan warna kalus terlihat lebih jelas pada minggu ke-5 setelah iradiasi. Kalus yang semula berwarna putih kekuningan berubah menjadi putih kecoklatan dan selanjutnya menjadi berwarna coklat (Gambar 5).
Gambar 5 Perubahan warna kalus, A. Putih keuningan (0, 20, 30 Gy),
B. Putih kecoklatan (40, 50, 60,70 Gy), C. Coklat (80, 90, 100 Gy)
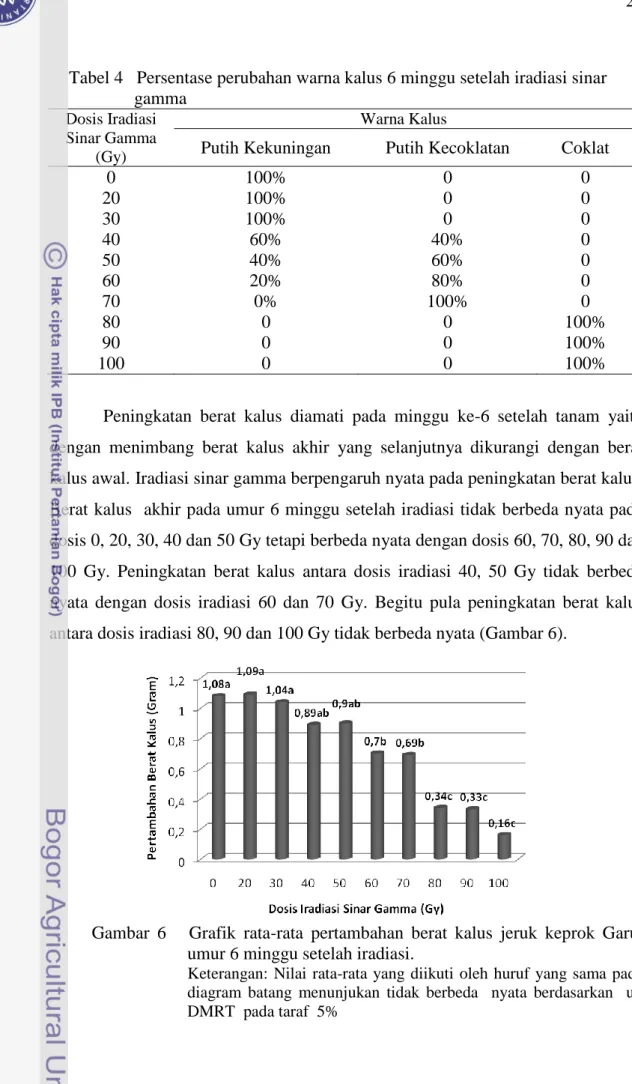
Warna kalus yang diamati pada umur 6 minggu setelah iradiasi menghasilkan perubahan warna kalus pada dosis 40, 50, 60, 70, 80, 90 dan 100 Gy. Dosis 0 (tanpa iradiasi), 20 dan 30 Gy menghasilkan warna kalus tetap putih kekuningan, sedangkan pada dosis 40, 50, dan 60 Gy sebagian kalus berubah menjadi putih kecoklatan. Peningkatan dosis iradiasi 70 Gy merubah semua warna kalus menjadi putih kecoklatan, sedangkan dosis 80, 90 dan 100 Gy semua warna kalus menjadi coklat (Tabel 4).
27
Tabel 4 Persentase perubahan warna kalus 6 minggu setelah iradiasi sinar gamma
Dosis Iradiasi Sinar Gamma
(Gy)
Warna Kalus
Putih Kekuningan Putih Kecoklatan Coklat
0 100% 0 0 20 100% 0 0 30 100% 0 0 40 60% 40% 0 50 40% 60% 0 60 20% 80% 0 70 0% 100% 0 80 0 0 100% 90 0 0 100% 100 0 0 100%
Peningkatan berat kalus diamati pada minggu ke-6 setelah tanam yaitu dengan menimbang berat kalus akhir yang selanjutnya dikurangi dengan berat kalus awal. Iradiasi sinar gamma berpengaruh nyata pada peningkatan berat kalus. Berat kalus akhir pada umur 6 minggu setelah iradiasi tidak berbeda nyata pada dosis 0, 20, 30, 40 dan 50 Gy tetapi berbeda nyata dengan dosis 60, 70, 80, 90 dan 100 Gy. Peningkatan berat kalus antara dosis iradiasi 40, 50 Gy tidak berbeda nyata dengan dosis iradiasi 60 dan 70 Gy. Begitu pula peningkatan berat kalus antara dosis iradiasi 80, 90 dan 100 Gy tidak berbeda nyata (Gambar 6).
Gambar 6 Grafik rata-rata pertambahan berat kalus jeruk keprok Garut umur 6 minggu setelah iradiasi.
Keterangan: Nilai rata-rata yang diikuti oleh huruf yang sama pada diagram batang menunjukan tidak berbeda nyata berdasarkan uji DMRT pada taraf 5%
Peningkatan dosis iradiasi sinar gamma menghambat pembentukan sel-sel kalus baru sehingga menurunkan berat akhir kalus. Kemampuan sel dalam menerima ionisasi sinar gamma berbeda-beda. Kalus jeruk keprok Garut yang terpapar iradiasi sinar gamma pada dosis 20 dan 30 Gy masih dapat bertahan dan mampu berproliferasi sehingga berat kalus yang dihasilkan tidak berbeda nyata dengan berat kalus tanpa iradiasi.
Tingkat sensitivitas suatu jaringan terhadap iradiasi dapat diketahui melalui radiosensitivitas. Pengaruh radiosensitivitas pada setiap tanaman berbeda-beda. Hal ini dapat diketahui melalui pendekatan Lethal dose 50 (LD50) atau melalui
pendekatan Growth Reduction (GR50) (Amano 2004).
Analisis terhadap data pertumbuhan kalus dengan menggunakan software
curve Expert 1.4 menghasilkan beberapa model regresi. Pemilihan model regresi
terbaik didasarkan pada kecilnya ragam (S) dan besarnya koefisien determinasi (r). Model regresi terbaik yaitu model Quadratic Fit dengan S = 6.46, r = 0.98 dan persamaan Y = a + bx + cx2 , dengan a = 10.259.049 ,b = - 0.040944327 , c = - 0.0087290345. Hasil analisis diperoleh GR50 pada kalus embriogenik
keprok Garut dengan perlakuan iradiasi sinar gamma berada di sekitar dosis 75.31 Gy (Gambar 7). Dosis di sekitar 75.31 Gy dapat menjadi acuan dosis untuk digunakan pada kalus embriogenik jeruk keprok.
Gambar 7 Kurva pengaruh iradiasi terhadap persentase proliferasi kalus
S = 6.46221280 r = 0.98372358
Dosis Iradiasi Sinar Gamma (Gray)
P ro lif er a si K al u s (% ) 0.0 18.3 36.7 55.0 73.3 91.7 110.0 5.68 23.12 40.56 58.00 75.44 92.88 110.32 (Gy) Y = a + bx + cx2 50% 75.31Gy