Rencana Pelaksanaan Pembelajaran ModelGroup Investigation(GI)
A. Identitas Mata Pelajaran 1. Nama Sekolah : SMA 2. Mata Pelajaran : KIMIA 3. Kelas/Semester : X / 1 4. Pertemuan ke : 1 (satu) 5. Alokasi waktu : 2 x 45 menit
B. Standar Kompetensi
Memahami struktur atom, sifat-sifat periodik unsur dan ikatan kimia.
C. Kompetensi Dasar
1.1.Memahami struktur atom berdasarkan teori atom Bohr, sifat-sifat unsur, massa atom relatif, dan sifat-sifat periodik unsur dalam tabel periodik serta menyadari keteraturannya, melalui pemahaman konfigurasi elektron.
D. Indikator
Menentukan partikel dasar (proton, elektron dan netron) Menentukan konfigurasi elektron dan elektron valensi
E. Tujuan Pembelajaran
Setelah mempelajari materi ini melalui model pembelajaranGroup Investigation(GI) diharapkan siswa dapat:
Siswa dapat menentukan partikel dasar atom (proton, elektron dan neutron), konfiguasi elektron dan elektron valensi.
Siswa dapat menghubungkan konfigurasi elektron dengan unsur dalam tabel periodik
F. Materi Ajar Struktur Atom
TEORI
Struktur atomadalah susunan partikel dasar dalam atom.Atom sebagai partikel penyusun materi dapat menentukan sifat materi. Berukuran sangat kecil dan kita tidak sanggup untuk melihatnya. Sedangkan para ahli memperkirakan bentuk
A
Z
X
A.Partikel-Partikel Dasar Atom inti
Partikel dasar penyusun atom adalah proton, netron dan elektron. n + p e Inti atom terdiri dari proton dan netron dikelilingi elektron yang terletak pada kulit atom Atom bersifat netral berarti jumlah proton (muatan positif) sama dengan jumlah elektron (muatan negatif)
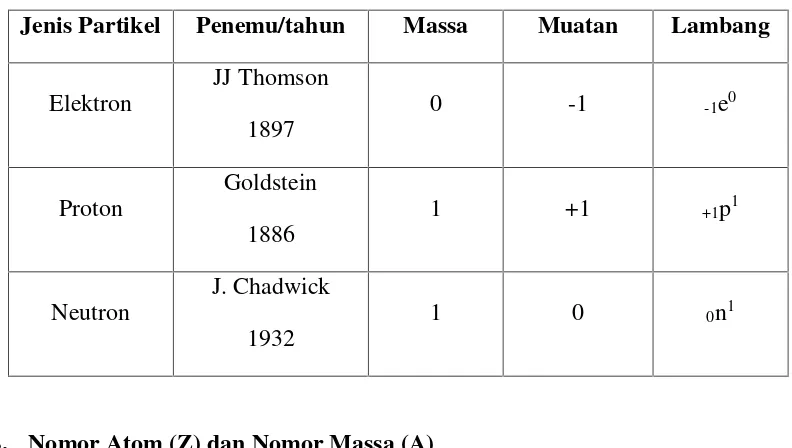
Tabel Partikel Atom
Jenis Partikel Penemu/tahun Massa Muatan Lambang
Elektron
JJ Thomson
1897
0 -1 -1e0
Proton
Goldstein
1886
1 +1 +1p1
Neutron
J. Chadwick
1932
1 0 0n1
B. Nomor Atom (Z) dan Nomor Massa (A)
A = Nomor Massa menyatakan jumlah p dan n
X = lambang unsur
Z = Nomor Atom menyatakan jumlah p atau e
C. Isotop, Isobar dan Isoton
Isotopialah atom dari unsur yang sama tetapi berbeda massanya. Contoh:
6C12: 6 proton, 6 elektron, 6 neutron
6C13: 6 proton, 6 elektron, 7 neutron
Perbedaan massa pada isotop disebabkan perbedaan jumlah neutron.
Contoh: 146 C dengan 147N; 2411Na dengan 2412Mg
Isoton ialah atom dari unsur yang berbeda (mempunyai nomor atom berbeda), tetapi mempunyai jumlah neutron sama.
Contoh : 136 C dengan 147N; 3115P dengan 3216S D. Susunan Elektron Dalam Atom
Elektron yang selalu bergerak mengelilingi inti atom ternyata berada pada tingkat-tingkat energi tertentu yang disebut sebagai kulit-kulit atom.
E. Konfigurasi Elektron
Konfigurasi elektron ialah penyusunan atau pengaturan elektron berdasarkan tingkat energinya dalam suatu atom. Tingkat energi paling dekat dengan inti atau tingkat energi pertama (n=1) diberi lambang K atau disebut kulit K. Tingkat energi kedua diberi lambang L, ketiga M dan seterusnya.
Jumlah elektron maksimum yang dapat menempati setiap tingkat energi sesuai dengan 2n2(akan diterangkan lebih rinci di kelas 3), sehingga jumlah elektron dalam tiap-tiap tingkat energi utama dapat anda lihat pada tabel di bawah ini.
TABEL: KULIT DAN JUMLAH ELEKTRON MAKSIMUM
Tingkat Energi elektron
Lambang Kulit Jumlah elektron Maksimum
1 K 2 elektron
2 L 8 elektron
3 M 18 elektron
4 N 32 elektron
5 O 50 elektron
6 P 72 elektron
7 Q 98 elektron
dst Dst Dst
Atom Jumlah elektron
Kulit K
(n = 1)
Kulit L
(n = 2)
Kulit M
(n = 3)
Kulit N
(n = 4)
1H 1 1
7Li 3 2 1
6C 6 2 4
12Mg 12 2 8 2
33As 33 2 8 18 5
Jumlah elektron maksimum perkulit = 2n2
Kulit K (n = 1), elektron maksimum = 2(1)2= 2
Kulit L (n = 2), elektron maksimum = 2(2)2= 8
Kulit M ( = 3), elektron maksimum = 2(3)2= 18 dst.
F. ELEKTRON VALENSI
Elektron valensi adalah jumlah elektron yang terdapat pada kulit terluar atom suatu unsur. Elektron valensi digunakan untuk membentuk ikatan kimia. jadi elektron valensi
merupakan penentu sifat kimia atom unsur.
Contoh:
3Li, elektron valensi = 1;6C, elektron valensi = 4
12Mg, elektron valensi = 2
G. Perkembangan Teori Atom
No. Gambar Teori Atom Penjelasan
1. Teori atom - atom bagian terkecil suatu materi yang tidak dapat dibagi lagi
- atom-atom suatu unsur sama dalam segala hal, tetapi berbeda dengan atom-atom unsur lain
- atom tidak dapat diciptakan dan dimusnahkan
- senyawa adalah hasil reaksi atom-atom penyusunnya
2.
Elektron
Materi
Bermuatan
positif
JJ. Thomson - dalam atom terdapat elektron tersebar merata dalam bola muatan +
- disebut model atom roh kis mis rotinyabola muatan + kismisnya elektron tersebar merata
No. Gambar Teori Atom Penjelasan
3. Rutherford Atom terdiri atas inti yang menjadi pusat massa atom dan muatan positifnya, sedang elektron berputas di sekelilingnya.
Rutherford tidak dapat menjelaskan mengapa elektron tidak tertarik pada inti. Dalam inti atom terdapat proton dan neutron. Dasar pemikiran tentang spektrum unsur.
4. Niels Bohr 1. Elektron dalam atom bergerak
melalui lintasan yang merupakan tingkat energi tertentu, dengan demikian elektron juga mempunyai energi tertentu
2. Selama bergerak dalam lintasannya elektron tidak memancarkan energi disebut keadaan stationer atau dasar. 3. Elektron dalam atom dapat menyerap
5.
Dasar pemikiran: materi mempunyai sifat gelombang. Elektron-elektron yang bergerak dalam atom juga mempunyai sifat gelombang. Sehingga kedudukan elektron tidak jelas. Kita hanya dapat berbicara tentang kebolehjadian untuk menemukan suatu elektron pada berbagai jarak dari inti dan pada berbagai arah dalam ruang. Daerah-daerah dalam atom dengan kebolehjadian menemukan elektron paling besar disebutorbitalbukanorbit.
G. Metode, Model dan Media Pembelajaran 1. Metode: Ceramah, Diskusi, Tanya Jawab.
2. Model: Model PembelajaranGroup Investigation(GI) 3. Media: Lembar Kerja Siswa (LKS), Power Point.
H. Langkah-Langkah Pembelajaran
No Tahapan
Memberikan salam pembuka Menyampaikan standar
kompetensi, kompetensi dasar dan indikator dan tujuan pembelajaran.
Memberikan pemahaman awal/apersepsi untuk memotivasi siswa.
Menjawab salam
Menyimak dan menulis apa yang disampaikan guru.
Menyimak dan menjawab pertanyaan yang diberikan.
15
2 Kegiatan Inti
Guru memberikan kesempatan bagi siswa untuk memberikan kontribusi apa yang akan mereka selidiki.
Kelompok dibentuk
berdasarkan heterogenitas.` Membagi LKS kepada
masing-masing kelompok
Memberikan masukkan terhadap topik yang akan diteliti dan diinvestigasi sesuai materi yang akan dipelajari.
Membentuk kelompok.
Menerima LKS dari guru
60 Fase 2: Merencanakan tugas
Mempersiapkan dan menata sumber belajar sebagai sarana siswa agar dapat berinvestigasi secara optimal.
Kelompok akan membagi sub topik kepada seluruh anggota. Kemudian
membuat perencanaan dari masalah yang akan diteliti.
Fase 3: Membuat penyelidikan Memfasilitasi, membimbing, serta mengawasi siswa yang sedang berinvestigasi agar setiap kelompok dapat bekerja optimal.
Siswa mengumpulkan, menganalisis, mengevaluasi informasi dan membuat kesimpulan.
Fase 4: Menyiapkan laporan akhir Membimbing dan mengawasi siswa dalam menyiapkan laporan akhir
Anggota kelompok merencanakan apa yang akan mereka laporkan, dan bagaimana mereka akan membuat presentasi.
Fase 5: Mempresentasikan tugas akhir Memberikan penghargaan pada
kelompok yang penampilannya baik dan memberikan motivasi pada kelompok yang kurang baik.
Siswa memprentasikan hasil kerjanya.
Memberikan penegasan terhadap masing-masing bahasan dari setiap kelompok
Kelompok lain
memberikan tanggapan
3 Kegiatan Penutup
Fase 6: Evaluasi pembelajaran Membantu siswa melakukan
refleksi terhadap pembelajaran yang telah dipelajari
Bersama siswa menyimpulkan pembelajaran
Mengevaluasi pembelajaran yang telah dilakukan dengan menggunaka tes hasil belajar
Menjawab teori yang
diberikan guru 15
I. Sumber Bahan Ajar
Permana Ivan, 2009,Memahami Kimia SMA/MA Untuk Kelas X Semester1 Dan 2, DEPDIKNAS: Jakarta
Ronald H. Sitorus, Cucun Cunayah, Nunung Nurhayati, 2006,Ringkasan Kimia Untuk SMA/MA,Yrama Widya: Bandung.
Suminar Achmadi, 1985,KIMIA DASAR Prinsip dan Terapan Modern,Erlangga : Jakarta.
David E. Goldberg, 2008,Kimia Untuk Pemula, Erlangga : Jakarta.
J. Evaluasi
- Bentuk Evaluasi :
- Penilaian Proses : Melalui pengamatan pada saat mengerjakan soal latihan
- Tes Lisan : Tanya jawab sesuai dengan indikator yang akan dicapai