PERPINDAHAN KALOR
Bila dua benda atau lebih terjadi kontak termal maka akan terjadi aliran kalor dari benda yang bertemperatur lebih tinggi ke benda yang bertemperatur lebih rendah, hingga tercapainya kesetimbangan termal.
Proses perpindahan panas ini berlangsung dalam 3 mekanisme, yaitu : konduksi, konveksi dan radiasi.
Konduksi
Jika pada suatu benda terdapat gradien temperatur, maka pada benda tersebut akan terjadi perpindahan energi dari bagian temperatur tinggi ke bagian
temperatur rendah. Besarnya fluks kalor yang berpindah berbanding lurus dengan gradien temperatur pada benda tersebut. Secara matematis dinyatakan sebagai :
dengan memasukan konstanta kesetaraan yang disebut sebagai konduktivitas termal, didapatkan persamaan berikut yang disebut juga dengan hukum
Fourier tentang konduksi kalor.
tanda minus (-) timbul untuk menunjukan arah perpindahan kalor terjadi dari bagian temperatur tinggi ke bagian dengan temperatur rendah.
Konduksi pada dinding datar :
Jika persamaan diintegrasi : akan didapatkan :
Dimana :
q = Laju perpindahan panas (w)
A = Luas penampang dimana panas mengalir (m2)
dT/dx = Gradien suhu pada penampang, atau laju perubahan suhu T terhadap jarak dalam arah aliran panas x
Apabila pada suatu sistem terdapat lebih dari satu macam bahan, misalnya dinding berlapis-lapis (seperti ditunjukkan pada gambar), maka aliran kalor dapat digambarkan sebagai berikut :
Jika digambarkan dalam analogi listrik didapatkan :
Persamaan Fourier dapat pula dituliskan sebagai berikut :
persamaan tesebut mirip dengan hukum Ohm dalam jaringan listrik, sehingga untuk perpindahan kalor dapat pula didekati dengan analogi listrik, dimana aliran kalor akan sama dengan :
Harga tahanan termal total Rth bergantung pada susunan dinding penyusunnya, apakah bersusun seri atau paralel atau gabungan.
k adalah kondutivitas termal.
Konduktivitas termal untuk beberapa bahan :
Bahan k (W/m.Co) Bahan k (W/m.Co) Aluminium 238 Asbestos 0,08 Tembaga 397 Concrete 0,8 Emas 314 Gelas 0,8 Besi 79,5 Karet 0,2 Timbal 34,7 air 0,6 Perak 427 kayu 0,08 udara 0,0234
Konveksi
Adalah transport energi dengan kerja gabungan dari konduksi panas, penyimpanan, energi dan gerakan mencampur. Perpindahan kalor karena berpindahnya partikel-partikel atau materi zat itu sendiri.
q = h A (∆T)
Dimana :
q = Laju perpindahan panas konveksi
h = Koefisien perpindahan panas konveksi (w/m2 0C)
A = Luas penampang (m2)
∆T = Perubahan atau perbedaan suhu (0C; 0F)
Misalnya materi zat tersebut cair atau gas yang berpindah adalah zat cair atau gas itu sendiri. Tidak seperti perpindahan kalor pada konduksi, dimana materi zat itu tidak berpindah.
Radiasi
Radiasi adalah perpindahan energi kalor dalam bentuk gelombang
elektromagnetik, sama seperti gelombang radio atau gelombang cahaya. Pada radiasi energi berpindah dengan cara merambat tanpa memerlukan medium seperti halnya pada konduksi dan konveksi.
Radiasi dapat terjadi di ruang hampa. Sehingga memungkinkan energi
matahari sampai ke bumi melalui ruang hampa sejauh lebih dari seratus juta kilometer.
q = δ A (T14 – T 24) Dimana : δ = Konstanta Stefan-Boltzman 5,669 x10-8 w/m2 k4 A = Luas penampang T = Temperatur
PENDAHULUAN
THERMODINAMIKA
KONSEP-KONSEP DASAR
Thermodinamika adalah pengetahuan eksperimental
:
berdasarkan pada sedikit prinsip/hukum yang kemudian di
generalisasikan yang didapatkan dari eksperimen.
Thermodinamika dapat didefinisikan sebagai ilmu tentang
energi
: ilmu yang membahas hubungan pertukaran antara
panas dengan kerja. Energi dapat dipandang sebagai
Ilmu ini menyatakan peristiwa untuk merubah panas ke bentuk
tenaga (proses transformasi energi).
Dimana hukum dasar alam tetap berlaku, yaitu prinsip-prinsip
kekekalan energi, selama berinteraksi energi dapat berubah dari
satu bentuk ke bentuk lain tetapi jumlah total dari energi tetap
(konstan).
Energi masuk 5 unit Energi tersimpan 1 unit Energi keluar 4 unitPemakaina prinsip-prinsip thermodinamika pada kehidupan
sehari-hari :
-Power plants
: perencanaan motor-motor bakar (turbin),
pusat- pusat tenaga nuklir
- Mesin otomotif
: roket, pesawat terbang, dll
- Rumah tangga
: AC, kulkas, pemanas air, dll
- Tubuh manusia
SISTEM THERMODINAMIKA
Pada thermodinamika,
benda kerja
yang dimaksud sering
disebut dengan
sistem
. Hal ini dimaksudkan untuk memisahkan
benda kerja dengan sekelilingnya (sekitarnya/surrounding)
Sistem
Lingkungan
= Alam Raya
Pengertian sistem
adalah bagian dari alam raya (univers). Sistem
dibatasi oleh permukaan tertutup (batas sistem) yang dapat
berupa bahan padat, cair, gas atau bahkan energi radiasi dan
lain-lain .
Batas sistem ini dapat tetap atau bergerak dan dapat dikelompokkan
menjadi dua :
1. Batas sistem sebenarnya (nyata) : Udara dikompresikan dan
permukaan sistem tertutup adalah permukaan yang dibatasi
silinder. Permukaan tertutup pada kondisi ini adalah keadaan
sebenarnya.
2. Batas sistem imaginary (khayal) : Sebongkah es terapung di atas
air, dalam hal ini permukaan tertutup berupa keadaan khayal, es
dianggap dikelilingi oleh suatu permukaan tertutup dan es adalah
sistem yang dimaksudkan.
Keadaan sistem (dalam hal ini sistem thermodinamika) yang
dikarakterisasi oleh besaran-besaran thermodinamik yang dapat
diukur seperti : temperatur, tekanan, volume dan sebagainya.
Sistem ada dua, yaitu :
1. Sistem tertutup (control mass) : Jika bahan tidak dapat
keluar/masuk menyeberangi batas, tetapi energi dalam
bentuk panas atau kerja dapat menyeberangi batas.
Batas tetap :
massa (tidak) energi (ya)
Sistem terisolasi yaitu dimana energi tidak menyeberangi batas
sistem
Batas bergerak :
Saat dipanaskan maka gas
mengembang sehingga piston
bergerak
2. Sistem terbuka (control volume) :
Jika bahan dapat menyeberang (keluar/masuk) batas, misal :
kompresor, turbin.
Jika bahan dan energi dapat menyeberangi batas, misal :
pemanas air
KESETIMBANGAN TERMAL
Keadaan setimbang, keadaan sistem yang memiliki harga x dan y
tertentu yang tetap selama kondisi eksternal tidak berubah.
Keadaan setimbang dalam suatu sistem bergantung pada sistem
yang lain yang ada di dekatnya dan sifat dinding yang
Sifat dinding :
1. Dinding adiabatis, tidak dapat dilalui panas (tidak ada pertukaran panas antara sistem dan sekitarnya), missal : lap, kayu yang tebal, beton, asbes dll.
2. Dinding diatermis, dapat dilalui panas (terjadi pertukaran panas antara sistem dan sekitarnya), sifat ini yang menyebabkan setimbang termal, misalnya : lempengan logan yang tipis.
Kesetimbangan termal adalah keadaan yang dicapai bila besaran-besaran thermodinamika sistem tidak berubah dengan berubahnya waktu.
Dari hasil percobaan, dua sistem yang ada dalam kesetimbangan termal dengan sistem ke tiga, maka ketiganya dalam kesetimbangan termal. Ini merupakan hukum ke-nol thermodinamika (menurut postulat R. H. Fowler)
C A B C A B = Dinding Adiabat = Dinding Diatermis
Kesetimbangan termodinamik adalah sistem yang berada pada kesetimbangan termal, mekanik dan kimia.
Kesetimbangan mekanik adalah bila di dalam suatu sistem terjadi suatu kesetimbangan gaya-gaya antara sistem dengan sekitarnya.
Kesetimbangan kimia adalah jika suatu sistem dalam kesetimbangan mekanis tidak mengalami perubahan spontan dari struktur di dalamnya betapapun
lambatnya.
Dalam kondisi setimbang termodinamik tidak akan terjadi perubahan keadaan baik untuk sistem dan lingkungannya.
Sistem dikatakan tidak setimbang, bila salah satu kesetimbangan yang merupakan komponen kesetimbangan termodinamik tidak dipenuhi.
Bila sistem dalam kesetimbangan termodinamik dan lingkungan dibuat tidak
berubah, maka tidak ada gerakan yang terjadi dan tidak ada kerja yang dilakukan, antara lain proses, kuasistatik, isovolumic/isochoric, isobaric/isopiestic, isotermal, adiabatik.
Akibat bila sistem tidak setimbang, artinya prasyarat kesetimbangan mekanis tidak terpenuhi, maka akan timbul :
1. Gaya tak berimbang dapat terbentuk dalam sistem, akibatnya timbul turbulensi, gelombang dsb. Selain itu sistem secara keseluruhan dapat melakukan gerak dipercepat.
2. Akibat turbulensi, percepatan dsb, distribusi temperatur tak serba sama
sehingga akan muncul atau dapat timbul perbedaan temperatur antara sistem dan lingkungan. Perubahan gaya dan temperatur yang mendadak dapat
menimbulkan reaksi kimia atau perubahan unsur kimia.
Koordinat sistem (perubahan variabel keadaan sistem/zat) berpengaruh pada keadaan sistem (P-V-T) dan kerapatan .
Dalam bidang teknik :
Gas Udara Uap Uap air
Campuran Uap bensin dan Udara
Dalam bidang kimia :
Gas, uap, campuran, zat padat, permukaan selaput dan sel listrik
Dalam bidang fisika :
Mencakup bidang teknik dan kimia, kapasitor listrik, termokopel dan zat magnetik
PERSAMAAN KEADAAN (Equation State) Hubungan Variabel (Perubah) Keadaan
Hubungan variabel keadaan p, V, T dengan massa m disebut persamaan keadaan suatu zat. Persamaan ini secara matematik ditulis :
F (p,V,T,m) = 0
maka persamaan keadaan zat hanya tergantung pada sifat zat itu sendiri. Bentuk persamaan keadaan menjadi :
F (p,v,T,m) = 0
Untuk zat yang berbeda sifatnya akan terdapat persamaan keadaan yang berbeda.
Persamaan Keadaan Gas Ideal (Gas Sempurna)
Gas ideal (sempurna) adalah gas dimana tenaga ikat melokul-molekulnya dapat diabaikan.
Untuk dasar dari teori kinetis molekul air, persamaan keadaan gas ideal untuk satu satuan massa adalah :
p v = RT dimana :
p : tekanan absolut v : volume jenis gas R : konstanta gas T : suhu absolut gas
Untuk massa m, persamaan keadaan gas ideal dapat ditulis : m p v = m R T
atau
m p V = m R T dimana :
V : volume gas sebenarnya m : massa gas
atau dapat ditulis juga dalam bentuk :
Perubahan Keadaan Gas Ideal
Pada gas ideal terdapat empat macam perubahan keadaan istimewa, yaitu :
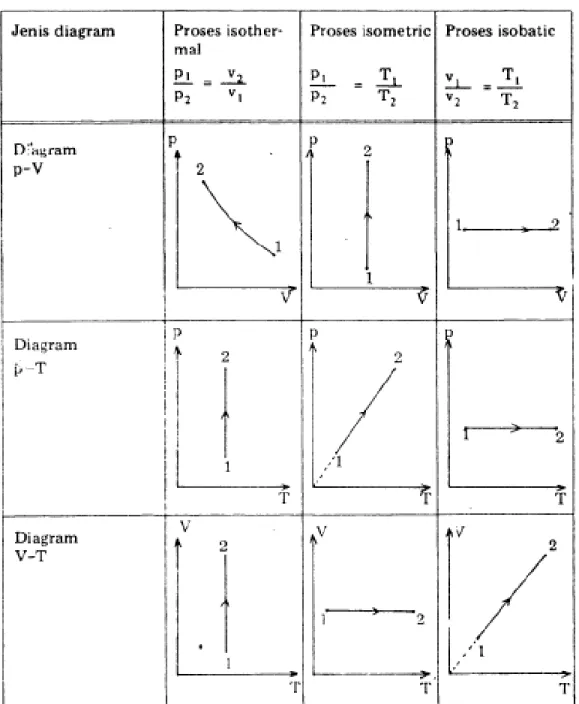
a. Perubahan keadaan dengan proses temperatur konstan (Isothermal atau Isotermis) p V 2 1 T = konstan p1 P2 V2 V1
Gambar. Diagram p-V pada proses Isothermal
Gas dimasukkan ke dalam
silinder torak. Keadaan gas akan dirubah dari keadaan 1 ke
keadaan 2 dengan menekan torak.
Suhu gas dijaga agar konstan dengan cara mendinginkan dan memanaskan silinder.
Persamaan gas ideal dalam hal ini menjadi :
untuk keadaan 1 dan 2 dapat ditulis hubungan sebagai berikut : p1 v1 = p2 v2
atau
Proses isothermal terdapat pada kompressor dan sebagainya.
b. Perubahan keadaan dengan proses volume konstan (Isokhorik)
Keadaan gas dirubah dari keadaan 1 ke keadaan 2 dengan memanaskan silinder, sedang torak ditahan supaya jangan
bergerak sehingga volume gas dalam silinder tetap konstan.
Tekanan gas dalam silinder akan bertambah. p V 2 1 V = konstan p1 P2
Gambar. Diagram p-V pada proses Isometrik
Persamaan gas ideal dalam hal ini untuk volume konstan :
Untuk keadaan 1 ke keadaan 2 dapat ditulis :
Proses isotermik terdapat pada motor bensin dan sebagainya.
c. Perubahan keadaan dengan proses tekanan konstan (Isobarik)
V2 V1 p V 2 1 p = konstan p1 = p2
Gambar. Diagram p-V pada proses isobarik
Keadaan gas dirubah dari keadaan 1 ke 2 dengan memanaskan silinder, sedang torak dibuat bebas bergerak sehingga tekanan gas dalam silinder tetap konstan.
Persamaannya :
Untuk keadaan 1 dan 2 dapat ditulis : atau
Persamaan isobarik terdapat pada ketel uap, motor diesel dan
Gabungan proses isothermal dan isobarik akan menghasilkan Hukum Boyle-Gay Lussac :
d. Perubahan keadaan dengan proses adiabatik
Pada proses adiabatik gas dalam silinder tidak menerima dan mengeluarkan panas, silinder diisolasi.
Kerja yang dilakukan gas dalam silinder hanya sebagai hasil perubahan energi sendiri. Kejadian ini di dapat pada motor bakar yang berputar dengan cepat.
Koefisien Pengembangan (Expansion) dan Komperessibilitas (Compressibility)
Pengaruh temperatur terhadap volume suatu zat pada tekanan konstan disebut koefisien pengembangan suatu zat.
Koefisien pengembangan (koefisien expansion/koefisien muai ruang) suatu zat dapat ditentukan dengan persamaan :
dimana :
V : volume zat sebenarnya v : volume jenis zat
Pengaruh tekanan terhadap volume suatu zat pada temperatur konstan disebut kompresibilitas suatu zat
Kompresibilitas suatu zat dapat ditentukan dengan persamaan :
Tanda negatif karena pertambahan tekanan menyebabkan pengurangan volume zat.
Karena volume jenis suatu zat adalah kebalikan dari kerapatan (density) zat atau :
maka persamaan dapat ditulis dalam hubungan kerapatan zat sebagai berikut :
dan untuk kompresibilitas :
Bila persamaan suatu zat diketahui (diberikan), maka koefisien pengembangan β dan kompresibilitas k akan dapat ditentukan, misalnya : untuk gas ideal
Perbandingan pertambahan tekanan dengan pertambahan temperatur dapat dilakukan dengan hubungan differensial parsil x,y,z yaitu :
maka untuk F (p,v,T) = 0 adalah :
Dari hubungan ini diperoleh perbandingan pertambahan tekanan terhadap pertambahan temperatur, yaitu :
HUKUM THERMODINAMIKA PERTAMA Kerja Luar (External Work)
Dalam thermodinamika, sistem akan melakukan kerja pada perubahan
keadaan.
Pada thermodinamika, bila vektor penyimpangan ds searah dengan vektor
gaya F, maka kerja adalah negatif. Sebaliknya bila vektor penyimpangan ds
berlawanan arah dengan vektor gaya F, maka kerja adalah positif, seperti gambar dibawah ini :
Persamaan untuk kerja oleh gaya F dalam thermodinamika : dW = -F cos θ ds
jika :
a) θ = 0 cos θ = 1
Vektor ds searah dengan vektor F, maka kerja adalah negatif, dapat ditulis sebagai berikut :
dW = -F ds b) θ = 180 cos θ = -1
Vektor ds berlawanan arah dengan vektor F, maka kerja adalah positif, atau : dW = F ds
Dalam hal ini berarti : Bila kerja negatif :
Berarti sistem menerima kerja (kerja luar) dari sekelilingnya. Bila kerja positif :
Berarti sistem melakukan kerja (kerja luar) terhadap sekelilingnya.
Untuk penjelasan tsb, tinjau suatu silinder berisi gas yang dilengkapi dengan suatu piston yang dapat bergerak.
Gambar. Kerja pada gas dalam silinder.
Piston bergerak sejarak ds kekanan. Menyebabkan perubahan volume gas sebesar dV. Arah ds berlawanan dengan arah F, jadi sistem melakukan kerja
terhadap sekelilingnya sebesar : dW = F ds
Bila A adalah luas penampang piston, maka :
F = p A Dimana :
p : tekanan atau gaya persatuan luas penampang piston.
Maka dapat ditulis : dW = p A ds sedangakan : A ds = dV sehingga menjadi : dW = p dV
Dari gambar, dW adalah elemen luas yang diarsir.
Dari gambar telihat bahwa :
Bila arah ds ke kanan (ds berlawanan arah dengan F), berarti gas mengembang atau volume bertambah atau dV positif.
Jadi sistem akan melakukan kerja terhadap sekelilingnya bila dV positif, hal ini terdapat pada proses expansi (pengembangan)
Artinya : pada proses expansi dV adalah positif maka kerja adalah positif. Bila arah ds ke kiri (ds searah dengan F), berarti volume gas berkurang atau dV negatif.
Jadi sistem akan menerima kerja dari sekelilingnya bila dV negatif. Hal ini terdapat pada proses kompresi (pemampatan).
Artinya : pada proses kompresi dV adalah negatif maka kerja adalah negatif. Jadi bila sistem berubah dari keadaan 1 ke keadaan 2, maka kerja total yang dilakukan/diterima sistem adalah :
Bila p konstan, kerja yang dilakukan/diterima sistem adalah : W = p (V2 – V1)
Kerja W pada perubahan keadaan istimewa
a. Perubahan keadan dengan temperatur konstan (Isothermal)
Gambar. Kerja W adalah luasan dibawah garis isothermal pada diagran p-V
Sistem berubah dari keadaan 1 ke
keadaan 2 dengan temperatur konstan. T = konstan
T1 = T2
Keja yang dilakukan sistem : Bila sistem adalah gas ideal, dimana :
b. Perubahan keadaan dengan tekanan konstan (Isobarik)
Gambar. Kerja W adalah luasan di bawah garis isobarik pada diagram p-V
Sistem berubah dari keadaab 1 ke keadaan 2 dengan tekanan konstan (Isobarik).
P = konstan p1 = p2
Kerja yang dilakukan sistem :
Bila sistem adalah gas ideal, dimana :
p V2 = n R T2 p V1 = n R T1
maka kerja yang dilakukan gas ideal :
c. Perubahan keadaan dengan volume konstan (Isometrik)
Gambar. Tidak ada luasan dibawah garis isometrik pada diagram p-V,
maka kerja = 0
Sistem berubah dari keadaan 1 ke keadaan 2 dengan volume konstan.
V = konstan, sehingga dV = 0
Kerja yang dilakukan sistem :
Jadi pada proses isometrik sistem tidak melakukan/menerima kerja terhadap sekelilingnya.
Dalam penulisan kerja dW ditulis dalam bentuk differensial dT dan dp, yaitu sebagai berikut :
Misalkan untuk V = V (p,T) maka,
sehingga kerja : dW = p dV
Untuk gas ideal dengan proses tekanan konstan (isobarik), maka dp = 0 P V = n R T
Sehingga : jadi
Bila diberikan sejumlah panas kecil dQ pada suatu sistem, maka sistem tersebut akan berexpansi dan melakukan kerja luar yang kecil sebesar dW. Energi yang diperlukan untuk hal ini disebut pertambahan energi dalam
(internal energy). Jadi panas dQ sebagian dirubah untuk pertambahan energi dalam. Selain itu sistem juga mengalami pertambahan energi kinetik dan
pertambahan energi potensial luar akibat gaya-gaya konservatif luar seperti gaya grafitasi dan lain-lain.
Bila : dU = Pertambahan energi dalam dEK = Pertambahan energi kinetik dEP = Pertambahan emergi potensial luar
Maka persamaan energi sistem adalah :
dQ = dW + dU + dEK + dEP
Tetapi dalam termodinamika, sistem-sistem sebagian besar mengalami energi kinetik dan energi potensial yang konstan (pada sistem-sistem yang diisolasi) atau dEK = 0 dan dEP = 0, maka hukum thermodinamika pertama menjadi :
Dalil Carnot
Carnot mengemukakan siklus ideal yang disebut siklus Carnot. Siklus ini terdi atas dua buah isoterm dan dua buah adiabat.
Gambar. dibawah melukiskan Siklus Carnot untuk sistem gas ideal.
W Q1 T1 T2 V P Q2 T2 T1
Di bawah ini tabel harga-harga R untuk beberap gas yang umum dipakai. G a s Berat Molekul (M) R (kg M/kg m K) Udara (tanpa CO2) 28,964 29,77
Dioksid arang (CO2) 44,011 19,25 ZaL air (H2) 2,0156 420,7 Zat lemas (N2) 28,016 30,26 Zat asam (O2) 32 26,49 Helium (He) 4,002 212 Amoniak (NH3) 17,031 49,76 Methana (CH4 ) 16,043 52,89 Athylene (C2H4) 28,054 30,25 Argon ( A ) 39,944 21,23