RENCANA PELAKSANAAN PEMBELAJARAN TEORI ATOM MEKANIKA KUANTUM Nama Sekolah : MAN 3 YOGYAKARTA
Mata Pelajaran : Kimia Kelas / Semester : XI IPA / 1
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa. Kompetensi dasar : 1.1. Menjelaskan teori atom Bohr dan mekanika kuantum
untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik.
Indikator Pencapaian Kompetensi: 1. Menjelaskan teori atom Niels Bohr.
2. Menjelaskan teori atom mekanika kuantum.
3. Menentukan bilangan kuantum (kemungkinan elektron berada). 4. Menggambarkan bentuk orbital.
5. Menjelaskan kulit dan sub kulit serta hubungannya dengan bilangan kuantum.
Tujuan:
1. Siswa dapat menjelaskan ide pokok dari teori atom Niels Bohr
2. Siswa dapat menjelaskan ide pokok dari teori atom mekanika kuantum 3. Siswa dapat menentukan bilangan kuantum yang diperbolehkan untuk
keberadaan elektron
4. Siswa dapat mengidentifikasi bentuk orbital s, p dan d
5. Siswa dapat menjelaskan hubungan kulit dan sub kulit dengan bilangan kuantum.
Materi Ajar : Materi ke-1 :
Teori atom Niels Bohr :
1. Bohr merupakan orang yang pertama menghubungkan teori struktur atom dengan tingkat energi elektron untuk menjelaskan spektrum.
2. Teori atom Bohr berhasil menjelaskan struktur atom hidrogen, tetapi belum dapat menerangkan atom berelektron banyak.
3. Spektrum atom berupa spektrum garis.
4. Menurut Bohr spektrum garis menunjukan bahwa elektron dalam atom hanya dapat beredar pada lintasan-lintasan dengan tingkat energi tertentu
5. Lintasan elektron berupa lingkaran dengan jari-jari tertentu yang disebut sebagai kulit atom
6. Setiap kulit ditandai dengan suatu bilangan yang disebut bilangan kuantum (n),
7. Bilangan kuantum dimulai dari kulit paling dalam n = 1,2,3,4,dst dan dinyatakan dengan lambang K,L M,N
8. Elektron dapat berpindah ke energi yang lebih tinggi dengan menyerap energi, kemudian akan kembali ke energi yang lebih rendah dengan memancarkan radiasi elektromagnetik
Kekurangan teori atom Bohr disempurnakan dengan teori atom mekanika kuantum.Teori atom mekanika kuantum berakar pada hipotesis Prince Louis de Broglie dan Werner Heisenberg.
a. HIPOTESIS LOUIS DE BROGLIE
Mengemukakan gagasan konsep dualisme materi
Partikel memiliki sifat gelombang dan diskrit
Gerakan partikel mempunyai ciri-ciri gelombang
= h/mv
b. AZAS KETIDAKPASTIAN WERNER HEISENBERG
Dalam merumuskan persamaan gelombang ,Erwin Schrodinger memperhitungkan dualisme sifat elektron, yaitu sebagai partikel sekaligus sebagai gelombang
Peluang menemukan elektron pada setiap titik dalam ruang disekitar inti ditentukan oleh kuadrat fungsi gelombangnya 2
Daerah dengan peluang terbesar menemukan elektron disebut dengan orbital
Istilah lain untuk menyatakan peluang menemukan elektron adalah densitas elektron
Materi ke-2 :
BILANGAN KUANTUM
Bilangan kuantum berguna menggambarkan kedudukan posisi elektron suatu atom dan membedakannya dari elektron yang lain
1. Bilangan kuantum utama ( n )
Bilangan kuantum utama menunjukkan posisi elektron pada tingkat energi utama/kulit. Dari n yang dimiliki elektron dapat diketahui nomor kulit yang ditempati elektron tersebut.
N 1 2 3 4 5 6 7
Kulit K L M N O P Q
2. Bilangan kuantum azimut
Bilangan kuantum azimuth menunjukkan posisi electron dalam sub kulit
Nilai l diwakili oleh huruf s, p, d, f 3. Bilangan kuantum magnetic (m)
Kuantum magnetik (m) menunjukkan orientasi electron pada orbital. Nilai bilangan kuantum magnetik bergantung pada nilai subkulit. Rentang nilainya
antara –l dan +l
L Subkulit M Jumlah Orbital
0 S 0 1 1 P -1,0,+1 3 2 D -2,-1,0,+1,+2 5 3 F -3,-2,-1,0,+1,+2,+3 7
4. Bilangan kuantum spin
Bilangan kuantum spin (s) menunjukkan arah orbital elektron dalam orbital. Seiap orbital maksimum hannya boleh berisi dua electron yang memiliki arah spin yang berlawanan. Arah spin tersebut dilambangkan dengan dua anak panah yang memiliki arah berlawanan dalam satu kotak dan mempunyai nilai +1/2 dan –1/2. Jumlah elektron maksimum dalam subkulit dapat dikrtahui dari jumlah orbital yang dimiliki sub kulit tersebut
Jumlah Elektron Maksimum dalam Subkulit Subkulit Jumlah Orbital Jumlah Elektron Maksimum S 1 2 P 3 6 D 5 10 F 7 14 Bentuk Orbital
Orbital mempunyai daerah orientasi dan bentuk ruang tertentu tergantung bilangan kuantum azimutnya. Makin besar bilangan kuantum azimut makin rumit dan kompleks daerah orientasi dan bangun ruang dari orbital.
Orbital s
Orbital s mempunyai daerah orientasi dan bentuk ruang seperti bola pada pusat sumbu.
Orbital p
Orbital p mempunyai bentuk ruang seperti balon terpilin.
Orbital d
Orbital d mempunyai orientasi dan bentuk yang agak rumit daripada orbital p.
Orbital f
Orbital f mempunyai orientasi dan bentuk orbital yang sangat rumit untuk dipaparkan.
Materi ke-3 :
1. Penggolongan Unsur
a. Golongan Utama atau Golongan A
Unsur-unsur golongan utama adalah unsur-unsur yang pengisian elektronnya berakhir pada subkulit s atau p. Nomor golongan utama ditunjukan oleh elektron valensi dan unsur-unsur dalam satu golongan mempunyai kemiripan sifat. Dalam sistem periodik terdapat 8 golongan utama, yaitu golongan IA sampai dengan VIIIA.
b. Golongan Transisi atau Golongan B
Unsur-unsur transisi adalah unsur-unsur yang pengisiannya berakhir pada subkulit d. Nomor golongan pada unsur-unsur transisi tidak sesusai dengan jumlah elektron valensinya, tetapi mencerminkan jumlah maksimum elektron yang tersedia untuk pembentukan ikatan atau bilangan oksidasi maksimum unsur dalam senyawa. Dalam sistem periodik terdapat 10 golongan unsur transisi, yaitu golongan IB sampai dengan VIIIB (golongan VIIIB terdiri atas 3 golongan).
c. Unsur-Unsur Transisi Dalam
Unsur-unsur transisi dalam adalah unsur-unsur yang pengisia elektronnya berakhir pada subkulit f. Terdiri dari unsur-unsur Lantanida dan Aktinida. Kedua deret unsur-unsur transisi dalam tersebut termasuk pada golongan IIIB, tetapi ditempatkan terpisah di bagian bawah tabel periodik unsur.
2. Hubungan golongan dengan konfigurasi elektron
Kemiripan sifat unsur-unsur satu golongan disebabkan unsur dalam satu golongan mempunyai jumlah elektron valensi yang sama
Contoh :
7N : 1s2 2s2 2p3 → elektron valensi terletak pada sub kulit 2s2 2p3, jadi
termasuk golongan VA.
19K : 1s2 2s2 2p6 3s2 3p6 4s1 → elektron valensi terletak pada sub kulit 4s1,
jadi termasuk golongan IA.
27Co : 1s2 2s2 2p6 3s2 3p6 4s2 3d7 → elektron valensi terletak pada sub kulit
4s2 3d7, jadi termasuk golongan VIIIB.
3. Hubungan Periode dengan Konfigurasi Elektron
Dalam sistem Periodik, , lajur mendatar atau horizontal disebut periode. Unsur-unsur dalam satu periode disusun menurut kenaikkan nomor atomnya. Berdasarkan konfigurasi elektron pada subkulit nomor periode ditunjukkan oleh bilangan kuantum utama (n) terbesar. Setiap periode dimulai dari pengisian subkulit ns dan diakhiri dengan subkulit np. Dalam sistem periodik modern terdiri atas 7 periode.
Metode pendekatan: Diskusi informasi Penugasan
Alokasi Waktu 6 Jam pelajaran
Pertemuan Pertama: (2 jam pelajaran) Skenario Pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur,
disiplin, peka
Pembukaan
a. Apersepsi
Di kelas X telah dipelajari perkembangan teori atom, mulai dari teori paling sederhana yang dikemukakan oleh John Dalton sampai teori atom modern yang disebut teori atom mekanika kuantum. Apakah kamu masih ingat ide pokok dalam masing-masing teori tersebut? Sekarang kita akan membahas lebih jauh tentang teori atom Niels Bohr dan teori atom mekanika kuantum. Kita akan membahas fakta-fakta eksperimen yang mendasari kedua teori atom itu sehingga kita dapat memahaminya secara utuh.
b.Motivasi
Berdasarkan teori atom mekanika kuantum, siswa dapat memahami sifat-sifat unsur dalam sistem periodik serta pembentukan ikatan kimia.
Rasa ingin tahu, komunikatif, berani bertanya. Kegiatan Inti Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai teori atom Niels Bohr dan teori atom mekanika kuantum dari buku-buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Elaborasi :
- Berdasarkan hasil searching siswa, guru menjelaskan tentang sifat teori atom Niels Bohr dan teori atom mekanika kuantum
- Diskusi
- Guru dan siswa tanya jawab tentang teori atom Bohr dan teori atom mekanika kuantum
Konfirmasi :
- Siswa menyimpulkan tentang hal-hal yang
Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin. kritis, teliti.
belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui
Penutup
Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan ide pokok dalam teori Niels Bohr dan teori kuantum Max Planck bersama siswa.
Tugas :
Guru memberikan tugas, pengayaan materi atau menyampaikan materi yang akan datang
Tanggung jawab, kritis, teliti
Pertemuan Kedua: (2 jam pelajaran) Skenario pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur,
disiplin, peka
Pembukaan
a. Apersepsi
Mengingat materi pada pertemuan pertama dan bertanya kepada siswa tentang materi sebelumnya.
b. Motivasi
Berdasarkan teori atom mekanika kuantum, kita dapat mengetahui bilangan-bilangan kuantum. Rasa ingin tahu, komunikatif, berani bertanya. Kegiatan Inti Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai teori atom mekanika kuantum atom dari buku-buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Elaborasi :
- Berdasarkan hasil searching siswa, guru menjelaskan tentang bilangan kuantum
- Diskusi Konfirmasi : Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin, tanggung jawab.
- Siswa menyimpulkan tentang hal-hal yang belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui Tanggung jawab, kritis, teliti. Penutup Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan ide pokok dalam bilangan kuantum bersama siswa.
Tugas :
Guru memberikan tugas, dan untuk pertemuan selanjutnya
Tanggung jawab, kritis, teliti
Pertemuan Ketiga: (2 jam pelajaran) Skenario pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur,
disiplin, peka
Pembukaan
a. Apersepsi
Mengingat materi pada pertemuan pertama dan bertanya kepada siswa tentang materi sebelumnya.
b. Motivasi
Berdasarkan teori atom mekanika kuantum, siswa dapat mengetahui tentang kulit dan sub kulit serta hubungannya dengan bilangan kuantum. Rasa ingin tahu, komunikatif, berani bertanya. Kegiatan Inti Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai teori atom mekanika kuantum atom dari buku-buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Elaborasi :
- Berdasarkan hasil searching siswa, guru menjelaskan menjelaskan hubungan kulit dan sub kulit dengan bilangan kuantum
Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin, tanggung jawab.
- Diskusi informasi Konfirmasi :
- Siswa menyimpulkan tentang hal-hal yang belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui Tanggung jawab, kritis, teliti. Penutup Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan hubungan kulit dan sub kulit dengan bilangan kuantum bersama siswa.
Tugas :
Guru memberikan tugas, dan untuk pertemuan selanjutnya
Tanggung jawab, kritis, teliti
Alat / Bahan / Sumber Belajar :
Budi Utami, dkk. (2009). Kimia Untuk SMA dan MA Kelas XI,Jakarta : Departemen Pendidikan Nasional
J.M.C. Johari and M. Rachmawati. (2010). CHEMISTRY 2A. Jakarta :Erlangga
Penilaian:
a. Teknik Penilaian: Tes tertulis
b. Bentuk Instrumen: Pretest dan postest (terlampir), tanya jawab c. Instrumen Penilaian:
Penilaian proses pembelajaran
No. Nama Siswa
Penilaian
Afektif Psikomotorik Kognitif I II III IV I II III IV I II 1 2 3 Keterangan : Afektif I : Kedisiplinan II : Perhatian III : Tangungjawab
IV : Ketekunan
Psikomotorik I : Menjawab Pertanyaan II : Bertanya
III : Menanggapi pertanyaan IV : Mengemukakan ide Kognitif I : Pretest/postest II : Ulangan Harian Rentang Nilai : >79 A 68-79 B 55-67 C <55 D Keterangan : A : Memuaskan B : Baik C : Cukup D : Kurang Yogyakarta, 24 Juli 2012 Mengetahui
Guru Pembimbing PPL Mahasiswa PPL
Supri Madyo Purwanto, S.Pd Aditya Dwicahyo Wibowo NIP : 19670902 199903 1 002 NIM : 09303244023
RENCANA PELAKSANAAN PEMBELAJARAN STRUKTUR ATOM - 2
(KONFIGURASI ELEKTRON DAN SISTEM PERIODIK UNSUR) Nama Sekolah : MAN 3 YOGYAKARTA
Mata Pelajaran : Kimia Kelas / Semester : XI IPA / 1
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa.
Kompetensi dasar : 1.1. Menjelaskan teori atom Bohr dan mekanika kuantum untuk menuliskan konfigurasi elektron dan diagram orbital serta menentukan letak unsur dalam tabel periodik.
Indikator Pencapaian Kompetensi:
1. Menggunakan azas larangan Pauli, prisip aufbau, dan aturan Hund untuk menuliskan konfigurasi elektron dan diagram orbital.
2. Menghubungkan konfigurasi elektron suatu unsur dengan letaknya dalam tabel periodik.
Tujuan:
Siswa dapat :
1. Menuliskan konfigurasi elektron menurut teori atom mekanika kuantum. 2. Menulisklan diagram orbital
3. Menentukan letak unsur dalam sistem periodik berdasarkan konfigurasi elektronnya atau sebaliknya.
Materi Ajar:
ATURAN KONFIGURASI ELEKTRON
Elektron tersusun dalam atom mengikuti tiga aturan, yaitu prinsip Aufbau,azas larangan Pauli, dan kaidah Hund.
a. Prinsip Aufbau
Pengisian elektron dimulai dari tingkat energi terendah ke tingkat energi yang lebih tinggi.
n = 1 1s n = 2 2s 2p n = 3 3s 3p 3d n = 4 4s 4p 4d 4f n = 5 5s 5p sd sf n = 6 6s 6p 6d
n = 7 7s 7p
Menurut tingkat energinya, orbital dituliskan sebagai berikut:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14
6d10 7p6
b. Azas Larangan Pauli
Dalam suatu atom, tidak mungkin ada dua elektron yang harga keempat bilangan kuantumnya sama
Contoh:
1H 1s1 n=1 l=0 m=0 s= +
2He 2s2 n=1 l=0 m=0 s=
-c. Kaidah Hund
Pengisian elektron pada orbital yang tingkat energinya sama. Setiap orbital diisi masing-masing satu elektron dengan arah yang sama. Setelah semua orbital terisi satu baru mengisi orbital dengan elektron berpasangan. Metode pendekatan:
Diskusi informasi Penugasan
Alokasi Waktu
2 Jam pelajaran (1 x pertemuan) Skenario Pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur,
disiplin, peka
Pembukaan
a. Apersepsi
Mengingat kembali tentang konfigurasi elektron kelas X dan mengingat kembali materi sebelumnya.
b. Motivasi
Berdasarkan teori atom mekanika kuantum, siswa dapat mengetahui konfigurasi elektron dalam sistem periodik unsur.
Rasa ingin tahu, komunikatif, berani bertanya. Kegiatan Inti Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai teori atom mekanika kuantum atom dari
buku-Peka, demokrasi, komunikatif.
buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Guru membahas konfigurasi electron berdasarkan tentang teori atom mekanika kuantum
Elaborasi :
Guru membahas hubungan konfigurasi elektron dengan sistem periodik
Diskusi informasi Konfirmasi :
- Siswa menyimpulkan tentang hal-hal yang belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui Kerjasama, jujur, disiplin, tanggung jawab. Tanggung jawab, kritis, teliti. Penutup Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan aturan-aturan penulisan konfigurasi elektron dan hubungan konfigurasi elektron dengan sistem periodik bersama siswa. Tugas :
Guru memberikan tugas, pengayaan materi atau menyampaikan materi yang akan datang
Tanggung jawab, kritis, teliti
Alat / Bahan / Sumber Belajar :
Budi Utami, dkk. (2009). Kimia Untuk SMA dan MA Kelas XI,Jakarta : Departemen Pendidikan Nasional
J.M.C. Johari and M. Rachmawati. (2010). CHEMISTRY 2A. Jakarta :Erlangga
Penilaian:
a. Teknik Penilaian: Tes tertulis
b. Bentuk Instrumen: Pretest dan postest (terlampir), tanya jawab c. Instrumen Penilaian:
No. Nama Siswa
Penilaian
Afektif Psikomotorik Kognitif I II III IV I II III IV I II 1 2 3 Keterangan : Afektif I : Kedisiplinan II : Perhatian III : Tangungjawab IV : Ketekunan
Psikomotorik I : Menjawab Pertanyaan II : Bertanya
III : Menanggapi pertanyaan IV : Mengemukakan ide Kognitif I : Pretest/postest II : Ulangan Harian Rentang Nilai : >79 A 68-79 B 55-67 C <55 D Keterangan : A : Memuaskan B : Baik C : Cukup D : Kurang Yogyakarta, 24 Juli 2012 Mengetahui
Guru Pembimbing PPL Mahasiswa PPL
Supri Madyo Purwanto, S.Pd Aditya Dwicahyo Wibowo NIP : 19670902 199903 1 002 NIM : 09303244023
RENCANA PELAKSANAAN PEMBELAJARAN GEOMETRI MOLEKUL
Nama Sekolah : MAN 3 YOGYAKARTA Mata Pelajaran : Kimia
Kelas / Semester : XI IPA / 1
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa.
Kompetensi dasar : 1.2. Menjelaskan teori jumlah pasangan elektron di sekitar inti atom dan teori hibridisasi untuk meramalkan bentuk molekul.
Indikator Pencapaian Kompetensi:
1. Menentukan bentuk molekul berdasarkan teori jumlah pasangan elektron 2. Menentukan bentuk molekul berdasarkan teori hibridisasi.
Tujuan:
Siswa dapat :
1. Menentukan bentuk molekul berdasarkan teori domain elektron. 2. Meramalkan kepolaran molekul berdasarkan geometri molekulnya 3. Menjelaskan geometri molekul berdasarkan teori hibridisasi. Materi Ajar :
1. Bentuk Geometri Molekul
Bentuk molekul berkaitan dengan susunan ruang atom-atom dalam molekul. Molekul-molekul sederhana dapat diramalkan bentuknya berdasarkan pemahaman tentang struktur elektron dalam molekul. Cara meramalkan bentuk molekul berdasarkan teori tolak menolak elektron-elektron pada kulit luar atom pusatnya, yang disebut teori domain elektron.
a. Teori Domain Elektron
Teori domain elektron adalah suatu cara meramalkan bentuk molekul bentuk molekul berdasarkan tolak menolak elektron-elektron pada kulit luar atom pusat. Teori ini merupakan penyempurnaan dari teori VSEPR (valence shell electron pair repulsion). Domain elektron berarti kedudukan elektron atau daerah keberadaan elektron. Jumlah domain elektron ditentukan sebagai berikut :
Setiap elektron ikatan (apakah ikatan tunggal, rangkap, atau rangkap tiga) berarti 1 domain.
Setiap pasangan elektron bebas berarti 1 domain.
Prinsip-prinsip dasar teori domain elektron adalah sebagai berikut :
Antar domain elektron pada kulit luar atom pusat saling tolak menolak sehingga domain elektron akan mengatur diri (mengambil formasi) sedemikian rupa sehingga tolak menolak di antaranya menjadi
minimum.
Urutan kekuatan tolak menolak di antara domain elektron adalah sebagai berikut:
Tolakan antardomain elektron bebas > tolakan antardomain elektron bebas dengan domain elektron ikatan > tolakan antardomain elektron ikatan. Perbedaan daya tolak ini terjadi karena pasangan elektron bebas hanya terikat pada satu atom saja, sehingga bergerak lebih leluasa dan menempati ruang lebih besar daripada pasangan elektron ikatan. Akibat dari perbedaan daya tolak tersebut adalah mengecilnya sudut ikatan karena desakan dari pasangan elektron bebas.
Bentuk molekul hanya ditentukan oleh pasangan elektron terikat. Tabel : Susunan ruang domain elektron yang menghasilkan tolakan minimum Jumlah domain elektron Susunan ruang (geometri) Besar sudut ikatan 2 Linear 180°
3 Segitiga sama sisi 120°
4 Tetrahedron 109,5°
5 Bipiramida trigonal Ekuatorial=120°
Aksial=90°
6 Oktahedron 90°
b. Merumuskan Tipe Molekul
Jumlah domain (pasangan elektron) dalam suatu molekul, dapat dinyatakan sebagai berikut :
Atom pusat dinyatakan dengan lambing A,
Domain elektron ikatan dinyatakan dengan X, dan Domain elektron bebas dinyatakan dengan E
Tabel : Berbagai emungkinan bentuk molekul yang atom pusatnya mempunyai 4, 5, atau 6 pasangan electron
Jumlah PEI Jumlah PEB Rumus Bentuk molekul Contoh
4 0 AX4 Tetrahedron CH4 3 1 AX3E Piramida trigonal NH3 2 2 AX2E2 Planar bentuk V H2O 5 0 AX5 Bipiramida trigonal PCl5 4 1 AX4E Bidang empat SF4 3 2 AX3E2 Planar bentuk T IF3 2 3 AX2E3 Linear XeF2 6 0 AX6 Oktahedron SF6 5 1 AX5E Piramida sisiempat IF5
4 2 AX4E2 Segiempat planar XeF4
Tentukan jumlah elektron valensi atom pusat (EV) Tentukan jumlah domain elektron ikatan (X) Tentukan jumlah domain elektron bebas (E)
𝐸 =(𝐸𝑉 − 𝑋)
2
Cara penetapan tipe molekul tersebut hanya berlaku untuk senyawa biner berikatan tunggal. Untuk senyawa biner yang berikatan rangkap atau ikatan kovalen koordinat (misalnya dengan oksigen), maka jumlah elektron yang digunakan untuk membentuk pasangan terikat menjadi 2 kali jumlah ikatan.
Selanjutnya, langkah-langkah untuk meramalkan geometri adalah sebagai berikut :
Menentukan tipe molekul
Menggambar susunan ruang domain-domain elektron di sekitar atom pusat yang memberi tolakan minimum.
Menetapkan pasanagn terikat dengan menuliskan lambing atom yang bersangkutan.
Menentukan geometri molekul setelah mempertimbangkan pasangan elektron bebas.
c. Molekul polar dan nonpolar
Suatu molekul akan bersifat polar jika memenuhi 2 syarat nerikut : Ikatan dalam molekul bersifat polar. Secara umum, ikatan antaratom
yang berbeda dapat dianggap polar.
Bentuk molekul tidak simetris, sehingga pusat muatan positif tidak berimpit dengan pusat muatan negatif.
2. Hibridisasi
Bentuk molekul dapat diramalkan dengan teori domain elektron. Namun demikian, teori tersebut tidak menjelaskan bagaimana suatu molekul dapat berbentuk seperti itu.
Hibridisasi adalah peleburan orbital-orbital dari tingkat energy yang berbeda menjadi orbital-orbital yang setingkat. Jumlah orbital hibrida (hasil hibridisasi) sama dengan jumlah orbital yang terlibat pada hibridisasi itu.
Tabel : Berbagai macam tipe hibridisasi
Orbital asal Orbital hibrida Bentuk orbital hibrida
Besar sudut ikatan
s, p Sp Linear 180°
s, p, p sp2 Segitiga sama sisi 120° s, p, p, p sp3 Tetrahedron 109,5°
s, p, p, p, d sp3d Bipiramida trigonal Ekuatorial=120° Aksial=90° s, p, p, p, d, d sp3d2 Oktahedron 90°
Metode pendekatan: Diskusi informasi Penugasan
Alokasi Waktu
2 Jam pelajaran (1 x pertemuan). Skenario Pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur, disiplin, peka
Pembukaan
a. Apersepsi
Mengaitkan materi teori bentuk geometri molekul dengan hal ramal-meramal atau membayangkan seseorang.
b. Motivasi
Berdasarkan teori domain elektron dan hibridisasi, siswa dapat mengetahui bentuk geometri suatu molekul.
Rasa ingin tahu, komunikatif, berani bertanya.
Kegiatan Inti
Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai teori domain elektron dan hibridisasi dari buku-buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Guru membahas teori domain elektron dan teori hibridisasi
Elaborasi :
Diskusi informasi Konfirmasi :
- Siswa menyimpulkan tentang hal-hal yang belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin, tanggungjawab. Tanggungjawab, kritis, teliti. Penutup Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya
Tanggungjawab, kritis, teliti
memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan teori domain elektron dan teori hibridisasi bersama siswa.
Tugas :
Guru memberikan tugas, pengayaan materi atau menyampaikan materi yang akan datang Alat / Bahan / Sumber Belajar :
Budi Utami, dkk. (2009). Kimia Untuk SMA dan MA Kelas XI,Jakarta : Departemen Pendidikan Nasional
J.M.C. Johari and M. Rachmawati. (2010). CHEMISTRY 2A. Jakarta :Erlangga
Penilaian:
a. Teknik Penilaian: Tes tertulis
b. Bentuk Instrumen: Pretest dan postest (terlampir), tanya jawab c. Instrumen Penilaian:
Penilaian proses pembelajaran
No. Nama Siswa
Penilaian
Afektif Psikomotorik Kognitif I II III IV I II III IV I II 1 2 3 Keterangan : Afektif I : Kedisiplinan II : Perhatian III : Tangungjawab IV : Ketekunan
Psikomotorik I : Menjawab Pertanyaan II : Bertanya
III : Menanggapi pertanyaan IV : Mengemukakan ide Kognitif I : Pretest/postest
Rentang Nilai : >79 A 68-79 B 55-67 C <55 D Keterangan : A : Memuaskan B : Baik C : Cukup D : Kurang Yogyakarta, 24 Juli 2012 Mengetahui
Guru Pembimbing PPL Mahasiswa PPL
Supri Madyo Purwanto, S.Pd Aditya Dwicahyo Wibowo NIP : 19670902 199903 1 002 NIM : 09303244023
RENCANA PELAKSANAAN PEMBELAJARAN GAYA ANTAR MOLEKUL
Nama Sekolah : MAN 3 YOGYAKARTA Mata Pelajaran : Kimia
Kelas / Semester : XI IPA / 1
Standar Kompetensi : 1. Memahami struktur atom untuk meramalkan sifat-sifat periodik unsur, struktur molekul, dan sifat sifat senyawa.
Kompetensi dasar : 1.3. Menjelaskan interaksi antar molekul (gaya antar molekul) dan sifat zat.
Indikator Pencapaian Kompetensi:
1. Menjelaskan perbedaan sifat fisik (titik didih, titik leleh) berdasarkan perbedaan gaya antar molekul (gaya van der waals, gaya London, dan ikatan hidrogen).
Tujuan: Siswa dapat :
1. Menjelaskan perbedaan sifat fisik (titik didih, titik leleh) berdasarkan perbedaan gaya antar molekul (gaya van der waals, gaya London, dan ikatan hidrogen).
Materi Ajar : Gaya Antar Molekul
Gaya antar molekul adalah interaksi antar molekul melalui gaya elektrostatis yang dipengaruhi oleh kepolaran suatu molekul senyawa.
Jenis gaya antar molekul :
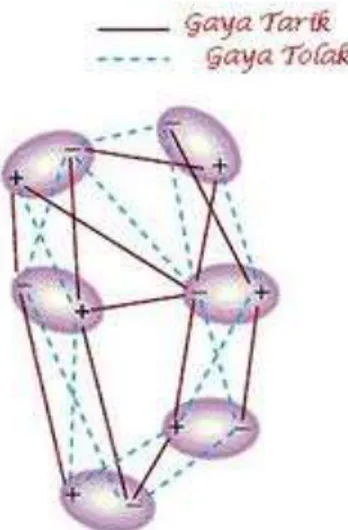
1. Gaya Tarik-menarik Dipol-dipol(Gaya Van der Waals)
Gaya tarik-menarik dipol-dipol berlaku untuk molekul-molekul yang bersifat polar. Molekul-molekul polar mempunyai dua kutub, yaitu kutub (dan
edua kutub ini merupakan dipol permanen. Dipol-dipol tersebut
selanjutnya akan saling tarik-menarik pada kutub yang berlawwanan. Pada saat bersamaan, juga terjadi gaya tolek-menolak anatar kutup yang sejenis. Secara keseluruhan gaya tarik menarik akan lebih besar daripada gaya tolak menolak. Akibatnya, terdapat suatu netto(selisih yang positif-peny) gaya tarik-menarik antar molekul. Inilah yang disebut dengan gaya Van der Waals.
Gambar gaya tarik-menarik dipole-dipol
Jika diperhatikan, susunan molekul-molekul polar di atas tidak teratur. Hal ini dikarenakan adanya tumbukan antar molekul yang menyebabkan molekul tersebut kehilangan orientasi. Akibatnya, efektifitas tarik menarikk berkurang.
Gaya tarik menarik dipol-dipol ini jauh lebih lemah dibandingkan ikatan kovalen anatar atom dalam masing-masing molekul itu sendiri, yakni hanya sekitar 1%nya. Hal ini disebabkan muatan-muatan yang terlibat dalam gaya antar-molekul iniadalah muatan parsial(dan , bukan muatan penuh. 2. Ikatan Hidrogen
Ikatan hidrogen terbentuk antara atom H dari suatu molekul polar dengan pasangan elektron bebas yang dimiliki atom berjari-jari kecil yang sangat elektronegatif dari molekul polar lainnya. Atom-atom berjari-jari kecil yang sangat elektronegatif itu ialah aton N, O dan F. Ikatan hidrogen merupakan gaya tarik-menarik dipol-dipol antar molekul polar. Namun, ikatan ini dibedakan dengan gaya van der Waals karena ikatanya sangat kuat, yaitu sekitar 5-10 kali lebih besar.
Mengapa ikatan hidrogen lebih kuat? Hal ini dapat dipahami karena atom H sendiri tidak memiliki kulit-kulit elektron terdalam sehingga elektronnya dapat tertarik sangat kuat ke atom kecil yang sangat elektronegatif tersebut. Ikatan hidrogen antara atom H dalam molekul polar dengan atom(yang berada pada molekul lain) yang sangat elektronegatif dilambangkan dengan H∙∙∙N, H∙∙∙O, H∙∙∙F.
Contoh senyawa yang mengalami ikatan hidrogen misalnya H2O, HF, dan
NH3. Perhatikan gambar dibawah ini,
a. Ikatan hydrogen pada H2O
b. Ikatan hydrogen pada HF
c. Ikatan hydrogen pada NH3 dan jarak ikatan antar molekul
3. Gaya London(Gaya Tarik-menarik Dipol Sesaat-Dipol Terimbas)
Sekitar tahun 1930, ahli fisika jerman bernama Fritz London menjelaskan bahwa partikel-pertikel(atom atau molekul) di dalam unsur atau senyawa nonpolar juga dapat mengalami gaya antar partikel yang lemah. Gaya ini disebut gaya tarik-menarik dipol-dipol terimbas atau gaya London atau disebit juga gaya dispersi.
Interaksi ini terbentuk dengan tahap-tahap sebagai berikut, Molekul Molekul
non-polar non-polar
Dua molekul nonpolar memiliki elektron-elektron yang terus menerus bergerak. Elektron ini terdistribusi dalam molekul secara merata.
Dipol sesaat non polar
menurut teori kebolehjadian(peluang), ada saatnya dimana elektron-elektron terkonsentrasi di satu sisi dari molekul. Hal ini menyebabkan kerapatan elektron molekul menjadi tersitribusi tidak merata. Dengan kata lain, terbentuk kutub atau disebut pembentukan dipol. Dipol ini bersifat sesaat, disebut juga dipol sesaat.
Dipol sesaat dipol terimbas
Sisi bermuatan parsial negatif () dari dipol sesaat akan mempengaruhi kerapatan elektron dari molekul terdekatnya. Akibatnya molekul tersebut mengalami dipol terimbas, karena elektron-elektron dalam molekulnya mengalami gaya tolak menolak dengan elektron pada molekul dipol sesaat. Terjadi tarik menarik antara dipol sesaat- dipol terimbasatau disebut gaya London
Gaya tarik menarik ini hanya terjadi sesaat, sebab dipole sesaat dan dipole terimbas muncul dan hilang mengikuti naik turunnya kerapatan electron
Dipol sesaat dipol terimbas
Di lain waktu, dipole sesaat dan dipole terimbas muncul dengan orientasi berbeda, yang menghasilkan gaya tarik-menarik baru yang juga hanya sesaat.
Gaya London berlaku untuk molekul nonpolar maupun molekul polar. Jadi, pada molekul nonpolar, selain ada gaya tarik-menarik antar dipole-dipol, juga ada gaya tarik menarik dipole sesaat-sipol terimbas.
Gaya tarik menarik dipole sesaat-dipol terimbas bersifat lemah karena terjadi sementara dan tidak terus menerus.
Ada 3 faktor yang mempengaruhi mudahnya awan elektron dalam molekul mengalami deformasi sehingga terjadi gaya London, yaitu,
a. Ukuran molekul. Semakin beasr ukuran moleku, semakin mudah elektron terdeformasi karena elektron luarnya cenderung tidak terikat dengan baik,
sehingga semakin mungkin terbentuk dipole sesaat dan dipole terimbas. Artinya, gaya London makin kuat
b. Jumlah atom dalam molekul. Semakin banyak atom dalam molekul, makin tersedia banyak tempat untuk terbentuknya dipole sesaat dan dipole terimbas, sehingga kekuatan gaya London makin besar.
c. Bentuk molekul. Semakin kompak bentuk moleku, kemungkinan terbentuknya dipole sesaat dan dipole terimbas makin kecil. Artinya, semakin lemah gaya London yang bisa terjadi.
Pengaruh Gaya Antar Molekul terhadap Sifat Fisis Senyawa 1. Titik didih
Titik didih menggambarkan energi yang diperlukan untuk mengatasi agaya tarik-menarik antar molekul. Senyawa yang memiliki interaksi antar molekul yang kuat akan memiliki titik didih yang relatif tinggi
2. Tegangan Permukaan
Tegangan permukaan suatu zat cair dipengarui oleh interaksi antar molekul at cair itu. Semakin besar interaksi, semakin besar pula tegangan permukaannya.
3. Sifat membasahi permukaan oleh zat cair
Sifat membasahi terjadi karena penyebaran molekul zat cair pada permukaan membentuk lapisan yang tipis. Apabila terjadi interaksi yang kuat antara permukaan dan zat cair, zat cair tersebut akan lebih mudah membasahi permukaan. Contohnya air pada permukaan gelas yang bersih dapat membentuk lapisan tipis karena molekul air membentuk ikatan hidrogen terhadap atom O yang terdapat pada gelas. Apabila gelas terkena minyak/ lemak, air tidak dapat membasahinya karena air tidak membentuk ikatan yang kuat dengan lemak(hidrokarbon).
4. Kekentalan
Semakin besar interaksi antar molekul yang terjadi pada senyawa berbentuk cair, semakin besar kekentalanya. Kekentalan mempengaruhi gerak zat cair. Semakin kental suatu zat cair, semakin sulit ia bergerak karena gaya antar sesama molekul zat cair sangat kuat.
Metode pendekatan: Diskusi informasi Penugasan
Alokasi Waktu
Pertemuan Pertama: (2 jam pelajaran) Skenario Pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pra
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur, disiplin, peka
Pembukaan
a. Apersepsi
Mengingat materi tentang ikatan kimia kelas X dan materi sebelumnya.
b. Motivasi
Berdasarkan gaya antar molekul maka siswa dapat mengetahui perbedaan sifat fisik zat.
Rasa ingin tahu, komunikatif, berani bertanya. Kegiatan Inti Eksplorasi :
Siswa diberi kesempatan untuk mencari bahan materi pembelajaran mengenai gaya antar molekul dari buku-buku atau sumber internet di sekolah atau melalui sumber-sumber lain yang relevan.
Guru membahas gaya antar molekul Elaborasi :
Diskusi informasi Konfirmasi :
- Siswa menyimpulkan tentang hal-hal yang belum diketahui
- Siswa menjelaskan tentang hal-hal yang belum diketahui Peka, demokrasi, komunikatif. Kerjasama, jujur, disiplin, tanggungjawa b. Tanggungjaw ab, kritis, teliti. Penutup Evaluasi :
Guru mencatat dan memberi penilaian kepada setiap individu berdasarkan keaktifan dan kontribusi siswa untuk peran sertanya memberikan kontribusi pada tanya jawab dan latihan soal
Simpulan :
Guru menyimpulkan teori domain elektron dan teori hibridisasi bersama siswa.
Tugas :
Guru memberikan tugas, pengayaan materi atau menyampaikan materi yang akan datang
Tanggungjaw ab, kritis, teliti
Pertemuan kedua : Ulangan Harian ( 2 Jam Pelajaran ) Skenario Pembelajaran
Tahap-tahap Langkah Pembelajaran Karakter
Pembukaan
- Guru memasuki kelas dan memberi salam - Mengkondisikan kelas
- Mengecek kehadiran siswa
Jujur, disiplin, peka
Kegiatan Inti
Ulangan Harian Jujur
Penutup Simpulan :
Guru menyampaikan materi yang akan datang
Tanggungjawab, kritis, teliti Alat / Bahan / Sumber Belajar :
Budi Utami, dkk. (2009). Kimia Untuk SMA dan MA Kelas XI,Jakarta : Departemen Pendidikan Nasional
J.M.C. Johari and M. Rachmawati. (2010). CHEMISTRY 2A. Jakarta :Erlangga
Penilaian:
a. Teknik Penilaian: Tes tertulis
b. Bentuk Instrumen: Pretest/Postest, Ulangan Harian (terlampir), tanya jawab c. Instrumen Penilaian:
Penilaian proses pembelajaran
No. Nama Siswa
Penilaian
Afektif Psikomotorik Kognitif I II III IV I II III IV I II 1 2 3 Keterangan : Afektif I : Kedisiplinan II : Perhatian III : Tangungjawab IV : Ketekunan
Psikomotorik I : Menjawab Pertanyaan II : Bertanya
III : Menanggapi pertanyaan IV : Mengemukakan ide
Kognitif I : Pretest/postest II : Ulangan Harian Rentang Nilai : >79 A 68-79 B 55-67 C <55 D Keterangan : A : Memuaskan B : Baik C : Cukup D : Kurang Yogyakarta, 24 Juli 2012 Mengetahui
Guru Pembimbing PPL Mahasiswa PPL
Supri Madyo Purwanto, S.Pd Aditya Dwicahyo Wibowo NIP : 19670902 199903 1 002 NIM : 09303244023