METODOLOGI
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juli tahun 2017 sampai dengan Agustus 2017. Pengambilan sampel ikan patin akan dilakukan dikolam Budidaya Ikan Air Tawar Kota Beling Tanah Air Kecamatan Tanjung Anomyang terkena penyakit. Identifikasi sampel ikan patin dilaksanakan di Balai Karantina Ikan Pengendalian Mutu dan Keamanan Hasil Perikanan Kelas I Medan I, Deli Serdang. Peta lokasi penelitian dapat dilihat pada Gambar 4.
Gambar 4. Peta Lokasi Penelitian
Tanjung Anom Tanjung Anom
Alat dan Bahan
Alat yang digunakan antara lain kertas label, tisu, tabung reaksi, rak tabung, gelas ukur, beaker glass, cawan petri, erlenmeyer, oven, autoclave,
alumunium foil, kapas, batang pengaduk, split spreader, timbangan analitik, laminar airflow,refrigerator, bunsen, alat bedah, inkubator, millimeter blok, nampan, alat tulis, pH meter, termometer, penggaris, mikroskop, jarum ose, masker, sarung tangan, batang pengaduk (Lampiran 1).
Bahan yang digunakan pada penelitian ini adalah sebagai berikut sampel ikan patin (Pangasius sp), Tryptic Soy Agar (TSA), alkohol 70%, aquadest, MnSO4, KOH-KI, pewarnaan gram (Crystal violet, safranin, lugol dan minyak emersi), KOH 3%, oxidase strips, aquabidest, Uji biokimia yaitu TSIA, O/F, MR-VP, LIA (Lysine Iron Agar), SCA (Simmon’s Citrat Agar) dan uji gula-gula (Arabinose, Maltose, Glucose, Fructose, Sukrosa, Gelatine, Sorbitol, Galactose dan Lactose) (Lampiran 1).
Tahap Pelaksanaan Penelitian
Deskripsi Kolam Budidaya
Lokasi budidaya ikan terletak di Kota Beling Tanah Air Kecamatan Tanjung Anom dengan luas 13x13 m dengan kedalaman ± 2 meter. Kolam tersebut termasuk semi intensif. Inlet kolam budidaya berasal dari anak sungai yang berada ±2 m dari kolam. Kolam budidaya ikan patin dikelilingi benih ikan mas, nila dan gurami. Didalam kolam tersebut tidak hanya ikan patin saja yang dibudidayakan tetapi ikan gurami.
Gambar 5. Kolam Budidaya Ikan Patin Pengambilan Sampel Ikan
Sterilisasi Alat dan Bahan
Semua peralatan yang akan digunakan dalam penelitian disterilkan terlebih dahulu. Alat-alat yang terbuat dari kaca sebelum digunakan dicuci dan dikeringkan. Alat-alat tersebut dibungkus dengan kertas dan disterilisasi menggunakan autoclave pada suhu 121oC selama 30 menit dan tekanan 1 atm. Kemudian dikeringkan dengan menggunakan oven. Sedangkan media disterilisasi pada suhu 121oC selama 15 menit dan tekanan 1 atm. Sterilisasi pembakaran yaitu jarum ose untuk inokulasi bakteri disterilisasi dengan membakarnya sampai berwarna kemerahan dengan menggunakan bunsen (Lampiran 5).
Pembuatan Media TSA
Ditimbang media TSA sebanyak 4.0 g, lalu ditimbang akuadest sebanyak 100 ml, setelah itu campurkan media TSA dengan akuadest kedalam labu Erlenmeyer lalu aduk hingga merata, kemudian tutup erat bagian mulut labu Erlenmeyer dengan aluminium foil, kemudian panaskan larutan media TSA dengan menggunakan hot plate sampai mendidih, lalu larutan media dimasukkan kedalam autoclave agar steril selama 15 menit, kemudian dituang kedalam cawan
petri, ditunggu sampai media mengeras dan disimpan kedalam kulkas (Lampiran 6).
Nekropsi Ikan Patin
menggunakan pisau bedah maupun gunting. Lalu diambil hati dan ginjal ikan yang selanjutnya diletakkan pada kertas alumunium foil dan ditimbang dengan menggunakan timbangan analitik (Lampiran 4).
Isolasi dan Identifikasi Bakteri Potensial Patogen dari Sampel Ikan
Bakteri patogen diisolasi pada beberapa organ dalam ikan yaitu hati, ginjal dan air budidaya. Isolasi bakteri dilakukan dengan menggunakan teknik cawan gores atau streak plate pada bagian-bagian tubuh ikan tersebut. Kemudian digoreskan pada media TSA, setelah itu diinkubasi dan dikultur selama 24 jam di dalam inkubator dengan suhu 25-28°C (Lampiran 7). Bakteri yang telah tumbuh kemudian dimurnikan kembali pada media TSA yang baru dengan menggunakan teknik cawan gores atau streak plate (Lampiran 8), kemudian kultur diinkubasi kembali selama 24-48 jam pada suhu ruang 25-28°C.
Isolasi dan Identifikasi Bakteri Potensial Patogen dari Air Budidaya
-1
dan dimasukkan kedalam pengenceran 10-2 dan dihomogenkan kembali. Selanjutnya, diambil kembali 1 ml dari pengenceran 10-2 dan dimasukkan kedalam pengenceran 10-3 dan dihomogenkan kembali dengan cara diaduk dengan menggunakan batang pengaduk. Setelah itu, diambil 1 ml dengan menggunakan split dan di sebar pada media TSA lalu di sebar kembali dengan menggunakan split berbentuk segitiga. Kemudian media tersebut diinkubasi selama 24 jam dengan suhu ruangan 25-28°C (Lampiran 7).
Pengamatan mikroskopik (Pewarnaan gram)
Pengecatan gram merupakan metode-metode double-straning yang merupakan bentuk dasar untuk pengujian dan identifikasi bakteri. Pengecatan gram akan membedakan bakteri menjadi 2 kelompok yaitu bakteri gram positif (+) dan gram negatif (-). Adapun langkah-langkah pengujian gram dengan menggunakan pengacatan gram adalah buat preparat ulas dari biakan murni bakteri yang akan diuji. Basahi preparat ulas tersebut dengan Crystal violet selama 0,5-1 menit. Preparat dicuci dengan air mengalir kemudian ditambahkan Lugol iodine selam 0,5-1 menit. Preparat dicuci dengan alkohol dan air mengalir. Selanjutnya, Safranin ditetesi ke preparat dan didiamkan selama 0,5-1 menit. Lalu cuci dengan menggunakan air mengalir dan difiksasi. Selanjutnya, preparat di identitifikasi menggunakan mikroskop 1000 kali pembesaran (Lampiran 9).
Pengujian Gram dengan Menggunakan KOH 3%
berdasarkan lendir atau gel yang berbentuk saat isolat dicampur dengan KOH 3%. Pengujian KOH 3% adalah teteskan aquadest pada objek glass, isolat bakteri murni diambil dengan menggunakan ose. Campurkan isolat tersebut dengan KOH 3%. Amati perbentukan lendir yang terjadi dengan menarik ose keatas. Jika organisme atau bakteri gram (-) maka terbentuk lendir saat dicampurkan dengan KOH 3% dan sebaliknya (Lampiran 12).
Uji Oksidase
Pengujian oksidase berfungsi untuk mentukan adanya oksidase sitokrom yang ditemukan pada mikroorganisme tertentu. Pengujian oksidase menggunaka
oxidase strips. Pengujian oksidase adalah biakan atau isolate murni diambil dengan menggunakan jarum ose, kemudian diletakkan pada kertas oxidase strips. Amati perubahan yang terjadi. Koloni yang bersifat oksidase (+) akan berubah warna menjadi biru atau ungu dalam kurung waktu dari 10 detik dan jika koloni
bakteri yang bersifat oksidase (-) akan berubah warna menjadi cokelat (Lampiran 11).
Uji Katalase
Pengujian katalase menggunakan reagent Hidrogen Perioksida (H2O3 3%).
glass. Amati pembentukan gelembung udara yang terjadi pada saat koloni bakteri bercampur atau bereaksi dengan H2O3 3%. Jika bakteri atau organisme yang bersifat katalase (+) akan terjadi gelembung dan sebaliknya (Lampiran 10).
Uji Biokimia Bakteri
1. Uji gula-gula (arabinose, maltose, laktose, galactose, sorbitol, fructose, glukosa)
Pengujian gula-gula dilakukan untuk melihat kemampuan bakteri dalam memfermentasi gula-gula pada media. Proses fermentasi gula-gula akan menghasilkan sejumlah besar asam (acid) dan beberapa bakteri akan menghasilkan gas yang dapat diamati dengan tabung reaksi yang diletakkan pada media gula-gula. Maing-masing larutan gula tersebut ditambahkan indikator
phenol red. Media gula-gula merupakan media cair (liquid) yang berwarna merah. Pengujian gula-gula dilakukan dengan cara menginokulasikan bakteri secara aseptis kedalam media gula-gula (arabinose, maltose, laktose, galactose, sorbitol, fructose, glukosa). Media yang telah diinokulasikan selanjutnya diinkubasi dengan suhu ruangan. Dalam pembacaan hasil gula-gula (+) apabila warna media berubah menjadi kuning dan gula-gula (-) apabila tidak terjadi perubahan warna pada media (tetap merah) (Lampiran 13).
2. Uji Oksidatif/Fermentatif (O/F)
kedalam tabung/media O/F. Media yang telah diinokulasi bakteri selanjutnya diinkubasi sesaui dengan suhu ruangan. Dalam pembacaan hasil fermentatif apabila O/F berubah warna menjadi kuning (acid) sedangkan oksidatif apabila bagian dasar media (anaerob) berwarna hijau dan bagian atas media (aerob) berwarna kuning. Reaksi negatif atau alkalin terjadi apabila media hijau atau terbentuk warna biru-alkaline (bakteri tidak mencerna karbohidrat) (Lampiran 13). 3. Uji Motil Indol Ornithin (MIO)
Pengujian motilitas bakteri dilakukan untuk membedakan bakteri motil
(bergerak) atau non-motil (tidak bergerak). Motilitas bakteri dapat diamati dari pertumbuhan bakteri pada media. Media agar yang digunakan untuk menguji motilitas bakteri adalah media MIO. Inokulasi bakteri pada media MIO dilakukan secara aseptis dengan menusukkan jarum ose yang mengandung isolat bakteri lurus kedalam tabung/media MIO Media yang telah diinokulasi bakteri selanjutnya diinkubasi sesuai dengan suhu ruangan.
Pembacaan hasil bakteri motil (+) yaitu pertumbuhan bakteri akan menyebar menjauhi garis inokulasi sehingga media menjadi keruh dan bakteri non-motil (-) yaitu pertumbuhan hanya terlihat disepanjang garis inokulasi dan media tidak keruh.
Untuk Ornithin Dekarboxylase, pembacaan hasil dengan mengamati perubahan pada daerah anaerob media, ornithin dekarboxylase (+) apabila daerah anaerob media berwarna abu-abu, ungu dan biru sedangkan ornithin dekarboxylase (-) apabila daerah anaerob media berubah menjadi kuning.
permukaan atas media/agar dan indole (-) jika tidak terbentuk cincin merah pada permukaan atas media/agar (Lampiran 13).
4. Uji Sitrat
Pengujian sitrat dilakukan untuk membedakan Enterobacteriaceae dan bakteri gram (-) tertentu berdasarkan penggunaan sitrat sebagai satu-satunya sumber carbon. Media sitrat merupakan media miring berwarna hijau dalam tabung reaksi. Pengujian sitrat adalah inokulasi media dengan menggunakan jarum ose steril, pertama dengan menusuk dasar media kemudian melakukan streakkeatas pada daerah miring media. Media yang telah diinokulasi selanjutnya diinkubasi dengan suhu ruangan. Proses inokulasi media harus dilakukan secara aseptis. Dalam pembacaan hasil uji reaksi sitrat (+) akan menghasilkan reaksi alkaline dan mengubah warna media dari hijau menjadi biru dan untuk reaksi citrate (-) tidak terjadi perubahan warna pada media (Lampiran 13).
5. Uji Lysine Iron Agar (LIA)
Media LIA digunakan untuk melihat kemampuan bakteri dalam mendekarboxylase lysine yang ada pada agar/media. Reaksi lysine dekarboxylase
butt berubah menjadi kuning dan H2S jika terbentuk warna hitam pada media (Lampiran 13).
6. Uji MR-VP
Pengujian MR-VP dilakukan untuk membedakan kelompok coli-aerogenes dan membedakan antara dua jalur fermentasi glukosa yaitu the mixed acid dan butanediol atau fermentasi butylenes glycol. Media MR-VP merupakan media cair (liquid). Dalam uji MR-VP adalah inokulasikan bakteri secara aseptis kedalam media MR-VP. Inokulasi dilakukan dengan menggunakan ose steril kemudian dicampurkan pada media MR-VP. Selanjutnya diinkubasi dalam suhu ruang. Proses inokulasi media harus dilakukan dalam kondisi aseptis.
Dalam pembacaan hasil uji MR, setelah diinkubasi pindahkan 1 ml untuk pengujian MR, tambahkan 5 tetes Methyl red pada media. Reaksi positif (pH < 4) jika media berwarna merah, positif lemah (pH <5,3 tapi > 4,4) jika media berwarna merah-orange (Lampiran 16).
Pembacaan uji VP, Tambahkan ± 12 tetes �-napthol dan 5 tetes KOH kedalam 1 ml media yang telah diinkubasi kemudian diaduk hingga rata. Jika tidak ada perubahan biarkan selama 30 menit, rekasi (+) jika warna pink menjadi
merah dan reaksi (-) jika tidak terjadi perubahan warna yang signifikan (Lampiran 13).
8. Uji TSIA
reaksi. Pengujian TSIA adalah inokulasi media dengan menggunakan ose steril, pertama dengan menusuk (butt) dasar media dan kemudian melakukan streak
keatas didaerah miring (slant) agar. Inkubasi media sesuai dengan suhu ruangan. Pembacaan hasil meliputi daerah butt dan slant. Reaksi acid apabila warna media berubah menjadi kuning. Reaksi alkaline apabila media tetap berwarna merah, pembentukan gas ditandai dengan naiknya dasar media atau media terpecah-pecah. Pembacaan H2S dilakukan apabila terbentuk warna hitam pada media (Lampiran 13).
Pengambilan Data Kualitas Air Derajat Keasaman (pH)
Nilai pH diukur dengan menggunakan pH meter, dengan cara memasukkan pH meter kedalam kolam budidaya sampai pembacaan pada alat konstan dan dibaca angka yang tertera pada pH meter tersebut (Lampiran 2). Suhu (oC)
Suhu diukur menggunakan thermometer air raksa yang dimasukkan kedalam sampel air selama lebih kurang 3 menit. Kemudian dibaca skala pada thermometer tersebut (Lampiran 2).
DO (Dissolved Oxygen)
Kedalaman
Pengambilan data kedalaman kolam dengan cara wawancara langsung dengan pemilik kolam.
Kecerahan
Pengambilan data kecerahan dengan menggunakan secchi disk, yaitu dengan meletakkan secchi disk dan melihat sampai kedalaman berapa warna putih pada secchi disk terlihat.
Identifikasi Bakteri
Referensi untuk identifikasi bakteri dengan menggunakan buku “Manual for the Identification of Medical Bacteria” Cowaan and Steels (1974), “Bergey’s Manual Determinative Bacteriology” oleh Holt dkk (1994) dan “Bacterial from Fish and Other Aquatic Animals” oleh N.B. Buller (2004).
Analisis Data
Lesi pada badan ikan
Sirip ekor patah Lendir
Lesi pada sirip dada
HASIL DAN PEMBAHASAN
Hasil
Ikan Terserang Penyakit
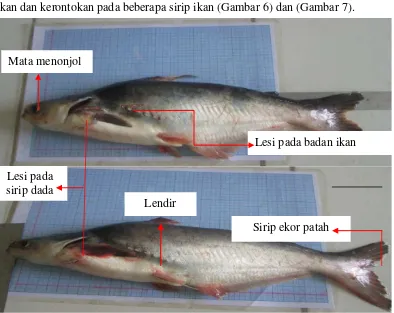
Ikan yang terserang penyakit biasanya ditandai dengan adanya perubahan tingkah laku pada ikan, seperti kurangnya nafsu makan, berenang dipermukaan dan pinggir-pinggir kolam serta kurangnya keseimbangan berenang. Gejala klinis pada ikan dapat dilihat adanya perubahan pada organ luar dan organ dalam tubuh ikan, perubahan tersebut merupakan langkah awal untuk mengetahui kondisi ikan budidaya yang sakit atau sedang sakit. Gejala klinis pada organ luar tubuh ikan biasanya ditandai dengan warna tubuh ikan menjadi merah dan lama-kelamaan menyebabkan luka yang besar, terdapatnya lendir yang berlebihan pada tubuh ikan dan kerontokan pada beberapa sirip ikan (Gambar 6) dan (Gambar 7).
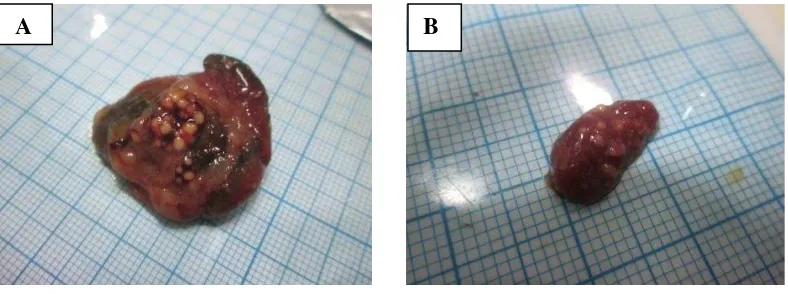
Pada pemeriksaan organ dalam ikan uji terjadi gejala klinis seperti pada hati dan ginjal ikan. Hati dan ginjal ikan mengalami perubahan warna menjadi pucat, terdapat bintik-bintik kuning dan mengeluarkan bau yang tidak sedap dan terlihat tidak sedap (Gambar 8). Menurut Sudheesh dan Xu (2001), terjadinya penyakit sangat berkaitan dengan faktor-faktor patogenisitas bakteri, percepatan perkembangbiakan patogen, maupun faktor pertahanan inang dalam melawan patogen. Bakteri yang mampu bertahan tersebut akan masuk kedalam aliran darah sehingga menyebar keseluruh sel tubuh inang maupun menuju organ target.
Gambar 7. Ikan patin yang terserang penyakit dari organ luar tubuh (A) Lesi pada tubuh ikan, (B) Sirip ekor ikan patah
Gambar 8. Organ dalam ikan patin yang terserang penyakit (A) Hati ikan patin, (B) Ginjal ikan patin
A B
Hasil Isolasi Bakteri dan Identifikasi Bakteri
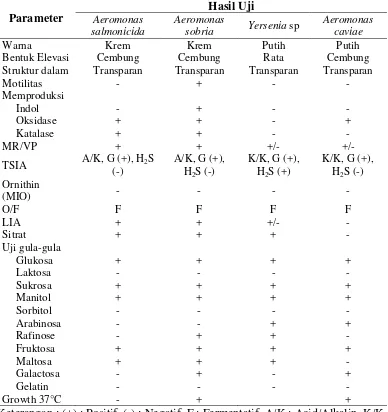
Isolasi yang dilakukan dengan melihat gejala klinis penyakit pada bagian organ dalam ikan yaitu ginjal, hati ikan dan air kolam. Dari hasil pemurnian dan identifikasi didapat tiga isolat bakteri potensial patogen yang menyerang ikan patin. Identifikasi bakteri dilakukan dengan melihat morfologi, sifat gram dan uji sifat biokimia (Tabel 1).
Tabel 1. Hasil pengamatan sel berupa pewarnaan gram dan uji biokimia bakteri patogen pada ikan patin
Parameter Bentuk Elevasi Cembung Cembung Rata Cembung Struktur dalam Transparan Transparan Transparan Transparan
Motilitas - + - -
Bakteri patogen yang terdapat pada ikan patin merupakan bakteri gram negatif dengan bentuk batang pendek. Adapun warna koloni yang dihasilkan dari setiap bakteri berbeda-beda, ada yang berwarna krem dan ada yang berwarna putih di media tumbuh TSA. Pertumbuhan bakteri juga ada yang tampak berkumpul dan ada juga yang pisah dari koloni. Hal ini disebabkan karena proses penggoresan, penggoresan tersebut bertujuan untuk membuat koloni bakteri yang digores semakin sedikit, sehingga dapat melihat adanya perbedaan warna dari masing-masing bakteri.
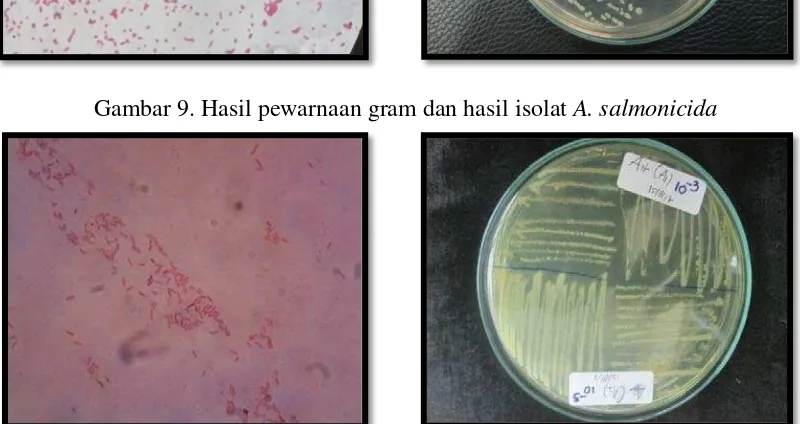
Gambar 9. Hasil pewarnaan gram dan hasil isolat A. salmonicida
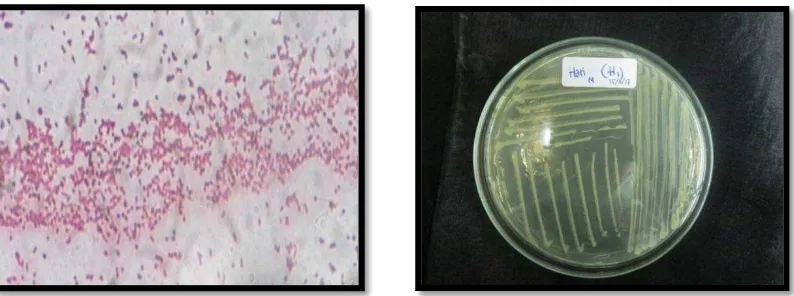
Gambar 11. Hasil pewarnaan gram dan isolat murni Yersenia spp
Gambar 12. Hasil pewarnaan gram dan isolat murni A. caviae
Kualitas Air
Kondisi lingkungan merupakan faktor yang dapat mempengaruhi kehidupan ikan pada habitatnya. Bila kondisi perairan member peluang penyakit berkembang dan menyerang ikan, sementara itu kondisi ikan lemah, maka ikan akan mudah terserang penyakit.
Tabel 2. Pengukuran data kualitas air pada kolam budidaya ikan patin (Pangasius sp) dan baku mutu budidaya ikan air tawar
No Parameter Hasil di Lapangan Baku Mutu
1 Suhu 31°C 25°C -32°C
2 pH 5.7 6.5-7.5
3 DO 4 mg/l 5 mg/l
4 Kedalaman ± 2 m -
Pembahasan
Gejala klinis ikan patin
Gejala klinis yang terlihat pada ikan patin yaitu terdapatnya luka pada tubuh ikan yang membuat permukaan tubuh ikan memerah, lendir yang sangat berlebihan dan rontoknya pada sirip ekor ikan (Gambar 6). Pada saat pengamatan dilapangan, ikan patin yang terserang penyakit menunjukan tingkah laku yang tidak normal yaitu berenang kepermukaan dan berenang dengan lambat bahkan ikan berdiam dipinggir kolam. Menurut Supriyadi (2005) menyatakan gejala umum akibat serangan bakteri antara lain gerakan ikan lemah, gerakan abnormal, produksi lendir berkurang setelah ikan yang terinfeksi mengeluarkan lendir yang berlebihan, perubahan warna tubuh menjadi lebih gelap, ikan menjadi kurus, pendarahan dan nekrosa pada tempat infeksi, luka (ulcer) pada tempat rontok pada insang dan kulit, bengkak pada perut dan mengeluarkan cairan kuning darah (dropsy), mata menonjol (exophthalmus), beberapa bakteri mampu menghasilkan tubercle atau granuloma pada bagian tubuh yang terinfeksi.
Perubahan yang terjadi pada ginjal yang terserang bakteri berupa perubahan warna (pucat), terdapat bintik-bintik kuning dan mengeluarkan bau tidak sedap sedangkan pada hati ikan juga terjadi perubahan warna (pucat) dan terdapat bintik-bintik kuning yang hampir menutupi seluruh permukaan hati ikan patin. Kordi (2004) menyatakan Jika bagian perutnya dibedah/dibelah akan terlihat perubahan warna pada organ hati, jantung, ginjal dan limfa menjadi kekuning-kuningan, kemerahan atau terjadi pendarahan.
Bakteri Gram Negatif Potensial Patogen Pada Ikan dan Air
Isolasi bakteri pada penelitian ini dilakukan untuk mendapatkan bakteri potensial patogen pada ikan patin yang sedang terserang penyakit. Hasil isolasi pada hati, ginjal ikan dan sampel air yang diambil di kolam budidaya tempat ikan hidup didapatkan 4 jenis bakteri potensial patogen yaitu Aeromonas spp (A, salmonicida, A. sobria, A. caviae) dan Yersenia sp. Bakteri-bakteri ini merupakan bakteri penyebab penyakit pada ikan patin yang menyebabkan furuncolosis dan
exophtalamia.
Aeromonas salmonicida adalah spesies bakteri Gram negatif, bakteri ini berbentuk batang, non-motil dan koloni berwarna krem transparan pada media TSA. Pada uji TSIA, bakteri menimbulkan reaksi A/K; Gas (+); H2S (-) yang berarti Acid/Alkalin dan terdapat gas serta tidak terdapat H2S. Pada uji LIA positif dan uji O/F bersifat Fermentatif dan tidak dapat tumbuh pada suhu 37°C.
Bakteri Aeromonas salmonicida pada isolasi ikan uji merupakan bakteri Gram negatif potensial patogen yang paling dominan pada ikan patin. Hal ini karena gejala klinis yang tampak pada kedua jenis ikan mengarah pada serangan
salmonicida. Organ yang paling banyak ditemukan bakteri ini adalah ginjal. Kurniawan (2012) menyatakan bakteri A. salmonicida juga dimasukkankan ke dalam kelompok bakteri gram negatif dengan ciri-ciri berbentuk batang, non motil, serta terdapat di perairan air tawar, payau, dan laut, penyebab utama penyakit pada ikan salmonid dengan penyakit yang dikenal dengan nama
furunkulosis. Tanda-tanda klinis serangan A. salmonicida antara lain adanya
hemorrhage pada otot tubuh dan bagian tubuh lainnya, jaringan subkutan seperti melepuh dan berkembang menjadi borok yang dalam (ulcerative dermatitis).
A. Salmonicida bersifat sangat patogenik, menyebabkan penyakit furunkulosis pada ikan sehingga berakibat kematian akut. Menurut Sumino, dkk (2013) menyatakan secara umum A. salmonicida merupakan bakteri penyebab utama penyakit infeksi pada ikan - ikan salmonid dengan penyakit yang dikenal dengan furunkulosis, tapi sejumlah laporan juga menunjukkan insiden infeksi pada ikan non salmonid air. Bakteri A. salmonicida umumnya menyerang ikan air tawar. Bakteri A. salmonicida dapat diisolasi dari ikan yang sakit ataupun ikan sehat yang bertindak sebagai carrier atau pembawa penyakit. Bakteri ini dapat hidup di luar hospes tergantung salinitas, pH, temperatur, dan kualitas air.
Aeromonas sobria merupakan kelompok bakteri gram negatif, berbentuk batang, motil dan koloni berwarna krem pada media TSA. Pada uji TSIA, bakteri menimbulkan reaksi A/K; Gas (+); H2S (-) yang berarti Acid/Alkalin dan terdapat gas serta tidak terdapat H2S. Pada uji LIA positif dan uji O/F bersifat Fermentatif dan dapat tumbuh pada suhu 37°C. Menurut Austin (2007) Bakteri A. sobria
komersial masih ada sebut sebagai A. sobria.A. veronii telah disebut sebagai ikan potensial patogen. Bakteri Aeromonas veronii ssp. Sobria.
Bakteri Aeromonas sobria menyebabkan terjadinya kerusakan pada permukaan tubuh ikan sampel, yang ditandai dengan warna merah dan ekor geripis. Gejala klinis dari bakteri A. sobria hampir sama dengan gejala klinis yang disebabkan oleh Aeromonas lainnya, yaitu luka borok, perut kembung serta terjadi perubahan pada ginjal, hati dan limfa ikan.
Pada ikan uji, bakteri A. sobria hanya terdapat pada 1 sampel uji ikan, yaitu hanya terdapat pada hati ikan saja. Berdasarkan tingkat patogeniknya, bakteri A. sobria berbeda dengan A. hydrophilla. Umumnya bakteri A. sobria
tidak terlalu berbahaya diperairan. Namun, jika keberadaanya diperairan sangat banyak yang disebabkan oleh banyak bahan organik diperairan serta kualitas air yang tidak baik serta kondisi ikan stress maka bisa saja bakteri ini dapat menjadi patogen pada budidaya ikan. Menurut Austin (1993) menyatakan A. sobria
merupakan bakteri patogen pada ikan. Namun, sifat patogenik ada ikan sering salah diidentifikasi, karena bakteri tersebut belum terlalu berbahaya pada organisme. Gejala pada bakteri A. sobria tidak menampilkan tanda eksternal atau internal yang terlalu ekstrim. Namun, gejala klinis yang tampak ialah terdapatnya lesi disekitaran tubuh ikan dan bahkan sirip-sirip ikan berubah menjadi busuk.
Bakteri A. sobria juga terdapat pada sampel air kolam budidaya pada pengenceran 10-3 dan 10-5. Menurut Muslim dkk (2009) menyatakan penularan bakteri ini melalui air, kontak badan, pemakaian alat yang telah tercemar atau karena alat yang digunakan untuk pemindahan ikan yang telah terserang bakteri
pembesaran ikan telah tercemar oleh penyakit, biasanya ikan yang dibudidayakan juga akan terserang oleh penyakit tersebut. Penyakit yang menyebabkan ikan sakit berupa penyakit infeksi maupun non-infeksi.
Aeromonas caviae merupakan kelompok bakteri gram negatif, berbentuk batang, motil dan koloni berwarna putih pada media TSA. Pada uji TSIA, bakteri menghasilkan reaksi K/K; Gas (+); H2S (-) yang berarti Alkalin/Alkalin dan terdapat gas. Pada uji LIA negatif dan uji O/F bersifat Fermentatif dan dapat tumbuh pada suhu 37°C.
Gejala klinis yang disebabkan bakteri Aeromonas caviae yaitu adanya luka (nekrosis) yang mengalami pembengkakkan pada kulit ikan, sirip ikan patah yang mengarah pada penyakit bacterial yaitu Aeromonas. Bakteri A. caviae pada hewan uji terdapat pada ginjal dan hati ikan di sampel ikan yang kedua. Organ ginjal dan hati mengalami nekrosis yaitu terdapatnya bintik kuning disekitaran ginjal dan hati menyebabkan organ ginjal mengalami pembengkakkan.
Yersenia sp merupakan kelompok bakteri gram negatif, berbentuk bulat, non-motil dan koloni berwarna krem pada media TSA. Pada uji TSIA, bakteri menghasilkan reaksi K/K; Gas (+) dan H2S (+) yang berarti Alkalin/Alkalin dan terdapat gas serta H2S. pada uji LIA positif lemah dan uji O/F bersifat Fermentatif.
ruckeri. Spesies ini dapat menimbulkan penyakit pada ikan-ikan jenis salmonid dan non-salmonid. Kurniawan (2012) menyatakan gejala klinis serangan Yersinia ruckeri antara lain septicemia disertai exopthalmia, ascites, hemorrhage, serta borok yang terjadi di rahang, langit-langit rongga mulut, insang, dan operculum.
Hemorrhage terjadi pada jaringan otot dan permukaan serosal intestinum, pembengkakan pada limpa dan ginjal. Pada sejumlah kasus ERM, dari muara pengeluaran sering keluar cairan kuning saat perut ditekan, serta necrosis terjadi pada jaringan hati, ginjal dan limpa. Menurut Hatmanti (2003) menyatakan
Yersinia sp. merupakan salah satu bakteri yang awalnya bukan termasuk patogen, namun pada suatu saat apabila kondisi lingkungan memungkinkan dapat pula menyebabkan penyakit.
Kualitas Air
Kualitas air merupakan salah satu faktor yang mempengaruhi timbulnya penyakit pada ikan, karena penyakit muncul dari interaksi antara inang, pathogen dan lingkungan. Kualitas air yang berada diluar kisaran optimum kebutuhan hidup ikan akan menyebabkan ikan mengalami stress, sehingga akibatnya ikan lebih mudah terserang penyakit.
makan sehingga pertumbuhannya terhambat, sebalikya bila suhu terlalu tinggi ikan akan stress bahkan mati kekurangan oksigen.
Derajat keasaman (pH) merupakan parameter kualitas air yang berkaitan dengan konsentrasi ion Hidrogen. Bila nilai pH rendah (bersifat asam) berarti air mengandung banyak ion H yang dapat mematikan makhluk hidup dalam air. Pada hasil pengukuran dilapangan, nilai pH pada kolam budidaya yaitu 5,7 yaitu kondisi air kolam berada pada sifat asam (Lampiran 2).
Pada saat pengambilan data pH, kondisi lingkungan sedang berada pada musim hujan. Hal tersebut yang membuat kondisi air bersifat asam. Minggawati dan Saptono (2012) menyatakan bahwa kualitas air yang biak untuk budidaya ikan patin adalah suhu air berkisar 25-33°C, pH air 6.5-9.0 dengan optimal 7-8.5. Barus (2004) menyatakan Nilai pH yang ideal bagi kehidupan organisme air pada umumnya terdapat antara 7-8.5. Kondisi perairan yanh bersifat asam ataupun basa sangat membahayakan kelangsungan hidup organisme. Penurunan pH disebabkan oleh adanya hujan asam, akibat yang ditimbulkan oleh hujan asam pada organisme yaitu ikan menjadi stres.
Oksigen terlarut merupakan suatu faktor yang sangat penting di dalam ekosistem air, terutama sekali dibutuhkan dalam proses respirasi. Menurut Zonneveld dkk (1991) kebutuhan oksigen mempunyai dua aspek, yaitu kebutuhan lingkungan bagi spesies tertentu dan kebutuhan konsumtif yang tergantung pada keadaan metabolisme ikan.
menyatakan beberapa jenis ikan mampu bertahan hidup pada perairan dengan konsentrasi 3 ppm, namum konsentrasi minimum yang masih dapat diterima sebagian besar spesies ikan untuk hidup dengan baik adalah 5 pmm. Pada perairan dengan konsentrasi oksigen dibawah 4 ppm ikan masih mampu bertahan hidup, akan tetapi nafsu makan ikan mulai menurun.
Kedalaman dan kecerahan merupakan sebagian cahaya yang diteruskan ke dalam air dan dinyatakan dengan persen, dari beberapa panjang gelombang. Dengan mengetahui kecerahan suatu perairan, kita dapat mengetahui sampai dimana masih ada kemungkinan terjadi proses asmilasi dalam air. Kecerahan sangat dipengaruhi oleh kedalaman, semakin curam suatu perairan maka intesitas cahaya yang akan diterima semakin sedikit dan sebaliknya.
Pada kolam budidaya ikan patin, kedalaman kolam budidaya ± 2 m dengan kecerahan 90 cm. Kecerahan kolam budidaya ikan patin termasuk kategori baik yang sesuai dengan baku mutu budidaya ikan air tawar. Barus (2004) faktor cahaya matahari yang masuk ke dalam air akan mempengaruhi sifat-sifat optis dari air. Dengan bertambahnya kedalaman lapisan air intensitas cahaya tersebut akan mengalami perubahan yang signifikan baik secara kualitatif maupun kuantitatif. Bagi organisme air, intensitas cahaya berfungsi sebagai alat orientasi yang akan mendukung kehidupan organisme tersebut dalam habitatnya. Apabila intensitas cahaya matahari berkurang, hewan akan merangsang ke permukaan perairan untuk mendapat cahaya yang cukup bagi kehidupan ikan.
ikan budidaya baik langsung maupun tidak langsung. Air yang sangat keruh tidak dapat digunakan untuk kegiatan budi daya ikan, karena air yang keruh dapat menyebabkan rendahnya kemampuan daya ikat oksigen, berkurangnya batas pandang ikan, selera makan ikan berkurang, sehingga efisiensi pakan rendah; serta ikan sulit bernafas karena insangnya tertutup oleh partikel-partikel lumpur. Gusrina (2008) menyatakan kekeruhan air juga akan menghalangi ikan dalam mencari makanan, menyebabkan kerusakan insang dan stress pada ikan.Jika tingkat kekeruhan terlalu tinggi, kegiatan fotosintesis akan terhambat dan secara signifikan akan menurunkan kandungan oksigen terlarut di perairan.
Rekomendasi pengelolaan dalam budidaya ikan patin meliputi pencegahan dan penanganan. Tindakan pencegahan dapat berupa secara mekanik, yaitu dengan bantuan mekanik berbagai peralatan. Tindakan secara kimiawi yaitu dengan memanfaatkan berbagai senyawa kimia berupa Methylen Blue, garam, Kalium permangat, antibiotik. Tindakan secara biologi berupa penggunaan prinsip-prinsip biologi atau organisme lain, yaitu ekstraksi, probiotik.
KESIMPULAN DAN SARAN
Kesimpulan
Kesimpulan dari penelitian ini adalah sebagai berikut :
1. Terdapat 4 jenis bakteri potensial patogen pada ikan patin (Pangasius sp) di Kolam Budidaya Ikan Air Tawar Kota Beling Tanah Air yaitu Aeromonas salmonicida, Aeromonas sobria, Aeromonas caviae dan Yersenia sp.
2. Bakteri patogen yang paling dominan pada ikan patin yaitu jenis Aeromonas salmonicida yang terdapat pada ginjal dan hati ikan patin yang ditanam pada media TSA.
Saran
Setelah ditemukannya penyakit pada bakterial pada ikan patin (P. pangasius), perlu dilakukan penelitian untuk mencegah penyakit bakterial ini