BAB 2
TINJAUAN PUSTAKA
2.1Sekam Padi
Sekam padi merupakan salah satu limbah pertanian yang paling banyak ditemukan di
seluruh negara penghasil beras. Sekitar 600 juta ton padi dihasilkan setiap tahun dan
20% di dalamnya adalah sekam padi yaitu sekitar 120 juta ton (Giddel, et al., 2007).
Komposisi kimia sekam padi sangat bervariasi, hal ini disebabkan karena
perbedaan jenis padi, iklim dan kondisi geografis pada tempat padi diperoleh. Namun
secara umum komposisi kimia sekam padi yaitu, silikon terhidrasi dan
material-material organik seperti selulosa (sebanyak 55-60%, termasuk selulosa dan
hemiselulosa), dan 22% lignin (Muthadi, et al., 2007). Menurut Muthadi et al., (2007),
komposisi kimia dari dari sekam padi setelah dianalisis dapat dilihat pada Tabel 2.1
dibawah ini:
Tabel 2.1. Komposisi Kimia Hasil Analisis Sekam Padi (Muthadi, et al., 2007)
Komposisi dan sifat sekam padi % massa
Densitas bulk (kg/m3) Kekerasan (skala Mohr)
Abu
Karbon
Hidrogen
Oksigen
Nitrogen
Sulfur
96-160
5-6
22-29
35
4-5
31-37
0.23-0.32
Sekam padi biasanya dibakar atau dibiarkan sebagai limbah buangan. Dengan
membakar sekam padi akan menghasilkan residu berupa abu sekam padi (Koteswara,
et al., 2006). Abu ini sangat kaya akan silika amorf karena dapat mencapai 88.32%
(Habeeb, et al., 2010). Tanaman padi banyak mengandung silika amorf karena secara
alami tanaman padi menyerap dan mengangkut silikon dalam bentuk asam silikat pada
epidermis tanaman padi (Singh, et al., 1978). Menurut Habeeb, et al., (2010),
komposisi kimia dari abu sekam padi dapat dilihat pada Tabel 2.2 dibawah ini:
Table 2.2. Komposisi Kimia Dari Abu Sekam Padi (Habeeb, et al., 2010)
Komposisi oksida (% massa) Abu sekam padi
SiO2
Tingginya kadar silika dalam abu sekam padi memungkinkan untuk
memisahkannya dengan cara ekstraksi pada temperatur rendah dan energi yang kecil
(Thuadaij, et al., 2008). Proses pengarangan sekam padi juga mempengaruhi silika
yang diperoleh, dimana semakin tinggi temperatur pada proses pengarangan sekam
dalam oven maka akan diperoleh kemurnian SiO2 yang makin tinggi (Hwang, et al.,
1989).
2.2 Silika (SiO2)
Silika (silicon dioxide) merupakan senyawa kimia dengan rumus molekul SiO2 yang
dapat diperoleh dari silika mineral, nabati dan sintesis Kristal. Silika mineral adalah
senyawa yang banyak mengandung SiO2 yang ditemukan dalam bahan tambang dan
bahan galian yang berupa mineral seperti pasir kuarsa, granit, dan fledspar (Kalapathy,
Silika yang terdapat dalam tanaman ditemui pada sekam padi dan tongkol jagung.
Silika yang berasal dari tumbuhan yang umumnya digunakan saat ini adalah silika
sekam padi Silika juga dapat dibentuk dengan cara mereaksikan silikon dengan
oksigen atau udara pada suhu tinggi (Iler, 1979).
Dalam mendapatkan silika dari sekam padi dapat dilakukan menggunakan
metode ekstraksi alkalis (Kalapathy et al, 2000) dan metode pengabuan. Silika yang
diperoleh melalui metode ekstraksi alkalis adalah berupa larutan sol dimana silika
pada fase larutan adalah fase amorf. Sedangkan pada metode pengabuan, sekam padi
dibakar pada suhu diatas 200°C selama 1 jam untuk mendapatkan arang sekam padi
yang berwarna hitam (Haslinawati et al., 2011).
Pada umumnya silka adalah dalam bentuk amorf terhidrat, namun bila
pembakaran berlangsung terus-menerus pada suhu diatas 650°C maka tingkat
kristalinitasnya akan cenderung naik dengan terbentuknya fasa quartz, crystobalite,
dan tridymite. Bentuk struktur quartz, crystobalite, dan tridymite yang merupakan
jenis kristal utama silika memiliki stabilitas dan kerapatan yang berbeda (Brindley dan
Brown, 1980). Struktur Kristal quartz, crystobalite, dan tridymite memiliki nilai
densitas masing-masing sebesar 2,65×103 kg/m3, 2,27×103 kg/m3, dan 2,23×103 kg/m3. Berdasarkan perlakuan termal, pada suhu < 570°C terbentuk low quartz, untuk suhu
570-870°C terbentuk high quartz yang mengalami perubahan struktur menjadi
crystobalite dan tridymite, sedangkan pada suhu 870-1470°C terbentuk high tridymite,
pada suhu ˃ 1470°C terbentuk high crystobalite, dan pada suhu 1723°C terbentuk
silika cair (Smallman and Bishop 2000).
2.2.1 Sifat fisika dan kimia silika 2.2.1.1 Sifat fisika silika
Silika dalam bentuk amorf memiliki densitas sebesar 2,21 g/cm3 dengan modulus elastisitas sebesar 10×106 psi. Kandungan unsur silikon (Si) dan oksigen (O) pada silika jenis ini adalah 46,7% dan 53,3%. Nilai kekerasan material ini pada pembebanan
tegak lurus dengan menggunakan indentor intan (metode Vickers atau Knoop) sebesar
2.2.1.2 Sifat Kimia Silika
Silika cenderung tidak reaktif terhadap Cl2, H2, asam, dan kebanyakan logam pada
kondisi normal atau suhu normal, tetapi mudah bereaksi dengan fluorin, HF encer,
alkali hidroksida, dan karbonat (Cotton, et al., 1976). Berikut ini dapat diketahui sifat
kimianya melalui reaksi dengan asam dan basa.
2.2.1.2.1 Reaksi dengan Asam
Silika relatif tidak reaktif terhadap asam kecuali asam hidrofluorida seperti reaksi
berikut:
SiO2(s) + 4HF(aq) SiF4(aq) + 2H2O(l)
Dalam asam hidrofluorida berlebih reaksinya menjadi:
SiO2(s) + 6HF(aq) H2[SiF6](aq) + 2H2O(l) (Basset, et al., 1989)
2.2.1.2.2 Reaksi dengan Basa
Silika dapat bereaksi dengan basa, terutama dengan basa kuat, seperti hidroksida
alkali.
SiO2(s) + 2NaOH(aq) Na2SiO3(aq) + H2O(l) (Basset, et al., 1989)
Secara komersial, silika dibuat dengan mencampurkan larutan natrium silikat dengan
suatu asam mineral. Reaksi ini menghasilkan suatu dispers peka yang akhirnya
memisahkan partikel dari silikat terhidrat, yang dikenal dengan silika hidrosol atau
asam silikat yang kemudian dikeringkan pada suhu 110oC agar terbentuk silika gel. Reaksi yang terjadi sebagai berikut:
Na2SiO3(aq) + 2 HCl(aq) H2SiO3(l) + NaCl(aq)
2.3 Magnesium Silikat
Magnesium silikat terdiri dari dua bahan baku utama yaitu magnesium oksida
(MgO) dan silika (SiO2) yang berbentuk bubuk (powder) putih, amorf, tidak berbau
dan tidak larut dalam air namun sangat mudah larut dalam HF (merck index, 2001).
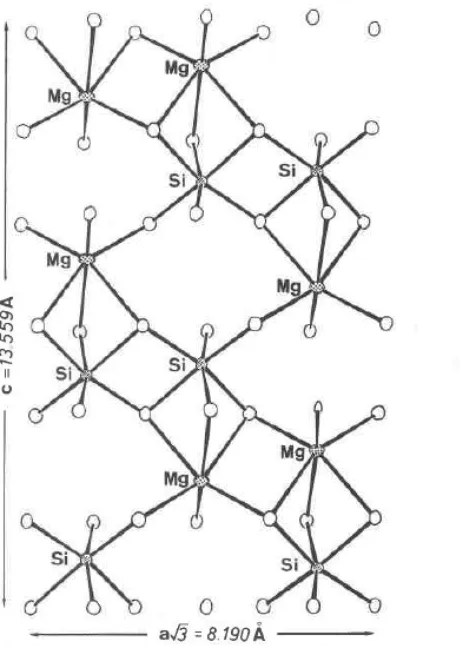
Berikut Gambar 2.1 adalah struktur perspektif mineral magnesium silikat:
Gambar 2.1 Struktur Perspektif Magnesium Silikat (Johnson, l97l).
Magnesium silikat terdapat di alam sebagai mineral, Seperti clonoenstantite,
enstantite dan protoenstantite (merck index, 2001). Rasio molekul magnesium silikat
dan perlakuan temperatur berperan penting dalam pembentukan komposit magnesium
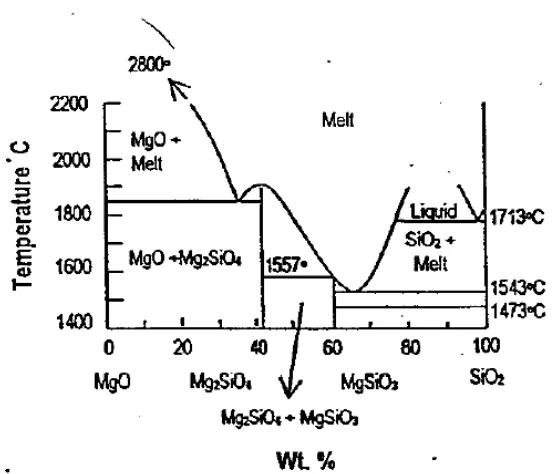
Gambar 2.2 Diagram Fasa Komposit Magnesium Silikat (Sumarnadi, 1998)
Pada Gambar 2.2 menunjukkan bahwa MgO dan SiO2 hanya akan membentuk
anhydrous silicate yaitu forsterite (Mg2SiO4) dan enstantie (MgSiO3). Kedua
anhydrous silicate tersebut adalah fasa yang stabil dalam sistem MgSiO3. Selama
berlangsungnya proses sintering/kalsinasi, fosteritisasi berlangsung melalui tahap
dehidrasi, reorganisasi kation, pembentukan forsterite dan enstantite. Pada tahap
dehidrasi, terjadi pelepasan gugus hidroksil dan pembentukan fasa oksida dimana
serpentinit dan magnesit terurai menjadi MgO dan SiO2. Pada tahap reorganisasi
kation, terjadi pemisahan kation seiring meningkatnya suhu sintering dan pada fasa
stabil MgSiO3 membentuk forsterite dan sedikit enstantite sedangkan MgO yang
berlebih akan membentuk periclase (Sumarnadi, dkk., 1998).
Magnesium silikat memiliki konduktivitas termal 2,6 Wm-1K-1 dan ekspansi termal 7,8×10-6 K-1 artinya memiliki ketahanan terhadap suhu tinggi sehingga dapat digunakan sebagai isolator suhu tinggi. Magnesium silikat juga memiliki luas
permukaan 612 m2/g dan densitas 2,90 g/cm3 (Sumarnadi, dkk., 1998) yang dapat diaplikasikan sebagai bahan katalis. MgSiO3 dapat dibuat dengan metode sol-gel.
Metode sol-gel adalah metode untuk mendapatkan padatan yang homogen dengan cara
pembentukan suspensi koloid yang berbentuk gel melalui proses gelasi sol pada suhu
ruang (Ni et al., 2007; Kharaziha, et al., 2010) yang tidak membutuhkan suhu tinggi
2.4 Asam Oleat
Asam oleat merupakan senyawa organik jenis asam lemak bebas yang tidak
jenuh yang disebabkan oleh adanya satu ikatan rangkap pada atom C-9. Dapat dibuat
dengan menghidrolisa lemak atau minyak lemak yang dipisahkan dengan cara
pemerasan.
Asam oleat ini sukar larut dalam air namun mudah larut dalam eter dan
alkohol, titik leburnya 15,3oC dan titik didihnya 360oC. Gambar 2.2 berikut adalah struktur dari asam oleat.
OH O
gugus hidrofobik
gugus hidrofilik
Gambar 2.2 Struktur Asam Oleat.
2.5 Material nanopartikel
Material nanopartikel dapat didefenisikan sebagai dispersi partikulat atau partikel
padat yang memiliki ukuran partikel antara 10-100 nm (Mohanraj, et al., 2006).
Material nanopartikel telah banyak menarik peneliti karena material nanopartikel
menunjukkan sifat fisika dan kimia yang sangat berbeda dari bulk materialnya, seperti
kekuatan mekanik, elektronik, magnetik, kestabilan termal, katalitik dan optik.
Ada dua hal utama yang membuat nanopartikel berbeda dengan material
sejenis dalam ukuran besar (bulk) yaitu: (a) Ukurannya yang kecil, nanopartikel
memiliki nilai perbandingan antara luas permukaan dan volume yang lebih besar jika
dibandingkan dengan partikel sejenis dalam ukuran besar. Ini membuat nanopartikel
bersifat lebih reaktif. Reaktivitas material ditentukan oleh atom-atom di permukaan,
karena hanya atom-atom tersebut yang bersentuhan langsung dengan material lain. (b)
Ketika ukuran partikel menuju orde nanometer, hukum fisika yang berlaku lebih
Material nanopartikel ini telah banyak digunakan dalam berbagai bidang.
Tetapi dewasa ini material nanopartikel telah banyak digunakan dalam bidang medis
yang berperan sebagai sistem drug delivery. Keuntungan dari menggunakan material
nanopartikel sebagai sistem drug delivery adalah: pertama, Ukuran partikel dan
karakteristik permukaannya dapat dengan mudah dimanipulasi untuk mendapatkan
kedua target sistem drug baik yang pasif maupun yang aktif. Kedua, material
nanopartikel ini dapat mengontrol pelepasan drug pada saat penghantaran maupun
pada saat penempatannya. Ketiga, pelepasan yang terjadi dan karakteristik degradasi
dapat dengan mudah dimodulasikan melalui pemilihan konstituen matriksnya
(Mohanraj, et al., 2006).
2.6. Karakterisasi Material
2.6.1. Metode Adsorpsi Brunauer-Emmet-Teller (BET)
Teori BET adsorpsi multilayer untuk menentukan luas permukaan (S) dikembangkan
oleh Brunauer, Emmet dan Teller. Proses adsorpsi digambarkan sebagai proses lapisan
dengan lapisan (Layer-by-layer), permukaan secara energetik dianggap homogen,
medan adsorpsi sama dalam setiap tempat permukaan, serta proses adsorpsi dianggap
tidak bergerak (setiap molekul yang diadsorpsi pada sisi dasar permukaan). Lapisan
pertama molekul yang diadsorpsi memiliki energi interaksi dengan medan adsorps
(Ea0) dan interaksi vertikal antara molekul setelah lapisan pertama (EL0) sama terhadap
panas liqufaksi adsorbat dan molekul yang diadsorpsi tidak berinteraksi secara
menyamping (Roque-Malherbe, 2007).
Metode BET tidak tepat untuk perhitungan mikropori, karena ketika metode
ini diterapkan pada adsorben mikro maka akan terjadi penyerapan pada tekanan yang
relatif rendah sehingga memungkinkan volume monolayer yang dihitung lebih dari
satu lapisan terserap. Jika nilai ini diubah menjadi luas permukaan BET maka nilai
yang dihasilkan akan lebih besar dari nilai yang sebenarnya. Meskipun metode BET
tidak menggambarkan keadaan yang sebenarnya, namum metode ini yang lebih umum
digunakan untuk analisa isotherm adsorbsi. Ini disebabkan metode BET relatif
sederhana dan dianggap memberikan kapasitas adsorpsi yang baik dari adsorben yang
Untuk menentukan luas permukaan, didasarkan dari data isoterm physorption,
menggunakan persamaan BET berikut ini:
�
monolayer dan C adalah konstanta tergantung bentuk isoterm. Karena kapasitas
monolayer ��� dapat ditentukan maka luas permukaan S dapat dihitung dengan
persamaan:
S=��� .�.��
Dimana L (bilangan avogadro) dan �� adalah luas rata-rata yang dilewati molekul
adsorbat pada monolayer, untuk N2= 0,162 nm2 pada 77K.
2.6.2. Metode Barret-Joyner-Halenda (BJH)
Metode BJH digunakan untuk menentukan distribusi ukuran pori / particle size
distribution (PSD). Tekanan relatif awal proses desorpsi dalam metode
Barret-Joyner-Halenda (BJH) berlangsung pada range 0,9 < P/Po < 0,95 dan semua pori telah diisi
fluida adsorbat. Pada tahap pertama (j=1) dalam proses desorpsi hanya melibatkan
pemindahan kondensasi kapiler. Tahap berikutnya melibatkan pemindahan kondensat
dari inti pori dan penipisan multilayer dalam pori yang lebih besar (misalnya pori telah
siap dikosongkan dari kondesat).
Distribusi ukuran pori Barret-Joyner-Halenda (BJH-PSD) dapat dihitung
Keterangan :
Vpn : volume pori pada berbagai tekanan relatif rp : jari-jari pori
rk : jari-jari inti
∆� : perubahan volume pada berbagai tekanan relatif
∆� : ketebalan lapisan yang diserap
Ac : area terbuka pori yang kosong (Roque-Malherbe, 2007).
2.6.3 Spektroskopi Difraksi Sinar-X (XRD)
Spektroskopi difraksi sinar-x (X-Ray diffraction / XRD) merupakan salah satu metode
karakterisasi material. Teknik ini digunakan untuk mengidentifikasi fasa kristalin
dalam material dengan cara menentukan parameter struktur kisi serta untuk
mendapatkaan ukuran partikel. Difraksi sinar-x terjadi pada hamburan elastis
foton-foton sinar-x oleh atom dalam sebuah kisi periodik. Hamburan monokromatis sinar x
dalam fasa tersebut memberikan interferensi yang konstruktif. Dasar penggunaan
difraksi sinar-x untuk mempelajari kisi Kristal adalah berdasarkan persamaan Bragg
(Cullity, 1978):
n.λ = 2.d.sin θ ; n =1,2,…
dengan; λ adalah panjang gelombang sinar-x yang digunakan, d adalah jarak antara
dua bidang kisi, θ adalah sudut antara sinar datang dengan bidang normal, n adalah
bilangan bulat yang disebut sebagai orde pembiasan.
Berdasarkan persamaan Bragg, ketika seberkas sinar-x menumbuk sampel
kristal, maka bidang kristal itu akan mendifraksi sinar-x yang memiliki panjang
gelombang sama dengan jarak antar kisi dalam kristal. Semakin banyak jumlah
elektron yang terdapat disekeliling atom pada suatu bidang, makin besar intensitas
pantulan yang disebabkan oleh bidang tersebut dan menyebabkan makin jelas spot
yang terekam pada film. Dengan menggunakan metoda yang dikenal dengan nama
metoda sintesis Fourier, kita dapat menghubungkan intensitas spot dengan kepekatan
distribusi elektron yang terdapat dalam unit sel. Dengan mengamati kepekatan
distribusi elektron dalam unit sel, kita dapat menduga letak atom dalam unit sel
tersebut. Atom akan terletak pada daerah-daerah yang mempunyai kepekatan distribusi
2.6.4 Fourier Transform Infra-Red (FTIR)
Fourier Transform Infra-Red (FTIR) Spectroscopy merupakan alat yang dipergunakan
untuk menganalisis secara kuantitatif maupun kualitatif berdasarkan gugus fungsi
yang ada dengan menggunakan standar.
Prinsip dasar spektroskopi inframerah yaitu interaksi antara vibrasi atom-atom
yang berikatan/gugus fungsi dalam molekul yang mengadsorbsi radiasi gelombang
elektromagnetik inframerah. Adsorbsi terhadap radiasi inframerah dapat menyebabkan
eksitasi energi vibrasi molekul ke tingkat energi vibrasi yang lebih tinggi. Untuk dapat
mengadsorbsi, molekul harus mempunyai perubahan momen dipole sebagai akibat
dari vibrasi. Daerah radiasi spektroskopi inframerah berkisar pada bilangan
gelombang 12800-10 cm-1. Umumnya daerah radiasi inframerah terbagi dalam daerah inframerah dekat (12800-4000 cm-1), daerah inframerah tengah (4000-200 cm-1), daerah inframerah jauh (200-10 cm-1). Daerah yang paling banyak digunakan adalah daerah inframerah tengah 4000-690 cm-1 (Khopkar, 2008).
Instrumen yang digunakan untuk mengukur serapan radiasi inframerah pada
pelbagai panjang gelombang disebut spektrometer inframerah. Pancaran inframerah
umumnya mengacu pada bagian spekturm elektromagnet yang terletak diantara daerah
tampak dan daerah gelombang mikro. Pancaran inframerah yang kerapatannya kurang
daripada 100 cm-1 (panjang gelombang lebih dari 100 µm) diserap oleh sebuah molekul organik dan diubah menjadi energi putaran molekul. Penyerapan itu tercatat
dan demikian spekturm rotasi molekul terdiri dari garis-garis tersendiri (Hartomo,
1986).
Terdapat dua macam vibrasi molekul, yaitu vibrasi ulur (stretching) dan vibrasi
tekuk (bending). Vibrasi ulur adalah suatu gerakan berirama di sepanjang sumbu
ikatan sehingga jarak antar atom bertambah atau berkurang. Vibrasi tekuk dapat terjadi
karena perubahan sudut-sudut ikatan antara ikatan-ikatan pada sebuah atom atau
karena gerakan sebuah gugusan. Contoh liukan (twisting), goyangan (rocking), dan
getaran punter (torsional) yang menyangkut perubahan sudut-sudut ikatan dengan
acuan seperangkat koordinat yang disusun arbiter dalam molekul. Hanya vibrasi yang
menghasilkan perubahan momen dwi kutub secara berirama saja yang teramati di
dalam inframerah. (Silverstein, et al., 1991).
Identifikasi pita adsorbsi khas yang disebabkan oleh berbagai gugus fungsi
merupakan dasar penafsiran spekturm inframerah (Creshwell, 1972). Hadirnya sebuah
puncak serapan dalam daerah gugus fungsi dalam sebuah spekturm inframerah hampir
selalu merupakan petunjuk pasti bahwa beberapa gugus fungsi tertentu terdapat pada
senyawa cuplikan. Demikian pula, tidak adanya puncak dalam bagian tertentu dari
daerah gugus fungsi sebuah spectrum inframerah biasanya berarti bahwa gugus
tersebut yang menyerap pada daerah itu tidak ada (Pine, 1998). Senyawa silikon dapat
diamati melalui spektroskopi inframerah ini. Vibrasi untuk ikatan Si-H termasuk
vibrasi ulur dan vibrasi tekuk diabsorbsi pada daerah 2200 cm-1 dan 800-950 cm-1. Frekuensi vibrasi ulur dapat meningkat dengan adanya suatu gugus yang
elektronegatif pada silikon sementara gugus OH dari SiOH diabsorbsi pada daerah