BAB II
TINJAUAN PUSTAKA 2.1 Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh, morfologi tumbuhan,
sistematika tumbuhan, nama asing, nama daerah, kandungan kimia dan kegunaan
dari tumbuhan.
2.1.1 Daerah tumbuh
Kangkung dapat tumbuh dan berproduksi dengan baik di dataran rendah
sampai dataran tinggi (pegunungan) ± 2000 meter dari permukaan laut. Baik
kangkung darat maupun kangkung air, keduanya dapat tumbuh di mana saja, baik
di dataran rendah maupun di dataran tinggi (Nazaruddin, 1993).
2.1.2 Morfologi tumbuhan
Batang kangkung bulat dan berlubang, berbuku-buku, banyak
mengandung air dan dari buku-bukunya mudah sekali keluar akar. Memiliki
percabangan yang banyak dan setelah tumbuh lama batangnya akan menjalar
(Djuariah, 2007). Kangkung memiliki tangkai daun melekat pada buku-buku
batang dan di ketiak daunnya terdapat mata tunas yang dapat tumbuh menjadi
percabangan baru. Bentuk daun umumnya runcing ataupun tumpul, permukaan
daun sebelah atas berwarna hijau tua, dan permukaan daun bagian bawah berwarna
hijau muda. Bentuk bunga kangkung umumnya berbentuk terompet dan daun
mahkota bunga berwarna putih atau merah lembayung (Suratman et al., 2000).
Perbedaan mendasar antara kangkung darat dan kangkung air (Dibyantoro,
a. Warna bunga.
Kangkung air berbunga putih kemerah-merahan, sedangkan kangkung darat
bunga putih bersih.
b. Bentuk daun dan batang.
Kangkung air berbatang dan berdaun lebih besar dari pada kangkung darat.
Warna batang keduanya berbeda. Kangkung air berbatang hijau, sedangkan
kangkung darat putih kehijau-hijauan.
c. Kebiasaan berbiji.
Kangkung darat lebih banyak berbiji dari pada kangkung air.Itu sebabnya
kangkung darat diperbanyak lewat biji, sedangkan kangkung air dengan stek
pucuk batang.
2.1.3 Nama asing
Ka ngkong, Swa mp Ca bba ge, Wa ter Convolvulus, Wa ter Spina ch, Chinese
Wa ter Spina ch, Patate aquatique, Espinaca aquatica (Spanyol), Karamta Liseron
d’Eau (Perancis), Nilkamli, (India, Bangladesh), Mr ibawa Ziwa (Kenya, Tanzania)
(Dibyantoro, 1996).
2.1.4 Nama daerah
Rumpun (Aceh), Kangkong (Madura), Pangpung (Bali), Lara (Nusa Tenggara), Kanto (Gorontalo), Namiri (Makassar), Lare (Bugis), Kako
(Halmahera), Kangko (Tidore) (Depkes RI, 2001).
2.1.5 Sistematika tumbuhan
Sistematika tumbuhan (Depkes RI, 2001) adalah sebagai berikut:
Kingdom : Plantae
Sub divisi : Angiospermae
Kelas : Dicotyledoneae
Ordo : Solanales
Suku : Convolvulaceae
Genus : Ipomoea
Spesies : Ipomoea aquatica Forsk.
Ipomoea repta ns Poir.
2.1.6 Kandungan kimia
Herba kangkung mengandung senyawa metabolit sekunder seperti saponin,
flavonoida dan polifenol (Depkes RI, 2001).
2.1.7 Kegunaan
Daun kangkung berkhasiat sebagai obat penenang dan obat sukar tidur
(Depkes RI, 2001).
2.2 Ketinggian Daerah
Berdasarkan ketinggian tempatnya, maka wilayah lingkungan terbagi menjadi
3 (Sutarya, et al., 1995), yaitu:
1. Dataran rendah, merupakan daerah pantai sampai daerah dengan ketinggian
200 m dari permukaan laut. Suhu maksimum berada diantara 27-30° C, dan
suhu pada malam hari berada diantara 22-25° C. Jenis tanah sebahagian besar
merupakan tanah alluvial dan latosol.
2. Dataran tinggi, merupakan daerah dengan ketinggian diatas 700 m dari
permukaan laut. Dari ketinggian tersebut, suhu rata-rata akan berkurang 1°C
rata-rata 24°C dan suhu pada malam hari 15°C. Intensitas penyinaran lebih rendah,
dan terutama berawan pada musim hujan. Kelembapan udara relatif tinggi.
Jenis tanah sebagian besar termasuk andosol dan grumosol.
3. Dataran medium, merupakan daerah dengan ketinggian berada di antara
dataran tinggi dan dataran rendah, yaitu ketinggian 200-700 m dari
permukaan laut.
2.3 Ekstraksi
Menurut Depkes RI (2000), ada beberapa metode ekstraksi yang sering
digunakan dalam berbagai penelitian antara lain yaitu:
A. Cara dingin
1. Maserasi, adalah proses penyarian simplisia dengan cara perendaman dengan
pelarut dengan sesekali pengadukan pada temperatur kamar. Maserasi yang
dilakukan pengadukan secara terus-menerus disebut maserasi kinetik sedangkan
yang dilakukan pengulangan panambahan pelarut setelah dilakukan
penyaringan terhadap maserat pertama disebut remaserasi.
2. Perkolasi, adalah proses penyarian simplisia dengan pelarut yang selalu baru
sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur
kamar.
B. Cara panas
1. Refluks, adalah proses penyarian simplisia dengan menggunakan alat pada
temperatur titik didihnya, selama waktu tertentu dan jumlah pelarut terbatas
2. Digesti, adalah proses penyarian dengan pengadukan kontinu pada temperatur
lebih tinggi daripada temperatur ruangan, yaitu secara umum dilakukan pada
temperatur 40-50°C.
3. Soxhletasi, adalah proses penyarian dengan menggunakan pelarut yang selalu
baru, dilakukan dengan menggunakan alat soklet sehingga menjadi ekstraksi
kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infundasi, adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 15 menit.
5. Dekoktasi, adalah proses penyarian dengan menggunakan pelarut air pada
temperatur 90°C selama 30 menit.
2.4 Radikal Bebas
Istilah radikal bebas merujuk ke atom atau gugus atom apa saja yang
memiliki satu atau lebih elektron tak berpasangan. Karena jumlah elektron ganjil,
maka tidak semua elektron dapat berpasangan. Mesikpun suatu radikal bebas tidak
bermuatan positif atau negatif, spesi semacam ini sangat reaktif karena adanya
elektron yang tidak berpasangan. Suatu radikal bebas biasanya dijumpai sebagai
zat-antara yang tak dapat diisolasi usia pendek, sangat reaktif, dan berenergi
tinggi. Pada bidang kimia organik, reaksi radikal bebas umumnya digunakan
dalam halogenasi hidrokarbon dan pirolisis (Fessenden dan Fessenden, 1986)
Sifat radikal bebas yang tidak stabil menyebabkan reaksi menerima atau
memberikan elektron dengan molekul sekitarnya. Kebanyakan molekul ini bukan
radikal bebas melainkan makromolekul biologi seperti lipid, protein, asam nukleat
terbentuknya radikal bebas baru yang bereaksi lagi dengan makromolekul lain
(Weisburger, 2004).
Senyawa oksigen reaktif (SOR) berperan dalam berbagai proses biologis
alami di dalam tubuh. SOR berasal dari oksigen (O2). Berbagai proses metabolisme dalam tubuh, seperti pada rantai pernapasan , reperfusi, dan proses
oksidasi asam lemak, oksigen berperan sebagai akseptor terakhir dari elektron.
Secara fisiologis tubuh menghasilkan SOR, namun apabila radikal bebas atau
oksidan dihasilkan secara berlebihan oleh tubuh, maka bahan tersebut akanbersifat
toksik dan merusak berbagai komponen dalam tubuh, seperti DNA, lipid dan
enzim.Golongan senyawa oksigen reaktif antara lain adalah hidroksil (OH-),
superoksida (O2-), peroksidal (RO2-), asam hipoklorit (HOCl) dan hidrogen peroksida (H2O2) (Ionita, 2005).
Secara umum (Froment dan Bischoff, 1979), reaksi pembentukan radikal
bebas melalui 3 tahapan reaksi berikut :
a. Tahap inisiasi
RH + initiator → R˙ + H˙
R˙→ R˙ + O2→ ROO˙ b. Tahap propagasi
R˙ + O2 → ROO˙
ROO˙ +RH → ROOH + R˙
c. Tahap terminasi
R˙ + R˙ → RR
Tahap inisiasi adalah tahap awal pembentukan radikal-radikal bebas,
sedangkan propagasi merupakan sederatan reaksi terbentuknya radikal baru akibat
reaksi antara suatu radikal dengan senyawa lain. Pada hakikatnya, pembentukan
awal beberapa radikal bebas akan mengakibatkan perkembangbiakan
radikal-radikal bebas baru dalam suatu reaksi pengabdian-diri (self-perpetuating) yang
disebut sebagai reaksi rantai. Tahap terakhir atau terminasi adalah reaksi
memusnahkan radikal bebas atau mengubah radikal bebas menjadi stabil dan tak
reaktif (Fessenden dan Fessenden, 1986).
2.5 Antioksidan
Antioksidan adalah zat yang dalam kadar rendah bila dibandingkan dengan
bahan yang dapat dioksidasi, dapat memperlambat atau menghambat oksidasi
bahan tersebut secara signifikan (Halliwell, 2002).
Senyawa ini memiliki berat molekul kecil, tetapi mampu menginaktivasi
berkembangnya reaksi oksidasi, dengan cara mencegah terbentuknya radikal atau
dengan mengikat radikal bebas dan molekul yang sangat reaktif(Winarsi, 2007).
Menurut Kumalaningsih (2006), antioksidan tubuh dikelompokkan
menjadi 3 yakni:
1. Antioksidan primer yang berfungsi untuk mencegah pembentuk senyawa
radikal baru karena dapat merubah radikal bebas yang ada menjadi molekul
yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi.
Contohnya adalah enzim superoksida dismutase (SOD) yang berfungsi sebagai
2. Antioksidan sekunder merupakan senyawa yang berfungsi menangkap senyawa
serta mencegah terjadinya reaksi berantai. Contohnya adalah vitamin E, vitamin
C, dan betakaroten yang dapat diperoleh dari buah-buahan.
3. Antioksidan tersier merupakan senyawa yang memperbaiki kerusakan sel-sel
dan jaringan yang disebabkan radikal bebas. Contohnya enzim metionin
sulfoksidan reduktase untuk memperbaiki DNA pada inti sel.
Khasiat antioksidan untuk mencegah berbagai penyakit akibat pengaruh
oksidatif akan lebih efektif jika kita mengkonsumsi sayur-sayuran dan
buah-buahan yang kaya akan antioksidan dan berbagai jenis daripada menggunakan
antioksidan tungggal. Hal ini mungkin dikarenakan oleh adanya komponen lain
dan interaksinya dalam sayur-sayuran dan buah-buahan yang berperan secara
positif (Silalahi, 2006).
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik
atau polifenolik yang dapat berupa golongan flavonoid, kumarin, tokoferol, dan
asam-asam organik.Senyawa polifenolik dapat bereaksi sebagai pereduksi,
penangkap radikal bebas (Kumalaningsih, 2006).
2.5.1 Vitamin C
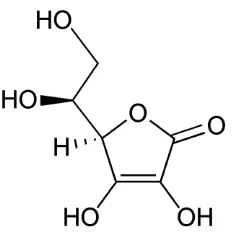
Struktur dari vitamin C (Iqbal, et al., 2004) dapat dilihat pada Gambar 2.1 berikut.
Vitamin C berhasil diisolasi untuk pertama kalinya pada tahun 1928 oleh
Albert Szent-Györgyi. Penemuan ini terjadi dikarenakan keinginan dari Albert
untuk mencoba mengidentifikasi suatu komponen yang mengikat oksigen dan
dapat mencegah kerusakan buah (Iqbal, et al., 2004).
Vitamin C atau asam askorbat mempunyai berat molekul 176,13 dengan
rumus bangun C6H8O6, dengan titik lebur 190-192°C. Asam askorbat
mengandung tidak kurang dari 99,0% C6H8O6. Pemerian: serbuk atau hablur putih
atau agak kuning, tidak berbau, rasa asam, oleh pengaruh cahaya lambat laun
menjadi gelap, dalam larutan cepat teroksidasi. Kelarutan: mudah larut dalam air,
agak sukar larut dalam etanol (95%) P, praktis tidak larut dalam kloroform P,
dalam eter P dan dalam benzen P. Penyimpanan dalam wadah tertutup rapat,
terlindung dari cahaya. Vitamin C mengandung khasiat sebagai antiskorbut
(Depkes, 1979).
Vitamin C berperan dalam mengurangi resiko hipertensi dan jantung
koroner, mencegah kanker, meningkatkan sistem kekebalan tubuh terhadap infeksi
virus dan bakteri, berperan dalam pembentukan kolagen serta produksi
neurotransmitter dan hormon tertentu dalam tubuh (Walingo, 2005).
Asam askorbat apabila terkena pengaruh oksigen, zat-zat pengoksidasi
lemah, atau oleh pengaruh enzim asam askorbat oksidase, akan mempermudah
senyawa ini mengalami oksidasi. Karena memiliki sifat mudah teroksidasi, asam
askorbat digunakan sebagai antioksidan (Iqbal, et al., 2004).
2.5.2 Flavonoid
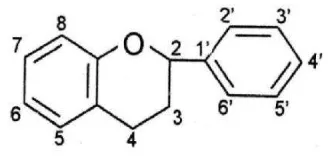
Gambar 2.2 Rumus bangun flavonoid
Golongan flavonoid dapat digambarkan sebagai deretan senyawa C6-C3-C6. Kelompok terbesar flavonoid memiliki ciri adanya cincin piran yang
menghubungkan rantai tiga-karbon dengan salah satu dari cincin benzen. Senyawa
ini merupakan pereduksi yang baik karena mampu menghambat reaksi oksidasi
(Robinson, 1995). Flavonoid pada tumbuhan berfungsi sebagai pelindung terhadap
serangan jamur ataupun radiasi sinar UV yang dapat merusak tumbuhan. Selain
itu, flavonoid juga terlibat dalam proses fotosintesis, transfer energi, dan respirasi
pada tumbuhan.
2.5.3 Tokoferol
Struktur α-tokoferol (Lmid, 1995) dapat dilihat pada Gambar 2.3 berikut:
Gambar 2.3 Rumus bangun α- tokoferol
Tokoferol merupakan salah satu antioksidan yang terdapat dalam
tumbuhan. Beberapa tokoferol ada yang terdapat di alam, salah satunya α
-tokoferol yang merupakan senyawa paling aktif secara biologis (Silalahi, 2006).
Makanan yang paling banyak mengandung tokoferol adalah minyak nabati,
mencegah dan melindungi sel tubuh dari kerusakan, sehingga dapat memperlambat
penuaan, mencegah kanker dan aterosklerosis (Lamid, 1995).
2.5.4 Polifenol
Senyawa polifenol adalah senyawa yang paling sedikit memiliki satu cincin
aromatik dan mengikat beberapa gugus hidroksil. Polifenol merupakan senyawa
antioksidan alami yang paling banyak terdapat dalam buah-buahan dan sayuran.
Sifat antioksidan yang dimiliki oleh polifenol dapat menghambat spesies oksigen
reaktif. Polifenol dapat menghambat senyawa-senyawa karsinogen dengan cara
metilasi dan pembentukan glukoronid, serta pembukaan cincin, kebanyakan dari
bagian katekol polifenol, akibat pengaruh dari enzim-azim dan bakteri pencernaan
(Weisburger, 2004).
2.6 Spektrofotometri UV-Visible
Prinsip kerja spektrofotometer UV-Vis berdasarkan penyerapan cahaya
atau energi radiasi oleh suatu larutan. Jumlah cahaya atau energi radiasi yang
diserap memungkinkan pengukuran jumlah zat penyerap dalam larutan secara
kuantitatif (Triyati, 1985). Panjang gelombang untuk sinar ultraviolet antara
200-400 nm sedangkan panjang gelombang untuk sinar tampak/visible antara 200-400-750
nm (Rohman, 2007).
Metode spektrofotometri ultra-violet dan sinar tampak (visible) telah
banyak diterapkan untuk penetapan senyawa-senyawa organik yang umumnya
dipergunakan untuk penentuan senyawa dalam jumlah yang sangat kecil. Dalam
suatu larutan, gugus molekul yang dapat mengabsorpsi cahaya dinamakan gugus
mengalami perubahan pada panjang gelombang. Molekul yang mengandung dua
gugus kromofor atau lebih akan mengabsorpsi cahaya pada panjang gelombang
yang hampir sama dengan molekul yang hanya mempunyai satu gugus kromofor
tertentu, tetapi intensitas absorpsinya adalah sebanding dengan jumlah kromofor
yang ada (Triyati, 1985).
Spektrofotometer pada dasarnya terdiri dari sumber sinar, monokromator,
sel untuk zat yang diperiksa, detektor, penguat arus dan alat ukur atau pencatat.
Spektrofotometri serapan merupakan metode pengukuran serapan radiasi
elektromagnetik pada panjang gelombang tertentu yang diserap zat (Depkes RI,
1979).
2.7 Penentuan Aktivitas Antioksidan dengan Metode DPPH
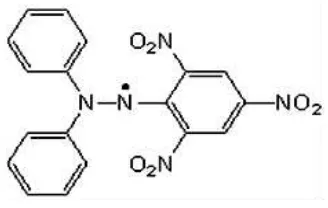
Rumus bangun DPPH (Prakash et al., 2001) dapat dilihat pada Gambar 2.4
berikut :
Gambar 2.4 Rumus bangun DPPH
Pada tahun 1922, Goldschmidt dan Renn menemukan senyawa berwarna
ungu radikal bebas stabil DPPH. DPPH berwarna sangat ungu seperti KMnO4 dan tidak larut dalam air (Ionita, 2005). Metode DPPH adalah sebuah metode yang
sederhana yang dapat digunakan untuk menguji kemampuan antioksidan yang
padat dan juga dalam bentuk larutan. Prinsipnya dimana elektron ganjil pada
molekul DPPH memberikan serapan maksimum pada panjang gelombang 517 nm
yang berwarna ungu. Warna ini akan berubah dari ungu menjadi kuning lemah
apabila elektron ganjil tersebut berpasangan dengan atom hidrogen yang
disumbangkan senyawa antioksidan. Perubahan warna ini berdasarkan reaksi
kesetimbangan kimia (Prakash et al., 2001).
Parameter yang dipakai untuk menunjukan aktivitas antioksidan adalah
harga konsentrasi efisien atau efficient concentration (EC50) atau Inhibition Concentra tion (IC50) yaitu konsentrasi suatu zat antioksidan yang dapat menyebabkan 50% DPPH kehilangan karakter radikal atau konsentrasi suatu zat
antioksidan yang memberikan penghambatan 50%. Zat yang mempunyai aktivitas
antioksidan tinggi, akan mempunyai harga EC50 atau IC50 yang rendah (Molyneux,
2004).
2.7.1 Pelarut
Metode ini akan bekerja dengan baik menggunakan pelarut metanol atau
etanol dan kedua pelarut ini tidak mempengaruhi dalam reaksi antara sampel uji
sebagai antioksidan dengan DPPH sebagai radikal bebas (Molyneux, 2004).
2.7.2 Pengukuran absorbansi – panjang gelombang
Panjang gelombang maksimum (λmaks) yang digunakan dalam
pengukuran uji sampel uji sangat bervariasi. Menurut beberapa literatur panjang
gelombang maksimum untuk DPPH antara lain 515-520 nm, bagaimanapun dalam
praktiknya hasil pengukuran yang memberikan peak maksimum itulah panjang
gelombangnya yaitu sekitar panjang gelombang yang disebutkan diatas.
2.7.3 Pengukuran waktu operasional (operating time)
Cara ini biasa digunakan untuk pengukuran hasil reaksi atau pembentukan
warna. Tujuannya adalah untuk mengetahui waktu pengukuran yang stabil. Waktu
operasional ditentukan dengan mengukur hubungan antara waktu pengukuran