ABSTRACT
JOKO UTOMO Production of Yolk Immunoglobulin Anti-Excretory/Secretory (E/S) of Fasciola gigantica to Laying Hens . Under direction FADJAR
SATRIJA, SRI MURTINI.
The research was designed to study the method of antibody anti-excretory/secretory (E/S) of Fasciola gigantica production in laying hens. Ten chickens were divided into two groups, i.e., five chickens/group. Group one was immunized with antigen E/S of Fasciola gigantica from buffalo and the second group was immunized with antigen E/S of Fasciola gigantica from sheep. Dose of immunization was 150 µg/animal. The immunization was done intravenously (i.v.) without adjuvant at the first time. One week later (second immunization) all chicken was injected subcutaneously (s.c.) with the antigen that had been added with Freund’s complete adjuvant with the same volume (1:1). Since the third immunization until the sixth immunization whereas every immunization was conducted one week after the previous one, the chicken was injected subcutaneously with combination of antigen and Freund’s incomplete adjuvant. The eggs were collected every day after the first immunization. Sera and egg yolk were tested using agar gel precipitation test (AGPT) to detect the presence of antibody against antigen E/S of Fasciola gigantica. The result showed that the chicken immunized with antigen-E/S of Fasciola gigantica from buffalo was able to develop antibody aster than the chicken immunized with antigen-E/S of Fasciola gigantica from sheep. The antibody against antigen E/S of Fasciola gigantica antigen from buffalo appeared in the sera at the 9-week and in the egg yolk at the 10-week after the first immunization. While the antibody against antigen E/S of Fasciola gigantica from sheep appeared in the sera at the 10-week and in the egg yolk at the 11-week after the first immunization.
PRODUKSI IMUNOGLOBULIN Y (Ig Y) ANTI-
EKSKRETORI/SEKRETORI (E/S) Fasciola gigantica PADA
AYAM PETELUR
JOKO UTOMO
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PRODUKSI IMUNOGLOBULIN Y (Ig Y) ANTI-
EKSKRETORI/SEKRETORI (E/S) Fasciola gigantica PADA
AYAM PETELUR
JOKO UTOMO
B04070022
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi Produksi Immunoglobulin Y (Ig Y) anti-E/S Fasciola gigantica pada Ayam Petelur adalah karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir skripsi ini.
Bogor, April 2012
Judul Skripsi
: Produksi Immunoglobulin Y (Ig Y) anti -Ekskretori/Sekretori
(E/S) Fasciola gigantica pada Ayam PetelurNama Mahasiswa : Joko Utomo
NRP : B04070022
Program Studi : Kedokteran Hewan
Disetujui
Pembimbing I Pembimbing II
drh.H.Fadjar Satrija, M.Sc, Ph.D
NIP. 19641003 198803 1 002 NIP. 19661120 199512 2 001 Dr.drh.Hj. Sri Murtini, M.Si
Diketahui
Wakil Dekan FKH IPB
NIP. 19630810 198803 1 004 drh. Agus Setiyono, MS, Ph.D, APVet
UCAPAN TERIMA KASIH
Syukur Alhamdulillah penulis ucapkan atas karunia dan rahmat Allah SWT penulis dapat menyelesaikan skripsi ini sebagai salah satu syarat untuk memperoleh gelar sarjana kedokteran hewan di Fakultas Kedokteran Hewan IPB. Sholawat dan salam selalu tercurahkan kepada junjungan Nabi Muhammad SAW.
Dengan selesainya penulisan skripsi ini dalam penulis mengucapakan terima kasih yang sebesar-besarnya kepada :
1. Keluarga penulis tercinta Papa, Mama, dan Adik yang selalu memberikan cinta, kasih sayang, doa, semangat serta dukungannya kepada penulis. 2. Drh. H. Fadjar Satrija, M.Sc, Ph.D dan Dr. drh. Hj. Sri Murtini, M.Si selaku
pembimbing skripsi yang telah memberikan masukan, arahan, nasihat, perhatian, waktu, didikan, dan kesabaran selama penulisan skripsi ini. 3. Drh. Huda Darusman dan Drh. Min Rahmminiwati, MS. Ph.D selaku
pembimbing akademik yang telah memberikan arahan dan bimbingan selama penulis menjalani studi.
4. Pegawai laboratorium ilmu penyakit hewan dan Pegawai AJMP FKH IPB yang telah membantu penulis selama ini.
5. Teman – teman satu perjuangan yang selalu memberikan motivasi sekaligus saran kepada penulis selama ini.
6. Tema sepenelitian Retno dan Risma yang telah berbagi pengalaman dan menyatukan segala perbedaan demi kelancaran penelitian dan penyusunan skripsi masing-masing. semoga kita dapat mendapatkan ilmu dan pengalaman baru yang bermanfaat
Terima kasih atas segala semangat, inspirasi dan persaudaraan yang luar biasa. Semoga Allah SWT membalas semua kebaikan yang telah diberikan. Penulis menyadari bahwa masih banyak terdapat kekurangan dalam tulisan ini, oleh karena itu saran dan kritik yang membangun sangat diharapkan. Semoga karya ilmiah ini dapat bermanfaat bagi kita semua.
Bogor, April 2012
RIWAYAT HIDUP
Penulis dilahirkan di Kerinci pada tanggal 29 Mei 1990 dari ayah Burman Salim dan ibu Jumalni Jalil. Penulis merupakan anak pertama dari dua bersaudara.
Pendidikan Sekolah Dasar sampai Sekolah Menengah Umum ditempuh di Kabupaten Kerinci yang diselesaikan pada Juni 2007. Pada tahun yang sama, diterima sebagai Mahasiswa Kedokteran Hewan di Institut Pertanian Bogor melalui jalur Ujian Seleksi Masuk Mahasiswa IPB (USMI).
RINGKASAN
JOKO UTOMO. 2012. Produksi Immunoglobulin Y (Ig Y) anti-Ekskretori/Sekretori (E/S) Fasciola gigantica pada Ayam Petelur. Dibimbing oleh FADJAR SATRIJA dan SRI MURTINI
ABSTRACT
JOKO UTOMO Production of Yolk Immunoglobulin Anti-Excretory/Secretory (E/S) of Fasciola gigantica to Laying Hens . Under direction FADJAR
SATRIJA, SRI MURTINI.
The research was designed to study the method of antibody anti-excretory/secretory (E/S) of Fasciola gigantica production in laying hens. Ten chickens were divided into two groups, i.e., five chickens/group. Group one was immunized with antigen E/S of Fasciola gigantica from buffalo and the second group was immunized with antigen E/S of Fasciola gigantica from sheep. Dose of immunization was 150 µg/animal. The immunization was done intravenously (i.v.) without adjuvant at the first time. One week later (second immunization) all chicken was injected subcutaneously (s.c.) with the antigen that had been added with Freund’s complete adjuvant with the same volume (1:1). Since the third immunization until the sixth immunization whereas every immunization was conducted one week after the previous one, the chicken was injected subcutaneously with combination of antigen and Freund’s incomplete adjuvant. The eggs were collected every day after the first immunization. Sera and egg yolk were tested using agar gel precipitation test (AGPT) to detect the presence of antibody against antigen E/S of Fasciola gigantica. The result showed that the chicken immunized with antigen-E/S of Fasciola gigantica from buffalo was able to develop antibody aster than the chicken immunized with antigen-E/S of Fasciola gigantica from sheep. The antibody against antigen E/S of Fasciola gigantica antigen from buffalo appeared in the sera at the 9-week and in the egg yolk at the 10-week after the first immunization. While the antibody against antigen E/S of Fasciola gigantica from sheep appeared in the sera at the 10-week and in the egg yolk at the 11-week after the first immunization.
© Hak Cipta milik IPB, tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyunan laporan, penulisan kritik, atau tinjauan masalah, dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
DAFTAR ISI
Gambaran Umum Fascioloa gigantica……… 3
Gejala……… 5
Diagnosa……… 5
Ayam Petelur ……… 5
Sistem Kekebalan Unggas……… 6
Immunoglobulin Y……… 7
Pemanfaatan Immunoglobulin Y……….. 9
Antigen Ekskretori/Sekretori……… 9
DAFTAR TABEL
DAFTAR GAMBAR
Halaman
1. Sikus hidup Fasciola spp……… 4
2. Hasil AGPT (1)………... 16
3. Hasil AGPT (2)……… 17
PENDAHULUAN
Latar Belakang
Fasciolosis adalah penyakit yang disebabkan oleh infeksi cacing famili Trematoda dengan spesies utama Fasciola gigantica dan Fasciola hepatica
(Winarsih et al. 1996). Fasciola hepatica merupakan cacing hati yang tersebar di wilayah empat musim (subtropis), sedangkan Fasciola gigantica merupakan cacing hati yang banyak hidup pada daerah yang beriklim tropis basah (Satrija et al. 2009). Kedua jenis cacing ini merupakan parasit yang sangat merugikan bagi ternak maupun peternak. Kerugian yang ditimbulkan oleh fasciolosis berupa penurunan bobot badan, berkurangnya hasil produksi, pengafkiran organ tubuh terutama hati, kematian, dan penurunan pendapatan peternak (Estuningsih et al.
2004). Kerugian ekonomis akibat fasciolosis pada ditafsirkan mencapai 439-525 juta Dollar Australia (Copeman dan Copland 2008).
Pengendalian fasciolosis di Indonesia menghadapi beberapa masalah salah satunya adalah sulitnya mendiagnosa infeksi F. gigantica pada ruminansia di awal infeksi karena masa prepaten infeksi cacing ini lama. Salah satu diagnosa yang dapat dilakukan dalam mendiagnosa penyakit kecacingan adalah pemeriksaan adanya antigen ekskretori/sekretori (E/S) cacing ini baik dalam sirkulasi darah maupun feses. Menurut Satrija et al. (2009), keberadaan E/S F. gigantica dapat dideteksi keberadaannya melalui pemeriksaan serologis menggunakan enzyme-linked immunosorbant assay (ELISA). Prinsip metode pemeriksaan tersebut adalah adanya ikatan spesifik antara antigen dan antibodi yang akan dideteksi (Burgess 1995). Oleh karena itu, untuk melakukan pemeriksaan E/S F. gigantica
menggunakan ELISA diperlukan antibodi anti- F. gigantica.
Perpindahan Ig Y tersebut dalam tubuh unggas ke anaknya dapat terjadi melalui dua tahap yaitu:
(a) Ig Y dipindahkan dari serum ke dalam kuning telur sebagaimana transfer antibodi cross-placental mamalia. Keberadaan reseptor Ig Y pada oosit akan mengikat dan memindahkan seluruh Ig Y serum ke telur
(b) pemindahan Ig Y dari kuning telur ke embrio.
Produksi Ig Y memiliki beberapa keunggulan bila dibandingkan dengan produksi imunoglobulin lainnya. Adapun keunggulan tersebut adalah: (a) proses pengebalan hewan mudah dilakukan, (b) menghasilkan antibodi dalam jumlah besar, dan (c) purifikasi antibodi dari kuning telur dapat dilakukan dengan mudah.
Perkembangan penyakit pada hewan membuat para peneliti mencari cara memberantas, mengobati maupun mendeteksi secara dini penyakit tersebut yang akurat. Pendeteksian penyakit secara dini memungkinkan peneliti menggunakan antibodi (Immunoglobulin) asal hewan salah satunya penggunaan immunoglobulin Y pada kuning telur. Tulisan ini menitiberatkan pada cara memproduksi immunoglobulin Y anti- F. gigantica asal kuning telur sebagai bahan untuk diagnosa fasciolosis pada hewan.
Tujuan
Penelitian ini bertujuan untuk mempelajari metode produksi ImunoglobulinY anti E/S Fasciola gigantica pada kuning telur ayam petelur sebagai bahan diagnosa fasciolosis dengan uji serologis.
Manfaat
Manfaat dari penelitian ini adalah dapat memberikan kemudahan dalam penyediaan bahan penelitian yang berkaitan dengan diagnosis fasciolosis dan memberikan pengetahuan tentang cara produksi Imunoglobulin Y anti E/S
TINJAUAN PUSTAKA
Klasifikasi Taksonomi Fasciola gigantica
Fasciola spp yang lebih dikenal dengan nama cacing hati merupakan trematoda paling penting sebagai penyebab kerugian ekonomi pada ternak ruminansia di seluruh dunia. Selain ruminansia cacing ini dapat menginfeksi beberapa jenis hewan lainnya seperti babi, kelinci, anjing, rusa, marmot, kuda, dan bahkan manusia. Kasus infeksi cacing Fasciola pada manusia pernah ditemukan di Kuba, Prancis selatan, Inggris dan Aljazair (Satrija et al. 2009).
Cacing hati yang biasa ditemukan di Indonesia adalah spesies Fasciola gigantica, sedangkan spesies Fasciola hepatica umumnya ditemukan pada ternak yang diimpor ke Indonesia (Kusumamiharja 1992). Hal ini dikarenakan inang antara yang berperan dalam siklus hidup Fasciola hepatica yaitu Lymnea truncatula tidak ditemukan di Indonesia, sedangkan inang antara Fasciola gigantica yaitu Lymnea rubiginosa adalah siput endemik Indonesia (Kusumamihardja 1992; Mitchell 2007).
Menurut Levine (1990), cacing Fasciola spp mempunyai klasifikasi sebagai berikut:
Kingdom : Animalia Phylum : Platyhelminthes Class : Trematoda Subclass : Digenea Family : Fasciolidae Genus : Fasciola
Spesies : Fasciola gigantica dan Fasciola hepatica
Morfologi dan Siklus Hidup
dibedakan dari Fasciola hepatica karena ukuran tubuh lebih pendek, dan kerucut kepala lebih panjang. Alat reproduksi terletak lebih posterior, dan batil isap perut lebih kecil (Noble dan Noble 1989).
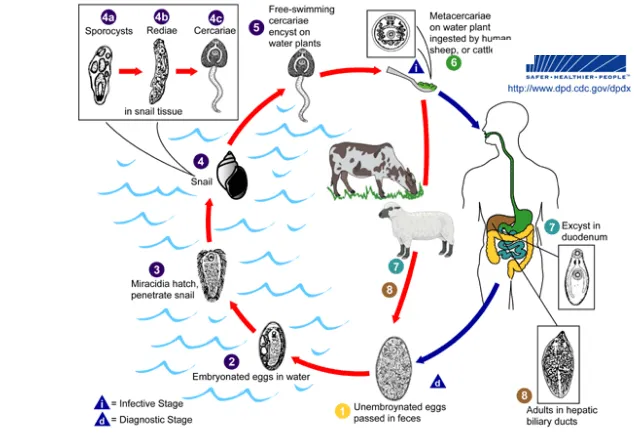
Siklus hidup Fasciola gigantica mirip dengan F. hepatica. Cacing Fasciola dewasa berada dalam saluran empedu mamalia sebagai induk semangnya, cacing dewasa tersebut menghasilkan telur-telur yang terbawa oleh cairan empedu, masuk ke dalam lumen usus dan keluar ke alam bebas bersama tinja. Telur cacing dalam tinja ruminansia atau hewan yang berada di lingkungan berair akan berkembang membentuk mirasidium. Telur akan menetas dan mirasidium ini akan keluar dan mencari siput sebagai inang antaranya (Ross 1996).
Mirasidium yang berhasil masuk ke dalam siput akan berkembang dan memperbanyak diri menjadi larva selanjutnya menjadi sporokista, redia dan serkaria (Gambar 1). Selanjutnya serkaria menempel di tanaman air, menanggalkan ekornya membentuk kista larva (metaserkaria) yang merupakan stadium infektif dari cacing hati (Satrija et al. 2009). Hewan akan terinfeksi bila memakan tanaman yang mengandung metaserkaria. Di dalam tubuh hewan, metaserkaria mengalami ekskistasi di dalam usus halus. Cacing muda yang keluar dari kista selanjutnya akan menembus usus dan bermigrasi ke hati. Di dalam hati cacing akan berkembang menjadi dewasa di dalam saluran empedu (Satrija et al.
2009).
Gejala
Tingkat keparahan fasciolosis pada ruminansia bervariasi mulai dari infeksi akut yang mematikan pada domba sampai infeksi asimptomatik pada sapi. Fasciolosis domba terjadi musiman dengan manifestasi klinis berupa anemia dan kematian mendadak. Fasciolosis subakut ditandai dengan jaundice, anemia dan penurunan berat badan, serta kematian domba umur 8-20 minggu. Fasciolosis kronis terjadi sepanjang musim yang ditandai dengan anemia, perlambatan kondisi umum dan produktivitas kerja (Satrija et al. 2009).
Diagnosa
Infeksi Fasciola dapat didiagnosa melalui pemeriksaan mikroskopik untuk mengindentifikasi keberadaan telur Fasciola dalam tinja dengan metode sedimentasi atau filtrasi bertingkat. Diagnosa dini infeksi sebelum cacing menghasilkan telur dapat dilakukan dengan metode ELISA untuk mendeteksi keberadaan antigen eksretori-sekretori (E/S) dalam tinja (Satrija et al.2009).
Ayam Petelur
Australop dan Barred Plymouth Rock, sedangkan tipe berat dari bangsa New Hampshire, White Plymouth Rock dan Cronish (Amrullah 2004).
Sistem Kekebalan Unggas
Tubuh makhluk hidup memiliki suatu sistem yang disebut sistem kekebalan yang memberikan respon dan melindungi tubuh terhadap bahan asing. Respon kekebalan sangat bergantung pada kemampuan sel-sel kekebalan mengenali molekul asing (antigen) dan kemudian membangkitkan reaksi yang tepat untuk menyingkirkan sumber antigen bersangkutan. Sistem pengenalan antigen dilakukan oleh unsur sistem kekebalan yaitu sel limfosit dan fase efektornya yang melibatkan berbagai jenis sel- sel dalam sistem kekebalan lainnya (Kresno 1996).
Sistem kekebalan ayam terdiri dari bursa fabricius, sumsum tulang, limpa, timus, kelenjar Herderian, limfonodus, sirkulasi limfosit dan jaringan limfoid ditraktus alimentarius. Sel pembentuk antibodi (sel B) diproduksi oleh bursa fabricius, sedangkan sumsum tulang adalah sumber dari bakal sel limfosit. Limpa adalah pusat proliferasi sel plasma dan sel B memori. Unggas tanpa limpa akan mengalami penurunan produksi antibodi. Timus merupakan tempat pematangan bakal sel T yang berdiferensiasi menjadi limfosit T. Aktivitas limfosit T pada unggas sama dengan limfosit T pada mamalia (Larsson et al.1993).
terhadap berbagai jenis antigen tidak sama), mampu mengenal kembali antigen yang pernah dijumpainya (memiliki memori), sehingga paparan berikutnya meningkatkan efektifitas mekanisme pertahanan tubuh (Kresno 1996).
Periode lag (keterlambatan) adalah waktu antigen pertama kali diimunisasikan ke dalam tubuh dan belum terlihat suatu reaksi dari tubuh tersebut. Antibodi baru akan ditemukan sekitar satu minggu setelah dimasukkannya antigen pertama kali, dan kadarnya dalam serum akan meningkat dan mencapai puncaknya pada 10-14 hari selanjutnya mengalami penurunan. Pemberian antigen kedua akan diikuti dengan pembentukan antibodi dengan periode lag yang lebih cepat yakni 3 atau 4 hari. Jumlah antibodi yang ditemukan meningkat dengan cepat ke tingkat yang tinggi sebelum menurun kembali dengan lambat (Tizard 2004).
Sel B adalah sel yang bertanggung jawab atas pembentukan imunoglobulin (Ig) dan merupakan 5-15% dari limfosit dalam sirkulasi darah. Sel B yang terdapat dalam sumsum tulang dan belum pernah terpapar pada antigen, umumnya menunjukkan respon yang lebih lambat dibandingkan dengan sel B yang terdapat dalam jaringan limfoid perifer. Perangsangan antigen pada limfosit B akan menyebabkan sel B mengalami proses perkembangan melalui dua jalur, yaitu berdiferensiasi menjadi sel plasma yang membentuk imunoglobulin, dan membelah dan lalu kembali dalam keadaan istirahat sebagai limfosit B memori. Pembentukan sel B memori adalah suatu proses yang bergantung pada proses sel T, sedangkan yang merangsang sel B tanpa sel T tidak merangsang pembentukan sel memori (Kresno 1996).
Immunoglobulin Y
selain itu Ig Y unggas lebih tahan terhadap suhu dan perubahan pH dibandingkan dengan Ig G serta tidak menyebabkan reaksi silang dengan komponen struktural jaringan dan sel darah mamalia (Larsson et al.1993). Ayam dapat digunakan untuk memproduksi antibodi selama masa produksi telurnya. Ayam yang telah digunakan untuk memproduksi antibodi selama 3 bulan harus di imunisasi booster setiap bulan berikutnya untuk memastikan antibodi yang tetap tinggi. Ayam mampu menghasilkan antibodi dengan aviditas yang tinggi segera setelah dilakukan satu kali vaksinasi. Aviditas yang sama dapat ditemukan pada domba setelah empat kali vaksinasi (Warr et al.1995).
Immunoglobulin Y terdiri atas 4 rantai polipeptida dasar yang terdiri atas dua rantai berat (heavy chain) yang identik dan dua rantai ringan (light chain) yang identik. Setiap rantai ringan terikat pada rantai berat melalui ikatan disulfide (S-S), demikian pula rantai berat satu dengan lainnya dihubungkan dengan ikatan S-S. Enzim proteolitikpapin dapat memecah struktur ini menjadi tiga fragmen yaitu 2 fragmen yang memiliki susunan sama terdiri atas rantai berat (H) dan rantai ringan (L), fragmen ini dapat bereaksi dengan antigen sehingga disebut
fragmen antibody binding site (Fab) serta satu fragmen yang tidak dapat mengikat antigen, tetapi terkristalkan disebut Fc. Fragmen Fab dibentuk oleh dominan terminal N, sedangkan fragmen Fc dibentuk oleh dominan terminal C dengan Fc dihubungkan dengan leher atau hinge yang fleksibel (Wibawan et al.2003).
Immunoglobulin Y adalah protein yang sensitif terhadap denaturasi, aktifitas Ig Y mampu bertahan setelah dipanaskan selama 15 menit pada suhu 70 °C. Inkubasi pada pH 4 dapat ditoleransi dengan baik, tetapi pada pH 2 suhu 37 °C aktifitas antibodi akan turun secara cepat (Shimizu et al. 1992). Sedangkan menurut Larsson et al.(1993), Ig Y relativ stabil untuk dipertahankan aktivitasnya jika disimpan pada suhu ruang. Aktivitas Ig Y dapat dipertahankan dengan baik jika disimpan pada suhu 37 °C untuk jangka waktu 1 bulan atau pada suhu kamar untuk jangka 6 bulan dan aktivitas Ig Y dapat dipertahankan selama 10 tahun jika disimpan pada suhu 4 °C.
Sulphate-Polyacrilamide Gel Electrophoresis (SDS-PAGE)(Gordon 1983, Carlander 2002).
Pemanfaatan Imunoglobulin Y
Produksi Ig Y sebagai sumber antibodi terhadap antigen tertentu memiliki beberapa keuntungan yaitu: a) biaya pemeliharaan ayam relatif lebih murah, b) kandungan Ig Y tinggi di dalam telur dan dapat diproduksi dalam jumlah besar, c) immunoglobulin Y menghasilkan respon imun yang lebih spesifik dan tidak memiliki efek samping karena tidak bereaksi dengan Ig G mamalia d) memiliki daya simpan yang lebih lama, e) jarak filogenik antara unggas dan mamalia sangat jauh sehingga tidak menunjukkan reaksi silang dengan komponen jaringan mamalia. Beberapa kelebihan yang dimiliki Ig Y akan menjadi hal pendukung pot ensi ayam sebagai inang untuk memproduksi Ig Y spesifik terhadap antigen tertentu sehingga dapat digunakan sebagai perangkat imunodiagnostik dan imuno terapi.
Antigen Ekskretori/Sekretori (E/S)
Cacing umumnya melepaskan protein ekskretori/sekretori sebagai produk metabolisme. E/S dapat berperan sebagai molekul antigen pemicu respon kekebalan spesifik (Rhoads dan Fetterer 1997). Antigen Ekskretori/Sekretori cacing umumnya antigen yang imunogenik dan terdiri dari makromolekul protein, polisakarida, polipeptida, atau polimer sintetik misalnya polivinilpirolidon (PVP). Namun hanya bagian tertentu saja yang dapat berikatan dengan situs pengikatan antigen dari antibodi anti cacing parasitik baik golongan cestoda, trematoda, maupun nematoda (Guyton dan Hall 2007). Ekskretori/Sekretori juga merupakan metabolit senyawa protease yang dihasilkan oleh cacing. Enzim proteolitik tersebut berperan penting untuk proses perkembangan dan kelangsungan hidup seperti penetasan telur, molting, serta penetrasi dan migrasi cacing ke jaringan inang definitif. E/S yang dihasilkan oleh cacing parasitik berperan sebagai antigen yang memicu kehadiran antibodi dalam tubuh (Balqis 2004).
bersifat antigenik harus besar, kaku dan memiliki struktur kimia kompleks. Ciri pokok yang kedua yaitu derajat keasingan atau tingkat keasingan suatu bahan atau senyawa di dalam tubuh. Selain limitasi fisikokimiawi dan derajat keasingan, antigenitas suatu bahan atau senyawa juga ditentukan oleh derajat keasingan antigen dalam tubuh (Kindt et al. 2007).
Protein merupakan antigen yang terbaik karena ukuran dan kerumitan strukturnya. Hampir semua protein yang berat molekulnya lebih besar dari 8000 dalton bersifat antigenik. Antigen E/S mengandung glikoprotein yang menutupi kulit cacing dan juga susunannya berupa enzim sehingga mempermudah migrasi cacing (Bird dan Jean 1991). Oleh karena itu, antigen E/S sering digunakan untuk kontrol biologi, pembuatan vaksin, atau bahan untuk memanipulasi respon kekebalan inang (Wulandari 2004).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2009 hingga Februari 2010. Penelitian dilakukan di kandang pemeliharaan hewan coba Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) dan Laboratorium Terpadu Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner (IPHK) FKH IPB.
Hewan coba
Hewan coba yang digunakan dalam penelitian ini adalah ayam petelur ras
Hysex Brown umur 24 minggu sebanyak 10 ekor. Ayam-ayam tersebut dipelihara secara individual di dalam kandang batere. Setiap ayam diperlakukan dengan kondisi yang sama, baik dari segi makan, minum, maupun kondisi kandang. Sebelum diberi perlakuan, ayam tersebut dilakukan pemeriksaan status parasit pencernaan menggunakan metode Mc Master. Hal ini untuk memastikan hewan coba bebas dari penyakit pencernaan akibat parasit yang dapat mempengaruhi produksi telur.
Metode Penelitian
1 Isolasi dan Produksi Antigen E/S Fasciola gigantica
2 Pengukuran Kosentrasi Protein E/S Fasciola gigantica
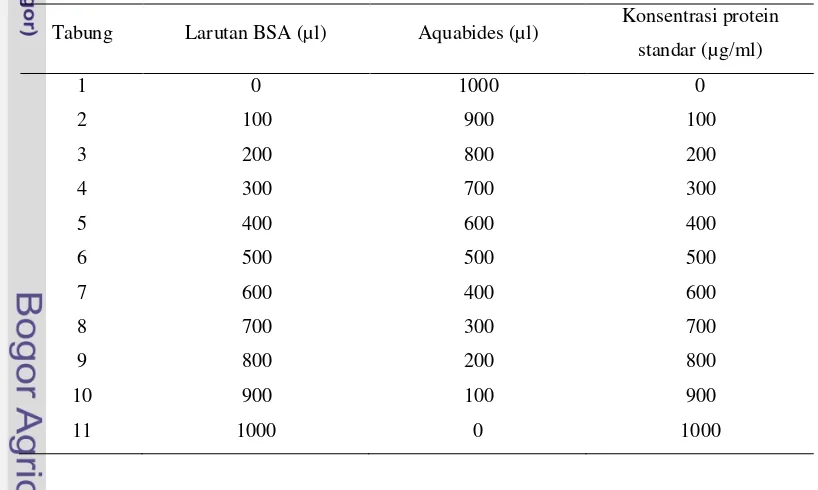
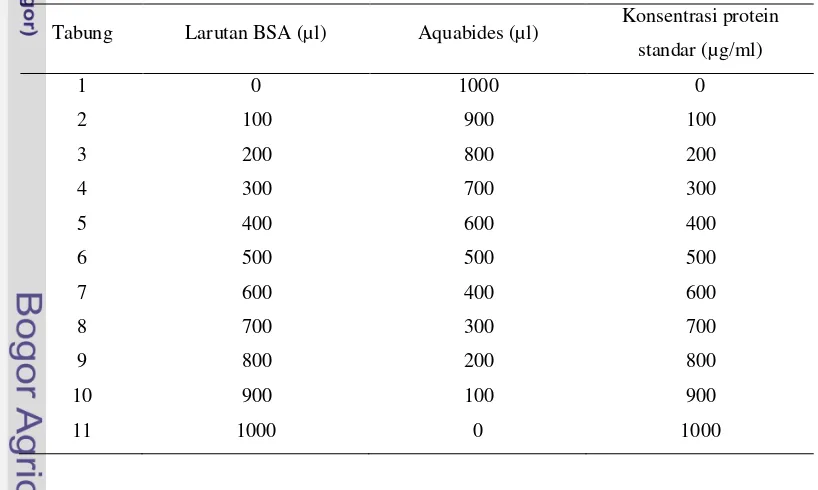
Konsetrasi protein E/S dihitung dengan metode Bradford menggunakan spektofotometer pada panjang gelombang 590 nm. Metode Bradford digunakan secara luas untuk menghitung titer protein secara kuantitatif. Metode ini menggunakan pereaksi commasie briliant blue. Larutan standar protein yang digunakan adalah bovine serum albumin (BSA). Larutan Bradford yang terdiri dari 100 mg commasie briliant blue yang dilarutkan dalam 59 ml etanol 95% dan ditambahkan sebanyak 100 ml asam fosfat 85% (w/v), serta diencerkan dengan dua kali pengenceran terlebih dahulu dengan aquabides hingga volume larutan mencapai 1 liter, kemudian disaring. Setelah itu, 10 ml larutan Bradford yang telah diencerkan ditambahkan 90 ml aquabides menjadi 100 ml larutan yang merupakan larutan Bradford dengan dua kali pengenceran. Sebanyak 10 mg BSA dilarutkan dalam 10 ml aquabides hingga homogen. Sebelas buah tabung reaksi yang telah disterilisasi diisi dengan larutan larutan BSA dan aquabides sesuai dengan Tabel 1.
Tabel 1 Tata cara pengisian larutan BSA
Tabung Larutan BSA (µl) Aquabides (µl) Konsentrasi protein standar (µg/ml)
selanjutnya ditambahkan 5 ml larutan Bradford. Kurva standar konsentrasi protein dibuat berdasarkan absorbansi dari masing-masing konsentrasi standar menggunakan spektrofotometer dengan panjang gelombang 590 nm. Protein E/S selanjutnya diambil 100 µ l dan dimasukkan kedalam tabung reaksi serta ditambahkan larutan Bradford 5 ml. Larutan E/S tersebut kemudian dibaca konsentrasinya menggunakan spektrofotometer dengan panjang gelombang 590 nm. E/S yang telah diketahui konsentrasi proteinnya selanjutnya di-aliquot dalam tabung mikrobervolume 1 ml dan disimpan pada suhu -20°C sampai digunakan.
3 Imunisasi Ayam Coba
Imunisasi dengan antigen E/S F. gigantica dilakukan terhadap 10 ekor ayam betina berumur 24 minggu dengan interval vaksinasi dua minggu sesuai dengan protokol Table 2. Penyuntikan antigen (imunisasi) pada ayam dilakukan melalui rute intravena dan subkutan dengan dosis 150 µg/ekor.
Tabel 2 Tata cara penyuntikan antigen
Kelompok Antigen Penyuntikan (minggu ke-)
0 1 3 5 7
Tanpa adjuvant (rute intravena)
FAC = Freund’s complete adjuvant (rute subkutan)
FAI = Freund’s incomplete adjuvant (rute subkutan)
4 Teknik Pengambilan Darah dan Pengumpulan Kuning Telur
digunakan. Seiring dengan pengambilan darah juga dilakukan pengumpulan telur ayam bila ada yang bertelur. Setiap butir telur diberi label nomor ayam dan tanggal pengeluaran telur. Kuning telur dari masing-masing telur yang dipanen dipisahkan dari putih telur lalu disimpan di freezer (refrigator -20 ºC) dan diberi tanda.
5 Pembuatan Antigen Telarut
Antigen dan antibodi harus harus dapat berdifusi dengan baik dalam uji presipitasi menggunakan media agar. Difusi dalam media agar dapat terjadi bila komponen antigen tersebut dalam ukuran kecil sehingga mudah terlarut. Antigen E/S Fasciola gigantica agar dapat terlarut harus dipecah molekulnya agar menjadi ukuran molekulnya lebih kecil. Pemecahan molekul dilakukan menggunakan alat sonikator Bioruptor™ . E/S Fasciola gigantica sebanyak 2.5 ml dimasukkan ke dalam tabung sonifikasi lalu dimasukkan dalam sonikator Bioruptor™ yang berisi air bersuhu 4 ºC. Hal ini bertujuan untuk mendinginkan tabung dan mencegah kerusakan antigen karena panas yang ditimbulkan selama proses berlangsung. Proses sonikasi dilakukan selama 5 menit dengan frekuensi 50000 Hz.
7 Pemurnian Ig Y dari Kuning Telur
Kuning telur yang menunjukkan hasil positif pada uji AGPT, selanjutnya dimurnikan Ig Y-nya dari kuning telur menggunakan kit eggstract® Ig Y
HASIL DAN PEMBAHASAN
Pengujian Serum dan Kuning Telur
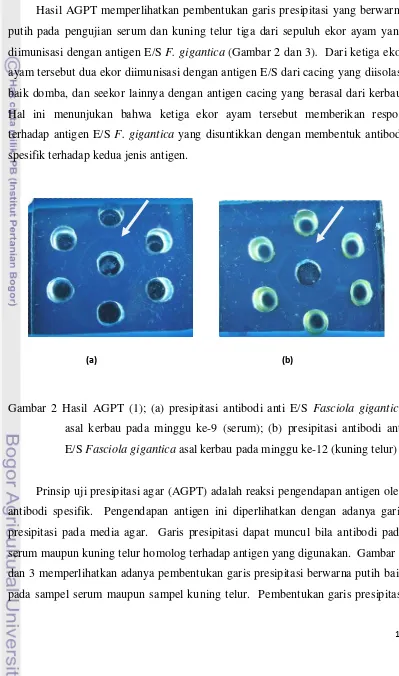
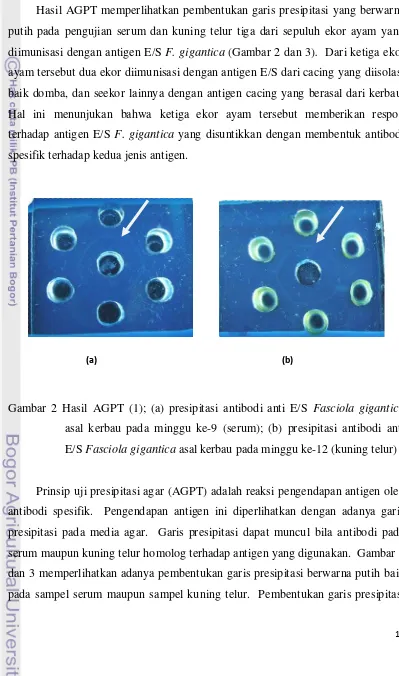
Hasil AGPT memperlihatkan pembentukan garis presipitasi yang berwarna putih pada pengujian serum dan kuning telur tiga dari sepuluh ekor ayam yang diimunisasi dengan antigen E/S F. gigantica (Gambar 2 dan 3). Dari ketiga ekor ayam tersebut dua ekor diimunisasi dengan antigen E/S dari cacing yang diisolasi baik domba, dan seekor lainnya dengan antigen cacing yang berasal dari kerbau. Hal ini menunjukan bahwa ketiga ekor ayam tersebut memberikan respon terhadap antigen E/S F. gigantica yang disuntikkan dengan membentuk antibodi spesifik terhadap kedua jenis antigen.
Gambar 2 Hasil AGPT (1); (a) presipitasi antibodi anti E/S Fasciola gigantica
asal kerbau pada minggu ke-9 (serum); (b) presipitasi antibodi anti E/S Fasciola gigantica asal kerbau pada minggu ke-12 (kuning telur)
Prinsip uji presipitasi agar (AGPT) adalah reaksi pengendapan antigen oleh antibodi spesifik. Pengendapan antigen ini diperlihatkan dengan adanya garis presipitasi pada media agar. Garis presipitasi dapat muncul bila antibodi pada serum maupun kuning telur homolog terhadap antigen yang digunakan. Gambar 2 dan 3 memperlihatkan adanya pembentukan garis presipitasi berwarna putih baik pada sampel serum maupun sampel kuning telur. Pembentukan garis presipitasi
diinisiasi oleh terbentuknya kompleks molekul antigen-antibodi yang saling bereaksi diikuti dengan proses agregasi serta sedimentasi kompleks tersebut. Pembentukan garis presipitasi tersebut melibatkan ion antigen divalen atau multivalen dan sangat tergantung pada proporsi antigen terhadap antibodi (Barriga 1981). Reaksi ini juga dipengaruhi oleh pH, suhu, avinitas atau kestabilan kompleks antigen-antibodi dan afinitas atau kekuatan ikatan kompleks antibodi-antigen (Tizzard 2004).
Gambar 3 Hasil AGPT (2); (a) presipitasi antibodi anti E/S Fasciola gigantica
asal domba pada minggu ke-10 (serum); (b) presipitasi antibodi anti E/S Fasciola gigantica asal domba pada minggu ke-13 (kuning telur)
Hasil AGPT asal kerbau terlebih dulu memperlihatkan adanya antibodi spesifik terhadap F. gigantica baik dalam serum maupun kuning telur. Pada ayam yang diimunisasikan dengan E/S F. gigantica asal kerbau, antibodi pada serum dan kuning telur ditemukan berturut-turut pada minggu ke-9 dan ke-10, sedangkan pada ayam yang diimunisasikan dengan antigen E/S F. gigantica asal domba antibodi pada serum dan kuning telur ditemukan berturut-turut pada minggu ke-10 dan ke-11 (Tabel 3).
Perbedaan waktu terdeteksinya antibodi tersebut dipengaruhi oleh beberapa faktor, diantaranya konsentrasi antibodi dalam serum maupun kuning telur pada saat pengujian. Pengujian keberadaan antibodi dengan uji AGPT memerlukan kosentrasi antibodi minimal sebesar 30 mg/ml (Tizzard 2004). Konsentrasi
antibodi saat pengujian AGPT yang kurang dari ambang batas tersebut, maka hasil uji akan memperlihatkan hasil negatif.
Tabel 3 Data Hasil AGPT E/S F.gigantica terhadap serum dan kuning telur
Keterangan : - Tidak Terbentuk Presipitasi
+ Terbentuk Presipitasi
++ Penebalan Presipitasi
Hasil penelitian ini juga menunjukkan bahwa antibodi anti E/S F. gigantica
asal kerbau pada serum maupun kunig telur terbentuk lebih cepat dibandingkan dengan antibodi terhadap E/S F. gigantica asal domba. Hal ini berbeda dengan hasil penelitian Setyaningsih (2011) yang menggunakan antigen yang sama tetapi dengan hewan coba kelinci. Perbedaan tersebut terletak pada waktu pembentukan antibodi anti E/S F. gigantica asal kerbau maupun asal domba pada serum. Berdasarkan hasil AGPT serum penelitian tersebut menyebutkan bahwa Ig G anti-E/S F. gigantica asal domba terbentuk lebih cepat dibandingkan dengan antibodi terhadap E/S F. gigantica asal kerbau. Kelinci yang diimunisasi dengan antigen E/S Fasciola gigantica asal domba sudah menunjukkan adanya pembentukkan antibodi terhadap E/S Fasciola gigantica asal domba pada minggu ke-4. Berbeda dengan kelinci yang disuntik antigen E/S Fasciola gigantica asal kerbau, antibodi yang terbentuk pada serum terhadap E/S Fasciola gigantica asal kerbau, baru dapat dideteksi pada minggu ke 12. Sedangkan berdasarkan hasil AGPT pada penelitian ini, ayam yang diimunisasi dengan antigen E/S Fasciola gigantica asal domba baru menunjukkan adanya pembentukkan antibodi terhadap E/S Fasciola gigantica asal domba pada minggu ke-10. Berbeda dengan ayam yang disuntik
Antigen Sampel Hasil AGPT (minggu ke-)
antigen E/S Fasciola gigantica asal kerbau, antibodi yang terbentuk pada serum terhadap E/S Fasciola gigantica asal kerbau, baru dapat dideteksi pada minggu ke-9. Hal ini menujukkan bahwa perbedaan waktu untuk menimbulkan respon pembentukan antibodi pada inang (hewan yang diinjeksi imunogen) dapat bervariasi dan tergantung pada imunogenitas, bentuk, dan stabilitas stimulan, spesies hewan, rute injeksi, serta sensitivitas uji yang digunakan untuk mendeteksi antibodi pertama yang terbentuk (Hercowitz 1978). Respon induk semang terhadap imunogen yang diberikan tidak hanya ditentukan oleh sifat fisikokimia imunogen, namun juga ditentukan oleh beberapa faktor terkait induk semang, termasuk ke dalamnya yaitu genetik, umur, status nutrisi, dan efek sekunder yang diturunkan dari suatu proses penyakit (Jackson 1978). Ayam yang digunakan pada penelitian ini memiliki rataan umur, bobot badan, jenis kelamin, dosis injeksi, nutrisi, serta rute injeksi yang sama, sehingga perbedaan waktu antibodi antara semua ayam dapat disebabkan karena adanya karakter antigen protein E/S
F. gigantica.
Perbedaan karakter E/S F. gigantica pada inang yang berbeda dapat mempengaruhi respon pembentukan antibodi. Kedua jenis antigen tersebut merupakan protein yang berasal dari spesies cacing yang sama, namun E/S F. gigantica yang dihasilkan dapat memiliki karakter protein yang berbeda. Morfologi inang asal F. gigantica yang berbeda akan mempengaruhi profil protein E/S yang dihasilkan. Perbedaan morfologi protein E/S F. gigantica tergantung pada inang definitifnya (Ashour et al. 1999). Berdasarkan elektroforesis menggunakan SDS-PAGE, antigen E/S F. gigantica dari isolat asal kerbau memiliki 9 pita protein dengan berat molekul berkisar antara 14-80 kDa (Satrija 2009), sedangkan E/S F. gigantica dari isolat asal sapi memiliki 6 pita protein dengan berat molekul berkisar antara 15-42 kDa (Meshgi et al. 2008).
Antigen somatik F. gigantica dan E/S F. hepatica dari isolat asal sapi memiliki jumlah pita protein yang berbeda. Antigen somatik F. hepatica
berbeda, spesies cacing yang berbeda dari inang yang sama ataupun karena variasi geografis (Ashour et al. 1999; Meshgi et al. 2008).
Pengujian IgY yang Dimurnikan dari Kuning Telur
Kuning telur yang mengandung antibodi anti E/S F. gigantica asal domba dan asal kerbau dimurnikan menggunakan kit eggstract® Ig Y (PROMEGA) media. Antibodi berupa IgY anti-F. gigantica hasil pemurnian diuji kembali dengan AGPT menggunakan antigen E/S F. gigantica. Presipitasi pada hasil AGPT menunjukkan bahwa Ig Y yang dihasilkan mampu mengikat antigen E/S F. gigantica (Gambar 4). Ig Y yang dihasilkan dari kuning telur pada penelitian ini dapat menjadi sumber bahan diagnostik untuk menguji antigen E/S Fasciola gigantica.
Gambar 4 Hasil AGPT (3); (a) presipitasi Ig Y dengan antigen E/S Fasciola gigantica asal domba pada (b) presipitasi Ig Y dengan antigen E/S
Fasciola gigantica asal kerbau (Ig Y terletak ditengah)
Pembentukan antibodi ayam juga dapat dipengaruhi oleh antigenitas protein E/S F. gigantica yang disuntikkan. Ciri pokok antigenitas suatu bahan atau senyawa ditentukan dari limitasi fisikokimiawi serta derajat keasingan (Tizzard 2004). Limitasi kimiawi suatu bahan atau senyawa yaitu ukuran molekul antigen harus besar, kaku dan memiliki struktur kimia yang kompleks (Kindt et al. 2007). Struktur kimia protein E/S F. gigantica yang besar dan kompleks, akan menghasilkan antibodi yang semakin cepat. Sifat antigenik atau imunogenik E/S
dari cacing golongan nematoda dan trematoda berasal dari kutikula dan tegumen (Lightowlers dan Rickard 1988).
Proses pembentukan Ig Y bermula dari makrofag yang berfungsi sebagai
antigen presenting cell (APC) akan memfragmentasi antigen dan akan mempresentasikan antigen tersebut ke sel limfosit melalui molekul major histocompasibility complex (MHC) yang terletak di permukaan makrofag. Sel T hanya bereaksi dengan antigen asing jika antigen tersebut ditampilkan pada permukaan APC bersama-sama dengan MHC. Sel Th mengenali antigen yang berikatan dengan molekul MHC kelas II (MHC II) dan sel Tc mengenali antigen yang berikatan dengan molekul MHC kelas I (MHC I). MHC II akan membawa antigen yang disajikan oleh APC kepada sel Th. Interaksi antara sel Th dan APC akan menginduksi pengeluaran sitokin atau interleukin. Sitokin dan interleukin berfungsi sebagai alat komunikasi antar sel. Sitokin dan interleukin akan menginduksi pematangan sel limfosit B menjadi sel plasma yang akan menghasilkan antibodi (Wibawan et al. 2003)
untuk bereaksi dengan antigen lebih besar, sehingga titer antibodi juga cepat meningkat.
Limfosit-limfosit yang mengikat antigen dirangsang untuk perbanyakan diri dan berdiferensiasi, sehingga terbentuk klon limfosit yang masing-masing memiliki reseptor pada membran sel induknya. Selama proses perbanyakan berlangsung, sel berdiferensiasi menjadi sel efektor dan sel memori. Sel memori memiliki reseptor sama dengan limfosit tetuanya. Sel tersebut akan berdiferensiasi kemudian ada antigen yang mempunyai determinan antigen sama dengan reseptornya akan dihasilkan antibodi spesifik. Dengan demikian dihasilkan bermacam-macam antibodi.
Ig Y yang telah dihasilkan dari pemurnian dapat dimanfaatkan sebagai bahan uji serologis. Salah satu uji tersebut adalah uji ELISA. ELISA adalah uji untuk mengukur langsung interaksi antara antigen dan antibodi sehingga termasuk dalam uji pengikatan primer seperti halnya FAT dan RIA (Tizard 2004). ELISA dapat digunakan untuk mendiagnostik pada penyakit infeksi misalnya dalam mendeteksi adanya antigen (bakteri, virus, parasit atau jamur) atau antibodi. Di uji ELISA, antibodi (IgY) dimanfaatkan sebagai pendeteksi dan pengikat suatu antigen dan antibodi yang di bantu oleh ligan dan enzim dalam suatu sumur plate
5.
KESIMPULAN DAN SARAN
Simpulan
Imunisasi antigen E/S Fasciola gigantica pada ayam sebanyak 150 µg dapat menghasilkan antibodi anti- ES F. gigantica (Ig Y) untuk bahan uji serologis dalam mendeteksi infeksi F. gigantica secara dini pada hewan ternak khususnya domba dan kerbau. Pembentukan antibodi anti- E/S F. gigantica pada kerbau yang diimunisasi pada ayam lebih cepat terbentuk dibandingkan dengan antibodi anti- E/S F. gigantica pada domba.
Saran
DAFTAR PUSTAKA
[Anonim]. 2004. Parasite and Health.www.dfpd.cdc.gov.htm [3 Februari 2011] [Anonim]. 2011. Beternak ayam petelur
April2011]
[Anonim]. 2011. Komposisi Kuning Telur 2011]
Amrullah KI. 2004. Nutrisi Ayam Petelur. Bogor: Lembaga Satu Gunung Budi KPP IPB Baranang Siang.
Ashour AA, Zaskia E, Abeer AK, Elham AN. 1999. Studies on the liver fluke
Fasciola in Egypt: I- morphological and morphometrical studies. J Egypt Soc Parasitol 29 (3): 979-996.
Balqis U. 2004. Pengaruh Pemberian Ekskretori-Sekretori (ES) Cacing Ascaridia galli Dewasa, L2, dan Kombinasinya Terhadap Perubahan Struktur Morfologi Saluran Cerna Ayam Petelur. [tesis]. Sekolah Pascasarjana Institut Pertanian Bogor.
Barriga OO. 1981. The Immunology of Parasitic Infection. Baltimore: University Park Pr. Hlm 1-16.
Burgess WG. 1995. Teknologi ELISA dalam Diagnosis dan Penelitian. Artama WT, penerjemah; Yogyakarta: UGM Pr. Terjemahan dari: ELISA Technology in Diagnosis and Research.
Bird AF, Jean B. 1991. The Structure of Nematodes Second Edition. California, San Diego: Academic Press Inc.
Carlender D. 2002. Avian Y antibody in vitro and in vivo. Comprehensive Summeries of Uppsala Disertation from the Faculty of Medicine 1119. Acta Universites Upsaliense.
Copeman DB, Copland RS. 2008. Importance and Potential Impact of Liver Fluke in Cattle and Buffalo. Di dalam: Gray GD, Copland RS, Copeman DB, editor. Overcoming Liver Fluke as a Constraint to Ruminant Production in South-East Asia. Canberra: Australian Centre for International Agricultural Research (ACIAR).
Estuningsih SE, Adiwinata G, Widjajanti S, Piedrafita D. 2004. Pengaruh infestasi cacing hati Fasciola gigatica terhadap gambaran darah sel leukosit eosinofil pada domba. J Vet Sci 9 (3):191-196.
Herscowitz HB. 1985. Immunophysiology: Cell Function and Cellular Interaction. Di dalam: Bellanti JA, editor. Immunology II. Phildelphia: W. B. Saunders Company. Hlm 151-202.
Jackson AL. 1985. Antigen and Immunogenicity. Di dalam: Bellanti JA, Editor.
Immunology II. Phildelphia: W. B. Saunders Company. Hlm 105-115. Jawetz E, Melnick JL, Andelberg EA. 1972. Review of Medical Microbiology.
Los Altos California: Lange Medical Publication p:138-141.
KO KY. 2005. Purifikation of Egg Yolk Immunoglobulin by Ammonium Sulfate and Cation Ion Exchange Chromatography. Animal Science Iowa State University.
Kindt TJ, Osborne BA, Goldsby RA. 2007. Kuby Immunology 6thed. New York: W.H Freeman and Company.
Kusumamihardja S. 1992. Parasit dan Parasitosis pada Hewan Ternak dan Hewan Piaraan di Indonesia. Bogor: Pusat Antar Universitas Bioteknologi IPB.
Kresno SB. 2001. Immunologi: Diagnosis dan Prosedur Laboratorium. Edisi keempat, Jakarta: Pen. Fakultas Kedokteran Universitas Indonesia.
Larsson A, Ballow RM, Lindahl TL, Frosberg PO. 1993. Chicken Antibodies: Taking advantages of Evolution A-review. Poultry Science 72:1807-1812. Larsson A, Sjoquist J. 1998. Chicken antibodies: A too to avoid false positive
results by rheumatoid factor in latek fixation test. J Immunol Metods
108:205.
Levine ND. 1990. Buku Pelajaran Parasitologi Veteriner. Ashadi G, peterjemah; Wardiato, editor. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Textbook of Veterinary Parasitology.
Li-Chahn ECY. 2000. Aplication of Egg Imunoglobulin in Immunoafinity Chromatography. Egg Nutrion and Biotechnology. Faculty of Agricultural Sciences.Univ. of British Columbia. CAB International: Canada. P: 323-337.
Lightowlers MW, Rickard MD. 1988. Excretory/secretory product of helminth parasites: effect on host immune responses.[abstrak]. J Parasitol 96; Suppl:S123-66.
Meshgi B, Eslami A, Hemmatzah F. 2008. Determination of somatic and excretory/secretori antigens of Fasciola hepatica and Fasciola gigantica
using SDS-PAGE. Iran J Vet Res 9(1):22.
Meshgi B, Karimi A, Shayan P. 2008. Genetic variation of Fasciola hepatica
from sheep, cattle, and buffalo. J Parasitol 6(2):12.
Mitchell GBB. 2007. Liver Fluke. Edisi ke-4. London: Blackwell.
Nobel RE, Nobel GA. 1989. Biologi Parasit Hewan. Edisi ke-5.Wardianto, Penerjemah; Soeripto N, Editor. Yogyakarta: Gajah Mada University Press. Terjemahan dari: The Biology of Animal Parasites.
Perez JC. 2000. Introduction to Techniques in Immunology. Natural Toxin Research Center. Texas A&M University, Kingsville.
Rasyad M. 2003. Manajemen Peternakan Ayam Petelur. Jakarta: PT. Penebar Swadaya.
Rose ME and Orland. 1981. Immunoglobulin in the egg, embryo and young chick. Dev. Comp. Immun. 5:15-20 and 371-375.
Satrija F. 2009. Laporan Akhir Hibah Kompetensi: Pengembangan Kit Diagnostik Koproantigen untuk Mendeteksi Infeksi Cacing Hati pada Ternak Ruminansia. Institut Pertanian Bogor.
Satrija F, Retnani EB, Ridwan Y. 2009. Buku ajar : kecacingan pada ruminansia platyhelminthes. Bogor: Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
Setyaningsih R. 2011. Produksi Antibodi Poliklonal Anti-Ekskretori/Sekretori
Fasciola gigantica pada Kelinci.[skripsi]. Fakultas Kedokteran Hewan, IPB. Shimizu M, Nagasima H, Sano K, Hashimoto K, Ozeki M, Tsuda K. 1992.
Molecouler stability of chiken and rabbit imunoglobulin G. Biosci Biotechnol Biochem 56: 270-274.
Tizard I. 2004. an Introduction to Veterinary Immunology 7th Ed. Elsevier: Philadelphia.
Higgins DA, Magor GW, Warr KE. 1995. Ig Y: Clues to the origin of modern antibodies. Immunol Tod 16:392-398.
Winarsih W, Estuningsih S, Setiyono A, Harlina E. 1996. Fasciolasis pada domba dan kambing di Rumah Potong Hewan Kotamadya Bogor. Media Veteriner
PENDAHULUAN
Latar Belakang
Fasciolosis adalah penyakit yang disebabkan oleh infeksi cacing famili Trematoda dengan spesies utama Fasciola gigantica dan Fasciola hepatica
(Winarsih et al. 1996). Fasciola hepatica merupakan cacing hati yang tersebar di wilayah empat musim (subtropis), sedangkan Fasciola gigantica merupakan cacing hati yang banyak hidup pada daerah yang beriklim tropis basah (Satrija et al. 2009). Kedua jenis cacing ini merupakan parasit yang sangat merugikan bagi ternak maupun peternak. Kerugian yang ditimbulkan oleh fasciolosis berupa penurunan bobot badan, berkurangnya hasil produksi, pengafkiran organ tubuh terutama hati, kematian, dan penurunan pendapatan peternak (Estuningsih et al.
2004). Kerugian ekonomis akibat fasciolosis pada ditafsirkan mencapai 439-525 juta Dollar Australia (Copeman dan Copland 2008).
Pengendalian fasciolosis di Indonesia menghadapi beberapa masalah salah satunya adalah sulitnya mendiagnosa infeksi F. gigantica pada ruminansia di awal infeksi karena masa prepaten infeksi cacing ini lama. Salah satu diagnosa yang dapat dilakukan dalam mendiagnosa penyakit kecacingan adalah pemeriksaan adanya antigen ekskretori/sekretori (E/S) cacing ini baik dalam sirkulasi darah maupun feses. Menurut Satrija et al. (2009), keberadaan E/S F. gigantica dapat dideteksi keberadaannya melalui pemeriksaan serologis menggunakan enzyme-linked immunosorbant assay (ELISA). Prinsip metode pemeriksaan tersebut adalah adanya ikatan spesifik antara antigen dan antibodi yang akan dideteksi (Burgess 1995). Oleh karena itu, untuk melakukan pemeriksaan E/S F. gigantica
menggunakan ELISA diperlukan antibodi anti- F. gigantica.
Perpindahan Ig Y tersebut dalam tubuh unggas ke anaknya dapat terjadi melalui dua tahap yaitu:
(a) Ig Y dipindahkan dari serum ke dalam kuning telur sebagaimana transfer antibodi cross-placental mamalia. Keberadaan reseptor Ig Y pada oosit akan mengikat dan memindahkan seluruh Ig Y serum ke telur
(b) pemindahan Ig Y dari kuning telur ke embrio.
Produksi Ig Y memiliki beberapa keunggulan bila dibandingkan dengan produksi imunoglobulin lainnya. Adapun keunggulan tersebut adalah: (a) proses pengebalan hewan mudah dilakukan, (b) menghasilkan antibodi dalam jumlah besar, dan (c) purifikasi antibodi dari kuning telur dapat dilakukan dengan mudah.
Perkembangan penyakit pada hewan membuat para peneliti mencari cara memberantas, mengobati maupun mendeteksi secara dini penyakit tersebut yang akurat. Pendeteksian penyakit secara dini memungkinkan peneliti menggunakan antibodi (Immunoglobulin) asal hewan salah satunya penggunaan immunoglobulin Y pada kuning telur. Tulisan ini menitiberatkan pada cara memproduksi immunoglobulin Y anti- F. gigantica asal kuning telur sebagai bahan untuk diagnosa fasciolosis pada hewan.
Tujuan
Penelitian ini bertujuan untuk mempelajari metode produksi ImunoglobulinY anti E/S Fasciola gigantica pada kuning telur ayam petelur sebagai bahan diagnosa fasciolosis dengan uji serologis.
Manfaat
Manfaat dari penelitian ini adalah dapat memberikan kemudahan dalam penyediaan bahan penelitian yang berkaitan dengan diagnosis fasciolosis dan memberikan pengetahuan tentang cara produksi Imunoglobulin Y anti E/S
TINJAUAN PUSTAKA
Klasifikasi Taksonomi Fasciola gigantica
Fasciola spp yang lebih dikenal dengan nama cacing hati merupakan trematoda paling penting sebagai penyebab kerugian ekonomi pada ternak ruminansia di seluruh dunia. Selain ruminansia cacing ini dapat menginfeksi beberapa jenis hewan lainnya seperti babi, kelinci, anjing, rusa, marmot, kuda, dan bahkan manusia. Kasus infeksi cacing Fasciola pada manusia pernah ditemukan di Kuba, Prancis selatan, Inggris dan Aljazair (Satrija et al. 2009).
Cacing hati yang biasa ditemukan di Indonesia adalah spesies Fasciola gigantica, sedangkan spesies Fasciola hepatica umumnya ditemukan pada ternak yang diimpor ke Indonesia (Kusumamiharja 1992). Hal ini dikarenakan inang antara yang berperan dalam siklus hidup Fasciola hepatica yaitu Lymnea truncatula tidak ditemukan di Indonesia, sedangkan inang antara Fasciola gigantica yaitu Lymnea rubiginosa adalah siput endemik Indonesia (Kusumamihardja 1992; Mitchell 2007).
Menurut Levine (1990), cacing Fasciola spp mempunyai klasifikasi sebagai berikut:
Kingdom : Animalia Phylum : Platyhelminthes Class : Trematoda Subclass : Digenea Family : Fasciolidae Genus : Fasciola
Spesies : Fasciola gigantica dan Fasciola hepatica
Morfologi dan Siklus Hidup
dibedakan dari Fasciola hepatica karena ukuran tubuh lebih pendek, dan kerucut kepala lebih panjang. Alat reproduksi terletak lebih posterior, dan batil isap perut lebih kecil (Noble dan Noble 1989).
Siklus hidup Fasciola gigantica mirip dengan F. hepatica. Cacing Fasciola dewasa berada dalam saluran empedu mamalia sebagai induk semangnya, cacing dewasa tersebut menghasilkan telur-telur yang terbawa oleh cairan empedu, masuk ke dalam lumen usus dan keluar ke alam bebas bersama tinja. Telur cacing dalam tinja ruminansia atau hewan yang berada di lingkungan berair akan berkembang membentuk mirasidium. Telur akan menetas dan mirasidium ini akan keluar dan mencari siput sebagai inang antaranya (Ross 1996).
Mirasidium yang berhasil masuk ke dalam siput akan berkembang dan memperbanyak diri menjadi larva selanjutnya menjadi sporokista, redia dan serkaria (Gambar 1). Selanjutnya serkaria menempel di tanaman air, menanggalkan ekornya membentuk kista larva (metaserkaria) yang merupakan stadium infektif dari cacing hati (Satrija et al. 2009). Hewan akan terinfeksi bila memakan tanaman yang mengandung metaserkaria. Di dalam tubuh hewan, metaserkaria mengalami ekskistasi di dalam usus halus. Cacing muda yang keluar dari kista selanjutnya akan menembus usus dan bermigrasi ke hati. Di dalam hati cacing akan berkembang menjadi dewasa di dalam saluran empedu (Satrija et al.
2009).
Gejala
Tingkat keparahan fasciolosis pada ruminansia bervariasi mulai dari infeksi akut yang mematikan pada domba sampai infeksi asimptomatik pada sapi. Fasciolosis domba terjadi musiman dengan manifestasi klinis berupa anemia dan kematian mendadak. Fasciolosis subakut ditandai dengan jaundice, anemia dan penurunan berat badan, serta kematian domba umur 8-20 minggu. Fasciolosis kronis terjadi sepanjang musim yang ditandai dengan anemia, perlambatan kondisi umum dan produktivitas kerja (Satrija et al. 2009).
Diagnosa
Infeksi Fasciola dapat didiagnosa melalui pemeriksaan mikroskopik untuk mengindentifikasi keberadaan telur Fasciola dalam tinja dengan metode sedimentasi atau filtrasi bertingkat. Diagnosa dini infeksi sebelum cacing menghasilkan telur dapat dilakukan dengan metode ELISA untuk mendeteksi keberadaan antigen eksretori-sekretori (E/S) dalam tinja (Satrija et al.2009).
Ayam Petelur
Australop dan Barred Plymouth Rock, sedangkan tipe berat dari bangsa New Hampshire, White Plymouth Rock dan Cronish (Amrullah 2004).
Sistem Kekebalan Unggas
Tubuh makhluk hidup memiliki suatu sistem yang disebut sistem kekebalan yang memberikan respon dan melindungi tubuh terhadap bahan asing. Respon kekebalan sangat bergantung pada kemampuan sel-sel kekebalan mengenali molekul asing (antigen) dan kemudian membangkitkan reaksi yang tepat untuk menyingkirkan sumber antigen bersangkutan. Sistem pengenalan antigen dilakukan oleh unsur sistem kekebalan yaitu sel limfosit dan fase efektornya yang melibatkan berbagai jenis sel- sel dalam sistem kekebalan lainnya (Kresno 1996).
Sistem kekebalan ayam terdiri dari bursa fabricius, sumsum tulang, limpa, timus, kelenjar Herderian, limfonodus, sirkulasi limfosit dan jaringan limfoid ditraktus alimentarius. Sel pembentuk antibodi (sel B) diproduksi oleh bursa fabricius, sedangkan sumsum tulang adalah sumber dari bakal sel limfosit. Limpa adalah pusat proliferasi sel plasma dan sel B memori. Unggas tanpa limpa akan mengalami penurunan produksi antibodi. Timus merupakan tempat pematangan bakal sel T yang berdiferensiasi menjadi limfosit T. Aktivitas limfosit T pada unggas sama dengan limfosit T pada mamalia (Larsson et al.1993).
terhadap berbagai jenis antigen tidak sama), mampu mengenal kembali antigen yang pernah dijumpainya (memiliki memori), sehingga paparan berikutnya meningkatkan efektifitas mekanisme pertahanan tubuh (Kresno 1996).
Periode lag (keterlambatan) adalah waktu antigen pertama kali diimunisasikan ke dalam tubuh dan belum terlihat suatu reaksi dari tubuh tersebut. Antibodi baru akan ditemukan sekitar satu minggu setelah dimasukkannya antigen pertama kali, dan kadarnya dalam serum akan meningkat dan mencapai puncaknya pada 10-14 hari selanjutnya mengalami penurunan. Pemberian antigen kedua akan diikuti dengan pembentukan antibodi dengan periode lag yang lebih cepat yakni 3 atau 4 hari. Jumlah antibodi yang ditemukan meningkat dengan cepat ke tingkat yang tinggi sebelum menurun kembali dengan lambat (Tizard 2004).
Sel B adalah sel yang bertanggung jawab atas pembentukan imunoglobulin (Ig) dan merupakan 5-15% dari limfosit dalam sirkulasi darah. Sel B yang terdapat dalam sumsum tulang dan belum pernah terpapar pada antigen, umumnya menunjukkan respon yang lebih lambat dibandingkan dengan sel B yang terdapat dalam jaringan limfoid perifer. Perangsangan antigen pada limfosit B akan menyebabkan sel B mengalami proses perkembangan melalui dua jalur, yaitu berdiferensiasi menjadi sel plasma yang membentuk imunoglobulin, dan membelah dan lalu kembali dalam keadaan istirahat sebagai limfosit B memori. Pembentukan sel B memori adalah suatu proses yang bergantung pada proses sel T, sedangkan yang merangsang sel B tanpa sel T tidak merangsang pembentukan sel memori (Kresno 1996).
Immunoglobulin Y
selain itu Ig Y unggas lebih tahan terhadap suhu dan perubahan pH dibandingkan dengan Ig G serta tidak menyebabkan reaksi silang dengan komponen struktural jaringan dan sel darah mamalia (Larsson et al.1993). Ayam dapat digunakan untuk memproduksi antibodi selama masa produksi telurnya. Ayam yang telah digunakan untuk memproduksi antibodi selama 3 bulan harus di imunisasi booster setiap bulan berikutnya untuk memastikan antibodi yang tetap tinggi. Ayam mampu menghasilkan antibodi dengan aviditas yang tinggi segera setelah dilakukan satu kali vaksinasi. Aviditas yang sama dapat ditemukan pada domba setelah empat kali vaksinasi (Warr et al.1995).
Immunoglobulin Y terdiri atas 4 rantai polipeptida dasar yang terdiri atas dua rantai berat (heavy chain) yang identik dan dua rantai ringan (light chain) yang identik. Setiap rantai ringan terikat pada rantai berat melalui ikatan disulfide (S-S), demikian pula rantai berat satu dengan lainnya dihubungkan dengan ikatan S-S. Enzim proteolitikpapin dapat memecah struktur ini menjadi tiga fragmen yaitu 2 fragmen yang memiliki susunan sama terdiri atas rantai berat (H) dan rantai ringan (L), fragmen ini dapat bereaksi dengan antigen sehingga disebut
fragmen antibody binding site (Fab) serta satu fragmen yang tidak dapat mengikat antigen, tetapi terkristalkan disebut Fc. Fragmen Fab dibentuk oleh dominan terminal N, sedangkan fragmen Fc dibentuk oleh dominan terminal C dengan Fc dihubungkan dengan leher atau hinge yang fleksibel (Wibawan et al.2003).
Immunoglobulin Y adalah protein yang sensitif terhadap denaturasi, aktifitas Ig Y mampu bertahan setelah dipanaskan selama 15 menit pada suhu 70 °C. Inkubasi pada pH 4 dapat ditoleransi dengan baik, tetapi pada pH 2 suhu 37 °C aktifitas antibodi akan turun secara cepat (Shimizu et al. 1992). Sedangkan menurut Larsson et al.(1993), Ig Y relativ stabil untuk dipertahankan aktivitasnya jika disimpan pada suhu ruang. Aktivitas Ig Y dapat dipertahankan dengan baik jika disimpan pada suhu 37 °C untuk jangka waktu 1 bulan atau pada suhu kamar untuk jangka 6 bulan dan aktivitas Ig Y dapat dipertahankan selama 10 tahun jika disimpan pada suhu 4 °C.
Sulphate-Polyacrilamide Gel Electrophoresis (SDS-PAGE)(Gordon 1983, Carlander 2002).
Pemanfaatan Imunoglobulin Y
Produksi Ig Y sebagai sumber antibodi terhadap antigen tertentu memiliki beberapa keuntungan yaitu: a) biaya pemeliharaan ayam relatif lebih murah, b) kandungan Ig Y tinggi di dalam telur dan dapat diproduksi dalam jumlah besar, c) immunoglobulin Y menghasilkan respon imun yang lebih spesifik dan tidak memiliki efek samping karena tidak bereaksi dengan Ig G mamalia d) memiliki daya simpan yang lebih lama, e) jarak filogenik antara unggas dan mamalia sangat jauh sehingga tidak menunjukkan reaksi silang dengan komponen jaringan mamalia. Beberapa kelebihan yang dimiliki Ig Y akan menjadi hal pendukung pot ensi ayam sebagai inang untuk memproduksi Ig Y spesifik terhadap antigen tertentu sehingga dapat digunakan sebagai perangkat imunodiagnostik dan imuno terapi.
Antigen Ekskretori/Sekretori (E/S)
Cacing umumnya melepaskan protein ekskretori/sekretori sebagai produk metabolisme. E/S dapat berperan sebagai molekul antigen pemicu respon kekebalan spesifik (Rhoads dan Fetterer 1997). Antigen Ekskretori/Sekretori cacing umumnya antigen yang imunogenik dan terdiri dari makromolekul protein, polisakarida, polipeptida, atau polimer sintetik misalnya polivinilpirolidon (PVP). Namun hanya bagian tertentu saja yang dapat berikatan dengan situs pengikatan antigen dari antibodi anti cacing parasitik baik golongan cestoda, trematoda, maupun nematoda (Guyton dan Hall 2007). Ekskretori/Sekretori juga merupakan metabolit senyawa protease yang dihasilkan oleh cacing. Enzim proteolitik tersebut berperan penting untuk proses perkembangan dan kelangsungan hidup seperti penetasan telur, molting, serta penetrasi dan migrasi cacing ke jaringan inang definitif. E/S yang dihasilkan oleh cacing parasitik berperan sebagai antigen yang memicu kehadiran antibodi dalam tubuh (Balqis 2004).
bersifat antigenik harus besar, kaku dan memiliki struktur kimia kompleks. Ciri pokok yang kedua yaitu derajat keasingan atau tingkat keasingan suatu bahan atau senyawa di dalam tubuh. Selain limitasi fisikokimiawi dan derajat keasingan, antigenitas suatu bahan atau senyawa juga ditentukan oleh derajat keasingan antigen dalam tubuh (Kindt et al. 2007).
Protein merupakan antigen yang terbaik karena ukuran dan kerumitan strukturnya. Hampir semua protein yang berat molekulnya lebih besar dari 8000 dalton bersifat antigenik. Antigen E/S mengandung glikoprotein yang menutupi kulit cacing dan juga susunannya berupa enzim sehingga mempermudah migrasi cacing (Bird dan Jean 1991). Oleh karena itu, antigen E/S sering digunakan untuk kontrol biologi, pembuatan vaksin, atau bahan untuk memanipulasi respon kekebalan inang (Wulandari 2004).
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2009 hingga Februari 2010. Penelitian dilakukan di kandang pemeliharaan hewan coba Fakultas Kedokteran Hewan Institut Pertanian Bogor (FKH IPB) dan Laboratorium Terpadu Departemen Ilmu Penyakit Hewan dan Kesehatan Masyarakat Veteriner (IPHK) FKH IPB.
Hewan coba
Hewan coba yang digunakan dalam penelitian ini adalah ayam petelur ras
Hysex Brown umur 24 minggu sebanyak 10 ekor. Ayam-ayam tersebut dipelihara secara individual di dalam kandang batere. Setiap ayam diperlakukan dengan kondisi yang sama, baik dari segi makan, minum, maupun kondisi kandang. Sebelum diberi perlakuan, ayam tersebut dilakukan pemeriksaan status parasit pencernaan menggunakan metode Mc Master. Hal ini untuk memastikan hewan coba bebas dari penyakit pencernaan akibat parasit yang dapat mempengaruhi produksi telur.
Metode Penelitian
1 Isolasi dan Produksi Antigen E/S Fasciola gigantica
2 Pengukuran Kosentrasi Protein E/S Fasciola gigantica
Konsetrasi protein E/S dihitung dengan metode Bradford menggunakan spektofotometer pada panjang gelombang 590 nm. Metode Bradford digunakan secara luas untuk menghitung titer protein secara kuantitatif. Metode ini menggunakan pereaksi commasie briliant blue. Larutan standar protein yang digunakan adalah bovine serum albumin (BSA). Larutan Bradford yang terdiri dari 100 mg commasie briliant blue yang dilarutkan dalam 59 ml etanol 95% dan ditambahkan sebanyak 100 ml asam fosfat 85% (w/v), serta diencerkan dengan dua kali pengenceran terlebih dahulu dengan aquabides hingga volume larutan mencapai 1 liter, kemudian disaring. Setelah itu, 10 ml larutan Bradford yang telah diencerkan ditambahkan 90 ml aquabides menjadi 100 ml larutan yang merupakan larutan Bradford dengan dua kali pengenceran. Sebanyak 10 mg BSA dilarutkan dalam 10 ml aquabides hingga homogen. Sebelas buah tabung reaksi yang telah disterilisasi diisi dengan larutan larutan BSA dan aquabides sesuai dengan Tabel 1.
Tabel 1 Tata cara pengisian larutan BSA
Tabung Larutan BSA (µl) Aquabides (µl) Konsentrasi protein standar (µg/ml)
selanjutnya ditambahkan 5 ml larutan Bradford. Kurva standar konsentrasi protein dibuat berdasarkan absorbansi dari masing-masing konsentrasi standar menggunakan spektrofotometer dengan panjang gelombang 590 nm. Protein E/S selanjutnya diambil 100 µ l dan dimasukkan kedalam tabung reaksi serta ditambahkan larutan Bradford 5 ml. Larutan E/S tersebut kemudian dibaca konsentrasinya menggunakan spektrofotometer dengan panjang gelombang 590 nm. E/S yang telah diketahui konsentrasi proteinnya selanjutnya di-aliquot dalam tabung mikrobervolume 1 ml dan disimpan pada suhu -20°C sampai digunakan.
3 Imunisasi Ayam Coba
Imunisasi dengan antigen E/S F. gigantica dilakukan terhadap 10 ekor ayam betina berumur 24 minggu dengan interval vaksinasi dua minggu sesuai dengan protokol Table 2. Penyuntikan antigen (imunisasi) pada ayam dilakukan melalui rute intravena dan subkutan dengan dosis 150 µg/ekor.
Tabel 2 Tata cara penyuntikan antigen
Kelompok Antigen Penyuntikan (minggu ke-)
0 1 3 5 7
Tanpa adjuvant (rute intravena)
FAC = Freund’s complete adjuvant (rute subkutan)
FAI = Freund’s incomplete adjuvant (rute subkutan)
4 Teknik Pengambilan Darah dan Pengumpulan Kuning Telur
digunakan. Seiring dengan pengambilan darah juga dilakukan pengumpulan telur ayam bila ada yang bertelur. Setiap butir telur diberi label nomor ayam dan tanggal pengeluaran telur. Kuning telur dari masing-masing telur yang dipanen dipisahkan dari putih telur lalu disimpan di freezer (refrigator -20 ºC) dan diberi tanda.
5 Pembuatan Antigen Telarut
Antigen dan antibodi harus harus dapat berdifusi dengan baik dalam uji presipitasi menggunakan media agar. Difusi dalam media agar dapat terjadi bila komponen antigen tersebut dalam ukuran kecil sehingga mudah terlarut. Antigen E/S Fasciola gigantica agar dapat terlarut harus dipecah molekulnya agar menjadi ukuran molekulnya lebih kecil. Pemecahan molekul dilakukan menggunakan alat sonikator Bioruptor™ . E/S Fasciola gigantica sebanyak 2.5 ml dimasukkan ke dalam tabung sonifikasi lalu dimasukkan dalam sonikator Bioruptor™ yang berisi air bersuhu 4 ºC. Hal ini bertujuan untuk mendinginkan tabung dan mencegah kerusakan antigen karena panas yang ditimbulkan selama proses berlangsung. Proses sonikasi dilakukan selama 5 menit dengan frekuensi 50000 Hz.
7 Pemurnian Ig Y dari Kuning Telur
Kuning telur yang menunjukkan hasil positif pada uji AGPT, selanjutnya dimurnikan Ig Y-nya dari kuning telur menggunakan kit eggstract® Ig Y
HASIL DAN PEMBAHASAN
Pengujian Serum dan Kuning Telur
Hasil AGPT memperlihatkan pembentukan garis presipitasi yang berwarna putih pada pengujian serum dan kuning telur tiga dari sepuluh ekor ayam yang diimunisasi dengan antigen E/S F. gigantica (Gambar 2 dan 3). Dari ketiga ekor ayam tersebut dua ekor diimunisasi dengan antigen E/S dari cacing yang diisolasi baik domba, dan seekor lainnya dengan antigen cacing yang berasal dari kerbau. Hal ini menunjukan bahwa ketiga ekor ayam tersebut memberikan respon terhadap antigen E/S F. gigantica yang disuntikkan dengan membentuk antibodi spesifik terhadap kedua jenis antigen.
Gambar 2 Hasil AGPT (1); (a) presipitasi antibodi anti E/S Fasciola gigantica
asal kerbau pada minggu ke-9 (serum); (b) presipitasi antibodi anti E/S Fasciola gigantica asal kerbau pada minggu ke-12 (kuning telur)
Prinsip uji presipitasi agar (AGPT) adalah reaksi pengendapan antigen oleh antibodi spesifik. Pengendapan antigen ini diperlihatkan dengan adanya garis presipitasi pada media agar. Garis presipitasi dapat muncul bila antibodi pada serum maupun kuning telur homolog terhadap antigen yang digunakan. Gambar 2 dan 3 memperlihatkan adanya pembentukan garis presipitasi berwarna putih baik pada sampel serum maupun sampel kuning telur. Pembentukan garis presipitasi
diinisiasi oleh terbentuknya kompleks molekul antigen-antibodi yang saling bereaksi diikuti dengan proses agregasi serta sedimentasi kompleks tersebut. Pembentukan garis presipitasi tersebut melibatkan ion antigen divalen atau multivalen dan sangat tergantung pada proporsi antigen terhadap antibodi (Barriga 1981). Reaksi ini juga dipengaruhi oleh pH, suhu, avinitas atau kestabilan kompleks antigen-antibodi dan afinitas atau kekuatan ikatan kompleks antibodi-antigen (Tizzard 2004).
Gambar 3 Hasil AGPT (2); (a) presipitasi antibodi anti E/S Fasciola gigantica
asal domba pada minggu ke-10 (serum); (b) presipitasi antibodi anti E/S Fasciola gigantica asal domba pada minggu ke-13 (kuning telur)
Hasil AGPT asal kerbau terlebih dulu memperlihatkan adanya antibodi spesifik terhadap F. gigantica baik dalam serum maupun kuning telur. Pada ayam yang diimunisasikan dengan E/S F. gigantica asal kerbau, antibodi pada serum dan kuning telur ditemukan berturut-turut pada minggu ke-9 dan ke-10, sedangkan pada ayam yang diimunisasikan dengan antigen E/S F. gigantica asal domba antibodi pada serum dan kuning telur ditemukan berturut-turut pada minggu ke-10 dan ke-11 (Tabel 3).
Perbedaan waktu terdeteksinya antibodi tersebut dipengaruhi oleh beberapa faktor, diantaranya konsentrasi antibodi dalam serum maupun kuning telur pada saat pengujian. Pengujian keberadaan antibodi dengan uji AGPT memerlukan kosentrasi antibodi minimal sebesar 30 mg/ml (Tizzard 2004). Konsentrasi