DI KPSBU LEMBANG
SKRIPSI
RATNA YUNITA HANDAYANI
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Gen β-laktoglobulin pada Sapi Perah Friesian Holstein di KPSBU Lembang.
Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc. Pembimbing Anggota : Ir. Anneke Anggraeni, MSi., Ph.D.
Kualitas susu dipengaruhi oleh komposisi protein yang dikandungnya, meliputi kasein dan whey. Peningkatan kualitas susu dapat dilakukan dengan upaya melakukan seleksi pada level DNA. Gen β-laktoglobulin merupakan salah satu gen utama pengontrol whey sehingga gen ini mampu menjadi faktor yang mempengaruhi kualitas susu. Keragaman yang terjadi pada gen β-laktoglobulin diharapkan mampu memberikan informasi terhadap kadar protein serta kualitas susu.
Penelitian ini bertujuan untuk mengidentifikasi keragaman gen β -laktoglobulin sapi Friesian Holstein (FH) di Desa Cilumber dan Pasir Kemis, KPSBU, Lembang. Sampel darah yang digunakan berasal dari 95 ekor sapi FH betina di Pasir Kemis dan 98 ekor sapi FH betina di Cilumber. Amplifikasi gen β -laktoglobulin menggunakan teknik Polymerase Chain Reaction (PCR), sedangkan penentuan genotipe dengan metode Polymerase Chain Reaction-Restriction Fragment Length Polymorphism (PCR-RFLP) menggunakan enzim restriksi HaeIII yang mengenali situs pemotong GG|CC. Analisis data menerapkan frekuensi genotipe, frekuensi alel, keseimbangan Hardy-Weinberg, dan heterozigositas.
Amplifikasi gen β-laktoglobulin terjadi pada ekson 4 dan menghasilkan fragmen sepanjang 247 pb. Tipe alel yang terbentuk yakni alel A dan B. Gen β -laktoglobulin pada sapi FH di kedua lokasi bersifat polimorfik dengan frekuensi alel B pada gen β-laktoglobulin pada sapi perah dari kedua lokasi memiliki nilai yang lebih tinggi (0,59) daripada frekuensi alel A (0,41). Terdapat tiga macam genotipe yang terbentuk, yaitu AA (99 dan 148 pb), AB (74, 99 dan 148 pb), dan BB (74 dan 148 pb). Genotipe AB memiliki nilai frekuensi yang paling tinggi (0,70) bila dibandingkan dengan frekuensi genotipe yang lainnya, yakni genotipe AA (0,06) dan BB (0,24). Berdasarkan data dari kedua lokasi, diketahui bahwa frekuensi alel A di Cilumber (0,46) lebih tinggi daripada frekuensi alel A di Desa Pasir Kemis (0,36), sedangkan frekuensi alel B tertinggi terdapat pada sapi FH di Desa Pasir Kemis. Analisis Chi Kuadrat menunjukkan bahwa sapi perah FH pada kedua pengamatan berada dalam ketidakseimbangan Hardy-Weinberg (χ2 > χ20,01). Tingkat heterozigositas pada kedua lokasi tergolong tinggi (Ho > He) dimana sapi FH di Cilumber (0,80) memiliki nilai heterozigositas lebih tinggi dibandingkan sapi FH dari Pasir Kemis (0,60). Keragaman gen β-laktoglobulin dapat dijadikan informasi dasar dalam program seleksi kualitas susu pada sapi FH.
Dairy Cattle at KPSBU Lembang
Handayani, R.Y., C. Sumantri, and A. Anggraeni
Gene β-lactoglobulin is a gene which can effect to milk quality. This gene is a major components of whey, which whey is one part of milk protein. The aim of this research was to identify the β-lactoglobulin polymorphism in Holstein Friesian (HF) cattle that were kept by small dairy farms in Cilumber and Pasir Kemis villages, in KPSBU Lembang. Blood samples of HF cows were collected successively 95 hds in Pasir Kemis and 98 hds in Cilumber. The β-lactoglobulin gene was amplified by PCR-RFLP method by using HaeIII restriction enzymes with restricting site at GG|CC. β-lactoglobulin gene located at exon 4 and had fragment length among 247 bp. β-lactoglobulin gene in this study had polymorphism with three genotypes that were identified namely AA (99 and 148 bp), AB (74, 99 and 148 bp), and BB (74 and 148 bp). Two alleles were produced from these genotypes, namely A and B alleles. At both locations of Cilumber and Pasir Kemis, AB genotype (0,70) had highest frequency than AA (0,06) and AB (0,24) genotype. The frequency of B allele (0,59) higher than A allele (0,41). Chi Square analysis showed that HF observed were not in Hardy-Weinberg equilibrium (χhit2 > χtabel20,01). The level of heterozygosity was relatively high (Ho > He), HF in Cilumber had a higher heterozygosity value than that of HF in Pasir Kemis. The β-lactoglobulin gene polymorphism could be used as a basic information milk protein quality selection program.
DI KPSBU LEMBANG
RATNA YUNITA HANDAYANI D14063324
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Nama : Ratna Yunita Handayani NIM : D14063324
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) (Ir. Anneke Anggraeni, MSi., Ph.D.) NIP. 19591212 198603 1 004 NIP. 19630924 199803 2 001
Mengetahui, Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan
(Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc.) NIP. 19591212 198603 1 004
Penulis adalah anak keempat dari 4 bersaudara dari pasangan Bapak Sunarno
(almarhum) dan Ibu Sumarmi Marlinasih.
Pendidikan dasar diselesaikan tahun 2000 di SD Negeri Bejen 02
Karanganyar. Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2003
di SLTP Negeri 1 Karanganyar dan pendidikan lanjutan menengah atas diselesaikan
pada tahun 2006 di SMA Negeri 1 Karanganyar, Surakarta.
Penulis diterima sebagai mahasiswa Departemen Ilmu Produksi dan
Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor melalui jalur
SPMB pada tahun 2006. Selama mengikuti pendidikan, penulis aktif di berbagai
kepanitiaan, beberapa organisasi penunjang, serta aktif dalam Program Kreativitas
Mahasiswa (PKM). Penulis aktif dalam kiprahnya sebagai pengurus di Lembaga
Dakwah Fakultas FAMM Al An’am Fakultas Peternakan IPB periode 2008/2009,
pengurus Asrama Putri Darmaga (APD) tahun 2008-2010 serta pengurus inti
(Sekretaris Umum serta Badan Pengawas) Paguyuban Beasiswa Karya Salemba
Empat (KSE) IPB pada tahun 2008-2011. Penulis pada tahun 2010/2011 ini juga
menjadi salah satu kandidat dari mahasiswa IPB penerima Beasiswa KSE yang
masuk dalam program Beasiswa KSE UNGGUL (Berprestasi) 2010/2011.
Penulis aktif di program kewirausahaan, yakni menjadi anggota Entrepreneur
Development Unit (EDU) BEM KM IPB pada angkatan pertama tahun 2009/2010,
peserta Building Entrepreneur Student (BEST) Fakultas Peternakan IPB angkatan ke
dua tahun 2009/2010, serta menjadi anggota binaan dari program wirausaha Mien R.
Uno Foundation (MRUF) tahun 2009/2010. Penulis menduduki peringkat ke-5
delegasi calon mahasiswa berprestasi Departemen IPTP tahun 2007/2008, menjadi
salah satu kontingen IPB dalam event nasional yakni menjadi peserta terpilih dalam
program intensive-Student Technopreneurship Program (i-STEP) 2009 yang
dilaksanakan selama tiga minggu di kampus IPB atas penyelenggaraan dari pihak
RAMP IPB yang bekerja sama dengan Lemelson Foundation serta penulis
berkesempatan mendapat penghargaan dengan menempati The 1st Winner in the
Country Undergraduate Competition for 2011 Alltech’s Young Scientist Award for
Pertanian Bogor yakni sebagai “Mahasiswa Berprestasi di bidang ekstrakurikuler”
periode Mei-Agustus tahun 2011 pada saat pelaksanaan Upacara 17 Agustus tahun
Rahmat dan Karunia-Nya, penelitian dan penulisan skripsi ini dapat terselesaikan.
Skripsi yang berjudul “Identifikasi Keragaman Gen β-laktoglobulin pada Sapi Friesian Holstein di KPSBU Lembang” merupakan salah satu syarat untuk
memperoleh gelar Sarjana Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Produktivitas ternak berpotensi untuk terus ditingkatkan. Salah satunya, yaitu
terkait dengan produksi susu pada sapi Friesian Holstein (FH). Peningkatan produksi
susu dapat ditingkatkan nilainya dengan melalui perbaikan kadar dan komposisi
protein susu yang dikandungnya. Kadar dan komposisi protein penyusun susu akan
ditentukan oleh keragaman genetik dari gen-gen pengontrol protein susu dan mampu
menjadi dasar perhitungan ekonomi dari sebuah peternakan sapi perah. Gen β
-laktoglobulin merupakan salah satu gen yang berhubungan dengan kualitas dan kadar
protein susu, penyusun utama whey pada susu sehingga gen ini erat kaitannya
terhadap kualitas susu yang dihasilkan sapi perah.
Penelitian ini bertujuan memberikan informasi mengenai keragaman gen β
-laktoglobulin pada sapi FH yang dipelihara oleh sejumlah peternakan rakyat.
Informasi mengenai keragaman β-laktoglobulin diharapkan dapat menjadi dasar
informasi untuk melakukan seleksi berdasarkan penciri DNA sehingga dapat
memberikan harapan pada perbaikan genetik bibit pada kadar protein susu sapi
Friesian Holstein (FH) Indonesia untuk meningkatkan kualitas produksi susu sapi
FH di Indonesia. Semoga skripsi ini dapat pula memberikan manfaat yang banyak
bagi dunia peternakan sapi perah khususnya bagi mahasiswa dan pelaku usaha sapi
perah di Indonesia. Amin
Bogor, 06 Oktober 2011
Halaman
RINGKASAN .………... i
ABSTRACT ………. ii
LEMBAR PERNYATAAN .………. iii
LEMBAR PENGESAHAN ………. iv
Frekuensi Alel dan Genotipe ………..…………. 17
Keseimbangan Hardy-Weinberg (HW) ……….………….. 18
Heterozigositas ………..…... 19
HASIL DAN PEMBAHASAN ………...…………. 20
Amplifikasi Gen ß-laktoglobulin ………. 20
Keragaman Gen ß-laktoglobulin ……….. 21
Frekuensi Gen ß-laktoglobulin …………….. 23
Keseimbangan Genotipe Gen β-laktoglobulin …………... 25
Heterozigositas Gen β-laktoglobulin ………... 26
Assosiasi antara Gen ß-laktoglobulin terhadap Susu …………... 27
KESIMPULAN DAN SARAN ………... 28
Kesimpulan ………... 28
Saran ………... 28
DAFTAR PUSTAKA ………... 29
UCAPAN TERIMA KASIH ………... 35
1. Variasi Jenis, Fraksi dan Jumlah Protein Susu pada Sapi Perah... 6
2. Keragaman Gen β-laktoglobulin dari Beberapa Penelitian
Terdahulu Terhadap Ternak Sapi dari Berbagai Bangsa ………. 8
3. Sekuen Gen β-laktoglobulin …………………. 14
4. Nilai Frekuensi Genotipe dan Frekuensi Alel gen β
-laktoglobulin pada Sapi Friesian Holstein ………... 24
5. Distribusi Genotipe Gen β-laktoglobulin pada sapi FH ……….... 26
6. Nilai Heterozigositas Gen β-laktoglobulin|HaeIII pada Sapi
1. Sapi Friesian Holstein ……… 4
2. Rekonstruksi Struktur Gen β-laktoglobulin Berdasarkan
Sekuen Gen β-laktoglobulin di GenBank ... 9
3. Pita Amplifikasi Fragmen Gen β-laktoglobulin dengan
Metode PCR pada Sapi FH ………... 20
4. Pemotongan Gen ß-laktoglobulin dengan Menggunakan
Enzim HaeIIIpada Ekson 4.………...………... 21
5. Posisi Penempelan Primer pada Sekuen Gen β-laktoglobulin
dengan Nomor Akses GenBank X14710…………..………... 21
6. Pola Pita ß-laktoglobulin Sapi FH dalam Gel Agarose 2,5%
Nomor Halaman
1. Sekuen Gen β-laktoglobulin (diakses dari GenBank No
PENDAHULUAN
Latar Belakang
Permintaan susu di Indonesia dalam tahun-tahun terakhir ini terus mengalami
peningkatan. Pemerintah telah menerapkan kebijakan impor susu dan ternak sapi
perah untuk memenuhi tingginya permintaan susu tersebut. Hal ini sesuai dengan
pernyataan dari Direktorat Jenderal Peternakan (2006) yang menyatakan bahwasanya
kebutuhan akan protein hewani berasal dari susu di Indonesia diperkirakan sebanyak
896.791 ton, tetapi baru terpenuhi dari dalam negeri sebanyak 577.628 ton, sehingga
sisanya sekitar 60% harus diimpor berupa bahan baku susu dari luar negeri. Namun,
pada sisi lain, masyarakat Indonesia masih memiliki potensi sapi perah yang cukup
baik dalam menghasilkan susu. Sapi perah sudah menjadi ternak yang cukup lama
dibudidayakan peternakan di Indonesia. Salah satu jenis sapi perah yang banyak
dikembangkan di Indonesia ialah sapi perah Friesian Holstein (FH). Berdasarkan
data statistik peternakan, jumlah populasi sapi perah (FH) nasional pada tahun 2006
mencapai sekitar 373.970 ekor. Jumlah sapi perah di Jawa tersebar di Propinsi Jatim,
Jateng dan Jabar berurutan sekitar 133.719, 123.132 dan 107.895 ekor atau
masing-masing sekitar 35,76, 32,93 dan 28,85% dari populasi nasional (Direktorat Jenderal
Peternakan, 2006). Sapi FH merupakan ternak sapi dengan penghasil susu yang
cukup tinggi bila dibandingkan dengan ternak perah lainnya.
Pengembangan sapi perah secara umum harus disertai dengan perbaikan
manajemen pemeliharaan dan perbaikan genetik. Performan sapi perah ditentukan
oleh faktor genetik yang dimilikinya dan lingkungan tempat ternak tersebut hidup.
Genetik adalah segala hal yang berhubungan dengan pewarisan sifat dari tetua
kepada turunannya. Perbaikan genetik pada sapi perah dapat dilakukan melalui
kegiatan seleksi, baik pada sifat produksi maupun kualitas susunya yang berpengaruh
terhadap sifat kualitas proteinnya. Melalui kemajuan dalam bidang bioteknologi
molekuler, dapat dilakukan upaya seleksi pada tingkat DNA yang memerlukan
identifikasi keragaman DNA dari gen yang mengontrol sifat-sifat yang ingin
diperbaiki. Teknik Polymerase Chain Reaction-Restriction Fragment Length
Polymorphism (PCR-RFLP) merupakan salah satu cara yang bisa dilakukan untuk
Susu memiliki kandungan protein yang terdiri dari kasein dan whey. Salah
satu gen yang diduga memiliki pengaruh besar terhadap persentase protein dari
produksi susu adalah gen β-laktoglobulin yang terdapat pada protein whey. Gen β
-laktoglobulin memiliki struktur yang sama dengan ikatan retinol binding dan
lipocalin. Oleh karena itu, gen β-laktoglobulin memiliki fungsi dalam transport
(pengangkutan) asam lemak dan vitamin A. Keragaman alel dari gen-gen kandidat
tersebut menarik karena kemungkinan berpengaruh langsung atau tidak langsung
pada kualitas susu dan diharapkan dapat menjadi informasi dalam
mempertimbangkan pelaksanaan program seleksi terhadap kualitas susu khususnya
protein susu.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengidentifikasi keragaman genetik gen β
-laktoglobulin menggunakan metode Polymerase Chain Reaction-Restriction
TINJAUAN PUSTAKA
Sapi Perah Friesian Holstein
Secara garis besar, bangsa-bangsa sapi (Bos) yang terdapat di dunia ada dua,
yaitu (1) kelompok yang berasal dari sapi Zebu (Bos indicus) atau jenis sapi yang
berpunuk, berasal dan tersebar di daerah tropis serta (2) kelompok dari Bos
primigenius yang tersebar di daerah sub tropis atau lebih dikenal dengan Bos Taurus
(Perkins, 1969). Jenis sapi perah Bos taurus yang unggul dan paling banyak
dipelihara adalah sapi Shorthorn (dari Inggris), Friesian Holstein (dari Belanda),
Jersey (dari selat Channel antara Inggris dan Perancis), Brown Swiss (dari
Switzerland), Red Danish (dari Denmark) dan Droughtmaster (dari Australia).
Sapi perah Friesian Holstein (FH) atau yang dikenal dengan nama Fries
Holland di Negara Belanda ini berasal dari nenek moyang sapi liar Bos (Taurus)
Typicus Primigenius yang tidak berpunuk. Sapi FH ditemukan di Propinsi Belanda
Utara dan Friesland Barat, Belanda (Schmidt & Vleck, 1974). Sapi ini di Amerika
Serikat disebut dengan Holstein Friesian atau disingkat Holstein dan di Eropa
disebut Friesian, sedangkan di Indonesia terkenal dengan nama Friesian Holstein
(Sudono, 2003).
Sapi FH memiliki ciri-ciri fisik berupa warna kulit belang hitam putih,
terdapat warna putih berbentuk segitiga pada dahinya, kaki bagian bawah dan bulu
ekornya berwarna putih, tanduknya pendek dan menjurus ke depan (Gambar 1).
Sifat-sifat pada sapi FH, yakni tenang dan jinak, tidak tahan panas, lebih mudah
menyesuaikan diri dengan keadaan lingkungan, serta lambat kedewasaannya
(Sudono, 2003). Rataan produksi susu sapi FH pada tahun 2008 di BPPT-SP Cikole
cukup tinggi, seperti ditunjukkan oleh capaian produksi susu harian yang mencapai
sebesar 14,2 kg, produksi susu tahunan sebesar 4058 kg dan laktasi lengkap sebesar
4558 kg (Anggraeni et al., 2008).
Sapi FH merupakan bangsa sapi perah berproduksi susu tinggi bila
dibandingkan dengan bangsa sapi perah lain, dengan kadar lemak susu rendah.
Holstein memiliki tanda yang khusus dan terkenal dengan produksi susunya. Sapi FH
kecil, memiliki tanda hitam dan putih yang terdapat pada tubuhnya baik didominasi
oleh warna hitam hingga didominasi oleh warna putih, atau setengah dan setengah,
40–45 kg atau lebih pada saat lahir. Sapi FH dewasa biasanya memiliki berat badan
580 kg, dan tinggi bahu pada saat berdiri adalah 147 cm (58 inchi). Sapi FH memiliki
masa kelamin yang lambat tidak seperti sapi-sapi bangsa Jersey dan Guernsey yang
termasuk masak dini (Sudono, 2003).
Sumber : Hilalnuha (2010)
Gambar 1.Sapi Friesian Holstein
Marker Assisted Selection (MAS)
Seleksi merupakan suatu proses dalam memilih individu dari suatu populasi
untuk dijadikan tetua bagi generasi berikutnya (Sumantri et al., 2007). Salah satu
metode seleksi adalah menggunakan marka penciri genetik. Penciri genetik
merupakan bagian dari gen yang menjadi patokan untuk mempelajari gen tersebut.
Lawrance dan Fowler (2002) menyatakan bahwa sifat kuantitatif dapat dipengaruhi
oleh sejumlah gen (polygenes) yang tempat atau posisi lokusnya dapat diketahui
melalui analisis pendekatan gen kandidat. Banyak gen yang teridentifikasi yang
memiliki potensi sebagai penciri genetik atau Marker Assisted Selection (MAS)
seperti gen-gen pengontrol protein susu yang dapat bermanfaat dalam mempercepat
kegiatan seleksi dari sifat produksi dan bernilai ekonomis (Sumantri et al., 2007).
Seleksi keunggulan genetik yang dilakukan dengan melalui identifikasi gen yang
berasosiasi kuat dengan sifat produksi serta kualitas susu akan sangat mendukung
Marker Assisted Selection (MAS) ini dapat diartikan sebagai penggunaan
informasi dari penanda genetik untuk membantu dalam pembuatan keputusan
seleksi. Hal ini biasanya akan dilakukan dalam sebuah kejadian yang melibatkan gen
utama yang sudah diketahui maupun belum (Kinghorn & Julius, 2000). MAS lebih
mudah untuk diterapkan ketika mutasi kausal telah diketahui. MAS dikenal sangat
bermanfaat ketika pengamatan terhadap sifat sulit atau mahal untuk diukur (sifat
yang tidak nampak, sex-limited atau terjadi gangguan dalam pengekspresian, hal-hal
invasif seperti penyakit atau rekaman setelah penyembelihan) ketika masing-masing
individu memberikan informasi yang sedikit dalam memprediksi nilai pemuliaan
(sifat dengan heritabilitas rendah, determinasi genetik atau penetrasi yang rendah
resesif) atau lebih umumnya, ketika pendekatan poligenik telah membatasi
efektivitas atau terlalu mahalnya biaya. Oleh karena itu, diyakini bahwa MAS sangat
menguntungkan bagi peternakan sapi perah yang berkonsentrasi pada kondisi yang
cukup buruk (pemuliaan konvensional) dan karena itu kondisi yang mendukung
untuk dilakukan MAS yakni pada sebagian besar sifat yang bersifat sex-limited,
memiliki interval generasi yang panjang, pengujian progeni panjang dan mahal,
pejantan sering diseleksi sebelum masa laktasi pertama mereka sebagai informasi
silsilah saja. Akhirnya, sifat-sifat fungsional seperti ketahanan terhadap penyakit dan
kesuburan, dengan heritabilitas rendah, serta memiliki pengaruh pada peningkatan
berat badan untuk tujuan reproduksi (Boichard et al., 2006).
Protein Susu
Komponen penyusun susu yang menjadi salah satu faktor penentu kualitas
susu adalah protein. Protein susu memiliki dua komponen utama yakni kasein dan
whey. Komponen terbanyak adalah kasein dengan persentase 80%, sedangkan whey
sebesar 20% (Roginskin, 2003). Whey merupakan fraksi dari protein yang terlarut
pada pH 4,6. Whey juga merupakan hasil sampingan dari produk keju. Whey adalah
salah satu komponen yang terpisah dari susu setelah pengentalan ketika rennet atau
sebuah substansi asam edible ditambahkan. Total protein whey secara berurutan β
-laktoglobulin, α-laktalbumin dan serum albumin sebanyak 50%, 20% dan 10%. β
-laktoglobulin, α-laktalbumin, Immunoglobuin (Ig), laktoferin dan Bovine Serum
jumlah β-laktoglobulin sebesar 7-12% dari total protein pada susu (Meza et al.,
2007). β-laktoglobulin merupakan komponen utama whey dalam protein susu.
Menurut Harper dan Hall (1981) variasi protein berdasarkan jumlahnya yakni
seperti tertera pada Tabel 1.
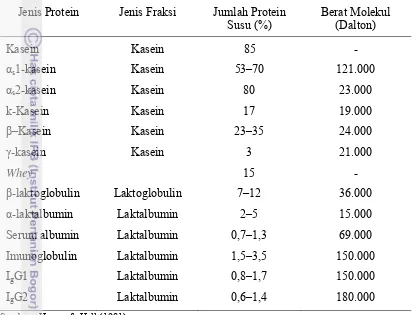
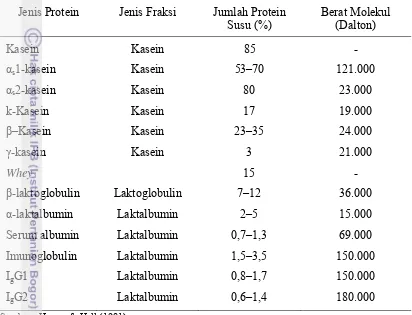
Tabel 1. Variasi Jenis, Fraksi dan Jumlah Protein Susu pada Sapi Perah
Jenis Protein Jenis Fraksi Jumlah Protein Susu (%)
Berat Molekul (Dalton)
Kasein Kasein 85 -
αs1-kasein Kasein 53–70 121.000
αs2-kasein Kasein 80 23.000
k-Kasein Kasein 17 19.000
β–Kasein Kasein 23–35 24.000
-kasein Kasein 3 21.000
Whey 15 -
β-laktoglobulin Laktoglobulin 7–12 36.000
α-laktalbumin Laktalbumin 2–5 15.000
Serum albumin Laktalbumin 0,7–1,3 69.000
Imunoglobulin Laktalbumin 1,5–3,5 150.000
IgG1 Laktalbumin 0,8–1,7 150.000
IgG2 Laktalbumin 0,6–1,4 180.000
Sumber : Harper & Hall (1981)
Harper & Hall (1981) menyatakan bahwa susu tersusun oleh protein kasein
dan whey. Komposisi keduanya yakni 85% dan 15%. Kasein terdiri dari fraksi
protein penyusun seperti αs1-kasein, αs2-kasein, k-kasein, β-kasein dan -kasein.
Sedangkan whey disusun oleh fraksi protein seperti β-laktoglobulin, α-laktalbumin,
serum albumin, imunoglobulin, IgG1 dan IgG2. Kandungan fraksi penyusun protein
whey tertinggi yakni protein β-laktoglobulin yakni menyusun β-laktoglobulin dengan
jumlah 7-12% dari total protein whey yang terdapat dalam susu. Fraksi protein selain
β-laktoglobulin hanya menyusun sebagian kecil dari protein whey. β-laktoglobulin juga memiliki berat molekul yang relatif lebih rendah apabila dibandingkan dengan
pada protein α-laktalbumin serta jauh lebih kecil dari pada serum albumin,
imunoglobulin, IgG1 dan IgG2.
Keragaman Gen β-laktoglobulin
Gen merupakan unit terkecil pewarisan sifat yang terdapat pada kromosom
yang tersusun oleh suatu substansi yang disebut dengan deoxyribonucleic acid
(DNA). DNA merupakan molekul yang terdapat dalam inti sel. Susbtansi DNA
terdiri dari dua untaian panjang terpilin yang membentuk double helix (seperti tangga
terpilin). Setiap dua untaian DNA disusun oleh ribuan unit nukleotida. Setiap
nukleotida disusun oleh basa nitrogen, gula deoksiribosa (deoxyribose) dan asam
fosfat. Antar nukleotida dihubungkan oleh ikatan kimia antara gula dan fosfat. Kedua
untaian DNA dihubungkan oleh ikatan lemah hidrogen. Ada 4 macam basa nitrogen
yang ditemukan pada DNA, yaitu adenine, timin, sitosin, dan guanin. Sitosin selalu
berpasangan dengan guanine dan adenin selalu berpasangan dengan timin. Struktur
tersebut memungkinkan terjadinya pewarisan sifat. DNA dapat diisolasi dari
berbagai jaringan hidup yang memiliki inti sel. DNA dapat diekstrak dari darah
karena dalam darah terdapat jaringan sel darah putih serta sel darah merah yang
masih muda (Williams, 2005).
β-laktoglobulin dapat stabil pada asam yang tinggi, tahan pada pH normal susu sapi, berat molekul 36.000 Dalton, serta merupakan polipeptida dengan ikatan
tunggal 18kDa yang terdiri dari 162 residu asam amino. Variasi alel A pada β
-laktoglobulin susu sapi berbeda dari variasi alel B dikarenakan oleh karena dua asam
amino saja, yaitu aspartat-64 dan valine-118. Asam-asam amino ini disubtitusi
berturut-turut oleh glysin dan alanin dalam alel B. Semua alel terdiri lima residu
systein, keempatnya diliputi dalam pembentukan jembatan disulfida ikatan dalam
(Rachagani et al., 2006).
β-laktoglobulin termasuk kelompok protein lipokolin yang dapat mengikat molekul-molekul yang bersifat hidrofobik dan berperan penting dalam metabolisme
lemak. β-laktoglobulin dalam susu mampu meningkatkan presentase kandungan
protein susu (Kumar et al., 2006).
Hasil–hasil dari penelitian terhadap gen β-laktoglobulin yang telah dilakukan
ditemukan pada ternak ruminansia. Tabel 2 berikut adalah tabel yang menunjukkan
keragaman gen β-laktoglobulin pada ternak sapi dari berbagai bangsa.
Tabel 2. Keragaman Gen β-laktoglobulin dari Beberapa Penelitian Terdahulu Terhadap Ternak Sapi dari Berbagai Bangsa
Bangsa Sapi Frekuensi Alel Frekuensi Genotipe Sumber
A B AA AB BB
Holstein 0,400 0,600 0,100 0,600 0,300 Nury (2010)
0,529 0,471 0,257 0,544 0,198 Heidari et al. (2009) 0,231 0,769 0,037 0,387 0,576 Lin & Mcallister (1986)
0,387 0,613 - - - Ng-Kwai-Hang et al. (1984)
Brown Swiss 0,440 0,560 0,172 0,289 0,537 Celik, (2003)
Sahiwal 0,170 0,830 0,031 0,276 0,693 Rachagani et al. (2006)
Tharparkar 0,390 0,610 0,023 0,733 0,244 Rachagani et al. (2006)
Guernsey 0,210 0,790 - - - Eenennaam & Medrano (1991)
Milking
Shorthorn
0,310 0,690 - - - Eenennaam & Medrano (1991)
Red Shindi 0,250 0,750 - - - Meignanalakshmi et al. (2001)
Ayrshire 0,158 0,842 0,019 0,279 0,702 Lin & Mcallister (1986)
Gen β-lactoglobulin pada penelitian sebelumnya banyak dijumpai genotipe
AB dengan frekuensi yang lebih tinggi dari genotipe AA dan BB. Hal ini
ditunjukkan pada penelitian Rachagani et al. (2006) yang mendapatkan hasil
frekuensi genotipe AB sebesar 0,733 sesuai dengan penelitian Heidari et al. (2009)
dengan frekuensi genotipe AB sebesar 0,544 dan penelitian Nury (2010) yang
memiliki nilai frekuensi genotipe AB sebesar 0,60. Hasil yang lain menunjukkan
bahwa baik genotipe BB memiliki nilai frekuensi yang lebih tinggi dari genotype AA
dan AB pada beberapa jenis bangsa sapi. Namun, sangat jarang ditemukan informasi
yang menunjukkan bahwa genotipe AA memiliki nilai frekuensi yang lebih tinggi
dari pada genotipe AB maupun BB. Hasil dari beberapa penelitian terdahulu
tinggi dari pada frekuensi pada alel A. Hal ini dikuatkan dengan hasil penelitian dari
Ng-Kwai-Hang (1984), Lin & Mcallister (1986), Eenannaam & Medrano (1991),
Sabour et al. (1993), Lunden et al. (1997), Meignanalakshmi et al. (2001), Celik
(2003), Rachagani et al. (2006), dan Nury (2010) yang dilakukan pada jenis sapi
perah dari berbagai bangsa.
Struktur Gen β-laktoglobulin
Gen β-laktoglobulin pada ternak sapi terletak pada kromosom 11 (Daniela et
al., 2008). Rekonstruksi struktur gen β-laktoglobulin dapat digambarkan berdasarkan
sekuens gen β-laktoglobulin di GenBank (Nomor akses : X14710) (Gambar 2) :
Keterangan : Ekson : Intron =
Sekuen awal 2170 (2170 pb)
Ekson 1 2171–2305 ( 135 pb) Intron 1 2306–2974 ( 669 pb) Ekson 2 2975–3114 ( 140 pb) Intron 2 3115–3975 ( 861 pb) Ekson 3 3976–4049 ( 74 pb) Intron 3 4050–5166 (1117 pb) Ekson 4 5167–5277 ( 111 pb) Intron 4 5278–5952 ( 675 pb) Ekson 5 5953–6057 ( 105 pb) Intron 5 6058–6278 ( 221 pb) Ekson 6 6279–6321 ( 43 pb) Intron 6 6322–6710 ( 389 pb) Ekson 7 6711–6893 ( 183 pb)
Sumber : Alexander et al. (1989)
Gambar 2. Rekonstruksi Struktur Gen β-laktoglobulin Berdasarkan Sekuen Gen β-laktoglobulin di GenBank
Alexander et al. (1989) melaporkan bahwa sumber organisme sampel yang
digunakan, yakni sapi jenis Bos Taurus. Struktur gen β-laktoglobulin ditemukan
terdiri dari 6 intron dan 7 ekson dengan panjang gen β-laktoglobulin pada sapi adalah
7877 pb (pasang basa). Menurut Nei & Kumar (2000), intron adalah segmen pada
bagian yang tidak dapat menyandikan basa yang dihubungkan dalam proses produksi
sebuah mRNA alami. Ekson adalah segmen pada struktur protein yang mampu
Ekson 1 Ekson 2 Ekson 3 Ekson 4 Ekson 5 Ekson 6 Ekson 7
Intron 1 Intron 2 Intron 3 Intron 4 Intron 5 Intron 6
Sekuen awal
menyandikan jenis protein. Jumlah dari ekson dalam sebuah gen bervariasi dari gen
yang satu ke gen yang lainnya. Gen prokariot tidak memiliki intron, di samping itu
beberapa gen eukariot (sebagai contohnya gen penyakit otot menyusut) memiliki
banyak hingga 78 intron (Roberts et al., 1992). Fungsi utama dari intron tidak
diketahui dengan jelas. Biasanya, sebuah intron diawali dengan dinukleotida GT dan
diakhiri dengan AG. Dinuklotida ini menunjukkan standar untuk penghubungan
intron yang benar.
Ruas fragmen pada hasil penelitian oleh Alexander et al. (1989)
menggunakan primer gen β-laktoglobulin dengan forward
5’TGTGCTGGACACCGACTACAAAAA3’ dan β-laktoglobulin reverse
5’GCTCCCGGTATATGACCACCCTCT3’. Alel yang dihasilkan ada dua jenis
yaitu alel A (148 bp, 99 bp, 74 bp) dan alel B (99 bp, 74 bp).
Metode PCR-RFLP
Polymerase Chain Reaction (PCR) merupakan suatu teknik untuk
menggandakan jumlah molekul DNA secara in vitro. Proses ini berjalan dengan
bantuan enzim polymerase dan primer. Primer merupakan oligonukleoteida spesifik
yang menempel pada bagian sampel DNA yang akan diperbanyak (Williams, 2005).
Enzim polymerase merupakan enzim yang dapat mencetak urutan DNA baru. Hasil
dari proses PCR dapat langsung divisualilsasikan dengan elektroforesis atau dapat
digunakan untuk analisis lebih lanjut (Williams, 2005).
Menurut Muladno (2002), Polymerase Chain Reaction (PCR) merupakan
suatu reaksi in vitro untuk menggandakan jumlah molekul DNA pada target tertentu
dengan mensintesa molekul DNA baru yang berkomplemen dengan molekul DNA
target tersebut dengan bantuan enzim polymerase dan oligonukleotida pendek
sebagai primer dalam suatu thermocyler. Secara umum, reaksi yang terjadi dalam
mesin PCR dapat dibagi menjadi tiga tahap yaitu tahap denaturasi (pemisahan untai
ganda DNA), tahap annealing (penempatan primer) dan tahap ekstensi
(pemanjangan primer).
Restriction Fragment Length Polymorphism (RFLP) adalah profil DNA
berupa fragmen-fragmen DNA hasil pemotongan enzim endonuklease untuk
situs pemotongan empat dan enam basa umum dipakai untuk analisis keragaman
genetik menggunakan pendekatan analisis RFLP. Yahyoui et al. (2001) menyatakan
bahwa PCR RFLP merupakan suatu metode yang sederhana dan biasa digunakan
untuk mencari keragaman genotipe.
Meskipun derajat keragaman genetik yang tinggi dalam spesies adalah nyata
dari variasi pada karakter morfologi, evaluasi kuantitatif dari variasi genetik dapat
diidentifikasi hanya setelah teknik elektroforesis protein ditemukan dari hasil
penelitian genetika populasi di pertengahan tahun 1960 (Harris, 1966; Lewontin &
Hubby, 1966). Teknik ini mampu mendeteksi perubahan isi dalam protein. Masih
bagian dari aplikasi dari teknik ini, menyatakan bahwa kebanyakan dari populasi
alami terdiri atas sejumlah besar variasi genetik dan teknik ini memfasilitasi
penelitian pada genetik populasi yang sangat besar (Lewontin, 1974; Nei, 1975)
Analisis RFLP biasa digunakan untuk melakukan deteksi terhadap adanya
keragaman pada gen yang berhubungan dengan sifat ekonomis, seperti produksi dan
kualitas susu (Sumantri et al., 2007). Selain PCR-RFLP, PCR-SSCP (Polymerase
Chain Reaction-Single Strand Conformation Polymorphism) juga dapat digunakan
untuk analisis keragaman DNA. Metode PCR-SSCP merupakan metode yang handal
dalam melakukan pendeteksian terhadap adanya mutasi secara cepat (Hayashi,
1991). Metode ini juga merupakan metode elektroforesis yang popular untuk
mengidentifikasi mutasi sekuens karena mudah, murah, dan memiliki sensitifitas
tinggi walau hanya satu nukleotida saja (Nataraj, 1999). SSCP dapat mendeteksi
keragaman dan mutasi titik pada berbagai posisi pada fragment DNA meskipun
mutasi yang terjadi hanya pada satu basa (Orita et al., 1998). Asumsi yang mendasari
metode analisis SSCP adalah bahwa perubahan yang terjadi pada nukleotdida
meskipun terjadi hanya pada satu basa akan mempengaruhi bentuk (conformation)
dari fragmen DNA pada kondisi untai tunggal (Bastos et al., 2001). Perbedaan
konformasi molekul akan menyebabkan perbedaan migrasinya dalam gel
poliakrilamid pada saat elektroforesis (Montaldo et al., 1998). Sensitifitas dari
analisis SSCP merupakan hal yang cukup sulit dalam teknik karena sangat peka
dalam kondisi elektroforesis. Sensitifitas dipengaruhi beberapa faktor termasuk
didalamnya tipe subtitusi basa, panjang fragmen, kandungan G dan C dalam fragmen
Metode PCR-RFLP bisa mendeteksi mutasi jika situs restriksi mengalami
perubahan susunan basa. Apabila mutasi terjadi di luar situs restriksi, maka mutasi
tersebut tidak dapat dideteksi. Metode PCR-SSCP dapat mendeteksi perubahan pada
satu basa tetapi tidak dapat diketahui basa mana yang berubah. DNA sekuensing
dapat digunakan untuk mengatasi kelemahan tersebut. Metode yang biasa digunakan
dalam sekuensing DNA adalah metode Sanger (Muladno, 2002). Metode sekuens ini
dapat digunakan untuk membandingkan sekuens dari gen yang sama pada sama pada
spesies yang berbeda sehingga dimungkinkan dibuatnya diagram filogenetik.
Elektroforesis
Elektroforesis adalah suatu cara pemisahan campuran dari beberapa senyawa
dengan melakukan suspense ke dalam air kemudian diberikan aliran listrik. Gel yang
ditempatkan ke dalam sumur elektroforesis yang mengandung larutan buffer dialiri
listrik. Molekul DNA yang bermuatan negatif pada PH netral akan bergerak ke arah
positif. DNA bergerak melalui gel pada kecepatan yang berbeda tergantung
ukurannya (Winarno dan Agustinah, 2007).
Hasil analisis DNA dapat diketahui melalui proses elektroforesis. Komponen
bahan kimia yang digunakan dalam proses tersebut yang utama adalah gel. Gel yang
biasa digunakan yaitu gel agarose dan gel poliakrilamid. Kecepatan migrasi DNA
pada proses elektroforesis ditentukan oleh beberapa faktor yaitu ukuran molekul
DNA, konsentrasi agarose, konformasi DNA, voltase yang digunakan, jenis
Ethidium Bromide (EtBr) yang digunakan serta komposisi larutan buffer yang
dipakai (Muladno, 2010).
Keragaman Genetik
Keragaman genetik dalam suatu populasi merupakan salah satu sarana untuk
mengetahui dan melestarikan bangsa-bangsa dalam populasi terkait dengan penciri
suatu sifat khusus. Informasi mengenai keragaman genetik suatu bangsa akan sangat
bermanfaat bagi keamanan dan ketersediaan bahan pangan yang berkesinambungan
(Blot et al., 1998).
Keseimbangan genetik dapat ditentukan dengan menggunakan hukum
Hardy-Weinberg. Hukum ini merupakan salah satu yang paling dasar dan konsep yang
dalam keadaan panmixia dan tanpa adanya gangguan dari faktor yang berhubungan
dengan genetik seperti seleksi, migrasi dan mutasi. Frekuensi gen dalam populasi
akan tetap sama dari generasi ke generasi berikutnya. Populasi yang demikian dapat
disebut dalam keadaan yang seimbang (equilibrium).
Pengujian Hardy-Weinberg ini sangat bermanfaat karena untuk lokus non
kodominan yang berada pada frekuensi genotipe keseimbangan Hardy-Weinberg
dapat diperkiraan dari frekuensi alel dan memiliki kemungkinan analisis yang sangat
kuat terhadap hubungan penanda genetik dengan penyakit (Chen & Chatterjee,
2006). Hukum Hardy-Weinberg tidaklah merupakan hukum yang mati karena
apabila suatu populasi yang telah mencapai keseimbangan genetik diganggu
sedemikian rupa sehingga proporsi genotipenya berubah, maka cukup dibutuhkan
satu generasi perkawinan acak untuk mengembalikan keadaan seimbangnya lagi
tetapi dengan keadaan keseimbangan yang baru, artinya baik frekuensi gen maupun
genotipenya akan berubah (Hardjosubroto, 1998). Nei dan Kumar (2000)
menyatakan bahwa populasi dinilai beragam jika memiliki dua atau lebih alel dalam
satu lokus dengan frekuensi yang cukup (biasanya lebih dari 1%).
Keragaman genetik dapat diukur pula secara akurat dengan nilai
heterozigositas (Nei, 1987). Pendugaan heterozigositas memiliki arti penting untuk
diketahui dalam mempelajari genetika populasi. Derajat heterozigositas merupakan
rataan persentase lokus heterozigositas tiap individu atau rataan persentase individu
heterozigot dalam populasi (Nei, 1987). Nilai dari derajat heterozigositas dapat
memberikan informasi mengenai tingkat polimorfisme suatu alel, serta prospek
populasi di masa yang akan datang (Falconer & Mackay, 1996). Nei (1987)
menyebutkan bahwa suatu alel dapat dikatakan polimorfik jika memiliki frekuensi
alel sama dengan atau kurang dari 0,99. Tingkat tinggi rendahnya variasi dari suatu
populasi dapat diketahui pula dari hasil penelitian oleh Javanmard et al. (2005) yang
menyatakan bahwa apabila nilai heterozigositas menunjukkan nilai di bawah 0,5
(50%) maka hal tersebut mengidentifikasikan rendahnya variasi suatu gen dalam
MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilaksanakan pada bulan Desember 2009 hingga bulan April
2010. Penelitian ini dilaksanakan di Laboratorium Genetika Molekuler Ternak,
Bagian Pemuliaan dan Genetika Ternak, Departemen Ilmu Produksi dan Teknologi
Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Materi Sampel
Sampel darah sapi Friesian-Holstein (FH) berasal dari peternakan rakyat desa
Pasir Kemis dan Cilumber di kabupaten Lembang-Bandung. Total darah yang
digunakan sebanyak 183 sampel, berurutan dari Pasir Kemis sejumlah 95 sampel dan
Cilumber sejumlah 98 sampel. Sampel DNA yang digunakan merupakan koleksi
sampel Laboratorium Genetika Molekuler Ternak, bagian Pemuliaan dan Genetika
Ternak, Fakultas Peternakan, Institut Pertanian Bogor.
Primer
Amplifikasi gen β-laktoglobulin pada ternak sapi perah mengacu pada
penelitian yang dilakukan oleh Karimi et al. (2009) dengan penggunaan primer yang
tampak pada Tabel 3.
Tabel 3. Sekuen Gen β-laktoglobulin
Gen Sekuen Primer Produk
PCR
Enzim Restriksi
β-laktoglobulin F 5’TGTGCTGGACACCGACTACAAAAA3’ R 5’GCTCCCGGTATATGACCACCCTCT3’
247 bp HaeIII
Amplifikasi Gen β-laktoglobulin
Bahan–bahan yang digunakan dalam analisis PCR-RFLP adalah sampel
DNA, air destilata, MgCl2, dBTP, 10xbuffer, primer, enzyme taq DNA polymerase,
enzim restriksi HaeIII dengan buffernya. Alat-alat yang digunakan adalah tabung
eppendorf, pipet mikro, vortex, alat sentrifugasi, tabung PCR, mesin PCR (Applied
Elektroforesis
Bahan-bahan yang digunakan untuk membuat satu lembar gel ukuran besar
(16 sampel) adalah sebagai berikut; 0,45 gram agarose, 30 ml 0,5xTBE, 2,5 µl EtBr
(Ethidium bromide). Selama proses elektroforesis bahan yang digunakan yaitu
10xbuffer, loading dye dan marker. Alat yang digunakan diantaranya adalah
timbangan digital, gelas ukur, stirrer, microwave, gelas kimia, plate cetakan gel,
pipet mikro, tip, plastik mika, power supply, sarung tangan dan UV transilluminator.
Prosedur Pengambilan Sampel Darah
Sampel darah diambil melalui vena jugularis dengan menggunakan jarum
vaccutainer no 21 G.
Isolasi DNA
Isolasi DNA dilakukan dari sampel darah dengan menggunakan metode
ektraksi phenol-chloroform (Sambrook et al., 1989) yang telah dimodifikasi untuk
penggunaan sampel darah yang disimpan dalam alkohol dengan prosedur sebagai
berikut:
Preparasi sampel. Sampel darah dalam ethanol (EtOH) sebanyak 200 µl dipindahkan ke tabung 1,5 µl. Kemudian dihilangkan alkoholnya dengan
menambahkan air destilasi 1000 µl. Sampel disentrifugasi pada kecepatan 800 rpm
selama 5 menit dan bagian supernatannya dibuang. Pencucian tersebut diulangi untuk
menghilangkan alkohol dalam darah sebanyak mungkin.
Degradasi protein. Sampel yang telah dibersihkan dari alkohol ditambahkan 1xSTE (Sodium Tris EDTA) hingga volume 340 µl (± 200 µl), 40 µl SDS (Sodium Dosesil
Sulfat) 10% dan 20 µl proteinase k 5 mg/ml. Campuran diinkubasi dan digoyang
pada suhu 50 ºC selama semalam.
Degradasi bahan organik. Sampel yang telah diinkubasi ditambahkan 400 µl larutan phenol, 400 µl CIAA (Chloroform : isoamyl alcohol (24 : 1) dan 40 µl 5 M
Presipitasi DNA. Perlakuan berikutnya sampel disentrifugasi pada kecepatan 5000 rpm selama 10 menit hingga fase DNA terpisah dengan fase phenol. Fase DNA
dipindahkan dalam tabung baru. Kemudian ditambahkan 800 µl alkohol absolut dan
40 µl 5 M NaCl, lalu diinkubasi pada suhu -20 ºC selama semalam. Larutan yang
telah diproses disentrifugasi pada kecepatan 12000 rpm selama 10 menit, bagian
alkohol dibuang sebanyak mungkin. Bagian endapan (DNA) yang tersisa
ditambahkan 800 µl alkohol 70% dan disentrifugasi seperti sebelumnya, serta bagian
alkohol dibuang sebanyak mungkin. Bagian DNA yang tersisa dibiarkan dalam
keadaan terbuka pada suhu ruang hingga kering. Terakhir, ditambahkan 100 µl
larutan pengemulsi yang telah dipanaskan sebelumnya. DNA disimpan pada suhu -20
ºC dan siap untuk digunakan.
Analisis PCR-RFLP
PCR pada perlakuan ini menggunakan tabung dengan volume reaksi 25 µl
yang di dalamnya terdiri dari campuran sampel DNA sebanyak 2 µl, air destilata
16,7 µl, 0,5 µl untuk masing-masing primer, 10xbuffer sebanyak 2,5 µl, 2,5 mM
MgCl2 µl dan 2 mM dNTP 0,3 µl, BSA 1 µl dan enzim Go Taq 0,1 µl. Kemudian,
campuran yang terdapat dalam tabung PCR dihomogenkan dengan cara divortex, lalu
diendapkan dengan melalui cara sentrifugasi pada kecepatan 5000 rpm selama 30
detik.
Proses selanjutnya adalah amplifikasi di mesin PCR Applied Bio System
selama 35 siklus dalam berbagai tahapan, pertama melakukan denaturasi awal pada
suhu 95 ºC selama lima menit. Tahap kedua yaitu denaturasi pada suhu 95 ºC selama
30 detik. Tahap ketiga dilanjutkan dengan penempelan primer (annealing) pada suhu
60 ºC selama 45 detik. Tahap keempat dilanjutkan dengan pemanjangan molekul
DNA pada suhu 72 ºC selama satu menit. Tahap kelima yaitu pemanjangan akhir
molekul DNA yang terjadi pada suhu 72 ºC selama lima menit.
Produk PCR yang telah berhasil nampak, diambil sebanyak 5 µl dan
dipindahkan ke tabung baru, yaitu tabung khusus untuk proses pemotongan.
Kemudian, pada tabung tersebut ditambahkan 0,3 µl enzim restriksi HaeIII 10 unit,
0,7 buffer R dan 1 µl air destilata. Setelah semua dimasukkan, maka sampel
Elektroforesis
Elektroforesis produk PCR dilakukan dengan menggunakan 5 µl produk PCR
pada gel agarose. Gel agarose dibuat dengan mencampurkan 0,45 gram agarose
dengan 30 µl 0,5xTBE. Campuran tersebut dimasukkan dalam microwave selama
empat menit. Campuran agarose dan TBE yang telah terlarut tersebut didinginkan
dengan menggunakan magnet stirrer yang dimasukkan di dalamnya dan
ditambahkan Ethidium Bromida (EtBr) sebanyak 2,5 µl dan terus diputar. Sampel
gel diangkat bila sudah cukup dingin dan dituang ke plate kaca yang telah dipasang
sisir sebagai bahan pembuat sumurnya.
Produk PCR yang sudah diperoleh kemudian dilakukan pengamatan dengan
melakukan pewarnaan DNA menggunakan loading dye sebanyak 1 µl dengan sampel
sejumlah 5 µl dan keduanya dicampur merata dalam pipet mikro. Sampel yang telah
diwarnai dimasukkan dalam sumur. Terakhir, marker dimasukkan sebagai indikator
dari panjang DNA. Gel agarose yang telah diisi oleh sampel dibenamkan dalam
larutan 0,5xTBE buffer dan dielektroforesis selama 45 menit. Hasil elektroforesis
divisualisasi dengan mengamatinya di atas UV transilluminator. Pita DNA yang
muncul dibandingkan dengan marker untuk diketahui panjang fragmennya dan
jumlah pita DNA dari setiap sampel dibandingkan untuk menentukan genotype pita
DNA. Penentuan alel β-laktoglobulin (A) dan β-laktoglobulin (B) ditunjukkan
dengan jumlah dan ukuran besarnya fragmen yang terpotong berdasarkan sekuen β
-laktoglobulin. Sesuai dengan genotyping berdasarkan (Karimi et al., 2009) alel A
gen β-laktoglobulin memiliki titik potong HaeIII (GG|CC) dan menunjukkan adanya
dua fragmen yang masing-masing panjangnya 99 dan 148, sedangkan alel B gen β
-laktoglobulin memiliki dua titik potong dan menghasilkan fragmen sepanjang 74, 74
dan 99 pb.
Analisis Data Frekuensi Alel dan Genotipe
Frekuensi genotipe merupakan rasio dari jumlah suatu genotipe terhadap
jumlah populasi. Keragaman genotipe pada masing-masing individu ternak dapat
diketahui dengan menghitung perbandingan jumlah genotipe tertentu pada setiap
populasi, dengan rumus Nei dan Kumar (2000) sebagai berikut :
Frekuensi alel merupakan frekuensi relatif dari suatu alel dalam populasi atau
jumlah suatu alel terhadap jumlah total alel dalam suatu populasi. Frekuensi alel (χi)
gen β-laktoglobulin dapat dihitung berdasarkan rumus Nei dan Kumar (2000),
sebagai berikut :
Keterangan :
= frekuensi genotipe ke-ii = frekuensi alel ke-i
= jumlah individu bergenotipe ii = jumlah individu bergenotipe ij N = jumlah individu sampel
Keseimbangan Hardy-Weinberg (HW)
Keseimbangan Hardy-Weinberg diuji dengan menggunakan perhitungan
Chi-Kuadrat (Hartl dan Clark, 1997):
Keterangan :
= chi-kuadrat
O = jumlah pengamatan genotipe ke-i E = jumlah harapan genotipe ke-i
Derajat bebas (db) yang digunakan merupakan hasil pengurangan antara
jumlah genotype dengan jumlah alel (Allendrof dan Luikart, 2007):
Heterozigositas
Keragaman genetik dapat diketahui melalui estimasi frekuensi heterozigositas
pengamatan yang diperoleh dari masing-masing populasi, dngan menggunakan
rumus Weir (1996) sebagai berikut :
Keterangan :
Ho = heterozigositas pengamatan (populasi) = jumlah individu heterozigositas N = jumlah individu yang diamati
Heterozigositas harapan (He) berdasarkan frekuensi alel dihitung
menggunakan rumus Nei dan Kumar (2000) sebagai berikut :
Keterangan :
He = nilai heterozigositas harapan = frekuensi alel
HASIL DAN PEMBAHASAN
Amplifikasi Gen ß-laktoglobulin
Penelitian ini berhasil melakukan amplifikasi terhadap gen ß-laktoglobulin
pada sapi perah Friesian Holstein (FH) betina laktasi yang berasal dari peternak di
Koperasi Peternak Sapi Bandung Utara (KPSBU), Lembang. Fragmen gen β
-laktoglobulin ini berhasil diamplifikasi dengan menggunakan primer yang mengacu
pada Karimi et al. (2009). Panjang produk hasil amplifikasi adalah 247 pb (pasang
basa) yang terletak pada ekson 4. Tingkat keberhasilan amplifikasi DNA ditentukan
oleh konsentrasi sampel DNA, taq polymerase, dinukleotida, ion Mg, buffer dan
primer (Yuwono, 2006). Proses amplifikasi dilakukan dengan menggunakan metode
Polymerase Chain Reaction-Restriction Fragment Length Polymorphism
(PCR-RFLP). Hasil amplifikasi fragmen Gen β-laktoglobulin dengan metode PCR pada
sapi FH yang divisualisasikan pada gel agarose 1,5% ditampilkan pada Gambar 3.
M 1 2 3 4 5 6 7 8
Keterangan : M = Marker; Nomor 1-8 : Ruas Gen β-laktoglobulin
Gambar 3. Pita Amplifikasi Fragmen Gen β-laktoglobulin dengan Metode PCR pada Sapi FH
Suhu annealing menjadi dasar awal dalam proses PCR karena memiliki
pengaruh yang cukup besar terhadap hasil dari produk PCR yang diperoleh. Suhu
annealing adalah kisaran suhu yang membuat primer menempel (komplementer) ke
DNA cetakan. Suhu annealing menjadi sangat penting dalam proses amplifikasi,
dikarenakan proses perpanjangan DNA dimulai dari primer (Muladno, 2002). Suhu
annealing diketahui mampu mempengaruhi akan menempel tidaknya primer dengan
fragmen DNA target pada saat dilakukan proses PCR. Suhu annealing yang biasa 500 pb
200 pb 100 pb
digunakan yaitu antara 50-65 °C dan pada penelitian ini suhu annealing yang
digunakan, yaitu 60 °C sesuai dengan literatur dari Karimi et al. (2009).
Keragaman Gen β-laktoglobulin
Hasil amplifikasi serta hasil pemotongan terhadap gen β-laktoglobulin
dengan menggunakan enzim restriksi HaeIII menunjukkan hasil yang sesuai dengan
literatur dari Karimi et al. (2009), yang dilaporkan panjang fragmen gen diketahui
yakni sepanjang 247 bp dengan pemotongan situs basa pada posisi
5’....GG|CC....3’yang terletak pada ekson 4. Pemotongan ini dapat dilihat pada Gambar 3 dan posisi penempelan primer pada sekuens gen β-laktoglobulin dapat
dilihat pada Gambar 4 :
Forward
5161 ttccagcctt gaatgagaac aaagtccttg tgctggacac cgactacaaa aagtacctgc
5221 tcttctgcat ggagaacagt gctgagcccg agcaaagcct gg|cctgccag tgcctgggtg
5281 ggtgccaacc ctggctgccc agggagacca gctgtgtggt cctcgctgca acgggg|ccgg
5341 gggggacggt gggagcaggg agcttgattc ccaggaggag gagggatggg gggtccccga 5401 gtcccgccag gagagggtgg tcatataccg ggagccggtg tcctgggggc ctgtgggtga
Primer reverse
Keterangan : GG|CC menunjukkan situs pemotongan enzim HaeIII; nukleotida yang digaris bawahi menunjukkan primer
Gambar 3. Pemotongan gen ß-laktoglobulin dengan menggunakan enzim HaeIII pada ekson 4
Alel A : 5’-GCCTGG TCTGCC… ACGGGG|CCGGGG-3’ Alel B : 5’-GCCTGG|CCTGCC… ACGGGG|CCGGGG-3’
Keterangan : Garis tebal menunjukkan posisi penempelan primer; Garis bawah menunjukkan posisi terjadinya mutasi basa C - T ; Alel A memiliki basa T pada posisi ke-5263 ; Alel B memiliki basa C pada posisi ke-5263
Gambar 4. Posisi Penempelan Primer pada Sekuen Gen β-laktoglobulin dengan nomor akses GenBank X14710
Pemotongan dengan enzim HaeIII memiliki hasil potongan yang disebut
dengan blunt end (tumpul) karena tidak memiliki bagian molekul yang mempunyai
bentuk single stranded (tidak berpasangan) (Muladno, 2010). Hasil pemotongan
dengan enzim HaeIII menunjukkan bahwasanya terjadi pemotongan titik-titik pada
Hasil analisis terhadap ruas atau pita gen ß-laktoglobulin dengan teknik PCR
RFLP menggunakan enzim restriksi HaeIII menunjukkan bahwa gen ß-laktoglobulin
yang diamati memiliki sifat beragam (polimorfik). Terdapat tiga genotipe, yaitu
genotipe AA, AB dan BB yang berasal dari dua alel, yaitu alel A dan alel B. Pola
Pita ß-laktoglobulin sapi FH dalam gel agarose 2,5% menggunakan enzim restriksi
HaeIII tampak seperti pada Gambar 6.
M 1 2 3 4 5 6 7 8 9
M AB AB AB AB AA AB BB AB BB
Elektroforesis gen ß-laktoglobulin
Keterangan :Huruf M = Marker; 1-9 = sampel; AA, AB, dan BB = hasil genotipe; AA = 99 dan 148 pb; AB = 74, 99 dan 148 pb; BB = 74 dan 99 pb
Gambar 6. Pola Pita ß-laktoglobulin Sapi FH dalam Gel Agarose 2,5% menggunakan Enzim Restriksi HaeIII
Pengamatan terhadap gen β-laktoglobulin pada sapi perah Friesian Holstein
di Cilumber dan Pasir Kemis, Lembang diketahui memiliki dua macam alel, yakni
alel A dan alel B. Hal ini sesuai dengan pernyataan dari Yahyaoui (2003) bahwa
terdapat dua variant alel pada gen ß-laktoglobulin yaitu A dan B. Pernyataan yang
sama juga diungkapkan oleh Chung et al. (1995) bahwa pada sapi Korea juga
ditemukan adanya dua varian dari gen ß-laktoglobulin, yakni A dan B. Alel
merupakan bentuk alternatif dari gen yang terjadi akibat mutasi (Noor, 2008).
Pemotongan oleh enzim restriksi HaeIII terhadap ruas gen β-laktoglobulin
menghasilkan amplifikasi sekuen DNA dengan pemotongan pada dua titik, yakni
pada nukleotida ke-5263 dan 5337 atau dapat dikatakan pula terjadi pemotongan
pada posisi basa ke 74 pb dan 148 pb dari produk PCR. Hasil potongan 500 pb
100 pb 200 pb
74 pb
menghasilkan tiga macam fragmen dengan panjang berturut-turut 74 pb, 74 pb dan
99 pb. Akan tetapi, dikarenakan terjadi titik potong yang sama yakni pada titik ke 74
pb maka titik tersebut membentuk 1 pita dikarenakan saling berhimpitan. Perpaduan
dari ketiga fragmen tersebut menunjukkan genotipe dengan homozigot BB yang
berarti memiliki alel B (Gambar 5). Alel A ditunjukkan dengan hasil potongan
fragmen yang bergenotipe homozigot AA dengan pola pita yang memiliki dua titik
basa (99 pb dan 148 pb). Asumsi yang mendukung dalam penentuan tipe genotipe,
yaitu semua pita yang memiliki laju migrasi yang sama merupakan alel yang
homolog (Nei, 1987) atau alel merupakan gen yang menempati lokus-lokus yang
sama pada kromosom yang homolog (Noor, 2008).
Frekuensi Gen ß-laktoglobulin
Hasil pengamatan terhadap gen ß-laktoglobulin pada sampel DNA sapi FH
yang dibudidayakan di dua daerah yakni dari Pasir Kemis dan Cilumber, Lembang
diketahui bahwa terdapat keragaman genotipe pada sapi FH tersebut. Hal ini dapat
diketahui dari adanya dua alel yang terbentuk yakni alel A dan B serta terbentuknya
tiga macam genotipe yakni genotipe AA, AB dan BB. Masing-masing alel dan
genotipe memiliki frekuensinya masing-masing. Frekuensi alel yaitu frekuensi relatif
dari suatu alel dalam populasi atau jumlah suatu alel terhadap jumlah total alel dalam
suatu populasi, sedangkan frekuensi genotipe yaitu rasio jumlah suatu genotipe
terhadap populasi (Nei dan Kumar, 2000). Pengamatan terhadap gen ß-laktoglobulin
dari sapi perah di Pasir Kemis diketahui dari sejumlah 95 sampel yang diamati terdiri
dari 6 sampel bergenotipe AA, 57 sampel bergenotipe AB dan 32 sampel bergenotipe
BB. Nilai frekuensi genotipe sapi asal Pasir Kemis untuk genotipe AA, AB dan BB
berturut-turut yaitu 0,06 ; 0,60 dan 0,34 sedangkan frekuensi alel A dan B diperoleh
sebesar 0,36 dan 0,64. Hasil yang hampir sama ditunjukkan pula dari penelitian
terhadap gen ß-laktoglobulin pada sapi perah jenis FH di wilayah Cilumber. Hasil
yang diperoleh dari sampel sejumlah 98 ekor, diketahui sampel yang bergenotipe
AA, AB dan BB berturut-turut berjumlah 6, 78 dan 14. Nilai frekuensi genotipenya
yakni 0,06 untuk genotipe AA, 0,80 untuk genotipe AB, dan 0,14 untuk genotipe BB.
Frekuensi alel yang diperoleh yakni 0,46 untuk alel A dan 0,54 untuk alel B.
Perhitungan terhadap frekuensi genotipe dan alel gen ß-laktoglobulin dari sapi perah
Tabel 4. Nilai Frekuensi Genotipe dan Frekuensi Alel Gen β-laktoglobulin pada
Frekuensi genotipe AB pada kedua lokasi yakni dari Desa Pasir Kemis (0,60)
dan Cilumber (0,80) memiliki nilai yang lebih tinggi dari pada frekuensi genotipe
AA (0,06 dan 0,06) dan BB (0,34 dan 0,14). Hasil yang sama ditunjukkan oleh Nury
(2010) pada sapi FH yang terdapat di stasiun BPPT-SP Cikole, Lembang yakni
frekuensi genotipe AB (0,60) lebih tinggi dari frekuensi genotipe AA (0,10) dan BB
(0,30). Hasil tersebut bersesuaian pula dengan penelitian Gurcan (2011) terhadap
sapi perah hitam dan putih di Turki yang menunjukkan bahwa genotipe AB memiliki
persentase nilai sebesar 0,38, lebih tinggi bila dibandingkan dengan genotipe AA
(0,37) dan BB (0,25). Heidari et al. (2009) juga menyatakan bahwa pada sapi
Holstein-Iran, genotipe AB (0,54) memiliki frekuensi yang lebih tinggi dari genotipe
AA (0,26) dan BB (0,20). Hal ini dapat terjadi karena sesuai dengan hukum
Hardy-Weinberg yang menyatakan bahwa jumlah proporsi frekuensi dari ketiga macam
genotip yakni sesuai dengan aturan p2 + 2pq + q2 = 1 sehingga frekuensi genotipe
AB yang diperoleh lebih besar karena merupakan hasil perkalian angka dua dengan
masing-masing jumlah genotipe dominan dan resesif yang terjadi. Namun, hasil yang
berbeda dijumpai pada penelitian Chung et al. (1995) yang menunjukkan bahwa
frekuensi genotipe BB (0,74) jauh lebih tinggi dari pada frekuensi genotipe AA
(0.05) dan BB (0,02). Penelitian Chung et al. (1998) terhadap Sapi Korea juga
menunjukkan bahwa frekuensi genotipe BB (0,60) lebih tinggi dari pada frekuensi
genotipe AA (0,03) dan AB (0,37). Demikian juga dengan penelitian dari Karimi et
al. (2008) yang melakukan penelitian pada sapi Iranian Najdi, menunjukkan bahwa
dan AB (0,18). Hal ini terjadi karena adanya manajemen perkawinan yang tidak
acak, seleksi terhadap sifat tertentu, dan tingkat silang dalam yang tinggi (Bourdon,
2000).
Frekuensi alel B (0,59) sapi FH di kedua lokasi memiliki nilai yang lebih
tinggi dari pada frekuensi alel A (0,41). Berbagai penelitian lainnya juga
menyebutkan bahwasanya frekuensi alel B memiliki nilai lebih tinggi dari frekuensi
alel A (Chung et al., 1998; Karimi et al., 2009; Nury, 2010). Sebaliknya, beberapa
penelitian menyebutkan, frekuensi alel A lebih besar dari frekuensi alel B (Heidari et
al., 2009; Gurcan, 2011). Akan tetapi, hasil yang sedikit berbeda dengan literatur
yakni pada penelitian Karimi et al. (2009), tidak ditemukan adanya genotipe AA,
sedangkan pada penelitian kali ini, telah berhasil ditemukan adanya genotipe AA
pada gen ß-laktoglobulin sapi FH dari daerah Pasir Kemis maupun Cilumber.
Keseimbangan Genotipe Gen β-laktoglobulin
Keseimbangan frekuensi genotipe dan alel pada suatu populasi dapat
diketahui dengan menggunakan perhitungan keseimbangan Hardy-Weinberg,
kemudian dilakukan pengujian terhadap tingkat penyimpangannya dari rasio harapan
dengan mengunakan uji chi-square test (x2).. Berdasarkan hasil analisis Chi-Kuadrat
diketahui bahwa pada sapi FH dari kedua lokasi yang berbeda yakni Pasir Kemis dan
Cilumber memiliki nilai xhit2 > x2((0,05) dan (0,01)), artinya hasil penelitian terhadap
distribusi genotipe gen β-laktoglobulin pada populasi sapi FH memiliki nilai yang
sangat berbeda nyata sehingga dapat dikatakan distribusi genotipe β-laktoglobulin
populasi sapi FH pada desa Cilumber berada dalam ketidakseimbangan. Menurut
Noor (2008), suatu populasi yang cukup besar berada dalam keadaan keseimbangan
Hardy-Weinberg jika frekuensi genotipe dominan dan resesif konstan dari generasi
ke generasi, tidak ada seleksi, mutasi migrasi, serta genetic drift. Seleksi merupakan
salah satu faktor yang dapat mengubah keseimbangan dalam populasi secara cepat.
Oleh karena itu, ketidakseimbangan frekuensi genotipe gen β-laktoglobulin pada sapi
FH di desa Pasir Kemis dan Cilumber, KPSBU Lembang, Bandung menunjukkan
bahwa telah terjadi adanya seleksi secara langsung terhadap ternak sapi perah
berdasarkan gen β-laktoglobulin. Perhitungan chi-square dan hasil uji x2 dapat dilihat
Tabel 5. Distribusi Genotipe Gen β-laktoglobulin pada Sapi FH
Lokasi N Frekuensi Genotipe β-laktoglobulin db x2 hitung
AA (O/E) AB (O/E) BB (O/E)
Pasir kemis 95 6/12,31 57/43,78 32/38,91 1 8,45
Cilumber 98 6/20,74 78/48,69 14/28,58 1 35,56
Keterangan : O = nilai pengamatan; E = nilai harapan; db = derajat bebas; x2 tabel : 3,84 (5%); x2 tabel : 2,71 (1 %)
Heterozigositas Gen β-laktoglobulin
Nilai heterozigositas merupakan cara yang paling akurat untuk mengukur
keragaman genetik suatu populasi (Nei, 1987). Nilai heterozigositas dari hasil
pengamatan terhadap gen β-laktoglobulin pada sapi perah FH di lokasi Cilumber dan
Pasir Kemis ditunjukkan pada Tabel 6.
Tabel 6. Nilai Heterozigositas Gen β-laktoglobulin|HaeIII pada Sapi Friesian Holstein
Lokasi N Ho He
Pasir Kemis 95 0,60 0,461
Cilumber 98 0,80 0,497
Total 193 0,70 0,484
Keterangan: Ho = Heterozigositas Pengamatan; He = Heterozigositas Harapan
Pendugaan nilai heterozigositas memiliki arti penting untuk diketahui karena
dapat memberikan informasi mengenai tingkat polimorfisme suatu alel, serta prospek
populasi di masa yang akan datang (Falconer & Mackay, 1996). Nilai heterozigositas
dipengaruhi oleh jumlah sampel, jumlah alel dan frekuensi alel (Nei, 1987). Nilai
heterozigositas pengamatan (Ho) hasil analisis terhadap sapi FH di Desa Pasir Kemis
dan Cilumber memiliki nilai sebesar 0,60 dan 0,80, keduanya menunjukkan nilai
yang lebih tinggi dari pada nilai heterozigositas harapan (He) yang diperoleh. Nilai
Ho yang lebih tinggi dari He dapat mengindikasikan adanya proses seleksi yang
intensif (Machado et al., 2003). Hal ini dapat dikatakan bahwa gen ß-laktoglobulin di
Desa Pasir Kemis dan Cilumber, KPSBU Lembang, Bandung memiliki variasi yang
tinggi (Ho > 0,5 (50%) ) pada populasi sapi FH yang terjadi. Pernyataan ini sesuai
bawah 0,5 (50%) menunjukkan bahwa variasi yang rendah suatu gen pada populasi.
Semakin tinggi derajat heterozigositas suatu populasi maka daya tahan hidup
populasi tersebut akan semakin tinggi (Avise, 1994).
Assosiasi antara Gen ß-laktoglobulin terhadap Protein Susu dan Kualitas Susu
Keragaman dari gen ß-laktoglobulin ini memiliki terhadap komposisi susu
lainnya. Salah satu contohnya yakni gen ß-laktoglobulin dalam susu dapat
meningkatkan presentase protein susu (Kumar et al., 2006). Pernyataan ini juga
didukung oleh penelitian dari Ng-Kwai-Hang et al., (1984) yang menyatakan bahwa
genotipe BB pada gen ß-laktoglobulin memiliki hubungan positif dengan
meningkatnya jumlah protein yang lebih tinggi.
Beberapa hasil penelitian menunjukkan hal yang lainnya dalam hubungannya
terhadap assosiasi antara varian genetik dari gen β-laktoglobulin dengan komposisi
dan produksi susu (Ng-Kwai-Hang et al., 1984; Ng-Kwai-Hang et al., 1986;
Aleandri et al., 1990; Tsiaras et al., 2005). Beberapa telah menunjukkan pula bahwa
genotipe BB pada β-laktoglobulin berassosiasi juga dengan lemak yang lebih tinggi
dan meningkatkan produksi keju (Ng-Kwai-Hang et al., 1986; Aleandri et al., 1990;
Weldholm et al., 2006).
Pengamatan pada penelitian yang lain, genotipe AA dari gen β-laktoglobulin
memiliki assosiasi dengan produksi susu yang lebih tinggi (Bovenhuis et al., 1992;
Ng-Kwai-Hang et al., 1990; Ikonen et al., 1999) serta memiliki hubungan (assosiasi)
dengan protein susu yang lebih tinggi (Ng-Kwai-Hang et al., 1984; Ng-Kwai-Hang
et al., 1990; Strazalkowska et al., 2002). Namun, dalam penelitian lain menurut
Tsiaras et al. (2005); Kaygisiz & Douan (1999) genotipe AB berhubungan dengan
produksi susu yang lebih tinggi dan produksi protein serta laktosa (Tsiaras et al.,
KESIMPULAN DAN SARAN
Kesimpulan
Pengamatan terhadap sapi perah Friesian Holstein di kedua lokasi (KPSBU
Pasir Kemis dan Cilumber, Lembang-Bandung) ditemukan gen β
-lacotglobulin|HaeIII yang memiliki sifat yang polimorfik dengan dua macam alel yaitu alel A dan alel B sehingga terbentuk tiga macam genotipe yaitu genotipe AA,
AB dan BB. Frekuensi genotipe AB pada kedua lokasi memiliki nilai yang paling
tinggi bila dibandingkan dengan frekuensi genotipe AA dan AB. Frekuensi alel B
(0,59) lebih tinggi dari alel A (0,41). Sapi FH pada kedua lokasi berada dalam
kondisi ketidakseimbangan Hardy-Weinberg serta memiliki keragaman (variasi)
yang cukup tinggi karena nilai heterozigositasnya diketahui lebih besar dari 0,5
(Ho>0,5) sehingga pada keduanya dapat terjadi proses seleksi yang cukup intensif
pada populasi.
Saran
Penelitian lebih lanjut terhadap gen β-laktoglobulin dapat dilakukan dengan
meningkatkan jumlah sampel yang digunakan sehingga diharapkan dapat terjadi
proses seleksi yang lebih intensif pada populasi serta perlu dilakukan pemilihan
lokasi yang memiliki kondisi iklim dan lingkungan yang hampir sama sehingga data
DAFTAR PUSTAKA
Aleandri R, L. G. Buttazzoni, & J. C. Schnerder. 1990. The effects of milk protein polymorphisms on milk components and cheese producing ability. J. Dairy Sci. 73: 241-255.
Alexander, L. J., C. W. Beattie, G. Hayes, M. J. Pearse, A. F. Stewart, & A. G. Mackinlay. 1989. Isolation and characterization of the bovine beta-lactoglobulin gene. University of New South Wales, School of Biochemistry, Australia.
Allendrof, F.W. & G. Luikart. 2007. Conservation and The Genetics of Polulations. Blockwell Publishing, USA.
Anggraeni, A., Y. Fitriyani, A. Attabany & I. Komala. Penampilan produksi susu dan reproduksi sapi Friesian Holstein di Balai Pengembangan Pembibitan Ternak Sapi Perah Cikole, Lembang. Pros. Sem. Nas. Teknologi Peternakan dan Veteriner. Bogor, 11-12 Nopember 2008. Puslitbang Peternakan: 137-145.
Avise, J. C. 1994. Molecular Markers, Natural History and Evolution. Chapman and Hall, Inc., New York.
Bastos, E., A. Cravador, J. Azevedo, & H. Pinto. G. 2001. Single strand conformation polymorphism (SSCP) detection in six genes in Portuguese indigenous sheep breed “Churra da Teerra Quente”. Biotechnol. Agron. Soc. Environ. 5 (1): 7-15.
Blott, S. C., J. L. Williams, & C. S. Haley. 1998. Genetic relationship among European cattle breeds. Anim. Genet. 29: 273-282.
Boichard, D., S. Fritz, M. N. Rossignol, Guillaume, J. J. Colleau, & T. Druet. 2006. Implementation of marker-assisted selection: practical lessons from dairy cattle. 8th World Congress on Genetic Applied to Livestock Production, Brazil.
Bovenhuis, H., J.A.M. Van Arendonk, & S. Kerver. 1992. Associations between milk protein polymorphism and milk production traits. J. Dairy. Sci. 75: 2549-2559.
Celik, S. 2003. β-lacotglobulin genetic variants in Brown Swiss breed and its association with composional properties and rennet cloting time of milk. Int. J. Dairy. 13: 727-731.
Chen , J. & Chatterjee, N. 206. Haplotype based association analysis in cohort and nested case control studies. Biometrics. 62: 28-35.
Chung, E. R., W. T. Kim, & C. S. Lee. 1998. DNA polymorphism of k-casein, β -lactoglobulin, growth hormone and prolactin genes in Korean cattle. AJAS 11: 422-427.
Daniela I, Aurelia S, Anuta M, Claudia S, & Vintila I. 2008. Genetic polymorphism at the β-lacotglobulin locus in a dairy herd of Romanian Spotted and Brown of Maramures breeds. Zoo Biotech. 41: 104-107.
Direktorat Jenderal Peternakan. 2006. Statistik Peternakan 2006. Direktorat Jenderal Peternakan, Departemen Pertanian, Jakarta.
Eenennaam A.V. & J. F. Medrano. 1991. Milk protein polymorphism in California dairy cattle. J. Dairy. Sci. 74: 1730-1742.
Falconer, D.S. & T. F. C. Mackay. 1996. Introduction to Quantitative Genetics. Fourt Ed. Logman Inc., New York.
Gurcan, E. K. 2011. Association betweein milk protein polymorphisms and milk production traits in Black and White dairy cattle in Turkey. Afric J. Biotech. 10: 1044-1048.
Hardjosubroto, W. 1998. Pengantar Genetika Hewan. Fakultas Peternakan UGM, Yogyakarta.
Harper, W. J. & E.W. Hall. 1981. Dairy Technology and Engineering. AVI Publ. co. Inc., Westport.
Harris, H. 1996. Enzyme polymorphisms in man. Proc. R. Soc. Lond. B. 164: 298-310.
Hartl, D. L. & A. G. Clark. 1997. Principle of Population Genetic. Sinaver Associates, Sunderland, M. A.
Hayashi, K. 1991. PCR-SSCP: a simple and sensitive method for detection of mutation in the genomic DNA. PCR Methods Appl. 1: 34-38.
Heidari, M., Mojtaba A, Saeed H, Alireza K, & Saeed Z. 2009. Association of genetic variants of β-lacotglobulin gene with milk production in a herd and a superior family of Holstein cattle. Iranian J. of Biotech. 7: 254-257.
Hilalnuha. 2010. Sapi Perah Friesian-Holstein. http://hilalnuha.files.word-press.com/2010/07/friesian-holstein.jpg. [29 September 2011]
Ikonen T, Ojala M, & Routtinen O. 1999. Associations between milk protein polymorphisms and first lactation milk production traits in Finnish Ayrshire cows. J. Dairy. Sci. 82: 1026-1033.