KAJIAN EKSTRAKSI GELATIN DARI KULIT
IKAN TUNA (
Thunnus alalunga
) DAN KARAKTERISTIKNYA
SEBAGAI BAHAN BAKU INDUSTRI FARMASI
F A H R U L
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis yang berjudul
KAJIAN EKSTRAKSI GELATIN DARI KULIT IKAN TUNA (Thunnus alalunga) DAN KARAKTERISTIKNYA SEBAGAI BAHAN BAKU INDUSTRI FARMASI
Merupakan gagasan atau hasil penelitian tesis saya sendiri, dengan bimbingan para komisi pembimbing, kecuali yang dengan jelas ditujukkan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Oktober 2005
Fahrul
ABSTRAK
FAHRUL. Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna (Thunnus alalunga) dan Karakteristiknya Sebagai Bahan Baku Industri Farmasi. Dibimbing oleh USMAN AHMAD dan ROSMAWATY PERANGINANGIN.
RIWAYAT HIDUP
Penulis dilahirkan di Ujung Pandang pada tanggal 19 April 1974 dari Bapak Asikin Kasim dan Ibu Muriati. Penulis adalah putra ketiga dari lima bersaudara.
Tahun 1993 penulis lulus dari SMA Negeri 3 Ujung Pandang, Sulawesi Selatan. Jenjang pendidikan Perguruan Tinggi mulai ditempuh di Universitas Hasanuddin jurusan Perikanan dan menyelesaikan studi pada tahun 1999.
KAJIAN EKSTRAKSI GELATIN DARI KULIT
IKAN TUNA (
Thunnus alalunga
) DAN KARAKTERISTIKNYA
SEBAGAI BAHAN BAKU INDUSTRI FARMASI
F A H R U L
Tesis
Sebagai Salah satu Syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Pascapanen
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna
(Thunnus alalunga) dan Karakteristiknya Sebagai Bahan
Baku Industri Farmasi. Nama : F a h r u l
NRP : F051030151
Program Studi : Teknologi Pascapanen
Disetujui, Komisi Pembimbing
Dr. Ir. Usman Ahmad, M.Agr Prof. Dr. Rosmawaty Peranginangin, MS, APU
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Pascapanen
Dr. Ir. I Wayan Budiastra, M.Agr Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
PRAKATA
Puji syukur ke hadirat Allah SWT, Tuhan Yang Maha Kuasa atas segala karunia-Nya sehingga penulis dapat menyelesaikan Tesis “Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna (Thunnus alalunga) dan Karakteristiknya Sebagai Bahan Baku Industri Farmasi”.
Sebelum penelitian dan penyusunan tesis ini, penulis benyak mendapat bantuan dari berbagai pihak, olehnya itu penulis menyampaikan ucapan terima kasih dan penghargaan yang setulusnya kepada:
1) Bapak Dr. Ir. Usman Ahmad, M.Agr selaku ketua komisi pembimbing yang telah banyak memberikan bimbingan, arahan dan saran yang konstruktif.
2) Ibu Prof. Dr. Rosmawaty Peranginangin, MS. APU selaku anggota komisi pembimbing yang telah banyak meluangkan waktunya dalam memberikan bimbingan, arahan dan saran yang konstruk tif.
3) Bapak Dr. Ir. Suroso, M.Sc selaku penguji luar komisi yang telah banyak memberikan saran dan arahan yang konstruktif.
4) Kepala dan Staf Pusat Riset Pengolahan Produk dan Sosisal Ekonomi Kelautan dan Perikanan, Departemen Kelautan dan Perikanan. Slipi, Jakarta yang telah memberikan izin untuk ikut dalam proyek penelitian pengembangan produk perikanan dari limbah hasil industri perikanan.
5) Dekan Sekolah Pascasarjana Institut Pertanian Bogor beserta para staf pengajar yang telah banyak membekali ilmu pengetahuan dan wawasan penulis.
6) Bapak Dr. Ir. I Wayan Budiastra, M.Agr yang telah banyak memberikan semangat dan dorongan moral dalam menyelesaikan studi selama beliau menjabat Ketua Program Studi Teknologi Pasaca Panen
7) Direktur Jenderal Pendidikan Tinggi DEPDIKNAS, yang telah memberikan bantuan dana pendidikan melalui Beasiswa Program Pasca Sarjana (BPPS). 8) Ketua Yayasan dan Rektor Sekolah Tinggi Teknologi Kelautan (STITEK) Balik
Diwa Makassar yang telah memberikan izin untuk melanjutkan studi.
9) Pemerintah Wilayah Provinsi Sulawesi Selatan yang telah memberikan bantuan penelitian.
11) Saudaraku Faishal dan Umrah, Fauziah, Fatimah dan Mansyur Zein, dan Achmad Fachri, serta ponakan-ponakanku yang pintar dan lucu Fachira “Fira” Khumaira, Muhammad Farhan “Paang” Ramadhan, dan Faiza Azizah “Chica” Khumaira yang saya cintai atas segala dukungan, pengorbanan dan doa serta pengertiannya selama ini.
12) Rekan-rekan Mahasiswa Program Studi Teknologi Pasca Panen khususnya angkatan 2003 atas segala kerjasama dan dukungannya selama ini.
13) Semua pihak yang telah memberikan dukungan dan sumbangsi pemikiran dalam penyelesaian tesis ini.
Penulis menyadari sepenuhnya bahwa tesis ini, masih jauh dari kesempurnaan. Olehnya itu, segala saran dan kritikan yang sifatnya konstruktif dengan senang hati penulis harapkan. Semoga tesis ini bermanfaat adanya.
Bogor, Oktober 2005
Halaman
Manfaat Penelitian... 3
TINJAUAN PUSTAKA Ikan Tuna... 4
Limbah Hasil Perikanan... 5
Kulit Ikan... 6
Metode Penelitian... 23
Asam Amino... 31
Titik Jendal... 32
Titik Leleh... 32
Derajat Putih ... 32
Penentuan Total Plate Count ... 33
Penentuan Escherichia coli... 33
Penentuan Salmonella... 34
Kandungan Mikrobiologi ... 55
KAJIAN EKSTRAKSI GELATIN DARI KULIT
IKAN TUNA (
Thunnus alalunga
) DAN KARAKTERISTIKNYA
SEBAGAI BAHAN BAKU INDUSTRI FARMASI
F A H R U L
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam tesis yang berjudul
KAJIAN EKSTRAKSI GELATIN DARI KULIT IKAN TUNA (Thunnus alalunga) DAN KARAKTERISTIKNYA SEBAGAI BAHAN BAKU INDUSTRI FARMASI
Merupakan gagasan atau hasil penelitian tesis saya sendiri, dengan bimbingan para komisi pembimbing, kecuali yang dengan jelas ditujukkan rujukannya. Tesis ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi lain.
Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan dapat diperiksa kebenarannya.
Bogor, Oktober 2005
Fahrul
ABSTRAK
FAHRUL. Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna (Thunnus alalunga) dan Karakteristiknya Sebagai Bahan Baku Industri Farmasi. Dibimbing oleh USMAN AHMAD dan ROSMAWATY PERANGINANGIN.
RIWAYAT HIDUP
Penulis dilahirkan di Ujung Pandang pada tanggal 19 April 1974 dari Bapak Asikin Kasim dan Ibu Muriati. Penulis adalah putra ketiga dari lima bersaudara.
Tahun 1993 penulis lulus dari SMA Negeri 3 Ujung Pandang, Sulawesi Selatan. Jenjang pendidikan Perguruan Tinggi mulai ditempuh di Universitas Hasanuddin jurusan Perikanan dan menyelesaikan studi pada tahun 1999.
KAJIAN EKSTRAKSI GELATIN DARI KULIT
IKAN TUNA (
Thunnus alalunga
) DAN KARAKTERISTIKNYA
SEBAGAI BAHAN BAKU INDUSTRI FARMASI
F A H R U L
Tesis
Sebagai Salah satu Syarat untuk memperoleh gelar Magister Sains pada
Program Studi Teknologi Pascapanen
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna
(Thunnus alalunga) dan Karakteristiknya Sebagai Bahan
Baku Industri Farmasi. Nama : F a h r u l
NRP : F051030151
Program Studi : Teknologi Pascapanen
Disetujui, Komisi Pembimbing
Dr. Ir. Usman Ahmad, M.Agr Prof. Dr. Rosmawaty Peranginangin, MS, APU
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Teknologi Pascapanen
Dr. Ir. I Wayan Budiastra, M.Agr Prof. Dr. Ir. Syafrida Manuwoto, M.Sc
PRAKATA
Puji syukur ke hadirat Allah SWT, Tuhan Yang Maha Kuasa atas segala karunia-Nya sehingga penulis dapat menyelesaikan Tesis “Kajian Ekstraksi Gelatin dari Kulit Ikan Tuna (Thunnus alalunga) dan Karakteristiknya Sebagai Bahan Baku Industri Farmasi”.
Sebelum penelitian dan penyusunan tesis ini, penulis benyak mendapat bantuan dari berbagai pihak, olehnya itu penulis menyampaikan ucapan terima kasih dan penghargaan yang setulusnya kepada:
1) Bapak Dr. Ir. Usman Ahmad, M.Agr selaku ketua komisi pembimbing yang telah banyak memberikan bimbingan, arahan dan saran yang konstruktif.
2) Ibu Prof. Dr. Rosmawaty Peranginangin, MS. APU selaku anggota komisi pembimbing yang telah banyak meluangkan waktunya dalam memberikan bimbingan, arahan dan saran yang konstruk tif.
3) Bapak Dr. Ir. Suroso, M.Sc selaku penguji luar komisi yang telah banyak memberikan saran dan arahan yang konstruktif.
4) Kepala dan Staf Pusat Riset Pengolahan Produk dan Sosisal Ekonomi Kelautan dan Perikanan, Departemen Kelautan dan Perikanan. Slipi, Jakarta yang telah memberikan izin untuk ikut dalam proyek penelitian pengembangan produk perikanan dari limbah hasil industri perikanan.
5) Dekan Sekolah Pascasarjana Institut Pertanian Bogor beserta para staf pengajar yang telah banyak membekali ilmu pengetahuan dan wawasan penulis.
6) Bapak Dr. Ir. I Wayan Budiastra, M.Agr yang telah banyak memberikan semangat dan dorongan moral dalam menyelesaikan studi selama beliau menjabat Ketua Program Studi Teknologi Pasaca Panen
7) Direktur Jenderal Pendidikan Tinggi DEPDIKNAS, yang telah memberikan bantuan dana pendidikan melalui Beasiswa Program Pasca Sarjana (BPPS). 8) Ketua Yayasan dan Rektor Sekolah Tinggi Teknologi Kelautan (STITEK) Balik
Diwa Makassar yang telah memberikan izin untuk melanjutkan studi.
9) Pemerintah Wilayah Provinsi Sulawesi Selatan yang telah memberikan bantuan penelitian.
11) Saudaraku Faishal dan Umrah, Fauziah, Fatimah dan Mansyur Zein, dan Achmad Fachri, serta ponakan-ponakanku yang pintar dan lucu Fachira “Fira” Khumaira, Muhammad Farhan “Paang” Ramadhan, dan Faiza Azizah “Chica” Khumaira yang saya cintai atas segala dukungan, pengorbanan dan doa serta pengertiannya selama ini.
12) Rekan-rekan Mahasiswa Program Studi Teknologi Pasca Panen khususnya angkatan 2003 atas segala kerjasama dan dukungannya selama ini.
13) Semua pihak yang telah memberikan dukungan dan sumbangsi pemikiran dalam penyelesaian tesis ini.
Penulis menyadari sepenuhnya bahwa tesis ini, masih jauh dari kesempurnaan. Olehnya itu, segala saran dan kritikan yang sifatnya konstruktif dengan senang hati penulis harapkan. Semoga tesis ini bermanfaat adanya.
Bogor, Oktober 2005
Halaman
Manfaat Penelitian... 3
TINJAUAN PUSTAKA Ikan Tuna... 4
Limbah Hasil Perikanan... 5
Kulit Ikan... 6
Metode Penelitian... 23
Asam Amino... 31
Titik Jendal... 32
Titik Leleh... 32
Derajat Putih ... 32
Penentuan Total Plate Count ... 33
Penentuan Escherichia coli... 33
Penentuan Salmonella... 34
Kandungan Mikrobiologi ... 55
Halaman
1 Penggunaan gelatin dalam industri pangan dan non pangan di
dunia tahun 1999 ... 2
2 Beberapa sifat gelatin berdasarkan tipenya ... 15
3 Spesifikasi Gelatin Farmasi... 16
4 Standar mutu gelatin... 22
5 Komposisi kimia kulit ikan tuna segar dan kulit ikan tuna siap ekstraksi... 36
6 Sifat kimia gelatin kulit ikan tuna, gelatin komersial dan gelatin standar laboratorium... 47
7 Komposisi asam amino gelatin kulit ikan tuna, gelatin komersial dan gelatin standar laboratorium ... 49
8 Kandungan logam berat pada gelatin kulit ikan tuna, gelatin komersial, dan gelatin standar laboratorium ... 50
9 Sifat fisik gelatin kulit ikan tuna, gelatin komersial dan gelatin standar laboratorium... 51
DAFTAR GAMBAR
Halaman
1 Reaksi pembentukan garam kalsium karboksilat... 7
2 Reaksi pembentukan garam natrium karboksilat ... 8
3 Susunan molekul kolagen... 12
4 Struktur kimia gelatin... 15
5 Diagram alir proses pembuatan gelatin dengan cara asam
(tipeA) dan cara basa (tipeB) ... 19
6 Transformasi kolagen-gelatin... 20
7 Proses ekstraksi gelatin dari kulit ikan tuna ... 26
8 Bagan alir pelaksanaan penelitian... 27
9 Kulit ikan tuna ... 36
10 Pengaruh lama perendaman kapur, konsentrasi enzim, dan lama perendaman asam sitrat pH 3 (kombinasi perlakuan) terhadap rendemen (%) gelatin kulit tuna. ... 38
11 Pengaruh konsentrasi enzim, lama perendaman kapur, dan lama perendaman asam sitrat pH 3 (kombinasi perlakuan)
terhadap viskositas (cP) gelatin kulit tuna... 40
12 Pengaruh konsentrasi enzim, lama perendaman kapur, dan lama perendaman asam sitrat pH 3 (kombinasi perlakuan) terhadap pH
gelatin kulit tuna. ... 42
13 Pengaruh Konsentrasi Enzim, lama perendaman kapur, dan lama perendaman asam sitrat pH 3 (kombinasi perlakuan)
terhadap kekuatan gel (Bloom) gelatin kulit tuna ... 43
14 Sheet gelatin kulit ikan tuna ... 44
15 Gelatin kulit ikan tuna (A1, A2, dan A3), gelatin komersial (B),
Halaman
1 Data hasil pengukuran rendemen, viskositas, ph, dan kekuatan gel gelatin dari kulit ikan tuna ... 69
2 Hasil analisis ragam rendemen gelatin kulit tuna... 70
3 Hasil uji beda jarak berganda Duncan (BJBD) terhadap rendemen gelatin kulit ikan tuna ... 70
4 Hasil analisis ragam viskositas gelatin kulit tuna ... 71
5 Hasil uji beda jarak berganda Duncan (BJBD) terhadap viskositas gelatin kulit ikan tuna ... 71
6 Hasil analisis ragam pH gelatin kulit tuna... 72
7 Hasil uji beda jarak berganda Duncan (BJBD) terhadap pH gelatin kulit ikan tuna ... 72
8 Hasil analisis ragam kekuatan gel gelatin kulit tuna ... 73
9 Hasil uji beda jarak berganda Duncan (BJBD) terhadap kekuatan
gel gelatin kulit ikan tuna... 73
10 Hasil analisa proksimat gelatin kulit tuna, gelatin standar laboratorium, dan gelatin komersial ... 74
11 Hasil analisa titik leleh, titik jendal, dan titik isoelektrik gelatin kulit tuna, gelatin standar laboratorium, dan gelatin komersial... 74
12 Hasil pengukuran derajat putih gelatin kulit tuna, gelatin standar laboratorium, dan gelatin komersial... 74
13 Hasil analisa kandungan logam berat gelatin kulit ikan tuna, gelatin standar laboratorium, dan gelatin komersial. ... 75
14 Hasil analisa kandungan mikrobiologi gelatin kulit tuna, gelatin standar laboratorium, dan gelatin komersial. ... 75
15 Hasil uji organoleptik pasangan segitiga terhadap gelatin komersial. ... 75
17 Formulir uji organoleptik gelatin kulit ikan tuna dengan pembanding gelatin komersial dan gelatin standar laboratorium.... 76
18 Chromatogram standar asam amino ... 77
19 Chromatogram asam amino gelatin kulit ikan tuna ... 78
20 Chromatogram standar asam amino... 79
21 Chromatogram asam amino gelatin standar laboratorium ... 80
22 Chromatogram asam amino gelatin komersial... 81
Latar Belakang
Gelatin merupakan suatu jenis protein yang diekstraksi dari jaringan kolagen hewan. Pada hewan, kolagen terdapat pada tulang, tulang rawan, kulit dan jaringan ikat. Gelatin pertama kali ditemukan oleh orang Perancis yang bernama Papin pada tahun 1682. Penemuan ini kemudian berkembang dan menjadi salah satu bahan industri yang digunakan untuk berbagai keperluan.
Saat ini penggunaan gelatin sudah semakin meluas, baik untuk produk pangan maupun non pangan. Untuk produk pangan, menurut Poppe (1992) gelatin dapat dimanfaatkan sebagai bahan penstabil (stabilizer), pembentuk gel (gelling agent), pengikat (binder), pengental (thickener), pengemulsi (emulsifier), perekat (adhesive), whipping agent, dan pembungkus makanan yang bersifat dapat dimakan (edibel coating). Industri pangan yang membutuhkan gelatin antara lain industri konfeksioneri, produk jelly, industri daging, industri susu, produk law fat (semisal margarin), food suplement.
Gelatin juga digunakan dalam indutri non pangan seperti; Industri pembuatan film, industri farmasi (seperti produksi kapsul lunak, cangkang kapsul, dan tablet), industri teknik (sebagai bahan pembuat lem, kertas, cat, dan bahan perekat), dan juga digunakan dalam industri kosmetika (seperti pemerah bibir, shampo, sabun).
Kebutuhan untuk industri-industri di Indonesia selama ini sebagian besar mengimpor dari negara lain; khususnya dari China, Eropa, dan Amerika. LPPOM-MUI (1997) menyatakan bahwa sebagian besar gelatin tipe A yang diproduksi Amerika dibuat dari kulit babi yakni 50% dari total produksi, sedangkan sisanya 33.3% dari tulang sapi dan 16.7% dari ossein. Tahun 1999 (sampai dengan bulan Juni) Indonesia mengimpor gelatin sebanyak 2.371.738 kg dengan nilai US$ 9.095.440, sedangkan pada tahun 2001 impor gelatin tersebut meningkat mencapai 4.291.579 kg dengan nilai US$ 10.749.199 (BPS, 2002)
2
Eropa dan Amerika. Secara umum terjadi peningkatan pemanfaatan gelatin dalam indutri pangan dan farmasi di Indonesia (Wiyono, 2001).
Tabel 1 Penggunaan gelatin dalam industri pangan dan non pangan di dunia tahun 1999*.
Pembuatan film 27.000 Konfeksionari 68.000
Produk Kapsul
lunak 22.600 Produk jelly 36.000
Cangkang Kapsul 20.200 Daging 16.000
Farmasi 12.600 Susu 16.000
Teknik 6.000 Produk low fat
(semisal margarin) 4.000
- - Food suplement 4.000
*SKW Biosystem (Wiyono, 2001)
Sumber utama lain yang sangat potensial sebagai bahan baku gelatin adalah kolagen yang berasal dari ikan. Menurut Surono et al. (1995) tulang dan kulit ikan sangat potensial sebagai sumber gelatin karena mencakup 10-20 % dari total berat tubuh ikan. Namun produk gelatin yang berbahan baku ikan umumnya memiliki masalah Fishy odor atau bau amis dan tidak sedap, yaitu berasal dari urea yang mudah terurai menjadi amonia. Fishy odor ini sangat tidak disukai konsumen dan merupakan penyebab belum dimasukkannya gelatin ikan ke dalam GRAS (Generally Recognized as Safe). Untuk itu diperlukan metode dan teknologi pembuatan gelatin ikan yang dapat mengurangi atau meminimalisasi fishy odor, menghasilkan rendemen yang tinggi serta memiliki sifat fisik, kimia dan fungsional yang menunjang sebagai bahan baku industri baik industri pangan maupun non pangan.
Beberapa penelitian mengenai gelatin yang diekstrak dari kulit ikan telah dilakukan, namun masih terbatas pada jenis-jenis ikan laut seperti ikan cucut, pari, paus dan patin (Chasanah, 2000; Yustika, 2000; Indrialaksmi, 2000; Gomes-Guillen dan Montero, 2001; Astawan et al., 2002; Aviana, 2002; Sopian, 2002; Rusli, 2004). Kajian mengenai ekstraksi gelatin dari kulit ikan tuna dengan standar bahan baku industri farmasi belum dilakukan. Oleh karena itu diperlukan suatu penelitian yang mengkaji teknik ekstraksi gelatin dari kulit ikan tuna, sehingga limbah yang dihasilkan dari produksi fillet dapat lebih termanfaatkan.
Dalam penelitian ini dilakukan ekstraksi gelatin dari kulit ikan tuna dengan cara asam, dengan tahapan awal pembersihan (deagreasing) pada lama perendaman kapur, beberapa konsentrasi enzim, dan lama perendaman asam. Jenis asam yang digunakan adalah asam sitrat. Gelatin yang dihasilkan dari perlakuan yang terbaik, selanjutnya dibandingkan dengan gelatin standar laboratorium, gelatin komersial, dan gelatin standar mutu farmasi berdasarkan indikator mutu gelatin.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk mendapatkan teknik ekstraksi gelatin dari kulit ikan tuna secara asam sebagai bahan baku kapsul. Dan secara khusus penelitian ini bertujuan untuk :
1. Mempelajari pengaruh lama perendaman kapur, konsentrasi enzim, dan lama perendaman asam terhadap mutu gelatin dari kulit ikan tuna sebagai bahan baku industri farmasi.
2. Mengkaji karakteristik gelatin dari kulit ikan tuna sebagai bahan baku industri farmasi, yang meliputi sifat fisik, sifat kimia, kandungan mikrobiologi, dan sifat organoleptik.
Manfaat Penelitian
TINJAUAN PUSTAKA
Ikan Tuna
Ikan tuna termasuk dalam keluarga Scombridae, dengan tubuh seperti cerutu, mempunyai kulit yang licin dengan sirip dada melengkung dengan ujung yang lurus dan pangkal yang lebar. Sirip ekor cagak dua dengan kedua ujungnya yang panjang dan pangkal bulat kecil, mempunyai dua sirip punggung, sirip depan pendek dan terpisah dengan sirip belakang, mempunyai jari- jari sirip tambahan (finlet) di belakang sirip
punggung dan sirip dubur. Sirip dada terletak agak ke atas, sirip perut kecil sirip ekor bercagak agak ke dalam dengan jari- jari penyokong menutup seluruh ujung hypural.
Klasifikasi ikan tuna (Thunnus alalunga) menurut Subardja et.al (1989).
Filum : Chordata Sub Filum : Vertebrata Kelas : Osteichthyes Sub Kelas : Actioopterygii Ordo : Perciformes
Sub Ordo : Scombridae Genus : Thunnus
Spesies : Thunnus alalunga
Ikan tuna ini memiliki ciri morfologi dengan mata agak besar, gill racker 25-31
buah pada helai insang pertama. Terdapat 7-9 finlet di belakang sirip punggung kedua. Sirip dada panjangnya 30% dar fork length dan dapat mencapai sirip punggung kedua,
terdapat 7-8 finlet di belakang sirip dubur.
Limbah Hasil Perikanan
Produksi perikanan tangkap dalam periode sepuluh tahun terakhir (1990 – 2000) meningkat rata-rata 4.47% per tahun, yaitu dari 2.66 juta ton meningkat menjadi 4.11 juta ton (Ditjen Perikanan Tangkap, 2002). Peningkatan produksi tersebut telah meningkatkan konsumsi ikan per kapita pada tahun 1998 menjadi 21,78 kg per kapita pada tahun 2001 (Dahuri, 2002). Dengan meningkatnya jumlah konsumsi ikan, maka jumlah limbahnya akan meningkat juga, karena tidak semua ikan dapat dimakan.
Limbah merupakan sisa dari proses pengolahan hasil perikanan yang tidak dimanfaatkan dan tidak mempunyai nilai ekonomis, bahkan dapat merugikan. Menurut Hardjo et al. (1989) pengertian limbah industri hasil pertanian adalah produk suatu proses
industri yang belum mempunyai nilai ekonomis, yang dibatasi oleh ruang dan waktu. Selanjutnya dinyatakan bahwa limbah seyogyanya dapat dianggap sebagai sumberdaya tambahan yang dapat dimanfaatkan. Pemanfaatan limbah disamping mempunyai nilai ekonomis juga mempunyai arti penting bagi lingkungan dan dampak perlakuan yang tidak wajar terhadap limbah pada pola kehidupan perlu ditekankan.
Pengambilan kembali dan pengubahan limbah bahan pangan menjadi semakin penting dilihat dari segi ekonomi pada industri pangan dan non pangan. Hal ini memungkinkan pemanfaatan maksimal dari bahan mentah dan memperkecil persoalan polusi dan penanganan limbah (Buckle, 1987). Selanjutnya dinyatakan bahwa dengan meningkatnya jumlah penduduk dunia dan adanya kekurangan pangan yang bermutu tinggi dengan harga murah di beberapa bagian dunia, penggunaan kembali zat-zat makanan dari sumber-sumber yang selama ini terbuang dan pemanfaatannya sebagai makanan manusia dan binatang merupakan hal penting.
Ilyas dan Soeparno (1985) mengelompokkan limbah hasil perikanan berdasarkan jenisnya, yaitu: (a) hasil samping, berupa ikan mentah utuh yang merupakan hasil ikutan dari usaha penangkapan (by catch); (b) limbah pengolahan, yang terdiri atas campuran
6
Kulit Ikan
Kulit ikan, umumnya terdiri dari dua lapisan utama yaitu epidermis dan dermis. Lapisan dermis merupakan jaringan pengikat yang cukup tebal dimana mengandung sejumlah serat-serat kolagen (Lagler et al., 1977).
Pada jaringan pengikat di dalam otot ikan, paling sedikit terdiri atas kolagen tipe I dan tipe V yang telah diidentifikasi sebagai mayor dan minor kolagen (Kimura et. al.,
1988). Selanjutnya Sato et al. (1991) menyatakan bahwa penguraian secara enzimatis
kolagen tipe V dipengaruhi oleh tingkat kelunakan otot ikan setelah panen seperti pada ikan rainbow trout (Oncorhychus mykiss) dan sardin (Sardinops melanosticta).
Kulit ikan mengandung air 69.6%, protein 26.9%, abu 2.5% dan lemak 0.7%. Secara kimiawi konstituen dari kulit dapat dibagi menjadi dua golongan yaitu konstituen non protein dan protein. Kandungan air pada kulit ikan lebih sedikit jika dibandingkan kandungan air pada dagingnya, sedangkan kandungan abu lebih banyak pada kulit.
Kandungan protein pada kulit hampir sama dengan kand ungan protein daging (Oosten, 1969).
Menurut Judoamijoyo (1974) menyatakan bahwa kira-kira 80% dari bahan kering kulit terdiri dari protein yang banyak macamnya serta sangat kompleks komposisinya. Protein kulit dapat dibagi dalam dua golongan besar, yaitu: (1) Protein yang tergolong
firous protein meliputi kolagen (yang terpenting), keratin dan elastin; (2) Protein yang
tergolong globular protein meliputi albumin dan globulin.
Pemanfaatan kulit, tulang dan gelembung renang ikan secara ko mersial sebagai bahan baku industri gelatin, dimana selama ini hanya merupakan limbah, dapat menanmbah penghasilan secara ekonomi dan memberi keuntungan bagi pengelolaan limbah industri perikanan karena bahan tersebut dihasilkan dalam jumlah yang banyak (Choi dan Regenstein, 2000). Menurut Surono et al. (1994) menyatakan bahwa tulang
Kapur Tohor (CaO)
Kapur Tohor diproduksi dengan memanaskan batu kapur (CaCo3) pada suhu antara
9000C hingga 12000C. Batu kapur tohor merupakan bahan yang bersifat reaktif dengan air
dan akan membentuk Ca(OH)2 yang berbentuk bubuk. Reaksi CaO dengan air
membentuk Ca(OH)2 merupakan reaksi eksoterm yang akan melepaskan kalor dan
menghasilkan bahan yang berbetuk bubuk putih (Chang dan Tikkanen, 1988). Bentuk CaCO3setelah dibakar menjadi CaO sama dengan bentuk sebelumnya, tetapi porositasnya
menjadi besar, karena setelah dibakar berarti CO2 telah dilepaskan, dan beratnya akan
menurun menjadi 56% (Gaspary dan Bucher, 1981). Reaksi kimia tersebut adalah:
CaO(s) + H2O Ca (OH)2(S) ∆H = -64.8 KJ
Kapur (CaO) digunakan pada proses pengapuran dengan melarutkannya ke dalam air, sehingga akan terbentuk larutan Ca(OH)2. Setelah proses pengapuran selesai, maka
dilakukan buang kapur dengan menggunakan asam seperti HCl dan H2SO4 atau garam
asam seperti (NH4)2SO4, lalu dilakukan dengan pencucian dengan air untuk
menghilangkan kelebihan asam. Proses pengapuran dilakukan dengan cara meredam kulit ke dalam larutan kapur jenuh yang terdiri dari air sekitar 300% dan kapur sebanyak 5 - 10% dari bobot kulit basah (William, 1974).
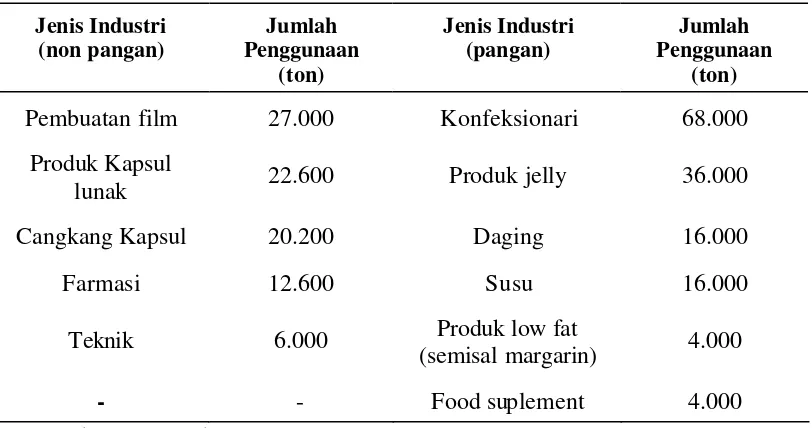
Menurut Christianto (2001), komponen larutan basa (CaO) yang digunakan sebagai larutan perendam dapat menyebabkan meningkatnya kadar abu gelatin yang dihasilkan, terutama dalam bentuk garam- garam karboksilat. Reaksi pembentukan garam kalsium karboksilat adalah sebagai berikut
8
Natrium Sulfida (Na2S)
Proses pembuangan rambut (epidermis) dilakukan dengan menggunakan bahan
kimia, misalnya Natrium sulfida (Na2S). Pembuangan lapisan epidermis dilakukan
melalui perendaman kulit dalam bak pengapuran dengan larutan 300% air. 2% Na2S, dan
4% kapur tohor (persentase dihitung dari berat kulit basah). Pengapuran dilakukan selama 48 jam dengan tiap hari kulit dikeluarkan dan larutan diaduk. Bila memakai tong berputar atau haspel untuk pengapuran, tiap jam diputar 5 menit selama jam kerja. Sisa lapisan epidermis halus dan kasar dapat dibuang dengan tangan (Judoamidjojo et al., 1979).
Menurut William (1974), kapur digunakan untuk membuka tenunan serat kulit, dan Na2S
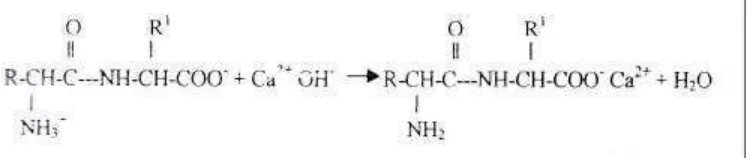
untuk membuang rambut (perontok rambut) dan melepaskan epidermis.
Menurut Christianto (2001) komponen larutan basa yang digunakan sebagai larutan perendam dapat menimbulkan residu abu di dalam gelatin yang dihasilkan, terutama dalam bentuk garam- garam karboksilat. Mineral natrium sebagai residu dari Na2S berikatan dengan gugus karboksil bebas dari asam amino penyusun rantai
polipeptida membentuk garam- garam karboksilat.
Gambar 2 Reaksi pembentukan garam natrium karboksilat
Amonium Sulfat [(NH4)2SO4]
diperiksa dengan indikator phenolphthalein untuk mengetahui masih ada atau tidaknya kapur. Bagian penampang yang berwarna merah menunjukkan masih adanya kapur (Judoamidjojo et al., 1979). Menurut William, pembuangan kapur dengan garam
amonium sulfat lebih efektif karena tidak terjadi pengendapan dan pembengkakakn. Pembuangan kapur ini bertujuan untuk membuang kapur bebas dan kapur terikat yang ada dalam kulit.
Enzim Protease
Proses pembuangan rambut dalam industri penyamakan kulit biasanya menggunakan bahan kimia seperti Na2S. Namun proses ini juga dapat dilakukan dengan
menggunakan enzim (Judoamidjojo et al., 1979). Menurut Varnali (2002), secara umum
metode pelepasan rambut dibagi menjadi dua grup yaitu; 1) penyerangan terhadap rambut dan menghancurkannya hingga menjadi bubur (biasanya menggunakan Ca(OH)2 atau
NaOH dan Na2S); 2) dengan cara mendestruksi (modifikasi) jaringan epidermis di sekitar
bulatan akar rambut, sehingga rambut dapat terlepas dengan utuh dan dapat dibuang secara mekanis. Proses pelepasan rambut ini, baik secara umum maupun secara konvensional, dilakukan pada proses pengapuran, melalui perusakan membran basalis di bagian epidermis sehingga rambut terlepas (Judoamidjojo et al., 1979).
Enzim protease yang digunakan dalam industri kulit, semula hanya diterapkan pada proses pelumatan atau pelunakan. Fungsi dari protease ini adalah melemaskan jaringan serat-serat kolagen dan protein elastin, sehingga kulit tersebut dapat disamak dan dilembabkan untuk menghasilkan kulit jadi. Saat ini, mengingat manfaat dari protease yang begitu besar, maka pemanfaatannya tidak hanya pada proses pelunakan saja tetapi juga pada proses yang lain seperti perendaman, pelepasan rambut dan pembuangan lemak (Puvanakrishnan dan Dhar, 1988; Feigel, 1995).
10
darah, kasein dan beberapa substrat protein. Pelepasan dari heksosa selama tingkat awal pelepasan rambut berhubungan dengan hilangnya kolagen yang disimpan sel dalam lapisan luar akar, sebelum ada perubahan dalam struktur folikel. Menurut Sadana (2002), sistem kerja enzim protease pada proses unhairing adalah dengan cara menghidrolisis
hemoglobin, Bovine Serum Albumin (BSA) dan kolagen.
Keuntungan dari penggunaan enzim protease ini adalah dapat mengurangi nilai Biochemical Oxygen Demand (BOD) dan Chemical Oxygen Demand (COD) dari limbah yang dihasilkan pada proses perontokan rambut (Trismilah, 2002). Cromogenia Units (1995) menyatakan bahwa penggunaan enzim dengan tetap menggunakan 1% sulfida, diperoleh reduksi COD sebesar 30-40%, BOD sebesar 30-40%, S (Sulfida anion) sebesar 50-65%, dan total padatan sebesar 65-80% dengan peningkatan daya kembali kulit sekitar 2%. Menurut Trusmilah (2002), penggunaan enzim protease dalam proses soaking, unhairing maupun bating mampu menghasilkan kulit berkulitas ya ng memenuhi SNI 06-0234, 1989.
Kolagen
Kolagen merupakan komponen struktural utama dari jaringan pengikat putih (white connective tissue) yang meliputi hampir 30% dari total protein pada jaringan organ
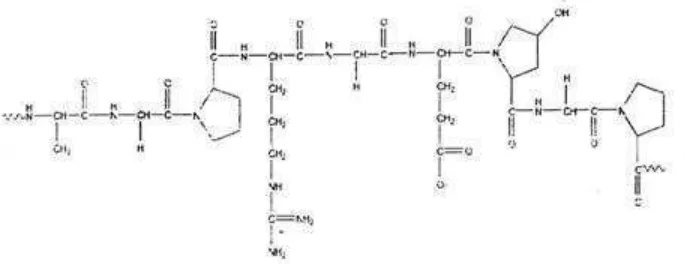
tubuh vertebrata dan invertebrata (Poppe, 1997). Kolagen berwarna putih, berupa serat tidak bercabang, dikelilingi oleh matrik mukopolisakarida dan protein lainnya. Sifat-sifat ini tergantung dari tipe jaringan dan umur hewan. Pada mamalia, kolagen terdapat dikulit, tendon, tulang rawan dan jaringan pengikat. Demikian juga pada bangsa burung dan ikan, sedangkan pada avertebrata kolagen terdapat pada dinding sel (Johns, 1977). Kandungan kolagen pada suatu jaringan tergantung pada kandungan proteinnya, karena kolagen merupakan komponen terbesar dalam prote in jaringan, dan kadar protein pada jaringan hewan tergantung pada jenis hewannya, sebagai contoh kulit hewan besar mengandung kadar protein yang lebih besar dibanding dengan kulit hewan kecil (Akademi teknologi Kulit, 1984).
tropokolagen yang berbentuk batang dengan panjang 3000Å, diameter 15Å serta mengandung tiga unit polipeptida yang saling berpilin membentuk struktur heliks yang disebut rantai a. Rantai tersebut mengandung 1000 residu asam amino dengan komposisi yang sangat bervariasi (Bennion, 1980). Wong (1989) menambahkan bahwa molekul tropokolagn mempunyai empat tipe yang digambarkan dengan rantai polipeptida yang mengandung triplet glisin dengan distribusi sebagai berikut : x-x; x- l; l-x; gly-l- l, dimana l adalah residu asam amino (prolin dan hidroksi prolin) dan x adalah residu asam amino lain. Susunan molekul tropokolagen pada fibril kolagen (Gambar 3).
Ada dua tipe ikatan yang merupakan struktur sekunder dan tersier kolagen yaitu: 1) Ikatan intramolekul yang terjadi antara rantai-rantai molekul tropokolagen dan; 2) Ikatan intermolekul yaitu ikatan antara molekul tropokolagen (Johns, 1977). Molekul kolagen tersusun dari kira-kira dua puluh asam amino yang memiliki bentuk agak berbeda bergantung pada sumber bahan bakunya. Asam amino glisin, prolin dan hidroksiprolin merupakan asam amino utama kolagen. Asam-asam amino aromatik dan sulfir terdapat dalam jumlah yang sedikit. Hidroksiprolin merupakan salah satu asam amino pembatas dalam berbagai protein (Estoe dan Leach, 1977). Molekul dasar pembentuk kolagen disebut tropokolagen yang mempunyai struktur batang dengan BM 300.000, dimana di dalamnya terdapat tiga rantai polipeptida yang sama panjang, bersama-sama membentuk struktur heliks (Bennion, 1980).
12
Menurut Balian dan Bowes (1969), kolagen mengandung asam amino glisisn, prolin, dan hidroksiprolin serta sejumlah kecil senyawa aromatik dan sulfur yang terkandung dalam asam amino. Lehninger (1982) menambahkan bahwa kolagen mengandung kira-kira 35% glisin dan kira-kira 11% alanin, tetapi yang paling menonjol adalah kandungan prolin dan 4-hidroksiprolin yang tinggi yaitu sekitar 21% (bersama-sama). Prolin dan hidroksiprolin merupakan asam amino yang jarang ditemukan pada protein selain kolagen dan elastin.
Gambar 3 Susunan molekul kolagen (Lehninger, 1982)
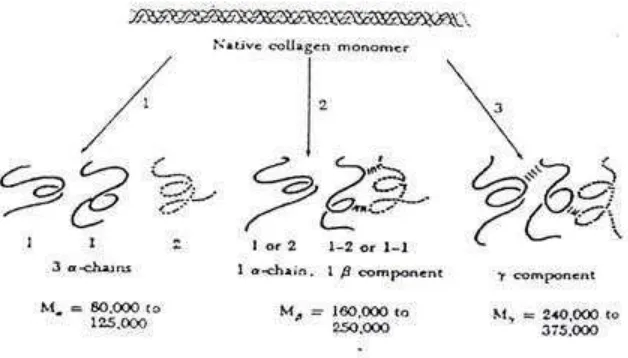
Larutan tropokolagen akan terdenaturasi oleh pemanasan atau perlakuan dengan penambahan zat seperti asam, basa, urea, kalsium dan permanganat. Tropokolagen yang telah terdenaturasi akan terdisosiasi menjadi tiga komponen yaitu a, ß, dan ?. Komponen a merupakan rantai tunggal polipeptida dengan bobot molekul kurang lebih 100.000 (sepertiga dari berat molekul tropokolagen), komponen ß dan ? merupakan dimer dan trimer yang dibentuk dari ikatan silang (Parker, 1982).
Kolagen yang terdapat pada kulit dan otot ikan mempunyai kemampuan untuk membentuk gel setelah dipanaskan. Kemampuan pembentukan gel ini tergantung pada karakteristik spesies ikan dan kolagen dari kulit ikan mempunyai kemampuan yang lebih tinggi dibandingkan kolagen dari otot. Kandungan NaCl yang rendah berpengaruh nyata terhadap kekuatan gel kolagen dari kulit ikan tetapi tidak berpengaruh nyata terhadap kemampuan gel kolagen dari otot (Montero dan Borderias 1991).
Pada ikan terdapat tiga tipe protein, yaitu protein myofibril (65–75%), sarkoplasma (20–30%), dan stromata (1–3%). Protein stromata merupakan jaringan ikat yang terdiri dari komponen kolagen dan elastin (Suzuki, 1981).
Kolagen murni sangat sensitif terhadap reaksi enzim dan kimia. Di samping pelarutnya kolagen ikan mempunyai kandungan asam amino rendah dibandingkan dengan kolagen mamalia, karena itu temperatur denaturasi proteinnya menjadi rendah (Johns, 1977).
Fibril kolagen terdiri dari sub-unit polipeptida berulang yang disebut tropokolagen yang disusun dalam untaian paralel dari kepala sampai ekor. Tropokolagen terdiri atas tiga rantai polipeptida yang berpilin erat menjadi tiga untaian tambang. Tiap rantai polipeptida dalam tropokolagen juga merupakan suatu heliks (Lehninger, 1982).
Gelatin
Gelatin berasal dari bahasa latin ”gelare” yang berarti membuat beku dan merupakan senyawa yang tidak pernah terjadi secara alamiah (Glicksman, 1969). Gelatin adalah protein dari kolagen kulit, membran, tulang, dan bagian tubuh berkolagen lainnya. Gelatin jika direndam dalam air akan mengembang dan menjadi lunak, berangsur-angsur menyerap air 5-10 kali bobot gelatin. Gelatin larut dalam air panas dan jika didinginkan membentuk gel.
14
Konversi kolagen menjadi gelatin biasanya didasarkan pada pengaturan temperatur ekstraksi, yang dilakukan untuk mencegah kerusakan protein pada suhu tinggi. Kisaran temperatur ekstraksi yang digunakan antara 500C – 1000C, sedangkan nilai pH ekstraksi dapat bervariasi untuk tiap metode (Hinterwaldner, 1977).
Harper et al., (1977) perbedaan gelatin dengan kolagen selain kandungan triptofan
dan tirosin adalah gelatin mempunyai sifat mudah larut dan gampang dicerna sehingga dapat dipakai sebagai sumber protein dalam makanan tetapi hanya berperan sebagai suplement sebab gelatin kurang mengandung asam amino yang cukup.
Gelatin termasuk molekul besar. Menurut Ward dan Court (1977) menyatakan bahwa berat molekul (BM) gelatin mencapai 90.000 sedangkan pada gelatin komersial berkisar antara 20.000 - 70.000. Balian dan Bowes (1969) menyatakan bahwa berat molekul gelatin merupakan kelipatan 768 atau kelipatan C32H52O12N10.
Gelatin mengandung 19 asam amino yang dihubungkan dengan ikatan peptida membentuk rantai polimer panjang (Glicksman, 1969). Senyawa gelatin merupakan suatu polimer linier yang tersusun oleh satuan terulang asam amino glisin-prolin-prolin atau glisin-prolin- hidroksiprolin. Komposisi asam amino gelatin bervariasi tergantung pada sumber kolagen tersebut, spesies hewan penghasil dan jenis kolagen (Ward dan Court, 1977). Gelatin tidak mengandung triptofan dan hanya mengandung sedikit tirosin dan sistin (Charley, 1982).
Gambar 4 Struktur kimia gelatin (Poppe, 1992)
Gelatin dibagi menjadi dua tipe berdasarkan perbedaan proses pengolahannya yaitu tipe A dan tipe B. Dalam pembuatan gelatin tipe A, bahan baku diberi perlakuan perendaman dalam larutan asam sehingga proses ini dikenal dengan sebutan proses asam. Sedangkan dalam pembuatan gelatin tipe B, perlakuan yang diaplikasikan adalah perlakuan basa, proses ini disebut dengan proses alkali (Utama, 1997). Menurut Wiyono (2001), gelatin ikan dikategorikan sebagai gelatin tipe A. Secara ekonomis, proses asam lebih disukai dibandingkan proses basa. Hal ini karena perendaman yang dilakukan dalam proses asam relatif lebih singkat dibandingkan proses basa.
Tabel 2 Beberapa sifat gelatin berdasarkan tipenya*
Parameter Gelatin Tipe A Gelatin Tipe B
Kekuatan gel (bloom) 75 - 300 75 – 275
Viskositas (Cp) 2.0 – 7.5 2.0 – 7.5
Kadar Abu (%) 0.3 – 2.0 0.05 – 2.0
pH 3.8 – 6.0 5.0 – 7.1
Titik Isoelektrik 9.0 – 9.2 4.8 – 5.0
* Tourtellote (1980)
16
kulit babi, dimana molekul kolagennya muda, sedangkan gelatin tipe B dihasilkan dari proses asam dan basa, yang umumnya diterapkan pada tulang dan kulit sapi, dimana molekul kolagen triple heliksnya lebih tua, ikatan silangnya lebih padat dan kompleks (GMAP, 2002). Dengan demikian dapat dikatakan bahwa proses asam yang digunakan untuk bahan baku yang relatif lunak, sedangkan proses alkali diterapkan pada bahan baku yang relatif keras.
Asam mampu mengubah serat kolagen triple heliks menjadi rantai tunggal, sedangkan larutan perendam basa hanya mampu menghasilkan rantai ganda. Hal ini menyebabkan pada waktu yang sama jumlah kolagen yang dihidrolis oleh larutan asam lebih banyak daripada larutan basa. Karena itu perendaman dalam larutan basa
membutuhkan waktu yang lebih lama untuk menghidrolisis kolagen (Ward dan Court, 1977).
Tabel 3 Spesifikasi Gelatin Farmasi* .
Parameter
mudah larut pada suhu 71.10C dan cenderung membentuk gel pada suhu 48.90C.
Sedangkan menurut Johns (1977) menyatakan bahwa pemanasan yang dilakukan untuk melarutkan gelatin sekurang-kurangnya 490C atau biasanya pada suhu 60-700C.
Gelatin memiliki beberapa sifat yaitu dapat berubah secara reversibel dari bentuk
sol ke gel, mengembang dalam air dingin, dapat membentuk film, mempengaruhi viskositas suatu bahan, dan dapat melindungi sistem koloid (Parker, 1982). Menurut Johns (1977) sifat reversible tersebut yang membedakan gelatin dengan gel hidrpkoloid
lain seperti pektin, pati, alginat, protein susu, dan albumin telur yang betuknya bersifat
irreversble.
Gelatin bersifat hidrofilik yang dapat digunakan untuk menstabilkan koloid, sehingga efektif dugunakan sebagai pengemulsi (emulsifier) dan penstabil (stabilizer) dalam sistem emulsi sehingga emulsi stabil atau tidak pecah selama penyimpanan (Glicksman, 1969). Pada suatu emulsi biasanya terdapat tiga bagian utama yaitu bagian yang terdispersi terdiri dari butiran-butiran yang biasanya terdiri dari lemak, bagian kedua disebut media pendispersi yang biasanya terdiri dari air, dan bagian ketiga adalah
emulsifier yang berfungsi menjaga agar butiran minyak tadi tetap tersuspensi di dalam air.
Daya kerja emulsifier terutama disebabkan oleh bentuk molekulnya yang dapat terikat
baik pada minyak maupun pada air (Winarno, 1997). Menurut Graham (1977), emulsifier
mempunyai dua sisi dengan sifat yang berbeda. Salah satu sisinya bersifat polar yang dapat berkaitan dengan cairan yang bersifat polar (air), sedangkan sisi yang lainnya bersifat non polar yang berkaitan dengan fase non polar (minyak). Stabilizer merupakan
suatu lapisan tipis yang menyelubungi partikel dan lokasinya berada diantara kedua permukaan, yaitu antara senyawa terdispersi dan senyawa pendispersi atau tepatnya senyawa ini disebut lapisa interfarsial. Kedua lapisan tersebut (senyawa terdispersi dan senyawa pendispersi) mempunyai tegangan yang disebut tegangan permukaan yang penting peranannya dalam sistem emulsi. Gelatin merupakan salah satu senyawa aktif permukaan yang mampu menurunkan tegangan permukaan tersebut (de Man, 1989).
18
hidrodinamik antar molekul gelatin, suhu, pH dan konsentrasi. Sifat fisik lainnya adalah titik pembentukan gel, warna, kapasitas emulsi, dan stabilitas emulsi (Glicksman, 1969).
Gelatin mempunyai banyak fungsi dan sangat aplikatif di berbagai industri. Gelatin sebagai pelindung koloid dapat berguna dalam industri fotografi dan pelapis logam dalam industri electroplanting (Ward dan Court, 1977). Dalam air gelatin dapat
membentuk larutan kental, karena sifat ini gelatin dapat digunakan sebagai bahan perekat dalam pembuatan tablet. Standar mutu gelatin untuk industri farmasi (Tabel 3).
Pembuatan Gelatin
Pada prinsipnya proses pembuatan gelatin dapat dibagi menjadi dua macam, yaitu proses asam dan proses basa. Perbedaan kedua proses ini terletak pada proses perendamannya. Berdasarkan kekuatan ikatan kovalen silang protein dan jenis bahan yang diekstrak, maka penerapan jenis asam maupun basa organik dan metode ektraksi lainnya seperti lama hidrolisis, pH dan suhu akan berbeda-beda (Pelu et al., 1998).
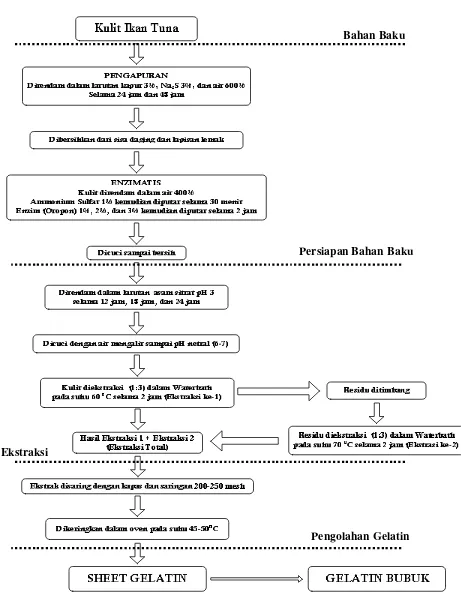
Hinterwaldner (1977) menyatakan bahwa proses produksi utama gelatin dibagi dalam tiga tahap: (1) Tahap persiapan bahan baku berupa penghilangan komponen non kolagen dengan atau tanpa pengurangan ikatan antara komponen kolagen; (2) Tahap konversi kolagen menjadi gelatin; (3) Tahap pemurnian gelatin dengan penyaringan dan pengeringan.
Pada proses pembuatan gelatin berbahan baku kulit, terdapat proses yang penting dilakukan pada bahan sebelum diproses menjadi gelatin, yaitu proses liming dan
degreasing. LP POM-MUI (1997) menyatakan bahwa proses degreasing bertujuan untuk
menghilangkan lemak-lemak yang masih terdapat dalam jaringan kulit dengan proses pemasakan. Penghilangan lemak pada kulit yang paling efektif dilakukan pada suhu antara titik cair lemak dan suhu koagulasi protein, yaitu sekitar 32-280C. Liming
Gambar 5 Diagram alir proses pembuatan gelatin dengan cara asam (tipe A) dan cara basa (tipe B)
Tahap pengembangan kulit (swelling) adalah tahap yang bertujuan untuk
menghilangkan kotoran-kotoran dan mengkonversi kolagen menjadi gelatin (Surono et.al.,
20
Proses produksi gelatin diawali dengan ekstraksi setelah sebelumnya dilakukan perlakuan atau penanganan awal pada bahan baku yang akan digunakan. Ekstraksi merupakan proses denaturasi untuk mengubah serat kolagen yang tidak larut dalam air dengan penambahan senyawa pemecah ikatan hidrogen. Menurut Hinterwaldner (1977), kisaran temperatur yang digunakan untuk ekstraksi antara 50-1000C atau lebih rendah. Nilai pH ekstraksi dapat berbeda untuk setiap metode.
Gambar 6 Transformasi kola gen-gelatin (Glicksman, 1969)
Tahapan selanjutnya ialah penghilangan zat-zat lain yang tidak larut yang dapat mengurangi kemurnian gelatin, yaitu melalui penyarinan. Proses terakhir ialah pemekatan dan penegringan larutan gelatin. Pemekatan bertujuan untuk meningkatkan total solid sehingga mempercepat proses pengeringan. Kerusakan gelatin dapat dicegah dengan pemekatan yang dilakukan dengan singkat pada temperatur tidak lebih dari 700C.
Mutu Gelatin
larutan cair pada kisaran suhu 30 - 350C. Gelatin yang diekstrak dari ikan memiliki titik
jendal pada kisaran suhu 5 - 100C (Food Chemicals Codex, 1996). Menurut Poppe (1997) bahwa gelatin memiliki titik leleh di bawah 370C, ini artinya gelatin dapat meleleh di dalam mulut dan mudah sekali larut.
pH dimana gelatin terbentuk dalam larutan netral disebut titik isoelektrik. Titik isoelektrik gelatin berkisar antara 4.8 dan 9.4 dimana gelatin yang diproses secara asam memiliki titik isoelektrik yang lebih tinggi dibanding yang diproses secara basa (Poppe, 1997). Gelatin yang dihasilkan dari proses asam memiliki titik isoelektrik point (IEP) antara 6-9 (Tessenderlo Group, 2002). Gelatin yang berbentuk gel pada konsentrasi minimum 0.5% memiliki pH dengan kisaran 4-8. pH dalam larutan air untuk gelatin tipe A yaitu antara 4.5 dan 6, dan kisaran pH untuk gelatin tipe B adalah 5-7 (USFDA, 1997).
Kadar abu gelatin bervariasi berdasarkan jenis bahan baku dan metode pengolahannya. Gelatin dari kulit babi atau tipe A mengandung sedikit klorida, sedangkan gelatin dari ossein (kulit anak sapi) atau gelatin tipe B terutama mengandung kalsium dan fosfat (Glicksman, 1969).
Gelatin komersial memiliki kekuatan gel yang cukup bervariasi yaitu dari 90 sampai 300 gram Bloom (Igoe, 1983). Gelatin dari ikan berbeda dengan gelatin dari sapi atau babi yaitu titik lelehnya rendah, suhu pembentukan gel rendah, dan viskositasnya tinggi (Leuenberger 1991).
Menurut Estoe dan Leach (1977) gelatin mengandung asam amino yang biasa terdapat pada protein kecuali triptopan dan sistein, tapi kadang-kadang keduanya terdapat dalam jumlah kecil. Gelatin yang diperoleh melalui proses basa lebih kaya hidroksiprolinnya dan rendah tirosin dibandingkan yang diperoleh secara asam. Lebih lanjut dikatakan bahwa komposisi asam amino gelatin yang diperoleh dari kolagen ikan dan elasmobranch lebih beragam dibandingkan gelatin dari sumber lainnya. Kadar prolin dan hidroksiprolin gelatin ikan lebih rendah dibandingkan gelatin dari mamalia, dan lebih rendah lagi pada ikan air dingin, sementara kandungan metioninnya lebih banyak.
22
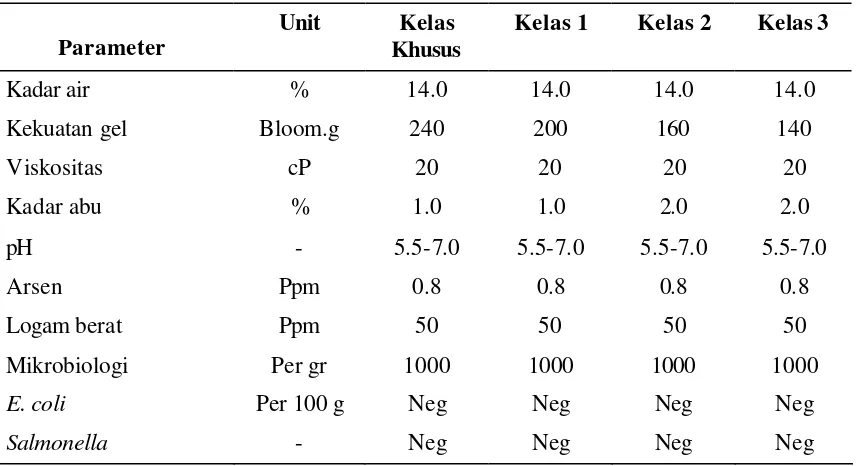
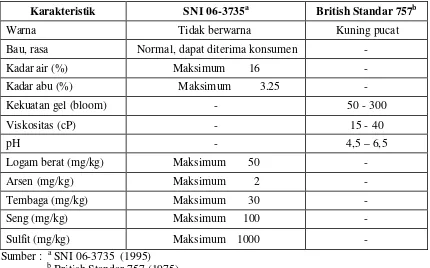
Tabel 4 Standar mutu gelatin.
Karakteristik SNI 06-3735a British Standar 757b
Warna Tidak berwarna Kuning pucat
Bau, rasa Normal, dapat diterima konsumen -
Kadar air (%) Maksimum 16 -
Kadar abu (%) Maksimum 3.25 -
Kekuatan gel (bloom) - 50 - 300
Viskositas (cP) - 15 - 40
pH - 4,5 – 6,5
Logam berat (mg/kg) Maksimum 50 -
Arsen (mg/kg) Maksimum 2 -
Tembaga (mg/kg) Maksimum 30 -
Seng (mg/kg) Maksimum 100 -
Sulfit (mg/kg) Maksimum 1000 -
METODOLOGI PENELITIAN
Tempat dan Waktu
Penelitian ini dilaksanakan di laboratorium Pusat Riset Pengolahan Produk dan Sosial Ekonomi Perikanan dan Kelautan Slipi Jakarta, mulai bulan April 2005 sampai Agustus 2005.
Bahan dan Alat
Bahan utama yang digunakan pada penelitian ini adalah kulit ikan tuna, dimana untuk satu kali percobaan digunakan 0.5 kg kulit ikan tuna. Bahan tersebut diperoleh dari tempat pengolahan fillet ikan tuna di Jakarta. Kulit ikan yang telah dipilih segera dimasukkan ke dalam peti pendingin. Kulit ikan tersebut segera dibawa ke laboratorium Pusat Riset Pengolahan Produk dan Sosial Ekonomi Perikanan dan Kelautan Jakarta untuk selanjutnya diberi perlakuan yang telah ditentukan dan diekstraksi menjadi gelatin. Bahan-bahan lainnya adalah Asam Sitrat, kapur, Natrium Sulfat, Amonium Sulfat, Enzim (Oropon), dan aquades.
Peralatan yang digunakan dalam penelitian ini adalah: pisau, wadah plastik, pan-pan aluminium, peti pendingin, beaker gelas 5000 ml, neraca analitik Chyo JP-160, pH-meter Accument 900-Fisher Scientific, ruang pendingin, inkubator, desikator, waterbath, thermometer digital Hanna, curd meter, viskometer, peralatan mikro Kjheldahl, peralatan soxhlet, spectrophotometer, high performance liquid chromatography (HPLC) Water Associates, detektor model 440 Absorbance Detector Water Associates, freeze dryer, gas chromatography (GC) Hitachi 263-50, magnetic stirrer, cawan porselin, alat-alat gelas, kapas dan kain saring.
Metode Penelitian
Proses pembuatan gelatin dengan metode asam yang digunakan meliputi persiapan bahan baku, pencucian, perendaman dalam larutan kapur, pencucian dan pembersihan, enzimatis, pencucian, swelling, pencucian, ekstraksi, filtrasi, pengeringan, dan
24
Bahan baku berupa kulit yang telah di persiapkan terlebih dahulu dicuci sampai bersih dari sisa-sisa kotoran dan darah yang masih menempel pada kulit. Kulit kemudian direndam dalam larutan kapur 3%, Na2S 3%, dan air 600% dari berat kulit basah selama
24dan 48 jam. Proses perendaman dalam larutan kapur dan Na2S dilakukan untuk
menghilangkan sisik dan menghilangkan lemak- lemak yang masih menempel pada permukaan bawah kulit, trimming secara mekanik dengan menggunakan pisau.
Deagreasing dilakukan untuk menghilangkan lemak yang masih terikat pada kulit.
Proses selanjutnya adalah pembuangan kapur dengan merendam kulit dalam air 400% dan larutan ammonium sulfat 1% kemudian diputar selama 30 menit, selanjutnya kulit dienzimatis dengan konsentrasi 1, 2, dan 3% kemudian diputar selama 2 jam dengan tujuan melepaskan lapisan epidermis kulit yang tidak mengandung kolagen dan melemaskan jaringan serat-serat kolagen dan protein elastin yang terdapat pada kulit.
Proses liming adalah proses perendaman dalam larutan asam untuk melanjutkan
pembengkakan kulit (swelling). Tujuannya adalah untuk menceraikan serabut-serabut
kolagen menjadi serat-serat atau fibril- fibril, sehingga kulit menjadi terbuka. Proses perendaman dalam larutan asam dilakuk an selama 12, 18, dan 24 jam.
Langkah selanjutnya adalah ekstraksi gelatin selama 2 jam dengan suhu 600C dengan perbandingan bahan dan aquades sebanyak 1 : 3. Residu yang diperoleh dari ekstraksi pertama kemudian diekstrak kembali pada suhu 700C selama 2 jam dengan perbandingan bahan dan aquades sebanyak 1 : 3. Filtrat yang diperoleh dari ekstraksi 1 dan 2 kemudian disaring dengan menggunakan saringan kapas dan saringan 200 – 250 mesh. Larutan gelatin yang dihasilkan kemudian dikeringkan dengan oven pada suhu 50 – 550C selama 2 – 3 hari. Selanjutnya dilakukan proses penggilingan (grinding), sehingga
diperoleh gelatin kering dalam bentuk butiran-butiran halus (bubuk).
Penelitian Tahap I
Pada penelitian tahap ini dilakukan pembuatan gelatin dari kulit ikan tuna dengan melakukan perendaman dalam larutan kapur selama 24 jam (P1) dan 48 jam (P2), dengan konsentrasi enzim 1% (E1), 2% (E2), 3% (E3), sedangkan perendaman dalam larutan asam dilakukan selama 12 jam (S1), 18 jam (S2), dan 24 jam (S3) dengan suhu ekstraksi 600C dengan waktu ekstraksi 2 jam. Dengan demikian terdapat sejumlah 18 perlakuan yaitu: 1). P1E1S1, 2). P1E1S2, 3). P1E1S3, 4). P1E2S1, 5). P1E2S2, 6). P1E2S3, 7). P1E3S1, 8). P1E3S2, 9). P1E3S3, 10). P2E1S1, 11). P2E1S2, 12). P2E1S3, 13). P2E2S1, 14). P2E2S2, 15). P2E2S3, 16). P2E3S1, 17). P2E3S2, 18). P2E3S3. Diagram alir proses ekstraksi gelatin dari kulit ikan tuna (Gambar 2). Penentuan teknik ekstraksi gelatin yang terbaik dipilih berdasarkan rendemen, viskositas, dan kekuatan gel yang sesuai dengan standar mutu gelatin.
Pada tahap ini rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap Faktorial dengan tiga faktor (Steel dan Torrie, 1993). Model rancangan adalah:
Yhij = µ + Ph + Ei + Sj + (PE)hi + (ES)ij + (PS)hj + (PES)hij + Shij
Dimana:
Yhij = hasil pengamatan
µ = nilai tengah umum
Ph = pengaruh lama pengapuran ke- h (h = 1, 2)
Ei = pengaruh konsentrasi enzim ke-i (i = 1, 2, 3)
Sj = pengaruh lama perendaman asam ke-j (j = 1, 2, 3)
(PE)hi = pengaruh interaksi lama perendaman kapur ke-h dengan
konsentrasi enzim ke- i
(ES)ij = pengaruh interaksi konsentrasi enzim ke- i dengan lama
perendaman asam ke-j
(PS)hj = penga ruh interaksi lama perendaman kapur ke-h dengan
lamaperendaman asam ke-j
(PES)hij = penguh interaksi lama pengapuran, konsentrasi enzim,
26
Gambar 7 Proses ekstraksi gelatin dari kulit ikan tuna (Sumber : Poppe, 1992 yang telah dimodifikasi)
Bahan Baku
Persiapan Bahan Baku
Ekstraksi
Penelitian Tahap II
Penelitian tahap keduan ini bertujuan mengkaji karakteristik gelatin kulit ikan tuna yang dihasilkan meliputi sifat fisik sifat kimia, sifat organoleptik serta kandungan mikrobiologi. Pada tahap ini dilakukan pembuatan gelatin dengan teknik ekstraksi terbaik yang diperoleh dari penelitian tahap pertama dengan 3 kali ulangan. Gelatin yang dihasilkan kemudian dibandingkan dengan gelatin standar laboratorium ”SIGMA” produksi Kanada (terbuat dari kulit ikan cod), gelatin komersial (terbuat dari tulang sapi dan telah dijual bebas), dan standar mutu gelatin farmasi
Pengamatan dilakukan terhadap parameter yang menjadi indikator mutu gelatin yang meliputi rendeman, kadar air, kadar abu, kadar protein, kadar lemak, pH, kekuatan gel, Viskositas, titik leleh, titik jendal, titik isoelektrik, komposisi asam amino, derajat putih, logam berat, uji organoleptik, dan uji mikrobiologi yang meliputi Total Plate Count (TPC), Escherichia coli dan Salmonella. Untuk penelitian tahap kedua, data hasil
pengamatan dibandingkan secara deskriptif.
28
Pengamatan
Rendemen (AOAC, 1995)
Rendemen diperoleh dari perbandingan berat kering sheet gelatin yang dihasilkan dengan bahan kulit (yang telah dibersihkan dari sisa daging dan lapisan lemak). Rendemen dapat diperoleh dengan menggunakan rumus :
Rendemen (%) = x 100%
Kekuatan Gel (British Standard 757, 1975)
Larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan aquades. Larutan diambil sebanyak 15 ml kemudian ditempatkan pada wadah dengan volume 20 ml. Sampel diinkubasi pada suhu 100C selama 17 ± 2 jam, kemudian diukur dengan menggunakan alat curd meter. Hasil dari pengukuran berupa grafik, selanjutnya dihitung dengan rumus :
Viskositas (British Standard 757, 1975)
Derajat Keasaman (pH) (British Standar 757, 1975)
Larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan aquades. Larutan sampel dipanaskan pada suhu 700C dan dihomogenkan dengan magnetic stirrer,
kemudian diukur derajat keasamannya pada suhu kamar dengan pH meter.
Kadar Air (AOAC, 1995)
Cawan porselen dikeringkan pada suhu 1050C selama 1 jam. Kemudian didinginkan dan ditimbang, contoh yang akan ditentukan kadar airnya ditimbang sebanyak 2 gram. Cawan yang telah berisi contoh dimasukkan ke dalam oven bersuhu 1050C sampai beratnya konstan. Kadar air dihitung dengan rumus :
Kadar air (%) =
(
)
x 100%Contoh yang telah diuapkan airnya dimasukkan ke dalam tanur bersuhu 6000C, sebelumnya berat cawan kering dan berat contoh telah diketahui. Proses penguapan dilakukan sampai semua bahan berubah warna menjadi abu-abu, kemudian contoh ditimbang. Kadar abu dihitung dengan rumus :
Kadar abu (%) = x 100%
Sejumlah 0.02-0.05 gram dimasukkan dalam labu Kjeldahl 100 ml kemudian ditambah 2-3 gram katalis (1.2 gram Na2SO4 dan 1 gram CuSO4) dan 2-3 ml H2SO4 pekat,
lalu dilakukan destruksi hingga larutan menjadi jernih. Setelah itu didinginkan kemudian sampel didestilasi dan ditambah 35 ml aquades dan 10 ml NaOH 50%. Hasil destilasi ditampung dalam erlenmeyer berisi 5 ml H3BO3 dan indikator metil merah dan metil biru
30
Sebanyak 2 gram sampel dibungkus dalam kertas saring dan dimasukkan ke dalam labu soxhlet (labu sebelumnya dikeringkan dalam oven, dimasukkan ke dalam desikator lalu ditimbang). Dimasukkan pelarut petroleum eter kemudian dilakukan reflux selama 6 jam. Lalu labu berisi hasil reflux dipanaskan dalam oven dengan suhu 1050C. Setelah itu
didinginkan dalam desikator dan ditimbang. Kadar lemak dihitung dengan rumus :
Kadar lemak (%) = x 100% sampel
lemak
berat berat
Titik Isoelektrik (Wainewright, 1977)
Sebanyak 0.2 gram sampel ditambah dengan 40 ml aquades sebagai pelarut dengan kisaran pH 4.5-10.5 (interval 0.5). Pengaturan pH dilakukan dengan menambahkan NaOH 0.5 N untuk menaikkan pH dan HCl 0.5 untuk menurunkan pH. Setelah kondisi pH tercapai, dilanjutkan dengan pengadukan selama 30 menit untuk menyempurnakan ekstraksi. Larutan yang dihasilkan dipisahkan dengan bagian yang tidak larut dengan cara disentrifuse, kemudian disaring dengan kertas saring whatman 41. Filtrat dianalisa kadar nitrogennya dengan metode mikro Kjeldahl. Kadar nitrogen terlarut yang paling rendah ditentukan sebagai daerah titik isoelektrik (pI).
Logam Berat
Setelah didinginkan dan disaring, filtrat dimasukkan ke dalam labu takar dan diencerkan dengan air sampai tanda tera. Blanko disiapkan menggunakan pereaksi yang sama.
Alat AAS diset sesuai interuksi dalam manual alat tersebut. Larutan standar logam, blanko dan sampel diukur. Selama penetapan sampel, dilakukan pemeriksaan apakah nilai standar tetap konstan. Kemudian dibuat kurva standar untuk masing-masing logam (nilai absorbsi/emisi vs konsentrasi logam dalam µg/ml)
Asam Amino (Muchtadi dkk, 1992)
Sebanyak 0.2 gram sampel disiapkan dalam tabung reaksi tertutup dan ditambahkan sebanyak 5 ml HCl 6 N. Sampel dimasukkan dalam oven dengan suhu 1000C selama 18-24 jam. Selanjutnya sampel disaring dengan kertas saring whatman 40.
Hasil hidrolisis dipipet sebanyak 10 µl dan dimasukkan ke dalam tabung reaksi.
Kemudian ditambahkan 30 µl larutan pengering, lalu dikeringkan dengan pompa vakum bertekanan 50 torr. Sampel yang telah dikeringkan ditambahkan larutan derivat sebanyak 30 µl dan dibiarkan selama ± 20 menit. Sampel selanjutnya diencerkan dengan 200 µl larutan pengencer natrium asetat 1 M. Sampel siap dianalisis dengan menggunakan HPLC Waters Associates. Kondisi HPLC pada saat dilakukan analisis :
- Temperatur kolom : 380C
- Kolom : pico tag 3.9 x 150 nm coulomb - Kecepatan alir : sistem linier gradien
- Batas tekanan : 3000 psi - Program : gradien
- Fase gerak : - Asetonitril 60%
- Buffer Natrium asetat 1 M, pH 5.75 - Detektor : UV, panjang gelombang 254 nm
Konsentrasi asam amino dihitung dengan rumus :
Konsentrasi asam amino (%) = x Bs x BM x Fp x 100%
Bc As
Ac
32
Keterangan : Ac = Luas area sampel As = Luas area standar Bc = Berat sampel (µg) Bs = Berat standar (µg)
BM = Berat molekul masing- masing asam amino Fp = Faktor pengencer (15)
Titik Jendal (Suryaningrum dan Utomo, 2002)
Larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan aquades, dan disiapkan dalam tabung reaksi volume 15 ml yang dihubungkan dengan sensor thermometer digital Hanna. Sampel diturunkan suhunya secara perlahan- lahan dengan cara menempatkan pada wadah yang telah diberi pecahan es. Titik jendal dientukan tepat pada saat sensor dapat mengangkat gel dalam tabung reaksi.
Titik Leleh (Suryaningrum dan Utomo , 2002)
Larutan gelatin dengan konsentrasi 6.67% (b/b) disiapkan dengan aquades. Sampel diinkubasi pasa suhu 100C selama 17 ± 2 jam. Pengukuran titik leleh dilakukan dengan cara memanaskan gel gelatin dalam waterbath. Di atas gel gelatin tersebut diletakkan gotri dan ketika gotri jatuh ke dasar gel gelatin maka suhu tersebut ditentukan sebagai titik leleh gelatin.
Derajat Putih
Analisis warna dilakukan dengan menggunakan kromameter. Alat dikalibrasi dengan warna putih yang diasumsikan mempunyai derajat putih 100%. Kemudian dilakukan pengukuran terhadap sampel. Hasil pengukuran berupa Y, x, dan y dikonversi
menjadi Y, X, dan Z dengan rumus :
Y = Y
X = Y(x/y)
Nilai Y, X, dan Z selanjutnya dikonversi menjadi L, a, dan b dengan rumus :
L = 10 Y
a = (17.5 (1.02X - Y)) / Y
b = (7.0 (Y - 0.847Z)) / Y
Derajat putih (WO) dihitung dengan rumus :
2
Penentuan Total Plate Count (SNI 01-2339, 1991)
Gelatin sebanyak 10 gr dimasukkan ke dalam blender jars dan ditambahkan 90 ml NaCl 0.9%, kemudian diblender selama beberapa detik dengan kecepatan rendah dan dilanjutkan dengan kecepatan tinggi selama dua menit. Larutan yang didapat adala h pengenceran 10-1. Selanjutnya larutan tersebut dipipet sebanyak 1 ml dan dimasukkan ke dalam cawan petri steril, dan 1 ml lagi ke dalam cawan petri yang lain sebagai duplo. Kemudian disiapkan larutan sampel dengan pengenceran 10-2 dengan memipet 1 ml larutan pengenceran 10-1 dan dimasukkan ke dalam 9 ml larutan NaCl 0.9%, lalu dikocok sampai homogen. Larutan 10-2 ini dipipet dan dimasukkan ke dalam cawan petri dan dilakukan secara duplo. Selanjutnya dengan cara yang sama dilakukan inokulasi sampel sampai pengenceran 10-8.
Ke dalam semua cawan petri yang telah berisi larutan sampel, dituangkan media tumbuh Plate Count Agar (PCA) dengan suhu 450C sebanyak 15 ml dan dibiarkan selama
15 – 20 menit sampai agarnya memadat. Selanjutnya diinkubasikan pada suhu 370C dengan posisi terbalik selama 48 jam. Disamping itu dibuat blanko, yaitu ke dalam cawan petri steril hanya dituangkan media tumbuh PCA 15 ml dan 1 ml larutan pepton 1%. Perhitungan jumlah koloni dilakukan dengan menggunakan Quebec Colony Counter.
Perhitungan dilakukan sesuai dengan Standart Plate Count (SPC).
Penentuan Escherichia coli (SNI 01-2332, 1991)
34
dengan pengenceran 10-1 sampai 10-3, aduk sampai homogen. Inokulasikan pada media
Lauryl Sulfate Tryptose (LST) broth masing- masing 3 tabung dengan 1 ml larutan sampel.
Tabung-tabung tersebut diinkubasi selama 48 jam pada suhu 350C. Tabung yang membentuk gas adalah positif untuk bakteri coliform. Selanjutnya dilakukan tes konfirmasi bakteri E. coli.
Tabung-tabung LST positif dikocok secara perlahan- lahan, lalu dipindahkan ke tabung-tabung EC broth menggunakan jarum inokulasi steril berdiameter 3 mm dan dihindari terjadinya selaput. Tabung-tabung EC broth diinkubasi pada water bath bersirkulasi dengan suhu 45.50C selama 48 jam. Tabung-tabung yang mengandung gas adalah tabung-tabung positif. Tabung-tabung EC positif dikocok perlahan- lahan, kemudian ditumbuhkan pada media Levine’s Eosine Methylene Blue (L-EMB) agar
dengan cara goresan menggunakan jarum inokulasi berdiameter 5 mm, dan dihindari terjadinya selaput. Selanjutnya diinkubasikan pada suhu 350C selama 24 jam. Jika terjadi pertumbuhan pada media berarti positif E. coli.
Penentuan Salmonella (SNI 01-2335, 1991)
Sebanyak 10 gr gelatin dimasukkan ke dalam blender jars dan ditambahkan 90 ml lactose broth, kemudian diblender selama beberapa detik dengan kecepatan rendah dan dilanjutkan dengan kecepatan tinggi selama dua menit. Sampel dipindahkan secara aseptis ke dalam botol steril yang bertutup. Kedalam larutan sampel ditambahkan NaOH 1 N untuk mencapai pH 7, lalu diinkubasikan pada suhu 350C selama 24 jam. Setelah inkubasi botol sampel dikocok secara perlahan- lahan kemudian diambil 1 ml dan dipindahkan ke dalam tabung reaksi yang berisi 10 ml media Selenite Cystine Broth
(SCB). Selanjutnya diinkubasikan pada suhu 350C selama 24 jam. Selesai inkubasi, ditumbuhkan pada tiga macam media yaitu Bismuth Sulphite Agar (BSA), Salmonella
-Shiggella Agar (SSA), dan Brilliant Green Agar (BGA), dengan cara goresan. Kemudian
diinkubasikan pada suhu 350C selama 24 jam. Setelah inkubasi, diamati adanya koloni
Salmonella dengan ciri-ciri sebagai berikut : pada media BGA, tidak berwarna, merah
cahaya metalik, sekeliling media berwarna coklat pada mulanya berubah menjadi hitam dengan makin lamanya inkubasi, koloni berwarna hijau dengan sedikit atau tanpa terjadinya warna gelap disekeliling media. Apabila pada agar-agar tersebut tidak ditemukan koloni tersangka maka diinkubasikan kembali selama 24 jam.
Setiap koloni tersangka Salmonella dipindahkan ke agar miring Triple Sugar Iron
Agar (TSIA) dengan cara menggoreskannya, lalu diinkubasikan pada suhu 350C selama
24 jam. TSIA yang tersangka ditumbuhi Salmonella akan menunjukkan terbentuknya
warna merah dengan atau tidak disertai timbulnya H2S yang warnanya hitam.
Uji Organoleptik (Soekarto dan Hubeis, 1991)
Uji organoleptik dilakukan melalui uji segitiga (Triangle Test). Sejumlah sampel disajikan bersama dengan pembanding. Kemudian sifat mutu yang meliputi warna, bau dan penampakan dinilai apakah lebih baik, sama atau kurang. Pembanding yang digunakan adalah gelatin standar dan gelatin komersial.
HASIL DAN PEMBAHASAN
Bahan Baku
Kulit ikan tuna yang digunakan dalam penelitian ini diperoleh dari limbah produksi fillet ikan tuna skala rumah tangga disekitar Tempat Pelelangan Ikan (TPI) Muara Baru, Jakarta. Gambar 9 memperlihatkan kulit ikan tuna segar sebagai bahan baku pembuatan gelatin yang diperoleh dari industri fillet. Kulit tersebut kemudian dicuci sampai bersih, setelah itu kulit direndam dalam larutan kapur sebagai tahap awal dalam proses pembuatan gelatin kulit ikan tuna.
Gambar 9 Kulit ikan tuna.
Hasil pengujian komposisi kimia kulit ikan tuna segar dan komposisi kimia kulit ikan tuna yang telah dibersihkan (degreasing) dengan perlakuan perendaman dalam larutan kapur dan proses enzimatis ya ng telah siap untuk diekstraksi
Tabel 5 Komposisi kimia kulit ikan tuna segar dan kulit ikan tuna siap ekstraksi
Sampel KadarAir
(%)
Kadar Abu
(%)
Kadar Lemak
(%)
Kadar Protein
(%)
Kulit segar 60.19 7.49 0.33 22.15
Penelitian Tahap I
Rendemen Gelatin
Rendemen merupakan salah satu parameter yang penting dalam menilai efektif tidaknya proses produksi gelatin. Efisien dan efektifnya proses ekstraksi bahan baku untuk pembuatan gelatin dapat dilihat dari nilai rendemen yang dihasilkan. Rendemen dihitung berdasarkan perbandingan antara gelatin kering yang dihasilkan dengan berat basah bahan baku atau kulit. Rendemen gelatin kulit ikan tuna yang dibuat berdasarkan lama Perendaman dalam larutan kapur, konsentrasi enzim, dan lama perendaman asam rataannya berkisar antara 5.9 sampai dengan 20.2% (Lampiran 1). Gelatin yang dapat diperoleh melalui ekstraksi kolagen secara bertingkat adalah 14% sampai 28% terhadap bahan baku (Glicksman, 1969).
Rendemen tiap ulangan untuk semua perlakuan sedikit beragam, hal ini kemungkinan disebabkan oleh proses penirisan kulit yang tidak sempurna setelah pencucian yang mengakibatkan kandungan air kulit menjadi tinggi sehingga pada saat penimbangan bobot yang terhitung bukan bobot murni kulit. Kandungan air yang tinggi dari bahan dapat mempengaruhi proses perendaman bahan, karena sifat dari air dapat mengencerkan konsentrasi larutan asam yang digunakan sehingga proses perendaman menjadi kurang efektif. Efektifitas proses perendaman kulit akan semakin tinggi apabila kadar air bahan bisa dikurangi terlebih dahulu sebelum perendaman, misalnya dengan cara diperas atau dikeringkan. Selain itu pada proses produksi, yaitu pada proses pengeringan dengan oven, apabila tidak dilakukan dengan sempurna maka akan mempengaruhi kadar air.