PEMANFAATAN BAKTERI PERAKARAN PEMACU
PERTUMBUHAN TANAMAN (PLANT GROWTH-
PROMOTING RHIZOBACTERIA) UNTUK
MENGENDALIKAN PENYAKIT MOSAIK
TEMBAKAU (TOBACCO MOSAIC VIRUS)
PADA TANAMAN CABAI
TAHLIYATIN WARDANAH
A44102021
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
TAHLIYATIN WARDANAH. Pemanfaatan Rizobakteri Pemacu Pertumbuhan
L.) merupakan salah satu mod
penggunaan P. ores
orium Mikologi Tumbuhan dan
ercobaan disusun dalam rancangan acak lengkap. Unit perlakuan terdiri
ada perlakuan campuran kedua bakteri
tembakau pada tanaman cabai.
Tanaman (Plant Growth-promoting Rhizobacteria) untuk Mengendalikan Penyakit Mosaik Tembakau (Tobacco mosaic virus) pada Tanaman Cabai. Dibimbing oleh GEDE SUASTIKA dan WIDODO.
Tanaman cabai merah (Capsicum annuum
ko itas penting hortikultura di Indonesia yang banyak digemari oleh masyarakat. Virus merupakan salah satu penyebab penyakit penting pada tanaman cabai. Salah satu virus yang menyerang tanaman cabai yaitu Tobacco mosaic virus (TMV). Usaha pengendalian penyakit yang mulai dikembangkan dan relatif aman terhadap lingkungan yaitu penggunaan bakteri perakaran pemacu pertumbuhan (Plant Growth- promoting Rhizobacteria (PGPR).
Penelitian ini bertujuan untuk mengetahui pengaruh
flu cens dan B. polymixa dalam pengendalian penyakit mosaik tembakau
(Tobacco mosaic virus) pada tanaman cabai. Penelitian dilaksanakan di Laborat
Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor sejak bulan September 2006 sampai Desember 2006. Tahapan penelitian ini terdiri dari: pembuatan suspensi bakteri,perendaman benih dalam suspensi bakteri konsentrasi 109 cfu, penanaman dan penyiraman bakteri ke tanaman uji dengan kepadatan 108/g media tanam, dan inokulasi virus. Pengamatan yang dilakukan yaitu tinggi tanaman, panjang dan lebar daun, jumlah bunga, dan produksi buah cabai serta pengamatan masa inkubasi, kejadian penyakit, dan keparahan penyakit. Deteksi virus dilakukan dengan metode ELISA.
P
dari 8 perlakuan. Setiap perlakuan terdiri dari 4 ulangan dan masing-masing ulangan terdiri dari 3 tanaman. Data variabel pengamatan yang didapat dianalisis dengan melalui Analisys of Variance (ANOVA) yang dilanjutkan dengan uji Duncan pada taraf nyata 5% (ά = 0,05).
Periode inkubasi terlama terjadi p
PEMANFAATAN BAKTERI PERAKARAN PEMACU
PERTUMBUHAN TANAMAN (PLANT GROWTH-
PROMOTING RHIZOBACTERIA) UNTUK
MENGENDALIKAN PENYAKIT MOSAIK
TEMBAKAU (TOBACCO MOSAIC VIRUS)
PADA TANAMAN CABAI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian
TAHLIYATIN WARDANAH A44102021
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
Institut Pertanian BogorFAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : PEMANFAATAN BAKTERI PERAKARAN PEMACU PERTUMBUHAN TANAMAN (PLANT
GROWTH-Nama : NRP :
jui,
Pembimbing I
Dr. Ir. Gede Suastika, MSc.
PROMOTING RHIZOBACTERIA) UNTUK MENGENDALIKAN PENYAKIT MOSAIK TEMBAKAU
(TOBACCO MOSAIC VIRUS) PADA TANAMAN CABAI Tahliyatin Wardanah
A44102021
Menyetu
NIP. 131 669 946
Pembimbing II
Dr. Ir. Wi odo, MS.d NIP. 131 476 605
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. H. Supiandi Sabiham, M. Agr.
NIP. 130 422 698
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT, berkat rahmat dan arunia-Nya lah penulis dapat menyelesaikan tugas akhir dengan judul Peman
emberikan arahan
2.
berada tingkat pertama hingga
4.
kungan , perhatian, dan doanya kepada penulis.
partemen Proteksi Tanaman yang telah membantu penulis dalam
8.
ita, Hari, Zul, Arif, AA Hendra, dan teman-teman di Laboratorium
9.
10. ersamaannya selama ini yang
yang tidak dapat penulis sebutkan satu-persatu. Semoga apa yang telah diberikan
i perbaikan selanju
Bogor, Januari 2007
Tahliyatin Wardanah k
faatan Rizobakteri Pemacu Pertumbuhan Tanaman (Plant Growth-promoting Rhizobacteria) untuk Mengendalikan Penyakit Mosaik Tembakau (Tobacco mosaic virus) pada Tanaman Cabai. Pada kesempatan ini penulis juga ingin mengucapkan terima kasih kepada :
1. Bapak Dr. Ir. Gede Suastika, MSc. sebagai dosen pembimbing I dan Dr. Ir. Widodo, MS. sebagai dosen pembimbing II yang telah m
dan bimbingan kepada penulis dalam menyelesaikan tugas akhir ini.
Dr. Ir. Dadan Hindayana selaku Penguji Tamu yang telah memberikan banyak masukan dalam penyusunan tugas akhir ini.
3. Prof. Dr. Ir. Aunu Rauf, MSc. selaku Pembimbing Akademik yang telah memberikan bimbingannya selama penulis
terakhir.
Bapak dan Ibu serta kakak-kakak dan adik-adik yang telah memberikan kasih sayang, du
5. Madun atas segala perhatian, bantuan, pengertian, dan kesabarannya kepada penulis. Juga kepada teman-temannya.
6. Reyna atas kerjasamanya dalam penelitian dan waktunya dalam suka dan duka.
7. Pak Edi, Pak Dadang, Pak Saefudin, Pak Agus, Pak Sodik, dan semua laboran di De
penelitian.
Mbak Ita, Mbak Dini, Mbak Tuti, Mbak Latifah, Mas Reno, Pak Ray, Ella, Widia Pusp
Virologi dan Mikologi atas segala bantuannya.
Widiandini, Mbak Yaxy, dan Iyuz atas kebersamaannya dalam suka dan duka Teman-teman seperjuangan HPT 39 atas keb
telah memberikan banyak kenangan.
Serta semua pihak yang telah membantu dalam mengerjakan penelitian ini
kepada penulis menjadi amal kebaikan yang dicatat oleh Allah SWT.
Penulis menyadari bahwa masih banyak kekurangan dan kelemahan dalam penulisan skripsi ini, karena itu saran dan kritik yang membangun dem
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo Jawa Tengah pada tanggal 2 Desember 1984 dari ayah Ali Asnawi dan ibu Mishriyah. Penulis merupakan putri keenam dari sep
d Surakarta (1996-1999), kemudian penulis melanjutkan ke Sek
ama dan Penyakit Tanaman Hortikultura, Hama dan Penyak
uluh bersaudara.
Pendidikan formal yang penulis ikuti adalah SD Negeri Klumprit (1990-1996), SLTP Al-Muayya
olah Menengah Umum di SMU Al-Muayyad Surakarta dan lulus pada tahun 2002. pada tahun yang sama penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjalani pendidikan di IPB, tahun akademik 2005/2006 penulis menjadi asisten mata kuliah H
DAFTAR ISI
Halaman D
... 1
TI
... 4
BA
...
HA
V ... 16 AFTAR TABEL ... ix DAFTAR GAMBAR ... DAFTAR LAMPIRAN ...
x xi PENDAHULUAN
Latar Belakang
Tujuan ... Manfaat ...
3 3
NJAUAN PUSTAKA Cabai Merah ...
Karakteristik Tobacco mosaic virus (TMV) ... Penyebaran dan Sebaran Inang TMV ... Kemaknaan TMV pada Tanaman cabai ... Kemaknaan Rizobakteri Pemacu Pertumbuhan Tanaman ... Bacillus spp. dan Pseudomonas spp. sebagai Agens Hayati Pengendalian Virus Tanaman ...
5 6 7 8
9
HAN DAN METODE Tempat dan Waktu ...
Bahan ... Metode ... Pembuatan Suspensi Bakteri ………... Perlakuan Benih, Penanaman dan Penyiraman Bakteri Tanaman Uji ... Inokulasi Virus pada Tanaman Uji ………... Pengamatan Pertumbuhan dan Produksi Tanaman ... Pengamatan Masa Inkubasi, Kejadian Penyakit, dan Keparahan Penyakit ... Deteksi Virus dengan Metode ELISA ... Rancangan Percobaan …... Analisa Data …...
11 11 11 11 11 12 12 13 14 14 14
SIL DAN PEMBAHASAN Gejala Tanaman Terinfeksi TM
Pengaruh Rizobakteri dan Infeksi TMV terhadap Pertumbuhan dan Produksi Tanaman Cabai ...
Pengaruh terhadap Tinggi Tanaman ... Pengaruh terhadap Panjang Daun dan Lebar Daun ... 1
KE
... 0
DA
Pengaruh terhadap Jumlah Bunga ... Pengaruh terhadap Produksi Buah Cabai ...
19
19 2 24 26
SIMPULAN DAN SARAN Kesimpulan ...
Saran ... 3 30
FTAR PUSTAKA ………. 31
DAFTAR TABEL
Halaman Nomor ks
………... 17 Te
1 Pengaruh Perlakuan Bakteri terhadap Penyakit, dan Keparahan Penyakit ………
DAFTAR GAMBAR
Halaman Teks
oleh TMV (B) ……….. 16
2
olymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
20
3
G01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran),
22
4
. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
23
5
olymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
25
6
uorescens (PG01), B. polymixa (BG25), P. fluorescens + B. polymixa Nomor
1 Tanaman cabai sehat (A) dan tanaman dan daun melengkung yang disebabkan
cabai sakit dengan gejala mosaik
Tinggi tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B. p
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Panjang daun tanaman cabai yang diberi perlakuan P. fluorescens (P
kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Lebar daun tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Jumlah bunga cabai yang diberi perlakuan P. fluorescens (PG01), B. p
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ……...
Bobot dan jumlah buah per tanaman cabai yang diberi perlakuan P. fl
(campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada
PEMANFAATAN BAKTERI PERAKARAN PEMACU
PERTUMBUHAN TANAMAN (PLANT GROWTH-
PROMOTING RHIZOBACTERIA) UNTUK
MENGENDALIKAN PENYAKIT MOSAIK
TEMBAKAU (TOBACCO MOSAIC VIRUS)
PADA TANAMAN CABAI
TAHLIYATIN WARDANAH
A44102021
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
ABSTRAK
TAHLIYATIN WARDANAH. Pemanfaatan Rizobakteri Pemacu Pertumbuhan
L.) merupakan salah satu mod
penggunaan P. ores
orium Mikologi Tumbuhan dan
ercobaan disusun dalam rancangan acak lengkap. Unit perlakuan terdiri
ada perlakuan campuran kedua bakteri
tembakau pada tanaman cabai.
Tanaman (Plant Growth-promoting Rhizobacteria) untuk Mengendalikan Penyakit Mosaik Tembakau (Tobacco mosaic virus) pada Tanaman Cabai. Dibimbing oleh GEDE SUASTIKA dan WIDODO.
Tanaman cabai merah (Capsicum annuum
ko itas penting hortikultura di Indonesia yang banyak digemari oleh masyarakat. Virus merupakan salah satu penyebab penyakit penting pada tanaman cabai. Salah satu virus yang menyerang tanaman cabai yaitu Tobacco mosaic virus (TMV). Usaha pengendalian penyakit yang mulai dikembangkan dan relatif aman terhadap lingkungan yaitu penggunaan bakteri perakaran pemacu pertumbuhan (Plant Growth- promoting Rhizobacteria (PGPR).
Penelitian ini bertujuan untuk mengetahui pengaruh
flu cens dan B. polymixa dalam pengendalian penyakit mosaik tembakau
(Tobacco mosaic virus) pada tanaman cabai. Penelitian dilaksanakan di Laborat
Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor sejak bulan September 2006 sampai Desember 2006. Tahapan penelitian ini terdiri dari: pembuatan suspensi bakteri,perendaman benih dalam suspensi bakteri konsentrasi 109 cfu, penanaman dan penyiraman bakteri ke tanaman uji dengan kepadatan 108/g media tanam, dan inokulasi virus. Pengamatan yang dilakukan yaitu tinggi tanaman, panjang dan lebar daun, jumlah bunga, dan produksi buah cabai serta pengamatan masa inkubasi, kejadian penyakit, dan keparahan penyakit. Deteksi virus dilakukan dengan metode ELISA.
P
dari 8 perlakuan. Setiap perlakuan terdiri dari 4 ulangan dan masing-masing ulangan terdiri dari 3 tanaman. Data variabel pengamatan yang didapat dianalisis dengan melalui Analisys of Variance (ANOVA) yang dilanjutkan dengan uji Duncan pada taraf nyata 5% (ά = 0,05).
Periode inkubasi terlama terjadi p
PEMANFAATAN BAKTERI PERAKARAN PEMACU
PERTUMBUHAN TANAMAN (PLANT GROWTH-
PROMOTING RHIZOBACTERIA) UNTUK
MENGENDALIKAN PENYAKIT MOSAIK
TEMBAKAU (TOBACCO MOSAIC VIRUS)
PADA TANAMAN CABAI
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian
TAHLIYATIN WARDANAH A44102021
PROGRAM STUDI HAMA DAN PENYAKIT TUMBUHAN
Institut Pertanian BogorFAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul Skripsi : PEMANFAATAN BAKTERI PERAKARAN PEMACU PERTUMBUHAN TANAMAN (PLANT
GROWTH-Nama : NRP :
jui,
Pembimbing I
Dr. Ir. Gede Suastika, MSc.
PROMOTING RHIZOBACTERIA) UNTUK MENGENDALIKAN PENYAKIT MOSAIK TEMBAKAU
(TOBACCO MOSAIC VIRUS) PADA TANAMAN CABAI Tahliyatin Wardanah
A44102021
Menyetu
NIP. 131 669 946
Pembimbing II
Dr. Ir. Wi odo, MS.d NIP. 131 476 605
Mengetahui, Dekan Fakultas Pertanian
Prof. Dr. Ir. H. Supiandi Sabiham, M. Agr.
NIP. 130 422 698
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT, berkat rahmat dan arunia-Nya lah penulis dapat menyelesaikan tugas akhir dengan judul Peman
emberikan arahan
2.
berada tingkat pertama hingga
4.
kungan , perhatian, dan doanya kepada penulis.
partemen Proteksi Tanaman yang telah membantu penulis dalam
8.
ita, Hari, Zul, Arif, AA Hendra, dan teman-teman di Laboratorium
9.
10. ersamaannya selama ini yang
yang tidak dapat penulis sebutkan satu-persatu. Semoga apa yang telah diberikan
i perbaikan selanju
Bogor, Januari 2007
Tahliyatin Wardanah k
faatan Rizobakteri Pemacu Pertumbuhan Tanaman (Plant Growth-promoting Rhizobacteria) untuk Mengendalikan Penyakit Mosaik Tembakau (Tobacco mosaic virus) pada Tanaman Cabai. Pada kesempatan ini penulis juga ingin mengucapkan terima kasih kepada :
1. Bapak Dr. Ir. Gede Suastika, MSc. sebagai dosen pembimbing I dan Dr. Ir. Widodo, MS. sebagai dosen pembimbing II yang telah m
dan bimbingan kepada penulis dalam menyelesaikan tugas akhir ini.
Dr. Ir. Dadan Hindayana selaku Penguji Tamu yang telah memberikan banyak masukan dalam penyusunan tugas akhir ini.
3. Prof. Dr. Ir. Aunu Rauf, MSc. selaku Pembimbing Akademik yang telah memberikan bimbingannya selama penulis
terakhir.
Bapak dan Ibu serta kakak-kakak dan adik-adik yang telah memberikan kasih sayang, du
5. Madun atas segala perhatian, bantuan, pengertian, dan kesabarannya kepada penulis. Juga kepada teman-temannya.
6. Reyna atas kerjasamanya dalam penelitian dan waktunya dalam suka dan duka.
7. Pak Edi, Pak Dadang, Pak Saefudin, Pak Agus, Pak Sodik, dan semua laboran di De
penelitian.
Mbak Ita, Mbak Dini, Mbak Tuti, Mbak Latifah, Mas Reno, Pak Ray, Ella, Widia Pusp
Virologi dan Mikologi atas segala bantuannya.
Widiandini, Mbak Yaxy, dan Iyuz atas kebersamaannya dalam suka dan duka Teman-teman seperjuangan HPT 39 atas keb
telah memberikan banyak kenangan.
Serta semua pihak yang telah membantu dalam mengerjakan penelitian ini
kepada penulis menjadi amal kebaikan yang dicatat oleh Allah SWT.
Penulis menyadari bahwa masih banyak kekurangan dan kelemahan dalam penulisan skripsi ini, karena itu saran dan kritik yang membangun dem
RIWAYAT HIDUP
Penulis dilahirkan di Sukoharjo Jawa Tengah pada tanggal 2 Desember 1984 dari ayah Ali Asnawi dan ibu Mishriyah. Penulis merupakan putri keenam dari sep
d Surakarta (1996-1999), kemudian penulis melanjutkan ke Sek
ama dan Penyakit Tanaman Hortikultura, Hama dan Penyak
uluh bersaudara.
Pendidikan formal yang penulis ikuti adalah SD Negeri Klumprit (1990-1996), SLTP Al-Muayya
olah Menengah Umum di SMU Al-Muayyad Surakarta dan lulus pada tahun 2002. pada tahun yang sama penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama menjalani pendidikan di IPB, tahun akademik 2005/2006 penulis menjadi asisten mata kuliah H
DAFTAR ISI
Halaman D
... 1
TI
... 4
BA
...
HA
V ... 16 AFTAR TABEL ... ix DAFTAR GAMBAR ... DAFTAR LAMPIRAN ...
x xi PENDAHULUAN
Latar Belakang
Tujuan ... Manfaat ...
3 3
NJAUAN PUSTAKA Cabai Merah ...
Karakteristik Tobacco mosaic virus (TMV) ... Penyebaran dan Sebaran Inang TMV ... Kemaknaan TMV pada Tanaman cabai ... Kemaknaan Rizobakteri Pemacu Pertumbuhan Tanaman ... Bacillus spp. dan Pseudomonas spp. sebagai Agens Hayati Pengendalian Virus Tanaman ...
5 6 7 8
9
HAN DAN METODE Tempat dan Waktu ...
Bahan ... Metode ... Pembuatan Suspensi Bakteri ………... Perlakuan Benih, Penanaman dan Penyiraman Bakteri Tanaman Uji ... Inokulasi Virus pada Tanaman Uji ………... Pengamatan Pertumbuhan dan Produksi Tanaman ... Pengamatan Masa Inkubasi, Kejadian Penyakit, dan Keparahan Penyakit ... Deteksi Virus dengan Metode ELISA ... Rancangan Percobaan …... Analisa Data …...
11 11 11 11 11 12 12 13 14 14 14
SIL DAN PEMBAHASAN Gejala Tanaman Terinfeksi TM
Pengaruh Rizobakteri dan Infeksi TMV terhadap Pertumbuhan dan Produksi Tanaman Cabai ...
Pengaruh terhadap Tinggi Tanaman ... Pengaruh terhadap Panjang Daun dan Lebar Daun ... 1
KE
... 0
DA
Pengaruh terhadap Jumlah Bunga ... Pengaruh terhadap Produksi Buah Cabai ...
19
19 2 24 26
SIMPULAN DAN SARAN Kesimpulan ...
Saran ... 3 30
FTAR PUSTAKA ………. 31
DAFTAR TABEL
Halaman Nomor ks
………... 17 Te
1 Pengaruh Perlakuan Bakteri terhadap Penyakit, dan Keparahan Penyakit ………
DAFTAR GAMBAR
Halaman Teks
oleh TMV (B) ……….. 16
2
olymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
20
3
G01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran),
22
4
. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
23
5
olymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol
25
6
uorescens (PG01), B. polymixa (BG25), P. fluorescens + B. polymixa Nomor
1 Tanaman cabai sehat (A) dan tanaman dan daun melengkung yang disebabkan
cabai sakit dengan gejala mosaik
Tinggi tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B. p
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Panjang daun tanaman cabai yang diberi perlakuan P. fluorescens (P
kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Lebar daun tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ………
Jumlah bunga cabai yang diberi perlakuan P. fluorescens (PG01), B. p
(tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST ……...
Bobot dan jumlah buah per tanaman cabai yang diberi perlakuan P. fl
(campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada
DAFTAR LAMPIRAN
Nomor Teks
ngaruh antara perlaku
man, lebar daun, panjang daun, 34 2
34 Halaman
1 Tabel pengaruh perlakuan bakteri dan pe dan inokulasi virus terhadap tinggi tana
an bakteri
PENDAHULUAN
Latar Belakang
Tanaman cabai merah (Capsicum annuum L.) merupakan salah satu komoditas penting hortikultura di Indonesia yang banyak digemari oleh
asyarakat. Menurut data Direktorat Je
atu komoditas
al. Hal ini disebabkan
m ndral Bina Produksi Hortikultura luas
panen cabai merupakan luas panen terbesar diantara tanaman sayuran lainnya yaitu berturut-turut 150.598 ha pada tahun 2002 dan 176.264 ha pada tahun 2003 serta meningkat menjadi 194.588 ha pada tahun 2004. tanaman tersebut ditanam di seluruh provinsi di Indonesia dan memiliki nilai ekonomi yang cukup baik sehingga mendapat prioritas untuk dikembangkan (Deptan 2005).
Berbagai manfaat cabai diantaranya sebagai bahan bumbu makanan,
antiseptik, dan bahan obat-obatan menjadikan cabai sebagai salah s
perdagangan sehingga produktivitasnya harus tetap dijaga. Produksi nasional cabai dari tahun 1999 sampai tahun 2001 mengalami penurunan, yaitu 1.007.726 ton pada tahun 1999, 279.668 ton pada tahun 2000, dan 580.464 ton pada tahun 2001. Namun produksi nasional mengalami peningkatan dari tahun 2002 sampai tahun 2004 yaitu dari 635.089 ton pada tahun 2002, 1.066.722 ton pada tahun 2003, dan 1.100.514 ton pada tahun 2004, sedangkan produktivitas pada tahun 2002 mencapai 42,17 kwintal/ha, 60,52 kwintal/ha pada tahun 2003, dan menurun menjadi 56,56 kwintal/ha pada tahun 2004. produktivitas ini masih sangat rendah apabila dibandingkan dengan potensi produksi yang dapat mencapai 10 ton/ha atau sekitar 0,5-1 kg/tanaman (Suwandi et al. 1989).
Peningkatan produksi dan luas lahan tidak mampu meningkatkan produktivitas nasional cabai di Indonesia secara optim
karena berkurangnya luas panen, cara bertani yang masih sangat tradisional, dan adanya gangguan hama dan penyakit (Ditlintan 2005). Penyakit yang umum terjadi pada tanaman cabai dapat disebabkan oleh bakteri, cendawan, nematoda, dan virus. Virus yang menyerang tanaman cabai diantaranya adalah Alfalfa mosaic virus (AMV), Andeon potato mottle virus –pepper strain (APMoV), Beat
curly top virus (BCTV), Tobacco leaf curl virus (TLCV) Chili vein mottle virus
Tomato spotted wilt virus (TSWV), dan Cucumber mosaic virus (CMV)
(Pernezny et al. 2005). ChiVMV, CMV, dan TMV merupakan virus utama yang menyerang tanaman cabai di Indonesia (Sastrosumarjo 2003, Ditlintan 2005). Kehilangan hasil yang disebabkan oleh infeksi virus sangat besar, yaitu mencapai 50-100% (Ong et al. 1980, Marte dan Wetter 1986). Infeksi TMV menunjukkan gejala mosaik sistemik baik ringan maupun berat pada daun tanaman. Serangan TMV yang sangat parah dapat menyebabkan mosaik parah disertai dengan deformasi daun hingga tanaman kerdil. Bahkan ada tanaman yang sama sekali tidak tumbuh dan pada akhirnya mati (Sutic et al. 1999, CABI 2003, Warintek Progressio 2005). Infeksi oleh TMV dapat menyebabkan kehilangan hasil dari 20,5% sampai 100% (Sutic et al. 1999).
Beberapa cara pengendalian terhadap penyakit yang disebabkan oleh virus (termasuk TMV) diantaranya dengan eradikasi gulma, menanam di daerah
n yaitu penggunaan bakteri perakaran pemacu pertumbuhan lant
sis virus (TNV) terisolasi, proteksi silang, penanaman bibit sehat, pembongkaran tanaman sakit, pengendalian vektor, dan penggunaan kultivar tahan (Walkey 1991). Penggunaan kultivar tahan dapat mengurangi kejadian penyakit di lapangan secara efektif, tetapi pengembangan varietas tanaman ini relatif lama dan dinilai tidak ekonomis (Hadidi et al. 1998). Disamping itu, munculnya strain baru dengan tingkat virulensi yang lebih tinggi menyebabkan efektivitas penggunaan varietas tahan ini
semakin menurun.
Usaha pengendalian penyakit yang mulai dikembangkan dan relatif aman terhadap lingkunga
(P Growth-promoting Rhizobacteria (PGPR)) (Kokalis et al. 2002). Usaha ini sering disebut dengan bakterisasi, yaitu perlakuan benih atau akar perkecambahan dengan suspensi bakteri sehingga dapat memperbaiki pertumbuhan tanaman (Baker 1974 dalam Widodo 993). Murphy et al. (2000) & Maurhofer et al. (1994) menyebutkan, beberapa tahun terakhir banyak dilaporkan keberhasilan pengendalian penyakit tanaman menggunakan PGPR. Genus rizobakteri yang banyak digunakan sebagai PGPR antara lain Bacillus polymixa, B. subtilis, dan Pseudomonas fluorescens (Murphy et al. 2000; Marwoso 2005).
pada tembakau (Maurhofer et al. 1994). P. aeroginosa strain 7 NSK untuk mengendalikan TMV pada tembakau (De Meyer et al. 1999), B. subtilis strain 937b dan B. pumilus strain SE34 untuk mengendalikan ToMV pada tomat (Murphy et al. 2000), dan B. pumilus strain INR7 mengendalikan CMV pada tomat (Murphy et al. 2003). Kombinasi P. fluorescens isolat PG01 dan B. polymixa isolat BG25 dilaporkan mampu menekan infeksi virus daun kecil kacang
panjang (Marwoso 2005). Pemanfaatan PGPR terutama dari genus P. fluorescens dan B. polymixa dalam pengendalian penyakit mosaik yang disebabkan oleh TMV pada tanaman cabai belum pernah dilakukan. Oleh sebab itu perlu dilakukan penelitian untuk mengetahui efektivitas PGPR dalam menekan penyakit mosaik tersebut.
Tujuan
Penelitian ini bertujuan untuk mengetahui pengaruh penggunaan P.
fluorescens dan B. polymixa dalam dalian penyakit mosaik tembakau
Penelitian ini bermanfat untuk memperoleh informasi tentang potensi
bakteri pemacu pertumbuhan dan produksi tanaman yang dapat digunakan sebagai pengen
(Tobacco mosaic virus) pada tanaman cabai.
Manfaat
alternatif pengendalian penyakit mosaik pada tanaman cabai.
TINJAUAN PUSTAKA
Cab
Cabai merah ivisi Spermatophyta
dan sub divisi Angiospermae. Tanam asuk tumbuhan dengan biji
tanaman perdu tegak atau semak (herba) dengan tinggi 0,5-1,5 m dan met
gan diameter 8-15 mm dan berwarna putih sampai ungu ai Merah (Capsicum annuum L.)
termasuk dalam dunia tumbuhan dari d an ini term
berkeping dua (kelas Dicotyledoneae) sub kelas Sympetalae, famili kentang-kentangan (Solanaceae) dan genus cabai-cabaian (Capsicum). Sebanyak lima spesies cabai sudah dibudidayakan secara umum, yaitu Capsicum annuum L., C. frutescens L., C. chinense Jacq., C. bacatum L., C. pubescens R.P., sedangkan sekitar 25 spesies lagi tumbuh secara liar (Purseglove et al. 1981, Sastrosumarjo 2003).
Tanaman cabai merah termasuk tanaman semusim dan digolongkan sebagai
dia er batang mencapai 1 cm dan memiliki perakaran tunggang yang kuat serta memiliki banyak akar samping. Batang tanaman cabai merah berkayu dan memiliki banyak cabang yang berwarna hijau sampai hijau coklat, sedangkan pada percabangannya terdapat noda berwarna keunguan. Pada batang yang masih muda terdapat bulu halus berwarna hijau muda (CABI 2003, Sastrosumarjo 2003). Menurut Nawaningsih dalam Aripin dan Lubis 2003 menyebutkan, diameter percabangan lebih kecil dari batang utama berkisar antara 0,5-1 cm, dan terdiri tangkai, tulang daun, dan helai daun. Panjang tangkai 2-5 cm berwarna hijau. Tangkai daun berkembang sekaligus sebagai ibu tulang daun, panjang daun 10-15 cm dengan lebar 4-5 cm.
Bunga cabai merah tumbuh pada percabangan dan ketiak daun. Mahkota bunga berbentuk roda den
lebah dan semut. Persentase persilangan alami ini berkisar antara 7,6% dan 36,8% dengan rata-rata 16,5% (Purseglove et al.1981, Greenleaf 1986).
Buah berbentuk kerucut memanjang dengan ujung yang runcing, ngga
abai membutuhkan media tanah, pasir, dan pupuk
Karakteristik Tobacco mosaic virus
Tobacco mosa grup Tobamovirus.
iliki ciri berbentuk batang dengan panjang 300 nm dan met
me ntung dan memiliki permukaan yang licin dan mengkilap. Ukuran, warna tingkat kepedasan, dan bentuk buah sangat bervariasi tergantung dari varietasnya. Buah cabai merah memiliki panjang 1-30 cm dengan diameter 0,8-20 mm. Buah yang masih muda berwarna hijau sampai keungu-unguan dan menjadi kuning ketika semakin tua dan menjadi berwarna merah ketika matang, walaupun ada beberapa jenis yang tetap berwarna hijau. Biji berbentuk bulat pipih dengan diameter sekitar 4 mm. Biji yang masih muda berwarna kuning dan setelah tua menjadi coklat (Martina 1999).
Pada pesemaian, benih c
kandang dengan perbandingan 1:1. Benih disebar dan ditutup dengan tanah tipis-tipis dan diberi naungan. Bibit dapat dipindahkan setelah berumur 21-35 hari, namun 5 hari sebelumnya diusahakan naungan dibuka untuk membiasakan bibit tersebut terkena sinar matahari. Pemupukan dapat dilakukan sebelum tanam yaitu menggunakan pupuk kandang. Pupuk yang digunakan setelah pindah tanaman adalah urea, ZA, KSP, dan KCl, yaitu 3,6,9 minggu setelah tanam. Pemasangan ajir dapat dilakukan setelah tinggi tanaman 30-50 cm, langsung diikat disamping
batang cabai. Pemeliharaan selanjutnya adalah menyiangi gulma (Martina 1999)
ic virus (TMV) termasuk ke dalam
TMV merupakan salah satu dari 14 spesies yang termasuk dalam genus Tobamovirus. Hubungan antar anggota kelompok virus dari genus tobamovirus
masih belum dapat ditetapkan secara pasti walaupun telah diteliti secara luas. Kebanyakan strain sering dimasukkan ke dalam jenis TMV, tetapi beberapa strain yang cukup berbeda dianggap sebagai virus yang berbeda oleh beberapa peneliti (Sutic et al. 1999).
TMV mem
helix. Asam nukleat TMV berbentuk untai tunggal RNA dan terdiri atas kurang lebih 6400 nukleotida. Untai RNA juga berbentuk helix sejajar dengan untai protein. Berat dari setiap partikel virus antara 3,9 x 107 dan 4 x 107 unit berat molekul.
TMV merupakan salah satu virus yang diketahui paling stabil terhadap
t yang hanya dapat hidup pada tanaman
Penyebaran dan Sebaran Inang TMV
TMV sudah ebaran inang TMV
panas, dan memiliki titik panas aktivasi hingga 93º C dalam cairan perasan tanaman. Virus pada daun yang terinfeksi, pada kondisi kering masih mampu menginfeksi walaupun telah dipanaskan sampai pada suhu 120º C selama 30 menit. TMV yang menginfeksi tanaman tembakau berisi 4 g virus per liter cairan perasan tanaman, dan virus masih infektif walaupun telah diencerkan hingga perbandingan 1:1.000.000. Virus menjadi tidak aktif setelah 4-6 minggu dalam cairan perasan biasa, tetapi pada cairan perasan virus yang bebas bakteri (steril) mungkin dapat bertahan hingga 5 tahun, dan TMV pada daun terinfeksi yang dikeringkan di laboratorium selama lebih dari 50 tahun masih infektif (Agrios 1997). Menurut Sutic et al. 1999, CABI 2003 menyebutkan pada tanaman yang terinfeksi, beberapa menit setelah virus menginfeksi jaringan tanaman, RNA mulai disintesis dan partikel baru berkembang dalam sitoplasma dan menyebar dari sel ke sel melalui plasmodesmata.
TMV merupakan parasit obliga
atau jaringan sel yang hidup. Virus ini menginfeksi tanaman melalui luka. Bagian tanaman yang rentan jika kontak dengan TMV akan segera terinfeksi. TMV dapat bertahan selama berbulan-bulan pada tanah bekas penanaman dan juga telah ditemukan di air dan didalam tanah di hutan. Sejumlah strain TMV pada tanaman obat-obatan telah diuraikan hampir diseluruuh dunia, dimana virus ini dapat dibedakan dari yang lainnya melalui reaksi inang, tetapi tidak pada tembakau (Sutic et al. 1999, CABI 2003)
tersebar luas hampir ke seluruh dunia. S
menunjukan gejala sistemik. Beberapa diantaranya hanya menunjukkan lesio nekrotik lokal pada titik infeksi (reaksi hipersensitif). Beberapa varietas yang menunjukkan reaksi hipersensitif yaitu tembakau, tomat, dan cabai (Sutic et al. 1999, CABI 2003).
Inang utama TMV ialah Nicotiana tabacum, Lycopersicon esculentum ill., C
Kemaknaan TMV pada Tanaman Cabai
Serangan T lkan gejala yang
i terhadap serangan TMV tergantung dari strain TMV M . annuum L., Solanum melongena L., Allium sativum L., Beta vulgaris L., Phaseolus vulgaris, Vigna unguiculata (L) Walp., Glycine max, Brassicaea,
Apium graveolens, Solanum tuberosum L.. Beberapa inang alternatif dari TMV
yaitu Rosa sinensis, Malus domestica Borkh., Helianthus annuus, Citrulus lanatus, dan Cucumis sativus L.. Anggota tobamovirus yang menginfeksi cabai
antara lain TMV, PMMV, TMGMV, dan ToMV (Sutic et al. 1999, CABI 2003).
MV pada tanaman cabai dapat menimbu
beragam. Gejala yang umum terlihat ialah gejala mosaik sistemik baik ringan maupun berat pada daun tanaman. Namun demikian beberapa gejala yang mungkin terlihat ialah bercak dan nekrotik. Hal ini terjadi pada varietas tertentu saja. Serangan TMV yang sangat parah dapat menyebabkan mosaik parah disertai dengan deformasi daun hingga tanaman kerdil. Bahkan ada tanaman yang sama
sekali tidak tumbuh dan pada akhirnya mati (Sutic et al. 1999, CABI 2003, Warintek Progressio 2005).
Reaksi tanaman caba
daun. Strain aucuba dari virus ini menyebabkan noda mosaik kuning terang pada daun (Sutic et al. 1999).
Produksi cabai akibat kerusakan yang disebabkan oleh TMV ditentukan oleh beberapa faktor seperti kerentanan kultivar, kelimpahan sumber infeksi, tahap perkembangan tanaman saat infeksi, dan keganasan dari strain yang ada di area tanaman. Pada kultivar Californian Wonder terjadi kehilangan hasil 60-80%. Pada kultivar Sorok Sari kehilangan hasil mencapai 78% walaupun kejadian penyakit mencapai 100%. Cairan perasan tanaman yang terinfeksi akan sangat infektif terutama pada konsentrasi tinggi dalam sel tanaman. Hal ini menjadi masalah yang sangat serius pada pertanaman cabai dan tomat karena adanya akumulasi TMV pada lahan yang berasal dari sisa tanaman yang terinfeksi. (Sutic et al. 1999).
Kemaknaan Rizobakteri Pemacu Pertumbuhan Tanaman
Sejak tahun 1970-an telah dilaporkan adanya kelompok bakteri yang secara khusus mengkoloni perakaran tanaman dan kemudian mulai diinokulasi sejak tahap awal penanaman (Liu et al. 1995). Dewasa ini kelompok bakteri tersebut dikenal dengan PGPR, yaitu kelompok bakteri yang dapat mengkoloni perakaran tanaman dan memiliki kemampuan untuk merangsang pertumbuhan
tanaman (Nelson 2004). Kemampuan PGPR sebagai agen pengendali hayati adalah karena kemampuannya untuk bersaing mendapatkan zat makanan atau karena hasil-hasil metabolit seperti siderofor, hydrogen sianida, antibiotik, atau enzim ekstraseluler yang bersifat antagonis melawan patogen (Liu et al. 1995).
Menurut Kesumadewi (1999), rizobakteria memungkinkan penyediaan unsur hara tertentu dari lingkungannya yaitu menambat N2 dan mensuplai ke tanaman. Rizobakteria juga mampu menghasilkan siderofor pyoverdine yang dapat melarutkan dan memisahkan besi dari tanah serta menyediakannya untuk tanaman. Genus bakteri pemacu pertumbuhan tanaman yang banyak diketahui sebagai pemacu pertumbuhan antara lain Pseudomonas sp., Bacillus sp., dan Rhizobium sp.
PGPR sebagai biocontrol berperan dengan mekanisme induced systemic resistance (ISR). Ramamoorthy et al. (2001) memaparkan bahwa mekanisme ISR
terjadi sebagai akibat perubahan fisiologi tanaman yang kemudian menstimulasi terbantuknya senyawa kimia yang berguna dalam pertahanan terhadap serangan patogen. Perubahan fisiologi tersebut dapat berupa modifikasi struktural dinding sel atau perubahan reaksi biokimia pada tanaman inang. Beberapa faktor yang dapat menyebabkan adanya induksi ketahanan sistemik oleh bakteri yaitu: 1) adanya sumbangan lipopolisakarida oleh bakteri; 2) produksi siderofor oleh bakteri; dan 3) produksi asam salisilat yang dapat terjadi secara langsung oleh bakteri ataupun secara tidak langsung (van Loon et al. 1998)
Keberadaan PGPR ini dalam tanaman juga dapat menekan kejadian penyakit seperti bercak daun bakteri pada ketimun (bacterial angular leaf spot)
(Liu et al. 1995), penyakit nekrosis tembakau (Maurhofer et al. 1994), dan penyakit akar gada Plasmodiophora brassicae (Widodo 1993).
Bacillus spp. Dan Pseudomonas spp. sebagai Agens Hayati Pengendalian Virus Tanaman
Virus yang menginfeksi tanaman umumnya dikendalikan dengan beberapa cara diantaranya dengan menanam tanaman yang tahan terhadap virus, pemberantasan gulma di sekitar tanaman, menanam tanaman di tempat yang agak jauh dari sumber infeksi, pengendalian vektor, serta perlindungan dan pengendalian dengan bakteri antagonis (Boss 1994)
Bacillus dan Pseudomonas sebagai kelompok PGPR merupakan genus
patogen secara langsung dengan mengeluarkan senyawa antibiotik dan induksi ketahanan sistemik pada tanaman.
Genus Pseudomonas adalah bakteri yang dapat ditemukan pada hampir semua media alami dan tahan terhadap senyawa yang bersifat menghambat pertumbuhan bakteri lain sehingga mudah diisolasi. Bakteri ini mampu mendominasi daerah rizosfer dan berkembang sangat cepat, bersifat gram negatif, motil, aerob/fakultatif anaerob (Pelczar & Chan 1986). Pseudomonas sp. banyak dilaporkan sebagai penghasil fitohormon dalam jumlah besar khususnya IAA. IAA merupakan hormon pertumbuhan kelompok auksin yang berguna untuk merangsang pertumbuhan tanaman. Auksin berfungsi untuk meningkatkan pertumbuhan sel batang, menghambat proses pengguguran daun, merangsang pembentukan buah, serta merangsang pertumbuhan kambium dan menghambat pertumbuhan tunas ketiak (Tjondronegoro et al. 1989). Pseudomonas sp. juga diketahui dapat memproduksi asam salisilat yang mampu mengendalikan TNV pada tembakau (Maurhofer et al. 1994).
Genus Bacillus merupakan kelompok bakteri yang sering diteliti untuk pengembangan secara komersial karena dapat menghasilkan endospora yang mampu bertahan dalam waktu lama dan toleran terhadap suhu dan pH ekstrim (Blackman et al. 1997 dalam Zehnder et al. 2000). Menurut Zehnder et al. (2000)
B. pumilis strain INR-7 dapat mengurangi gejala layu bakteri pada tanaman
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan di Laboratorium Mikologi Tumbuhan dan Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor sejak bulan September 2006 sampai Desember 2006.
Bahan
Bakteri yang digunakan dalam penelitian ini yaitu Pseudomonas fluorescens PG01, Bacillus polymixa BG25 yang merupakan koleksi Klinik
Tanaman Departemen Proteksi Tanaman. Bahan tanaman uji yang digunakan
adalah cabai besar (Capsicum annuum) varietas TIT Super LV yang didapat di toko pertanian. Sumber inokulum berasal dari koleksi Laboratorium Virologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, yaitu tanaman tembakau yang terinfeksi Tobacco mosaic virus (TMV).
Metode Pembuatan Suspensi Bakteri
Biakan murni bakteri yang berasal dari koleksi Klinik Tanaman diambil sebanyak 1 sampai 3 loop dari stok awal dan digoreskan pada media untuk diremajakan. Bakteri kelompok Pseudomonas sp. dibiakkan pada media King’s B dan bakteri kelompok Bacillus sp. dibiakkan pada media Tryctic Soy Agar (TSA). Bakteri yang telah diremajakan diinkubasikan pada suhu ruangan selama 48 jam. Sebanyak 15 loop biakan murni yang didapat diencerkan dalam 100 ml NaCl 0,85% sehingga didapat suspensi bakteri (stok) dengan kepadatan masing-masing kira-kira 1012 cfu/ml untuk Bacillus dan 1013 cfu/ml untuk Pseudomonas (Jamaliah 2005).
Perlakuan Benih, Penanaman dan penyiraman bakteri Tanaman Uji
Sebanyak 5 ml dari masing-masing suspensi bakteri dicampurkan sehingga didapat suspensi kombinasi kedua bakteri tersebut (campuran) dengan kepadatan yang sama. Benih cabai yang sebelumnya telah dicuci kemudian dimasukkan ke dalam suspensi bakteri (PG01, BG25, dan campuran) dan dibiarkan selama 10 jam pada suhu ruang. Sebagai kontrol, benih cabai direndam dalam 10 ml NaCl 0,85% selama 10 jam.
Benih yang telah direndam disebar pada baki semai yang berisi media tanam berupa campuran tanah dan pupuk kandang dengan perbandingan 1:2 (v/v). setelah berumur dua minggu setelah sebar dilakukan pemindahan tanaman ke dalam polybag dengan media yang sama pada pesemaian.
Satu minggu setelah tanaman berada di dalam polibag, dilakukan penyiraman suspensi bakteri dengan kepadatan 1011 cfu sebanyak 2 ml per polibag. Penyiraman dilakukan kembali satu minggu kemudian. Pemupukan dilakukan pada saat tanaman berumur lima minggu dengan pupuk majemuk NPK dengan dosis 5 g/polibag.
Inokulasi Virus pada Tanaman Uji
Inokulasi TMV secara mekanis dilakukan pada tanaman cabai yang telah berumur enam minggu. Daun tembakau yang terinfeksi TMV yang digunakan
sebagai sumber inokulum diambil secukupnya dan ditimbang, kemudian digerus dalam mortar dengan diberi bufer fosfat dengan perbandingan berat basah daun : buffer fosfat 1:200 (b/v). Dari hasil penggerusan ini didapat sap sebagai inokulum virus yang siap dioleskan ke tanaman cabai. Daun tanaman cabai yang akan diinokulasi sebelumnya ditaburi serbuk Carborumdum untuk menimbulkan luka pada jaringan tanaman. Setelah diinokulasi tanaman dipelihara sampai muncul gejala.
Pengamatan Pertumbuhan dan Produksi Tanaman
Pengamatan Masa Inkubasi, Kejadian Penyakit, dan Keparahan Penyakit Pengamatan masa inkubasi dimulai sejak tanaman cabai diinokulasi TMV sampai dengan gejala pertama muncul.
Pengukuran kejadian penyakit yang terjadi pada tanaman uji dihitung pada 4 minggu setelah inokulasi TMV (MSI TMV).
Penghitungan kejadian penyakit menggunakan rumus: KP = n/N x 100%
Keterangan :
KP = Kejadian penyakit (%)
N = jumlah tanaman yang terinfeksi virus N = jumlah seluruh tanaman
Pengamatan keparahan penyakit diukur pada 4 MSI TMV dengan mengukur seluruh bagian tanaman atas (tajuk tanaman) pada masing-masing tanaman uji. Kategori skor yang digunakan yaitu:
0 : tidak bergejala
2 : mosaik ringan pada daun 4 : mosaik berat pada daun
6 : perubahan bentuk daun dan mosaik 8 : mosaik parah dan perubahan bentuk daun
10 : mosaik parah dan deformasi daun disertai tanaman kerdil
Nilai skor yang didapat kemudian dikonversi dalam nilai keparahan penyakit (disease severity) berdasarkan rumus Townsend & Heuberger (1974 dalam Agrios 1997):
KP = [Σ nivi/NV] x 100% Keterangan:
KP = keparahan penyakit
ni = jumlah tanaman dengan skor ke-i vi = nilai skor penyakit
Deteksi Virus dengan Metode ELISA
Deteksi TMV dilakukan dengan metode direct ELISA. Antibodi TMV (Agdia, USA) yang diencerkan 1:1000 dalam coating bufer (Sodium carbonate 1,59 g, Sodium bicarbonate 2,93 g, Sodium azide 0,2 g) dimasukkan ke dalam sumuran plate sebanyak 100 l dan diinkubasikan pada 4ο C salama semalam, keesokan harinya sumuran plate dibilas 4-8 kali dengan bufer PBST (Sodium chloride 8 g, Sodium phosphate 1,15 g, Potassium phosphate 0,2 g, Potassium chloride 0,2 g, tween-20 0,5 g). Daun sebanyak 0,05 g digerus bersama dengan 500 l bufer GEB (Sodium sulfite 1,3 g, Polyvinylpyrrolidone 20 g, Sodium azide 0,2 g, Powdered egg chicken albumin 2 g, tween-20 20 g). Sap tanaman yang dihasilkan diambil sebanyak 100 l, kemudian dimasukkan ke dalam sumuran plate, selanjutnya diinkubasikan pada suhu ruang selama 2 jam. Kemudian sap dibuang dan sumuran plate dibilas 4-8 kali dengan bufer PBST. Enzim konjugat (Agdia, USA) yang diencerkan 1:1000 dalam bufer ECI (Bovine serum albumin 2 g, Polyvinylpyrrolidone 20 g, Sodium azide 0,2 g) dimasukkan ke dalam sumuran plate sebanyak 100 l dan diinkubasikan selama 2 jam pada suhu ruang, kemudian dibilas kembali dengan PBST 4-8 kali.
Deteksi hasil uji ini menggunakan p-nitrophenyl phosphate/PNP yang dilarutkan dalam bufer PNP (Magnesium chloride 0,1 g, Sodium azide 0,2 g,
Diethanolamine 97 ml) sebanyak 100 l yang dimasukkan ke dalam sumuran plate dan diinkubasikan selama 30-60 menit. Reaksi dihentikan dengan menambahkan 50 l Natrium hidroksida 3 M. Perubahan warna cairan dalam sumuran yang menjadi kuning menunjukkan reaksi positif. Analisis secara kuantitatif dilakukan dengan mengukur nilai absorban dengan ELISA plate reader. Reaksi dinyatakan positif terinfeksi TMV apabila nilai absorban ( 405 nm) tanaman uji lebih tinggi dari nilai absorbansi rata-rata tanaman kontrol ditambah dua kali nilai standar deviasinya.
Rancangan Percobaan
campuran+TMV, kontrol (tanpa perlakuan rizobakteri) +TMV. Setiap perlakuan terdiri dari 4 ulangan dan masing-masing ulangan terdiri dari 3 tanaman.
Analisis Data
HASIL DAN PEMBAHASAN
Gejala Tanaman Terinfeksi TMV
Tanaman uji yang terinfeksi TMV memperlihatkan gejala yang sangat jelas, yaitu pertumbuhan tanaman yang relatif lebih kerdil dari tanaman sehat. Daun menjadi belang hijau tua dan hijau muda (mosaik). Ukuran daun relatif lebih kecil daripada daun yang sehat dan sepanjang tulang daun terdapat jaringan yang menguning atau hijau gelap atau tulang daun menonjol dan berkelok-kelok dengan pinggiran daun yang bergelombang. Daun menjadi melengkung ke permukaan atas daun. Daging daun kadang-kadang tidak tumbuh sempurna, sehingga yang tumbuh hanya tulang-tulang daunnya saja (Gambar 1).
A B
[image:37.595.116.512.330.586.2]man cabai sehat (A) dan tanaman caba dengan gejala
Gambar 1 Tana i sakit
Pengaruh Perlakuan Rizobakteri terhadap Masa Inkubasi, Kejadian
Secara umum, tanaman yang diberi perlakuan bakteri menunjukkan masa inkuba
rhadap Masa Inkubasi, Kejadian Penyakit,
Perlaku
Absorbansi
sa Inkubasi Kejadian Penyakit (%)
Keparahan
Pe b)
Penyakit, dan Keparahan Penyakit
[image:38.595.113.513.330.419.2]si yang lebih lama dibanding tanaman kontrol. Hal ini menunjukkan adanya kemampuan bakteri dalam memperlambat perkembangan TMV atau menunda pemunculan gejala awal sehingga ekspresi gejala yang muncul lebih lama dari tanaman tanpa perlakuan bakteri. Perlakuan bakteri pada tanaman cabai tidak mempengaruhi terhadap tingkat kejadian penyakit tetapi mempengaruhi keparahan penyakit mosaik (Tabel 1).
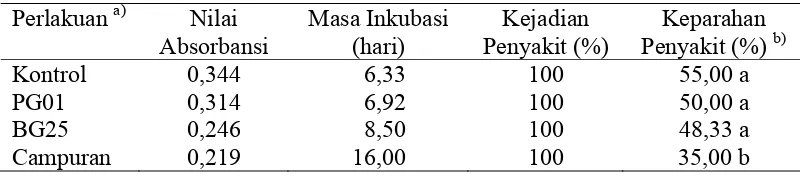
Tabel 1 Pengaruh Perlakuan Bakteri te dan Keparahan Penyakit an a) Nilai Ma
(hari) nyakit (%)
Kontrol 0,344 6,33 100 55,00 a
PG01 0,314 6,92 100 50,00 a
BG25 0,246 8,50 100 48,33 a
Campuran 0,219 16,00 100 35,00 b
a
tanpa PG01= P. fluorescens; BG2 . polymixa ran
tanaman yang diinokulasi dengan
Kejadian penyakit oleh TMV ditunjukkan pada tabel 1. Semua perlakuan ember
)
Kontrol = bakteri; 5= B ; Campu
= P.fluorescens+B. polymixa yang diinokulasi TMV
b)
Angka yang diikuti dengan huruf yang sama dalam satu kolom tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
Waktu munculnya gejala pertama pada
TMV adalah berbeda-beda dari semua perlakuan (Tabel 1). Rataan masa inkubasi
TMV tercepat adalah 6,33 hari setelah inokulasi, yaitu pada kontrol, setelah itu pada perlakuan P. fluorescens, yaitu 6,92 hari. Sedangkan untuk perlakuan B. polymixa rataan masa inkubasinya adalah 8,50 hari. Masa inkubasi TMV terlama
pada perlakuan campuran, yaitu 16 hari. Tanaman cabai yang diberi perlakuan campuran kedua bakteri P. fluorescens dan B. polymixa dapat menunda terhadap pemunculan gejala infeksi TMV sehingga masa inkubasi TMV menjadi lebih lama.
sehingga tanaman yang diinokulasi TMV tetap menunjukkan gejala penyakit dan tanaman tetap dapat tumbuh. Namun demikian, tanaman yang diberi perlakuan bakteri mempunyai vigor tanaman yang lebih baik (walaupun tanaman menunjukkan gejala) daripada tanaman yang tidak diberi bakteri atau tanaman kontrol.
Tanaman dengan perlakuan campuran kedua bakteri menunjukkan
penyakit yang paling rendah dengan gejala yang paling ringan.
perbedaan tingkat keparahan penyakit yang signifikan dibandingkan dengan kontrol dan dua perlakuan bakteri yang lain (Tabel 1). Tidak ada perbedaan yang nyata pada dua perlakuan bakteri terhadap perlakuan kontrol . Hal ini memberi arti bahwa pemberian campuran kedua bakteri PGPR dapat menurunkan tingkat keparahan penyakit mosaik pada tanaman cabai yang disebabkan oleh TMV. Sedangkan perlakuan individu bakteri (P. fluorescens saja atau B. polymixa saja) belum mampu menurunkan keparahan penyakit mosaik pada tanaman cabai. Laporan Leeman et al. (1995) mengatakan bahwa keparahan penyakit pada tanaman dengan perlakuan bakteri akan lebih rendah (gejala lebih ringan) dibandingkan dengan kontrol. Selain itu, tanaman yang diinokulasi PGPR memiliki kemungkinan untuk sembuh dari penyakit (recovery) (Kloepper et al. 2004). Jika keparahan penyakit dihubungkan dengan masa inkubasi, perlakuan campuran menunjukkan masa inkubasi terlama dan keparahan penyakit yang
Pengaruh Rizobakteri dan Infeksi TMV terhadap Pertumbuhan dan Produksi Tanaman Cabai
Pengaruh terhadap Tingg
PGPR mampu meningkatkan pertumbuhan tanaman secara langsung ang dihasilkan seperti Giberelin (Gac) dan ole
a penghambat rtum
rbedaan yang nyata dengan i Tanaman
melalui hormon-hormon pertumbuhan y
ind 3-acetic acid (IAA). Disamping itu PGPR juga mampu mensintesis sitokinin dan beberapa fitohormon lain (Nelson 2004). Oleh karena itu, umumnya tanaman yang diberi perlakuan PGPR mampu tumbuh lebih baik.
Sedangkan tanaman yang terinfeksi virus akan terjadi penurunan zat pengatur tumbuh (hormon) dan peningkatan kadar senyaw
pe buhan (Agrios 1997). TMV yang menginfeksi tanaman cabai dapat menghambat pertumbuhan tinggi tanaman sampai mengakibatkan tanaman kerdil (Semangun 2000). Menurut Ramamoorthy et al. (2001) PGPR akan menghasilkan induksi ketahanan sistemik sehingga mampu membentuk senyawa kimia yang berguna dalam pertahanan terhadap serangan patogen.
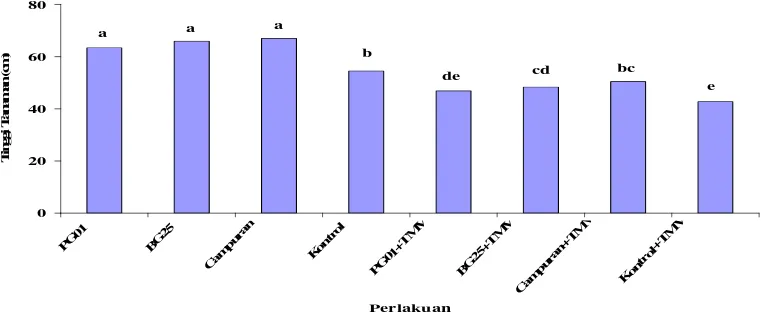
Gambar 2 menunjukkan bahwa pada umur 8 MST semua perlakuan pada tanaman yang diinokulasi bakteri saja menunjukkan pe
kontrol. Hal ini mengindikasikan bahwa bakteri mampu meningkatkan
0 20 40 60 80 PG 01 BG 25 Cam
pura
n Kon trol PG 01+ TM V BG 25+ TM V Cam
pura
n+T
MV Kon trol +T MV Perlakuan T in ggi T an am an ( c m )
a a a
b
de cd bc
[image:41.595.123.506.92.248.2]e
Gambar 2 Tinggi tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST
Huruf yang sama pada minggu yang sama tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
Pada 8 MST juga menunjukkan bahwa B. polymixa dan campuran menunjukkan perbedaan yang nyata terhadap pertumbuhan tinggi tanaman dibandingkan dengan kontrol. Perbedaan tinggi tanaman dengan kontrol yang
diinokulasi virus ini mengindikasikan bahwa pemberian perlakuan B. polymixa dan campuran ini sangat mempengaruhi pertumbuhan tinggi tanaman dimana bakteri mampu mengadakan induksi ketahanan sistemik, sehingga tanaman masih mampu meningkatkan tingginya walaupun ada infeksi TMV. Sedangkan perlakuan P. fluorescens tidak ada perbedaan yang nyata terhadap kontrol. Hal ini memberi arti bahwa tidak ada pengaruh terhadap pemberian P. fluorescens pada tanaman cabai yang terinfeksi TMV sehingga pertambahan panjang daun tidak berbeda dengan tanaman yang terinfeksi TMV saja.
1). Hal ini memberi arti bahwa tanaman yang tidak diberi bakteri dan tidak ada infeksi TMV (kontrol sehat) akan seiring pertumbuhannya dengan tanaman yang diberi campuran kedua bakteri dan ada infeksi TMV. Adanya campuran kedua bakteri pada tanaman yang terinfeksi TMV dapat mengkompensasi tanaman dari infeksi TMV sehingga pertumbuhan tinggi tanaman akan lebih baik atau keadaannya akan sama dengan tanaman yang sehat.
Pengaruh terhadap Panjang Daun dan Lebar Daun
PGPR dalam mempengaruhi pertambahan panjang daun ditunjukkan oleh B. polymixa yang dapat merangsang pembentukan hormon sitokinin. Timmusk et
al. (1999) melaporkan bahwa Bacillus sp. dapat menghasilkan hormon kelompok
sitokinin. Sitokinin dapat memacu pembelahan sel, mendorong diferensisi tajuk pada kultur jaringan, mendorong pertumbuhan tunas samping dan perluasan daun, perkembangan kloroplas, menunda penuaan daun, dan bersama IAA yang dihasilkan oleh P. fluorescens sitokinin dapat merangsang pembelahan sel secara cepat (Tjondronegoro et al. 1989).
Ukuran daun yang meliputi panjang daun dan lebar daun merupakan parameter yang penting terhadap adanya infeksi TMV. Tanaman yang terinfeksi TMV akan menimbulkan gejala pada daun yaitu ukuran daun menjadi berkurang
dari semestinya sejak adanya infeksi TMV. Dengan adanya PGPR dapat membantu daun tetap mempertahankan ukuran daunnya dengan senyawa-senyawa yang dihasilkan oleh bakteri.
signifikan antara ketiga perlakuan yang mengartikan bahwa kemampuan bakteri dalam merangsang pertumbuhan panjang daun adalah sama.
0 4 8 12 16 PG 01 BG 25 Cam pura
n Kon trol PG 01+ TM V BG 25+ TM V Cam pu ran +T MV Kon trol +T MV Perlakuan P a nj a ng D a un (c m )
a a a
b
c c
b
[image:43.595.123.504.158.323.2]d
Gambar 3 Panjang daun tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST
Huruf yang sama pada minggu yang sama tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
Peningkatan panjang daun pada tanaman yang terinfeksi TMV juga mengalami hal yang sama, yaitu semua perlakuan mengalami perbedaan yang nyata terhadap panjang daun dibandingkan dengan kontrol. Akan tetapi perlakuan campuran yang menunjukkan hasil yang paling baik dalam menekan infeksi TMV sehingga pertumbuhan panjang daun lebih meningkat dibandingkan dengan tanaman kontrol yang tidak diberi perlakuan bakteri.
infeksi TMV. Dalam hal ini adanya campuran dua bakteri dapat mengkompensasi tanaman dari infeksi TMV sehingga keadaannya akan sama dengan tanaman yang sehat yang tidak diberi apa-apa.
Gambar 4 menunjukkan bahwa pada 8 MST terdapat perbedaan yang nyata pada ketiga perlakuan terhadap kontrol. Perlakuan campuran juga menunjukkan pengaruh yang signifikan terhadap perlakuan P. fluorescens. Hal ini menunjukkan bahwa ketiga perlakuan bakteri mampu meningkatkan pertambahan lebar daun dan perlakuan campuran paling baik dalam meningkatkan pertambahan lebar daun. Hal ini sesuai menurut Timmusk et al. (1999) bahwa B. polymixa dapat menghasilkan hormon sitokinin yang dapat merangsang perluasan daun dan apabila bersama IAA yang dihasilkan oleh P. fluorescens akan meningkatkan pembelahan sel secara cepat Hal ini juga mengindikasikan bahwa dengan adanya perlakuan bakteri pada tanaman cabai, maka pertumbuhan lebar daun menjadi lebih meningkat. 0 1 2 3 4 5 6 PG 01 BG 25 Cam pura
n Kon trol PG 01+ TM V BG 25+ TM V Cam pura
[image:44.595.122.503.401.567.2]n+T MV Kon trol +T MV Perlakuan L e ba r D a un ( cm ) b ab a c de cd c e
Gambar 4 Lebar daun tanaman cabai yang diberi perlakuan P. fluorescens (PG01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST
Huruf yang sama pada minggu yang sama tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
Perlakuan pada tanaman dengan inokulasi TMV menunjukkan bahwa
campuran yaitu 4,50 cm (Lampiran 1). Kedua perlakuan ini memperlihatkan adanya kemampuan bakteri dalam menekan infeksi TMV secara tidak langsung, yaitu dengan menginduksi ketahanan tanaman sehingga tanaman menjadi vigor yang akan mempengaruhi ukuran daun. Ukuran daun akan menjadi lebih baik daripada kontrol. P. fluorescens tidak memberikan pengaruh sama sekali terhadap peningkatan lebar daun. Hal ini ditunjukkan dengan tidak adanya perbedaan yang signifikan dari nilai lebar daun terhadap kontrol tanpa perlakuan bakteri. Hal ini terjadi mungkin karena senyawa-senyawa yang dihasilkan oleh P. fluorescens tidak mampu menahan adanya infeksi TMV, sehingga TMV mudah menginfeksi jaringan tanaman dan pertumbuhan daun juga terhambat.
Jika dibandingkan antara tanaman dengan perlakuan bakteri yang tidak diinokulasi TMV dan diinokulasi TMV, semua perlakuan dengan inokulasi TMV akan berbeda nyata dengan tanaman yang tidak diinokulasi TMV. Artinya, semua tanaman cabai yang diinokulasi TMV pertumbuhan lebar daun akan terhambat. Akan tetapi, pada perlakuan campuran dan B. polymixa dengan inokulasi TMV rata-rata lebar daun menunjukkan hasil yang hampir sama dengan kontrol tanpa inokulasi TMV atau tidak ada perbedaan yang nyata antara keduanya. Hal ini memberi arti bahwa tanaman yang tidak diberi bakteri dan tidak ada infeksi TMV (kontrol sehat) akan sama pertumbuhannya dengan tanaman yang diberi B.
Polymixa dan ada infeksi TMV dan campuran kedua bakteri serta ada infeksi
TMV. Adanya campuran bakteri dan B. Polymixa dapat mengkompensasi tanaman dari infeksi TMV sehingga pertumbuhan lebar daun akan lebih baik atau sama dengan tanaman sehat tanpa perlakuan bakteri.
Pengaruh terhadap Jumlah Bunga
dapat menghambat semua penghambatan pertumbuhan generatif tanaman, sehingga tanaman tetap dapat mengalami pembungaan dengan baik.
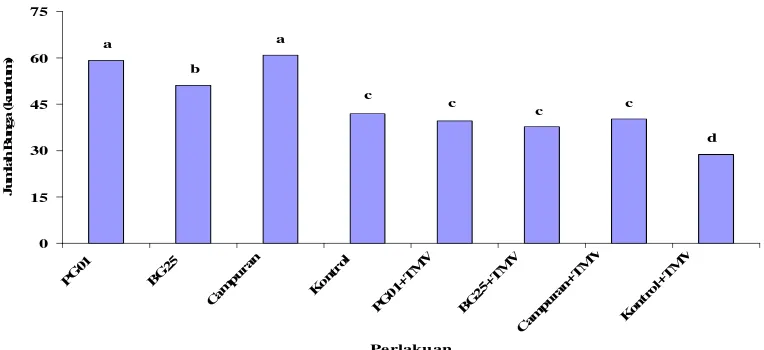
Gambar 5 menunjukkan bahwa pada 8 MST semua perlakuan bakteri menunjukkan perbedaan yang signifikan terhadap tanaman kontrol. Hal ini mengindikasikan bahwa ada pengaruh dengan adanya pemberian bakteri pada tanaman cabai sehingga pertumbuhan bunganya menjadi lebih banyak daripada tanaman cabai yang tidak diberi perlakuan bakteri. Perlakuan campuran menunjukkan hasil yang paling tinggi, yaitu sebesar 60,91 kuntum bunga, disusul oleh P. fluorescens sebesar 59,17 kuntum bunga. Kedua perlakuan ini sama-sama menunjukkan hasil yang sangat baik terhadap pertumbuhan bunga. Dalam proses pertumbuhan bunga, peran campuran kedua bakteri sangat nyata yang berarti bahwa perlakuan bakteri PGPR dapat meningkatkan pertumbuhan pada fase generatif. 0 15 30 45 60 75 PG 01 BG 25 Cam pura
n Kon trol PG 01+ TM V BG 25+ TM V Cam pura
[image:46.595.122.504.379.554.2]n+T MV Kon tro l+T MV Perlakuan J um la h B ung a ( kunt um ) a b a c c c c d
Gambar 5 Jumlah bunga cabai yang diberi perlakuan P. fluorescens (PG01), B. polymixa (BG25), P. fluorescens+B. polymixa (campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 8 MST
Huruf yang sama pada minggu yang sama tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
pengaruh adanya pemberian bakteri terhadap pengaruh infeksi TMV, sehingga walaupun ada infeksi TMV tanaman masih mampu mengalami pembungaan dengan baik yang dapat dilihat dari jumlah bunga yang dihasilkan. Juga dapat disimpulkan bahwa semakin lama bakteri mempengaruhi pertumbuhan tanaman, maka pengaruh infeksi TMV juga akan dihambatnya, sehingga tanaman masih mampu memproduksi bunga dengan baik.
Secara keseluruhan perlakuan antara tanaman dengan bakteri saja dan tanaman dengan bakteri serta diinokulasi virus menunjukkan bahwa pada 4 MSI perlakuan B. polymixa dengan TMV dan kontrol dengan TMV ada perbedaan yang nyata terhadap semua perlakuan tanaman dengan bakteri saja, kecuali dengan kontrol sehat pada B. polymixa dengan TMV. Akan tetapi ketiga perlakuan bakteri yang diinokulasi TMV tidak menunjukkan perbedaan yang nyata terhadap tanaman kontrol sehat. Dari hal ini menunjukkan bahwa tanaman yang diberi bakteri dan terinfeksi TMV akan sama pertumbuhannya dengan tanaman yang tidak diberi bakteri dan tidak terinfeksi virus. Sehingga dengan adanya bakteri pada tanaman yang terinfeksi TMV dapat mengkompensasi pertumbuhan bunga dan pertumbuhan bunga akan menjadi sama dengan tanaman sehat yang tidak diberi perlakuan apa-apa.
Pengaruh pada Produksi Buah Cabai
Umur 13 MST adalah pada saat dilakukan pemanenan. Dari hasil pemanenan dapat dilakukan pengukuran bobot buah dan penghitungan jumlah buah. Pengukuran bobot buah bertujuan untuk mengetahui pengaruh perlakuan pemberian bakteri terhadap buah cabai. Dengan adanya pemberian bakteri diharapkan dapat meningkatkan mutu buah cabai baik dari segi kuantitas maupun kualitas. Penghitungan jumlah buah dilakukan untuk mengetahui jumlah buah
dalam bobot buah per tanaman sehingga bisa diketahui kualitas buah cabai.
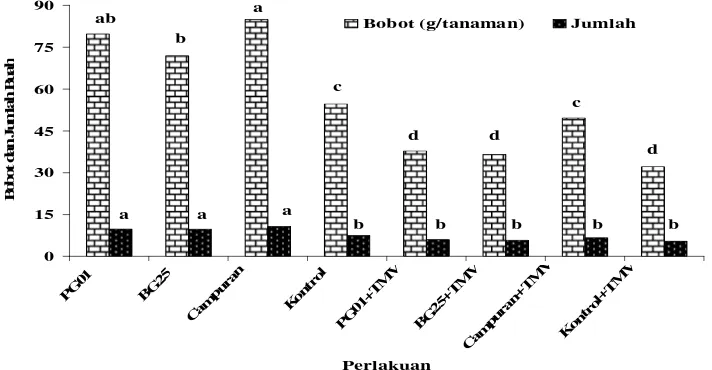
0 15 30 45 60 75 90 PG 01 BG 25 Cam pura
n Kon trol PG 01+ TM V BG 25+ TM V Cam pura
n+ TM V Kon trol+ TM V Perlakuan B o bo t d a n J u m la h B u a h
Bobot (g/tanaman) Jumlah
ab b a c d d c d
a a a
[image:48.595.123.479.125.310.2]b b b b b
Gambar 6 Bobot dan jumlah buah per tanaman cabai yang diberi perlakuan P.
fluorescens (PG01), B. polymixa (BG25), P. fluorescens + B.
polymixa (campuran), kontrol (tanpa bakteri), PG01 yang diinokulasi TMV (PG01+TMV), BG25+TMV, campuran+TMV, dan kontrol+TMV pada 13 MST
Huruf yang sama pada minggu yang sama tidak berbeda nyata berdasarkan uji Duncan pada ά = 0,05
Melalui gambar 6 juga dapat diketahui bahwa perlakuan campuran kedua bakteri menunjukkan perbedaan yang nyata dibandingkan dengan kontrol dan kedua bakteri lain terhadap bobot buah, yaitu sebesar 49,65 g. Hal ini menunjukkan bahwa pemberian campuran bakteri dapat mempengaruhi produksi cabai dan mengurangi pengaruh infeksi TMV yang dapat dilihat dari pembentukan buah yang menjadi penuh.
Jumlah buah yang dihitung menunjukkan bahwa ketiga perlakuan bakteri menunjukkan perbedaan yang signifikan dibandingkan dengan kontrol dan tidak ada perbedaan yang nyata pada ketiga perlakuan bakteri. Hal ini berarti bahwa adanya pengaruh pemberian bakteri terhadap jumlah buah pada tanaman cabai dimana ketiga perlakuan bakteri mempunyai kemampuan yang sama dalam mempengaruhinya.
Pengukuran jumlah buah tidak mengalami perbedaan yang nyata pada semua perlakuan tanaman yang diberi bakteri juga diinokulasi TMV dibandingkan dengan tanaman kontrol sakit. Hal ini menunjukkan bahwa pada 13 MST pemberian bakteri tidak mempengaruhi jumlah buah sehingga TMV dapat menghambat pembentukan buah yang mengakibatkan jumlah buah menjadi sedikit.
Dilihat dari perbandingan antara tanaman yang diinokulasi TMV dan
tidak, menunjukkan bahwa semua tanaman dengan perlakuan bakteri yang diinokulasi TMV terdapat perbedaan yang nyata dengan perlakuan pemberian bakteri saja. Tanaman yang diberi bakteri saja mampu berproduksi lebih banyak daripada tanaman yang diberi bakteri tetapi juga diinokualsi TMV. Dari sini jelas menunjukkan pengaruh infeksi TMV sangat nyata sehingga jumlah buah yang dihasilkan juga lebih sedikit. Akan tetapi dengan adanya perlakuan bakteri dapat menolong tanaman dari infeksi TMV sehingga tanaman yang diberi bakteri dan terinfeksi TMV masih mampu menghasilkan bobot dan jumlah buah yang sama dengan tanaman sehat (tanaman yang tidak mendapat pengaruh apapun) atau bakteri dapat mengkompensasi tanaman dari infeksi TMV.
KESIMPULAN DAN SARAN
Kesimpulan
P. fluorescens, B. polymixa, dan campuran keduanya dapat berfungsi
sebagai PGPR pada tanaman cabai karena dapat meningkatkan pertumbuhan dan produksi tanaman. P. fluorescens, B. polymixa, dan campuran keduanya dapat mengurangi pengaruh infeksi TMV pada tanaman cabai sehingga pertumbuhan dan produksi tanaman dapat menjadi lebih baik. Kombinasi kedua bakteri dapat mengkompensasi tanaman dari infeksi TMV sehingga tanaman cabai masih dapat tumbuh dan memproduksi buah dengan baik.
Saran
DAFTAR PUSTAKA
Agrios GN. 1997. Plant Pathology. Edisi ke-4. New York: Academic Press. Aripin K, Lubis L. 2003. Teknik pengelolaan hama terpadu (PHT) pada tanaman
cabai (Capsicum annuum L.) di dataran rendah. Laporan penelitian. Jurusan Ilmu Hama dan Penyakit Tumbuhan, Fakultas Pertanian, Universitas Sumatera Utara
Asghar HN, Zahir ZA, Arsyad M. 2004. Screening rhizobacteria for improving the growth, yield and oil content of canola (Brassica napus L.). Australian Journal of Agricultural Research 55: 187-194.
Blomberg GV, Lugtenberg BJJ. 2001. Molecular basic of plant growth-promotion and biocontrol by rhizobacteria. Curr. Opin. Plant Biol. 4:343-350.
Boss L. 1994. Pengantar Virologi Tumbuhan. Triharso, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari : Introduction to Plant Virology.
[CABI] CAB International. 2003. Crop Protection Compendium [serial online]. CAB International.
Compant S, Duffy B, Nowak J, Clement C, Barka EA. 2005. Use of plant growth-promoting rhizobacteria for biocontrol of plant disease: principles, mechanisms of action and future prospect. App Env. Microbiol. 71(9): 4951-4959.
[DEPTAN] Departemen Pertanian. 2005. Luas Panen, Rata-rata Hasil dan Produksi Tanaman Hortikultura di Indonesia. Jakarta: Departemen Pertanian RI.
De Meyer G, Hofte M. 1997. Salycylic acid produced by the rhizobacterium Pseudomonas aeruginosa 7NSK2 induced resistance to leaf infection by Botrytis cinerea on Bean. Phytopathology 87: 588-593.
[DITLINTAN] Direktorat Perlindungan Tanaman. 2005. OPT Tanaman Pertanian: Jenis, Luas Serangan dan Luas Pengendalian OPT. Jakarta: Ditlintan.
Gray EJ, Smith DL. 2005. Intracellular and extracellular PGPR: communalities and distinctions in the plant-bacterium signaling processes. Soil. Biol. Biochem. 37:395-412.
Greenleaf WH. 1986. Pepper Breeding. Di dalam Hawkes JG, Editor. Breeding vegetable crops. Connecticut: The Avi Publishing Company Inc.
Hadidi A, Khetarpal RK, Koganezawa H. 1998. Plant Virus Disease Control. USA: APS Press.
Kesumadewi, AAI. 1999. Telaah kontribusi kombinasi bakteri akar pemacu tumbuh tanaman (Pseudomonas putida) dan nitrogen terhadap neraca nitrogen tanah serta adaptabilitas sorgum pada inceptisol Sumatera Selatan [tesis]. Program Pasca Sarjana Fakultas Pertanian IPB.
Kloepper JW, CM. Ryu, dan S. Zang. 2004. Induced Systemic Resistance and Promoting Plant Growth by Bacillus spp. Phytopathology 94: 1259-1266. Kokalis et al. 2002. Field evaluation of plant growth promoting rhizobacteria
amended transplant mixes and soil solarization for tomato and pepper production in Florida. Plant and soil. 2: 257-166.
Leeman M, JA. Van Pelt, FM. Den Quden, M. Heinsbroek, PAHM. Baker, dan B Schippers. 1995. Induction of Systemic Resistance Against Fusarium Wilt Radish by Lipopolysaccharides of Pseudomonas fluorescens. Phytopathology 85: 1021-1027.
Liu L, Kloepper JW, Tuzun S. 1995. Induction of systemic resistance in cucumber against bacterial angular leaf spot by plant growth promoting rhizobacteria. Phytopathology 85: 843-847.
Martina. 1999. Budidaya tanaman cabai. Buletin Penelitian Hortikultura Balai Penelitian Holtikultura Lembang No 02/Juli 1999.
Marte M dan Wetter C. 1986. Occurance of Pepper mild mottle virus in Pepper Cultivars from Italy and Spain. Plant Dis. Protec. 93(1): 37-43.
Marwoso E. 2005. Pemanfaatan rizobakteria untuk pengendalian virus daun kecil kacang panjang (Cowpea little leaf virus). [skripsi]. Bogor: Institut Pertanian Bogor.
Maurhofer M, Hase C, Mewly P, Metraux JP, Defago G. 1994. Induction of systemic resistance of tobacco to Tobacco necrosis virus by the root-colonizing Pseudomonas fluorescens strain CHA0: influence of the gacAgene and pyoverdine production. Phytopathology 84: 139-146.
Murphy JF, Zehnder GW, Schuster DJ, Sikora EJ, Polston JE, Kloepper JW. 2000. Plant Growth-promoting rhizobacterial mediated protection in tomato against Tomato mottle virus. Plant Dis. 84: 779-784.
Nelson LM. 2004. Plant growth promoting rhizobacteria (PGPR): prospects for New Inoculants. Crop Management
Ong CA, Varghese G, dan Poh TW. 1980. The Effect of Chili Veinal Mottle Virus on Yield of Chili (Capsicum annuum L.). Malaysian Agriculture Research and Development Institut (MARDI). Res Bull. 8(1): 74-79. Pelzar MJ, Chan ESC. 1986. Dasar-dasar mikrobiologi 1. Hadioetomo HS, Imas
T, Angka SL. Terjemahan dari Element of Microbiology. Jakarta: UI Press.
Ramamoorthy V, Viswanathan R, Raguchander T, Prakasam V, Samiyappan R. 2001. Induction of systemic resistance by plant growth promoting rhizobacterian crop plants against pests and diseases. Crop Prot. 20: 1-11. Sastrosumarjo S. 2003. Pembentukan Varietas Cabai Tahan Penyakit
Antraknosa dengan Pendekatan Metode Konvensional dan Bioteknologi. Laporan Akhir Riset Unggulan Terpadu VI