PERUBAHAN KOMPONEN MINOR DAN STABILITAS
MINYAK SAWIT MERAH SELAMA FOTO-OKSIDASI
DEWI FORTUNA AYU
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa disertasi berjudul Perubahan Komponen Minor dan Stabilitas Minyak Sawit Merah selama Foto-oksidasi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, 27 Agustus 2015
Dewi Fortuna Ayu
RINGKASAN
DEWI FORTUNA AYU. Perubahan Komponen Minor dan Stabilitas Minyak Sawit Merah selama Foto-oksidasi. Dibimbing oleh NURI ANDARWULAN, PURWIYATNO HARIYADI, dan EKO HARI PURNOMO.
Penelitian pengembangan produk minyak kelapa sawit perlu diprioritaskan, salah satunya berupa minyak sawit merah (MSM). Kandungan -karoten dan tokoferol yang tinggi dalam MSM terbukti memberikan efek fungsional bagi kesehatan. Akan tetapi, proses pengolahan MSM yang tanpa pemucatan tidak hanya mampu mempertahankan kandungan -karoten dan tokoferol, tetapi juga klorofil yang merupakan sensitizer reaksi foto-oksidasi. Keberadaan klorofil, tokoferol, dan karoten berpengaruh terhadap stabilitas foto-oksidatif MSM.
Tujuan penelitian ini adalah : (1) mempelajari perubahan komponen minor (klorofil, tokoferol, karoten) dan stabilitas oksidasi (bilangan peroksida, p -anisidin, total oksidasi) MSM akibat pengaruh paparan cahaya, (2) mendapatkan parameter kinetika perubahan komponen minor dan stabilitas MSM selama foto-oksidasi, dan (3) mempelajari peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas foto-oksidatif MSM. Penelitian dirancang dalam 2 tahapan menggunakan MSM dan sistem model, yang meliputi (1) kajian perubahan komponen minor dan stabilitas oksidasi MSM akibat pengaruh intensitas cahaya dan (2) kajian peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas foto-oksidatif MSM. Foto-oksidasi dilakukan dengan mengekspos sampel minyak pada paparan cahaya intensitas 5000, 10000, dan 15000 lux di dalam kotak inkubator yang dilengkapi dengan lampu flouresen pada suhu terkontrol (31±2 °C). Dua jenis kontrol yang digunakan pada penelitian ini yaitu kontrol gelap dan kontrol cahaya normal pada intensitas 476.25-496.25 lux dalam ruang laboratorium.
Minyak sawit merah yang diproduksi dari minyak sawit mentah (crude palm oil, CPO) memiliki kandungan klorofil (4.36 mg/kg), tokoferol (1127.49 mg/kg), dan karoten (559.39 mg/kg), dengan rasio komposisi asam lemak jenuh dan tidak jenuh 45:55. Pemberian paparan cahaya dapat memicu reaksi foto-oksidasi dalam MSM. Reaksi foto-oksidasi MSM diperlihatkan dengan menurunnya kandungan klorofil dan tokoferol serta meningkatnya bilangan peroksida dan total oksidasi (total oxidation, Totox). Klorofil mengalami penurunan tajam pada saat awal paparan cahaya yang diikuti dengan peningkatan bilangan peroksida dan Totox. Tokoferol mengalami penurunan langsung pada paparan intensitas 10000 dan 15000 lux, sedangkan karoten relatif konstan hingga 7 hari penyimpanan baik pada kontrol gelap maupun perlakuan cahaya. Paparan cahaya mempercepat peningkatan bilangan peroksida dan Totox mengikuti model kinetika ordo nol dengan nilai konstanta laju (k) 0.81 (r2=0.99), 1.11 (r2=0.99), 1.47 mek O2/kg/hari
Paparan intensitas cahaya 5000, 10000, dan 15000 lux pada suhu ruang (31.60±0.69 oC) mempercepat degradasi klorofil, tokoferol, dan karoten dalam MSM. Fotodegradasi klorofil, tokoferol, dan karoten selama penyimpanan dapat dievaluasi untuk menghitung parameter kinetikanya. Klorofil mengalami fotodegradasi mengikuti model kinetika reaksi ordo pertama dalam dua periode; yaitu periode fotodegradasi cepat selama penyimpanan 6 jam pertama dengan nilai k 3.8110-2, 4.4510-2, 5.6410-2 per hari, diikuti periode fotodegradasi lambat pada penyimpanan yang lebih lama dengan nilai k 1.4110-2, 3.0110-2, 4.5910-2 per hari, masing-masing pada intensitas 5000, 10000, dan 15000 lux. Fotodegradasi tokoferol dan karoten juga mengikuti model kinetika reaksi ordo pertama. Fotodegradasi tokoferol berlangsung dengan laju paling tinggi (nilai k 9.1010-2, 12.0210-2, 17.3310-2 per hari), sedangkan fotodegradasi karoten berlangsung dengan laju paling rendah (nilai k 0.8010-2, 1.4010-2, 1.9810-2 per hari) masing-masing pada perlakuan intensitas 5000, 10000, dan 15000 lux. Konstanta intensitas cahaya (zi) dapat digunakan sebagai indikator ketergantungan
nilai k terhadap perubahan intensitas cahaya. Nilai zi klorofil, tokoferol, karoten
berturut-turut 20000, 33333, dan 25000 lux, mengindikasikan bahwa laju degradasi klorofil paling sensitif terhadap perubahan intensitas cahaya.
Peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas foto-oksidatif MSM dipelajari menggunakan sistem model. Sistem model dipersiapkan dari refined bleached deodorized palm (RBDP) olein dan MSM. Sistem model terdiri dari TAG+Toc yang mengandung komponen tokol (704.72 mg/kg), TAG+Car yang mengandung -karoten (529.47 mg/kg), serta TAG+Toc+Car yang mengandung komponen tokol (641.02 mg/kg) dan -karoten (535.73 mg/kg). MSM yang mengandung komponen tokol (698.76 mg/kg), -karoten (518.61 mg/kg), dan klorofil (3.44 mg/kg) diasumsikan sebagai sistem model TAG+Toc+Car+Chlor. Komponen tokol dan -karoten yang terpisah dalam sistem model TAG+Toc maupun TAG+Car mengalami degradasi selama 7 jam paparan intensitas 5000, 10000, dan 15000 lux. Peningkatan paparan intensitas cahaya mempercepat laju degradasi komponen tokol dengan urutan -T3>-T>-T3>-T3. Peningkatan paparan cahaya juga mempercepat laju degradasi -karoten dengan nilai k 0.3710-2, 0.72x 10-2, dan 2.1910-2 per jam masing-masing pada intensitas 5000, 10000, dan 15000 lux. Laju degradasi -karoten paling sensitif terhadap perubahan intensitas cahaya diikuti tokotrienol dan tokoferol dengan urutan -karoten>-Tγ>α-T3>-T3>-T. Keberadaan komponen tokol dan -karoten secara bersama dalam sistem model TAG+Toc+Car memperlihatkan efek perlindungan dan penghambatan foto-oksidasi tertinggi. Keberadaan klorofil mempercepat degradasi komponen tokol dan -karoten pada tahap awal foto-oksidasi serta laju foto-oksidasi MSM pada intensitas cahaya yang sangat tinggi.
SUMMARY
DEWI FORTUNA AYU. Changes of Minor Compounds and Stability of Red Palm Oil during Photo-oxidation. Supervised by NURI ANDARWULAN, PURWIYATNO HARIYADI, and EKO HARI PURNOMO.
Research development of palm oil products such as red palm oil (RPO) need to be prioritized. The high content of -carotene and tocopherol in RPO has been shown to give functional effect on health. However, RPO processing without bleaching is not only able to maintain -carotene and tocopherol content, but also chlorophyll content which is sensitizer in photo-oxidation reaction. The existence of chlorophyll, tocopherol, and carotene affect the photo-oxidative stability of RPO.
This research aims to (1) study the changes of minor compounds (chlorophyll, tocopherol, carotene) and oxidative stability (peroxide, p-anisidine, total oxidation values) of RPO due to influence of exposure to light, (2) determine kinetics parameters of the minor compounds changes and oxidative stability of RPO during photo-oxidation, and (3) study the effect of tocopherol, tocotrienol, -carotene, and chloropyll on the photo-oxidative stability of RPO. The study was designed into 2 stages using RPO and system models, which covered (1) study of the minor compounds changes and photo-oxidative stability of RPO due to the influence of light intensities and (2) study of the effect of tocopherols, tocotrienols, -carotene, and chloropyll on the photo-oxidative stability of RPO. Photo-oxidation is performed by exposing the samples to light on intensities of 5000, 10000, and 15000 lux in the incubator box equipped with fluoresence light at controlled temperature (31±2 °C). Two different controls used in this research are namely dark and normal light control on intensity of 476.25-496.25 lux in laboratory room.
Red palm oil is produced from crude palm oil (CPO) having chlorophyll (4.36 mg/kg), tocopherol (1127.49 mg/kg), and carotene (559.39 mg/kg) contents, with ratio of saturated and unsaturated fatty acid composition of 45:55. Exposure to light triggered photo-oxidation reaction in RPO. Photo-oxidation reactions were shown by decrease on chlorophyll and tocopherol contents and increase on peroxide (PV) and total oxidation (Totox) values. The chlorophyll experienced a sharp decline at early stage of light exposure followed by an increase of PV and Totox values. The tocopherol directly decreased on light intensities of 10000 and 15000 lux, while the carotene was relatively constant up to 7 days of storage both on dark control and light treatments. Exposure to light accelerated the increase of PV and Totox values that could be discribed using zero order kinetics model with k value of 0.81 (r2=0.99), 1.11 (r2=0.99), 1.47 mequiv/kg/day (r2=0.99), and 1.93 (r2=0.95), 2.63 (r2=0.96), 3.83 per day (r2=0.95) on light intensities of 5000, 10000, and 15000 lux, respectively. A significant negative correlation between the changes of PV and tocopherol content showed that at the same degradation of tocopherol content (>20%), the higher light intensities have bigger effect on the increase of PV.
during storage could be evaluated to determine its kinetics parameters. Chlorophyll underwent photo-degradation following first order kinetics model in two periods. The photo-degradation of chloropyll were fast photo-degradation period during the first 6 hours of storage with k value of 3.8110-2, 4.4510-2, 5.6410-2 per day, followed by slow photo-degradation period in longer storage duration with k value of 1.4110-2, 3.0110-2, 4.5910-2 per day on light intensities of 5000, 10000, and 15000 lux, respectively. The photo-degradation of tocopherol and carotene also followed first order kinetics model. The photo-degradation of tocopherol occured with the highest rate (k values of 9.1010-2, 12.0210-2, 17.3310-2 per day), while the photo-degradation of carotene with the lowest rate (k values of 0.8010-2, 1.4010-2, 1.9810-2 per day) on light intensities of 5000, 10000, and 15000 lux, respectively. Light intensity coefficient (zi) can be used as dependence indicator of k values to the changes of
light intensity. The zi values of chlorophyll, tocopherol, and carotene were
respectively of 20000, 33333, and 25000 lux, indicated that the degradation rate of chlorophyll was the most sensitive to the changes of light intensity.
The effects of tocopherols, tocotrienols, -carotene, and chloropyll on photo-oxidative stability of RPO were studied using model systems. The model systems were prepared from refined bleached deodorized palm (RBDP) olein and RPO. The model systems consist of TAG+Toc containing tocols compound (704.72 mg/kg), TAG+Car containing -carotene (529.47 mg/kg), and TAG+Toc+Car containing tocols compound (641.02 mg/kg) and -carotene (535.73 mg/kg). RPO which contained tocols compound (698.76 mg/kg), -carotene (518.61 mg/kg), and chlorophyll (3.44 mg/kg) was assumed as TAG+Toc+Car+Chlor model system. The tocols compound and -carotene which were separated in TAG+Toc or TAG+Car model systems showed degradation during 7 hours of exposure to light on intensities of 5000, 10000, and 15000 lux. The increase of exposure to light accelerated the degradation rate of tocols compound with the following order -T3>-T>-T3>-T3. The increase of exposure to light also accelerated degradation rate of -carotene with k values of 0.3710-2, 0.7210-2, and 2.1910-2 per h on intensities of 5000, 10000, and 15000 lux, respectively. The degradation rate of -carotene was the most sensitive compound to an increase of light intensity followed by tocotrienols and tocopherols with order -karoten>-Tγ>α-T3>-T3>-T. The existence of tocols compound and -carotene together in TAG+Toc+Car model system showed the highest protection and inhibitory effects on photo-oxidation. The presence of chloropyll accelerated the degradation of tocols compound and -carotene at an early stage of photo-oxidation and photo-oxidation rate of RPO on very high-light intensity.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor
pada
Program Studi Ilmu Pangan
PERUBAHAN KOMPONEN MINOR DAN STABILITAS
MINYAK SAWIT MERAH SELAMA FOTO-OKSIDASI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Penguji pada Ujian Tertutup: 1. Dr Ir Feri Kusnandar, MSc
(Ketua Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor)
2. Dr Nur Wulandari, STP MSi
(Staf Pengajar Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian, Institut Pertanian Bogor)
Penguji pada Sidang Promosi Terbuka: 1. Dr Anny Sulaswatty, MSc
(Peneliti Senior Pusat Penelitian Kimia LIPI) 2. Dr Nur Wulandari, STP MSi
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga disertasi dengan judul “Perubahan Komponen Minor dan Stabilitas Minyak Sawit Merah selama Foto-oksidasi” dapat diselesaikan. Bagian dari disertasi ini telah diajukan sebagai artikel imiah, yaitu: 1) “ Photo-oxidative changes of red palm oil as affected by light intensity” pada International Journal of Food Science and Technology (Wiley), β) “Kinetika fotodegradasi
klorofil, tokoferol, dan karoten dalam minyak sawit merah” pada jurnal AGRITECH volume 36 nomor β pada bulan Mei β016, dan γ) “Effects of tocopherols, tocotrienols, and -carotene on photo-oxidative stability of red palm oil pada jurnal Food Science and Biotechnology (Springer).
Terima kasih penulis sampaikan kepada Prof Dr Ir Nuri Andarwulan MSi selaku ketua Komisi Pembimbing, Prof Dr Ir Purwiyatno Hariyadi MSc, dan Dr Eko Hari Purnomo STP MSi sebagai anggota Komisi Pembimbing, yang telah memberikan bimbingan, arahan, dan dukungan hingga terselesainya disertasi ini. Penulis juga mengucapkan terima kasih kepada Dr Didah Nur Faridah STP MSi, Dr Ir Drajat Martianto MSi, Dr Ir Feri Kusnandar MSc, Dr Nur Wulandari STP MSi, dan Dr Anny Sulaswatty MSc sebagai penguji luar komisi pada ujian prelim, ujian tertutup dan ujian terbuka, serta kepada Prof Dr Ir Ratih Dewanti-Hariyadi MSc (Ketua PS IPN), Dr Ir Endang Prangdimurti MSi (Sekretaris PS IPN), dan Prof Dr Ir Slamet Budijanto MAgr (Wakil Dekan Fateta) yang telah memberikan masukan mendasar pada keseluruhan isi disertasi ini.
Terima kasih kepada Rektor Universitas Riau dan Dekan Fakultas Pertanian Universitas Riau, serta Rektor dan Dekan Sekolah Pascasarjana (SPs IPB) yang telah memberikan ijin dan kesempatan kepada penulis untuk mengikuti pendidikan Program Doktor di SPs IPB. Terima kasih kepada Ketua PS Ilmu Pangan dan semua dosen atas ilmu dan keteladanan yang telah diberikan. Terima kasih kepada Kementerian Pendidikan dan Kebudayaan Republik Indonesia atas bantuan beasiswa BPPS tahun 2010-2014, Hibah Penelitian Bersaing tahun 2013 dan Penelitian Doktor tahun 2014, serta Yayasan Supersemar atas bantuan biaya penelitian Program Pascasarjana tahun 2014. Terima kasih kepada Laboratorium Seafast Center-IPB dan Laboratorium Ilmu dan Teknologi Pangan IPB serta seluruh staf yang telah mengakomodir jalannya penelitian ini. Terima kasih juga penulis sampaikan kepada Dr Ir Zita Letviany Sarunggallo MSi atas bantuannya dalam analisis komposisi tokol menggunakan HPLC, Dody Dwi Handoko Phd atas sumbangan pemikiran dalam penulisan publikasi internasional, serta Dr Ir Mursalin Murod MSi yang telah memberikan saran dan berbagai pemikiran dalam penyelesaian penelitian dan penulisan disertasi ini.
Hendra, Inneke, Syahrul, dan Andarini) atas kebersamaan, semangat, dukungan, dan motivasi selama menempuh pendidikan.
Semoga karya ilmiah ini bermanfaat untuk pengembangan ilmu pengetahuan dan teknologi serta bidang terkait lainnya.
Bogor, 27 Agustus 2015
DAFTAR ISI
DAFTAR TABEL xvi
DAFTAR GAMBAR xvii
DAFTAR LAMPIRAN xix
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 4
Ruang Lingkup Penelitian 4
2 TINJAUAN PUSTAKA 5
3 METODE 27
Waktu dan Tempat 27
Bahan dan Alat 27
Metode Penelitian 27
Analisis Data 30
Prosedur Analisis 31
4 PERUBAHAN FOTO-OKSIDATIF MINYAK SAWIT MERAH
AKIBAT PENGARUH INTENSITAS CAHAYA 37
5 KINETIKA FOTODEGRADASI KLOROFIL, TOKOFEROL, DAN
KAROTEN DALAM MINYAK SAWIT MERAH 51
6 PERANAN TOKOFEROL, TOKOTRIENOL, BETA-KAROTEN, DAN KLOROFIL TERHADAP STABILITAS FOTO-OKSIDATIF
MINYAK SAWIT MERAH 67
7 PEMBAHASAN UMUM 81
8 SIMPULAN DAN SARAN 89
Simpulan 89
Saran 90
DAFTAR PUSTAKA 91
LAMPIRAN 97
DAFTAR TABEL
1 Kandungan komponen minor dalam minyak sawit merah 6
2 Komposisi asam lemak minyak sawit merah 7
3 Karakteristik fisiko-kimia minyak sawit dan minyak sawit merah 7 4 Perbandingan karakteristik oksigen singlet dan triplet 8 5 Profil karoten minyak sawit yang diekstrak dari E. quineensis, E.
oleifera, hibrida, dan persilangannya 13
6 Komposisi vitamin E dalam minyak sawit merah 17
7 Kandungan klorofil (mg/kg) selama tahap perkembangan buah E.
quineensis 21
8 Karakteristik kimia minyak sawit mentah dan merah 41
9 Kinetika fotodegradasi klorofil 56
10 Kinetika fotodegradasi tokoferol 59
11 Kinetika fotodegradasi karoten 61
12 Parameter kinetika fotodegradasi klorofil, karoten, dan tokoferol dalam
MSM 63
13 Karakteristik kimia sistem model dan MSM 71
DAFTAR GAMBAR
1 Konversi -karoten (1) menjadi retinol (3) (Fernández-García et al.
2011) 6
2 Obital molekul (A) oksigen triplet dan (B) oksigen singlet (Min dan
Boff 2002) 8
3 Berbagai jalur pembentukan oksigen singlet (Min dan Boff 2002) 9 4 Pembentukan oksigen singlet dengan adanya photosensitizer, cahaya,
dan oksigen triplet (Choe dan Min 2005) 9
5 Pembentukan sensitizer triplet tereksitasi (3Sen*) dan reaksinya dengan substrat melalui jalur tipe I dan II (Min dan Boff 2002) 10 6 Reaksi foto-oksidasi pembentukan hidroperoksida (Choe dan Min
2009) 11
7 Mekanisme dekomposisi asam lemak hidroperoksida (Choe dan Min
2006). 12
8 Mekanisme degradasi termal -karoten minyak jagung (Zeb dan
Murkovic 2011) 14
9 Struktur kimia tokoferol dan tokotrienol 17
10 Reaksi oksidasi tokoferol (Krieger-Liszkay dan Trebst 2006) 18 11 Mekanisme pro-oksidan tokoferol (Kim et al. 2007) 20
12 Dekomposisi klorofil 21
13 Pengaruh suhu terhadap foto-oksidasi metil linoleat yang disensitasi
oleh klorofil (Endo et al. 1984) 22
14 Pengaruh intensitas cahaya terhadap foto-oksidasi metil linoleat yang
disensitasi klorofil (Endo et al. 1984) 23
15 Kotak inkubator untuk penelitian foto-oksidasi (a) tampak atas dan (b)
tampak depan 29
16 Desain kotak inkubator untuk penelitian foto-oksidasi 39 17 Pengaruh intensitas cahaya terhadap retensi kandungan (a) klorofil, (b)
tokoferol, dan (c) karoten dalam MSM selama penyimpanan. Kontrol adalah sampel yang disimpan pada kondisi gelap dan cahaya normal.
Error bars menunjukkan standard error of the mean (n =3) 42
18 Pengaruh intensitas cahaya terhadap perubahan bilangan peroksida dalam MSM selama penyimpanan. Kontrol adalah sampel yang disimpan pada kondisi gelap dan cahaya normal. Error bars
menunjukkan standard error of the mean (n =3) 43 19 Pengaruh intensitas cahaya terhadap bilangan p-anisidin dalam MSM
selama penyimpanan. Kontrol adalah sampel yang disimpan pada kondisi gelap dan cahaya normal. Error bars menunjukkan standard
error of the mean (n =3) 44
20 Pengaruh intensitas cahaya terhadap bilangan Totox dalam MSM selama penyimpanan. Kontrol adalah sampel yang disimpan pada kondisi gelap dan cahaya normal. Error bars menunjukkan standard
error of the mean (n =3) 45
21 Perubahan komponen minor dan stabilitas oksidasi MSM selama penyimpanan pada (a) kontrol cahaya normal, (b) intensitas 5000 lux, (c) 10000 lux, and (d) 15000 lux. Error bars menunjukkan standard
22 Korelasi antara perubahan bilangan peroksida dan tokoferol dalam MSM selama penyimpanan pada intensitas ○ 5000 lux, ▲ 10000 lux, □
15000 lux 47
23 (a) Degrasi klorofil MSM selama penyimpanan pada berbagai kondisi cahaya, (b) fotodegradasi klorofil MSM selama penyimpanan 0-6 jam pada intensitas cahaya tinggi, dan (c) fotodegradasi klorofil MSM selama penyimpanan 6 jam-61 hari pada intensitas cahaya tinggi (
kontrol dalam botol gelap; ■ kontrol dalam botol transparan; ○
intensitas 5000 lux; ▲intensitas 10000 lux; □ intensitas 15000 lux) 55 24 (a) Degradasi tokoferol MSM selama penyimpanan pada berbagai
kondisi cahaya dan (b) fotodegradasi tokoferol MSM selama penyimpanan pada intensitas cahaya tinggi ( kontrol dalam botol
gelap; ■ kontrol dalam botol transparan; ○ intensitas 5000 lux; ▲
intensitas 10000 lux; □ intensitas 15000 lux) 58
25 (a) Degradasi karoten MSM selama penyimpanan pada berbagai kondisi cahaya dan (b) fotodegradasi karoten MSM selama penyimpanan dengan intensitas cahaya tinggi ( kontrol dalam botol gelap; ■ kontrol
dalam botol transparan; ○ intensitas 5000 lux; ▲ intensitas 10000 lux; □
intensitas 15000 lux) 60
26 Hubungan antara intensitas cahaya dan log k komponen minor dalam MSM selama foto-oksidasi ( klorofil; □ tokoferol; karoten) 62 27 Perubahan -T, -T3, -T3, dan -T3 dalam sistem model (a)
TAG+Toc, (b) TAG+Toc+Car, dan (c) MSM selama paparan cahaya pada intensitas 5000, 10000, and 15000 lux. Error bars menunjukkan
standard error of the mean (SEM) 72
28 Perubahan -karoten dalam sistem model (a) TAG+Car, (b) TAG+Toc+Car, dan (c) MSM selama paparan cahaya pada intensitas 5000, 10000, and 15000 lux. Error bars menunjukkan standard error
of the mean (SEM) 74
29 Pengaruh intensitas cahaya terhadap stabilitas foto-oksidatif sistem model (a) TAG+Toc, (b) TAG+Car, (c) TAG+Toc+Car, dan (d) MSM.
Error bars menunjukkan standard error of the mean (SEM) 76
30 Perubahan peak kromatogram -karoten MSM selama (a) 0 jam dan (b) 7 jam pada paparan intensitas cahaya 5000 lux, (c) 10000 lux, dan (d)
15000 lux 83
31 Perubahan warna MSM (a) awal, (b) kontrol dalam botol gelap setelah disimpan selama 182 hari, (c) kontrol dalam botol transparan setelah 182 hari, (d) intensitas cahaya 5000 lux setelah 130 hari, (e) 10000 lux setelah 90 hari, dan (f) 15000 lux setelah 65 hari 84 32 Sistem model (a) TAG+Toc, (b) TAG+Car, (c) TAG+Toc+Car, dan (d)
MSM sebagai TAG+Toc+Car+Chlor 86
33 Penurunan kandungan klorofil dalam sistem model TAG+Toc+Car+Chlor selama paparan intensitas cahaya 5000, 10000,
dan 15000 lux 87
DAFTAR LAMPIRAN
1 Karakteristik kimia minyak sawit mentah dan minyak sawit merah 97 2 Kurva standar total tokoferol (spektrofotometer) 98 3 Kurva standar -tokoferol dan -tokoferol (HPLC) 99 4 Kurva standar -tokotrienol, -tokotrienol, dan -tokotrienol (HPLC) 100
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara penghasil minyak kelapa sawit terbesar di dunia selain Malaysia. Hingga tahun 2013, total produksi minyak sawit mentah (crude palm oil, CPO) Indonesia telah mencapai 26.9 juta ton dengan luas lahan perkebunan besar 6,171,700 Ha dan perkebunan rakyat 4,415,800 Ha (BPS 2014). Tingginya produksi minyak kelapa sawit di Indonesia mendorong prioritas penelitian nasional lebih diarahkan pada pengembangan produk minyak kelapa sawit dalam rangka peningkatan nilai tambah yang dimilikinya. Salah satu produk minyak kelapa sawit yang memberikan efek fungsional bagi kesehatan adalah minyak sawit merah (MSM).
Minyak sawit merah merupakan minyak hasil ekstraksi mesokarp buah kelapa sawit yang dimurnikan tanpa proses pemucatan untuk mempertahankan kandungan karotenoidnya. Kandungan karoten MSM berkisar 524-542 mg/kg (Yie et al. 2012; Dauqan et al. 2011), didominasi -karoten yang secara in vivo dapat dikonversi menjadi dua molekul vitamin A (Fernández-García et al. 2011). Beberapa penelitian membuktikan bahwa konsumsi minyak sawit merah dapat memperbaiki status vitamin A pada populasi yang beresiko kekurangan vitamin ini (Rice dan Burn 2010). Konsumsi MSM mampu meningkatkan kadar serum retinol pada anak usia 7-12 tahun (Zeba et al. 2006), pasangan ibu dan balita usia 1-3 tahun (Zagrè et al.
2003), wanita hamil dan menyusui (Lietz et al. 2001; 2006), serta bayi (Canfield et al. 2001). Beberapa penelitian lain menyatakan bahwa konsumsi karoten dapat mencegah gangguan penyakit jantung, kanker, katarak (Man dan Tan 2003), meningkatkan fungsi kekebalan tubuh, dan menurunkan kejadian kanker (Chew dan Park 2004).
Minyak sawit merah juga mengandung vitamin E 953-955 mg/kg dalam bentuk
α-tokoferol (171-β4β mg/kg), α-tokotrienol (266-294 mg/kg), -tokotrienol (367 mg/kg), dan -tokotrienol (80-126 mg/kg) (Yie et al. 2012; Dauqan et al. 2011). Vitamin E minyak sawit berpotensi sebagai antioksidan biologis, melindungi terhadap stress oksidatif, proses penyempitan pembuluh darah (Mukherjee dan Mitra 2009), dan melawan perkembangan penyakit aterosklerosis (Idris et al. 2014). Namun demikian, -karoten dan tokoferol dapat mengalami kerusakan oksidasi yang dipercepat oleh panas dan cahaya. Produk termal oksidasi -karoten berupa epoxy -karoten terbukti bersifat mutagen pada S. Typhimurium (Puspitasari-Nienaber 2002), sedangkan tokoferol teroksidasi dapat membentuk berbagai radikal dan senyawa teroksidasi -tocopherolquinone, 4a,5-epoksi--tocopherolquinone, dan
7,8-epoksi--tocopherolquinone yang bersifat pro-oksidan selama penyimpanan (Kim et al. 2007).
al. 1984). Menurut Choe dan Min (2006), klorofil merupakan sensitizer umum pemicu foto-oksidasi, pada kisaran 0.070-1.200 mg/kg dalam minyak nabati dapat menginisiasi dan mempercepat reaksi foto-oksidasi (Belitz et al. 2009). Setelah menyerap energi dari cahaya, klorofil mentransfer energi ke triplet oksigen (3O2)
untuk membentuk oksigen singlet (1O2) yang lebih reaktif. Oksigen singlet bereaksi
cepat dengan rantai karbon tidak jenuh menghasilkan peroksida, menginisiasi auto-oksidasi radikal bebas konvensional untuk memproduksi lebih banyak hidroperoksida. Selanjutnya minyak yang mengalami foto-oksidasi, produk oksidasi akan mengkatalis rantai reaksi oksidasi menghasilkan penurunan mutu minyak. Laju reaksi oksigen singlet dengan asam lemak oleat, linoleat dan linolenat lebih cepat hingga 30,000, 1,450, dan 909 kali daripada oksigen triplet (Park et al. 2011).
Keberadaan -karoten, tokoferol, dan tokotrienol dengan kadar dan struktur kimia yang berbeda memperlihatkan peranan yang unik selama foto-oksidasi. Karoten bersifat antioksidan terutama sebagai quencher oksigen singlet pada minyak kedelai (Jung dan Min 1991), zaitun (Rahmani dan Csallany 1998), dan biji evening primrose (Hanyz et al. 2006) melalui transfer energi (Chen dan Liu 1998). Karoten tidak memperlihatkan aktivitas antioksidan pada kondisi gelap (auto-oksidasi) (Yie et al. 2011; Hall dan Cuppett 2000) maupun suhu tinggi (termal oksidasi) (Rahmani dan Csallany 1998; Steenson dan Min 2000). Hilangnya ikatan ganda konjugasi akibat pemanasan menyebabkan hilangnya kemampuan quenching oksigen singlet dan mencegah foto-oksidasi pada minyak kedelai dan zaitun (Steenson dan Min 2000; Rahmani dan Csallany 1998). Produk oksidasi -karoten tidak bersifat antioksidan pada foto-oksidasi minyak biji bunga matahari (Yanishlieva et al. 2001), bahkan -karoten bertindak pro-oksidan pada minyak biji rapeseed (Haila dan Heinonen 1994). Namun, keberadaan produk oksidasi -karoten atau -karoten bersama tokoferol dalam minyak biji bunga matahari dan rapeseed memperlihatkan aktivitas antioksidan yang efektif menghambat foto-oksidasi (Yanishlieva et al.
2001; Haila dan Heinonen 1994).
Tokoferol merupakan salah satu antioksidan paling efektif dalam sistem pangan yang menyumbangkan atom hidrogen fenoliknya ke radikal peroksil selama oksidasi (Kamel-Eldin 2006). Aktivitas antioksidan -tokoferol selama foto-oksidasi diperlihatkan pada minyak kedelai (Jung et al. 1991; Hall dan Cuppett 2000), zaitun (Rahmani dan Csallany 1998), rapeseed (Haila dan Heinonen 1994), alga (Chang 2011), canola (Lee dan Choe 2011), dan lemak babi (King et al. 2011). Mekanisme antioksidan tokoferol selama foto-oksidasi melibatkan quenching fisik oksigen singlet melalui transfer muatan, dengan aktivitas tertinggi isomer -, dikuti -, dan -tokoferol (Kim dan Choe 2013). Tokoferol juga bereaksi ireversibel dengan oksigen singlet menghasilkan tokoferol hidroperoksidienon, tokoferil kuinon, dan kuinon epoksida (Choe dan Min 2005; 2006). Walaupun berfungsi sebagai antioksidan, tokoferol dapat kehilangan aktivitas antioksidan bahkan bertindak sebagai pro-oksidan dalam bentuk tokoferol teroksidasi (Kim et al. 2007; Chapman
et al. 2009) dan pada konsentrasi tinggi (King 2007; Chang 2011).
Beberapa kajian terkait stabilitas MSM telah dilakukan pada kondisi auto- dan termal oksidasi. Minyak sawit merah memiliki stabilitas auto-oksidasi (suhu 30 °C) yang lebih rendah dibandingkan minyak sawit tanpa kandungan karoten (yellow palm oil) (Yie et al. 2011). Beta-karoten MSM mengalami degradasi mengikuti kinetika reaksi ordo nol selama penyimpanan gelap dengan waktu paruh (t1/2) selama 12
(Puspitasari-Nienaber 2002). Perlakuan penyimpanan suhu 60, 75, dan 90 °C meningkatkan laju degradasi karoten MSM mengikuti kinetika reaksi ordo 1 masing-masing dengan konstanta laju (nilai k) 9.1310-3, 2.1510-2, 4.7910-2 per hari (Ayustaningwarno 2010). Menurut Sampaio et al. (2013), pemanasan suhu 170-230 °C mempercepat degradasi karoten MSM mengikuti kinetika reaksi ordo 1.3, dimana hubungan antara peningkatan suhu dan nilai k dapat dijelaskan berdasarkan persamaan Arrhenius dengan energi aktivasi 109.4 kJ/mol.
Cahaya merupakan salah satu faktor pemicu reaksi foto-oksidasi selain oksigen triplet dan sensitizer (Min dan Boff 2002; Choe dan Min 2006). Pembentukan oksigen singlet tertinggi pada minyak zaitun ekstra murni terjadi akibat aktivitas klorofil-a dan feofitin-a pada panjang gelombang 417 dan 668 nm (Jung et al. 2011). Penelitian foto-oksidasi menggunakan cahaya flouresen menunjukkan bahwa paparan cahaya intensitas tinggi mampu menyebabkan penurunan mutu pada minyak kelapa murni (Rukmini dan Rahardjo 2010), zaitun murni (Rahmany dan Csallany 1998; Psomiadou dan Tsimidou 2002), bunga matahari (Choe 2013), dan campuran zaitun dan perilla (Kim dan Choe 2012; 2013). Sampai saat ini penelitian yang mengkaji stabilitas foto-oksidatif sekaligus peranan komponen minor dalam MSM belum pernah dilaporkan.
Melihat keunggulan dan potensi MSM sebagai pangan fungsional, perlu dilakukan kajian stabilitas foto-oksidatif MSM terkait faktor-faktor yang mempengaruhinya, antara lain intensitas cahaya dan kandungan komponen minor terutama tokoferol, karoten, dan klorofil dalam MSM. Pada penelitian ini sampel MSM diekspos cahaya flouresen intensitas tinggi untuk mempercepat reaksi foto-oksidasi sehingga dapat menghitung parameter kinetikanya. Penggunaan cahaya flouresen dilakukan dengan pertimbangan bahwa produk MSM diperdagangkan dalam kemasan transparan yang mendapat paparan cahaya flouresen terutama selama penyimpanan dan display di retailer. Hubungan antara intensitas cahaya dan laju fotodegradasi serta stabilitas MSM dipelajari menggunakan pendekatan nilai zi, yang
menunjukkan ketergantungan laju perubahan komponen minor dan stabilitas MSM terhadap intensitas cahaya selama foto-oksidasi.
Perumusan Masalah
Minyak sawit merah memiliki potensi sebagai pangan fungsional, sehingga penelitian stabilitas foto-oksidatif terkait faktor-faktor yang mempengaruhinya, antara lain intensitas cahaya dan kandungan komponen minor terutama tokoferol, karoten, dan klorofil perlu dikaji lebih mendalam. Beberapa masalah yang diangkat pada penelitian ini adalah sejauhmana intensitas cahaya berpengaruh terhadap perubahan komponen minor dan stabilitas MSM selama foto-oksidasi, bagaimana menghitung kinetika dan ketergantungan laju fotodegradasi komponen minor dan stabilitas MSM terhadap intensitas cahaya, dan bagaimana peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas foto-oksidatif MSM.
Tujuan Penelitian
kinetika perubahan komponen minor dan stabilitas MSM selama foto-oksidasi; dan (3) mempelajari peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas foto-oksidatif MSM.
Manfaat Penelitian
Hasil penelitian memberikan informasi pengaruh intensitas cahaya, parameter kinetika, serta peranan tokoferol, tokotrienol, -karoten, dan klorofil terhadap stabilitas MSM selama foto-oksidasi. Informasi ini dapat menjadi masukan dalam merancang proses pengolahan MSM, mulai dari penanganan pasca panen buah di kebun, pengemasan, dan penyimpanan. Upaya ini mendukung komersialisasi MSM sebagai produk pangan fungsional. Selain itu, hasil penelitian ini diharapkan dapat membuka peluang alternatif pemanfaatan minyak sawit merah maupun komponen minornya yang lebih luas terutama dalam bidang pangan.
Ruang Lingkup Penelitian
2
TINJAUAN PUSTAKA
Minyak Sawit Merah
Minyak sawit merah (MSM) merupakan minyak dari sabut buah sawit (Elaeis quineensis) yang dimurnikan tanpa proses pemucatan dan dalam kondisi terkontrol untuk mempertahankan kandungan karotenoidnya. Minyak sawit merah ini diproduksi karena proses pemurnian minyak sawit secara konvensional tidak hanya menyebabkan minyak menjadi tidak berasa dan berwarna, namun terjadi penurunan sekitar 60-80% kandungan karoten dan 10-35% mikronutrien seperti tokol dan sterol sebagai akibat kondisi proses ekstrim di atas suhu 200 °C (Mayamol et al. 2007).
Beberapa teknologi proses telah dikembangkan untuk menghasilkan MSM skala pilot plant. Mayamol et al. (2007) mengembangkan proses netralisasi CPO diikuti kristalisasi dengan kecepatan pendinginan dan tekanan vakum terkontrol menghasilkan netralisasi dan winterisasi palm olein (WPOn) dengan kandungan lebih dari 80% karoten (- dan -karoten 445 mg/kg), 85% tokol (739 mg/kg), dan 65% sterol alami (428 mg/kg). Mas’ud (β007) telah mengoptimasi proses
degumming dengan memanaskan CPO hingga 80 °C, menambahkan larutan asam
fosfat 85% sebanyak 0.15% berat CPO sambil diaduk selama 15 menit. Setelah
degumming, dilakukan proses deasidifikasi menggunakan larutan NaOH 11.1% pada
suhu 59 °C selama 20 menit menghasilkan neutralized red palm oil (NRPO) dengan kandungan -karoten 390 mg/kg. Menurut Widarta (2008) dan Widarta et al. (2012), proses deasidifikasi menggunakan larutan NaOH 11.1% dan excess 17.5% CPO pada suhu 61±2 °C selama 26 menit memberikan recovery karoten terbaik sebesar 87.30%. Riyadi (2009) menyatakan bahwa proses deodorisasi dengan sistem batch
dalam tangki deodorizer pada suhu 140 °C selama 1 jam dengan laju alir gas N2 20
L/jam dan tekanan 20 mmHg direkomendasikan sebagai kondisi deodorisasi terbaik karena mampu mempertahankan karoten hampir 70% (375.33 mg/kg) dan mereduksi odor hingga 67%.
Kandungan karoten yang paling banyak dalam MSM adalah -karoten yang yang dapat dikonversi menjadi vitamin A dan memainkan peranan penting dalam proses visual, diferensiasi epitel seluler, dan regulasi genetik. Konversi -karoten menjadi vitamin A melibatkan pemotongan secara oksidatif oleh enzim 15,15’ -dioxygenase dalam usus menjadi dua molekul vitamin A, senyawa isoprenoid dengan cincin beranggotakan 6 karboksilat dan 11 karbon rantai samping (Fernández-García et al. 2011). Gambar 1 menunjukkan konversi -karoten menjadi retinol.
(Zagrѐ et al. 2003). Dua penelitian di Tanzania menunjukkan bahwa konsumsi MSM pada wanita hamil dan menyusui dapat meningkatkan kadar provitamin A dalam air susu dan serum ibu (Lietz et al. 2001; 2006). Studi tunggal di Honduras mengkonfirmasikan bahwa asupan MSM pada ibu mampu memperbaiki kadar karotenoid serum provitamin A pada bayi (Canfield et al. 2001).
Gambar 1 Konversi -karoten (1) menjadi retinol (3) (Fernández-García et al. 2011) MSM juga merupakan sumber vitamin E (953-955 mg/kg) dalam bentuk α -tokoferol atau -T (171-242 mg/kg), α-tokotrienol atau -T3 (266-294 mg/kg), -tokotrienol atau -T3 (367 mg/kg), dan -tokotrienol atau -T3 (80-126 mg/kg) (Yie
et al. 2011; Dauqan et al. 2011). Vitamin E dalam minyak sawit telah dilaporkan memiliki potensi sebagai antioksidan biologis, melindungi terhadap stress oksidatif dan proses penyempitan pembuluh darah (Mukherjee dan Mitra 2009), serta melawan perkembangan penyakit aterosklerosis pada model tikus aterogenik (Idris et al. 2014). Kandungan karoten, tokoferol, dan komponen minor lainnya dalam MSM diperlihatkan pada Tabel 1.
Tabel 1 Kandungan komponen minor dalam minyak sawit merah
Komponen Komposisi
mg/kg (Gee 2007) mg/kg (Gibon et al. 2007)
Karotenoid 500- 700 500-2000
Tokoferol dan tokotrienol 600- 700 600-1000
Squalen 200- 500 200- 500
Non-terpenoid hidrokarbon 30- 50 30- 50
Sterol 362- 627 500
Triterpenoid alcohol 40- 80 40- 80
Metilsterol 48- 80 40- 80
Dolikol+poliprenol 81
Ubiquinon 10- 80 10- 80
Phospolipid 5- 130
Glikolipid 1033-3780
Tabel 2 Komposisi asam lemak minyak sawit merah
Asam lemak jenuh 48.29-48.72 50.14-50.96 39.46 44.23 50.78
Asam palmitTAGat 16:1 0.00- 0.40 0.00- 0.30 0.12 Asam oleat 18:1cis 37.40-44.10 36.70-40.80 46.880.08 44.800.13 36.85
Asam eikonosenat 20:1 0.11
Asam lemak tidak jenuh
rantai tunggal 39.95-41.60 38.38-38.96 46.42 44.954 37.32
Asam linoleat 18:2 8.70-12.50 9.40-11.90 13.880.02 10.800.15 11.54
Tabel 3 Karakteristik fisiko-kimia minyak sawit dan minyak sawit merah
Parameter Minyak sawit Minyak sawit
merah Minyak sawit
mentah
Fraksi olein Fraksi stearin
1 2 1 2 1 2 3 4
1:PORIM 1988, 2:Edem (2002), 3:Mayamol et al. (2007), 4:Widarta (2012)
Foto-oksidasi Minyak/Lemak
Sifat Kimia Oksigen Triplet dan Singlet
sementara oksigen triplet memiliki putaran paralel 2(1/2+1/2)+1 = 3 (Choe dan Min 2006). Orbital molekul oksigen triplet dan singlet ditunjukkan Gambar 2.
(A) (B)
Gambar 2 Obital molekul (A) oksigen triplet dan (B) oksigen singlet (Min dan Boff 2002)
Oksigen singlet memiliki dua elektron dengan spin berlawanan. Kondisi ini menyebabkan tolakan elektronik yang lebih besar dan menciptakan dua keadaan tereksitasi. Energi oksigen singlet 22.4 kkal/mol di atas keadaan dasar. Tingginya energi oksigen singlet bertanggung jawab terhadap cepatnya inisiasi oksidasi lemak. Selain itu, oksigen singlet juga mencari elektron dari komponen senyawa kaya elektron untuk menempati orbital molekul yang kosong karena karakteristiknya yang sangat elektrofilik. Ikatan ganda dapat langsung bereaksi dengan oksigen singlet karena sifatnya yang kaya elektron (Min dan Boff 2002). Laju reaksi oksigen singlet dengan asam lemak oleat, linoleat, dan linolenat lebih cepat 30,000, 1,450, dan 909 kali dibandingkan oksigen triplet (Park et al. 2011). Rangkuman karakteristik kimia oksigen triplet dan singlet ditunjukkan pada Tabel 4 berikut ini.
Tabel 4 Perbandingan karakteristik oksigen triplet dan singlet Karakteristik Oksigen triplet Oksigen singlet
Tingkat energi 0 22.4 kkal/mol
Bentuk asal Diradikal Non-radikal, elektrofilik
Reaksi Komponen radikal Komponen kaya elektron
Sumber : Min dan Boff (2002)
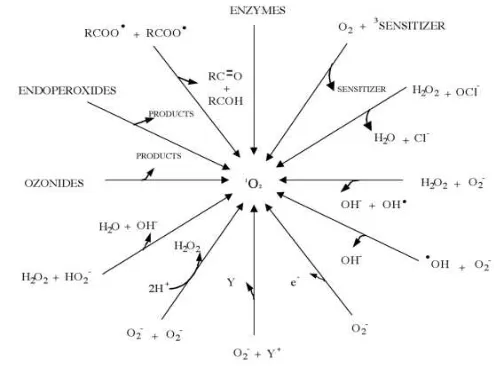
Gambar 3 Berbagai jalur pembentukan oksigen singlet (Min dan Boff 2002) Pembentukan Oksigen Singlet
Mayoritas oksigen singlet terbentuk dari reaksi photosensitizer triplet tereksitasi dengan oksigen triplet. Metilen biru, klorofil, hematoporfirin, dan riboflavin merupakan photosensitizer yang menyerap energi cahaya untuk membentuk oksigen singlet (Min dan Boff 2002). Oksigen singlet dihasilkan oleh mekanisme photosensitizer tereksitasi (1Sen*) setelah terpapar cahaya.
Photosensitizer singlet tereksitasi memiliki umur hidup pendek dan dapat
bereaksi melalui dua jalur ; (1) mengalami pengembalian ke kondisi ground state
dengan mengeluarkan sinar fluoresen atau energi panas, dan (2) mekanisme intra-system crossing (ISC) membentuk photosensitizer triplet tereksitasi (3Sen*). Pembentukan oksigen singlet dengan adanya photosensitizer dan oksigen triplet pada kondisi cahaya ditunjukkan Gambar 4.
Ganbar 4 Pembentukan oksigen singlet dengan adanya photosensitizer, cahaya, dan oksigen triplet (Choe dan Min 2005)
Boff 2002). Komponen radikal (R.) kemudian bereaksi dengan oksigen triplet radikal untuk membentuk radikal peroksil (ROO.). 3Sen* pada jalur tipe I juga dapat bereaksi dengan 3O2 membentuk anion superoksida melalui transfer elektron ke
oksigen singlet. Reaksi photosensitizer triplet dan oksigen triplet menghasilkan anion superoksida kurang dari 1%. Laju alir tipe I tergantung pada jenis dan konsentrasi photosensitizer serta substrat (Min dan Boff 2002).
Gambar 5 Pembentukan sensitizer triplet tereksitasi (3Sen*) dan reaksinya dengan substrat melalui jalur tipe I dan II (Min dan Boff 2002)
Gambar 5 menunjukkan bahwa photosensitizer triplet tereksitasi (3Sen*) juga dapat bereaksi dengan oksigen triplet membentuk oksigen singlet melalui jalur tipe II. Lebih dari 99% reaksi antara photosensitizer triplet dan oksigen triplet menghasilkan oksigen singlet (Min dan Boff 2002). Laju reaksi jalur tipe II umumnya tergantung pada kelarutan dan konsentrasi oksigen dalam sistem pangan. Oksigen lebih larut dalam sistem non-polar dibandingkan dalam air. Begitu oksigen dalam sistem menghilang akan mendorong perubahan mekanisme dari tipe II ke tipe I. Pada minyak kedelai, pembentukan oksigen singlet yang diinduksi klorofil mendorong terjadinya reaksi jalur tipe II (Min dan Boff 2002).
Foto-oksidasi
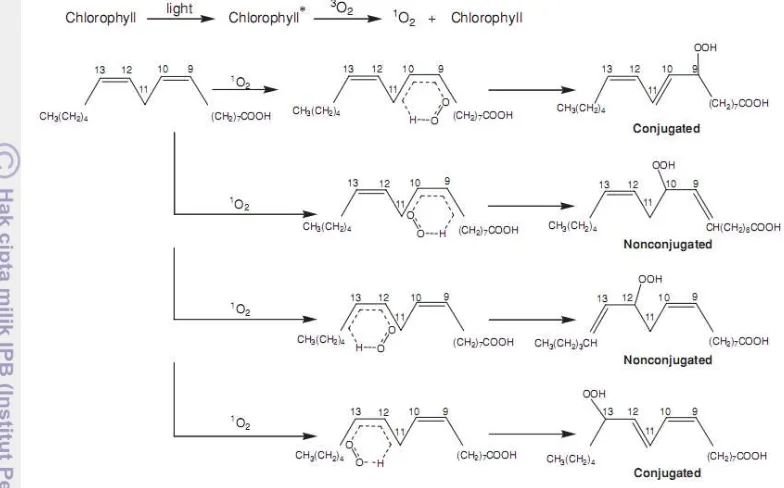
Cahaya pada panjang gelombang mendekati ultraviolet atau sinar tampak mempercepat oksidasi lemak terutama dengan adanya sensitizer. Cahaya mengeksitasi sensitizer sehingga berada pada keadaan triplet yang menyebabkan terjadinya oksidasi, baik melalui mekanisme tipe I dan tipe II (Scrimgeour 2005). Menurut Jung et al. (2011), pembentukan oksigen singlet tertinggi dalam minyak zaitun ekstra murni terjadi pada panjang gelombang 417 nm dan 668 nm, dimana feofitin-a dan klorofil-a adalah komponen yang paling bertanggung jawab.
oksigen singlet keduanya konjugasi dan non kojugasi (Choe dan Min 2009). Reaksi foto-oksidasi pembentukan hidroperoksida diperlihatkan Gambar 6.
Gambar 6 Reaksi foto-oksidasi pembentukan hidroperoksida (Choe dan Min 2009) Produk Oksidasi Primer dan Sekunder
Gambar 7 Mekanisme dekomposisi hidroperoksida asam lemak (Choe dan Min 2006).
Karotenoid
Karakteristik Kimia Karotenoid
Karotenoid merupakan pigmen organik tetraterpenes kaya asam lemak tidak jenuh hasil biosintesis dari delapan unit isoprena. Karotenoid alami lebih banyak terdapat dalam bentuk trans. Karotenoid dibagi menjadi dua kelas utama: karoten
polyene hidrokarbon dan xanthophylls yang mengandung oksigen. Oksigen dalam
xanthophylls terdapat dalam bentuk hidroksil, metoksil, karboksil, keto, atau epoksi (Lee et al. 2004). Likopen, -, -, dan -karoten merupakan contoh karoten, sedangkan lutein, bixin, kapxantin, kriptoxantin, neoxantin, violaxantin, dan zeaxantin merupakan contoh xanthophylls.
Tabel 5 Profil karoten minyak sawit yang diekstrak dari E. quineensis, E. oleifera,
Sumber : Sambanthamurthi et al. (2000); M: E. Oleifera (Melanococca), P: E. Quineesis (pisifera), D: E. Quineensis (dura), T: E.quineensis (tenera) DxP
Menurut Zeb (2012), -karoten memegang peranan penting selama oksidasi minyak dan lemak. Karakteristik -karoten dalam proses oksidasi sangat tergantung pada konsentrasinya dalam media lemak, kondisi gelap atau cahaya, dan ada tidaknya antioksidan atau pro-oksidan lain. Penelitian yang dilakukan oleh Puspitasari-Nienaber (2002) menunjukkan bahwa -karoten dalam MSM relatif stabil selama penyimpanan kondisi gelap (auto-oksidasi) dan mengalami degradasi mengikuti kinetika reaksi ordo nol dengan waktu paruh (t1/2) selama 12 bulan.
Karotenoid MSM memiliki t1/2 selama 12, 4 dan 1.3 bulan pada suhu penyimpanan
25, 37 dan 60 °C, jika tidak ada keberadaan tokoferol kinetika degradasi karotenoid berubah menjadi ordo 1 dengan t1/2 berkurang menjadi 18 jam. Produk oksidasi
berupa epoksi -karoten memiliki kemampuan konversi vitamin A yang kurang efisien dan bersifat mutagen pada S. typhimurium. Menurut Ayustaningwarno (2010), proses oksidasi pada suhu tinggi (60, 75, dan 90 °C) meningkatkan laju degradasi karoten mengikuti kinetika reaksi ordo 1 masing-masing dengan konstanta laju degradasi (nilai k) 9.1310-3, 2.1510-2, dan 4.7910-2 per hari (Ayustaningwarno 2010). Namun, menurut Sampaio et al. (2013), pemanasan pada suhu yang lebih tinggi (170 sampai 230 °C) mampu mempercepat degradasi karoten MSM mengikuti kinetika reaksi ordo 1.3 dengan energi aktivasi 109.4 kJ/mol.
Gambar 8 Mekanisme degradasi termal -karoten dalam minyak jagung (Zeb dan Murkovic 2011)
Peranan Karotenoid selama Foto-oksidasi
Beberapa penelitian menyatakan karotenoid memperlihatkan aktivitas antioksidan selama reaksi foto-oksidasi, namun beberapa penelitian lain menyatakan bahwa karotenoid tidak memiliki antivitas antioksidan terutama pada kondisi auto-oksidasi (gelap) bahkan bersifat pro-oksidan pada konsentrasi dan suhu tinggi. Menurut Bulton dan Ingold (1984), karotenoid merupakan antioksidan yang unik, efektif hanya pada tekanan oksigen parsial kurang dari 150 torr (tekanan oksigen di bawah udara normal), dimana karotenoid menangkap radikal dengan mentransfer hidrogen. Pada tekanan oksigen tinggi, karotenoid kehilangan aktivitas antioksidannya dan menunjukkan autokatalitik dan efek pro-oksidan, terutama pada konsentrasi relatif tinggi.
Menurut Lee et al. (β00γ), -karoten tidak bekerja sebagai antioksidan dan tidak mampu mencegah peroksidasi minyak kedelai pada kondisi gelap suhu 55 °C.
Βeta-karoten memiliki standar potensial reduksi satu elektron 1060 mV lebih tinggi daripada radikal alkil, peroksil dan alkoksil masing-masing sebesar 600, 1000 dan 1600 mV, sehingga tidak mampu mendonorkan atom hidrogen. Standar potensial
reduksi satu elektron -karoten yang lebih tinggi daripada asam lemak tidak jenuh
rantai panjang (600 mV) menyebabkan -karoten mampu mengabstraksi hidrogen asam lemak tidak jenuh dan menghasilkan radikal asam lemak bebas baru. Kation
radikal -karoten sendiri bereaksi dengan radikal alkil, alkoksil atau peroksil minyak kedelai ataupun oksigen triplet menyebabkan oksidasi lebih lanjut.
Namun, -karoten dapat menyumbangkan hidrogen ke radikal hidroksil yang memiliki potensial reduksi lebih tinggi (2310 mV) dan menghasilkan radikal karoten. Radikal karoten merupakan senyawa cukup stabil melalui delokalisasi elektron tidak berpasangan pada sistem poliena terkonjugasinya. Pada konsentrasi oksigen rendah, karoten radikal dapat bereaksi dengan radikal lainnya seperti radikal peroksil dan membentuk produk non-radikal (Burton dan Ingold 1984).
Pada kondisi tereksitasi cahaya, -karoten mengalami isomerisasi reversibel dari trans- menjadi 9-cis-, 13-cis-, 15-cis-, dan 13,15-di-cis--karoten (Chen dan Huang 1998). Menurut Hernandez-Marin et al. (2013), isomer 15-cis--karoten memiliki stabilitas relatif paling rendah dan kemampuan mentransfer hidrogen ke radikal peroksil paling tinggi diikuti isomer 9-cis-, 13-cis, dan trans--karoten. Kondisi ini memungkinkan -karoten juga memiliki aktivitas antioksidan menangkap radikal bebas melalui transfer hidrogen pada kondisi foto-oksidasi.
Kajian Jung dan Min (1991) menyatakan bahwa karotenoid yang ditambahkan ke dalam minyak kedelai bertindak sebagai quencher oksigen singlet untuk menurunkan foto-oksidasi yang disensitasi oleh klorofil. Semakin banyak jumlah ikatan ganda konjugasi pada karotenoid, efek perlindungan terhadap oksidasi oksigen singlet semakin meningkat. Menurut Kim dan Min (2008), 1 molekul -karoten mampu melakukan quenching 250–1000 molekul oksigen singlet pada kecepatan 1.31010 M/s melalui transfer energi. Energi eksitasi elektron dari oksigen singlet ditransfer ke singlet karotenoid (1CAR) menghasilkan kondisi triplet karotenoid (3CAR) dan oksigen triplet disebut quenching oksigen singlet. Energi juga ditransfer dari kondisi triplet sensitizer tereksitasi (3Sen *) ke kondisi singlet karotenoid (1CAR), yang disebut quenching triplet sensitizer. Triplet karotenoid dengan mudah dapat kembali ke singlet karotenoid melalui hamburan panas.
+ hamburan panas
Beta-karoten merupakan inhibitor foto-oksidasi yang kuat pada intensitas cahaya mencapai 5340 lux suhu 2 °C dalam minyak zaitun murni dengan keberadaan feofitin-a sebagai photosensitizer. Namun, aktivitas antioksidan -karoten menurun pada suhu 40 °C akibat kerusakan termal yang sangat cepat. Tingkat foto-oksidasi minyak zaitun murni tergantung pada 3 faktor, yaitu intensitas cahaya flouresen, waktu, dan suhu (Rahmani dan Csallany 1998).
Penambahan -karoten dalam minyak biji evening primrose juga dapat melindungi minyak terhadap oksidasi yang disensitasi oleh klorofil-a. Penambahan -karoten menyebabkan degradasi klorofil menjadi lebih rendah akibat quenching
triplet klorofil dan pembentukan produk oksidasi malonat dialdehyde menjadi lebih lambat (Hanyz et al 2006).
Namun, hasil penelitian Yanishlieva et al. (2001) mengatakan bahwa β
-apo-8'-carotenoic acid (CA), etil β-apo-8'-carotenoate (EC), dan
-apo-8'-carotenoylglycerol (CG) tidak bersifat antioksidan dalam minyak biji bunga
Penelitian Haila dan Heinonen (1994) yang mengkaji pengaruh -karoten dan -tokoferol pada foto-oksidasi suhu 25 °C dalam minyak rapeseed menunjukkan bahwa -karoten bertindak sebagai pro-oksidan, akan tetapi kombinasi 20 µg/g -karoten dan 50 µg/g -tokoferol lebih bersifat melindungi terhadap oksidasi daripada secara sendiri-sendiri. Mekanisme sinergis penghambatan oksidasi terkait penyaringan cahaya oleh -karoten pada panjang gelombang 400-500 nm dan efek penghambatan fotoperoksida oleh -tokoferol.
Namun, -karoten dalam MSM (524 mg/kg karotenoid, 242 mg/kg -T, 266 mg/kg -T3, 367 mg/kg -T3, 80 mg/kg -T3) pada kondisi auto-oksidasi (suasana gelap, suhu 30 °C) lebih cepat mengalami oksidasi dibandingkan dengan yellow palm olein (tanpa karotenoid, 237 mg/kg -T, 265 mg/kg -T3, 349 mg/kg -T3, dan 77 mg/kg -T3) dalam campuran minyak ikan (4:1 b/b). Hal ini menunjukkan bahwa karotenoid dalam MSM tidak mampu memberikan perlindungan selama auto-oksidasi (Yie et al. 2011). Peranan -karoten MSM selama foto-oksidasi belum pernah dilaporkan.
Konsentrasi dan kondisi oksidasi yang berbeda menyebabkan perubahan fungsi karotenoid. Hasil penelitian Schroeder et al. (2006) menunjukkan bahwa konsentrasi -karoten dalam MSM mengalami penurunan 5 mg/kg per penggorengan atau 52.3% setelah 60 kali penggorengan suhu 161-165 °C. Hasil pengujian kestabilan rancimat pada suhu 120 °C menunjukkan bahwa minyak sawit merah lebih stabil dibandingkan yelllow palm oil. Campuran -karoten dan -T3, -T3, atau -T memperlihatkan aktivitas antioksidan yang berinteraksi sinergis pada konsentrasi -karoten yang lebih rendah daripada total fenol (1:10 atau 1:2). Efek sinergis antara tokoferol dan -karoten selama penggorengan adalah -karoten melindungi komponen tokol sebagai substrat utama radikal lemak atau mekanisme regenerasi fenol teroksidasi oleh karoten. Sedangkan hasil pengamatan menggunakan laser flash photolysis menunjukkan bahwa -karoten dapat diregenerasi dari kation -karoten radikal oleh -T, -T3, dan -T3.
Tokoferol
Karakteristik Kimia Tokoferol
Tabel 6 Komposisi vitamin E dalam minyak sawit merah
Vitamin E Komposisi (mg/kg)
Schroeder et al.
(2006)
Daugan et al.
(2011)
Yi et al. (2011)
-Tokoferol (-T) 288 171 242
-Tokotrienol (-T3) 336 294 266
-Tokotrienol (-T3) 471 367 367
-Tokotrienol (-T3) 166 126 80
Total 1260 953 955
Tokoferol merupakan antioksidan paling populer digunakan dalam makanan, terutama minyak goreng karena karakteristik larut lemaknya. Semua homolog tokoferol (-, -, -, dan -) mengandung cincin chromanol dan ekor phytyl jenuh. Homolog memperlihatkan jumlah kelompok metil yang berbeda pada posisi 5, 7, dan 8 pada cincin chromanol. Sedangkan tokotrienol mengandung cincin chromanol dan homolog yang sama dengan tokoferol, namun ekor phytyl memiliki tiga ikatan tidak jenuh. Aktivitas antioksidan tokoferol maupun tokotrienol didasarkan pada struktur cincin chromanol, sementara ekor phytyl berperan pada sifat lipofilik yang larut
edible oil. Tokotrienol dikatakan memiliki karakteristik antioksidan lebih potensial daripada -tokoferol karena rantai sisi tidak jenuhnya yang menyebabkan penetrasi lebih efisien ke dalam jaringan yang memiliki lapisan asam lemak jenuh seperti otak, hati, dan membran sel (Sen et al. 2006).
Gambar 9 Struktur kimia tokoferol dan tokotrienol
Gambar 10 Reaksi oksidasi tokoferol (Krieger-Liszkay dan Trebst 2006) Peranan Tokoferol selama Foto-oksidasi
Beberapa penelitian membuktikan bahwa tokoferol memiliki aktivitas antioksidan, namun beberapa penelitian lain membuktikan bahwa tokoferol memberikan efek pro-oksidan terutama dalam bentuk teroksidasi dan konsentrasi tinggi. Aktivitas antioksidan tokoferol dalam minyak nabati dan lemak babi mengikuti urutan -> - atau ->-tokoferol (Choe dan Min 2006; King et al. 2011). Alpa-tokoferol terbukti merupakan antioksidan paling baik karena kemampuannya menyumbang hidrogen, potensial reduksi, dan energi ikatan disosiasi terendah (Kim
et al. 2007). Energi ikatan disosiasi menunjukkan kekuatan ikatan OH pada -, -, -, dan -tokoferol yang terhitung masing-masing sebesar 75.8, 77.7, 78.2, dan 79.8 kcal/mol (Wright et al. 2001). Berbeda dengan tokoferol, aktifitas antioksidan tokotrienol jarang dilaporkan. Penelitian terkini menunjukkan bahwa aktivitas antioksidan tokotrienol selama auto-oksidasi suhu 55 °C dalam lemak babi
meningkat dengan urutan α-<-<-<-tokotrienol. Hal ini disebabkan karena aktivitas antioksidan tokotrienol tidak hanya tergantung pada reaktivitas kimia (konstanta disosiasi asam, potensial reduksi, energi ikatan disosiasi), tetapi juga pada konsentrasi, suhu, cahaya, jenis substrat, pelarut, dan ada tidaknya bahan kimia lain (Kim 2014).
Tokoferol bertindak sebagai antioksidan dengan menyumbang atom hidrogen ke radikal peroksil selama oksidasi (Bartee et al. 2007). Tokoferol memiliki potensial reduksi rendah 300-400 mv yang dengan mudah dapat menyumbangkan atom hidrogen kelompok 6-hidroksi pada cincin kromannya ke radikal peroksil dan menangkap radikal peroksil (1000 mv). Laju reaksi antara tokoferol dan radikal peroksil adalah 107 M/s, 105-106 kali lebih cepat daripada asam lemak dengan radikal peroksil. Akibatnya, asam lemak tidak dapat bereaksi dengan radikal peroksil, sehingga langkah propagasi dihentikan (Choe dan Min 2005).
Aktivitas antioksidan tokoferol juga diperlihatkan dalam reaksi foto-oksidasi minyak kedelai (Jung et al. 1991; Hall dan Cuppett 2000), zaitun (Rahmani dan Csallany 1998), rapeseed (Haila dan Heinonen 1994), alga (Chang 2011), canola (Lee dan Choe 2011), dan lemak babi (King 2007). Jung et al. (1991) menyatakan bahwa -tokoferol melakukan quenching oksigen singlet pada foto-oksidasi minyak kedelai dengan laju 2.7107 M/s melibatkan transfer muatan, dimana aktivitas tertinggi isomer -, dikuti -, dan -tokoferol. Tokoferol dapat membentuk kompleks transfer muatan melalui donor elektron. Kompleks transfer mengalami
intersystem crossing untuk membentuk oksigen triplet dan tokoferol. Mekanisme ini merupakan quenching fisik karena tidak melibatkan reaksi kimia antara tokoferol dan oksigen singlet. Laju reaksi α-tokoferol menunjukkan laju reaksi tertinggi (2.1108 M/s), diikuti -tokoferol (1.5×108 M/s), -tokoferol (1.4×108 M/s), dan δ-tokoferol (5.3×107 M/s). Tokoferol juga bereaksi ireversibel dengan singlet oksigen melalui
quenching kimia dan menghasilkan tokoferol hidroperoksidienon, tokoferil kuinon, dan kuinon epoksida (Choe dan Min 2006).
Namun tokoferol dapat kehilangan aktivitas antioksidannya, bahkan dapat bertindak sebagai pro-oksidan dalam bentuk tokoferol teroksidasi pada lemak babi (Kim et al. 2007), konsentrasi lebih besar dari 250 mg/kg pada lemak babi (King 2007), 1500 atau 2000 mg/kg dalam minyak alga (Chang 2011). Tokoferol yang mengalami foto-oksidasi selama 48 jam pada suhu 28 °C dengan photosensitizer
metilen biru juga menunjukkan aktivitas pro-oksidan pada oksidasi gelap suhu 55 °C pada minyak kedelai, jagung, safflower dan zaitun (Chapman et al. 2009). Menurut Lampi et al. 1999, tokoferol sepertinya berpartisipasi dalam reaksi samping yang menghasilkan radikal bebas pada konsentrasi tinggi.
Radikal tokoferol yang dihasilkan setelah menyumbangkan atom hidrogen dapat lebih mengabstraksi atom hidrogen dari lemak atau hidroperoksida lemak untuk membentuk radikal alkil dan peroksil yang bertindak sebagai pro-oksidan akibat potensial reduksinya yang tinggi (Kim et al. 2007). Aktivitas pro-oksidan tertinggi ditunjukkan α-tokoferol diikuti - dan δ-tokoferol selama auto-oksidasi minyak kedelai (Jung dan Min 1990). Nilai ambang batas α-tokoferol sebagai pro-oksidan dalam oksidasi minyak zaitun 60-70 mg/kg (Choe dan Min 2006).
Radikal tokoferol terdegradasi dengan adanya molekul oksigen dan menghasilkan senyawa teroksidasi yang mengakibatkan hilangnya aktivitas antioksidan, terutama pada konsentrasi tinggi (Kim et al. 2007). Tokoferol yang teroksidasi pada konsentrasi tinggi membentuk berbagai radikal dan komponen senyawa tokoferol teroksidasi. Radikal dan senyawa teroksidasi, termasuk
-tocopherolquinone, 4a,5-epoksi--tocopherolquinone, dan 7,8-epoksi-
-tocopherolquinone telah ditemukan bertindak sebagai pro-oksidan dalam minyak kedelai selama penyimpanan (Kim et al. 2007). Gambar 11 menunjukkan mekanisme pro-oksidan dari tokoferol radikal dan berbagai senyawa tokoferol teroksidasi yang terbentuk.
Gambar 11 Mekanisme pro-oksidan tokoferol (Kim et al. 2007)
Photosensitizer Klorofil
atom magnesium yang terikat di bagian tengah. Klorofil larut dalam lemak akibat rantai fitol yang melekat pada salah satu cincin porfirin.
Gambar 12 Dekomposisi klorofil
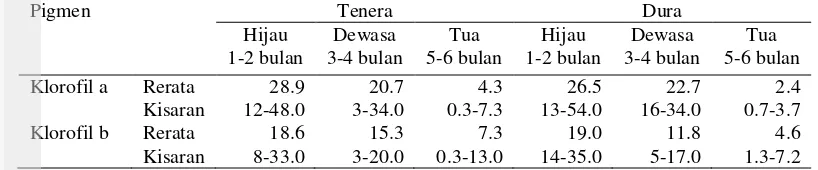
Proses perubahan pada buah E. quineensis menunjukkan klorofil yang tidak sepenuhnya hilang dalam buah matang. Buah hijau dan buah matang sawit Tenera dan Dura mengandung klorofil-a dan b dalam jumlah yang bervariasi (Tabel 7). Klorofil-a buah matang berkurang sekitar 80-90% sedangkan klorofil-b 50-75% dari buah muda (hijau). Pemurnian minyak secara fisik menghasilkan kadar klorofil CPO 800 µg/kg, klorofil sisa tidak ditemukan dalam produk pemurnian ulang minyak sawit (Sambanthamurthi et al. 2000).
Tabel 7 Kandungan klorofil (mg/kg) selama tahap perkembangan buah E. quineensis
Pigmen Tenera Dura
Hijau 1-2 bulan
Dewasa 3-4 bulan
Tua 5-6 bulan
Hijau 1-2 bulan
Dewasa 3-4 bulan
Tua 5-6 bulan Klorofil a Rerata 28.9 20.7 4.3 26.5 22.7 2.4 Kisaran 12-48.0 3-34.0 0.3-7.3 13-54.0 16-34.0 0.7-3.7 Klorofil b Rerata 18.6 15.3 7.3 19.0 11.8 4.6 Kisaran 8-33.0 3-20.0 0.3-13.0 14-35.0 5-17.0 1.3-7.2
Sumber : Sambanthamurthi et al. 2000
Usuki et al. (1984) menyatakan bahwa kandungan klorofil minyak nabati yang telah dimurnikan oleh produsen minyak Jepang meningkat dengan urutan minyak kedelai<jagung<safflower atau bunga matahari <rapeseed <kapas <palm olein. Rasio kandungan klorofil-a dan b adalah 70% dan 30%. Feofitin terdapat dalam proporsi lebih tinggi daripada klorofil, feofitin-a menunjukkan kandungan tertinggi sebesar 60% dan feofitin-b 15-25%. Rasio komposisi klorofil-a/klorofil-b/feofitin-a/feofitin-b terhitung 4:10:67:19.
selama 1 tahun dari CPO yang dikumpulkan dari pabrik dan pemurnian minyak di Malaysia, Tan et al. (2000) menganalisa total kandungan klorofil dalam 1300 sampel menggunakan teknik laser-induced berkisar 897-4000 µg/kg.
Klorofil bersifat sebagai photosensitizer, kelompok senyawa kimia yang menyerap cahaya untuk mengaktifkan atau mensensitasi oksigen molekuler menginduksi foto-oksidasi. Menurut Leet et al. (1997), kandungan klorofil sebanyak 0.065-1.330 mg/kg dalam minyak nabati dapat berperan sebagai sensitizer. Sedangkan menurut Belitz et al. (2009), kandungan klorofil 0.07-1.20 mg/kg dalam minyak nabati murni dapat mempercepat oksidasi, feofitin merupakan foto-oksidan terkuat karena kandungannya paling dominan dalam minyak rapeseed. Menurut Endo et al. (1984), klorofil mengkatalis reaksi oksidasi metil linoleat pada konsentrasi yang lebih besar 2.210-9 mol/g metil linoleat, feofitin memperlihatkan aktivitas pro-oksidan lebih tinggi daripada klorofil.
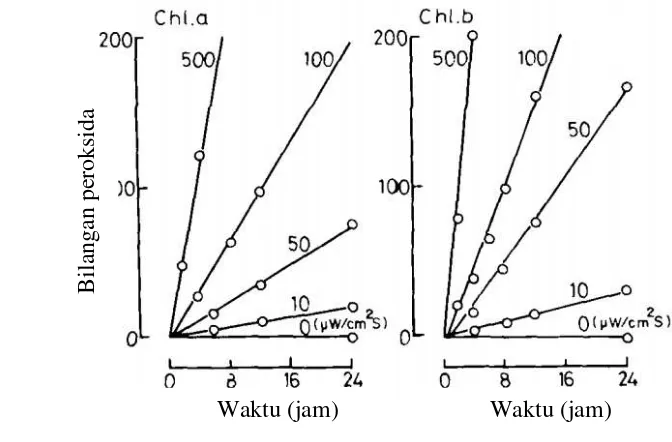
Oksidasi minyak kedelai yang dieskpos pada cahaya suhu kamar menunjukkan bahwa semakin tingginya campuran klorofil-a/feofitin-b (1:3 dan 10:3) menunjukkan semakin tinggi pula bilangan peroksida yang terbentuk (Usuki et al. 1984). Semakin tinggi suhu dan intensitas cahaya memperlihatkan aktivitas pro-oksidan klorofil yang semakin meningkat (Gambar 13 dan 14).
Gambar 13 Pengaruh suhu terhadap foto-oksidasi metil linoleat yang disensitasi oleh klorofil (Endo et al. 1984)
Waktu (jam)
B
il
anga
n
pe
Gambar 14 Pengaruh intensitas cahaya terhadap foto-oksidasi metil linoleat yang disensitasi klorofil (Endo et al. 1984)
Laju degradasi selama foto-oksidasi (selanjutnya disebut fotodegradasi) klorofil dalam sistem model metil stearat, oleat, linoleat (Chen dan Liu 1998), aseton, dan heksana yang mengandung trans -karoten (Chen dan Huang 1998) telah dipelajari. Laju fotodegradasi klorofil dalam minyak zaitun murni (Rahmani dan Csallany 1998; Psomiadou dan Tsimidou 2002), serta campuran minyak zaitun dan perilla (Kim dan Choe 2012; 2013) mengikuti model kinetika ordo 1 dengan nilai k fotodegradasi yang lebih rendah daripada dalam sistem model metil stearat, oleat, linoleat (Chen dan Liu 1998), aseton, dan heksana yang mengandung trans -karoten (Chen dan Huang 1998). Berdasarkan hasil penelitian tersebut, nilai k fotodegradasi klorofil dipengaruhi oleh kandungan komponen minor terutama karoten, tokoferol, dan fenolik.
Foto-oksidasi pada minyak zaitun murni menyebabkan berkurangnya kandungan senyawa fenolik polar, feofitin-a, dan -tokoferol, tetapi tidak pada kandungan karotenoidnya (Psomiadou dan Tsimidou 2002). Paparan cahaya pada intensitas 4000 lux selama 5 jam menyebabkan penurunan kandungan klorofil-a dalam minyak kelapa murni yang signifikan dibandingkan dengan minyak kelapa murni yang ditutupi aluminium foil (Rukmini et al. 2011). Sedangkan menurut Hall dan Cuppett (2000), klorofil tidak berpengaruh terhadap auto-oksidasi (gelap) minyak kedelai.
Kinetika Reaksi Kimia
Kinetika reaksi kimia adalah pengukuran kecepatan reaksi dan analisis data percobaan untuk memperoleh sejumlah informasi sistematik yang dapat menerangkan informasi kinetika reaksi tersebut. Informasi tersebut dapat digunakan untuk mengetahui faktor yang mempengaruhi reaksi antara lain (1) kecepatan reaksi; (2) ketergantungan reaksi pada konsentrasi yang disebut ordo reaksi; (3) persamaan yang memberi informasi mengenai ketergantungan kecepatan terhadap konsentrasi
B
il
anga
n pe
roksida