PENETAPAN DOSIS PEMAKAIAN TAWAS SEBAGAI
KOAGULAN UNTUK MENJERNIHKAN AIR BAKU
PDAM TIRTANADI SUNGGAL
TUGAS AKHIR
Oleh :
IRA RAHMAWATI 052410035
PROGRAM DIPLOMA III ANALIS FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDANLEMBAR PENGESAHAN
PENETAPAN DOSIS PEMAKAIAN TAWAS SEBAGAI
KOAGULAN UNTUK MENJERNIHKAN AIR BAKU
PDAM TIRTANADI SUNGGAL
TUGAS AKHIR
Diajukan Untuk Memenuhi Salah Satu Syarat untuk Memproleh Gelar Ahli Madya Pada Program Diploma III Analis Farmasi
Fakultas Farmasi Universitas Sumatera utara
Oleh :
IRA RAHMAWATI 052410035
Medan, Mei 2008 Disetujui Oleh:
Dosen Pembimbing,
Drs. Agusmal Dalimunthe, MS. Apt NIP 131 286 002
Disahkan Oleh Dekan,
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Allah Swt yang telah
melimpahkan rahmad, karunia, dan hidayah-Nya sehingga penulis dapat
menyelesaikan Tugas Akhir ini yang merupakan salah satu syarat untuk
menyelesaikan program pendidikan Diploma III Analis Farmasi di Universitas
Sumatera Utara.
Selanjutnya penulis mengucapkan terima kasih yang sebesar-besarnya
kepada Ayahanda dan Ibunda tercinta yang penuh kesabaran memberikan
dorongan, nasehat, serta doa, dan tidak lupa pula pada saudara-saudara yang telah
dukungan dan semangat hingga penulis bisa menyelesaikan Tugas Akhir dengan
baik.
Dalam penyusunan Tugas Akhir ini penulis telah banyak mendapat
bantuan, bimbingan, nasehat serta petunjuk dari berbagai pihak, untuk itu pada
kesempatan ini penulis tidak lupa menyampaikan rasa terima kasih yang tulus dan
ikhlas kepada:
1. Bapak Drs. Agusmal Dalimunthe, MS. Apt., selaku dosen pembimbing
penulis yang telah banyak membimbing penulis hingga selesainya tugas akhir
ini.
2. Bapak Prof. Dr. Jansen Silalahi, M. App. Sc, Apt, selaku koordinator Program
Diploma III Analis Farmasi Fakultas Farmasi Universitas sumatera Utara.
3. Bapak Prof. Dr. Sumadio Hadisahputra, Apt, selaku Dekan Fakultas Farmasi
Universitas Sumatera Utara.
4. Dosen-Dosen Farmasi beserta staf yang telah membimbing dan membantu
penulis selama perkuliahan di Diploma III Analis Farmasi Universitas
sumatera Utrara.
5. Bapak Drs. Asan Haloho, selaku Kepala Bagian Produksi di PDAM Tirtanadi
Instalasi Sunggal
6. Bapak Iwan Setiawan selaku Kepala Bagian Pengendalian Mutu di PDAM
7. Abang, kakak, serta adik saya yang telah memberikan semangat dan doa serta
material dalam menyelesaikan tugas akhir ini.
8. Sahabatku yang juga fartner pada masa PKL (Eva) yang telah mengalami
susah dan senang selama 1 bulan PKL, dan teman-teman sepermainan
dibangku akdemik (Putri, Melisa, Ika dan Desi ), teman-teman AFA terutama
buat cowok-cowoknya yang hanya tinggal 5 orang (Diki, Jaya, Izal, Irfan, dan
Tedi) dan teman-teman AFA lainnya.
Atas segala bantuan tersebut, penulis tidak dapat membalasnya dan hanya
dapat memohon kehadirat limpahan rahmat dan hidayah-Nya yang tak terhingga.
Penulis menyadari bahwa dalam penulisan Tugas Akhir ini masih terdapat
kekurangan, maka untuk itu penulis mengharapkan kritik serta saran yang
membangun demi kesempurnaan tugas akhir ini.
Akhir kata penulis berharap semoga tugas akhir ini dapat bermanfaat bagi
kita semua.
Medan, Mei 2008
3.2.1 Pembuatan Larutan Tawas 1 % ... 15
3.2.2 Penentuan Dosis Aluminium Sulfat Dengan Metode Jartest ... 16
BAB IV HASIL DAN PEMBAHASAN ... 17
4.1 Hasil ... 17
4.2 Pembahasan ... 23
BAB V KESIMPULAN DAN SARAN ... 24
5.1 Kesimpulan ... 24
5.2 Saran ... 24
DAFTAR TABEL
Tabel 2.3.2 Standart air minum menurut WHO ... 9
Tabel 4.1.1 Hasil uji kekeruhan awal dan akhir dari air baku dengan dosis optimum Al2(SO4)3 ... 17
Tabel 4.1.2 Sampel I dengan kekeruhan awal 10,45 NTU ... 18
Tabel 4.1.3 Sampel II dengan kekeruhan awal 37,45 NTU ... 19
Tabel 4.1.4 Sampel III dengan kekeruhan awal 55,8 NTU ... 20
Tabel 4.1.5 Sampel IV dengan kekeruhan awal 76,5 NTU ... 21
BAB I
PENDAHULUAN
1.1 Latar Belakang
Air permukaan merupakan sumber air yang paling utama yang dapat
digunakan sebagai sumber air baku untuk memenuhi kebutuhan akan air bersih
karena jumlahnya yang cukup melimpah. Salah satu contohnya adalah air sungai.
Dengan melimpahnya air sungai di permukaan, maka air sungai dapat digunakan
sebagai sumber air baku untuk penyediaan air bersih. Namun, air sungai ini belum
tentu lebih baik kualitasnya jika dibandingkan dengan air permukaan lainnya.
Hal ini dapat terjadi karena air sungai mendapatkan pengotoran yang lebih
besar selama pengalirannya. Pengotoran dapat bersumber dari domestik (rumah
tangga, perkampungan dan kota) dan sumber nondomestik, misalnya hasil
pembuangan pabrik dan industri, pertaniaan, peternakan serta sumber lainnya.
Baik secara langsung maupun tidak langsung pengotoran tersebut akan
berpengaruh terhadap kualitas air terutama kekeruhannya. Oleh sebab itu
diperlukan suatu pengolahan yang sempurna untuk menghilangkan
pengotoran-pengotoran air sungai yang digunakan sumber air baku untuk memenuhi
kebutuhan akan air bersih.
Salah satu proses pengolahan yang biasa dipakai dalam menghilangkan
pengotoran air sungai adalah dengan proses koagulasi dan flokulasi. Proses ini
dipakai untuk pembentukan flok yang mengadsorbsi dan mengikat partikel koloid
yang menyebabkan tingginya kekeruhan air sehingga akan membentuk flok yang
melibatkan bahan kimia yang disebut dengan koagulan. Koagulan yang umum
dipakai adalah Aluminium Sulfat / Al2(SO4)3. yang sering dikenal dengan tawas. Untuk menetukan dosis Aluminium Sulfat / Al2(SO4)3
1.2 Tujuan dan Manfaat
dapat dilakukan melalui
percobaan yang disebut Jartest.
1.2.1 Tujuan
Tujuan Tugas Akhir ini adalah untuk menentukan dosis pemakaian tawas
( Al2(SO4)3 )
1.2.2 Manfaat
yang dibutuhkan untuk menjernihkan air baku di PDAM Tirtanadi
Sunggal.
Manfaat Tugas Akhir ini adalah untuk menafsirkan berapa dosis
BAB II
TINJAUAN PUSTAKA
2.1 Air
Air merupakan kebutuhan utama bagi proses kehidupan dibumi ini. Tidak
akan ada kehidupan seandainya di bumi ini tidak ada air. Air yang relatif bersih
sangat didambakan oleh manusia baik untuk keperluan hidup sehari-hari, untuk
keperluan industri, untuk keberhasilan sanitasi kota, maupun untuk keperluan
pertanian dan lain sebagainya (Wardhana, 2001).
Menurut Azwar (1996), secara umum dapat dikatakan bahwa hampir tidak
mungkin ditemukan air yang benar-benar murni di alam ini. Karena air tersebut
selalu ada kemungkinan tercemar, misalnya :
1. Karena mengandung gas-gas tertentu yang membahayakan kesehatan
seperti gas metana, hidrogen sulfida dan lain sebagainya.
2. Karena mengandung mineral tertentu yang dapat mendatangkan kelainan
penyakit, misalnya sulfat, nitrat dan lain-lain.
3. Karena mengandung benda-benda bersifat koloid seperti bakteri, jamur,
dan lain sebagainya.
4. Karena mengandung zat radioaktif, terutama jika sumber air tersebut
kontak dengan zat-zat ataupun peralatan yang menggunakan tenaga atom.
Menurut Azwar (1996), berbagai jenis pencemar air biasanya berasal dari
dua sumber yaitu :
1. Sumber domestik (rumah tangga), perkampungan, kota, pasar, jalan, dan
2. Sumber non-domestik (pabrik, industri, pertanian, peternakan, perikanan,
serta sumber-sumber lainnya.
Semua bahan pencemar diatas baik secara langsung maupun tidak
langsung akan mempengaruhi kualitas air dalam memenuhi kebutuhan yang terus
meningkat. Oleh sebab itu diperlukan pengolahan dan perlindungan sumber daya
air secara seksama untuk menghindari terjadinya penurunan kualitas air yang
dapat menimbulkan gangguan, keusakan dan bahaya bagi semua makhluk hidup
yang bergantung pada sumber daya air tersebut (Effendi, 2003)
2.2 Sumber Air
Pada prinsipnya jumlah air di alam ini tetap dan mengikuti suatu aliran
yang dinamakan siklus hidrologi. Dengan adanya penyinaran matahari maka
semua air yang ada dipermukaan bumi akan menguap dan membentuk uap air.
Karena adanya angin, maka uap air ini akan bersatu dan berada di tempat yang
tinggi yang sering dikenal dengan nama awan. Oleh angin, awan ini akan terbawa
makin lama makin tinggi dimana temperatur diatas makin rendah yang
menyebabkan titik-titik air dan jatuh kebumi sebagai hujan. Air hujan ini sebagian
mengalir kedalam tanah, jika menjumpai lapisan rapat air maka peresapan akan
berkurang, dan sebagian air akan mengalir di atas lapisan rapat air ini. Jika air ini
keluar pada permukaan bumi, maka air ini akan disebut air mata air. Air
permukaan yang mengalir di permukaan bumi umumnnya berbentuk
sungai-sungai dan jika melalui suatu tempat rendah (cekung) maka air akan terkumpul
membentuk suatu danau atau telaga. Tetapi banyak diantaranya yang mengalir ke
Menurut Sutrisno, (1997) sumber-sumber air yang terdapat di alam adalah:
2.2.1 Air laut
Mempunyai sifat asin karena mengandung garam NaCl. Kadar NaCl
dalam air laut 3 %. Dengan keadaan ini maka air laut tidak memenuhi syarat
untuk air minum.
2.2.2 Air Atmosfir atau Air Meteorologik
Air atmosfir atau air meteorologik ini dinamakan juga air hujan. Air hujan
ini diperoleh dari siklus hidrologi. Dengan adanya penyinaran matahari maka air
yang ada dipermukaan bumi akan terjadi evaporasi (penguapan). Kemudian uap
air itu akan saling bertumbukan dan kemudian terjadi penyatuan hingga terbentuk
butir-butir yang lebih besar karena gaya gravitasi, butir-butir air itu akan jatuh
sebagai air hujan.
2.2.3 Air Permukaan
Air permukaan merupakan air hujan yang mengalir dipermukaan bumi.
Pada umumnya air permukaan ini akan mendapatkan pengotoran selama
pengalirannya misalnya oleh lumpur, batang-batang kayu, daun-daun, hasil
buangan industri dan sebagainya.
Air permukaan ini ada 2 macam yaitu :
1) Air Sungai
Dalam pengolahannya sebagai air minum haruslah mengalami pengolahan
yang sempurna mengingat bahwa air sungai pada umumnya mempunyai
2) Air Rawa atau Danau
Kebanyakan air rawa ini berwarna yang disebabkan adanya zat-zat organik
yang telah membusuk misalnya asam humus yang larut dalam air yang
menyebabkan warna kuning cokelat pada air.
Air Tanah
Air tanah adalah air yang terdapat pada lapisan-lapisan tanah. Air tanah
terjadi karena adanya daya proses peresapan air dari permukaan tanah.
Ciri-ciri air tanah secara umum adalah sebagai berikut :
1. Memiliki kekeruhan yang relatif rendah.
2. Intensitas warna air lebih rendah.
3. Komposisi mineralnya lebih stabil.
Air tanah ini terbagi menjadi 3 yaitu :
1) Air Tanah Dangkal
Terjadi karena daya proses peresapan air dari permukaan tanah. Lapisan
tanah disini berfungsi sebagai saringan. Disamping penyaringan,
pengotoran masih terus berlangsung terutama pada muka air yang dekat
dengan muka tanah. Setelah menemui lapisan rapat air, air akan
berkumpul dan dapat dimanfaatkan untuk sumber air minum melalui
sumur-sumur dangkal
2) Air Tanah Dalam
Terdapat setelah lapisan rapat air yang pertama. Pengambilan air tanah
dalam tak semudah pada air tanah dangkal. Dalam hal ini harus digunakan
bor dan memasukkan pipa kedalamnya sehingga dalam suatu kedalaman
3) Mata air
Mata air adalah air tanah yang keluar dengan sendirinya ke permukaan
tanah. Mata air ini berasal dari tanah dalam hampir tidak berpengaruh oleh
musim dan kualitasnya sama dengan keadaan air tanah dalam.
2.3 Karakteristik Air
Menurut Linsley (1995), karakteristik air dapat dibagi menjadi 3 kelompok
yaitu :
2.3.1 Ciri-ciri Fisik Air
a. Kekeruhan
Kekeruhan akan mengurangi kejernihan air dan diakibatkan oleh
pencemar-pencemar yang terbagi halus dari manapun asalnya yang ada
di dalam air. Kekeruhan disebabkan oleh lempung, lanau,
partikel-partikel tanah dan pencemar-pencemar koloidal lainnya. Tingkat
kekeruhan tergantung pada kehalusan partikel dan konsentrasinya.
b. Warna
Air kadang-kadang mengandung warna yang banyak diakibatkan oleh
jenis-jenis tertentu dari bahan organik yang terlarut dan koloidal yang
terbilas dari tanah oleh tumbuh-tumbuhan yang membusuk.
c. Rasa dan Bau
Rasa dan bau pada air disebabkan oleh adanya bahan organik yang
membusuk atau bahan kimia yang mudah menguap. Air minum secara
d. Suhu
Suhu air merupakan hal yang penting jika dikaitkan dengan tujuan
penggunaan, pengolahan untuk membuang bahan-bahan pencemar
serta pengangkutannya. Suhu tergantung pada sumber airnya.
e. Bahan Padat Keseluruhan / Sisa Zat Padat
Sisa zat padat ini diperoleh dengan menguapkan suatu contoh air dan
menimbang sisanya yang telah kering. Konsentrasi bahan padat
keseluruhan dipergunakan untuk menguji kecolokan berbagai sumber
air untuk berbagai pemanfaatan misalnya industri dan pertanian.
Standart Air Minum dari segi fisik menurut WHO
a. Rasa : Tidak berasa
b. Bau : Tidak berbau
c. Warna : Tidak berwarna
d. Sisa zat padat : 500 – 1000 ppm
e. Derajat kekeruhan : Tidak melebihi 5 – 15 unit (Turbidity Unit)
2.3.2 Ciri – ciri kimiawi air
Air minum tidak boleh mengandung racun, zat-zat mineral/zat-zat kimia
tertentu dalam jumlah melampaui batas yang telah ditentukan. Unsur-unsur
tersebut tidak dikehendaki kehadirannya karena dapat membahayakan kesehatan
jika telah melewati ambang batas maksimal yang telah ditetapkan. Selain
membahayakan kesehatan keberadaan unsur-unsur tersebut juga dapat merusak
perpipaan untuk distribusi kepada konsumen.
Untuk melihat batas maksimal keberadaan dari unsur-unsur kimia dapat
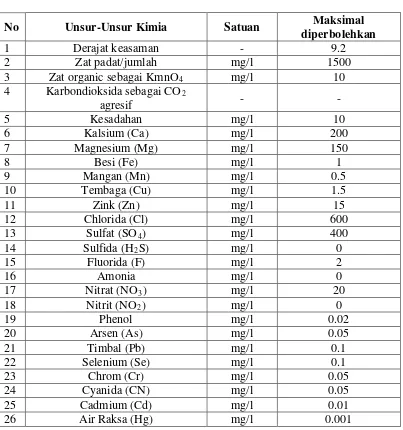
Tabel 2.3.2 Standart air minum menurut WHO
No Unsur-Unsur Kimia Satuan Maksimal
diperbolehkan
1 Derajat keasaman - 9.2
2 Zat padat/jumlah mg/l 1500
3 Zat organic sebagai KmnO4 mg/l 10
4 Karbondioksida sebagai CO2 -
agresif -
2.3.3 Ciri-ciri Biologis Air
Air minum tidak boleh mengandung bakteri-bakteri penyakit (patogen)
sama sekali dan tidak boleh mengandung bakteri golongan Coli melebihi
batas-batas yang telah ditentukan yaitu 1 coli / 100 ml air. Bakteri golongan coli ini
berasal dari usus besar (faeces) dan tanah.
Air yang mengandung golongan Coli telah berkombinasi / berhubungan
2.4 Pengolahan Air Secara Umum
Untuk menghasilkan air yang memenuhi karakteristik di atas tersebut
maka dilakukan proses pengolahan air baku. Proses pengolahan air baku
merupakan suatu usaha untuk menjernihkan air dan meningkatkan mutu air agar
dapat diminum.
Menurut Gabriel (2001), proses pengolahan air meliputi 5 tahap, yaitu :
2.4.1 Proses perifikasi / proses pemurnian air
Pemurnian air dilakukan untuk merubah keadaan air dari keruh, berbau,
dan berwarna, pH beraneka ragam menjadi air yang jernih bebas dari keruh dan
pH yang netral
Cara mengatasi kekeruhan dapat dilakukan dengan cara :
a) Pengendapan secara alami (proses sedimentasi)
Dengan menenangkan air yang mengandung lumpur kasar maupun halus
sehingga akan mengendap dengan perlahan-lahan.
b) Melalui proses koagulasi.
Dengan melakukan reaksi pengendapan koloidal yang ada di air dengan
melibatkan bahan koagulan. Bahan koagulan yang dapat dipakai adalah
Fe(SO4), FeCl3, Al2(SO4)3. 18H2
c) Proses sedimentasi aktif
O, Poly Aluminium Clorida (PAC), dan
lain-lain.
Apabila sudah menggunakan koagulan maka koloidal yang berada di
d) Melalui Proses Filtrasi
Koloidal yang telah mengalami flokulasi namun tidak terjadi pengendapan
maka usaha selanjutnya melalui proses filtrasi menggunakan saringan
pasir cepat dan saringan pasir lambat
2.4.2 Proses Desinfeksi
Proses desinfeksi yaitu suatu proses usaha agar kuman patogen yang
berada didalam air dipunahkan. Proses desinfeksi dapat dilakukan dengan
klorinasi.
Klorinasi adalah salah satu proses desinfeksi yang digunakan untuk
membunuh mikroorganisme patogen dalam air, selain dengan ozonisasi atau
dengan penyinaran ultraviolet. Klor adalah zat kimia yang sering dipakai karena
mempunyai daya desinfeksi sampai beberapa jam setelah pembubuhannya. Kalau
gas klor sebagai Cl2
Cl
dilarutkan dalam air, maka akan terjadi reaksi hidrolisis
dengan cepat .
2 + H2O H+ + Cl- + HOCl Asam hipoklorit akan pecah, Ion klorida (Cl
-HOCl OCl
) pada reksi diatas dianggap
tidak aktif
+ H+ Sedangkan HOCl dan OCl-
2.4.3 Proses Pengaturan pH air.
adalah bahan yang aktif.
Air yang telah mengalami proses koagulasi akan mengakibatkan pH air
6,5 s/d 9,2 maka dilakukan pembubuhan kapur CaO ke dalam air. Apabila
pH diluar dari range tersebut, akan mengakibatkan pipa air yang terbuat
dari logam mengalami korosik sehingga pada akhirnya air tersebut
menjadi racun bagi tubuh manusia.
2.4.4 Proses Pengaturan Mineral Air
Proses pengaturan mineral air dilakukan karena mineral dalam air yang
diperlukan oleh tubuh akan ikut mengendap bersama dengan proses
sedimentasi setelah dilakukan pembubuhan koagulant.
2.5 Koagulasi dan Flokulasi
Koagulasi dilakukan terhadap air yang mengandung bahan-bahan padat
terapung maupun koloidal yang menyebabkan kekeruhan. Proses koagulasi yang
umumnya menggunakan bahan koagulan akan bereaksi dengan air dan
partikel-partikel yang mengakibatkan air menjadi keruh. Flokulasi dilakukan beriringan
setelah proses koagulasi dengan melakukan pengadukan cepat yang kemudian
dilanjuti dengan pengadukan lambat (flokulasi) selama 20 hingga 30 menit. Hal
ini akan mengakibatkan bertumbukannya kumpulan-kumpulan partikel kecil yang
akan membentuk partikel-partikel yang lebih besar. Berhubung dengan ukur dan
kerapatannya, partikel-partikel besar ini dapat mengendap dengan sendirinya
karena adanya gaya gravitasi.
Flokulasi dapat dilaksanakan dengan menggunakan berbagai cara
dibawah kolam-kolam pengaduk dan penambahan suatu gas, biasanya udara
(Leanslay, 1991)
2.6 Aluminium Sulfat Al2(SO4)3
Koagulan yang umum dipakai adalah Aluminium Sulfat / Al2(SO4)3
Menurut Paul (1995), Reaksi umum Aluminium Sulfat / Al
yang
lebih dikenal dengan nama tawas. Koagulan ini paling banyak digunakan karena
relatif murah dan mudah diperoleh di pasaran. Di laboratorium, dosis aluminium
sulfat yang diperlukan dapat ditentukan melalui percobaan yang disebut jartest
(Paul, 1995)
Aluminium sulfat bereaksi didalam air akan membentuk aluminium
hidroksida, disamping terbentuknya asam (H+), dan senyawa sulfat.
2(SO4)3
Al
di
dalam air dapat dijelaskan sebagai berikut:
2(SO4)3 2 Al3+ + 3 SO4 2-
H
Ion Hidroksida berasal dari proses ioniasi dari air
2O H+ + OH-
Ion Aluminium (Al3+) kemudian akan bereaksi dengan ion hidroksida (OH
-Selain terbentuknya aluminium hidroksida akan terbentuk pula asam.
4 2- + H+ H2SO4
penggunaan dosis tawas yang berlebihan akan mengakibatkan penurunan pH yang
cukup besar dan air yang diolah menjadi asam.
Apabila air tidak mengandung alkalinitas yang diperlukan, maka mungkin
BAB III
METODOLOGI PERCOBAAN
3.1 Alat dan Bahan
3.1.1 Alat-alat
Alat-alat yang diperlukan pada percobaan ini adalah :
1. Timbangan analitik
2. Beaker glass
3. Labu ukur
4. Pipet volum
5. Jartest
6. HACH 2100 N Turbidity
3.1.2 Bahan-bahan
Bahan-bahan yang diperlukan pada percobaan ini adalah :
1. Air baku PDAM Tirtanadi Sunggal (Sungai Belawan)
2. Aquadest
3. Al2(SO4)3
3.2 Prosedur Kerja
3.2.1 Pembuatan Larutan Tawas 1 %
- Ditimbang 1 gram Al
2(SO4)3
- Dilarutkan dalam labu ukur 100 ml dengan aquadest lalu di addkan
sampai garis tanda.
3.2.2 Penentuan Dosis Aluminium Sulfat Dengan Metode Jartest
- Diisi masing-masing beaker glass dengan 1000 ml sampel air baku
(intake), turunkan Agitator Jar Test, aktifkan alat dan atur putaran pada
140 rpm untuk putaran cepat dan atur timer selama 5 menit.
- Diinjeksi masing-masing beaker glass dengan variasi dosis tawas yang
diinginkan berdasarkan hasil perhitungan :
mg/l
- Diperhatikan kecepatan pembentukan flok, tingkat kekeruhan secara
visual, atur putaran pada posisi 30 rpm untuk putaran lambat, atur
timer selama 10 menit, matikan alat, angkat Agitator, diamkan selama
20 menit untuk proses pengendapan, perhatikan secara visual
kecepatan pengendapan flok, jumlah flok yang mengendap dan
melayang, serta kekeruhan air.
- Diperiksa dan catat kekeruhan air pada masing-masing konsentrasi.
- Dosis pemakaian tawas yang diambil adalah pada saat pemberian
BAB IV
HASIL DAN PEMBAHASAN
4. 1 Hasil
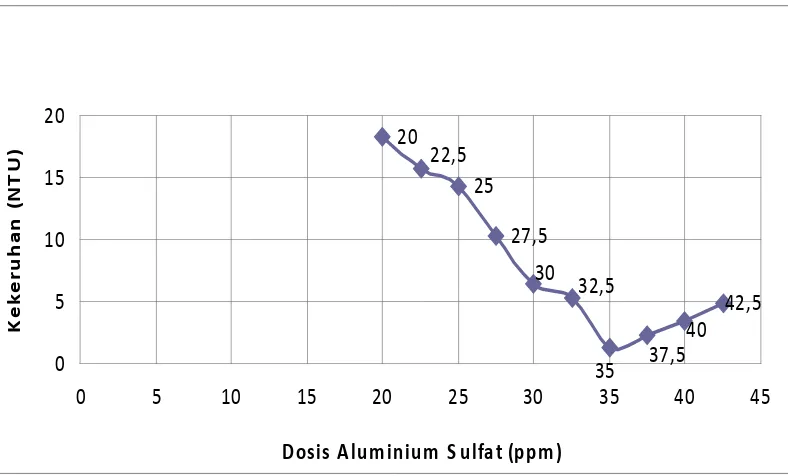
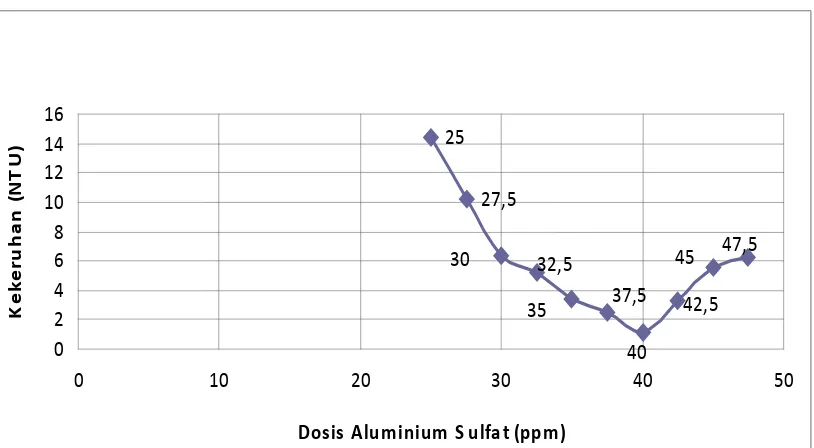
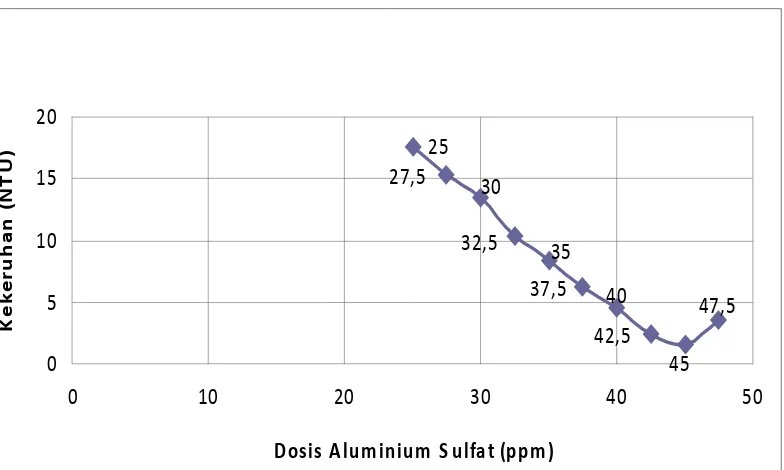
Hasil uji dari 5 sampel air baku PDAM Tirtanadi Sunggal dengan masing-
masing pemberian Aluminium Sulfat / Al2(SO4)3 yang bervariasi, dan dengan dilakukannya 3x pengujian tercantum pada tabel 4.1.1.
Tabel 4.1.1 Hasil uji kekeruhan awal dan akhir dari air baku dengan dosis
optimum Al2(SO4)
Sampel
3
Dosis Optimum Al2(SO4)3 Kekeruhan (NTU)
(ppm) Kekeruhan awal Kekeruhan akhir
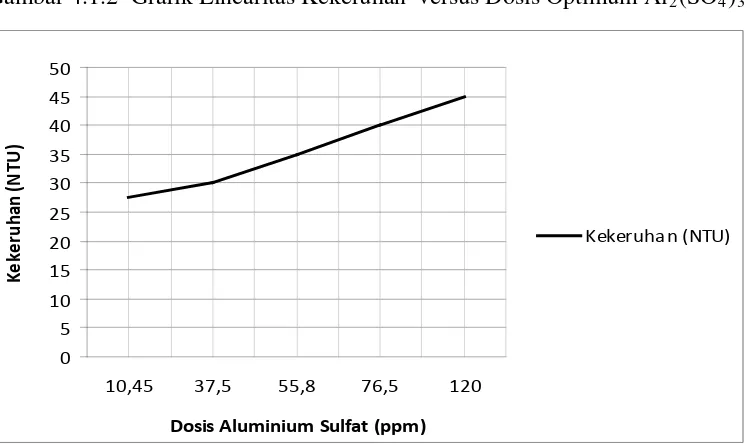
1 27.5 10.45 1.23 tercantum pada tabel 4.1.1 diatas dapat dilihat pada gambar 4.1.2 dibawah ini.
Gambar 4.1.2 Grafik Linearitas Kekeruhan versus Dosis Optimum Al2(SO4)
0
10,45 37,5 55,8 76,5 120
Dosis Aluminium Sulfat (ppm)
Untuk melihat kekeruhan akhir dengan pemberian dosis Al2(SO4)3
NO
yang
bervariasi yang dilakukan 3x terhadap 5 sampel dengan kekeruhan awal yang
berbeda-beda tercantum pada tabel dan grafik dibawah ini.
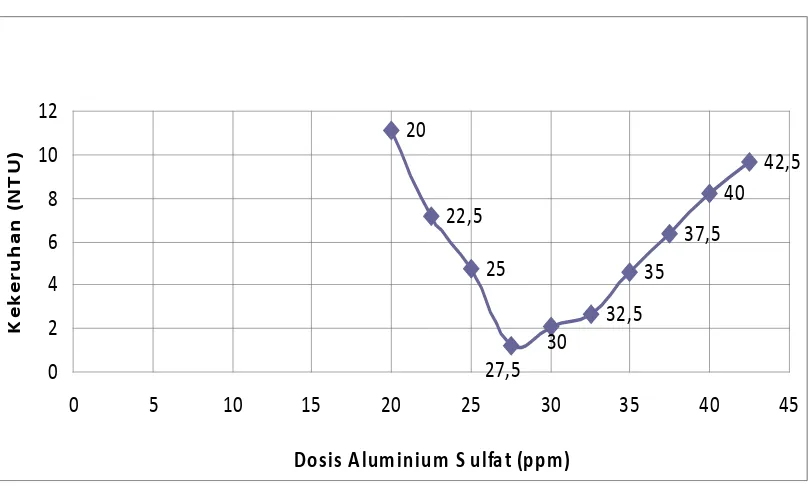
Tabel 4.1.2 Sampel I dengan kekeruhan awal 10,45 NTU
Kekeruhan
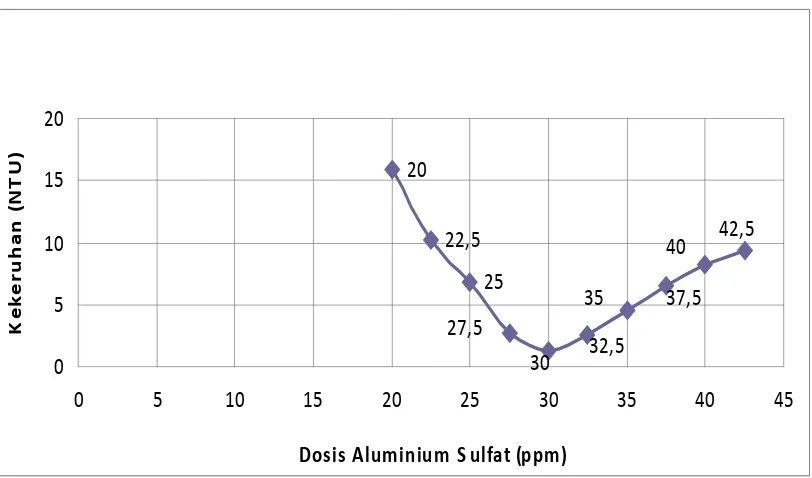
Tabel 4.1.3 Sampel II dengan kekeruhan awal 37,45 NTU
Tabel 4.1.4 Sampel III dengan kekeruhan awal 55,8 NTU
Tabel 4.1.5 Sampel III dengan kekeruhan awal 55,8 NTU
Tabel 4.1.6 Sampel V dengan kekeruhan awal 120 NTU
4. 2 Pembahasan
Dari gambar 4.1.2 dapat dilihat adanya hubungan antara dosis Aluminium
Sulfat / Al2(SO4)3 dengan kekeruhan air baku, semakin tinggi kekeruhan air maka Aluminium Sulfat / Al2(SO4)3 yang digunakan akan semakin tinggi. Disamping itu apabila dosis pemakaiannya telah melewati titik optimum maka
akan menaikkan kembali derajat kekeruhan air . Hal ini diakibatkan karena flok
yang terbentuk kembali pecah akibat makin jenuhnya sampel sehingga Al2(SO4)3 yang ditambahkan akan merusak flok yang terbentuk dan mengabitkan kekeruhan
air akan semakin tinggi.
Aluminium Sulfat / Al2(SO4)3 akan mengendap bersama partikel koloid yang diikat didalam flok yang terbentuk. Namun jika pemakaiannya telah
melewati titik optimum maka kekeruhan akan semakin meningkat karena terjadi
kerusakan pada flok yang terbentuk. Selain itu, pemakian tawas yang berlebihan
akan mengakibatkan penurunan pH yang cukup besar dan air yang diolah menjadi
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil percobaan yang telah dilakukan maka dapat disimpulkan bahwa:
- Penetapan dosis pemakaian tawas untuk menjernihkan air baku dapat
dilakukan dengan metode jartest.
- Dosis Aluminium Sulfat yang dibutuhkan untuk menjernihkan air baku
dengan kekeruhan yang berbeda-beda dapat diperkirakan sebagai
berikut:
- Air baku dengan kekeruhan 10.45 NTU dibutuhkan kira-kira 27,5
ppm
- Air baku dengan kekeruhan 37.5 NTU dibutuhkan kira-kira 30 ppm
- Air baku dengan kekeruhan 55.8 NTU dibutuhkan kira-kira 35 ppm
- Air baku dengan kekeruhan 76.5 NTU dibutuhkan kira-kira 40 ppm
- Air baku dengan kekeruhan 120 NTU dibutuhkan kira-kira 45
ppm
5.2 Saran
Diharapkan agar digunakan bahan koagulan lain selain dari aluminium
sulfat agar dapat dibandingkan pembentukan floknya untuk menjernihkan air
DAFTAR PUSTAKA
Azwar, Azrul, (1996), PENGANTAR ILMU KESEHATAN LINGKUNGAN,
Cetakan kedelapan, Jakarta: Mutiara Sumber Widya
Effendi, Heffni, (2007), TELAAH KUALITAS AIR BAGI PENGELOLAAN
SUMBER DAYA DAN LINGKUNGAN PERAIRAN, Cetakan kelima,
Jakarta: Erlangga
Gabriel, J. F, (2001), FISIKA LINGKUNGAN, Cetakan pertama, Bandung:
Hipokrates
Linsley, Ray (1991), TEKNIK SUMBER DAYA AIR, Jakarta: Erlangga
Paul, N, (1995), HANDBOOK OF WATER AND WASTEWATER
TREATMENT TECHNOLOGY, Newyork: Marcel Dekker Inc
Suriawiria, Unus, (2005), AIR DALAM KEHIDUPAN DAN LINGKUNGAN
YANG SEHAT, Cetakan kedua, Bandung: PT Alumni
Totok, Sutrisno C, (2004), TEKNOLOGI PENYEDIAAN AIR BERSIH, Cetakan
kelima, Jakarta: PT. Rineka Cipta
Wardhana, W, A, (2001), DAMPAK PENCEMARAN LINGKUNGAN, Edisi
LAMPIRAN
OVER LAY OUT PDAM TIRTANADI INSTALASI SUNGGAL
Sungai Intake
Lagoon
Clearator
Presetting tank
Filter
Reservoir Chlorination
Air Tawas
Lumpur
RWP satation
Air
Kapur/soda ash
FWP station
Distribusi
Kaporit Air