ABSTRACT
THE EFFECT OF ORAL HERBICIDE PARAQUAT DICHLORIDE TO KIDNEY HISTHOPATHOLOGY IN MALE RATS (Rattus norvegicus)
Sprague dawley STRAIN By
DIAH SEPTIA LIANTARI
Herbicide is one of chemical material which is used by farmers to inhibit and kill weeds. Nowadays, the use of herbicide is increasing. But, the use of herbicide sometimes doesn’t appropriate to the procedure so it causes adverse effect in human. The exposure of herbicide paraquat dichloride give effects to human organs such as lung, kidney, heart, liver, muscle, spleen, skin, eyes, and brain. In kidney, it damage both glomerulus and renal tubules. The purpose of this study is to determine the effect of oral herbicide paraquat dichloride to kidney histhopathology in male rats (Rattus norvegicus) Sprague dawley strain. In this study, 25 male rats (Rattus norvegicus) Sprague dawley strain about 8−10 weeks are divided randomly into 5 group and treated for 2 days. K1 is given aquadest, K2, K3, K4, K5 is given herbicide paraquat dichloride 25 mg/kgBB, 50 mg/kgBB, 100 mg/kgBB, and 200 mg/kgBB. The results showed that the average number of kidney damage K1:0, K2:1,8, K3:2,0, K4:3,6, K5:4,4. In Kruskal Wallis test found a significant difference (p<0,05). There is an effect of oral herbicide paraquat dichloride to kidney histhopathology in male rats (Rattus novergicus) Sprague dawley strain.
ABSTRAK
PENGARUH PEMBERIAN HERBISIDA GOLONGAN PARAQUAT DIKLORIDA PER-ORAL TERHADAP GAMBARAN HISTOPATOLOGI
GINJAL TIKUS PUTIH (Rattus norvegicus) JANTAN GALUR Sprague dawley
Oleh
DIAH SEPTIA LIANTARI
Herbisida merupakan salah satu bahan kimia yang digunakan oleh para petani untuk menghambat dan mematikan tumbuhan. Saat ini, penggunaan herbisida semakin meningkat. Namun, penggunaan herbisida sering tidak sesuai prosedur sehingga dapat menimbulkan efek samping terhadap manusia. Paparan herbisida golongan paraquat diklorida berpengaruh ke organ-organ tubuh seperti paru-paru,jantung, ginjal, hati, otot, limpa, kulit, mata dan otak. Pada organ ginjal dapat merusak glomerulus maupun tubulus ginjal. Tujuan Penelitian ini adalah untuk mengetahui pengaruh pemberian herbisida golongan paraquat diklorida per-oral terhadap gambaran histopatologi ginjal tikus putih (Rattus norvegicus) jantan galur Sprague dawley. Pada penelitian ini, 25 ekor tikus putih (Rattus norvegicus) jantan galur Sprague dawley berumur 8−10 minggu tikus dibagi dalam 5 kelompok secara acak dan diberi perlakuan selama 2 hari. K1 diberi aquades, K2, K3, K4, K5 diberi herbisida paraquat diklorida 25mg/kgBB, 50mg/kgBB, 100mg/kgBB dan 200mg/kgBB. Hasil penelitian menunjukan bahwa rerata skor kerusakan ginjal pada K1: 0, K2: 1,8, K3: 2,0, K4:3,6, K5; 4,4. Data yang diperoleh diuji dengan Uji Kruskal-Wallis didapatkan perbedaan bermakna (p<0,05). Terdapat pengaruh pemberian herbisida golongan paraquat diklorida per-oral terhadap gambaran histopatologi ginjal tikus putih (Rattus norvegicus) jantan galur Sprague dawley
RIWAYAT HIDUP
Penulis dilahirkan di Bumi Nabung, Lampung Tengah pada tanggal 12 September
1993, sebagai anak keempat dari empat bersaudara dari Bapak Sugito, S.Pd dan
Ibu Astiyatun, S.Pd.
Pendidikan Taman Kanak-kanak (TK) di TK Alfirman Ma’arif, Sekolah Dasar (SD) di SDN 5 Bumi Nabung Ilir pada tahun 1999, Sekolah Menengah Pertama
(SMP) di SMPN 1 Rumbia pada tahun 2005 dan Sekolah Menengah Atas (SMA)
di SMAN 4 Metro pada tahun 2008.
Tahun 2011, penulis terdaftar sebagai mahasiswa Fakultas Kedokteran
Unuversitas Lampung melalui jalur Undangan Seleksi Nasional Masuk Perguruan
Tinggi Negeri (SNMPTN). Selama menjadi mahasiswa, penulis menjadi asisten
dosen Patologi Anatomi pada tahun 2013-2014. Penulis aktif dalam Lembaga
Kemahasiswaan Forum Studi Islam (FSI) Ibnu Sina FK Unila sebagai Kardiak
pada tahun 2011/2012 dan sebagai Bendahara Umum pada tahun 2012/2013.
Penulis juga aktif dalam Lembaga Kemahasiswaan Badan Eksekutif Mahasiswa
(BEM) FK Unila sebagai EA BEM pada tahun 2011/2012, sebagai anggota Biro
2013/2014. Penulis juga aktif dalam Lembaga Eksternal yaitu Pusat Komunikasi
Daerah (PUSKOMDA) Lampung sebagai anggota Komisi D (media dan
“Jadikanlah sabar dan sholat sebagai penolongmu”
(Q.S. Al-Baqarah: 32)
“Ya Allah, anugerahkanlah aku ilham untuk tetap
mensyukuri nikmat-Mu yang telah Engkau
Anugerahkan kepadaku dan kepada kedua orang tuaku
dan agar aku mengerjakan kebajikan yang Engkau
Ridhoi; dan masukkanlah aku dengan rahmat-Mu ke
PERSEMBAHAN
Segala puji hanyalah milik Allah SWT yang telah memberikan nikmat iman,
nikmat islam, hidayah dan rahmat kepada penulis. Shalawat serta salam
semoga tercurahkan kepada suri tauladan kita Nabi Muhammad SAW
beserta keluarganya.
Dengan syukur kupersembahkan lembaran-lembaran sederhana ini untuk
Ayah dan Ibuku Tercinta
Yang selalu menyanyangiku, yang selalu memberikan kebahagiaan dalam
hidupku dan yang selalu menyebut namaku dalam setiap doa.
Kakak-kakak ku tersayang
SANWACANA
Puji syukur Penulis ucapkan kehadirat Allah SWT, karena atas rahmat dan
hidayah-Nya sehingga skripsi ini dapat diselesaikan. Sholawat serta salam semoga
selalu tercurahkan kepada Nabi Muhammad S.A.W.
Skripsi dengan judul “Pengaruh Pemberian Herbisida Golongan Paraquat Diklorida Per−OralTerhadap Gambaran Histopatologi Ginjal Tikus Putih (Rattus norvegicus) Jantan Galur Sprague dawley” adalah salah satu syarat untuk
memperoleh gelar sarjana Kedokteran di Universitas Lampung.
Dalam kesempatan ini penulis mengucapkan terimakasih kepada:
1. Bapak Prof. Ir. Sugeng P. Harianto, M.S., selaku Rektor Universitas
Lampung.
2. Bapak Dr. Sutyarso, M.Biomed., selaku Dekan Fakultas Kedokteran
Universitas Lampung.
3. Bapak dr. Muhartono, M.Kes., Sp.PA., selaku Pembimbing Utama atas
kesediannya memberikan untuk memberikan bimbingan, saran dan kritik
dalam proses penyelesaian skripsi ini.
4. Ibu dr. Indri Windarti, Sp.PA., selaku Pembimbing Kedua atas kesediannya
proses skripsi ini serta memberikan banyak ilmu selama lebih dari setahun
terakhir ini.
5. Ibu dr. Susianti, M.Sc., selaku Penguji Utama pada ujian skripsi untuk
masukan dan saran-saran yang diberikan.
6. Ibu dr. Tiwuk Susantiningsih, M. Biomed., dan dr. Maya Ganda Ratna yang
telah memberikan banyak masukan, saran dan bantuan dalam proses
penelitian ini.
7. Ibu Prof. Dr. dr. Efrida Warganegara, M.Kes., Sp. MK., selaku Pembimbing
Akademik saya sejak semester awal hingga semester akhir.
8. Ayah dan Ibu yang selalu memberikan kasih sayang, nasehat, motivasi, selalu
mendoakan anak-anaknya dan selalu memberikan yang terbaik. Semoga
Allah swt selalu melindungi dalam setiap langkah.
9. Kakak-kakak saya, Mas Andi Perdana Saputra yang dulu selalu mendukung
saya dan semoga tenang disana, Mbak Marthia Ratna Dewi dan Mbak Indah
Kusuma Rini yang selalu memberikan doa, bantuan dan semangat untuk
menyelesaikan skripsi ini serta adik kecil Angga Adi Prayoga.
10. Seluruh Staf Dosen FK Unila atas ilmu dan pengalaman berharga yang telah
diberikan kepada penulis untuk menambah wawasan yang menjadi landasan
untuk mencapai cita-cita.
11. Seluruh Staf TU, Administrasi dan Akademik FK Unila, serta pegawai yang
turut membantu dalam proses penelitian skripsi ini.
12. Mas Bayu Putra yang sudah banyak membantu dalam proses pembuatan
13. drh. Aulia Andi M. Msi., Abang Alias dan Om Adi yang telah banyak
membantu dalam proses penelitian ini.
14. Sahabat-sahabat saya: Yolanda Fratiwi, Ferina Dwi Marinda, Sakinah dan
Tiara Anggraini yang selalu ada dalam suka maupun duka, saling
mengingatkan dan selalu memberikan semangat.
15. Sahabat-sahabat saya yang dipertemukan dalam sebuah lingkaran kecil:
Anggia, Karimah dan Melly yang telah mengajariku tujuan hidup ini.
16. Sahabat-sahabat CUPS: Yolci, Ferina, Sakinah, Naomi, Bela, Rifka, Dila,
Pelis, Ririn, Mbak Oni, Roby, Desta, Wayan, Gede, Filla dan Baji atas
bantuan, doa dan saling menyemangati untuk menyelesaikan skripsi ini.
17. Partner kerja skripsi saya, Yolanda Fratiwi, I Gede Eka Widayana dan Wayan
Ferly Aryana atas kerjasama dan semangat nya dalam menyelesaikan skripsi
ini.
18. Rekan kerja seperjuangan Asdos PA, Yolanda Fratiwi, Kak Tiara Anggraini,
Fadia Nadila, Yuda Ayu K, Muflikha Sofiana, I Gede Eka dan Rizky Bayu
atas kerjasama nya selama ini.
19. Sahabat-sahabat Keluarga Besar FSI IBNU SINA: Mbak Defi, Mbak Putri,
Mbak Tya, Mbak Megan, Mbak Ghina, Mbak Nora, Mbak Annida, Mbak
Nyimas, Mbak Nida, Mbak Meta, Mbak Vicha, Mbak Laili, Nindry, Rania,
Huzai, Idzni, Oci, Laras, Eka, Siti M, dan sahabat-sahabat semua yang tidak
bisa saya tulis satu persatu, atas nasehat, motivasi selama ini dan semoga kita
20. Sahabat-sahabat BEM FK UNILA Kabinet NEURAL: Ara, Tiwi, Mahendra,
Yolci, Ani, Gede, Putri, Vivi, Taufiq, Belinda Sandra, Bulan, Aryati, dan
teman-teman semua.
21. Sahabat-sahabat PUSKOMDA Lampung atas ilmu dan pengalaman selama
ini.
22. Sahabat-sahabat angkatan 2011 yang tidak bisa disebutkan satu persatu.
Terimakasih atas kebersamaan dan kerja sama dalam mengemban ilmu di
kampus tercinta ini.
23. Kakak-kakak dan adik-adik tingkat saya (angkatan 2002-2014) yang sudah
memberikan semangat kebersamaan dalam satu kedokteran.
Akhir kata, Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan.
Akan tetapi, sedikit harapan semoga skripsi yang sederhana ini dapat berguna dan
bermanfaat bagi kita semua. Aamiin.
Bandar Lampung, Desember 2014
Penulis,
i
2.1 Herbisida Golongan Paraquat Diklorida...
2.1.1 Deskripsi Herbisida Golongan Paraquat Diklorida...
2.1.2 Penggunaan Herbisida Golongan Paraquat Diklorida...
ii
2.1.4 Mekanisme Toksisitas Herbisida Golongan Paraquat
Diklorida...
2.3 Radikal Bebas dan Stres Oksidatif...
2.3.1 Radikal Bebas...
2.3.2 Stres Oksidatif...
2.4 Tikus Putih (Rattus norvegicus) Galur Sprague dawley......
2.4.1 Klasifikasi Tikus Putih...
2.4.2 Jenis Tikus Putih...
2.4.3 Biologi Tikus Putih...
BAB III METODE PENELITIAN
3.1 Desain Penelitian ………...……... 3.4.3.1 Alat Penelitian ………...
iii
3.5 Prosedur Penelitian ……….…... 3.5.1 Prosedur Pemberian Dosis Herbisida Paraquat Diklorida...
3.5.2 Prosedur Penelitian………...
3.6 Identifikasi Variabel dan Devinisi Operasional Variabel …... 3.6.1 Identifikasi Variabel ………...…...
3.6.2 Definisi Operasional Variabel ………...
3.7 Analisis Data ………... 3.8 Ethical Clearance...
BAB IV HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian...
4.2 Pembahasan...
BAB V KESIMPULAN DAN SARAN
DAFTAR TABEL
Tabel Halaman
1. Definisi Operasional ………... 2. Rerata Skor Kerusakan Ginjal...
3. Analisis Mann Whitney...
49
58
DAFTAR GAMBAR
Gambar Halaman
1. Kerangka teori ...
2. Kerangka konsep...
3. Histologi glomerulus ginjal normal manusia...
4. Histologi tubulus ginjal normal manusia...
5. Pembentukan radikal bebas...
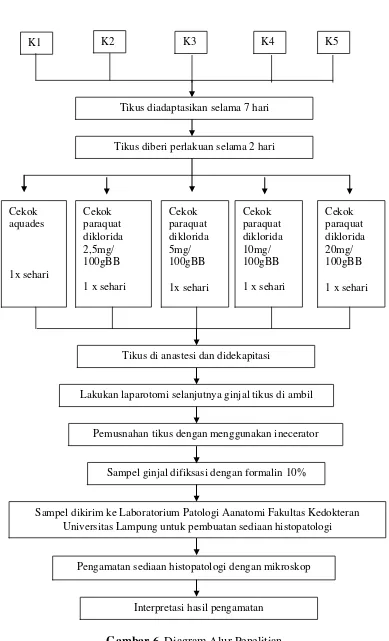
6. Diagram Alur Penelitian...
7. Histologi ginjal normal tikus kontrol negatif...
8. Histopatologi ginjal tikus kelompok 2...
9. Histopatologi ginjal tikus kelompok 3...
10. Histopatologi ginjal tikus kelompok 4...
11. Histopatologi ginjal tikus kelompok 5...
12. Grafik perbandingan rerata skor kerusakan ginjal...
DAFTAR LAMPIRAN
Lampiran Halaman
1. Analisis Statistik...
2. Dokumentasi Penelitian...
75
1
BAB I PENDAHULUAN
1.1 Latar Belakang
Saat ini pestisida telah secara luas digunakan untuk tujuan memberantas hama
dan penyakit tanaman dalam bidang pertanian dan perkebunan. Laporan dari
Food Agriculture Oganization menyatakan lebih dari 70.000 pestisida
beredar di seluruh dunia dan dipergunakan secara aktif oleh para petani
(FAO, 2003). Penggunaan pestisida dalam mengatasi organisme pengganggu
tanaman telah meluas di kalangan para petani di Indonesia. Penggunaan
pestisida yang tidak terkendali akan berakibat pada kesehatan petani dan
lingkungan. Pada tahun 2000, penelitian terhadap para pekerja atau penduduk
yang memiliki riwayat kontak pestisida banyak sekali dilakukan di Indonesia.
Dari berbagai penelitian tersebut diperoleh gambaran prevalensi keracunan
tingkat sedang hingga berat disebabkan pekerjaan, yaitu antara 8,5%−50%
(Achmadi, 2005).
Pestisida dikelompokkan menjadi tiga yaitu insektisida sebagai pembunuh
insekta, fungisida sebagai pembunuh jamur dan herbisida sebagai pembunuh
tanaman pengganggu. Kematian yang disebabkan oleh keracunan pestisida
2
karena disalahgunakan yaitu untuk bunuh diri. Sekarang ini
bermacam-macam jenis pestisida telah diproduksi dengan usaha mengurangi efek
samping yang dapat menyebabkan berkurangnya daya toksisitas pada
manusia, tetapi sangat toksik pada tanaman penggangu dan serangga (WHO,
2008).
Penggunaan pestisida secara global dan jenis-jenis pestisida yang digunakan
jika dipresentasikan penggunaan herbisida adalah yang terbanyak, kemudian
insektisida dan fungsida. Insektisida adalah pestisida yang paling banyak
digunakan di negara maju, sedangkan fungisida dan herbisida paling banyak
digunakan di negara berkembang (Ginting et al., 2012).
Herbisida paraquat dan diquat termasuk golongan dipyrydyl yang merupakan herbisida non−selektif dan secara luas sering digunakan, terutama pada sistem
pertanian dan oleh agen pemerintah dan perindustrian untuk mengontrol hama
tanaman. Paraquat dibatasi pemakaiannya terutama di Amerika Serikat, dan
sudah menjadi isu dunia yang signifikan tentang kemungkinan keracunannya.
Beberapa negara di Eropa juga sudah membatasi pemakaian paraquat. Pada
beberapa dekade terakhir, paraquat menjadi agen yang popular untuk
tindakan bunuh diri (Indika & Buckley, 2011).
Keracunan herbisida merupakan permasalahan kesehatan masyarakat di
3
herbisida per 100.000 populasi setiap tahun. Paraquat merupakan agen
penyebab kematian utama di Sri Lanka dengan angka fatalitas yang tinggi
yaitu lebih dari 50%. Keracunan paraquat tidak hanya merupakan masalah di daerah Asia−Pasifik dan Sri Lanka, pada tahun 1986−1990, 63% dari seluruh
percobaan bunuh diri di Trinidad-Tobago dikarenakan paraquat. Kontribusi
yang sama tentang kematian akibat paraquat juga dilaporkan dari Trinidad
Selatan yaitu 76% diantara tahun 1996−1997 dan Samoa yaitu 70% dari tahun 1979−2000 (Indika & Buckley, 2011).
Penelitian oleh Saftarina (2011) di desa Raja Basa Bandar Lampung
didapatkan petani melakukan penyemprotan pestisida rata-rata lebih dari 3
kali dalam seminggu. Petani melakukan penyemprotan walaupun tidak ada
tanda-tanda tanaman yang diserang hama, hal ini dilakukan untuk mencegah
tanaman diserang hama secara tiba-tiba. Pada saat melakukan penyemprotan
pestisida, para petani kurang memperhatikan arah angin dan cara pemakaian
pestisida yang benar.
Penelitian yang dilakukan oleh Pujiono (2009) pada tenaga kerja di tempat
penjualan pestisida di kabupaten subang didapatkan bahwa masih banyak
tenaga kerja yang praktek pengelolaan pestisida tidak memakai alat pelindung
diri yang memenuhi syarat dengan alasan tidak disediakannya alat pelindung
diri, sudah terbiasa tidak pakai dan menghambat aktivitas saat bekerja.
Sebagian pekerja telah mempunyai persepsi bahwa praktek saat mengelola
4
menggunakan alat pelindung diri, dan hal ini cenderung telah menjadi
perilaku pekerja untuk tidak menggunakan alat pelindung diri pada saat
mengelola pestisida. Pemakaian alat pelindung diri yang tidak memenuhi
syarat, berisiko menyebabkan keracunan pestisida terhadap tenaga kerja.
Penggunaan pestisida apabila tidak benar dan tepat maka akan menimbulkan
efek samping terhadap manusia. Efek samping dapat berupa hasil dari
penimbunan yang berlama-lama, surface runoff, atau kontak langsung dengan
komponen herbisida. Resiko terhadap manusia, kehidupan hewan, dan
kematian terhadap tumbuhan disekitarnya, harus dipertimbangkan sebelum
pemakainan pestisida (WHO, 2008).
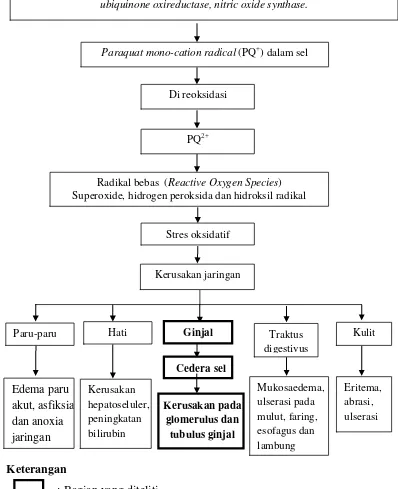
Paparan herbisida golongan paraquat diklorida berpengaruh ke organ-organ
tubuh seperti paru-paru, jantung, ginjal, hati, otot, limpa, kulit, mata dan otak.
Pada organ ginjal didapatkan kerusakan pada tubulus ginjal. Gangguan fungsi
ginjal memainkan peranan penting untuk menentukan outcome dari
keracunan paraquat (Ginting et al., 2012).
Rute utama eliminasi pestisida paraquat setelah masuk aliran darah adalah
melalui ginjal dimana paraquat secara aktif disekresi oleh sistem transport
kation organik. Konsentrasi paraquat yang lebih tinggi dapat bersifat
nefrotoksik. Kerusakan ginjal ditandai dengan adanya proteinuria, hematuri,
5
Pada penelitian yang dilakukan oleh Malekinejad et al (2011) didapatkan
bahwa pemberian paraquat secara subkutan menyebabkan perubahan
gambaran histopatologi pada ginjal berupa nefritis interstitial multifokal,
endapan protein pada tubulus dan degenerasi tubulus.
Berdasarkan hal di atas, peneliti tertarik untuk melakukan penelitian tentang
pengaruh pemberian herbisida golongan paraquat diklorida per−oral terhadap
gambaran histopatologi ginjal tikus putih (Rattus norvegicus) jantan galur
Sprague dawley.
1.2 Rumusan Masalah
Herbisida paraquat diklorida merupakan salah satu herbisida yang angka
penggunaannya tinggi. Keracunan herbisida menjadi permasalahan kesehatan
masyarakat di negara berkembang dengan perkiraan sekitar 300.000 kematian di daerah Asia−Pasifik. Paparan herbisida paraquat berpengaruh ke
organ-organ tubuh seperti paru-paru, jantung, ginjal, hati, otot, limpa, kulit, mata
dan otak. Rute utama eliminasi paraquat setelah masuk aliran darah adalah
melalui ginjal. Konsentrasi paraquat yang lebih tinggi dapat bersifat
nefrotoksik. Dari uraian singkat tersebut dapat dirumuskan:
Apakah terdapat pengaruh pemberian herbisida golongan paraquat diklorida per−oral terhadap gambaran histopatologi ginjal tikus putih (Rattus
6
1.3 Tujuan
Tujuan Umum:
Untuk mengetahui pengaruh pemeberian herbisida golongan paraquat
diklorida per−oral terhadap gambaran histopatologi ginjal tikus putih (Rattus
norvegicus) jantan galur Sprague dawley.
Tujuan Khusus:
1. Untuk mengetahui pengaruh pemberian herbisida golongan paraquat
diklorida per−oral terhadap gambaran histopatologi glomerulus ginjal
tikus putih (Rattus norvegicus) jantan galur Sprague dawley.
2. Untuk mengetahui pengaruh pemberian herbisida golongan paraquat
diklorida per−oral terhadap gambaran histopatologi tubulus ginjal tikus
putih (Rattus norvegicus) jantan galur Sprague dawley.
1.4 Manfaat
Manfaat Teoritis:
Penelitian ini dapat digunakan untuk pengembangan Ilmu Patologi Anatomi
dan agromedicine khususnya di bidang Toksikologi.
Manfaat Praktis:
1. Bagi Peneliti
Penelitian ini sebagai wujud pengaplikasian disiplin ilmu yang telah
7
2. Bagi Masyarakat
Hasil penelitian ini diharapkan dapat memberikan informasi mengenai
pengaruh paparan herbisida paraquat diklorida terhadap ginjal.
3. Bagi Fakultas Kedokteran Universitas Lampung
Meningkatkan iklim penelitian dibidang agromedicine sehingga dapat
menunjang pencapaian visi Fakultas Kedokteran Universitas Lampung
sebagai Fakultas Kedokteran Sepuluh Terbaik di Indonesia pada Tahun
2025 dengan kekhususan agromedicine.
4. Bagi Peneliti Lain
Dapat dijadikan bahan acuan untuk dilakukannya penelitian yang serupa
yang berkaitan dengan herbisida paraquat diklorida.\
1.5 Kerangka Teori
Herbisida merupakan suatu bahan atau senyawa kimia yang digunakan untuk
menghambat pertumbuhan atau mematikan tumbuhan (Riadi, 2011).
Herbisida paraquat diklorida merupakan herbisida yang dapat diaplikasikan
pada saat purna tumbuh. Herbisida ini merupakan herbisida kontak yang
dapat mematikan jaringan tumbuhan yang terkontaminasi dan beracun pada
sel-sel tumbuhan yang hidup (Sarbino & Syahputra, 2012).
Paraquat merupakan suatu herbisida golongan bipyridylium. Komposisi kimia
dari paraquat adalah C12H14N2 (karbon, hidrogen dan nitrogen). Paraquat
merupakan zat yang sangat toksik dan dapat memasuki tubuh dengan
8
rusak, mungkin juga melalui inhalasi. Beribu kematian muncul karena
menelan untuk bunuh diri atau kontak kulit dengan paraquat biasanya karena
pekerjaan (Indika & Buckley, 2011).
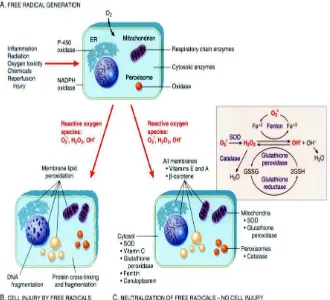
Paraquat menginduksi toksisitas dikarenakan kemampuannya untuk
mempengaruhi siklus redoks dan membentuk ROS. Paraquat dimetabolisme
oleh beberapa sistem enzim seperti NADPH-Cytochrome p450 reductase,
Xantin oksidase, NADH dan ubiquinone oxireductase serta nitric oxide
synthase. Metabolisme paraquat melalui sistem enzim ini menyebabkan
terbentuknya paraquat mono-cation radical (PQ+) di dalam sel. PQ2+ secara cepat di reoksidasi menjadi PQ2+ dan proses ini mencetuskan terbentuknya superoxide (O2) yang menyebabkan kerusakan oksidatif terhadap lemak,
protein dan DNA (Indika & Buckley, 2011).
Paraquat akan menyebabkan peningkatan reaksi oksidasi di dalam tubuh
dengan cara dimetabolisme oleh berbagai enzim seperti NADPH sehingga
akan meningkatkan ROS (Haliwell & Whiteman, 2004). Paparan herbisida
golongan paraquat diklorida berpengaruh ke organ-organ tubuh seperti
paru-paru,jantung, ginjal, hati, otot, limpa, kulit, mata dan otak. Pada paru-paru
akan terjadi edema paru akut, yang akan menyebabkan asfiksia dan anoxia
jaringan. Pada kulit, paraquat menyebabkan kerusakan kulit lokal termasuk
dermatitis kontak yang meimbulkan eritema, abrasi dan ulserasi paraquat
9
Traktus gastrointestinal merupakan tempat awal kerusakan yang ditandai
mukosa edema, ulserasi pada mulut, faring, esofagus dan lambung. Paraquat
juga menyebabkan kerusakan hepatoseluler, peningkatan bilirubin dan enzim
hepatoseluler. Pada organ ginjal didapatkan kerusakan pada glomerulus
tubulus ginjal. Gangguan fungsi ginjal memainkan peranan penting untuk
menentukan outcome dari keracunan paraquat (Ginting et al., 2012).
10
Radikal bebas (Reactive Oxygen Species)
Superoxide, hidrogen peroksida dan hidroksil radikal
Cedera sel
Dimetabolisme oleh enzim NADPH-Cytochrome p450 reductase, Xantin oksidase,
ubiquinone oxireductase, nitric oxide synthase.
Karbon, Hidrogen dan Nitrogen
Paraquat mono-cation radical (PQ+) dalam sel
11
1.6 Kerangka Konsep
Kerangka konsep pada penelitian ini, tersaji pada gambar 2.
Gambar 2. Kerangka konsep
1.7 Hipotesis
Terdapat pengaruh pemberian herbisida paraquat diklorida per−oral terhadap
gambaran histopatologi ginjal tikus putih (Rattus norvegicus) jantan galur
12
BAB II
TINJAUAN PUSTAKA
2.1 Herbisida Golongan Paraquat Diklorida
2.1.1 Deskripsi Herbisida Golongan Paraquat Diklorida
Herbisida merupakan suatu bahan atau senyawa kimia yang digunakan
untuk menghambat pertumbuhan atau mematikan tumbuhan. Herbisida
ini dapat mempengaruhi proses pembelahan sel, perkembangan
jaringan, pembentukan klorofil, fotosintesis, respirasi, metabolisme
nitrogen, aktivitas enzim dan sebagainya yang sangat diperlukan
tumbuhan untuk mempertahankan kelangsungan hidupnya. Herbisida
berasal dari metabolit, hasil ekstraksi, atau bagian dari suatu organisme.
Di samping itu herbisida bersifat racun terhadap gulma atau tumbuhan
penganggu juga terhadap tanaman. Herbisida yang diaplikasikan
dengan dosis tinggi akan mematikan seluruh bagian dan jenis
tumbuhan. Pada dosis yang lebih rendah, herbisida akan membunuh
tumbuhan dan tidak merusak tumbuhan yang lainnya (Riadi, 2011).
Herbisida paraquat diklorida merupakan herbisida yang dapat
diaplikasikan pada saat purna tumbuh. Herbisida ini merupakan
herbisida kontak yang dapat mematikan jaringan tumbuhan yang
13
daun tanaman terkena herbisida, daun akan segera layu dan akhirnya
seperti terbakar. Keuntungan penggunaan herbisida kontak adalah
gulma cepat mati sehingga dapat segera ditanami (Sarbino &
Syahputra, 2012).
Penetrasi paraquat terjadi melalui daun. Aplikasi paraquat akan lebih
efektif apabila ada sinar matahari karena reaksi keduanya akan
menghasilkan hidrogen peroksida yang merusak membran sel. Cara
kerja paraquat yaitu menghambat proses dalam fotosistem I, yaitu
mengikat elektron bebas hasil fotosistem dan mengubahnya menjadi
elektron radikal bebas. Radikal bebas yang terbentuk akan diikat oleh
oksigen membentuk superoksida yang bersifat sangat aktif. Superoksida
tersebut mudah bereaksi dengan komponen asam lemak tak jenuh dari
membran sel, sehingga akan menyebabkan rusaknya membran sel dan
jaringan tanaman (Pusat Informasi Paraquat, 2006).
2.1.2 Penggunaan Herbisida Golongan Paraquat Diklorida
Pada era peningkatan mekanisasi dan program budidaya intensif ini,
peran penggunaan herbisida dalam upaya meningkatkan hasil dan
mengurangi biaya produksi semakin besar. Seperti kita ketahui bersama
bahwa peran herbisida kini sangat penting dalam mengurangi jumlah
gulma yang mengganggu tanaman utama. Penggunaan herbisida dan
jenis pestisida lainnya telah memberikan kontribusi yang sangat penting
14
Penggunaan herbisida untuk mendukung produktivitas pertanian dunia
masih dominan yaitu 49,6% dibandingkan dengan jenis pestisida
lainnya. Tiga bahan aktif herbisida paling luas digunakan adalah
glifosat, paraquat dichloride, dan dichloro phenoxyacetic acid
(Supriadi, 2011).
2.1.3 Kandungan Kimia Herbisida Golongan Paraquat Diklorida
Paraquat merupakan suatu herbisida golongan bipyridylium. Komposisi
kimia dari paraquat adalah C12H14N2 (karbon, hidrogen dan nitrogen).
Paraquat merupakan herbisida yang paling umum digunakan dari
golongan ini. Angka kematian akibat toksisitas dari paraquat sangat
tinggi dikarenakan toksisitasnya secara langsung dan belum adanya
pengobatan yang efektif (Indika & Buckley, 2011).
Menurut WHO's Classification of Pesticides by Hazard, bahan aktif
paraquat termasuk golongan II dimana absorbsi paraquat mempunyai
efek serius dalam jangka panjang. Dengan dosis rendah paraquat relatif
berbahaya dan fatal jika termakan atau mengenai kulit secara langsung
(WHO, 2009). Selain itu herbisida paraquat dapat mempengaruhi
kesehatan manusia lewat tanah dan air yang tercemar sehingga produk
15
2.1.4 Mekanisme Toksisitas Herbisida Golongan Paraquat Diklorida Herbisida dapat menimbulkan efek pada hama khususnya tanaman
pengganggu, namun herbisida dapat mempengaruhi mekanisme yang
penting bagi bentuk kehidupan yang lebih tinggi seperti manusia dan
hewan. Dalam dosis kecil, herbisida tidak berbahaya bagi manusia dan
hewan karena ukurannya yang jauh lebih besar dari hama tanaman
pengganggu, namun apabila dosis kecil tersebut terakumulasi dalam
jumlah tertentu akan membahayakan manusia dan hewan. Kontak
dengan herbisida akan mengakibatkan efek bakar yang langsung dan
dapat terlihat pada penggunaan kadar tinggi karena kandungan asam
sulfat 70%, besi sulfat 30%, tembaga sulfat 40%, dan paraquat.
Keracunan herbisida menyebabkan rusaknya lapisan selaput lendir
saluran pernafasan, dehidrasi, rasa terbakar di saluran pencernaan,
terganggunya sistem pernafasan yang akhirnya menyebabkan korban
kejang, muntah, koma akibat kekurangan oksigen hingga kematian
mendadak jika tidak segera mendapatkan pertolongan (Riadi, 2011).
Faktor resiko yang berhubungan dengan kejadian keracunan pestisida
yaitu umur, jenis kelamin, pengetahuan, pengalaman, keterampilan,
pendidikan, pemakaian alat pelindung diri, status gizi dan praktek
penanganan pestisida. Sedangkan fase kritis yang harus diperhatikan
adalah penyimpanan pestisida, pencampuran pestisida, penggunaan
pestisida dan pasca penggunaan pestisida (Achmadi, 2005). Terdapat 3
16
lahan, banyak pestisida yang digunakan dan frekuensi penyemprotan
(Saftarina, 2011)
Paraquat merupakan zat yang sangat toksik dan dapat memasuki tubuh
dengan beberapa cara, terutama dengan cara tertelan tiba-tiba, atau
melalui kulit yang rusak, mungkin juga melalui inhalasi. Beribu
kematian dijumpai karena menelan paraquat atau kontak dengan kulit
biasanya karena pekerjaan. Paraquat sangat bersifat korosif terhadap
kulit dan sangat mudah terabsorbsi kedalam tubuh. Seorang petani
meninggal hanya dalam 3,5 jam setelah menyemprot paraquat yang
sudah diencerkan dengan luka pada tangan dan kaki yang tidak tertutup.
Lebih dari ribuan para pekerja yang pernah terpapar paraquat baik akut
maupun kronik, terkena efek paraquat tersebut (Indika & Buckley,
2011).
Di negara berkembang, paraquat sering digunakan dengan sembarangan
dan tidak memperhatikan label peringatan sehingga menyebabkan
angka keterpaparan yang tinggi. Hanya sedikit sendok teh paraquat,
maka dapat menyebabkan kematian. Kematian dikarenakan kegagalan
pernafasan dan mungkin bisa dijumpai dalam beberapa hari setelah
keracunan bahkan sampai beberapa bulan kemudian (Indika & Buckley,
17
Lama reaksi reaksi racun ditentukan dari kondisi fisik korban. Korban
dengan kondisi fisik lemah, kurang gizi, perut kosong atau menderita
tukak lambung akan cepat mengalami muntah–muntah dan mulut
berbuih. Jika terindikasi keracunan, secepatnya korban diberikan
antidotum seperti norit, putih telur atau susu. Tujuan pemberian
antidotum agar dinding usus tidak rusak dan racun tidak diserap oleh
darah. Namun cara yang paling penting adalah agar korban muntah
sehingga jumlah herbisida yang masuk berkurang (Riadi, 2011).
Paraquat menginduksi toksisitas dikarenakan kemampuannya untuk
mempengaruhi siklus redoks dan membentuk Reactive Oxygen Species
(ROS). Paraquat dimetabolisme oleh beberapa sistem enzim seperti
NADPH-Cytochrome p450 reductase, Xantin oksidase, NADH, dan
ubiquinone oxireductase serta nitric oxide synthase. Metabolisme
paraquat melalui sistem enzim ini menyebabkan terbentuknya paraquat
mono-cation radical (PQ+) di dalam sel. PQ+ secara cepat di reoksidasi menjadi PQ2+ dan proses ini mencetuskan terbentuknya superoxide (O2). Superoxide bertindak sebagai reseptor elektron dan NADP
bertindak sebagai donor elektron pada reaksi ini. Reaksi ini lebih jauh
membentuk Hydroxyl free radical (HO). Paraquat secara langsung atau
tidak langsung menginduksi nitric oxide synthase menghasilkan Nitric
Oxide (NO). NO berikatan dengan O2 membentuk peroxinitrite
18
oksigen reaktif dan nitrite menyebabkan toksisitas pada kebanyakan
organ (Indika & Buckley, 2011).
Paraquat merupakan bahan reduksi alternatif dan reoksidasi berulang
akan menyebabkan terbentuknya oksigen free radicals, seperti
superoksida, hidrogen peroksida, dan hidroksil radikal, yang
menyebabkan kerusakan oksidatif terhadap lemak, protein dan DNA.
Siklus redoks juga menyebabkan berkurangnya jumlah NADPH dan
Thiol intraseluler (Indika & Buckley, 2011). Paraquat akan
menyebabkan peningkatan reaksi oksidasi di dalam tubuh dengan cara
dimetabolisme oleh berbagai enzim seperti Nikotinamideadenine
dinukleotide phosphate oxidase (NADPH) sehingga akan meningkatkan
ROS (Haliwell & Whiteman, 2004).
Paparan herbisida golongan paraquat diklorida berpengaruh ke
organ-organ tubuh seperti paru-paru, jantung, ginjal, hati, otot, limpa, kulit,
mata dan otak. Paru-paru merupakan target primer dari toksisitas
paraquat baik akut dan kronik. Pada paru-paru akan terjadi edema paru
akut, yang akan menyebabkan gangguan pertukaran gas sehingga
proliferasi jaringan ikat fibrosa semakin progresif di alveoli dan
menyebabkan asfiksia dan anoxia jaringan. Pada kulit, paraquat
menyebabkan kerusakan kulit lokal termasuk dermatitis kontak yang
19
Traktus gastrointestinal merupakan tempat awal kerusakan yang
ditandai mukosa edema, ulserasi pada mulut, faring, esofagus dan
lambung. Paraquat juga menyebabkan kerusakan hepatoseluler,
peningkatan bilirubin dan enzim hepatoseluler. Otak merupakan organ
yang sangat vital, karena di otak terdapat sistem saraf pusat yang
apabila terjadi gangguan pada otak bisa memicu munculnya berbagai
penyakit misalnya, alzheimer dan sindrom parkinson. Pada organ ginjal
didapatkan kerusakan pada tubulus ginjal. Gangguan fungsi ginjal
memainkan peranan penting untuk menentukan outcome dari keracunan
paraquat (Ginting et al., 2012).
Setiap obat atau racun yang masuk dalam tubuh akan mengalami
absorbsi, distribusi, metabolisme, dan ekskresi. Ginjal merupakan organ
ekskresi utama. Ekskresi di ginjal dapat berefek samping baik karena
toksik, obat atau konsentrasi tinggi zat yang potensial dapat merusak,
menyebabkan nekrosis tubuler akut (NTA), nefritis intersisial akibat
obat dan glomerulonefritis membranosa (Dharma, 2006).
Pemberian formulasi pestisida menyebabkan perubahan histopatologi
pada ginjal baik pada glomerulus, tubulus maupun interstisiumnya.
Perubahan yang ditemukan pada glomerulus adalah edema ruang
Bowman. Pada tubulus terjadi degenerasi, apoptosis, endapan protein
pada lumen dan dilatasi lumen tubulus. Kongesti adalah perubahan
20
2.2 Ginjal
2.2.1 Anatomi Ginjal
Ginjal terletak pada dinding posterior abdomen di daerah lumbal, di
sebelah kanan dan kiri tulang belakang dibungkus lapisan lemak,
dibelakang peritonium (Price & Wilson, 2012). Kedua ginjal terletak
retroperitoneal pada dinding abdomen, masing-masing disisi dekstra
dan sinistra columna vertebralis setinggi vertebra T12 sampai L3.
Ginjal dekstra terletak sedikit lebih rendah daripada ginjal sinistra
karena besarnya lobus hepatis dekstra. Masing-masing ginjal memiliki
facies anterior dan facies poserior, margo medialis dan margo lateralis,
extremitas superior dan extremitas inferior (Moore, 2002).
Pada orang dewasa, panjang ginjal adalah sekitar 12 cm sampai 13 cm,
lebarnya 6 cm, tebalnya 2,5 cm dan beratnya sekitar 150 gram.
Ukurannya tidak berbeda menurut bentuk dan ukuran tubuh. (Price &
Wilson, 2012). Sisi medial ginjal berbentuk cekung dan sisi lateralnya
cembung. Sisi cekung medial ginjal atau disebut hilum merupakan
tempat masuknya saraf, keluar masuknya pembuluh darah dan
pembuluh limfa, serta keluarnya ureter (Junqueira & Carneiro, 2007).
Ginjal mendapatkan aliran darah dari arteri renalis yang merupakan
cabang langsung dari aorta abdominalis, sedangkan darah vena
dialirkan melalui vena renalis yang bermuara ke dalam vena kava
21
mempunyai anastomosis dengan cabang–cabang dari arteri lain,
sehingga jika terdapat kerusakan salah satu cabang arteri ini, berakibat
timbulnya iskemia atau nekrosis pada daerah yang dilayaninya
(Purnomo, 2012).
Aliran darah di dalam kedua ginjal seorang dewasa berjumlah 1,2−1,3L
darah permenit. Hal ini berarti bahwa seluruh darah yang beredar dalam
tubuh mengalir melalui ginjal setiap 4−5 menit. Glomerulus terdiri atas
kapiler arteri dengan tekanan hidrostastik lebih kurang 45 mmHg yang
lebih tinggi dari tekanan hidrostatik kapiler lain di tubuh (Junqueira &
Carneiro, 2007).
2.2.2 Histologi Ginjal
Unit fungsional setiap ginjal yaitu tubulus uriniferus mikroskopik.
Tubulus ini terdiri dari nefron dan duktus koligentes yang menampung
curahan dari nefron. Jutaan nefron terdapat di setiap korteks ginjal.
selanjutnya, nefron terbagi lagi menjadi dua komponen yaitu
korpuskulum ginjal dan tubulus ginjal. Korpuskulum ginjal terdiri dari
suatu kumpulan yang disebut glomerulus yang dikelilingi oleh dua lapis
sel epitel, yaitu kapsul glomerulus (Bowman). Ada dua lapisan dalam
korpuskulum ginjal yaitu lapisan dalam atau stratum viseral yang
teridiri dari sel epitel khusus disebut podosit dan lapisan luar atau
22
Korpuskulum ginjal menyaring darah melalui kapiler-kapiler di
glomerulus dan filtrat masuk ke stratum kapsulare yang terletak
diantara stratum parietal dan stratum viseral. Filtrasi darah di
korpuskulum ginjal difasilitasi oleh endotel glomerulus. Endotel di
kapiler glomerulus ini berfenestra dan sangat permeabel terhadap
banyak substansi di dalam darah, kecuali elemen darah yang terbentuk
atau protein plasma. Oleh karena itu, filtrat glomerulus yang masuk ke
spatium kapsulare bukanlah urin, melainkan ultrafiltrat yang mirip
dengan plasma, kecuali tidak mengandung protein (Eroschenko, 2010).
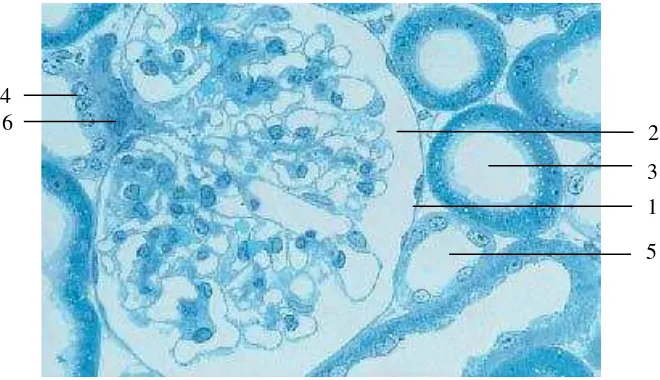
Secara histopatologi, gambaran glomerulus ginjal normal manusia
terlihat pada gambar 3.
Gambar 3. Histologi glomerulus ginjal normal manusia (Sumber: Kuehnel, 2003).
Keterangan: 1. Kapsular Bowman, 2. Spatium Bowman, 3. Arteriol
glomerulus aferen, 4. Tubulus distal, 5. Makula densa, 6. Polus urinarius.
Pada kutub urinarius di korpuskel renalis, epitel gepeng di lapisan
parietal kapsula bowman berhubungan langsung dengan epitel tubulus
kontortus proksimal yang berbentuk kuboid atau silindris rendah. 1 3 2
5 4
23
Tubulus ini lebih panjang dari tubulus kontortus distal dan karenanya
tampak lebih banyak di dekat korpuskel ginjal dalam korteks ginjal. Sel−sel epitel kuboid ini memiliki sitoplasma asidofilik yang
disebabkan oleh adanya mitokondria panjang dalam jumlah besar.
Apeks sel memiliki banyak mikrovili dengan panjang kira-kira 1 µm
yang membentuk suatu brush border (Junquiera & Carneiro, 2007).
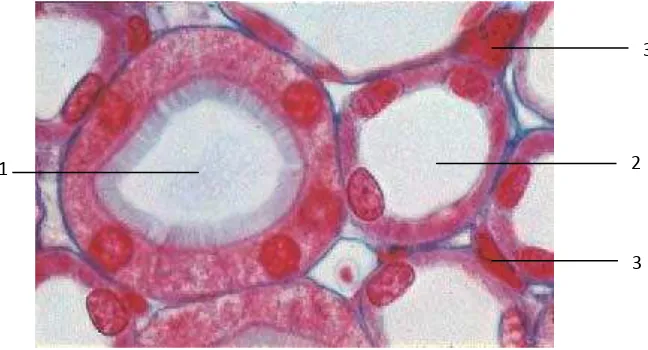
Secara histopatologi, gambaran tubulus ginjal normal manusia terlihat
pada gambar 4.
Gambar 4. Histologi tubulus ginjal normal manusia (Sumber: Kuehnel, 2003).
Keterangan: 1. Tubulus proximal, 2. Tubulus distal, 3. Pembuluh darah
Filtrat glomerulus keluar dari korpuskulum ginjal di polus urinarius dan
mengalir melalui berbagai bagian nefron sebelum sampai tubulus ginjal
yaitu tubulus koligens dan duktus koligens. Filtrat glomerulus
mula-mula masuk ke tubulus ginjal, yang terbentang dari kapsul glomerulus
sampai tubulus koligens. Tubulus ginjal ini memiliki beberapa bagian
histologik dan fungsional yang berbeda. Bagian tubulus yang berawal 3
1
24
di korpuskulum ginjal sangat berkelok atau melengkung sehingga
disebut tubulus kontortus proksimal (Eroschenko, 2010).
Tubulus kontortus proksimal mengabsorpsi seluruh glukosa dan asam
amino dan lebih kurang 85% natrium klorida dan air dari filrat, selain
fosfat dan kalsium. Selain aktivitas tersebut, tubulus kontortus
proksimal menyekresikan kreatinin dan subsatansi asing bagi
organisme, seperti asam para aminohippurat dan penisilin, dari plasma
interstitial ke dalam filtrat. Hal tersebut merupakan suatu proses aktif
yang disebut sekresi tubulus (Junquiera & Carneiro, 2007).
Sel epitel tubulus proksimal sangat peka terhadap anoksia dan rentan
terhadap toksik. Banyak faktor yang memudahkan tubulus mengalami
toksik, seperti permukaan bermuatan listrik yang luas untuk reabsorbsi
tubulus, sistem transport aktif untuk ion dan asam organik serta
kemampuan melakukan pemekatan secara efektif. Iskemia
menyebabkan banyak perubahan struktural di sel epitel. Hilangnya
polaritas sel tampaknya merupakan kejadian awal yang penting secara
fungsional atau reversibel (Robbins et al., 2011).
Tubulus kontortus distal tidak memiliki brush border, tidak ada
kanalikuli apikal, dan ukuran sel yang lebih kecil. Tubulus ini
mengadakan kontak dengan kutub vaskular di korpuskel ginjal yang
25
mengalami modifikasi, seperti halnya dengan arteriol aferennya. Di
daerah jukstaglomerulus ini, sel-sel tubulus kontortus distal biasanya
menjadi silindris dan intinya berhimpitan. Kebanyakan selnya memiliki
kompleks Golgi di bagian basal. Dinding segmen tubulus distal yang
termodifikasi ini, yang tampak lebih gelap pada sediaan mikroskopik
karena rapatnya inti, disebut makula densa (Junqueira & Carneiro,
2007).
Fungsi utama aparatus jukstaglomerulus adalah mempertahankan
tekanan darah yang sesuai di ginjal untuk filtrasi glomerulus. Sel di
aparatus ini bekerja sebagai baroreseptor dan kemoreseptor. Sel
jukstaglomerulus memantau perubahan tekanan darah sistemik dengan
berespon terhadap peregangan dinding arteriol aferen. Sel-sel makula
densa peka terhadap perubahan konsentrasi natrium klorida. Penurunan
tekanan darah menyebabkan jumlah filtrat glomerulus berkurang dan
akibatnya, konsentrasi ion natrium di filtrat berkurang sewaktu filtrat
melewati makula densa di tubulus kontortus distal. Penurunan tekanan
darah sistemik atau penurunan konsentrasi natrium dalam filtrat
merangsang sel jukstaglomerulus untuk melepaskan enzim renin ke
dalam aliran darah (Eroschenko, 2010).
Urin mengalir dari tubulus kontortus distal ke tubulus koligentes, yang
saling bergabung membentuk duktus koligentes yang lebih besar dan
26
kuboid. Di sepanjang perjalanannya, tubulus dan duktus koligentes
terdiri atas sel–sel yang tampak pucat dengan pulasan biasa. Epitel
duktus koligentes responsif terhadap vasopresin arginin atau hormon
antidiuretik, yang disekresi hipofisis posterior. Jika masukan air
terbatas, hormon antidiuretik disekresi dan epitel duktus koligentes
mudah dilalui air yang diabsorbsi dari filtrat glomerulus. Air berpindah
ke kapiler darah sehingga air dipertahankan dalam tubuh (Junquiera &
Carneiro, 2007).
2.2.3 Fisiologi Ginjal
Ginjal melakukan berbagai fungsi yang ditujukan untuk
mempertahankan homeostasis. Ginjal bekerja sama dengan masukan
hormonal dan saraf yang mengrontrol fungsinya. Ginjal merupakan
organ yang terutama berperan dalam mempertahankan stabilitas
volume, komposisi elektrolit dan osmolaritas/konsentrasi zat terlarut
cairan ekstra seluler. Dengan menyesuaikan jumlah air dan berbagai
konstituen plasma yang dipertahankan ditubuh atau dikeluarkan di urin,
ginjal dapat mempertahankan keseimbangan air dan elektrolit dalam
kisaran yang sangat sempit yang memungkinkan kehidupan, meskipun pemasukan dan pengeluaran konstituen−konstituen ini melalui saluran
27
Price & Wilson (2012) menjelaskan secara singkat fungsi utama ginjal
yaitu:
Fungsi Eksresi:
1) Mempertahankan osmolalitas plasma sekitar 285 mili Osmol
dengan mengubah-ubah ekresi air.
2) Mempertahankan volume ekstracellular fluid (ECF) dan tekanan
darah dengan mengubah-ubah ekresi natrium.
3) Mempertahankan konsentrasi plasma masing-masing elektrolit
individu dalam rentang normal.
4) Mempertahankan derajat keasaman atau pH plasma sekitar 7,4
dengan mengeluarkan kelebihan hidrogen dan membentuk kembali
karbonat.
5) Mengeksresikan produk akhir nitrogen dari metabolisme protein
terutama urea, asam urat dan kreatinin.
6) Bekerja sebagai jalur ekskretori untuk sebagian besar obat.
Fungsi non eksresi:
Menyintesis dan mengaktifkan hormon :
1) Renin: penting dalam pengaturan tekanan darah
2) Eritropoietin: merangsang produksi sel darah merah oleh sumsum
tulang
3) 1,25-dihidroksivitamin D3 sebagai hidroksilasi akhir vitamin D3
28
4) Prostaglandin: sebagian besar adalah vasodilator bekerja secara
lokal dan melindungi dari kerusakan iskemik ginjal.
5) Degradasi hormon polipeptida
6) Insulin, glukagon, parathormon, prolaktin, hormon pertumbuhan,
ADH dan hormon gastrointestinal yaitu gastrin, polipetida
intestinal vasoaktif.
Ginjal adalah organ utama untuk membuang produk sisa metabolisme
yang tidak diperlukan lagi oleh tubuh. Produk-produk ini meliputi urea
dari sisa metabolisme asam amino, kreatinin asam urat dari asam
nukleat, produk akhir dari pemecahan hemoglobin yaitu bilirubin.
Gangguan pada fungsi ginjal dapat diketahui melalui pengukuran
beberapa bahan-bahan hasil metabolisme diantaranya adalah ureum dan
kreatinin (Guyton & Hall, 2008).
2.2.4 Patologi Ginjal
Ginjal menerima darah sebesar 20%−25% dari curah jantung melalui
arteri renalis. Tingginya aliran darah yang menuju ginjal inilah yang
menyebabkan berbagai macam obat, bahan kimia, dan logam−logam
berat dalam sirkulasi sistemik dikirim ke ginjal dalam jumlah yang
besar. Zat-zat toksik ini akan terakumulasi di ginjal dan menyebabkan
kerusakan bagi ginjal itu sendiri (Schnellman & Goldstein, 2001).
Ginjal memiliki kemampuan untuk mengkonsentrasikan larutan dan
29
yang disebabkan bahan-bahan kimia berbahaya yang ada di dalam
sirkulasi darah (Susianti, 2013). Pada keadaan normal glomerulus tidak
dapat dilalui oleh protein yang bermolekul besar, tetapi pada keadaan
patologis protein tersebut dapat lolos (Junquiera & Carneiro, 2007).
Setiap ginjal memiliki kira-kira satu sampai satu setengah juta nefron.
Bila terjadi kerusakan pada ginjal tersebut, maka akan terjadi gangguan
eksresi ginjal yang menyebabkan perubahan fungsi dan perubahan
struktur yang meliputi reaksi inflamasi, degenerasi, nekrosis dan
fibrosis. Tubulus proksimal yang rusak akibat iskemia atau nefrotoksik,
gagal untuk menyerap jumlah natrium dan air yang terfiltrasi.
Akibatnya makula densa mendeteksi adanya kadar natrium di tubulus
distal dan merangsang peningkatan produksi renin dari sel−sel
jukstaglomerolus. Terjadi aktivasi angiotensin II yang menyebabkan
vasokonstriksi arteriol afferen, mengakibatkan penurunan aliran darah
ginjal dan laju filtrasi glomerulus (Dharma, 2006).
2.3 Radikal Bebas dan Stres Oksidatif 2.3.1 Radikal Bebas
Radikal bebas merupakan spesies kimiawi dengan satu elektron tak
berpasangan di orbital luar. Keadaan kimiawi tersebut sangat tidak
stabil dan mudah bereaksi dengan zat kimia anorganik atau organik,
saat dibentuk dalam sel, radikal bebas segera menyerang dan
30
itu, radikal bebas menginisiasi reaksi autokatalitik. Sebaliknya, molekul
yang bereaksi dengan radikal bebas diubah menjadi radikal bebas,
semakin memperbanyak rantai kerusakan (Robbins et al., 2011).
Tiga reaksi yang paling relevan dengan jejas sel yang diperantarai
radikal bebas:
1) Peroksidasi membran lipid
Ikatan ganda pada lemak tak jenuh membran mudah terkena
serangan radikal bebas berasal dari oksigen. Interaksi radikal lemak
menghasilkan peroksida yang tidak stabil dan reaktif sehingga terjadi
reaksi rantai autokatalitik.
2) Fragmentasi DNA
Reaksi radikal bebas dengan timin pada DNA mitokondria dan
nuklear menimbulkan kerusakan untai tunggal. Kerusakan DNA
tersebut telah memberikan implikasi pada pembunuhan sel dan
perubahan sel menjadi ganas.
3) Ikatan silang protein
Radikal bebas mencetuskan ikatan silang protein diperantarai
sulfhidril, menyebabkan peningkatan kecepatan degradasi atau
hilangnya aktivitas enzimatik. Reaksi radikal bebas juga bisa secara
langsung menyebabkan fragmentasi polipeptida (Robbins et al,
31
Reactive Oxygen Species adalah senyawa yang mengandung O2,
termasuk ke dalam radikal bebas yang sangat reaktif atau senyawa yang
siap dikonversi menjadi radikal bebas O2 dalam sel. Radikal hidroksil
mungkin adalah ROS yang paling poten. ROS terbentuk di sel secara
konstan, sekitar 3%−5% O2 yang dikonsumsi dikonversi menjadi
radikal bebas O2. Sumber utama produksi ROS dalam sel adalah
mitokondria karena sekitar 80%−90% O2 yang masuk digunakan oleh
mitokondria untuk membentuk ROS (Wu & Cederbaum, 2004).
Reactive Oxygen Species terbentuk di hati dan akan masuk kedalam
sirkulasi darah sistemik yang dapat merusak struktur sel-sel jaringan
yaitu jaringan otak, paru-paru, jantung dan ginjal. ROS yang dihasilkan
akan terakumulasi dalam tubuh dan bersifat sebagai radikal bebas dan
dapat menimbulkan kerusakan sel, termasuk sel ginjal (Muhartono et
al., 2012)
Selain ROS yang terbentuk secara alami dalam tubuh, manusia secara
konstan terpapar radikal bebas dari lingkungan dalam bentuk radiasi.
Sinar ultra violet, asap rokok, pestisida, dan beberapa obat kanker
adalah contoh radikal bebas dari lingkungan (Wu & Cederbaum, 2004).
32
Gambar 5. Pembentukan radikal bebas (Sumber: Robbins et al., 2011)
2.3.2 Stres Oksidatif
Keadaan dimana terjadi gangguan keseimbangan antara produksi ROS
dan pembuangan ROS disebut stres oksidatif (Wu & Cederbaum,
2004). Pada kondisi stres oksidatif, radikal bebas akan menyebabkan
terjadinya peroksidasi lipid membran sel dan merusak organisasi
membran sel. Membran sel ini sangat penting bagi fungsi reseptor dan
fungsi enzim, sehingga terjadinya peroksidasi lipid membran sel oleh
radikal bebas dapat mengakibatkan hilangnya fungsi seluler secara total
33
2.4 Tikus Putih (Rattus norvegicus) Galur Sprague dawley 2.4.1 Klasifikasi Tikus Putih
Kingdom : Animalia
Filum : Chordata
Kelas : Mamalia
Ordo : Rodentai
Subordo : Sciurognathi
Familia : Muridae
Genus : Rattus
Species : Rattus norvegicus (Setiorini, 2012).
2.4.2 Jenis Tikus Putih
Tikus putih (Rattus norvegicus) merupakan hewan pengerat dan sering
digunakan sebagai hewan percobaan atau digunakan untuk penelitian,
dikarenakan tikus merupakan hewan yang mewakili dari kelas
mamalia, sehingga kelengkapan organ, kebutuhan nutrisi,
metabolisme biokimianya, sistem reproduksi, pernafasan, peredaran
darah dan ekskresi menyerupai manusia. Tikus yang digunakan dalam
penelitian adalah galur Sprague dawley berjenis kelamin jantan
berumur kurang lebih 3 bulan. Tikus Sprague dawley dengan jenis
kelamin betina tidak digunakan karena kondisi hormonal yang sangat
berfluktuasi pada saat mulai beranjak dewasa, sehingga dikhawatirkan
akan memberikan respon yang berbeda dan dapat mempengaruhi hasil
34
Tikus putih (Rattus norvegicus) juga memiliki beberapa sifat
menguntungkan seperti berkembang biak, mudah dipelihara dalam
jumlah banyak, lebih tenang dan ukurannya lebih besar daripada
mencit. Tikus putih juga memiliki ciri−ciri yaitu albino, kepala kecil
dan ekor lebih panjang dibandingkan badannya, pertumbuhan cepat,
tempramen baik, kemampuan laktasinya tinggi dan tahan terhadap
perlakuan. Keuntungan utama tikus putih (Rattus norvegicus) galur
Sprague dawley adalah ketenangan dan kemudahan penanganannya
(Kesenja, 2005).
2.4.3 Biologi Tikus Putih
Di Indonesia hewan percobaan ini sering dinamakan tikus besar.
Dibandingkan dengan tikus liar, tikus laboratorium lebih cepat
menjadi dewasa dan umumnya lebih mudah berkembang biak. Berat
badan tikus laboratorium lebih ringan dibandingkan dengan berat tikus
liar. Biasanya pada umur empat minggu beratnya 35−40 gram dan
35
BAB III
METODE PENELITIAN
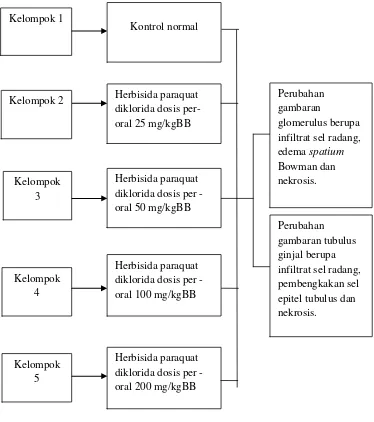
3.1 Desain Penelitian
Penelitian ini merupakan penelitian eksperimental, yaitu untuk mempelajari
suatu fenomena dalam korelasi sebab-akibat, dengan cara memberikan
perlakuan pada subjek penelitian kemudian mempelajari efek perlakuan
tersebut (Notoatmodjo, 2012). Penelitian ini menggunakan metode rancangan
acak terkontrol dengan pola post test-only control group design. Sebanyak 25
ekor tikus putih (Rattus norvegicus) jantan galur Sprague dawley berumur
8−10 minggu yang dipilih secara acak dan dibagi menjadi 5 kelompok, dengan pengulangan sebanyak 5 kali.
3.2 Tempat dan Waktu
Perlakuan hewan coba pada penelitian ini akan dilaksanakan selama bulan
Oktober 2014 di Fakultas Kedokteran Universitas Lampung dan pembuatan
serta pengamatan preparat dilaksanakan di Laboratorium Patologi Anatomi
36
3.3 Populasi dan Sampel
Populasi penelitian ini adalah tikus putih (Rattus norvegicus) jantan galur
Sprague dawley berumur 8−10 minggu yang diperoleh dari laboraturium Unit Kandang Hewan Laboratorium Fakultas Kedokteran Hewan Institut Pertanian
Bogor. Sampel penelitian sebanyak 25 ekor tikus putih jantan yang dipilih
secara acak yang dibagi menjadi 5 kelompok dengan pengulangan sebanyak 5
kali, sesuai dengan rumus Frederer.
Menurut Frederer (1967), rumus penentuan sampel untuk uji eksperimental
adalah:
(t-1) (n-1)≥15
Dimana t merupakan jumlah kelompok percobaan dan n merupakan jumlah
pengulangan atau jumlah sampel tiap kelompok. Penelitian ini menggunakan
5 kelompok perlakuan sehingga perhitungan sampel menjadi:
(5-1)(n-1)≥15
4n-4≥15
4n≥19
n≥4,75
Jadi, sampel yang digunakan tiap kelompok percobaan sebanyak 5 ekor
37
Kriteria Inklusi
a. Tikus putih galur Sprague dawley
b. Berjenis kelamin jantan
c. Berat badan sekitar 100−150 gram d. Berusia sekitar kurang lebih 8–10 minggu e. Tingkah laku dan aktivitas normal
f. Tidak ada kelainan anatomi yang tampak
g. Tidak tampak penampakan rambut kusam, rontok, atau botak, dan
bergerak aktif
Kriteria Eksklusi
a. Terdapat penampakan rambut kusam, rontok atau botak dan aktivitas
kurang atau tidak aktif, keluarnya eksudat yang tidak normal dari mata,
mulut, anus dan genital.
b. Terdapat penurunan berat badan lebih dari 10% setelah masa adaptasi di
laboraturium.
c. Mati selama masa pemberian perlakuan.
3.4 Bahan dan Alat Penelitian 3.4.1 Bahan Penelitian
Bahan penelitian yang digunakan ada 1 yakni herbisida paraquat
diklorida dengan dosis yang diberikan secara berbeda disetiap
kelompoknya, yakni pada kelompok 2 dengan dosis 25 mg/kgBB,
38
dosis 100 mg/kgBB dan pada kelompok 5 dengan dosis 200
mg/kgBB.
3.4.2 Bahan Kimia
Bahan yang digunakan untuk pembuatan preparat histopatologi
dengan metode paraffin meliputi larutan formalin 10% untuk fiksasi,
alkohol 70%, alkohol 96%, alkohol absolut, etanol, xilol, pewarna
Hematoksilin dan Eosin, dan Entelan.
3.4.3 Perangkat Penelitian 3.4.3.1 Alat Penelitian
Alat penelitian yang digunakan dalam penelitian ini adalah
neraca analitik Metler Toledo dengan tingkat ketelitian 0,01g,
untuk menimbang berat tikus, spuit oral 1cc, 3cc dan 5cc,
sonde lambung, minor set untuk membedah perut tikus
(laparotomi), kandang tikus, mikroskop cahaya, gelas ukur
dan pengaduk, serta kamera digital.
3.4.3.2 Alat Pembuat Preparat Histopatologi
Alat pembuat preparat histopatologi yang digunakan yaitu
object glass, deck glass, tissue cassette, rotarymicrotome,
oven, water bath, platening table, autochnicom processor,
staining jar, staining rak, kertas saring, histoplast dan
39
3.5 Prosedur Penelitian
3.5.1 Prosedur Pemberian Dosis Herbisida Paraquat Diklorida
Dosis herbisida paraquat diklorida yang digunakan pada ekperimen
ini adalah 25 mg/kgBB untuk kelompok 2, 50 mg/kgBB untuk
kelompok 3, 100 mg/kgBB untuk kelompok 4, dan 200 mg/kgBB untuk
kelompok 5. Kelompok 1 merupakan kelompok kontrol negatif
sehingga tidak diberikan herbisida paraquat diklorida per-oral.
Herbisida paraquat diklorida yang digunakan pada penelitian ini adalah
herbisida dalam bentuk cair. Dosis herbisida cair yang digunakan
adalah 276 SL atau sama dengan 276 mg/ml yang akan dilarutkan
dengan air sesuai dengan dosis masing-masing kelompok sehingga
mendapatkan jumlah sebanyak 1 ml. Berat rata-rata tikus putih jantan
yang digunakan sebagai hewan coba pada eksperimen ini adalah 100 gram
atau 0,1 kg sehingga didapatkan dosis herbisida paraquat diklorida untuk
40
1) Dosis untuk tiap tikus kelompok 2
Dosis tikus (100 g) = 25 mg/kgBB x 0,1 kg
= 2,5 mg/100gBB
Dosis herbisida dalam bentuk cairan 276 mg = 2,5 mg/100gBB
1 ml x
x = 2,5 mg/100gBB 276 mg
x = 0,009 ml dibulatkan menjadi 0,01 ml
Dosis herbisida paraquat diklorida yang diberikan per-oral adalah
0,01 ml herbisida paraquat diklorida + 0,99 ml air = 1 ml
2) Dosis untuk tiap tikus kelompok 3
Dosis tikus (100 g) = 50 mg/kgBB x 0,1 kg
= 5 mg/100gBB
Dosis herbisida dalam bentuk cairan 276 mg = 5 mg/100gBB
1 ml x x = 5 mg/100gBB
276 mg
x = 0,0018 ml dibulatkan menjadi 0,02 ml
Dosis herbisida paraquat diklorida yang diberikan per-oral adalah
41
3) Dosis untuk tiap tikus kelompok 4
Dosis tikus (100 g) = 100 mg/kgBB x 0,1 kg
= 10 mg/100gBB
Dosis herbisida dalam bentuk cairan 276 mg = 10 mg/100gBB
1 ml x
x = 10 mg/100gBB 276 mg
x = 0,036 ml dibulatkan menjadi 0,04 ml
Dosis herbisida paraquat diklorida yang diberikan per-oral adalah
0,04 ml herbisida paraquat diklorida + 0,96 ml air = 1 ml
4) Dosis untuk tiap tikus kelompok 5
Dosis tikus (200 g) = 200 mg/kgBB x 0,1 kg
= 20 mg/100gBB
Dosis herbisida dalam bentuk cairan 276 mg = 20 mg/100gBB
1 ml x
x = 20 mg/100gBB 276 mg
x = 0,072 ml dibulatkan menjadi 0,07 ml
Dosis herbisida paraquat diklorida yang diberikan per-oral adalah
42
Jadi, dosis toksik minimal herbisida paraquat dikloridayang diberikan
per−oral pada penelitian ini adalah 0,01 ml.
3.5.2 Prosedur Penelitian
a. Tikus sebanyak 25 ekor, dikelompokkan dalam 5 kelompok.
Kelompok 1 (K1) sebagai kontrol negatif, hanya diberi aquadest.
Kelompok 2 (K2) sebagai kontrol patologis, diberikan herbisida
paraquat diklorida dengan dosis 2,5 mg/100gBB, kemudian untuk
kelompok 3 (K3), diberi herbisida paraquat diklorida dengan dosis 5
mg/100gBB, untuk kelompok 4 (K4) diberi dosis 10 mg/100gBB
dan kelompok 5 (K5) diberi dosis 20 mg/100gBB. Pemberian
herbisida paraquat diklorida diberikan secara per−oral selama 2 hari. b. Selanjutnya tikus dilakukan anastesi kemudian didekapitasi dan
dilakukan pembedahan.
c. Dilakukan laparotomi untuk mengambil organ ginjal, setelah itu
bangkai tikus dimusnahkan dengan cara pembakaran ditempat
khusus.
d. Pembuatan sediaan mikroskopis dengan metode paraffin dan
pewarnaan Hematoksilin Eosin.
e. Sampel ginjal difiksasi dengan formalin 10%.
f. Teknik pembuatan preparat :
1) Fixation
a) Memfiksasi spesimen berupa potongan organ ginjal yang telah
43
b) Mencuci dengan air mengalir.
2) Trimming
a) Mengecilkan organ ±3 mm.
b) Memasukkan potongan organ ginjal tersebut ke dalam
embedding cassette.
3) Dehidrasi
a) Menuntaskan air dengan meletakkan embedding cassette pada
kertas tisu.
b) Berturut-turut melakukan perendaman organ ginjal dalam
alkohol bertingkat 70%, 96%, alkohol absolut I, II, III
masing-masing selama 1 jam.
c) Clearing
Untuk membersihkan sisa alkohol, dilakukan clearing dengan
xilol I, II, III masing-masing selama 30 menit.
4) Impregnasi
Impregnasi dengan menggunakan paraffin I dan II masing-masing
selama 1 jam di dalam inkubator dengan suhu 65,10C. 5) Embedding
a) Menuangkan paraffin cair dalam pan.
b) Memindahkan satu persatu dari embedding cassette ke dasar
pan.
c) Melepaskan paraffin yang berisi potongan ginjal dari pan
44
d) Memotong paraffin sesuai dengan letak jaringan yang ada
dengan menggunakan scalpel/pisau hangat.
e) Meletakkan pada balok kayu, ratakan pinggirnya dan buat
ujungnya sedikit meruncing.
f) Memblok paraffin siap dipotong dengan mikrotom.
6) Cutting
a) Sebelum memotong, mendinginkan blok terlebih dahulu.
b) Melakukan pemotongan kasar, dilanjutkan dengan pemotongan
halus dengan ketebalan 4–5 mikron.
c) Memilih lembaran potongan yang paling baik, mengapungkan
pada air dan menghilangkan kerutannya dengan cara menekan
salah satu sisi lembaran jaringan tersebut dengan ujung jarum
dan sisi yang lain ditarik menggunakan kuas runcing.
d) Memindahkan lembaran jaringan ke dalam water bath selama
beberapa detik sampai mengembang sempurna.
e) Dengan gerakan menyendok mengambil lembaran jaringan
tersebut dengan slide bersih dan menempatkan di tengah atau
pada sepertiga atas atau bawah, mencegah jangan sampai ada
gelembung udara di bawah jaringan.
f) Mengeringkan slide. Jika sudah kering, slide dipanaskan untuk
merekatkan jaringan dan sisa paraffin mencair sebelum
pewarnaan.
45
Setelah jaringan melekat sempurna pada slide, memilih slide
yang terbaik selanjutnya secara berurutan memasukkan ke
dalam zat kimia di bawah ini dengan waktu sebagai berikut:
Untuk pewarnaan, zat kimia yang pertama digunakan xilol I,
II, III masing-masing selama 5 menit. Kedua, zat kimia yang
digunakan Alkohol absolut I, II, III masing-masing selama 5
menit. Zat kimia yang ketiga aquadest selama 1 menit.
Keempat, potongan organ di masukkan dalam zat warna
Harris Hematoxylin selama 20 menit. Kemudian memasukkan
potongan organ dalam Eosin selama 2 menit. Secara berurutan
memasukkan potongan organ dalam alkohol 96% selama 2
menit, alkohol 96%, alkohol absolut III dan IV masing-masing
selama 3 menit. Terakhir, memasukkan dalam xilol IV dan V
masing-masing 5 menit.
7) Mounting
Setelah pewarnaan selesai menempatkan slide di atas kertas tisu
pada tempat datar, menetesi dengan bahan mounting yaitu kanada
balsam dan tutup dengan cover glass cegah jangan sampai
terbentuk gelembung udara.
8) Pemeriksaan mikroskopis ginjal
Slide diperiksa dibawah mikroskop cahaya dengan pembesaran
10x dan 40x. Pengamatan dilakukan oleh peneliti dan