Karya Ilmiah
PENGGUNAAN MANNANOLIGOSAKARIDA DARI
BUNGKIL INTI SAWIT SEBAGAI PENGENDALI
Salmonella sp PADA TERNAK UNGGAS
Di susun oleh
Dr. Nevy Diana Hanafi, SPt, MSi.
Dr. Ir. Ma’ruf Tafsin, MSi
DEPARTEMEN PETERNAKAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENDAHULUAN
Mikroba seperti virus atau bakteri berpotensi membahayakan ternak
yang dapat ditemukan di udara, makanan atau air. Bakteri yang sering
mengkontaminasi ternak ayam, baik pada saat penetasan, pembesaran dan
pascapanen diantaranya kelompok Salmonella sp. Bakteri tersebut selain
akan berpengaruh terhadap kesehatan ternak juga akan berpengaruh terhadap
aspek keamanan pangan ditinjau dari segi mikrobiologis. Potensi yang
ditimbulkannnya yaitu dapat mengkontaminasi produk daging atau telur yang
akan dikonsumsi manusia.
Beberapa upaya telah ditempuh untuk mengatasi hal tersebut seperti
melakukan vaksinasi, sanitasi ataupun penggunaan antibiotik. Upaya tersebut
disamping mempunyai banyak manfaat juga mempunyai keterbatasan, sebagai
contoh untuk antibiotik sekarang ini ditemukan beberapa strain bakteri yang
resisten terhadap antibiotik. Selain itu penggunaannya terutama pada negara
maju pengaturannya sangat ketat karena akan berpengaruh pada aspek
keamanan pangan untuk manusia. Upaya alternatif dicoba untuk mengatasi
keterbatasan tersebut, diantaranya dengan menggunakan karbohidrat.
Devegowda et al. (1997) melaporkan bahwa tiga oligosakarida utama yang
dapat memperbaiki produksi ternak, yaitu mannanoligosakarida (MOS),
fruktooligosakarida, dan galaktooligosakarida, dan MOS dilaporkan
memberikan hasil yang paling baik.
Pendekatan baru untuk mencegah infeksi mikroba ditemukan dengan
diketahuinya pentingnya proses penempelan pada saluran pencernaan.
Diketahui bahwa fimbriae tipe 1 yang sensitif terhadap mannosa berperan
dalam menempelnya mikroba patogen. Bakteri seperti Salmonella, E. coli, dan
Vibrio cholera mempunyai lektin pada permukaan selnya yang penempelannya
spesifik terhadap mannosa, dengan demikian mannosa dapat menghambat
proses penempelan mikroba merugikan pada saluran pencernaan (Center for
Food and Nutrition Policy (CFNP) Technical Advisory Panel (TAP) Review 2002).
Bungkil inti sawit (BIS) adalah hasil ikutan dari industri pengolahan
kelapa sawit dan di Indonesia ketersediaannya sangat tinggi. Luas lahan
kelapa sawit pada tahun 2004 di proyeksikan sekitar 4.4 juta ha (Jakarta
(Kompas 2006). Produksi tandan buah segar kelapa sawit sekitar 12.5 – 27.5
ton/ha, dan sekitar 2 persennya berupa bungkil inti sawit (Sinurat 2001).
Penggunaan BIS sebagai salah satu pakan potensial telah banyak dilaporkan
baik pada ternak ruminansia ( Elisabeth dan Ginting 2003; Mathius et al.
2003), ayam (Sundu dan Dingle 2005), bahkan ikan (Keong dan Chong 2005).
Makalah ini mencoba menjelaskan mengenai potensi bungkil inti sawit
serta bahan sejenis yang dapat menghasilkan mannanoligosakarida yang dapat
dimanfaatkan sebagai pengendali bakteri Salmonella sp.
MIKROFLORA PADA SALURAN PENCERNAAN UNGGAS
Saluran pencernaan pada unggas yang baru ditetaskan umumnya steril.
Sesaat setelah menetas unggas yang masih muda secara alami mikroflora
saluran pencernaannya berkembang melalui kontaminasi dari material feses
yang berasal dari ayam dewasa. Faktor lain yang berpengaruh yaitu transfer
mikroba dari induk pada anak, dan kontak dengan bakteri dari lingkungan.
Saluran pencernaan unggas apabila dilihat dari aspek mikrobiologis dapat
dikelompokkan menjadi lima bagian yaitu : tembolok (crop); rempela; usus
halus; sekum; kolon dan kloaka (Gambar 1).
Gambar 1 menunjukkan bahwa faktor utama yang menentukan
populasi mikroba adalah pH. Escherichia coli dan Enterococci merupakan
organisme yang dominan yang ditemukan pada unggas yang baru menetas.
Pada bagian tembolok, Lactobacillus menjadi dominan pada lima hari pertama,
sedangkan pada usus halus memerlukan waktu dua minggu. Kolonisasi
bakteri pada usus halus lebih lambat dibandingkan pada bagian lain dari
saluran pencernaan dan pada hari pertama konsentrasinya dibawah 105
CFU/g (Coloni Forming Unit). Pada bagian sekum, pada umur unggas sekitar
dua sampai empat minggu bakteri obligat aerob meningkat. Pada saat ini
bakteri Bifidobacteria, Bacteroides, Eubacteria, Peptostreptococci, dan Clostridia
menjadi predominan. Selain itu pada sekum ditemukan juga kelompok bakteri
Gambar 1. Mikroflora pada saluran pencernaan unggas (Spring 1997).
Sekarang ini telah diketahui bahwa mikroflora yang secara alami sudah
ada dalam saluran pencernaan (indegenous) pada hewan dan manusia dapat
memberikan perlindungan terhadap infeksi mikroorganisme yang bersifat
patogen. Istilah yang menjelaskan perlindungan tersebut dikenal dengan nama
‘colonization resistance’. Penelitian yang menunjukkan hal tersebut
diantaranya dilakukan pada mencit dan diamati pada tiga fase yaitu sebelum,
selama, dan sesudah pemberian antibiotik (streptomycin dan neomycin). Hasil
penelitian menunjukkan bahwa sebelum pemberian antibiotik ‘colonization
resistance’ tinggi terhadap tiga mikroba (E coli; Klebsiela pneumoniae;
Pseudomonas aeroginosa). Selama pemberian antibiotik akan menurunkan
resistensi dan mencit lebih mudah terinfeksi tiga mikroba patogen tersebut
antibiotik resistensi ini kembali menuju normal karena terjadinya repopulasi
flora saluran pencernaan yang tahan terhadap antibiotik (Hentges 1992).
Hentges (1992) menjelaskan beberapa hipotesis muncul untuk
menjelaskan mekanisme yang dapat menekan bakteri patogen. Beberapa
faktor tersebut diantaranya muncul teori kompetisi terhadap nutrien; merubah
kondisi lingkungan yang tidak ideal bagi patogen seperti dihasilkannya asam
lemak terbang oleh flora usus ; dan kompetisi untuk menempati ruang yang
ada pada saluran pencernaan. Selanjutnya Mulder et al. (1997) menjelaskan
teori “competitive exclusion (CE)” yaitu perlakuan terhadap anak ayam (DOC)
yang diberi mikroflora yang menghasilkan resistensi terhadap mikroorganisme
yang berpotensi patogen. Beberapa percobaan telah dilakukan menggunakan
kultur mikroba murni maupun kultur campuran (undefined microflora). Hasil
penelitian menunjukkan bahwa dibandingkan dengan kultur murni ternyata
pemberian dengan “undefined microflora” yang berasal dari sekum ayam
memberikan hasil yang lebih baik. Kultur tersebut mengandung sejumlah
besar mikroba aerobik yang telah diketahui dan banyak bakteri anaerobik yang
belum diketahui.
Teori “competitive exclusion (CE)” pertama kali dikemukakan oleh
Rantala dan Nurmi (1973) dan banyak mengilhami peneliti selanjutnya untuk
mengamati pencegahan bakteri merugikan seperti Salmonella pada ternak
unggas. Beberapa hasil positif ditemukan yaitu dengan menurunnya
kolonisasi bakteri Salmonella pada ayam broiler dengan digunakannya kultur
yang mengandung 29 strain bakteri dari sekum (Corrier et al. 1995).
Selanjutnya Ziprin dan Deloach (1993) meneliti pada ayam broiler dan petelur
dengan menggunakan bakteri normal dari sekum. Hasil penelitian
menunjukkan bahwa bakteri Salmonella menurun meskipun kultur mikroba
dari sekum tersebut diberikan tiga hari setelah dilakukan uji tantang terhadap
Salmonella typhimurium.
Selanjutnya Spring (1997) merangkum beberapa mekanisme pengaturan
bakteri yang mempengaruhi mikroflora pada saluran pencernaan. Tabel 1
menjelaskan bahwa mekanisme yang tercakup dalam CE sangat kompleks dan
dapat dilihat bahwa populasi bakteri mempunyai pendekatan berbeda dalam
mekanisme yang terjadi dapat dibedakan secara tidak langsung dan secara
langsung. Secara tidak langsung merupakan akibat dari mikroflora normal
meningkatkan respon fisiologis inang dan akan mempengaruhi interaksi antara
inang dengan mikroba. Mekanisme secara langsung adalah terjadinya saling
penekanan antara suatu populasi bakteri terhadap populasi bakteri lainnya.
Tabel 1. Mekanisme pengaturan bakteri terhadap mikroflora saluran pencernaan pada unggas
Mekanisme Pengaturan Faktor Pengontrol
Perangsangan proses kekebalan Ig pada usus halus
Modifikasi garam empedu Asam empedu tak berkonjugasi
Stimulasi peristalsis Laju lintas
Penggunaan nutrient Kompetisi nutrien atau faktor
pertumbuhan
Pemanfaatan nutrient sinergis
Penempelan Kompetisi tempat reseptor
Stimulasi pergantian epitel sel
Pembentukan lingkungan terbatas pH
Asam laktat
VFA
Hidrogen sulfida
Modifikasi garam empedu
Perangsangan proses kekebalan
Produksi substansi antimikroba Ammonia
Hidrogen peroksida
hemolisin
Enzim bakteri
Bakteriofage Bakteriosin Antibiotik
PENGGUNAAN ANTIBIOTIK PADA TERNAK
Kemajuan peternakan ayam broiler sekarang ini menuntut optimalisasi
baik dari segi pertumbuhan, perbaikan konversi ransum, dan kepadatan
ternak per satuan luas. Meningkatnya kepadatan akan membawa akibat
semakin mudahnya ayam akan terkena serangan penyakit. Upaya pencegahan
dan pengobatan yang dilakukan sekarang ini masih bergantung pada
penggunaan antimikroba, bahkan dapat dikatakan secara ekonomis tidak
mungkin mengembangkan ternak ayam broiler komersial tanpa antimikroba.
Pada negara-negara maju seperti Masyarakat Uni Eropa penggunaan antibiotik
sebagai imbuhan pakan pengaturannya sangat ketat, dan sampai sekarang
penggunaan beberapa antibiotik seperti virginiamycin, tylosin, spiramycin, dan
zinc bacitracyn telah dilarang. Pelarangan penggunaan antibiotik yang bersifat
pencegahan ini akan membawa akibat meningkatnya penggunaan antibiotik
yang bersifat terapetik (menggunakan dosis tinggi), lebih banyak ayam yang
akan terkena bakteri patogen dan pada akhirnya kerugian ekonomis akan lebih
besar (Bouliane 2003).
Penggunaan antibiotik secara tidak terkontrol akan membawa dampak
negatif diantaranya terjadinya resistensi dan ternak yang mengkonsumsi
pakan yang mengandung antibiotik, juga akan mengekskresikannya. Levy
(2000a). mengemukakan bahwa pada beberapa kasus ditemukan bahwa 80
persen antibiotik yang diberikan secara oral akan lewat dan tidak mengalami
perubahan oleh hewan dan masuk ke kolam limbah yang kaya akan bakteri.
Selanjutnya akan menyebar ke lahan pertanian karena digunakan sebagai
pupuk, dan mengakibatkan pencemaran air permukaan dengan membawa baik
obat tersebut maupun bakteri yang resisten ke dalam tanah dan air. Todar
(2000) menjelaskan bahwa resistensi mikroba dapat diakibatkan beberapa hal.
Pertama, resistensi alamiah, sebagai contoh streptomycete mempunyai gen
yang bertanggung jawab untuk resistensi terhadap antibiotiknya sendiri; atau
bakteri gram negatif mempunyai membran luar yang menghambat
permeabilitas terhadap antibiotik; atau organisme tersebut mempunyai
keterbatasan dalam sistem transport terhadap antibiotik; atau terbatasnya
target atau reaksi yang akan dicapai oleh antibiotik. Kedua, resistensi buatan,
dahulunya sensitif menjadi resisten. Resistensi seperti ini dihasilkan dari
perubahan gen dan dicapai dengan dua cara yaitu ; (1)mutasi dan seleksi; dan
(2) pertukaran gen antara strain dan spesies.
Selanjutnya Levy (2000b) menjelaskan bahwa di Amerika Serikat (AS)
lebih dari 40 persen antibiotik yang diproduksi diberikan pada hewan baik
untuk pencegahan dan pengobatan infeksi, dan pemacu pertumbuhan.
Penggunaan antibiotik sebagai pemacu pertumbuhan kadarnya sangat kecil
untuk melawan infeksi dan diberikan dalam jangka waktu yang lama (beberapa
minggu sampai bulan). Pemberian dalam jangka waktu yang lama dan dosis
rendah ini menjadikan bakteri terseleksi dan menjadi resisten. Environmental
Media services (EMS) (2000) menjelaskan bahwa bakteri Salmonella umum
ditemukan pada produk ternak (daging dan telur) dan di AS dilaporkan infeksi
Salmonella pada manusia lebih dari 40.000 kasus setiap tahun. Selain itu
ditemukan pula strain Salmonella DT-104 yang resisten terhadap lima
antimikroba: ampicillin, chloramphenic, streptomycin, sulfonamide, dan
tetrasiklin.
MANNANOLIGOSAKARIDA (MOS)
Sumber Mannanoligosakarida (MOS)
MOS dapat diperoleh dari beberapa sumber yaitu dari fungi (dinding sel
fungi) dan dari sumber lain seperti dinding sel tanaman atau berupa limbah
pertanian. Uraian berikut ini menjelaskan mengenai beberapa sumber yang
dapat digunakan untuk memproduksi MOS. Faktor yang perlu diperhatikan
dalam memproduksi MOS yaitu kandungan komponen gula mannosa yang
dikandung sumber bahan yang akan diekstraksi.
Hasil penelitian Tafsin (2000) menunjukkan bahwa Dinding sel fungi
Penicillium sp didominasi oleh mannosa. Urutan selengkapnya komponen gula
dari dinding sel Penicillium sp adalah tersusun atas glukosa; mannosa;
galaktosa; asam glukoronat; arabinosa : dan glukosamin dengan perbandingan
konsentrasi berturut-turut 119 ; 169; 11; 15; 1; 1 . Penelitian lanjutan
mengenai derajat antigenisitas dengan mengukur produksi antibodi poliklonal
dengan menggunakan metode ELISA (Enzymes Link Immunosorbant Assay)
dari miselium fungi tersebut bersifat imunogenik. Hal tersebut dapat dilihat
dari nilai absorbansi yang lebih tinggi (300-400 persen) dibandingkan dengan
hewan kontrol. Percobaan tersebut menggunakan hewan kelinci sebagai model
percobaannya.
Bungkil inti sawit tinggi akan serat kasar yakni berkisar antara 13.0–
15.7% dan ADF (Acid Detergent Fiber) 31.7% (Daud et al. 1993). Total dinding
sel terbanyak adalah mannosa sebesar 56.4%. Formasi linier mannan
berbentuk kristal yang cukup tinggi dan ikatan β-(1-4) sulit untuk dipecah.
Adapun secara lengkap komponen dinding sel dari bungkil inti sawit tertera
pada Tabel 2.
Tabel 2 Persentase komponen gula netral pada bungkil inti sawit (BIS)
Komponen gula netral Persentase dari dinding sel (%)
Mannosa 56.4 ± 7.0
Selulosa 11.6 ± 0.7
Xylosa 3.7 ± 0.1
Galaktosa 1.4 ± 0.2
Total 73.1 ± 7.2
Sumber : Daud et al. (1993).
Turner et al. (2000) menyebutkan bahwa sumber yang paling umum
yang dapat digunakan untuk menghasilkan MOS adalah dari Saccharomyces
cerevisae. Hal tersebut dipakai karena kandungan gula mannosanya yang
tinggi yang mencapai 45% dari keseluruhan dinding selnya. Sumber lain yaitu
CFNP TAP Review (2002) menyebutkan kandungannnya dapat mencapai 50
persen.
Ishihara et al. (2000) menjelaskan sumber MOS dari tumbuhan yaitu
dari guar gum (Cyamoposis tetragonolobus). Guar gum diperoleh dari biji guar
yang selanjutnya diproses dengan menggunakan enzim -D-mannanase untuk
memecah ikatan tulang punggung (backbone) , dan mengandung
Peranan MOS sebagai Pengendali Salmonella.
Polisakarida dari nilai nutrisinya secara umum dikenal sebagai
penyumbang sumber energi untuk ternak disamping sebagai bagian integral
struktur seperti asam nukleat, glikolipid dan glikoprotein. Devegowda et al.
(1997) melaporkan bahwa ada tiga oligosakarida utama yang dapat
memperbaiki produksi ternak, yaitu Mannanoligosakarida, fruktooligosakarida,
dan galaktooligosakarida. Mannanoligosakarida (MOS) dilaporkan memberikan
hasil yang paling baik. Selanjutnya pada ayam broiler yang dilakukan uji
tantang menggunakan strain liar Salmonella menunjukkan hasil yang lebih
baik pada ayam yang diberi MOS. Selain itu MOS juga mempunyai fungsi
untuk mengikat mikotoksin seperti zearalenone dan aflatoksin (Lyons 1997;
Power 1997).
Pendekatan baru untuk mencegah infeksi mikroba ditemukan dengan
diketahuinya pentingnya proses penempelan pada saluran pencernaan.
Diketahui bahwa fimbriae tipe 1 yang sensitif terhadap mannosa berperan
dalam menempelnya patogen, dengan demikian mannosa dapat menghambat
proses penempelan mikroba merugikan pada saluran pencernaan. Kemampuan
lain dari MOS adalah dapat merangsang sistem kekebalan dan efek ini juga
berperan dalam melawan bakteri Salmonella (Spring 1997).
Mekanisme kerja yang terjadi dari pencegahan kolonisasi bakteri
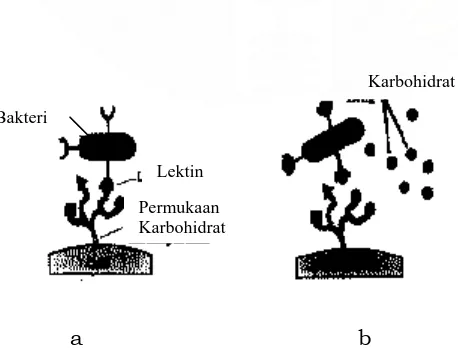
merugikan oleh MOS dapat dilihat pada Gambar 2 berikut :
Karbohidrat
Lektin Permukaan Karbohidrat Bakteri
a b
Gambar 2a menjelaskan mekanisme terjadinya kolonisasi bakteri pada
saluran pencernaan, sedangkan Gambar 2b menunjukkan efek penggunaan
karbohidrat seperti MOS dalam mencegah kolonisasi bakteri yang merugikan.
Karbohidrat pada permukaan sel merupakan faktor utama yang bertanggung
jawab dalam pengenalan oleh sel. Bakteri mempunyai lektin pada permukaan
selnya yang dapat mengenal gula spesifik dan membiarkan sel untuk
menempel pada gula tersebut. Gula tersebut dapat ditemukan pada
permukaaan sel epitel. Pengikatan Salmonella, E. coli, dan Vibrio cholera
dimediasi oleh substansi seperti lektin yang spesifik terhadap mannosa dari
permukaan sel bakteri. MOS akhirnya dapat mencegah penempelan bakteri
patogen pada usus halus sehingga tidak terjadi kolonisasi yang dapat
menimbulkan penyakit, dan dapat menjadi sumber makanan terhadap bakteri
lain yang menguntungkan (CFNP TAP review 2002).
Turner et al. (2000) menunjukkan adanya efek yang menguntungkan
dari MOS terhadap kesehatan pada saluran pencernaan dan sistem kekebalan.
Sebagai contoh terhadap Salmonella thypimuriuminvitro akan dihambat dengan
adanya mannosa, dan selanjutnya setelah dilakukan pemberian melalui air
minum pada ayam ternyata menurunkan kolonisasi S. thypimurium pada
sekumnya. Selanjutnya pada ternak kalkun, ternyata penggunaan MOS akan
meningkatkan level plasma IgG dan konsentrasi IgA pada cairan empedu.
Ishihara et al. (2000) melakukan penelitian MOS yang diperoleh dari
Guar gum dan mengamati efeknya terhadap Salmonella enteridis (SE) pada
ayam broiler dan ayam petelur. Hasil penelitian menunjukkan penambahan
MOS secara oral menurunkan adanya SE pada organ, Peningkatan ekskresi SE
pada feses, menurunkan titer antibodi terhadap SE pada serum. Efek lain
yang ditimbulkan yaitu meningkatkan jumlah bakteri Bifidobacterium spp dan
Lactobacillus spp. Keadaan yang sama ditemui pada ayam petelur dengan
menurunnya SE baik pada permukaan kerabang, putih dan kuning telur.
Kadar optimum MOS pada penelitian ini yaitu 0.025% dari ransum.
Spring et al. (2000) meneliti efek MOS pada ayam broiler menemukan
bahwa MOS dapat mengaglutinasikan lima dari tujuh strain E.coli dan 7 dari
10 strain Salmonella thypimurium dan Salmonella enteridis. Sedangkan
Campylobacter tidak terjadi agglutinasi. Selanjutnya dilakukan uji tantang
terhadap bakteri Salmonella thypimurium 29E sebanyak 104 cfu pada umur
anak ayam tiga hari. Kadar MOS yang diberikan sebanyak 4000 ppm, dan
hasil penelitian menunjukkan terjadinya penurunan konsentrasi Salmonella
thypimurium dari 5.40 menjadi 4.01 log cfu pada hari ke sepuluh. Hasil
penelitian lainnya yang diperoleh menunjukkan bahwa MOS tidak
menurunkan konsentrasi coliform pada sekum, dan tidak mempunyai efek
terhadap konsentrasi laktobacillus, enterococcus, bakteri anaerob, laktat, VFA,
dan pH sekum.
Secara umum, Ferket et al. (2002) membandingkan antara penggunaan
antibiotik dengan MOS dan terlihat pada Tabel 3. Tabel 3 menjelaskan bahwa
penggunaan antibiotik jelas akan memperbaiki efisiensi pertumbuhan dan
kesehatan ternak, tetapi potensi bahaya yang ditimbulkan akibat penggunaan
yang tidak tepat sangat besar, diantaranya semakin meningkatnya ancaman
dari bakteri patogen yang resisten terhadap antibiotik. Alasan tersebut
mendorong industri peternakan untuk menggunakan bahan alternatif yang
lebih aman. MOS dapat dikatakan menjadi alternatif terbaik terhadap
antibiotik sebagai pemacu pertumbuhan, dan MOS dapat lebih
menguntungkan daripada antibiotik jika digunakan secara strategis
bersama-sama dengan bahan non obat-obatan seperti probiotik, fruktoosoligosakarida,
Tabel 3 Perbandingan penggunaan antibiotik dengan MOS
Antibiotik Mannanoligosakarida (MOS)
• Menghambat viabilitas dan
proliferasi beberapa mikroflora patogen dan mikroba pencernaan yang menguntungkan
• Mencegah penempelan dan
kolonisasi beberapa bakteri pada saluran pencernaan, tapi tidak membunuhnya
• Mempunyai aktivitas spektrum luas terhadap bakteri gram positif
• Mempunyai aktivitas spesifik
terhadap bakteri gram negatif yang mempunyai Fimbriae tipe I yang spesifik terhadap mannose
• Menurunkan efek merugikan dari metabolit mikroba dengan menekan mikrofloranya
• Menurunkan efek merugikan dari metabolit mikroba dengan meningkatkan profil mikroflora
• Menurunkan stress imunologis dengan cara menurunkan masuknya mikroba pada saluran pencernaan
• Merangsang sistem kekebalan
dengan jalan berlaku seperti antigen mikroba yang bersifat non patogen
• Penggunaan secara jangka panjang dan tidak tepat dapat menghasilkan patogen yang resisten
• Tidak menghasilkan bakteri yang resiten baik terhadap antibiotik atau MOS
• Memberikan keuntungan pada
inang untuk menyerap zat makanan penting dengan jalan menekan kompetisi dari mikroba saluran cerna.
• Memberikan keuntungan pada inang untuk menyerap zat makanan penting dengan jalan memperbaiki kesehatan ‘brush borders’.
• Memperbaiki ketersedian Energi Netto (EN) untuk produksi dengan jalan memperbaiki Energi Metabolis (EM) pakan dan menurunkan kebutuhan energi tubuh untuk hidup pokok.
• Memperbaiki ketersedian Energi Netto (EN) untuk produksi dengan jalan memperbaiki Energi Metabolis (EM) pakan.
• Secara konsisten memperbaiki penampilan pertumbuhan pada kondisi lingkungan yang berbeda.
• Memperbaiki penampilan
pertumbuhan terutama ketika dilakukan uji tantang dengan patogen dari saluran pencernaan.
• Menurunkan perlindungan mukosa yang non spesifik dengan jalan menurunkan kolonisasi bakteri yang menguntungkan (sebagai contoh ; laktobasilus)
• Meningkatkan perlindungan mukosa yang non spesifik dengan jalan peningkatan relatif jumlah sel goblet dan sekresi mucus dan meningkatnya koloni bakteri yang menguntungkan.
BUNGKIL INTI SAWIT SEBAGAI SUMBER MOS
Bungkil inti sawit dapat digunakan sebagai salah satu bahan untuk
menghasilkan mannan. Penelitian Tafsin (2007) yaitu mencoba kombinasi
perlakuan fisik dan kimia dicoba untuk mendapatkan komponen tersebut.
Kandungan total gula terekstrak yang dihasilkan mencapai sekitar 2-3 persen
dari total BIS (as fed), sedangkan jumlah mannosa terekstrak dari total
mannan BIS pada perlakuan kombinasi ekstraksi menggunakan kaca
mencapai 5.49% dan 7.58%, berturut-turut pada pelarut menggunakan air dan
NaOH 0.05 N. Hasil tersebut masih lebih rendah dibandingkan yang
dilaporkan oleh Yokomizo (2005) serta Morikoshi dan Yokomizo (2006) yang
menggunakan enzim mannanase terhadap BIS yang mencapai 10-20 % dari
total mannan yang ada pada BIS yang diperoleh dengan waktu reaksi selama
24-72 jam dan pada temperatur 60 oC.
Analisis dengan menggunakan kromatografi filtrasi gel (Sephadex G-50)
menunjukkan komponen terekstrak berupa polisakarida. Selanjutnya, analisis
komponen monosakarida dengan HPLC (Carbohydrate column) menunjukkan
bahwa komponen polisakarida tersusun atas glukosa, galaktosa, dan mannosa,
dengan komponen dominan berupa galaktomannan. Penggunaan pelarut yang
berbeda yaitu air dan NaOH (0.05 dan 0.1N) menghasilkan rasio komponen
gula yang berbeda. Penggunaan NaOH ternyata meningkatkan komponen
galaktosa, sehingga rasio komponen gula antara mannosa:galaktosa menjadi
lebih kecil dibandingkan menggunakan pelarut air. Hal tersebut menunjukkan
komponen galaktosa lebih mudah terekstrak karena dalam struktur
polisakarida BIS, komponen galaktosa ada pada rantai sisi (side chain) berupa
-D-galactopyranosil dengan ikatan (1 6) (Kennedy dan White 1988b).
Penggunaan NaOH 0.1 N selain menghasilkan kandungan total gula terekstrak
paling rendah, juga menunjukkan kandungan mannosa yang terkecil
dibandingkan perlakuan lainnya. Komponen utama dari dinding sel bungkil
inti sawit (BIS) adalah linear (1-4)- –D-Manp (Carre 2002), dan menunjukkan
kesamaan dengan guar gum, tetapi dengan rasio galaktomannan yang berbeda.
Rasio galaktomannan pada guaran adalah 1:2 (Kennedy dan White 1988).
Respons penggunaan bahan sejenis Mannan terhadap pertumbuhan
menggunakan S cerevisiae menunjukkan efek positif dan menyamai
penggunaan antibiotik (avilamisin) sebagai pemacu pertumbuhan pada ayam
broiler. Efek positif penggunaan MOS terhadap pertumbuhan pada ternak babi
dilaporkan oleh Davis et al. (2002), selanjutnya pada kalkun (Zdunczyk et al.
2005) dan pada ayam broiler (Waldroup et al. 2003). Dosis MOS yang
digunakan pada penelitian tersebut berkisar 0.05-0.4% dari ransum.
Selanjutnya beberapa laporan menyebutkan tidak adanya pengaruh
penggunaan MOS terhadap pertumbuhan ayam broiler (Ma et al. 2006;
Flemming et al. 2004; dan Shafey et al. 2001) dengan dosis penggunaan
berkisar 0.05-0.3%. Hooge (2004) mengumpulkan informasi beberapa
penelitian dari tahun 1993-2003 tentang penggunaan MOS menunjukkan
bahwa terjadi perbaikan relatif terhadap pertumbuhan sebesar 1.61%
dibandingkan pakan kontrol.
Penggunaan mannan dari BIS dari penelitian Tafsin (2007) juga
menunjukkan hasil yang beragam terhadap pertumbuhan ayam. Pada
keadaan tanpa infeksi, penggunaan mannan dari BIS tidak memberikan
pengaruh terhadap PBB. Hasil sebaliknya ditunjukkan pada perlakuan infeksi
S thyphimurium yaitu ayam yang diberi mannan dari BIS menunjukkan
pertumbuhan yang lebih baik dibandingkan perlakukan kontrol infeksi. Secara
konsisten terlihat bahwa pada penggunaan sebanyak 2 000-3 000 ppm
menunjukkan PBB sekitar 10% dan 20% lebih baik dibandingkan perlakuan
kontrol infeksi, berturut-turut pada tingkat infeksi 104 dan 107 CFU S
thyphimurium.
Hasil tersebut menunjukkan bahwa mannan memberikan efek positif
pada kondisi lingkungan yang buruk (ancaman mikroba pathogen tinggi) dan
mungkin dapat menjelaskan mengapa penggunaan bahan sejenis seperti MOS
memberikan hasil yang beragam terhadap pertumbuhan ayam. Efek tersebut
diakibatkan penekanan terhadap pertumbuhan akibat kehadiran bakteri yang
merugikan seperti S thyphimurium dapat dihindari, dan hal tersebut terlihat
pada hasil penelitian yang menunjukkan terjadinya penurunan jumlah koloni
dan insiden Salmonella pada penelitian ini.
Penggunaan mannan dari BIS dalam ransum tidak mempengaruhi
ransum ayam menunjukkan hasil yang beragam. Nilai konversi ransum pada
percobaan 1 dipengaruhi oleh penggunaan mannan, dan penggunaan pada
tingkat 4 000 ppm menunjukkan hasil lebih buruk dibandingkan perlakuan
lainnya. Hasil sebaliknya ditunjukkan pada percobaan 3 yang menunjukkan
tidak adanya pengaruh terhadap konversi ransum ayam. Perbedaan perlakuan
yang diberikan yaitu pada percobaan ke 3 dilakukan periode penyesuaian
selama 5 hari dengan menggunakan ransum kontrol, sedangkan pada
percobaan 1 ransum perlakuan sudah diberikan pada hari pertama. Dampak
buruk penggunaan mannan dalam dosis yang tinggi (4 000 ppm) terlihat lebih
berat ketika digunakan pada umur ayam satu hari(DOC).
Hal tersebut diakibatkan mannan terekstrak dari BIS ada dalam bentuk
komponen yang terlarut dan tergolong pada polisakarida bukan pati (NSP; Non
Starch Polysacharides) dan bersifat antinutritif yang mengakibatkan gangguan
pencernaan dan absorpsi nutrien dengan jalan meningkatnya viskositas dari
digesta. Efek buruk tersebut berkurang pada periode penyesuaian pemberian
selama 5 hari, dan hal tersebut diduga terkait dengan telah berkembangnya
mikroba yang ada dalam saluran pencernaan ayam yang dapat mengeluarkan
enzim yang dapat memotong rantai polisakarida menjadi lebih pendek
sehingga viskositasnya menurun dan mengakibatkan dampak buruk efek anti
nutrisinya menjadi berkurang.
Efek antinutritif NSP sangat tergantung pada ukuran berat molekulnya.
Percobaan Choct (2002) menunjukkan hal tersebut yang menggunakan NSP
berupa arabinoxylan dan diuji dalam bentuk utuh (BM 758 000 Da)
dibandingkan dengan yang sudah didegradasi oleh xylanase sehingga
viskositasnya menurun empat kali lipat dan ternyata ketika diuji pada level
yang sama (3%), bentuk yang terdegradasi tidak menunjukkan efek antinutrisi
pada ayam broiler. Lin dan Hsu (2006) yang meneliti pada angsa menyebutkan
bahwa pakan yang mengandung 9% NSP nyata menurunkan penampilan
ternak.
Pengujian mannan (in vitro) terhadap Salmonella menunjukkan bahwa
mannan dari BIS tidak mempunyai aktivitas yang bersifat membunuh bakteri
(bakterisidal) maupun menghambat pertumbuhan bakteri (bakteriostatik),
mannosa dari mannan dengan reseptor bakteri (fimbriae tipe I) yang tampak
secara mikroskopik. Tidak terjadinya aktivitas yang bersifat bakterisidal
maupun bakteriostatik tersebut ditinjau dari perspektif lingkungan dan
penggunaannya dimasa akan datang sangat menguntungkan. Hal tersebut
diakibatkan tidak terjadinya proses adaptasi oleh mikroba yang
memungkinkan terjadinya mutasi. Efek terjadinya mutasi bakteri yang
membahayakan pada manusia terlihat pada penggunaan antibiotik seperti
dilaporkan Environmental Media services (EMS) (2000) yang menjelaskan
ditemukannya strain Salmonella DT-104 yang resisten terhadap beberapa
antimikroba seperti ampisilin, kloramfenikol, streptomisin, dan tetrasiklin.
PENUTUP
Bungkil Inti Sawit (BIS) sebagai produk samping dari industri
pengolahan kelapa sawit mempunyai potensi ketersediaan dan kontinuitas
yang tinggi di Indonesia. Nilai manfaat BIS sampai sekarang ini masih lebih
banyak ditujukan sebagai salah satu komponen dari pakan baik untuk ternak
ruminansia maupun monogastrik. Struktur polisakarida yang spesifik dari BIS
didominasi komponen gula mannosa, dan hal ini dapat menjadi nilai tambah
untuk mengendalikan bakteri merugikan seperti dari kelompok Salmonella
sp.dan dapat menjadi prebiotik. Hasil tersebut menjadikan potensi BIS tidak
hanya sebagai bahan pakan tetapi dapat ditingkatkan nilai manfaatnya sebagai
pengendali bakteri yang merugikan pada ternak.
DAFTAR PUSTAKA
Bouliane M. 2003. Can We Farm Poultry Without Antimicrobials?. Quebec; Fac. of Veterinary Medicine, Univ. of Montreal.
[CFNP TAP] Center for Food and Nutrition Policy Technical Advisory Panel Review. 2002. Cell Wall Carbohydrates : Livestock. Virginia; CFNP. Choct M. 2002. Non-starch Polysaccharides: effect on nutritive value. Di
dalam: McNab JM and Boorman KN, editor. Poultry Feedstuff: supply, composition, and nutritive value. Nottingham; CAB international.
Corrier DE et al. 1995. Treatment of commercial broiler chickens with a characterized culture of caecal bacteria to reduce salmonella colonization. Poult Sci 74: 1093-1101.
Daud MJ, Jarvis MC, Rasidah A. 1993. Fibre of PKC and its potential as poultry feed. Proceeding. 16th MSAP Annual Conference, Kuala Lumpur,
Davis ME et al. 2002. Effect of mannan oligosaccharides and (or) pharmacological additions of copper sulphate on growth performance and immunocompetence of weanling and growing/finishing pig. J Anim Sci 80:2887-2894.
Devegowda G et al. 1994. Biotechnology in the feed industry. Proc. Alltech’s 10th Annual Symposium. Nottingham University Press. 235-245.
Elisabeth W, Ginting SP. 2003. Pemanfaatan hasil samping industri kelapa sawit sebagai bahan pakan ternak sapi potong. Pros. Lokakarya Nasional Sistem Integrasi Kelapa-Sawit Sapi (9-10 September 2003), Bengkulu.
[EMS] Environmental Media services. 2000. Public Health Concerns. http:www.ems.org/antibiotics/antibiotics_public.html. [31 Januari 2000] Ferket PR, Park CW, Grimes JL. 2002. Benefits of dietary antibiotics and
mannanoligosaccharide supplementation for poultry. Multi-State Poultry meeting. Raleigh; North Carolina State Univ.
Flemming JS, Freitas JRS, Fontoura P, Monthaninhi NR, Arruda JS. 2004. Use of Mannanoligosaccharides in Broiler Feeding. Braz J Poult Sci. 6(2):159-161.
Hentges JD. 1992. Gut Microflora and Disease Resistance. Di dalam: Fuller R., editor. Probiotics : The Scientific Basis. Chapman and Hall, London. Hooge DM. 2004. Meta-analysis of broiler chicken pen trials evaluating dietary
mannan oligosaccharides, 1993-2003. Int J Poult Sci 3(3): 163-174.
Ishihara N, Shu DC, Akachi S, Juneja LR. 2000. Preventive effect of partially hydrolyzed guar gum on infection of Salmonella enteridis in young and laying hen. Poult Sci 79:689-697.
Jakarta Future Exchange. 2001. Perkembangan produk minyak goreng sawit di Indonesia. http/www.bbj.jfx.com.
Keong NW, Chong KK. 2002. The nutritive value of palm kernel meal and the effect of enzyme supplementation in practical diets for red hybrid tilapia (Oreochromis sp.). Asian Fish Sci 15:167-176.
Kennedy JF, White CA. 1988. The Plant, Algae, and Microbial Polysaccharides. Di dalam: Kennedy JF, editor. Carbohydrate Chemistry. Oxford; Clarendon Press.
[KOMPAS]. 2006. Malaysia kuasai 330.000 hektar lahan sawit, 25 Agustus 2006.
Levy BS. 2000a. Environmental Concerns:The antibiotics paradox; How miracle drugs are destroying the miracle. http:www.ems.org/antibiotics/
antibiotics-concerns.html. [30 oktober 2000].
Levy BS. 2000b. The Challenge of Antibiotics Resistance. http/www.sciam.com/1998/0398issue/0398levy.html. [31 Oktober 2000].
Lin PH, Hsu JC. 2006. Effects of different sources of dietary non-starch polysaccharides on the growth performance and carbohydrase development in intestine of goslings. XIIth AAAP Animal science congress 2006 Busan, Korea.
Ma D, Shan A, Li Q, Du J. 2006. Influence of mannan oligosaccharide, Ligustrum lucidum and Schsandra chinesis on antioxidant and immunity of chicken. XIIth AAAP Animal Science Congress 2006, Busan.Korea. Mathius IW, Sitompul D, Manurung BP, Azmi. 2003. Produk samping
komplit untuk sapi: suatu tinjauan. Pros. Lokakarya Nasional Sistem Integrasi Kelapa-Sawit Sapi (9-10 September 2003), Bengkulu.
Menocal JA et al. 2005. Effect of Saccharomyces cerevisiae cell walls on productive parameters in broiler chicks. T c Pecu M x 43(2):155-162. Morikoshi T, Yokomizo F, penemu; 6 April 2006. -1,4 mannobiose- containing
composition. US patent 2006 0073191.
Mulder RW, Havenaar R, Huis in’t Veld JHJ. 1997. Interventions Strategies: The Use of Probiotics and Competitive Exclusion Microfloras Againts Contamination with Pathogens in Pig and Poultry. Di dalam: Fuller, R, editor. Probiotics 2; Application and Practical Aspect. London; Chapman and Hall.
Rantala M, Nurmi E. 1973. Prevention of the growth Salmonella infantis in chick by the flora of the allimentary tract of chicken. Br Poult Sci 14:627-630.
Shafey TM, Al-mufarez M, Shalaby I, Jarlenabi, AJ. 2001. The effect of feeding mannanoligosaccharides (BioMos) on the performance of meat chicken under two different vaccination programs. Asian-Aust J Anim Sci 14: 559-563.
Sinurat AP. 2001. Pemanfaatan bahan pakan lokal. Makalah pada dies natalis HIMASITER III, Fapet IPB Bogor.
Spring P. 1997. Understanding the development of the avian gastrointestinal microflora : an essential key for developing competitive exclusion products. Proc. Alltech 11th Annual Asia Pacific Lecture Tour. 149-160. Spring P, Wenk C, Dawson KA, Newman KE. 2000. The effects of dietary
mannanoligosaccharides on cecal parameters and the concentration of enteric bacteria in the ceca of salmonella-challenge broiler chicks. Poult Sci 79: 205-211.
Sundu B, Dingle J. 2005. Use of enzyme to improve the nutritional value of palm kernel meal and copra meal. Proc. Quensland Poult Sci Symp, Australia 11:1-15.
Tafsin M. 2000. Studi Kimia Polisakarida Dinding Sel Cunninghamella spp dan Penicillium spp yang Diisolasi dari Pakan serta Efek Toksiknya pada Mencit [tesis]. Bogor; Program Pascasarjana, Institut Pertanian Bogor. Todar K. 2000. Bacterial resistance to antibiotics. Dept. of bacteriology, Univ.of
Wisconsin. http/www.bact.wise.edu/Bact330/lecturebactres. [31 Oktober 2000].
Turner JL, Dritz PAS, Minton JE. 2000. Alternatives to conventional microbials in swine diets. Prof Anim Sci 17:217-226.
Waldroup PW, Edgar O, Oviedo-Rondon, Fritts CA. 2003. Comparison of Bio-MOS and antibiotic feeding programs in broiler diet containing cooper sulfate. Int J Poult Sci 2(1):28-31.
Yokomizo F, penemu; Fuji Oil Co. LTD; 24 Mei 2005. Mannose-containing palm kernel meal. US patent 6 896 918.
Zdunczyk Z, Juskiewicz J, Jankowski J, Biedrzycka E, Koncicky A. 2005. Metabolic response of the Gastrointestinal tract of turkeys to diet with different level of mannan-oligosaccharides. Poult Sci 84:903-909