TELAAH KUALITAS DAGING SERTA IDENTIFIKASI
KERAGAMAN GEN GH DAN GHR PADA KERBAU
(Bubalus bubalis)
ERYK ANDREAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Telaah Kualitas Daging serta Identifikasi Keragaman gen GH dan GHR pada Kerbau (Bubalus bubalis) adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Maret 2010
ABSTRACT
ERYK ANDREAS. Study of Meat Quality and Identification Polymorphism of GH and GHR Genes in Buffalo (Bubalus bubalis). Under direction of CECE SUMANTRI, Henny NURAINI, and ACHMAD FARAJALLAH
Growth hormone exert its effect on growth and metabolism by interacting with a specific receptor on the surface of the target cells. GHR has been suggested as candidate gene for traits related to meat production in Bovidae. The objective of this research was to studied meat quality and identify polymorphism of GH and GHR genes in buffalo. The 93 muscle samples from Longissimus dorsi et lumbarum from slaughter house in Pandeglang-Banten were used to study meat quality. There was a significant effect of age at slaughter on body and carcass weight in both male and female buffaloes, and fat thickness in female. A positive relationship was observed between carcass weight and fat thickness and rib eye area, and also between fat thickness and rib eye area. Increase in pH value was affected to decreased shear force Warner Bratzler and percentage of cooking loss. The 452 DNA samples buffalo from five populations in Indonesia (Siborong-Borong-Medan (65 samples), Lebak-Banten (29 samples), Pandeglang-Banten (180 samples), Semarang-Central Java (75 sampel), and Mataram-West Nusa Tenggara (103 samples) were used to determined polymorphism elucidated by PCR-RFLP method. There were no polymorphism detected using PCR-RFLP. PCR-SSCP and DNA sequencing as another molecular techniques also give same result as PCR-RFLP. Therefore, GH and GHR genes can not use as molecular markers for meat quality.
RINGKASAN
ERYK ANDREAS. Telaah Kualitas Karkas dan Daging serta Identifikasi Keragaman gen GH dan GHR pada Kerbau (Bubalus bubalis). Dibimbing oleh CECE SUMANTRI, HENNY NURAINI, dan ACHMAD FARAJALLAH.
Modal dasar pembangunan subsektor peternakan nasional sangat ditentukan oleh pemilikan, pelestarian dan pemanfaatan sumberdaya hayati ternak baik berupa ternak yang sudah dikembangkan maupun yang masih dipelihara secara subsisten. Kerbau merupakan ternak ruminansia besar yang penting bagi masyarakat Indonesia. Kerbau di Indonesia selain digunakan sebagai tanaga kerja, juga digunakan sebagai sumber daging. Kontribusi daging kerbau terhadap pemenuhan kebutuhan daging nasional masih sangat rendah, yaitu 2,03%. Tingkat konsumsi yang rendah tersebut dapat dipengaruhi oleh latar belakang budaya konsumen, selain kualitas daging juga merupakan faktor penentu bagi konsumen dalam memilih daging yang akan dikonsumsi. Penelitian ini bertujuan untuk mendapatkan informasi tentang kualitas daging kerbau yang datanya masih sangat terbatas, juga informasi keragaman gen pertumbuhan ataugrowth hormone (GH) dan growth hormone receptor (GHR) kerbau, serta kemungkinannya digunakan sebagai penanda kualitas daging kerbau.
Sampel otot yang digunakan untuk pengujian kualitas daging merupakan otot Longissimus dorsi et lumbarum, sebanyak 93 sampel. Sampel yang digunakan dalam identifikasi keragaman gen GH dan GHR sebanyak 425 sampel, terdiri atas 65 sampel dari Siborong-Borong-Medan, 29 sampel dari Lebak-Banten, 180 sampel dari Pandeglang-Banten (48 sampel darah, dan 132 sampel daging), 75 sampel dari Semarang-Jawa Tengah, dan 103 sampel dari Mataram-Nusa Tenggara Barat.
Penilaian kualitas daging meliputi nilai pH, daya putus Warner Bratzler, persentase susut masak, dan persentase air bebas. Penilaian kualitas karkas meliputi bobot potong, bobot karkas, persentase bobot karkas, tebal lemak punggung, dan luas urat daging mata rusuk. Analisis keragaman ruas gen GH dan GHR kerbau dilakukan dengan pendekatanpolymerase chain reactions-restriction length polymorphism (PCR-RFLP), polymerase chain reactions-single strand conformation polymorphism(PCR-SSCP), dan DNA sekuensing.
Kelompok umur kerbau dibawah 2 tahun, 2-4 tahun, dan diatas 4 tahun tidak berpengaruh terhadap kualitas daging yang dihasilkan. Nilai pH daging kerbau dalam penelitian ini berkisar antara 5,5–5,8, daya putus Warner Bratzler berkisar 7,9–9,6 kg/cm2, persentase susut masak antara 44–49%, dan persentase air bebas berkisar antara 18–33%. Nilai pH berkorelasi negatif dengan nilai daya putus Warner Bratzler sebesar -0,69 dan persentase susut masak sebesar -0,31. Korelasi antara daya putus Warner Bratzler dengan persentase susut masak bernilai positif sebesar 0,34.
5
penambahan umur. Kelompok umur 2–4 tahun memiliki bobot potong dan bobot karkas yang lebih tinggi jika dibandingkan dengan kerbau kelompok umur dibawah 2 tahun. Pada kelompok kerbau betina, bobot potong dan bobot karkas untuk kelompok umur 2–4 tahun tidak berbeda dengan kelompok umur diatas 4 tahun, tetapi lebih besar dari kelompok umur dibawah 2 tahun. Parameter kualitas karkas menunjukkan bahwa bobot potong berkorelasi positif dengan bobot karkas (0,89) dan tebal lemak punggung (0,47). Bobot karkas berkorelasi positif dengan tebal lemak punggung (0,65), dan luas urat daging mata rusuk sebesar (0,22). Korelasi positif juga terjadi antara tebal lemak punggung dan luas urat daging mata rusuk (0,27).
Amplifikasi ruas gen GH menggunakan primer forward 5’-CGGACCGTGTCTATGAGAAGCTGAAG-3’ dan primerreverse 5’-GTTCTTG AGCAGCGCGTCGTCA-3’. Panjang produk hasil amplifikasi adalah 432 bp. Amplifikasi ruas gen GHR menggunakan primerforward5’-CGCTTACTTCTGC GAGGTAGACGC-3’ dan primerreverse5’-GTCTGTGCTCACATAGCCAC-3’. Panjang produk amplifikasi ruas gen GHR sepanjang 398 bp. Produk amplifikasi dipotong dengan enzimAluI (lokus GH|AluI dan GHR|AluI). Lokus GH|AluI dan GHR|AluI pada kelima populasi kerbau adalah seragam. Genotipe yang ditemukan adalah genotipe LL untuk gen GH dan genotipe AA untuk gen GHR.
Runutan nukleotida ruas gen GH dan GHR pada kerbau memiliki tingkat kesamaan yang tinggi dengan sapi (96–98%). Pada kerbau dengan daging yang empuk maupun pada kerbau dengan daging yang alot memiliki runutan nukleotida yang sama. Hal tersebut mengindikasikan bahwa ruas gen tersebut tidak dapat digunakan sebagai penanda sifat keempukan daging kerbau.
© Hak Cipta milik IPB, tahun 2010
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
TELAAH KUALITAS DAGING SERTA IDENTIFIKASI
KERAGAMAN GEN GH DAN GHR PADA KERBAU
(Bubalus bubalis)
ERYK ANDREAS
Tesis
sebagai salah satu syarat untuk memperoleh gelar
Magister Sains pada
Mayor Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Telaah Kualitas Daging serta Identifikasi Keragaman Gen GH dan GHR pada Kerbau (Bubalus bubalis)
Nama : Eryk Andreas
NRP : D151080161
Disetujui
Komisi Pembimbing
Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc Ketua
Dr. Ir. Henny Nuraini, M.Si Anggota
Dr. Ir. Achmad Farajallah, M.Si Anggota
Diketahui Ketua Mayor
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R. A. Maheswari, DEA
a.n. Dekan Sekolah Pascasarjana IPB Sekretaris Program Magister
Dr. Ir. Naresworo Nugroho, MS.
Tanggal Ujian: 19 Februari 2010 (tanggal pelaksanaan ujian tesis)
Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa, atas
rahmat dan karunia yang telah diberikan-Nya sehingga penulis dapat
menyelesaikan studi, penelitian, dan penulisan tesis ini. Tesis ini berjudul Telaah
Kualitas Daging serta Identifikasi Keragaman Gen GH dan GHR pada Kerbau
(Bubalus bubalis)..
Penulis mengucapkan terimakasih kepada Prof. Dr. Ir. Cece Sumantri,
M.Agr.Sc, Dr. Ir. Henny Nuraini, M.Si, dan Dr. Ir. Achmad Farajallah, M.Si
selaku pembimbing, yang selalu memberikan arahan dalam penyelesaian tugas
akhir dari awal hingga akhir. Ucapan terimakasih juga tak lupa penulis sampaikan
kepada Dr. Ir. Rudy Priyanto selaku penguji atas segala saran dan masukkan
dalam penulisan tesis ini.
Ucapan terimakasih juga penulis sampaikan kepada Prof. Dr. Ir. Ronny
Rachman Noor, M.Rur.Sc dan Prof. Dr. Ir. Muladno, MSA yang telah
memberikan kesempatan melakukan penelitian di Laboratorium Genetika
Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak. Penghargaan tertinggi
penulis sampaikan kepada kedua orang tua tercinta atas kasih sayang, perhatian
dan motivasi yang tak pernah dapat terbalaskan. Kepada kakak, adik, dan saudara
penulis semua, yang selalu memberikan perhatian dan semangat kepada penulis.
Kepada teman-teman di Laboratorium Genetika Molekuler Ternak penulis
mengucapkan terimaksih atas kerjasamanya selama penelitian berlangsung.
Akhirnya penulis mengharapkan semoga karya ini bermanfaat bagi upaya
pembangunan peternakan di Indonesia.
Bogor, Maret 2010
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 7 April 1986 di Subang. Penulis adalah anak kedua dari dua bersaudara dari pasangan Yeremia Gunawan dan Kwie Nio.
Pendidikan dasar diselesaikan pada tahun 1998 di SD Negeri 3 Ciwidey, Bandung. Pendidikan lanjutan menengah pertama diselesaikan pada tahun 2001 di SLTP Negeri 1 Ciwidey, Bandung, pendidikan lanjutan menengah atas diselesaikan pada tahun 2004 di SLTA Negeri 1 Ciwidey, Bandung. Diterima sebagai mahasiswa pada Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI) pada tahun 2004. Selanjutnya diterima sebagai mahasiswa Sekolah Pascasarjana IPB pada Mayor Ilmu Produksi dan Teknologi Peternakan dengan pilihan minat di bidang pemuliaan dan genetika ternak pada tahun 2008.
DAFTAR ISI
Halaman
DAFTAR ISI ... iv
DAFTAR TABEL ... vi
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 2
Kerangka Pemikiran ... 2
TINJAUAN PUSTAKA ... 4
Kerbau (Bubalus bubalis) ... 4
Kualitas Daging dan Karkas ... 5
Faktor yang Berpengaruh terhadap Kualitas Daging dan Karkas ... 7
Hormon Pertumbuhan ... 9
Reseptor Hormon Pertumbuhan ... 10
Pengaturan Otot oleh GH ... 11
Penanda Molekuler ... 12
Analisis Keragaman Genetik ... 13
METODE ... 14
Waktu dan Tempat ... 14
Materi ...14
Sampel OtotLongissimus dorsi et lumbarum ... 14
Sampel DNA ... 14
Primer ... 14
Prosedur ... 15
Penilaian Kualitas Karkas dan Daging Kerbau ... 15
Ekstraksi DNA ... 16
Amplifikasi Ruas Gen GH dan GHR ... 17
v
Pendeteksian Keragaman dengan Pendekatan PCR-SSCP
dan DNA Sekuensing ... 17
Analisis Data ... 18
Pengaruh Umur terhadap Kualitas Karkas dan Daging ... 18
Koefisien Korelasi ... 18
Frekuensi Genotipe dan Alel ... 19
HASIL DAN PEMBAHASAN ... 20
Kualitas Karkas ... 20
Kualitas Daging ... 22
Potensi Kerbau sebagai Ternak Potong ... 23
Amplifikasi Ruas Gen GH dan GHR Kerbau ... 24
Identifikasi Varian Gen GH Kerbau dengan Pendekatan PCR-RFLP ... 25
Identifikasi Varian Gen GHR Kerbau dengan Pendekatan PCR-RFLP ... 26
Identifikasi Varian Gen GH dan GHR dengan Pendekatan PCR-SSCP ... 28
Runutan DNA Ruas Gen GH dan GHR ... 29
Keragaman Genetik Kerbau di Indonesia ... 32
SIMPULAN DAN SARAN ... 33
Simpulan ... 33
Saran ... 33
DAFTAR PUSTAKA ... 34
DAFTAR TABEL
Nomor Halaman
1. Data populasi kerbau (ekor) produksi daging kerbau (kg)
masing-masing provinsi di Indonesia ... 5
2. Rataan penilaian kualitas karkas kerbau jantan ... 20
3. Rataan penilaian kualitas karkas kerbau betina ... 20
4. Koefisien korelasi antar peubah kualitas karkas ... 22
5. Rataan penilaian kualitas daging kerbau jantan ... 22
6. Rataan penilaian kualitas daging kerbau betina ... 22
7. Koefisien korelasi antar kualitas daging kerbau ... 23
8. Frekuensi genotipe dan alel GH|AluI ... 27
9. Frekuensi genotipe dan alel GHR|AluI ... 28
10. Posisi perbedaan nukleotida pada ruas gen GH ... 30
DAFTAR GAMBAR
Nomor Halaman
1. Kerangka pemikiran penelitian ... 3
2. Diagram alir sinyal intraseluler interaksi GH dan GHR ... 10
3. Visualisasi hasil amplifikasi ruas gen GH dan GHR pada gel
agarosa 1,5% ... 25
4. Runutan nukleotida ruas gen GH (Genbank nomor akses
J00008) ... 25
5. Visualisasi PCR-RFLP ruas gen GH|AluI pada gel agarosa 2% .... 26 6. Runutan nukleotida ruas gen GHR (Genbank nomor akses
AY053546) ... 27
7. Visualisasi PCR-RFLP ruas gen GHR|AluI pada gel agarosa 2% . 27 8. Visualisasi PCR-SSCP pada PAGE 8% ... 29
9. Runutan DNA ruas gen GH ... 30
DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil analisis ragam pengaruh umur terhadap bobot potong
kerbau pada kelompok jantan ... 40
2. Hasil analisis ragam pengaruh umur terhadap bobot karkas
kerbau pada kelompok jantan ... 40
3. Hasil analisis ragam pengaruh umur terhadap persentase
bobot karkas kerbau pada kelompok jantan ... 40
4. Hasil analisis ragam pengaruh umur terhadap tebal lemak
punggung karkas kerbau pada kelompok jantan ... 40
5. Hasil analisis ragam pengaruh umur terhadap luas urat daging
mata rusuk karkas kerbau pada kelompok jantan ... 41
6. Hasil analisis ragam pengaruh umur terhadap pH daging kerbau
pada kelompok jantan ... 41
7. Hasil analisis ragam pengaruh umur terhadap daya putus
Warner Bratzler daging kerbau pada kelompok jantan ... 41
8. Hasil analisis ragam pengaruh umur terhadap persentase
susut masak daging kerbau pada kelompok jantan ... 41
9. Hasil analisis ragam pengaruh umur terhadap persentase air
bebas daging kerbau pada kelompok jantan ... 42
10. Hasil analisis ragam pengaruh umur terhadap bobot potong
kerbau pada kelompok betina ... 42
11. Hasil analisis ragam pengaruh umur terhadap bobot karkas
kerbau pada kelompok betina ... 42
12. Hasil analisis ragam pengaruh umur terhadap persentase
bobot karkas kerbau pada kelompok betina ... 42
13. Hasil analisis ragam pengaruh umur terhadap tebal lemak
punggung kerbau pada kelompok betina ... 43
14. Hasil analisis ragam pengaruh umur terhadap luas urat daging
mata rusuk karkas kerbau pada kelompok betina ... 43
15. Hasil analisis ragam pengaruh umur terhadap nilai pH daging
kerbau pada kelompok betina ... 43
16. Hasil analisis ragam pengaruh umur terhadap daya putus
Warner Bratzler daging kerbau pada kelompok betina ... 43
17. Hasil analisis ragam pengaruh umur terhadap persentase
susut masak daging kerbau pada kelompok betina ... 44
18. Hasil analisis ragam pengaruh umur terhadap persentase air
PENDAHULUAN
Latar Belakang
Modal dasar pembangunan subsektor peternakan nasional sangat
ditentukan oleh pemilikan, pelestarian dan pemanfaatan sumberdaya hayati ternak
baik berupa ternak yang sudah dikembangkan maupun yang masih dipelihara
secara subsisten. Kerbau (Bubalus bubalis) merupakan ternak ruminansia besar
yang penting bagi masyarakat Indonesia. Populasi kerbau di Indonesia pada tahun
2008 diperkirakan sebanyak 2.191.636 ekor (Direktorat Jenderal Peternakan
2008).
Kerbau memiliki keunggulan tersendiri untuk dikembangkan karena dapat
bertahan hidup dengan pakan berkualitas rendah, toleran terhadap parasit setempat
serta keberadaannya telah menyatu sedemikian rupa dengan kehidupan sosial dan
budaya petani Indonesia. Kerbau di Indonesia pada umumnya digunakan sebagai
sumber daging, dan sebagai tenaga kerja dalam mengolah lahan usahatani. Pada
beberapa daerah, kerbau digunakan sebagai penghasil susu, dan pelengkap
upacara adat. Ternak yang secara genetik beradaptasi terhadap kondisi lingkungan
spesifik, akan lebih produktif karena dapat dikembangkan dengan menggunakan
biaya rendah, mendukung keanekaragaman pangan, pertanian, dan budaya, serta
efektif dalam mencapai tujuan keamanan pangan.
Bertujuan untuk mempertahankan, menggali dan mengembangkan potensi
sumberdaya genetik kerbau lokal, langkah awal yang perlu dilakukan antara lain
dengan menghimpun informasi, karakterisasi dan identifikasi baik pada performa
maupun parameter genetik terutama yang berkaitan dengan sejumlah sifat
ekonomis penting. Informasi asal-usul, karakteristik ternak (sifat-sifat produksi
dan reproduksi), dan karakteristik populasi (keragaman, status populasi) kerbau
lokal belum banyak diketahui. Informasi tersebut sangat penting dan diperlukan
bagi pengembangan dan perbaikan mutu genetik sebagai bagian dari
pengembangan ternak kerbau secara nasional.
Kualitas daging merupakan salah satu faktor yang penting bagi konsumen
dalam menentukan jenis daging yang akan dikonsumsi. Penentuan kualitas daging
dapat dipengaruhi oleh beberapa faktor, diantaranya preferensi, pengalaman, dan
2
beberapa peubah, antara lain nilai pH, daya ikat air, susut masak, dan keempukan.
Kualitas daging dipengaruhi oleh faktor sebelum pemotongan (ante mortem)
seperti genetik, spesies, bangsa, jenis kelamin, umur dan jenis pakan, dan faktor
setelah pemotongan (post mortem) seperti metode penyimpanan, preservasi, dan pemasakan daging tersebut (Aberleet al. 2001).
Hormon pertumbuhan atau growth hormone (GH) merupakan hormon anabolik yang disintesis dan disekresikan oleh sel somatotrof pada lobus anterior
pituitari (Ayuk dan Sheppard 2006). GH memiliki peranan penting dalam
pertumbuhan dan perkembangan longitudinal pascanatal, pertumbuhan jaringan,
laktasi, reproduksi, dan metabolisme protein, lipid, dan karbohidrat (Akers 2006;
ThidarMyintet al. 2008). Keragaman gen GH berpengaruh terhadap sifat karkas
dan komposisi asam lemak pada sapi Japanese Black (Ardiyanti et al. 2009). Reseptor hormon pertumbuhan ataugrowth hormone receptor (GHR) merupakan
protein transmembran yang mengikat GH dengan afinitas dan spesifitas yang
tinggi. Ekspresi reseptor diperlukan untuk menghasilkan aktivitas selular terhadap
GH. Hal tersebut mengindikasikan bahwa perubahan fungsi GHR dapat
berpengaruh terhadap kemampuan mengikat GH dan aktivitas GH dalam jaringan
target (Di Stasioet al. 2005).
Tujuan
Penelitian ini bertujuan untuk mendapatkan informasi tentang kualitas
karkas dan daging kerbau, serta keragaman gen GH dan GHR pada kerbau.
Kerangka Pemikiran
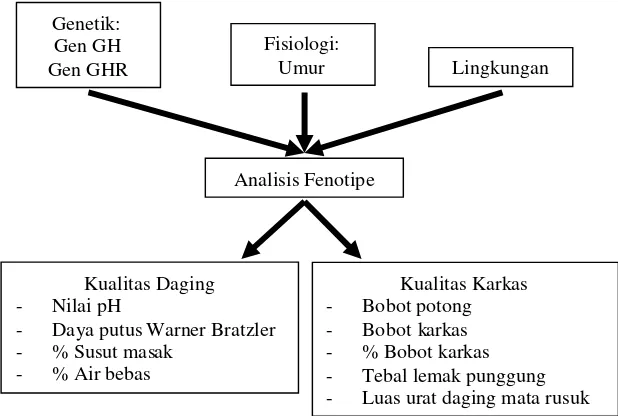
Karakteristik fenotipe yang diamati dalam penelitian ini adalah penilaian
kualitas daging, dan kualitas karkas. penilaian kualitas daging mewakili nilai pH,
daya putus Warner Bratzler, persentase susut masak, dan persentasse air bebas.
Penilaian kualitas karkas meliputi bobot potong, bobot karkas, persentase bobot
karkas, tebal lemak punggung, dan rib eye area (luas urat daging mata rusuk). Laporan tentang adanya pengaruh dari faktor genetik, fisiologi, dan lingkungan
terhadap sifat fenotipe telah banyak dilaporkan pada sapi. Penelitian ini dirancang
3
keragaman gen GH dan GHR pada Kerbau. Penelitian ini dirancang berdasarkan
tinjuan pustaka yang terkait dengan topik penelitian. Kerangka pemikiran diatas
kemudian diringkas dalam Gambar 1.
Gambar 1. Kerangka pemikiran penelitian. Genetik:
Gen GH Gen GHR
Analisis Fenotipe
Kualitas Karkas - Bobot potong - Bobot karkas - % Bobot karkas - Tebal lemak punggung - Luas urat daging mata rusuk Fisiologi:
Umur Lingkungan
Kualitas Daging - Nilai pH
- Daya putus Warner Bratzler - % Susut masak
TINJAUAN PUSTAKA
Kerbau
Kerbau merupakan salah satu ternak ruminansia yang penting dalam
pemenuhan kebutuhan daging masyarakat Indonesia setelah sapi. Kerbau
termasuk kedalam famili Bovidae, genus Bubalus. Menurut Hardjosubroto dan
Astuti (1993), populasi kerbau yang ada di seluruh dunia saat ini berasal dari
daerah sekitar India yang merupakan hasil domestikasi dari kerbau liar (Bubalus arnee). Beberapa tipe kerbau liar masih dapat ditemukan, antara lain Anoa
(Bubalus depressicornis) yang terdapat di daerah Sulawesi, kerbau Mindoro (Bubalus mindoronensis) yang terdapat di Filipina, Bubalus caffer yang terdapat di Afrika Timur dan Barat Daya dan Kerbau merah yang terdapat di daerah Tsad,
Niger, Kongo dan Maroko Selatan. Kerbau domestik (Bubalus bubalis) secara umum dikelompokkan menjadi kerbau rawa (swamp buffalo) dan kerbau sungai
(river buffalo).
Kerbau diketahui memiliki beberapa kelebihan dibandingkan dengan sapi.
Diwyanto dan Handiwirawan (2006) menyatakan bahwa kerbau dapat hidup di
agroekosistem dengan ketersediaan pakan terbatas. Kerbau juga dapat
berkembangbiak dalam rentang kawasan yang luas dari daerah yang basah sampai
daerah yang relatif kering. Usaha pertanian secara tradisional, memelihara kebau
selain sebagai penghasil daging, juga digunakan sebagai ternak kerja. Kerbau juga
digunakan sebagai ternak penghasil susu seperti kerbau murrah yang banyak
terdapat di daerah Sumatera Utara.
Populasi kerbau di Indonesia pada tahun 2008 diperkirakan sebanyak
2.191.636 ekor. Jumlah kerbau yang dipotong pada tahun 2008 tercatat sebanyak
208.800 ekor dengan produksi daging sebanyak 43.954 ton atau sekitar 2,03%
dari total produksi daging dalam negeri. Data statistik 2007 menunjukkan bahwa
tingkat konsumsi daging kerbau sebesar 0,05 kg/kapita/tahun. Nilai tersebut jauh
lebih rendah dari jenis daging yang lainnya seperti sapi (0,53 kg/kapita/tahun),
kambing (0,27 kg/kapita/tahun), dan ayam (4,37 kg/kapita/tahun) (Direktorat
Jenderal Peternakan 2008). Data populasi kerbau dan jumlah produksi daging
5
Tabel 1. Data populasi kerbau (ekor) dan produksi daging kerbau (kg) masing-masing provinsi di Indonesia.
Provinsi 2006 2007 2008 *)
Populasi Produksi Populasi Produksi Populasi Produksi
NAD 371.143 6.300 390.334 3.899 410.518 4.101
Sumut 261.794 7.075 189.167 10.951 189.167 9.542
Sumbar 211.531 2.923 192.148 2.584 197.335 2.842
Riau 51.791 1.778 50.362 1.668 56.884 1.542
Jambi 72.117 1.883 72.206 2.189 74.976 2.140
Sumsel 86.777 1.711 90.160 1.695 93.675 1.725
Bengkulu 48.693 692 51.255 604 51.768 648
Lampung 36.408 435 38.991 523 42.559 523
DKI Jakarta 143 245 83 138 90 184
Jabar 149.444 4.436 149.030 3.348 170.568 3.348
Jateng 112.963 3.499 109.004 3.228 116.014 3.174
DI Yogyakarta 4.990 7 4.761 12 4.809 13
Jatim 54.198 488 53.364 417 53.364 417
Bali 6.775 15 5.988 6 6.684 9
NTB 155.166 1.952 153.822 2.536 169.204 2.638
NTT 142.257 1.716 144.981 1.166 159.479 1.166
Kalbar 4.079 21 2.222 12 4.302 27
Kalteng 16.560 72 17.100 564 18.810 567
Kalsel 41.435 946 43.096 866 43.096 909
Kaltim 8.810 280 9.091 260 7.087 540
Sulut 27 0 0 0 0 0
Sulteng 4.491 38 4.181 40 4.192 45
Sulsel 129.565 4.924 120.003 2.297 120.003 3.622
Sultra 7.613 45 6.951 42 6.946 47
Maluku 23.164 351 25.303 344 27.509 403
Papua 1.290 28 1.319 52 1.365 58
Babel 756 7 759 15 756 7
Banten 146.453 1.894 144.944 2.270 144.944 3.685
Gorontalo 0 0 0 0 0 0
Malut 16 0 68 0 70 0
Kepri 0 0 252 0 258 0
Irjabar 0 3 1 0 1 0
Sulbar 16.157 123 14.833 30 15.203 31
Total 2.166.606 43.886 2.085.779 41.756 2.191.636 43.954
Sumber: Direktorat Jenderal Peternakan 2008
Kualitas Daging dan Karkas
Daging didefinisikan sebagai bagian dari hewan dan semua produk hasil
pengolahan bagian tersebut yang dapat dimakan tanpa menyebabkan gangguan
bagi yang memakannya, termasuk bagian otot, beberapa organ seperti hati, ginjal,
otak dan jaringan yang dapat dimakan lainnya (Lawrie 1998). Kualitas daging
dipengaruhi oleh faktor sebelum pemotongan (ante mortem) seperti genetik,
spesies, bangsa, jenis kelamin, umur dan jenis pakan, dan faktor setelah
pemotongan (post mortem) seperti metode penyimpanan, preservasi, dan
6
daging dapat dipengaruhi oleh beberapa faktor, diantaranya preferensi,
pengalaman, dan latar belakang budaya konsumen. Kualitas daging dapat
ditentukan melalui beberapa peubah, antara lain nilai pH, daya ikat air, susut
masak dan keempukan.
Keempukan daging merupakan salah satu faktor yang paling penting pada
penentuan kualitas daging karena berpengaruh terhadap kepuasan konsumen
(Miller et al. 1995). Sifat tersebut setidaknya ditentukan oleh tiga komponen daging, yaitu struktur myofibril, kandungan jaringan ikat, dan daya ikat air
(Aberle et al. 2001). Faktor lingkungan yang berpengaruh terhadap keempukan diantaranya pelayuan karkas (Mayet al. 1992), stimulasi listrik (Nouret al. 1994), waktu pelayuan, umur dan jenis kelamin (Lonergan dan Lonergan 2005) serta
suplementasi vitamin D3 sebelum pemotongan (Swaneket al. 1999).
Daya ikat air merupakan kemampuan daging untuk mengikat air di dalam
daging atau air yang ditambahkan selama pengolahan, seperti pemotongan,
pemanasan, penggilingan dan penekanan (Aberle et al. 2001). Beberapa penelitian menunjukkan bahwa daya ikat air dipengaruh oleh lama pelayuan (Irurueta et al.
2008), jenis kelamin (Rao et al. 2009), spesies, umur, fungsi otot, jenis pakan, transportasi, temperatur, kelembaban dan penyimpanan (Lawrie 1998; Aberle et al. 2001).
Susut masak merupakan fungsi dari temperatur dan lama pemasakan.
Susut masak dipengaruhi oleh pH daging, panjang sarkomer serabut otot, panjang
potongan serabut otot, status kontraksi miofibril, ukuran dan berat sampel daging,
dan penampang lintang daging. Sifat susut masak daging bervariasi antara
15-40%. Nilai susut masak daging dapat digunakan untuk estimasi jumlah jus dalam
daging masak. Daging dengan susut masak yang lebih rendah relatif memiliki
kualitas yang lebih baik dari daging dengan susut masak lebih tinggi (Soeparno
2005).
Karkas merupakan hasil utama proses pemotongan ternak. Bagian karkas
merupakan bagian ternak tanpa darah, kepala, organ dalam, kulit, ekor dan shank
(Soeparno 2005). Bagian karkas pada umumnya memiliki nilai ekonomis yang
7
individu ternak sangat bervariasi. Hal tersebut disebabkan oleh beberapa faktor,
diantaranya faktor genetik, nutrisi dan lingkungan (Aberleet al. 2001).
Faktor yang Berpengaruh terhadap Kualitas Daging dan Karkas
Bangsa dari suatu ternak berperanan penting terhadap kualitas daging dan
karkas ternak tersebut. Penelitian tentang kualitas daging dan karkas pada bangsa
yang berbeda telah banyak dilakukan pada babi (Jeremiah et al. 1999), sapi (Sanudoet al. 2004; Monsonet al. 2004; Cuvelieret al. 2006), kuda (Juarezet al.
2009) dan kambing (Pena et al. 2009). Hasil penelitian mengindikasikan adanya perbedaan potensi, periode penggemukan, bobot badan, skor lemak, dan
kandungan lemak intramuskular pada bangsa yang berbeda.
Perbedaan utama komponen karkas ternak pada bangsa yang berbeda
disebabkan oleh perbedaan ukuran saat mencapai dewasa. Hal tersebut
ditunjukkan Sanudoet al. (2004) yang menggunakan sapi dengan fenotipedouble muscle(DM), fast growth(FG), dual purpose (DP) dan sapi lokal Spanyol (UT) dengan bobot badan 240-290 kg. Hasil penelitian menunjukkan bahwa sapi DM,
FG dan DP memiliki persentase bobot karkas dan persentase bobot otot yang lebih
tinggi dari sapi UT. Bobot tulang dan kandungan lemak intramuskuler dari sapi
UT memiliki persentase yang lebih tinggi dibandingkan sapi yang lainnya.
Tingginya kandungan lemak intramuskular mengindikasikan bahwa pada bobot
badan yang sama, sapi DM, FG, dan DP memilliki umur fisiologis yang lebih
muda dibandingkan sapi UT.
Beberapa faktor yang berpengaruh terhadap kualitas karkas dan daging
ternak dengan bangsa yang sama diantaranya adalah umur dan bobot potong.
Beberapa laporan menunjukkan adanya pengaruh yang nyata dari umur saat
pemotongan terhadap bobot potong, tebal lemak punggung (Du Plessis dan
Hoffman 2007), bobot karkas (Mojto et al. 2009), pH, daya putus Warner Bratzler dan persentase air bebas (Iruruetaet al. 2008; Rao et al. 2009).
Sapi dengan umur 30 bulan memiliki bobot badan dan bobot karkas yang
lebih tinggi dari sapi umur 18 bulan. Sapi yang lebih tua menghasilkan daging
yang lebih alot (Du Plesis dan Hoffman 2007; Irurueta et al. 2008; Rao et al.
8
eye are yang lebih besar (Mojto et al. 2009). Pada ternak dengan bobot potong yang berbeda didapatkan bahwa ternak dengan bobot potong yang lebih tinggi
memiliki daging yang lebih empuk (Sanudoet al. 2004).
Faktor genetik yang sangat berpengaruh terhadap keempukan diantaranya
gencalpastatin (Lonergan dan Lonergan 2005; Casaset al. 2006; Schenkelet al.
2005), leptin (Schenkel et al. 2005), thyroglobulin (Casas et al. 2007) dan
myostatin F94L (Esmailizadeh et al. 2008). Variasi kadar kalpastatin sangat tergantung pada spesies (Koohmaraie 1991) dan jenis otot (Geesink dan
Koohmaraie 1999), semakin tinggi aktifitas kalpastatin akan menurunkan
keempukan daging postmortem (Woodward et al. 2000). Pengaruh yang nyata dari gen RYR1 (ryanodine receptor locus) dan PRKAG3 (Protein kinase
adenosinemonophosphate gamma 3 subunit) terhadap beberapa sifat kualitas
daging babi telah dilaporkan Ottoet al. (2007). Penanda melanocortin-4 receptor
(MC4R) dan high mobility group AT hook 1 (HMGA1) berpengaruh nyata terhadap susut masak,lactate dehydrogenaseA (LDHA), kalpastatin dan ATPase
Ca2+ transporting fast twitch 1 (ATP2A1) berpengaruh terhadap pH dan
kandungan lemak intramuskular.
Nutrisi merupakan komponen lingkungan yang memiliki pengaruh
terbesar terhadap kualitas daging dan karkas. Cerdeno et al. (2006) melaporkan
adanya pengaruh pakan terhadap kandungan lemak internal, skor penggemukan,
dan tebal lemak subkutan. Penelitian yang dilakukan Jaturasithaet al. (2009) pada sapi lokal Thailand menunjukkan bahwa sapi yang diberikan campuran rumput
dan legum memiliki warna daging yang lebih terang dan lebih empuk dari sapi
yang diberikan rumput saja. Kandungan lemak dan kolesterol pada sapi yang
diberikan legum dan rumput lebih tinggi dari yang diberikan rumput saja. Hal
tersebut mengindikasikan bahwa energi pakan yang lebih tinggi menghasilkan
kandungan lemak karkas yang lebih tinggi (Soeparno 2005).
Hormon Pertumbuhan
Hormon pertumbuhan atau growth hormone (GH) merupakan hormon anabolik yang disintesis dan disekresikan oleh sel somatotrof pada lobus anterior
9
dengan berat molekul 22 kDa (Frago dan Chowen 2005). Sintesis dan sekresi
protein tersebut dipengaruhi oleh umur dan jenis kelamin (Ardiyantiet al. 2009).
Protein ini memiliki peranan penting dalam pertumbuhan dan
perkembangan longitudinal pascanatal, pertumbuhan jaringan, laktasi, reproduksi,
metabolisme protein, lipid dan karbohidrat (Akers 2006; ThidarMyintet al. 2008).
Pengaruh GH terhadap pertumbuhan telah diamati pada beberapa jaringan,
termasuk tulang, otot dan jaringan adiposa. Selain itu pada ternak ruminansia, GH
berperan dalam pengaturan perkembangan kelenjar mamae (Akers 2006).
Protein GH disandikan oleh gen GH yang terletak pada kromosom 19 pada
Bovinaedengan panjang sekitar 2800 pb yang tersusun atas lima ekson dan empat intron. Gen GH telah digunakan secara luas sebagai penanda pada beberapa
spesies ternak seperti pada sapi (Bos taurus danBos indicus) (Zhou et al. 2005; Beauchemin et al. 2006; Katoh et al. 2008), domba (Ovis aries) (Marques et al.
2006) dan kambing (Capra hircus) (Boutinaudet al. 2003).
Penelitian yang mempelajari tentang hubungan keragaman gen GH dengan
sifat pertumbuhan telah banyak dilakukan. Pada sapi Belgian White Blue,
keragaman GH dengan restriction fragment length polymorphism (RFLP) menggunakan enzim pemotongTaqI (GH|TaqI) dihubungkan dengan bobot badan pada umur tujuh dan 13 bulan (Sneyers et al. 1994). Genotipe GH|AluI
berpengaruh nyata terhadap bobot sapi Canchim umur satu tahun (5/8 Charolais +
3/8 Zebu) (Pereira et al. 2005), sifat karkas dan komposisi asam lemak pada sapi Japanese Black (Ardiyantiet al. 2009.
Keragam gen GH pada kambing Algarvia (Potugis) yang diidentifikasi
dengan metode single strand conformation polymorphism (SSCP) berhubungan dengan produksi, lemak dan protein susu (Boutinaud et al. 2003). Keragaman
haplotip gen GH|HaeIII pada kambing Boer berpengaruh terhadap bobot lahir, bobot sapih, pertambahan bobot badan perhari sebelum sapih dan bobot pada
umur 11 bulan (Huaet al. 2009).
Reseptor Hormon Pertumbuhan
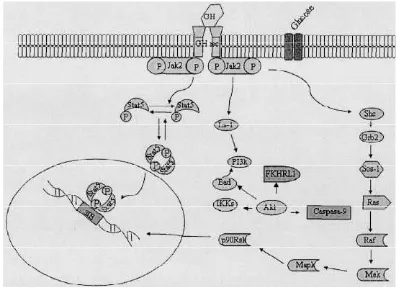
Reseptor hormon pertumbuhan atau growth hormone receptor (GHR)
10
spesifitas yang tinggi. Ekspresi reseptor diperlukan untuk aktivitas selular
terhadap GH. Hal tersebut mengindikasikan bahwa perubahan fungsi GHR dapat
mempengaruhi kemampuan mengikat GH dan aktivitas GH dalam jaringan target
(Di Stasio et al. 2005). Diagram alir signal intraseluler interkasi GH dan GHR disajikan pada Gambar 2.
Gambar 2. Diagram alir sinyal intraseluler interaksi GH dan GHR (Frago dan Chowen 2005)
Protein GHR disandikan oleh gen GHR yang terletak pada kromosom 20
pada sapi, dan terdiri atas 10 ekson pada sapi (Moodyet al. 1995). Tanskripsi gen GHR pada sapi diinisiasi oleh tiga promotor utama dari ekson 1A, 1B dan 1C,
menghasilkan mRNA jenis 1A, 1B dan 1C. Jenis mRNA tersebut memiliki
perbedaan pada bagian 5’-untranslated region (Jiang dan Lucy 2001). mRNA GHR 1A hanya diekspresikan di hati (Lucyet al. 1998), sedangkan mRNA GHR
1B dan 1C diekspresikan pada berbagai jaringan (Jiang dan Lucy 2001).
Perubahan gen GHR pada ayam berpengaruh terhadap dwarf phenotype
(kerdil) (Tixier-Boichard 2002). Keragaman gen GHR pada sapi yang telah
11
10 (Geet al. 2000). Analisis PCR-RFLP menggunakanNsiI pada daerah regulator GHR sapi berpengaruh terhadap tingkat serum IGF-1 (Ge et al. 2000). Subsitusi
dari fenilalanin menjadi tirosin pada daerah transmembran GHR sangat
berpengaruh terhadap produksi dan komposisi susu sapi (Blott et al. 2003). Keragaman pada GHR sapi ekson 10 berpengaruh terhadap kualitas daging (Di
Stasioet al. 2005).
Pengaturan Otot oleh GH
Otot rangka merupakan penyusun 40% dari bobot badan. Otot memiliki
beberapa peran penting, diantaranya sebagai alat gerak, bernafas, penyeimbang
panas tubuh, pelindung organ dalam, metabolisme glukosa dan lemak. Terdapat
dua mekanisme utama yang menyebabkan peningkatan masa otot, yaitu
hyperplasia atau peningkatan ukuran serabut otot dan hyperplasia atau
peningkatan jumlah serabut otot (Velloso 2008).
Rangkaian utama dalam pengontrolan masa otot adalah proses aktivasi
sintesis dan inhibisi degradasi protein. Kedua proses tersebut disebabkan oleh
adanya rangkaian aktifitas tirosin kinase melalui fospatidilinositol 3 kinase
(rangkaian PI3K/AKT). Rangkaian PI3K/AKT diaktifkan melalui proses exercise
dan keberadaan reseptor IGF-1 dan insulin dalam sel (Bolsteret al. 2004).
Interkasi GH dengan GHR pada sel mengakibatkan terjadinya sinyal
intraselular janus kinase dan mengaktifkan rangkaian transkripsi (Smit et al. 1996). Stimulasi GH berpengaruh terhadap sintesis IGF-1 hampir di semua
jaringan. Hati merupakan organ yang bertanggungjawab dalam proses produksi
serum IGF-1. Pelepasan GH menyebabkan peningkatan proses sintesis mRNA
dan protein IGF-1 dalam hati. Ternak yang mengalami kehilangan IGF-1 spesifik
hati menghasilkan serum IGF-1 yang lebih rendah (10-25%) dibandingkan yang
normal (Sjogrenet al. 1999; Yakaret al. 1999).
Defisiensi GH atau GH yang tidak sensitif (sindrom Laron’s yang
disebabkan adanya mutasi pada gen GHR) tidak berpengaruh pada bobot lahir,
tetapi menurunkan proses pertumbuhan selanjutnya. Suprafisiologis GH memicu
terjadinya gigantisme, acromegaly yang ditandai pertumbuhan yang berlebihan
12
cardiomyopathies, hyperglycaemia, tekanan darah tinggi, dan diabetes mellitus (Ayuk dan Sheppard 2006).
Penanda Molekuler
Penanda molekuler merupakan pemanfaatan dari keragaman pada tingkat
deoxyribonucleic acid (DNA). Penanda molekuler memiliki peranan penting dalam genetika ternak. Hal tersebut merupakan salah satu faktor utama yang
mendasari terjadinya proses seleksi (Vignal et al. 2002). Tipe dasar perubahan
dalam DNA meliputi subsitusi, delesi, insersi, dan inversi (Nei dan Kumar 2000).
Single nucleotide polymorphisms (SNP) merupakan penanda yang memiliki perbedaan satu nukleotida dalam sekuen DNA, dan diperkirakan bahwa
satu SNP terjadi setiap 250–1000 bp. Perbedaan tersebut disebabkan oleh
terjadinya proses substitusi, sehingga biasanya memiliki dua kemungkinan pada
posisi yang sama dalam sekuen DNA (Vignal et al. 2002). Frekuensi mutasi dan stabilitas yang tinggi menyebabkan SNP sering digunakan sebagai penanda
molekuler dalam penelitian tentang genetika populasi dan pemetaan gen untuk
penyakit kompleks (Ye et al. 2001). Metode yang umum digunakan dalam menganalisis adanya SNP antara lain PCR-RFLP dan PCR-SSCP.
Polymerase chain reaction (PCR) merupakan suatu teknik untuk
menggandakan jumlah molekul DNA secara in vitro. Proses ini berjalan dengan bantuan enzim polymerase dan primer. Primer merupakan oligonukleotida spesifik pada DNA templete. Enzim polymerase merupakan enzim yang dapat
mencetak urutan DNA baru. Hasil PCR dapat langsung divisualisasikan dengan
elektroforesis atau dapat digunakan untuk analisis lebih lanjut (Williams 2005).
Polymerase chain reaction-restriction fragment length polymorphism atau
RFLP merupakan metode analisis lanjutan dari produk PCR. Metode
PCR-RFLP memanfaatkan perbedaan pola pemotongan enzim pemotong yang berbeda
pada tiap-tiap mikroorganisme. Analisis RFLP sering digunakan untuk
mendeteksi lokasi genetik dalam kromosom yang menyandikan penyakit yang
13
Polymerase chain reaction-single-strand conformation polymorphism atau PCR-SSCP merupakan salah satu metode analisis lebih lanjut yang memanfaatkan
produk PCR. Metode PCR-SSCP merupakan metode yang handal dalam
mendeteksi adanya mutasi secara cepat (Hayashi 1991). Metode ini didasarkan
pada asumsi bahwa perubahan asam nukleotida akan menyebabkan perubahan
pola migrasi pada gel poliakrilamidanondenaturasi(Barroso et al. 1999). Mutasi dideteksi dari adanya perbedaan pola migrasi dari bentuk ikatan utas tunggal DNA
pada gel poliakrilamida (Hayashi 1991), yang disebut sebagai perubahan
konformasi atau bentuk molekul. Pendeteksian dalam SSCP dipengaruhi oleh
matriks gel, kondisi elektroforesis, panjang fragmen dan kandungan G+C (Nataraj
et al. 1999). Perbedaan konsentrasi akrilamida, perbandingan akrilamida dengan
bis-akrilamida, penggunaan gliserol, suhu elektroforesis dan kondisi bufer dapat
berpengaruh terhadap pendeteksian keragaman (Barrosoet al. 1999).
Analisis Keragaman Genetik
Identifikasi keragaman genetik dalam suatu populasi digunakan untuk
mengetahui dan melestarikan bangsa-bangsa dalam populasi terkait dengan
penciri suatu sifat khusus. Populasi alami biasanya memiliki keragaman genetik
yang tinggi. Informasi keragaman genetik suatu bangsa akan sangat bermanfaat
bagi keamanan, dan ketersediaan bahan pangan yang berkesinambungan (Blottet al.2003). Nei dan Kumar (2000) menyatakan bahwa populasi dinilai beragam jika memiliki dua atau lebih alel dalam satu lokus dengan frekuensi yang cukup
(biasanya lebih dari 1%).
Keragaman genetik dapat digunakan sebagai parameter dalam mempelajari
genetika populasi dan genetika evolusi. Tingkat keragaman dalam populasi dapat
digambarkan dari frekuensi alel. Frekuensi alel merupakan rasio relatif suatu alel
terhadap keseluruhan alel yang ditemukan dalam satu populasi. Informasi
keragaman genetik suatu populasi menggunakan beberapa lokus, dapat
METODE
Waktu dan Tempat
Penelitian ini dilakukan selama enam bulan dari bulan Juli 2009 sampai
dengan Desember 2009, Laboratorium Genetika Molekuler Ternak, dan
Laboratorium Ruminansia Besar, Departemen Ilmu Produksi dan Teknologi
Peternakan, Fakultas Peternakan Institut Pertanian Bogor.
Materi
Sampel OtotLongissimus dorsi et lumbarum
Sampel otot yang digunakan untuk pengujian kualitas daging merupakan
otot longissimus dorsi pada bagian rusuk ke 12-13. Sampel otot sebanyak 93
sampel, didapatkan dari rumah potong hewan di Kecamatan Labuan,
Pandeglang-Banten. Kerbau yang dipotong merupakan kerbau yang dipelihara secara semi
intensif, yaitu digembalakan pada siang hari, dan dikandangkan pada malam hari.
Pemotongan dilakukan secara tradisional. Jumlah kerbau yang dipotong sekitar 2
ekor/hari. Pembekuan sampel otot dilakukan 4-5 jam setelah pemotongan sampai
dilakukan pengujian kualitas daging dan ektraksi DNA.
Sampel DNA
Sampel DNA yang digunakan dalam penelitian ini berasal dari darah dan
daging kerbau. Sampel darah yang digunakan sebagai sumber DNA sebanyak 320
sampel yang berasal dari lima daerah berbeda, yaitu 65 sampel dari
Siborong-Borong-Medan, 29 sampel dari Lebak-Banten, 48 sampel dari
Pandeglang-Banten, 75 sampel dari Semarang-Jawa Tengah, dan 103 sampel dari
Mataram-Nusa Tenggara Barat. Sampel daging yang digunakan sebagai sumber DNA
sebanyak 132 sampel yang berasal dari Pandeglang-Banten.
Primer
Primer untuk mengamplifikasi ruas gen GH mengikuti Balogh et al. (2009), dengan runutan primerforward5’-CGGACCGTGTCTATGAGAAGCTG AAG-3’, dan primer reverse 5’-GTTCTTGAGCAGCGCGTCGTCA-3’. Panjang
15
gen GHR didesain menggunakansoftware primer designing tool(http://www.ncbi .nlm.nih.gov/tools/primer-blast/index.cgi), dengan opsi default untuk panjang
primer 20-24 nukleotida, dan panjang produk PCR 200-500 bp. Runutan primer
forward 5’-CGCTTACTTCTGCGAGGTAGACGC-3’ dan primer reverse 5’-GTCTGTGCTCACATAGCCAC-3’. Panjang produk hasil amplifikasi sepanjang
298 bp.
Prosedur
Penilaian Kualitas Karkas dan Daging Kerbau
Penilaian kualitas karkas meliputi bobot potong, bobot karkas, persentase
bobot karkas, tebal lemak punggung dan luas urat daging mata rusuk. Penilaian
kualitas daging meliputi nilai pH, daya putus Warner Bratzler, persentase susut
masak dan persentase air bebas. Prosedur untuk pengukuran parameter tersebut
diatas diuraikan sebagai berikut:
Bobot Potong. Bobot potong merupakan bobot kerbau yang dihitung saat kerbau
akan dipotong. Bobot kerbau dalam penelitian ini diestimasi dari lingkar dada
menggunakan pita ukur (RONDO®, Hauptner-Instrumente GmbH).
Bobot Karkas. Bobot karkas merupakan bobot kerbau yang telah dipotong, tanpa
darah, kulit, organ dalam, kepala, ekor danshank.
Persentase Bobot Karkas. Persentase bobot karkas merupakan rasio dari bobot
karkas terhadap bobot potong.
Tebal Lemak Punggung. Pengukuran tebal lemak dilakukan pada posisi 3/4
panjang irisan penampang melintang urat daging mata rusuk ke 13.
Luas Urat Daging Mata Rusuk. Pengukuran luas urat daging mata rusuk
dilakukan pada irisan rusuk ke-13. Patron permukaan irisan luas urat daging mata
rusuk dicetak pada plastik dan digambar dengan spidol. Gambar bidang
permukaan penampang melintang tersebut kemudian diukur dengan planimeter.
Nilai pH Daging. Nilai pH daging diukur menggunakan pH meter. Bagian plat
dari alat tersebut ditancapkan pada sampel daging. Nilai stabil pada layar
merupakan nilai pH daging.
Daya Putus Warner Bratzler. Daya putus Warner Bratzler digunakan untuk
16
besarnya kekuatan yang diperlukan untuk membelah sampel daging yang telah
direbus mencapai suhu internal 81oC.
Persentase Susut Masak. Persentase susut masak merupakan rasio dari selisih
bobot sebelum dan setelah direbus mencapai suhu internal 81oC terhadap bobot
sebelum dimasak.
Persentase Air Bebas. Persentase air bebas merupakan rasio air yang keluar (mg
H2O) terhadap bobot sampel daging. Pengukuran air yang keluar dilakukan
dengan cara membebani 0,3 g sampel daging yang dilapisi kertas saring pada
kedua sisi dengan beban seberat 35 kg selama 5 menit. Air yang keluar dan
persentase air bebas dihitung dengan persamaan:
Mg H2O= luas area basah(cm
Ektraksi DNA dilakukan dari darah dan daging kerbau. Prosedur ektraksi
mengikuti metodephenol-chloroform(Sambrooket al. 1989):
Preparasi Sampel.Sampel yang berasal dari daging dalam alkohol sebanyak 70
mg dan dari darah dalam alkohol sebanyak 200 µl dimasukan ke dalam tabung 1,5
ml. Alkohol dihilangkan dari sampel dengan menambahkan air destilasi sampai
1000 µl, dan dibiarkan selama 20 menit. Sampel kemudian diendapkan dengan
sentrifugasi pada kecepatan 8000 rpm selama 5 menit.
Degradasi Protein. Sampel yang telah bersih dari alkohol ditambahkan 1x STE
(sodium tris EDTA) sampai volume 340 µl, 40 µl sodium dosesil sulfat 10% dan 20 µl proteinase K 5 mg/ml. Campuran diinkubasi pada suhu 50ºC selama
semalam sambil digoyang pelan.
Degradasi Bahan Organik. Sampel yang telah diinkubasi ditambahkan 400 µl
larutan phenol, 400 µl choloform:isoamyl alcohol (24:1) dan 40 µl NaCl 5M. Campuran digoyang pada suhu ruang selama satu jam.
Presipitasi DNA. Sampel selanjutnya disentrifugasi pada kecepatan 5000 rpm
17
dalam tabung baru dengan volume terukur. Molekul DNA diendapkan dengan
cara menambahkan 2x volume alkohol absolut dan 0,1x volume NaCl 5M.
Campuran kemudian diinkubasi pada suhu -20ºC selama semalam. Pengendapan
DNA selanjutnya dilakukan dengan sentrifugasi pada kecepatan 12000 rpm
selama 10 menit. Endapan DNA yang diperoleh dicuci dengan alkohol 70%,
kemudian diendapkan lagi. Endapan DNA yang telah bersih dari alkohol
dipulihkan dengan menambahkan 100 µl TE (Tris EDTA). Sampel DNA
disimpan pada suhu -20ºC dan siap untuk digunakan.
Amplifikasi Ruas Gen GH dan GHR
Amplifikasi ruas gen GH dan GHR dilakukan dengan metode PCR
(polymerase chain reaction). Pereaksi yang digunakan untuk amplifikasi kedua ruas gen target adalah 2 µl sampel DNA, masing-masing primer 25 pmol,
campuran dNTP 200 µM, MgCl21 mM, dantaq polymerase 0,5 unit dan bufernya dalam larutan total 25 µl. Amplifikasi in vitro dengan mesin thermal cycler
dilakukan dengan kondisi denaturasi awal pada suhu 94ºC selama 5 menit, 35
siklus yang terdiri dari denaturasi pada suhu 94ºC selama 45 detik, penempelan
primer pada suhu 62ºC selama 45 detik dan pemanjangan DNA baru pada suhu
72ºC selama 1 menit, dan pemanjangan akhir pada suhu 72ºC selama 5 menit.
Penentuan Genotipe dengan Pendekatan PCR-RFLP
Penentuan genotipe masing-masing individu dilakukan dengan pendekatan
restriction fragment length polymorphism(RFLP) yang divisualisasikan pada gel agarosa 2% dengan bufer 0,5x TBE (tris borat EDTA) yang difungsikan pada
tegangan 100 V selama 40 menit yang diwarnai dengan etidium bromida diatas
UV trans iluminator. Enzim pemotong yang digunakan untuk kedua ruas gen
target adalahAluI.
Pendeteksian Keragaman dengan Pendekatan PCR-SSCP dan DNA
Sekuensing
Pendeteksian keragaman dengan pendekatan PCR-SSCP dilakukan
sebagai alternatif dalam identifikasi keragaman gen GH dan GHR yang
18
perlakuan PCR-SSCP dibedakan menjadi empat kelompok, yaitu 1) kelompok
jantan, daging empuk; 2) kelompok jantan, daging alot; 3) kelompok betina,
daging empuk; dan 4) kelompok betina, daging alot.
Analisis PCR-SSCP dilakukan dengan memisah-misahkan utas tunggal
DNA pada PAGE (polyacrilamide gel electrophoresis) 8%. Proses elektroforesis
dilakukan pada tegangan 100 v selama 16 jam. Pewarnaan pita utas tunggal DNA
dilakukan dengan pewarnaan sensitif perak. Selain PCR-SSCP, pada keempat
kelompok sampel dilakukan perunutan DNA ruas gen GH dan GHR. Hal tersebut
dilakukan untuk mengetahui perbedaan runutan DNA ruas gen GH dan GHR yang
diamati dengan GenBank.
Analisis Data
Pengaruh Umur terhadap Kualitas Karkas dan Daging
Hubungan antara umur dengan kualitas karkas dan daging kerbau
dianalisis menggunakan pendekatan general linier model. Umur dikelompokkan menjadi I (<2 tahun), II (2–4 tahun), dan III (>4 tahun). Pengujian dilakukan
berdasarkan jenis kelamin yang sama. Jika respon yang diperoleh menunjukkan
hasil yang berbeda (α=0,05), dilakukan pengujian menggunakan metode uji beda
nyata jujur. Model matematis dirumuskan sebagai berikut (Mattjik dan
Sumertajaya 2002):
Yij= µ +αi+€ij
Keterangan :
Yij = nilai pengamatan
µ = nilai rataan umum
αi = pengaruh aditif dari umur ke-i €ij = pengaruh galat yang menyebar normal
Koefisien Korelasi
Koefisien korelasi merupakan nilai yang menggambarkan keeratan
hubungan linier antara dua peubah. Korelasi digunakan saat menemukan
hubungan antara dua peubah, namun sulit untuk menentukan peubah bebas atau
peubah tidak bebasnya. Nilai koefisien korelasi berkisar antara -1 sampai dengan
19
ρ= σxy
σx2σy2 Keterangan :
ρ = nilai koefisien korelasi σxy = nilai peragam peubah x dan y σx2 = nilai ragam peubah x
σy2 = nilai ragam peubah y
Frekuensi Genotipe dan Alel
Frekuensi genotipe merupakan merupakan rasio dari jumlah suatu
genotipe terhadap jumlah populasi. Frekuensi alel merupakan rasio suatu alel
terhadap keseluruhan alel pada suatu lokus dalam populasi. Model matematika
frekuensi genotipe dan alel (Nei dan Kumar 2000) dilambangkan sebagai berikut:
χii=nii
N x 100%
χi= 2 nii+ ∑i ≠jnij 2 N Keterangan :
χii = frekuensi genotipe ke ii nii = jumlah sampel bergenotipe ii nij = jumlah sampel bergenotipe ij N = jumlah populasi sampel
HASIL DAN PEMBAHASAN
Kualitas Karkas
Hasil analisis menunjukkan bahwa bobot potong dan bobot karkas
dipengaruhi oleh umur (P<0,01) pada kedua jenis kelamin kerbau. Pengaruh umur
terhadap tebal lemak punggung ditemukan pada kelompok kerbau betina
(P<0,01). Peubah persentase bobot karkas dan luas urat daging mata rusuk tidak
dipengaruhi oleh umur pada kedua jenis kelamin kerbau. Nilai rataan penialaian
kualitas karkas kerbau jantan disajikan pada Tabel 2, sedangkan untuk kerbau
betina pada Tabel 3.
Tabel 2. Rataan penilaian kualitas karkas kerbau jantan.
Parameter Kelompok Umur (n)
Superskrip yang berbeda menunjukkan nilai yang berbeda pada P<0,05 n : jumlah sampel ternak
BP : Bobot Potong LUDMT : Luas urat daging mata rusuk
BK : Bobot Karkas I : Kerbau umur < 2 tahun
% BK : Persentase Bobot Karkas II : Kerbau umur 2–4 tahun
TLP : Tebal Lemak Punggung III : Kerbau umur >4 tahun
Tabel 3. Rataan penilaian kualitas karkas kerbau betina.
Parameter Kelompok Umur (n)
Superskrip yang berbeda menunjukkan nilai yang berbeda pada P<0,05 n : jumlah sampel ternak
BP : Bobot Potong LUDMT : Luas urat daging mata rusuk
BK : Bobot Karkas I : Kerbau umur < 2 tahun
% BK : Persentase Bobot Karkas II : Kerbau umur 2–4 tahun
21
Bobot potong dan bobot karkas pada kelompok kerbau jantan
menunjukkan peningkatan seiring dengan terjadinya penambahan umur.
Kelompok kerbau dengan umur 2–4 tahun memiliki bobot potong dan bobot
karkas yang lebih tinggi dari kelompok umur dibawah 2 tahun. Bobot potong dan
bobot karkas kerbau betina kelompok umur 2–4 tahun tidak berbeda dengan
kelompok umur diatas 4 tahun, namun lebih besar dari kelompok umur dibawah 2
tahun. Hal tersebut disebabkan oleh berhentinya pertumbuhan linier pada tubuh
ternak setelah mencapai dewasa (Lawrence dan Fowler 2002).
Beberapa laporan menunjukkan adanya pengaruh yang nyata dari umur
saat pemotongan terhadap bobot potong (Du Plessis dan Hoffman 2007), bobot
karkas (Mojto et al. 2009), dan tebal lemak punggung (Du Plessis dan Hoffman
2007). Bobot potong kerbau umur 2 tahun dalam penelitian ini lebih rendah dari
bobot kerbau pada umur yang sama dengan sistem pemeliharaan pastura (Irurueta
et al. 2008). Persentase bobot karkas berkisar 31–37 %, sedangkan Siregar dan Diwyanto (1996) melaporkan bahwa persentase bobot karkas kerbau dapat
mencapai 44%. Tebal lemak punggung kerbau yang diamati berkisar 2,4 – 9,1 mm
dengan luas urat daging mata rusuk seluas 31–41 cm2. Penelitian yang dilakukan
Irurueta et al. (2008) melaporkan bahwa tebal lemak punggung dan luas urat daging mata rusuk kerbau umur 2 tahun secara berturut-turut 13,6 mm dan 50,92
cm2.
Analisis korelasi pada peubah kualitas karkas menunjukkan bahwa bobot
potong berkorelasi positif dengan bobot karkas (0,89) dan tebal lemak punggung
(0,47). Bobot karkas berkorelasi positif dengan tebal lemak punggung ( 0,65) dan
luas urat daging mata rusuk (0,22). Korelasi positif juga ditemukan antara tebal
lemak punggung dengan luas urat daging mata rusuk (0,27). Beberapa penelitian
melaporkan bahwa bobot potong yang berbeda menghasilkan perbedaan
persentase karkas, persentase lemak, otot dan tulang (Sanudo et al. 2004; Du Plesis dan Hoffman 2007). Korelasi positif mengindikasikan bahwa kenaikan
pada salah satu peubah, akan menyebabkan nilai peubah lain yang berkorelasi
meningkat (Kaps dan Lamberson 2004). Koefisien korelasi antar peubah kualitas
22
Tabel 4. Koefisien korelasi antar peubah kualitas karkas kerbau.
Parameter BP BK TLP
BK 0,89** -
-TLP 0,47** 0,65**
-LUDMT 0,09 0,22* 0,27**
Keterangan:
Superskrip*menunjukkan nilai yang berbeda nyata pada P<0,05 Superskrip**menunjukkan nilai yang berbeda sangat nyata pada P<0,01
BP : Bobot Potong
BK : Bobot Karkas
TLP : Tebal Lemak Punggung
LUDMT : Luas urat daging mata rusuk
Kualitas Daging
Hasil analisis menunjukkan bahwa nilai pH, daya putus Warner Bratzler,
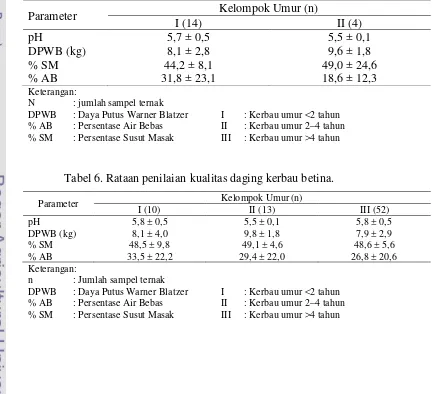
persentase susut masak, dan persentase air bebas daging pada kedua jenis kelamin
kerbau tidak dipengaruhi oleh umur. Nilai rataan penialaian kualitas daging
kerbau jantan atau betina masing-masing disajikan pada Tabel 5, dan Tabel 6.
Tabel 5. Rataan penilaian kualitas daging kerbau jantan.
Parameter Kelompok Umur (n)
N : jumlah sampel ternak
DPWB : Daya Putus Warner Blatzer I : Kerbau umur <2 tahun
% AB : Persentase Air Bebas II : Kerbau umur 2–4 tahun
% SM : Persentase Susut Masak III : Kerbau umur >4 tahun
Tabel 6. Rataan penilaian kualitas daging kerbau betina.
Parameter Kelompok Umur (n)
n : Jumlah sampel ternak
DPWB : Daya Putus Warner Blatzer I : Kerbau umur <2 tahun
% AB : Persentase Air Bebas II : Kerbau umur 2–4 tahun
23
Nilai pH daging dalam penelitian ini berkisar antara 5,5–5,8, daya putus
Warner Bratzler sebesar 7,9–9,6 kg/cm2, persentase susut masak antara 44–49 %,
dan persentase air bebas antara 18–33%. Beberapa laporan menunjukkan bahwa
pH, daya putus Warner Bratzler, dan persentase air bebas dipengaruhi (P<0,01)
oleh umur pemotongan dan lama pelayuan (Irurueta et al. 2008; Rao et al. 2009).
Proses pelayuan yang lebih lama dapat menurunkan nilai pH dan daya putus
Warner Bratzler, tapi meningkatkan nilai daya ikat air (Iruruetaet al. 2008). Analisis korelasi pada peubah kualitas daging menunjukkan bahwa nilai
pH berkorelasi negatif dengan nilai daya putus Warner Bratzler (-0,69) dan
persentase susut masak (-0,31). Korelasi nilai daya putus Warner Bratzler dengan
persentase susut masak bernilai positif (0,34). Okeudo dan Moss (2005)
melaporkan adanya korelasi yang sama dengan penelitian yang dilakukan pada
ternak domba. Aberle et al. (2001) menyatakan bahwa stres pada saat sebelum
pemotongan menyebabkan penurunan pH akibat dari penumpukkan asam laktat.
Proses tersebut dapat menyebabkan daging yang dihasilkan memiliki nilai daya
putus Warner Bratzler yang tinggi. Percepatan penurunan pH daging dapat
menyebabkan susut masak daging meningkat (Lonergan dan Lonergan 2005).
Koefisien korelasi antar peubah kualitas daging kerbau disajikan pada Tabel 7.
Tabel 7. Koefisien korelasi antar penilaian kualitas daging kerbau.
Parameter pH DPWB % SM
DPWB -0,69** -
-% SM -0,31** 0,34**
-% AB -0,08 0,10 -0,02
Keterangan:
Superskrip**menunjukkan nilai yang berbeda nyata pada P<0,01
pH : Nilai pH
DPWB : Daya Putus Warner Bratzler % SM : Persentase Susut Masak % AB : Persentase Air Bebas
Potensi Kerbau sebagai Ternak Potong
Ternak kerbau yang ada di Indonesia saat ini masih digunakan sebagai
tenaga kerja dalam mengolah lahan pertanian, walaupun ada sebagian yang
memanfaatkannnya sebagai ternak penghasil susu, sebagai penciri status sosial,
24
merupakan usaha sampingan. Hal tersebut didasarkan pada ditemukannya
banyaknya sampel kerbau betina yang dipotong pada kelompok umur diatas 4
tahun (70% dari total sampel betina). Pemotongan kerbau betina dilakukan pada
ternak kerbau yang sebelumnya digunakan sebagai bibit dan tenaga kerja, namun
sudah tidak produktif lagi.
Berdasarkan pengamatan pada kualitas karkas, umur kerbau yang paling
baik untuk dipotong adalah umur 2-4 tahun. Kerbau yang dipotong pada umur 2-4
tahun memiliki bobot badan yang stabil, karena tubuhnya tidak mengalami
pertumbuhan linier. Selain itu, kerbau dengan umur 2-4 memiliki bobot karkas
yang lebih tinggi dari kelompok umur yang lainnya. Hal tersebut dapat
disebabkan belum terbentuknya deposit lemak dalam tubuh dengan jumlah yang
besar, jika dibandingkan dengan kelompok umur diatas 4 tahun pada bobot potong
yang sama. Kualitas daging kerbau yang dipotong pada umur yang berbeda tidak
menunjukkan adanya perbedaan yang nyata.
Proses seleksi pada ternak kerbau dapat dilakukan berdasarkan parameter
bobot badan, karena didapatkan adanya korelasi yang bernilai positif antara
beberapa peubah parameter kualitas karkas. Seleksi untuk mendapatkan bobot
badan lebih tinggi pada umur yang sama akan meningkatkan bobot karkas, tebal
lemak punggung dan luas urat daging mata rusuk. Bobot badan yang lebih tinggi
juga akan menghasilkan daging yang lebih empuk (Sanudoet al. 2004).
Amplifikasi Ruas Gen GH dan GHR Kerbau
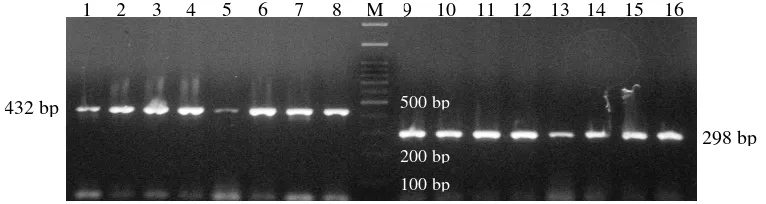
Amplifikasi ruas gen GH dan GHR dilakukan pada mesin thermal cycler
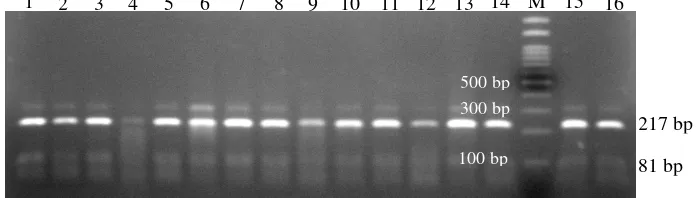
(Ependorf 5332) dengan suhuannealing yang sama, yaitu 62oC. Hasil amplifikasi ruas gen yang divisualisasikan pada gel agarosa 1,5% disajikan pada Gambar 5.
Panjang produk hasil amplifikasi ruas gen GH adalah 432 bp, meliputi 55 bp dari
ekson 4, intron 4, dan 99 bp dari ekson 3 (Genbank Nomor Akses J00008)
(Baloghet al. 2009). Panjang produk hasil amplifikasi ruas gen GHR adalah 298
25
Gambar 3. Visualisasi hasil amplifikasi ruas gen GH dan GHR pada gel agarosa 1,5%. 1-8: ruas gen GH, M: marker 100 bp, dan 9-16: ruas gen GHR.
Identifikasi Varian Gen GH Kerbau dengan Pendekatan PCR-RFLP
Penentuan genotipe gen GH dalam penelitian ini dilakukan dengan
pendekatan PCR-RFLP dengan AluI sebagai enzim pemotong. Enzim AluI mengenali situs pemotongan AG|CT. Berdasarkan sekuen DNA ruas gen GH yang
diamplifikasi terdapat tiga situs pemotongan AluI, yang menghasilkan fragmen dengan panjang 20, 51, 96, dan 265 bp, yang dikenal dengan alel leucine (L) (Gambar 4). Beberapa penelitian menunjukkan adanya perubahan basa pada posisi
ke 1758, yaitu dari C menjadi G. Perubahan tersebut menyebabkan perubahan
fragmen hasil potongan AluI menjadi 20, 147, dan 265 bp, yang dikenal dengan alelvaline(V) (Lucyet al. 1993; Baloghet al. 2009).
Gambar 4. Runutan nukleotida ruas gen GH (Genbank nomor akses J00008). Posisi primer (cetak terbal bergaris bawah), situs pemotongan enzim AluI (cetak tebal), dan titik mutasi (cetak tebal berwarna merah).
Genotipe gen GH pada sampel kerbau didapatkan melalui pengukuran
panjang fragmen ruas gen GH hasil pemotongan dengan enzim AluI. Hasil visualisasi menggunakan agarosa 2%, menunjukkan bahwa panjang fragmen yang
didapatkan adalah 265 dan 96, serta 20 dan 51 bp (tidak tervisualisasikan). Hasil 1381 cctcagcaga gtcttcacca acagcttggt gtttggcacc tcggaccgtg tctatgagaa
1441 g|ctgaaggac ctggaggaag gcatcctggc cctgatgcgg gtggggatgg cgttgtgggt 1501 cccttccatg ctgggggcca tgcccgccct ctcctggctt agccaggaga atgcacgtgg 1561 gcttggggag acagatccct gctctctccc tctttctagc agtccagcct tgacccaggg 1621 gaaacctttt ccccttttga aacctccttc ctcgcccttc tccaagcctg taggggaggg 1681 tggaaaatgg agcgggcagg agggag|ctgc tcctgagggc ccttcggcct ctctgtctct 1741 ccctcccttg gcaggag|ctg gaagatggca ccccccgggc tgggcagatc ctcaagcaga 1801 cctatgacaa atttgacaca aacatgcgca gtgacgacgc gctgctcaag aactacggtc
26
tersebut menunjukkan bahwa lokus GH|AluI pada kelima populasi kerbau yang diamati adalah seragam. Genotipe yang ditemukan pada kerbau dari kelima
populasi kerbau dalam penelitian ini adalah genotipe LL (Gambar 5).
Gambar 5. Visualisai PCR-RFLP ruas gen GH|AluI pada gel agarosa 2%. M: Marker 100 bp, 1-16: Sampel kerbau penelitian.
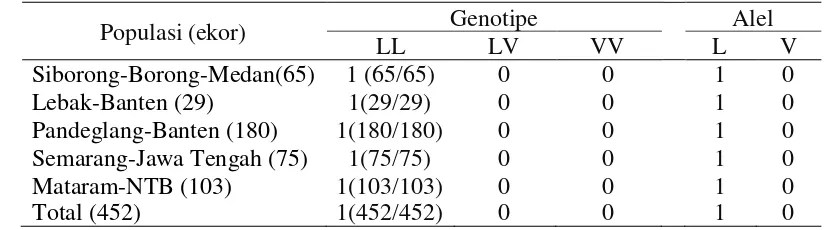
Frekuensi genotipe dan alel ruas gen GH lokusAluI disajikan pada Tabel 8. Berdasarkan analisis, didapatkan bahwa frekuensi genotipe LL pada
masing-masing populasi kerbau yang diamati adalah satu (1). Hal tersebut menyebabkan
frekuensi genotipe LV dan VV menjadi nol (0). Frekuensi alel untuk alel L yang
dihitung dengan persamaan Nei dan Kumar (2000) adalah 1, dan sebaliknya,
frekuensi alel V adalah 0. Hal tersebut diatas mengindikasikan bahwa telah terjadi
proses fiksasi yang ditandai dengan adanya frekuensi salah satu genotipe dan alel
yang memiliki nilai 1. Proses fiksasi tersebut bisa disebabkan oleh adanya
inbreedingdalam kelima populasi kerbau yang diamati (Nei dan Kumar 2000).
Tabel 8. Frekuensi genotipe dan alel GH|AluI.
Populasi (ekor) Genotipe Alel
LL LV VV L V
Siborong-Borong-Medan(65) 1 (65/65) 0 0 1 0
Lebak-Banten (29) 1(29/29) 0 0 1 0
Pandeglang-Banten (180) 1(180/180) 0 0 1 0
Semarang-Jawa Tengah (75) 1(75/75) 0 0 1 0
Mataram-NTB (103) 1(103/103) 0 0 1 0
Total (452) 1(452/452) 0 0 1 0
Identifikasi Varian Gen GHR dengan Pendekatan PCR-RFLP
Penentuan genotipe gen GHR dalam penelitian ini dilakukan dengan
pendekatan PCR-RFLP menggunakan AluI sebagai enzim pemotong. Enzim AluI
27
mengenali situs pemotongan AG|CT. Berdasarkan sekuen DNA ruas gen GHR
yang diamplifikasi terdapat satu situs pemotongan AluI, yang menghasilkan
fragmen dengan panjang 81 dan 217 bp, yang dikenal dengan alel A (Gambar 6).
Beberapa penelitian menunjukkan adanya perubahan basa pada posisi ke 256,
yaitu dari A menjadi G. Perubahan tersebut menyebabkan situs pemotong tidak
dikenali oleh enzimAluI, sehingga menghasilkan fragmen sepanjang 298 bp, yang dikenal dengan alel G (Geet al.2000; Di Stasioet al. 2005).
Gambar 6. Runutan nukleotida ruas gen GHR (Genbank nomor akses AY053546). Posisi primer (cetak tebal bergaris bawah), situs pemotongan enzim AluI (cetak tebal), dan titik mutasi (cetak tebal berwarna merah).
Genotipe gen GHR pada sampel kerbau didapatkan melalui pengukuran
panjang fragmen ruas gen GHR hasil pemotongan dengan enzim AluI. Hasil visualisasi menggunakan agarosa 2%, menunjukkan bahwa panjang fragmen yang
didapatkan adalah 217 dan 81 bp. Hasil tersebut menunjukkan bahwa lokus
GHR|AluI pada kelima populasi kerbau yang diamati adalah seragam. Genotipe yang ditemukan pada kerbau dari kelima populasi kerbau dalam penelitian ini
adalah genotipe AA (Gambar 7).
Gambar 7. Visualisai PCR-RFLP ruas gen GHR|AluI pada gel agarosa 2%. M: Marker 100 bp, 1-16: Sampel kerbau penelitian.
81 bp
121 tgtgacacgc acccagaagt ggtcacaccc tgccaagcta acttcatcgt ggacaacgct
28
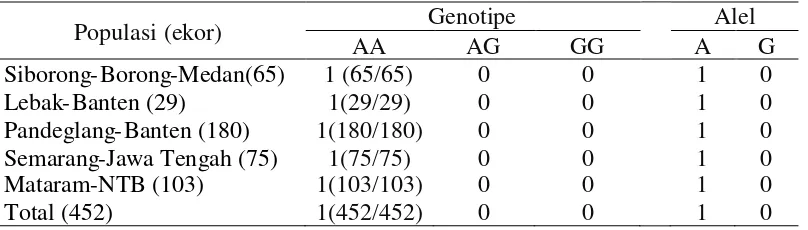
Frekuensi genotipe dan alel ruas gen GHR lokusAluI disajikan pada Tabel 9. Berdasarkan analisis, didapatkan bahwa frekuensi genotipe AA pada
masing-masing populasi kerbau yang diamati adalah satu (1). Hal tersebut menyebabkan
frekuensi genotipe AG dan GG menjadi nol (0). Frekuensi alel untuk alel A yang
dihitung dengan persamaan Nei dan Kumar (2000) adalah 1, sebaliknya, frekuensi
alel G adalah 0. Hal tersebut diatas mengindikasikan bahwa telah terjadi proses
fiksasi yang ditandai dengan adanya frekuensi salah satu genotipe dan alel yang
memiliki nilai 1. Proses fiksasi tersebut bisa disebabkan oleh adanya inbreeding
dalam kelima populasi kerbau yang diamati (Nei dan Kumar 2000).
Tabel 9. Frekuensi genotipe dan alel GHR|AluI.
Populasi (ekor) Genotipe Alel
AA AG GG A G
Siborong-Borong-Medan(65) 1 (65/65) 0 0 1 0
Lebak-Banten (29) 1(29/29) 0 0 1 0
Pandeglang-Banten (180) 1(180/180) 0 0 1 0
Semarang-Jawa Tengah (75) 1(75/75) 0 0 1 0
Mataram-NTB (103) 1(103/103) 0 0 1 0
Total (452) 1(452/452) 0 0 1 0
Identifikasi Varian Gen GH dan GHR dengan Pendekatan PCR-SSCP
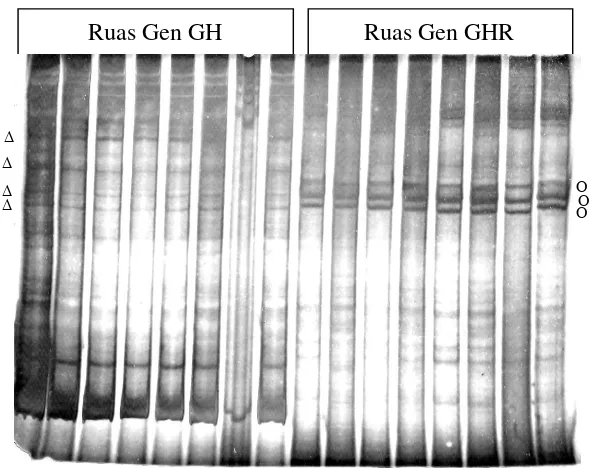
Pendeteksian keragaman ruas gen GH dan GHR selanjutnya dilakukan
dengan pendekatan PCR-SSCP. Pendekatan PCR-SSCP dilakukan pada kelompok
sampel kerbau dengan nilai keempukan daging yang paling tinggi dan paling
rendah pada kelompok umur yang sama dan jenis kelamin yang berbeda. Pada
analisis PCR-SSCP, pendeteksian keragaman diketahui dari perbedaan pola
migrasi bentuk utas tunggal DNA pada gel poliakrilamida (Hayashi 1991). Pola
migrasi utas tunggal ruas gen GH dan GHR pada gel poliakrilamida dalam
penelitian ini bersifat seragam. Hasil visualisasi utas tunggal DNA disajikan pada
29
Gambar 8. Visualisasi PCR-SSCP pada PAGE 8%. Δ: Pita utas tunggal
ruas gen GH, Ο: pita utas tunggal ruas gen GHR.
Runutan DNA Ruas Gen GH dan GHR
Perunutan nukleotida dilakukan pada ruas gen GH dan GHR yang telah
dikelompokkan berdasarkan keempukan dagingnya (terdapat 2 kelompok yaitu
kerbau dengan daging alot dan daging empuk). Pengelompokkan juga dilakukan
berdasarkan jenis kelamin (terdapat 2 kelompok yaitu kerbau jantan dan betina),
sehingga didapatkan 4 kelompok, yaitu (1) kerbau jantan dengan daging alot dan
(2) kerbau jantan dengan daging empuk, serta (3) kerbau betina dengan daging
alot dan (4) kerbau betina dengan daging empuk. Analisis kesamaan runutan DNA
hasil sekuensing dengan runutan nukleotida gen GH dan GHR pada sapi dan
kerbau yang ada di Genbank dilakukan dengan pendekatan BLAST (basic local
alignment search tool) (http://blast.ncbi.nlm.nih.g ov/Blast.cgi), dan disajikan pada.
Runutan nukleotida gen GH dalam penelitian ini memiliki tingkat
kesamaan yang tinggi dengan sapi (J00008) dan kerbau (AJ011533) yang ada di
GenBank, yaitu mencapai 96–98 %. Pada runutan nukleotida gen GH kerbau
(Gambar 9) tidak ditemukan adanya perubahan basa dari C menjadi G pada posisi
ke 1758 (Lucyet al. 1993; Balogh et al. 2009). Runutan nukleotida pada ruas gen tersebut adalah sama, baik pada kerbau dengan daging yang empuk maupun pada
Ruas Gen GHR Ruas Gen GH
Ο Ο Ο Δ