Disusun Oleh : EKA RAKHMAWATI
M 0302001
SKRIPSI
Ditulis dan diajukan untuk memenuhi sebagian persyaratan mendapatkan gelar Sarjana Sains Kimia
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SEBELAS MARET
ii Pembimbing I
Triana Kusumaningsih, M.Si NIP 132 240 166
Pembimbing II
Abu Masykur, M.Si NIP 132 162 020
Dipertahankan didepan TIM Penguji Skripsi pada : Hari : Rabu
Tanggal : 7 maret 2007
Anggota TIM Penguji :
1. Dr. rer nat Fajar Rakhman Wibowo, MSi. NIP. 132 258 067
2. Soerya Dewi Marliyana, MSi. NIP. 132 162 561
1. ………
2. ………
Disahkan oleh
Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sebelas Maret Surakarta
Dekan,
Drs. Marsusi, MS NIP. 130 906 776
Ketua Jurusan Kimia,
PEMANFAATAN KITOSAN HASIL DEASETILASI KITIN CANGKANG BEKICOT SEBAGAI ADSORBEN ZAT WARNA REMAZOL YELLOW adalah benar-benar hasil penelitian sendiri dan tidak terdapat karya yang pernah diajukan untuk memperoleh gelar kesarjanaan di suatu perguruan tinggi, dan sepanjang pengetahuan saya juga tidak terdapat kerja atau pendapat yang pernah ditulis atau diterbitkan oleh orang lain, kecuali yang secara tertulis diacu dalam naskah ini dan disebutkan dalam daftar pustaka.
Surakarta, 7 Maret 2007
iv
REMAZOL YELLOW. Skripsi. Jurusan Kimia. Fakultas MIPA. Universitas Sebelas Maret.
Kitosan telah dibuat dari kitin cangkang bekicot melalui proses deasetilasi. Isolasi kitin dari cangkang bekicot dilakukan melalui proses deproteinasi dan demineralisasi. Kitosan dipelajari kemampuannya dalam mengadsorpsi zat warna
Remazol Yelow. Karakterisasi kitosan meliputi penentuan kadar air dan kadar abu, berat molekul, derajat polimerisasi serta derajat deasetilasi yang dihitung dengan metode spektroskopi infra merah. Adsorpsi zat warna Remazol Yellow oleh kitosan dilakukan dengan variasi pH dan variasi waktu kontak untuk mencari kondisi adsorpsi optimum. Variasi konsentrasi dilakukan untuk menentukan jenis adsorpsi yang terjadi selama proses penyerapan. Jenis isoterm adsorpsi diuji dengan isoterm adsorpsi Langmuir dan Freundlich. Pengukuran adsorpsi dan desorpsi air limbah zat warna Remazol Yellow dengan kitosan dilakukan pada kondisi optimum.
Hasil deasetilasi kitin cangkang bekicot diperoleh kitosan dengan rendemen 9,59 ± 0,71 %, berwarna putih kecoklatan, tidak berbau dan berbentuk serbuk. Kitosan yang diperoleh mempunyai kadar air 2,06 ± 0,82 %, kadar mineral 26,11 ± 0,45 %, berat molekul rata-rata 2 kilodalton dengan derajat polimerisasi 12 dan derajat deasetilasi 74,95 %. Kondisi optimum adsorpsi zat warna Remazol Yellow
oleh kitosan pada pH 2 dan waktu kontak optimum 24 jam. Isoterm adsorpsi yang dominan untuk adsorpsi kitosan terhadap zat warna Remazol Yellow adalah isoterm Langmuir. Daya serap kitosan terhadap air limbah zat warna Remazol Yellow adalah sebesar 0,40 mg/g dengan persen desorpsi rata-rata sebesar 23,34 %.
Faculty. Sebelas Maret University.
Chitosan has been made from achatina shell chitin by deacetylation process. Isolation of chitin from achatina shell was done by deproteination and demineralization The chitosan was studied for its ability in adsorbing Remazol Yellow dye. Characterizations of the chitosan are involving determination of water and mineral content, molecular weight, polymerization degree, and degree of deacetylation which is measured by Infrared spectroscopic method. Remazol Yellow dye adsorption by chitosan was done by variation of pH and contact time in order to determine optimum condition of adsorption. Variation of concentration was done to determine isotherm adsorption type that occurred during the adsorption process. The types of the adsorption isotherm were analyzed by Langmuir and Freundlich isotherm. Adsorption and desorption of Remazol Yellow
dye in waste water by the chitosan were measured in the optimum condition. The yield of deacetylation process of achatina shell chitin was chitosan with rendement of 9.59 ± 0.71 %. It was odorless, brownish white powder. The chitosan was characterized with 2.06 ± 0.82 % of water content and 26.11 ± 0.45 % of mineral content. The molecular weight average of chitosan was 2 kilodaltons with degree of polimerisation and degree of deacetylation were 12 and 74.95 % respectively. The optimum condition of Remazol Yellow dye adsorption was pH of 2 and contact time of 24 hours. The dominant adsorption isotherm for Remazol Yellow dye adsorption by chitosan was Langmuir isotherm. The chitosan capacity of adsorptionin Remazol Yellow dye waste water was 0.40 mg/g with 23.34 % of average desorption percentage.
vi
Sesungguhnya Dia Maha Mengetahui segala isi hati.
Sesungguhnya sesudah kesulitan ada kemudahan.
Maka apabila engkau telah selesai (dari suatu urusan), maka kerjakanlah (urusan yang lain) dengan sungguh-sungguh
(Q.S. Al-Insyirah : 6-7).
K arya kecilku ini kupersembahkan kepada :
Bapak dan I bu tercinta, at as bimbingan, cinta, kasih
sayang, dan perhatian untuk Ananda yang tak pernah
mengenal lelah.
Semua orang yang selalu menyayangiku dengan tulus.
viii
yang berjudul “Pemanfaatan Kitosan Hasil Deasetilasi Kitin Cangkang Bekicot Sebagai Adsorben Zat Warna Remazol Yellow” hingga selesai dengan baik.
Skripsi ini disusun sebagai hasil penelitian yang telah penulis lakukan untuk memenuhi sebagian syarat guna memperoleh gelar Sarjana Sains pada Jurusan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret Surakarta.
Penulis telah banyak menerima bantuan, dorongan dan pertunjuk serta fasilitas dalam pengerjaan skrispsi ini. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada semua pihak, terutama kepada :
1. Bapak Drs.Marsusi, M.S selaku Dekan FMIPA UNS.
2. Bapak Drs. Sentot Budi Rahardjo, Ph.D selaku Ketua Jurusan Kimia. 3. Ibu Triana Kusumaningsih, M.Si selaku dosen pembimbing I yang telah
berkenan meluangkan waktu dan memberikan bimbingan yang berguna demi terselesaikannya skripsi ini.
4. Bapak Abu Masykur, M.Si selaku dosen pembimbing II yang dengan penuh kesabaran telah membantu dalam penyelesaian skripsi ini.
5. Bapak dan Ibu Dosen di Jurusan Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Sebelas Maret atas semua ilmu yang berguna dalam penyusunan skripsi ini.
6. Bapak Dr. rer. nat. Fajar Rakhman Wibowo, M. Si., selaku Ketua Sub Laboratorium Kimia Laboratorium Pusat FMIPA UNS dan semua staffnya.
7. Ibu Desi Suci Handayani, M. Si., selaku Ketua Laboratorium Kimia Dasar FMIPA UNS beserta staffnya : Mbak Nanik dan Mas Anang.
8. Kepala Laboratorium Kimia Organik UII Yogyakarta beserta teknisi. 9. Semua pihak yang telah membantu penulis dalam menyelesaikan skripsi
Surakarta, 7 Maret 2007
x
HALAMAN PERRSETUJUAN ... ii
HALAMAN PERNYATAAN ... iii
HALAMAN ABSTRAK... iv
HALAMAN ABSTRACT ... v
HALAMAN MOTTO ... vi
HALAMAN PERSEMBAHAN ... vii
KATA PENGANTAR ... viii
DAFTAR ISI... x
DAFTAR TABEL... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN... xv
TABEL LAMPIRAN ... xvii
BAB I. PENDAHULUAN ... 1
A. Latar Belakang ... 1
B. Perumusan Masalah ... 4
1. Identifikasi Masalah ... 4
2. Batasan Masalah... 4
3. Rumusan Masalah ... 5
C. Tujuan Penelitian ... 5
D. Manfaat Penelitian ... 6
BAB II. LANDASAN TEORI ... 7
A. Tinjauan pustaka ... 7
1. Bekicot... 7
2. Kitin... 7
3. Kitosan... 9
4. Zat Warna Remazol Yellow... 12
B. Kerangka Pemikiran... 18
C. Hipotesis... 19
BAB III. METODOLOGI PENELITIAN ... 20
A. Metode Penelitian... 20
B. Tempat dan Waktu Penelitian ... 20
C. Alat dan Bahan yang Digunakan... 21
1. Alat yang Digunakan... 21
2. Bahan yang Digunakan ... 21
D. Prosedur Penelitian... 21
1. Preparasi Kitin dan Kitosan ... 21
a. Persiapan Bahan ... 21
b. Proses Deproteinasi ... 22
c. Proses Demineralisasi ... 22
d. Proses Deasetilasi... 22
2. Karakterisasi Kitosan ... 22
a. Kadar Air... 22
b. Kadar Abu ... 23
c. Berat molekul ... 23
d. Derajat Deasetilasi ... 23
3. Adsorpsi Larutan Remazol Yellow... 24
a. Pembuatan Spektrum Absorpsi Zat Warna ... 24
b. Pembuatan Kurva Standar Untuk Spektroskopi UV-Vis ... 24
c. Orientasi pH Larutan Remazol Yellow... 24
d. Orientasi Waktu Pengadukan... 24
e. Orientasi Konsentrasi Larutan Remazol Yellow... 24
4. Aplikasi Limbah... 25
xii
BAB IV. HASIL PENELITIAN DAN PEMBAHASAN ... 27
A. Preparasi Adsorben ... 27
1. Pemurnian Kitin ... 27
2. Pembentukan Kitosan... 29
3. Karakterisasi Kitosan ... 31
B. Proses Adsorpsi... 33
1. Penentuan Panjang Gelombang Maksimum Zat Warna Remazol Yellow... 33
2. Penentuan pH Optimum... 33
3. Penentuan Waktu Kontak Optimum ... 35
4. Penentuan Isoterm Adsorpsi ... 36
a. Isoterm Langmuir... 36
b. Isoterm Freundlich ... 37
C. Aplikasi Limbah... 38
1. Adsorpsi ... 38
2. Desorpsi ... 39
BAB V. KESIMPULAN DAN SARAN... 40
A. Kesimpulan ... 40
B. Saran... 40
DAFTAR PUSTAKA ... 41
xiv
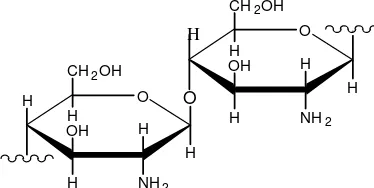
Gambar 2. Struktur Kitosan ... 9
Gambar 3. Pemilihan garis dasar metode base line menggunakan spektra FTIR ... 12
Gambar 4. Struktur Zat Warna Remazol Yellow... 13
Gambar 5. Spektra Infra Merah Kitin ... 28
Gambar 6. Mekanisme Reaksi Deasetilasi... 29
Gambar 7. Spektra Infra Merah Kitosan... 30
Gambar 8. Spektrum Absorbansi Zat Warna Remazol Yellow... 33
Gambar 9. Grafik Hubungan pH vs Konsentrasi Zat Warna Remazol Yellow Terserap... 34
Gambar 10. Grafik Hubungan Waktu Kontak vs Konsentrasi Zat Warna Remazol Yellow Terserap ... 35
Gambar 11. Grafik Isoterm Adsorpsi Langmuir Kitosan ... 37
Lampiran 2. Perhitungan Rendemen dalam Tahap Pembentukan Kitosan .. 46
Lampiran 3. Perhitungan Kadar Air, Kadar Abu dan Berat Molekul Kitosan ... 47
Lampiran 4. Perhitungan Derajat Deasetilasi Kitosan... 49
Lampiran 5. Data absorbansi penentuan panjang gelombang maksimum Remazol Yellow... 50
Lampiran 6. Kurva standar optimasi pH... 51
Lampiran 7. Data pengaruh pH terhadap absorbansi zat warna Remazol Yellow... 52
Lampiran 8. Data pengaruh pH terhadap konsentrasi zat warna Remazol Yellow terserap ... 53
Lampiran 9. Kurva standar optimasi waktu kontak... 54
Lampiran 10. Data pengaruh waktu kontak terhadap absorbansi zat warna Remazol Yellow... 55
Lampiran 11. Data pengaruh waktu kontak terhadap konsentrasi zat warna Remazol Yellow terserap... 56
Lampiran 12. Kurva standar penentuan isoterm adsorpsi ... 57
Lampiran 13. Data isoterm adsorpsi kitosan ... 58
Lampiran 14. Data isoterm adsorpsi langmuir kitosan... 59
Lampiran 15. Data isoterm adsorpsi freundlich kitosan... 60
Lampiran 16. Data hasil adsorpsi kitosan terhadap limbah zat warna Remazol Yellow... 61
Lampiran 17. Data hasil desorpsi kitosan terhadap limbah zat warna Remazol Yellow... 62
xvi
Tabel Lampiran 2. Data rendemen kitosan... 68 Tabel Lampiran 3. Data kadar air dan kadar abu kitosan ... 68 Tabel Lampiran 4. Data waktu alir larutan kitosan pada alat viskometer
Ostwald ... 68 Tabel Lampiran 5. Uji duncan pengaruh pH terhadap konsentrasi
zat warna Remazol Yellow terserap ... 69 Tabel Lampiran 6. Uji duncan pengaruh waktu kontak terhadap
BAB I PENDAHULUAN
A. Latar Belakang Masalah
Surakarta merupakan daerah sentra industri batik, mulai skala industri kecil (rumah tangga) sampai skala besar. Perkembangan industri batik ini mempunyai dampak positif yaitu dapat meningkatkan kesejahteraan masyarakat. Selain berdampak positif, perkembangan industri batik ini juga bisa menimbulkan dampak negatif yaitu pencemaran lingkungan apabila air limbah industri batik yang berasal dari proses pencelupan zat warna dibuang ke sungai atau selokan tanpa diolah terlebih dahulu. Kualitas air sungai menjadi rendah ditandai dengan warna air sungai yang pekat. Limbah cair industri batik bersumber dari proses pencelupan (dyeing), pencucian (washing), pencetakan (printing) dan penyempurnaan (finishing). Limbah hasil pewarnaan pada industri batik mengandung komponen diantaranya sisa zat warna, garam dan bahan-bahan aditif seperti urea, sodium alginate, sodium bicarbonate serta air (sisa pewarnaan dan pencucian) (Atmaji P., Wahyu P., dan Edi P., 1999).
Sisa zat warna merupakan komponen paling dominan pada limbah hasil pewarnaan industri batik. Penggolongan zat warna berdasarkan pada sifat-sifat dan penggunaannya yaitu zat warna asam, basa, direct, mordan, komplek logam, azoat, belerang, bejana, dispersi dan reaktif (Isminingsih, G., L Djufri, dan Rassid, 1982). Zat warna reaktif yang sering digunakan pada industri batik antara lain
Procion, Cibracon, Drimaren, dan Lavafix, yang dapat mengadakan reaksi substitusi dengan serat dan membentuk ikatan ester, dan zat warna Remazol, Remalan, dan Primazin, yang dapat mengadakan reaksi adisi dengan serat dan membentuk ikatan eter.
Limbah hasil pewarnaan industri batik harus diolah terlebih dahulu sebelum dibuang ke lingkungan. Pengolahan air limbah bertujuan untuk menghilangkan atau mengurangi kandungan polutan-polutan yang terlarut maupun terdispersi di dalam air limbah. Salah satu cara yang dapat dilakukan untuk mengolah air limbah yaitu dengan cara adsorpsi. Beberapa penelitian tentang pengolahan
limbah zat warna dengan adsorpsi antara lain Supriyanto (2003) meneliti adsorbsi limbah zat warna tekstil jenis Celedon Red X5B menggunakan tanah alofan teraktivasi NaOH. Aryunani (2003) telah meneliti adsorbsi zat warna tekstil
Remazol Yellow pada limbah batik menggunakan eceng gondok teraktivasi NaOH. Triyanto (2003) telah meneliti pemanfaatan limbah genteng sebagai adsorben dengan aktivator NaOH pada limbah zat warna tekstil jenis Celedon Red X5B. Rochanah (2003) telah meneliti adsorbsi zat warna Procion red MX 8B pada limbah tekstil oleh batang jagung.
Salah satu adsorben yang dapat digunakan untuk menyerap zat warna adalah kitosan. Kitosan bisa diperoleh melalui deasetilasi kitin. Salah satu sumber kitin adalah cangkang bekicot. Bekicot merupakan hewan lunak (mollusca) dari kelas
gastropoda. Bekicot menurut jenisnya dapat dibedakan menjadi empat yaitu
Achatina variegata, Achatina fulica, Helix pomatia dan Helix aspersa sedangkan di Indonesia hanya terdapat jenis Achatina variegata dan Achatina fulica. Bekicot di Indonesia telah dibudidayakan sebagai sumber protein dan menjadi komoditas ekspor. Ekspor bekicot ke Perancis pada tahun 1986 baru mencapai 1.212 ton, sedangkan pada tahun 1990 naik menjadi 11.000 ton (Koswara, 2002). Besarnya pertumbuhan perdagangan ini menyebabkan timbulnya limbah cangkang bekicot dalam jumlah yang cukup besar. Limbah cangkang bekicot banyak ditemukan di kecamatan Papar kabupaten Kediri sebagai daerah sentra ekspor daging bekicot. Selama ini pemanfaatan cangkang bekicot hanya digunakan sebagai campuran makanan ternak. Cangkang bekicot mengandung senyawa kitin. Kitin dalam cangkang berikatan dengan protein, lipid, garam-garam anorganik seperti kalsium karbonat serta pigmen-pigmen. Agar diperoleh produk yang bernilai ekonomis sekaligus dapat mengatasi penumpukan limbah cangkang bekicot maka salah satu caranya dilakukan isolasi kitin yang terdapat pada cangkang bekicot.
arthropoda. Kitin diperoleh dengan melakukan sejumlah proses pemurnian. Proses isolasi kitin terdiri dari dua tahap utama yaitu deproteinasi dan demineralisasi.
Salah satu senyawa turunan dari kitin, yaitu kitosan banyak dimanfaatkan sebagai adsorben karena mempunyai kemampuan yang cukup tinggi dalam mengikat ion logam dan kemungkinan pengambilan kembali yang relatif mudah terhadap ion logam yang terikat pada kitosan dengan menggunakan pelarut tertentu. Keunggulan adsorben kitosan adalah dapat digunakan untuk penanganan limbah secara berulang-ulang (Muzzarelli, 1997 dalam Darjito, 2001). Kitosan adalah kitin yang telah dihilangkan gugus asetilnya melalui proses deasetilasi. Kitosan (2-asetamida-deoksi-β-D-glukosa) memiliki gugus amina bebas yang menjadikan polimer ini bersifat polikationik, sehingga polimer ini potensial untuk diaplikasikan dalam pengolahan limbah dan obat-obatan hingga pengolahan makanan serta dalam bidang bioteknologi (Savant, dan Torres, 2000). Biopolimer alami dan tidak beracun ini sekarang secara luas diproduksi secara komersial dari limbah kulit udang dan kepiting (No. H., Lee, Mayers S.P., 2000).
Beberapa penelitian tentang kitosan antara lain, Salami (1998) telah mempelajari aplikasi kitosan dari bahan kulit udang (phenaus monodon) sebagai bahan koagulasi limbah cair industri tekstil. Majid A., Narsito, dan Nuryono (2001) menggunakan kitosan dari bahan kulit udang (phenaus monodon) sebagai adsorben logam. Kusumaningsih (2004) telah berhasil mengisolasi kitin cangkang bekicot dengan rendemen sebesar 22,04% dan telah melakukan deasetilasi kitin menjadi kitosan. Arief, U (2003) telah meneliti pembuatan kitosan dari kitin cangkang bekicot dan pemanfaatannya sebagai adsorben logam nikel. Kitosan yang dihasilkan harus diteliti lebih lanjut agar menjadi bahan yang bermanfaat, sehingga cangkang bekicot menjadi lebih bernilai ekonomis.
Dari uraian diatas perlu adanya penelitian lebih lanjut untuk memanfaatkan kitosan hasil deasetilasi kitin cangkang bekicot. Pada penelitian ini akan diteliti pemanfaatan kitosan untuk adsorben limbah zat warna industri batik jenis
B. Perumusan Masalah 1. Identifikasi Masalah
Kitin adalah biopolimer yang melimpah kedua di alam setelah selulosa. Kitin terdapat pada jamur, cangkang anthropoda, cangkang crustaceae dan cangkang mollusca. Cangkang crustacea yang telah diisolasi kitinnya adalah lobster dan udang, sedangkan cangkang mollusca yang telah diisolasi kitinnya adalah bekicot.
Disamping lobster dan udang, bekicot juga sudah banyak dibudidayakan di Indonesia. Bekicot di Indonesia telah dibudidayakan sebagai sumber protein dan menjadi komoditas ekspor. Besarnya pertumbuhan perdagangan menyebabkan timbulnya limbah cangkang bekicot dalam jumlah yang cukup besar. Limbah cangkang bekicot banyak ditemukan di kecamatan Papar kabupaten Kediri sebagai daerah sentra ekspor daging bekicot.
Kitin dapat diubah menjadi kitosan dengan menghilangkan gugus asetilnya. Kitosan yang dihasilkan dari isolasi kitin diketahui dengan melakukan karakterisasi yang meliputi kadar abu, kadar air, kadar nitrogen, sifat antimikroba, derajat deasetilasi, dan berat molekul. Beberapa metode untuk menentukan derajat deasetilasi diantaranya metode base line dengan spektroskopi inframerah, uji ninhydrin, titrasi potensiometri linear dan spektroskopi NMR.
Kitosan memiliki gugus amina dan hidroksil yang menyebabkan kitosan mempunyai reaktifitas yang tinggi. Dalam suasana asam, gugus amina akan terprotonasi sehingga dapat berikatan dengan gugus sulfonat zat warna Remazol Yellow sedangkan dalam suasana basa gugus hidroksil dapat berikatan dengan gugus vinil sulfon zat warna Remazol Yellow. Kemampuan adsorpsi kitosan terhadap zat warna Remazol Yellow dapat diketahui dengan melakukan variasi pH larutan zat warna. Waktu kesetimbangan adsorpsi kitosan terhadap zat warna
Remazol Yellow dapat diketahui dengan melakukan variasi waktu kontak, sedangkan isoterm adsorpsi yang terjadi dapat diketahui dengan menvariasi konsentrasi zat warna Remazol Yellow.
seberapa besar kemampuan kitosan untuk melepaskan kembali limbah zat warna
Remazol Yellow yang sudah diserap dilakukan proses desorpsi.
2. Batasan Masalah
Berdasarkan identifikasi masalah yang telah disebutkan diatas maka batasan masalah dalam penelitian ini adalah :
1. Karakterisasi kitosan yang dilakukan meliputi pengukuran kadar air, kadar abu, derajat deasetilasi (metode base line oleh Baxter) dan penentuan berat molekul.
2. Variasi pH larutan zat warna meliputi pH 1, 2, 3, 4, 5, 6, 7, 8, 9, 10 dan 11. 3. Variasi waktu kontak meliputi 6, 12, 18, 24, 30, dan 36 jam.
4. Variasi konsentrasi zat warna meliputi 4, 8, 12, 16 dan 20 ppm pada pH optimum dengan waktu kontak optimum.
5. Adsorpsi dan desorpsi kitosan terhadap limbah zat warna Remazol Yellow
dilakukan pada kondisi optimum.
6. Zat warna yang diserap dianalisis dengan menggunakan UV-Vis.
3. Rumusan Masalah
Dari batasan masalah yang telah disebutkan diatas maka rumusan masalah pada penelitian ini adalah :
1. Seberapa besar kemampuan cangkang bekicot sebagai bahan dasar pembuatan kitosan ?
2. Bagaimana sifat fisika dan sifat kimia kitosan yang berasal dari cangkang bekicot ?
3. Berapakah pH dan waktu kontak optimum penyerapan zat warna Remazol Yellow oleh kitosan?
4. Jenis adsorpsi apakah yang terjadi pada adsorpsi kitosan dari cangkang bekicot terhadap zat warna Remazol Yellow?
C. Tujuan Penelitian Tujuan dari penelitian ini adalah :
1. Mengetahui kemampuan cangkang bekicot sebagai bahan dasar pembuatan kitosan.
2. Mengetahui sifat fisika dan sifat kimia kitosan dari bahan dasar cangkang bekicot.
3. Mengetahui pH dan waktu kontak optimum adsorpsi zat warna Remazol Yellow oleh kitosan.
4. Mengetahui jenis adsorpsi yang terjadi pada adsorpsi kitosan terhadap zat warna Remazol Yellow.
5. Mengetahui sifat adsorpsi kitosan terhadap limbah zat warna Remazol Yellow yaitu dapat dilepaskan kembali atau tidak.
D. Manfaat Penelitian Manfaat dari penelitian ini adalah :
1. Meningkatkan pemanfaatan limbah cangkang bekicot. 2. Memberikan alternatif sumber kitosan.
3. Memberikan alternatif cara pengolahan limbah zat cair khususnya yang mengandung zat warna reaktif.
BAB II
LANDASAN TEORI
A. Tinjauan Pustaka 1.Bekicot
Bekicot dikategorikan sebagai binatang malam karena lebih aktif bergerak di malam hari sedangkan pada siang hari bekicot beristirahat atau tidur. Bekicot termasuk binatang lunak (mollusca) dan diklasifikasikan kedalam kelas gastropoda (Santoso, 1989). Klasifikasi bekicot sebagai berikut:
- Divisio : Mollusca - Kelas : Gastropoda - Ordo : Pulmonata - Familia : Achatinidae - Genus : Achatina - Spesies : Achatina Fullica
Bekicot banyak dimanfaatkan untuk makanan manusia sebagai sumber protein (dikenal sebagai escargot ) di Eropa, Asia dan Afrika karena mengandung banyak daging dan mengandung banyak asam amino esensial. Bekicot juga sudah menjadi komoditas ekspor. Ekspor bekicot ke Perancis pada tahun 1986 baru mencapai 1.212 ton, sedangkan pada tahun 1990 naik menjadi 11.000 ton (Koswara, 2002). Besarnya manfaat dan pertumbuhan perdagangan ini menyebabkan timbulnya limbah cangkang bekicot dalam jumlah yang cukup besar. Limbah cangkang bekicot banyak ditemukan di kabupaten Kediri. Cangkang bekicot banyak mengandung senyawa-senyawa antara lain protein, lemak, air, kitin dan mineral-mineral seperti kalsium, kalium, magnesium, besi, seng dan mangan (Aboua, F., 1990).
2.Kitin
Kitin adalah senyawa karbohidrat yang termasuk dalam polisakarida, tersusun atas monomer-monomer asetil glukosamin yang saling berikatan dengan ikatan 1,4 beta membentuk suatu unit polimer linier yaitu
2-deoksi-D-glukosa atau beta-(1,4)-N-asetil glukosamin. Analisis dengan sinar x mengindikasikan bahwa struktur kitin mirip dengan selulosa. Perbedaan kitin dan selulosa terletak pada adanya gugus 2-asetil amino pada unit glukosa (Pujiastuti, 2001). Analisis dengan Spektroskopi Infra Merah menunjukkan adanya serapan pada 1671 cm-1 yang merupakan serapan dari gugus amina terasetilasi (Saraswathy, G., Pal, S., Rose, C., and Sastry, T.P., 2001). Struktur selulosa dan kitin diperlihatkan pada Gambar 1.
H O
Struktur kitin tersusun atas 2000-3000 satuan monomer N-asetil D-glukosamin yang saling berikatan melalui 1,4-glikosidik. Satu diantara enam monosakarida yang menyusun rantai kitin adalah glukosamin (Suhardi, 1993).
Kitin merupakan bahan organik utama terdapat pada kelompok hewan seperti, crustaceae, insekta, fungi, mollusca dan arthropoda. Dalam cangkang udang yang termasuk kelompok crustaceae, kitin berikatan dengan protein, garam-garam anorganik seperti kalsium karbonat dan lipid termasuk pigmen-pigmen. Stephen (1995) menyebutkan dalam kulit kepiting terdapat 60% kitin, sedangkan dalam lidah, rahang ataupun contoh yang lainnya dari kelas gastropoda
selulosa
Kitin
terdapat 20% kandungan kitin. Kitin juga diketahui terdapat pada kulit keong, kepiting, kerang dan cangkang bekicot (Stephen, 1995). Bahan-bahan berkitin terutama berada di bagian ektodermal dalam binatang multiseluler dan membentuk eksoskeleton yang spesifik dari kebanyakan binatang tidak bertulang belakang. Tidak ada bukti adanya hubungan antara proporsi kitin dengan kekerasan atau fleksibilitas bahan. Kitin diperoleh dengan melakukan sejumlah proses pemurnian. Proses isolasi kitin terdiri dari dua tahap utama, yaitu deproteinasi dan demineralisasi. Deproteinasi betujuan untuk menghilangkan protein yang terdapat pada cangkang. Tahap ini dilakukan dengan menambahkan NaOH pada konsentrasi rendah sehingga terbentuk Na-proteanat yang larut dalam air. Tahap demineralisasi dilakukan untuk memurnikan kitin dari mineral-mineral yang terkandung dalam cangkang. Tahap ini dilakukan dengan menambahkan HCl encer (Suhardi, 1993).
3.Kitosan
Kebanyakan mutu kitosan komersil mengandung 75-95 % glukosamin dan 5-25 % unit N-asetilglukosamin (Stephen, 1995). Menurut Pujiastuti (2001), derajat deasetilasi kitin terhadap kitosan biasanya berkisar antara 70-100% tergantung penggunaannya. Spesifikasi kitosan untuk kualitas teknis mempunyai derajat deasetilasi sekitar 85%, untuk kualitas makanan derajat deasetilasinya sekitar 90%, sedangkan untuk kitosan berkualitas farmasetis derajat deasetilasinya sekitar 95% (Pujiastuti, 2001). Derajat deasetilasi menentukan muatan gugus amino bebas dalam polisakarida serta digunakan dalam membedakan antara kitin dan kitosan (Khan et. al., 2002). Semakin tinggi derajat deasetilasi maka kualitas kitosan semakin baik.
Biopolimer alami dan tidak beracun ini sekarang secara luas diproduksi secara komersial dari limbah kulit udang dan kepiting (No et. al., 2000). Penelitian kitosan sebagai adsorben telah banyak dilakukan dan kesemuanya menunjukkan karakteristik sifat pada : (1) kemampuannya yang cukup tinggi dalam mengikat ion logam, (2) kemungkinan pengambilan kembali yang relatif mudah terhadap ion logam yang terikat pada kitosan dengan menggunakan pelarut tertentu. Keunggulan adsorben kitosan adalah dapat digunakan untuk penanganan limbah secara berulang-ulang (Muzzarelli, 1997 dalam Darjito, 2001).
Hidrofilitas kitosan lebih tinggi dari pada kitin (Salami, 1998). Kitosan memiliki gugus-gugus amino dan hidroksil yang menyebabkan kitosan mempunyai reaktifitas yang tinggi. Ketika kitosan dilarutkan kedalam asam, amina primer pada molekul kitosan menjadi terprotonasi dan memperoleh muatan positif, karena itu molekul kitosan yang terlarut adalah polikationik. Kitosan tidak larut dalam pelarut alkali, karena pengaruh gugus amina (Kim, S.Y., Cho, S.M., Lee, Y.M. and Kim, S.J., 2000).
dapat berikatan dengan zat warna. Hal ini dikarenakan dalam keadaan terprotonasi, gugus amina pada kitosan dapat berikatan dengan gugus sulfonat dari zat warna (Sakkayawong, et.al., 2005)
Kitosan dengan sifatnya yang non toksik, digunakan dalam berbagai bidang seperti agrikultur, penjernihan dan pemurnian air serta minuman. Kitosan juga digunakan dalam bidang farmasi, imobilisasi sel dan enzim serta kosmetik (Stephen, 1995).
Karakteristik kitosan dapat diketahui secara fisika dan kimia. Kualitas kitosan dapat diketahui dari kemurnian kitosan, berat molekul, kadar abu, kadar air dan derajat deasetilasinya. Kitosan adalah biopolimer yang mempunyai berat molekul yang besar. Berat molekul kitosan bervariasi sesuai dengan sumber bahan mentahnya dan metode preparasinya. Kitosan merupakan biopolimer higroskopis (Salami, 1998) sehingga terjadi penyerapan uap air ketika kitosan dalam keadaan terbuka. Menurut Li, Q., Dunn, E. T., Grandmaison, E. W. dan Goosen, M. F. A. (1992), produk kitosan komersial mengandung kadar air kurang dari 10%. Kadar abu adalah indikator keefektifan tahap demineralisasi. Kualitas kitosan yang baik memiliki kadar abu kurang dari 1% (Sun-Ok Fernandez-Kim B. S. 1991).
Derajat deasetilasi merupakan salah satu karakteristik kimia yang sangat penting, karena sangat mempengaruhi dalam aplikasi kitosan. Derajat deasetilasi menentukan muatan gugus amino bebas dalam polisakarida serta digunakan dalam membedakan antara kitin dan kitosan (Khan et. al., 2002). Metode yang telah dilaporkan dalam penentuan derajat deasetilasi kitosan diantaranya adalah metode
base line dengan spektroskopi inframerah, uji ninhydrin, titrasi potensiometri linear dan spektroskopi NMR.
Penentuan derajat deasetilasi dengan spektroskopi inframerah dapat dilakukan dengan metode base line yang dirumuskan oleh Baxter (Khan et. al., 2002). Derajat deasetilasi dihitung dari perbandingan antara absorbansi pada 1655 cm-1 dengan absorbansi 3450 cm-1 dengan rumus:
DD = 100 – [(A1655 /A3450) X 115]
Dengan (A1655) amida = Log 10 (DF2 / DE)
Pemilihan garis dasar metode base line dapat dilihat pada Gambar 3.
4.Zat Warna Remazol Yellow
Zat warna reaktif merupakan suatu zat warna yang dapat mengadakan reaksi dengan serat sehingga zat warna tersebut merupakan bagian dari serat (Rasjid, dkk , 1976). Zat warna reaktif mengandung gugus fungsi elektrofilik yang dapat bereaksi dengan nukleofilik untuk membentuk ikatan kovalen satu sama lain melalui reaksi adisi atau pertukaran. Nukleofilik pada serat yang secara khusus bereaksi dengan zat warna adalah gugus hidroksil pada selulosa, amino, hidroksil dan gugus tiol pada wool, dan gugus amino pada poliamida (Kirk-Othmer, 1992).
Menurut reaksi yang terjadi, zat warna reaktif dapat dibagi menjadi dua golongan yaitu :
1. Zat warna reaktif yang mengadakan reaksi substitusi dengan serat dan membentuk ikatan pseudoester. Misalnya : zat warna Procion, Cibracron, Drimaren dan Levafix.
2. Zat warna reaktif yang mengadakan reaksi adisi dengan serat dan membentuk ikatan eter. Misalnya : zat warna Remazol, Remalan dan
Primazin (Rasjid, dkk; 1976)
Gugus-gugus reaktif merupakan bagian dari zat warna dan mudah lepas, sehingga bagian zat yang berwarna mudah bereaksi dengan serat. Pada umumnya agar reaksi dapat berjalan dengan baik maka diperlukan penambahan alkali atau
asam sehingga mencapai suatu pH tertentu (Rasjid, dkk, 1976). Dalam larutan alkali akan terjadi reaksi sebagai berikut:
δ- δ+
D-SO2-CH2-CH2-OSO3Na + NaOH → D-SO2-CH=CH2 + Na2SO4+ H2O (1)
Gugusan -SO2-CH=CH2 adalah senyawa vinilsulfon, dimana gugus -SO2-
menyebabkan terjadinya kepolaran yang kuat pada gugus radikal vinil. Ikatan rangkap dari senyawa vinilsulfon bereaksi dengan gugus hidroksil dari air, alkohol, dan selulosa dengan reaksi (2).
δ- δ+ δ- δ+
D-SO2-CH=CH2 + R-O-H → D-SO2- CH2-CH2-OR (2)
senyawa yang dihasilkan merupakan suatu eter yang dapat membentuk ikatan kovalen sangat stabil dengan serat (Isminingsih, 1978).
Pada kondisi asam, kitosan dapat berikatan dengan zat warna. Menurut Sakkayawong et. al. (2005), hal ini dikarenakan dibawah kondisi asam atom-atom hidrogen (H+) pada larutan dapat memprotonasi gugus amina (-NH2) dari kitosan
seperti ditunjukkan pada reaksi (3).
R’-NH2 + H+ R’-NH3+ (3)
Dalam larutan encer, zat warna akan terlarut dan gugus sulfonat pada zat warna
Remazol Yelllow terdissosiasi dan berubah menjadi ion-ionnya. Reaksinya ditunjukkan pada reaksi (4).
DSO3Na DSO3- + Na+ (4)
Proses adsorpsi kemudian dihasilkan dari interaksi elektrostatik antara dua ion tersebut seperti ditunjukkan pada reaksi (5).
R’-NH3+ + DSO3- R’-NH3+-O3SD (5)
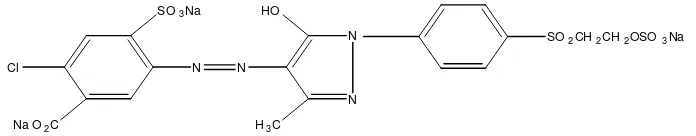
Zat warna Remazol Yellow merupakan salah satu zat warna reaktif dan banyak digunakan dalam industri batik. Struktur molekul zat warna Remazol Yellow ditunjukkan pada Gambar 4.
N
Gambar 4. Struktur Zat Warna Remazol Yellow (Kirk-Othmer, 1992).
5.Adsorpsi
Adsorpsi adalah suatu peristiwa fisik yang terjadi pada permukaan suatu padatan. Adsorpsi terjadi jika gaya tarik menarik antara zat terlarut dengan permukaan penyerap dapat mengatasi gaya tarik menarik antara pelarut dengan permukaan penyerap (Oscik, 1982). Zat atau molekul yang terserap ke permukaan disebut adsorbat sedangkan zat atau molekul yang menyerap disebut adsorben (Sukardjo, 1985).
Isoterm adsorpsi adalah adsorpsi yang menggambarkan hubungan antara zat yang teradsopsi oleh adsorben dengan tekanan atau konsentrasi pada keadaan kesetimbangan dan temperatur tetap (Barrow, 1988; Alberty dan Daniel, 1983). Ada beberapa jenis isoterm adsorpsi antara lain :
1. Isoterm Adsorpsi Langmuir
Isoterm adsorpsi langmuir diturunkan secara teoritis dengan menganggap bahwa hanya sebuah adsorpsi tunggal yang terjadi. Adsorpsi tersebut terlokalisasi, artinya molekul-molekul zat hanya dapat diserap pada tempat-tempat tertentu dan panas adsorpsi tidak tergantung pada permukaan yang tertutup oleh adsorben. Isoterm adsorpsi langmuir digunakan untuk menggambarkan adsorpsi kimia (Robert, A. A., 1997).
Persamaan isoterm adsorpsi langmuir yang merupakan jenis adsorpsi monolayer dapat dijelaskan sebagai berikut :
p dimana : m = massa yang teradsorpsi
b = kapasitas adsorpsi (mg/g) p = konsentrasi akhir larutan (mg/L) K = konstanta kesetimbangan adsorpsi
Dengan membuat plot antara 1/m terhadap 1/p maka harga konstanta K dan d dapat dihitung dari slope dan intercept grafik.
2. Isoterm Adsorpsi Freundlich
Dengan persamaan Barrow (1988) Jika persamaan Barrow dilogaritmakan akan terbentuk persamaan :
log m = log k +
C = konsentrasi sebelum teradsorpsi (mg/L)
K dan n adalah konstanta
(Castellan, 1983) Faktor-faktor yang mempengaruhi adsorpsi adalah :
1). Karakteristik fisika dan kimia dari adsorben antara lain luas permukaan, ukuran pori dan komposisi kimia.
2). Karakteristik kimia dan fisika dari adsorbat antara lain luas permukaan, polaritas molekul, dan komposisi kimia.
3). Konsentrasi adsorbat di dalam fasa cair.
4). Karakteristik fasa cair antara lain pH dan temperatur. 5). Sistem waktu adsorpsi.
(Pohan dan Tjiptahadi, 1987)
6.Spektrofotometri Sinar Tampak dan Ultraviolet
Absorpsi sinar tampak dan ultraviolet mengakibatkan transisi elektronik yaitu promosi elektron dari orbital keadaan dasar yang berenergi rendah ke orbital keadaan transisi yang berenergi lebih tinggi. Transisi ini memerlukan 40-300 kkal/mol. Energi yang diserap selanjutnya terbuang sebagai kalor, sebagai cahaya atau tersalurkan dalam reaksi kimia (misalnya isomerisasi atau reaksi-reaksi radikal bebas) (Pudjaatmaka, A. H.,1991).
di dalam molekul yang sedang diselidiki, sehingga spektroskopi serapan molekul dapat mengidentifikasi gugus-gugus fungsional yang ada dalam suatu molekul. Tetapi yang lebih penting adalah penggunaan spektroskopi UV-Vis untuk penentuan kuantitatif senyawa yang mengandung gugus-gugus pengabsorpsi (Hendayana, S, Kadarohman, A.A, Sumarna, A.A, dan Supriatna, A., 1994).
Absorpsi radiasi oleh suatu sampel diukur pada berbagai panjang gelombang dan dialirkan oleh suatu perekam untuk menghasilakan spektrum-spektrum UV maupun tampak, memiliki radiasi pita absorpsi lebar pada daerah panjang gelombang yang lebar. Hal ini disebabkan oleh terbaginya keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat-subtingkat rotasi dan vibrasi. Berbagai transisi ini berbeda energi sedikit sekali, maka panjang gelombang absorpsinya juga berbeda sedikit dan menimbulkan pita lebar yang nampak dalam spektrum.
Absorpsi energi direkam sebagai absorban pada suatu panjang gelombang tertentu didefinisikan oleh persamaan berikut :
A = log
I = intensitas berkas cahaya sampel
Absorpsi suatu senyawa pada panjang gelombang tertentu bertambah dengan banyaknya molekul yang mengalami transisi. Oleh karena itu, absorpsi tergantung pada struktur elektronik senyawa dan juga pada kepekatan sampel dan panjangnya sel sampel. Karena itu absorpsi energi dinyatakan sebagai absorptivitas molar ε
(koefisien ektingsi molar) dan bukan sebagai absorpsi sebenarnya. Absorptivitas molar ditunjukkan pada persamaan berikut :
A = Absorbansi
c = Konsentrasi (M)
l = panjang gelombang (cm)
(Pudjaatmaka, A. H., 1991)
7.Spektroskopi Infra Merah
Spektroskopi infra merah adalah alat untuk menentukan struktur suatu senyawa berdasarkan interaksi molekul dengan energi sinar infra merah. Atom-atom dalam suatu molekul tidak diam, tetapi terus bervibrasi (bergetar) dimana ikatan kimia yang menghubungkan dua atom dapat dimisalkan sebagai dua bola yang dihubungkan oleh suatu pegas.
Bila radiasi IR dilewatkan pada cuplikan, maka molekul-molekul cuplikan tersebut akan menyerap energi shingga terjadi transisi dari vibrasi dasar (ground state) ke tingkat vibrasi tereksitasi (exited state). Pengabsorpsian energi pada berbagai frekuensi dapat dideteksi oleh spektrofotometer IR yang memplotkan jumlah radiasi yang diteruskan melalui cuplikan sebagai fungsi frekuensi atau panjang gelombang radiasi. Hasil plot tersebut yang memberikan informasi penting tentang gugus fungsional suatu molekul (Hendayana dkk, 1994).
Spektra infra merah kebanyakan menyatakan panjang gelombang atau frekuensi versus persen transmitansi (%T). Apabila senyawa menyerap radiasi dengan panjang gelombang tertentu, maka intensitas radiasi yang diteruskan oleh sampel akan berkurang, sehingga menyebabkan penurunan %T dan dalam spektrum nampak sebagai sumur (dip) yang disebut puncak adsorpsi (peak) atau pita absorpsi (band). Tidak adanya serapan oleh senyawa pada panjang gelombang tertentu terekam sebagai 100%T dan disebut sebagai garis dasar (baseline) yang terekam pada bagian atas spektrum.
Daerah inframerah pada bilangan gelombang 4000 cm-1- 1400 cm-1 dibagi menjadi 4 bagian yaitu :
a. Daerah 4000-2500 cm-1 sesuai untuk vibrasi ikatan stretching N-H, C-H, dan O-H, keduanya menyerap pada daerah 3300-3600 cm-1. karena hampir semua senyawa organik mempunyai ikatan C-H, maka hampir semua spektra memberikan serapan kuat pada daerah ini.
b. Daerah 2500-2000 cm-1 merupakan daerah serapan yang diberikan oleh ikatan rangkap tiga stretching. Nitril dan alkuna menunjukkan puncaknya di daerah ini.
c. Daerah 2000-1500 cm-1 adalah daerah absorpsi ikatan rangkap dua yang meliputi C=O, C-N dan C=C. Secara umum gugus karbonil menyerap pada bilangan gelombang 1670-1780 cm-1 dan alkena stretching secara normal terjadi dalam rentang yang lebar dari 1640-1680 cm-1. Posisi pasti dari serapan C=O sering ditentukan sebagai serapan gugus karbonil dalam molekul. Serapan ester biasa terjadi pada daerah 1735 cm-1, aldehid pada 1725 cm-1 dan ikatan keton terbuka terjadi pada 1715 cm-1.
d. Daerah dibawah 1500 cm-1 biasa disebut daerah sidik jari. Sejumlah besar serapan yang disebabkan oleh berbagai vibrasi ikatan tunggal seperti C-O, C-C, dan C-N yang terjadi di daerah ini, membentuk pola yang unik yang bertindak sebagai identitas sidik jari oleh tiap molekul organik (McMurry, 1994).
Menurut Hamdan, (1992) spektra FTIR didasarkan pada metode vibrasi gugus –O-Si-O- dibedakan menjadi 3, yaitu :
a. Daerah 1250-900 cm-1 menunjukkan vibrasi ulur asimetri –O-Si-O- . b. Daerah 850-680 cm-1 menunjukkan vibrasi ulur simetri –Si-O-Si- . c. Daerah 500-420 cm-1 menunjukkan vibrasi tekuk –Si-O-Si- .
B. Kerangka Pemikiran
dimanfaatkan sebagai sumber kitin adalah cangkang bekicot yang merupakan kelompok hewan lunak (mollusca).
Kitin yang berasal dari cangkang bekicot dapat diubah menjadi kitosan melalui proses deasetilasi. Deasetilasi merupakan proses peghilangan gugus asetil dari kitin.
Kitosan memiliki gugus-gugus amina dan hidroksil yang menyebabkan kitosan mempunyai reaktifitas yang tinggi. Ketika kitosan dilarutkan kedalam campuran asam, amina primer pada molekul kitosan menjadi terprotonasi dan memperoleh muatan positif, karena itu molekul kitosan yang terlarut adalah polikationik.
Adsorpsi zat warna Remazol Yellow oleh kitosan dipengaruhi oleh kondisi proses adsorpsi, antara lain pH awal larutan dan waktu kontak. Proses adsorpsi zat warna Remazol Yellow oleh kitosan dilakukan pada pH asam dan pH basa karena pada pH asam atom-atom hidrogen (H+) pada larutan dapat memprotonasi gugus amina (-NH2) dari kitosan sedangkan pada pH basa, zat warna Remazol Yellow
dapat membentuk senyawa vinil sulfon yang dapat meningkatkan proses adsorpsi. Adsorpsi zat warna Remazol Yellow oleh kitosan selain dipengaruhi oleh pH awal larutan juga dipengaruhi oleh waktu kontak antara kitosan dan zat warna. Dari berbagai variasi pH awal larutan dan lamanya waktu kontak tersebut akan diperoleh kondisi optimum penyerapan zat warna Remazol Yellow oleh kitosan.
Jenis isoterm adsorpsi zat warna Remazol Yellow dengan kitosan ditentukan pada kondisi pH dan waktu kontak optimum. Kemungkinan isoterm adsorpsi antara zat warna Remazol Yellow dengan kitosan adalah isoterm Langmuir karena dimungkinkan terjadi ikatan kimia antara zat warna dengan gugus aktif pada kitosan.
C. Hipotesis
Berdasarkan kerangka pemikiran maka diajukan hipotesis sebagai berikut : 1. Kitosan dari cangkang bekicot dapat digunakan sebagai adsorben Remazol
Yellow.
BAB III
METODOLOGI PENELITIAN
A. Metode Penelitian
Penelitian tentang studi pemanfaatan kitosan dari limbah cangkang bekicot untuk adsorben zat warna Remazol Yellow menggunakan metode eksperimen. Kitin murni dari cangkang bekicot diperoleh melalui proses deproteinasi dan demineralisasi. Tujuan deproteinasi dan demineralisasi adalah menghilangkan protein dan mineral yang terkandung dalam cangkang bekicot. Pembentukan kitosan dari kitin dilakukan melalui proses deasetilasi kitin.
Identifikasi gugus fungsi pada kitin dan kitosan dilakukan dengan memakai analisa FTIR. Besarnya nilai adsorpsi Remazol Yellow oleh kitosan dianalisa dengan spektroskopi UV-Vis. Karakterisasi sifat fisika kitosan diperoleh dengan analisa kadar air, kadar abu, berat molekul dan derajat deasetilasi. Adsorpsi
Remazol Yellow oleh kitosan dengan metode Batch dengan variasi meliputi : 1. Variasi pH untuk mengetahui pengaruh keasaman terhadap adsorpsi
kitosan.
2. Variasi waktu kontak untuk mendapatkan waktu optimum adsorpsi. 3. Variasi konsentrasi untuk menentukan isoterm adsorpsi.
Adsorpsi dan desorpsi kitosan terhadap limbah batik dilakukan pada kondisi optimum untuk mengetahui sifat adsorpsi kitosan terhadap Remazol Yellow.
B. Tempat dan Waktu Penelitian
C. Alat dan Bahan 1. Alat yang digunakan a. Ayakan ASTM Standar TEST SIEVE 50 mesh. b. Seperangkat alat gelas Pyrek.
c. Stirer Hot Plate Model 4658 Cole Parmer Instrument company d. Thermolyne Furnace 48000
e. Neraca analitis Satorius tipe GF-300 f. PH meter Lutron PH-207
g. FTIR 8201 PC
h. Spektroskopi UV-Vis merk Spectrophotometer Optima SP-300 i. Termometer
j. Stopwatch
k. Viscometer Ostwald
2. Bahan yang digunakan
a. Cangkang bekicot dari kecamatan Papar, kabupaten Kediri, Jawa Timur. b. Asam asetat p.a. Merck
c. NaOH p.a. Merck d. HCl 37 % p.a. Merck e. Akuades
f. Kertas saring Whatman 42 g. Alumunium foil
h. Zat warna Remazol Yellow.
D. Prosedur Penelitian 1. Preparasi Kitin dan Kitosan a. Persiapan Bahan
b. Proses Deproteinasi
Labu refluks 1000 ml diisi serbuk cangkang bekicot sebanyak 50 gram lalu ditambahkan larutan NaOH 3,5% (w / v) dengan perbandingan 10 : 1 (v / w), kemudian dipanaskan 650C sambil distirer selama 2 jam (No, 1989 dalam Sun-Ok Fernandez-Kim B. S., 1991). Setelah dingin, disaring dan dicuci dengan akuades sampai netral lalu dikeringkan dalam oven 600 C.
c. Proses Demineralisasi
Serbuk cangkang bekicot hasil deproteinasi dimasukkan dalam labu refluks 1000 ml kemudian ditambahkan larutan HCl 1 M dengan perbandingan 15 : 1 (v /w), kemudian dipanaskan pada suhu kamar (400 C) sambil distirer selama 30 menit (No, 1989 dalam Sun-Ok Fernandez-Kim B. S., 1991). Setelah dingin, disaring lalu dicuci dengan akuades. Hasil yang diperoleh dikeringkan dalam oven pada suhu 600 C. Kitin yang diperoleh dianalisa dengan spektroskopi infra merah pada daerah bilangan gelombang 4000 – 400 cm-1.
d. Proses Deasetilasi Kitin
Kitin yang diperoleh dari proses sebelumnya ditambahkan larutan NaOH 50% pada labu refluks 1000 ml dengan perbandingan 10 : 1 (v /w), kemudian dipanaskan 1200 C sambil distirer selama 30 menit (No and Meyers, 1989 dalam Sun-Ok Fernandez-Kim B. S., 1991). Setelah didinginkan, disaring lalu dicuci dengan akuades kemudian dikeringkan dalam oven pada suhu 600 C selama 24 jam. Kitosan yang diperoleh dianalisa dengan spektroskopi infra merah pada daerah bilangan gelombang 4000 – 400 cm-1.
2. Karakterisasi Kitosan
Karakterisasi kitosan meliputi kadar air, kadar abu, derajat deasetilasi dan berat molekul dengan cara sebagai berikut :
a. Kadar Air
Perlakuan diulangi sampai diperoleh berat yang konstan. Kadar air dihitung dari selisih berat sampel sebelum dikeringkan dan sesudah dikeringkan.
b. Kadar Abu
Cawan porselin kosong ditimbang, kemudian sebanyak 0,5 gram sampel kitosan dimasukkan dalam cawan porselin dan ditimbang. Cawan dimasukkan dalam tanur dengan suhu 5750 C selama 3 jam (ASTM Standar E: 1755), didinginkan kemudian ditimbang. Perlakuan diulangi sampai diperoleh berat yang konstan. Kadar abu diperoleh dari berat sampel yang tidak terabukan setelah pemanasan.
c. Berat Molekul
Kitosan dalam asam asetat 1% dalam berbagai variasi konsentrasi diukur viskositasnya dengan viscometer Ostwald, dengan menghitung waktu penurunan larutan kitosan (No et. al., 2000). Viskositas dihitung dengan rumus :
0
Sedangkan untuk menghitung rata-rata berat molekul polimer dipakai persamaan Mark-Houwink, yaitu :
Derajat deasetilasi kitosan yang terbentuk ditentukan dengan spektra infra merah dengan bilangan gelombang berkisar antara 4000 – 400 cm-1. Derajat deasetilasi ditentukan dengan metode base line yang dirumuskan oleh Baxter (Khan et al., 2002). Derajat deasetilasi dihitung dari perbandingan antara absorbansi pada 1655 cm-1 dengan absorbansi 3450 cm-1 dengan rumus:
DD = 100 – [(A1655 /A3450) X 115]
Dengan (A1655) amida = Log 10 (DF2 / DE)
3. Adsorpsi Larutan Remazol Yellow
Penentuan kondisi optimum adsorpsi kitosan terhadap larutan Remazol Yellow dilakukan dengan memakai metode batch dengan melakukan variasi yang meliputi variasi pH larutan Remazol Yellow, variasi konsentrasi larutan Remazol Yellow dan variasi waktu kontak. Optimasi adsorpsi didasarkan pada orientasi berikut :
a. Pembuatan Spektrum Absorpsi Zat Warna
Larutan Remazol Yellow 20 ppm sebanyak 25 ml diukur absorbansinya pada berbagai panjang gelombang dengan spektroskopi UV– Vis untuk mendapatkan panjang gelombang maksimumnya.
b. Pembuatan Kurva Standar Untuk Spektroskopi UV-Vis
Larutan standar Remazol Yellow dengan variasi 5, 10, 15, 20, 25, 30 dan 35 ppm diukur absorbansinya dengan spektroskopi UV-Vis.
c. Orientasi pH larutan Remazol Yellow
Larutan Remazol Yellow 10 ml dengan konsentrasi 15 ppm diatur pHnya dengan penambahan NaOH dan HCl menjadi pH 1, 2, 3, 4, 5, 6, 7, 8, 9 10 dan 11, kemudian kedalam masing-masing larutan ditambahkan 100 mg kitosan. Campuran diaduk dengan kecepatan 150 rpm selama 24 jam (Sakkkayawong at. al., 2005). Setelah itu larutan disaring dan kadar adsorpsi Remazol Yellow
oleh kitosan dianalisa dengan spektroskopi UV-Vis. d. Orientasi Waktu Pengadukan
Larutan Remazol Yellow 10 ml pada konsentrasi 15 ppm dan pH optimum hasil orientasi sebelumnya ditambahkan 100 mg kitosan, diaduk dengan kecepatan 150 rpm dengan variasi waktu pengadukan selama 6, 12, 18, 24, 30 dan 36 jam. Larutan disaring kemudian dianalisa dengan spektroskopi UV-Vis.
e. Orientasi Konsentrasi Larutan Remazol Yellow
waktu pengadukan optimum hasil orientasi sebelumnya. Larutan kemudian disaring dan dianalisa dengan spektroskopi UV-Vis.
4. Aplikasi Limbah a. Adsorpsi Limbah Zat Warna
Limbah pabrik batik diambil dari bak penampungan setelah proses pencelupan sebelum limbah tersebut dialirkan ke sungai. Konsentrasi awal zat warna diukur setelah zat warna diatur pHnya sampai pH optimum dengan penambahan NaOH dan HCl. Sebanyak 100 mg kitosan dimasukkan ke dalam 10 ml limbah yang telah diatur pHnya sampai pH optimum kemudian diaduk dengan shaker dengan kecepatan 150 rpm selama waktu kontak optimum. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-Vis untuk mengetahui konsentrasi yang tidak diserap oleh kitosan. Konsentrasi limbah zat warna yang diserap oleh kitosan adalah selisih antara konsentrasi awal larutan dengan konsentrasi yang tidak diserap kitosan.
b. Desorpsi
Endapan adsorben hasil penyaringan setelah adsorpsi ditambahkan 10 ml akuades, kemudian diaduk dengan shaker dngan kecepatan 150 rpm selama waktu kontak optimum. Filtrat yang diperoleh ditentukan konsentrasinya dengan spektroskopi UV-Vis untuk mengetahui konsentrasi limbah zat warna yang terdesorpsi.
E. Pengumpulan dan Analisis Data 1. Pengumpulan Data
Kadar air dan kadar mineral kitosan diperoleh dengan menimbang berat sampel sebelum dan sesudah pemanasan. Pengukuran kadar air dilakukan dengan pemanasan 1050 C, sedangkan kadar abu dengan pemanasan 5750C.
standar Remazol Yellow dipakai untuk memplotkan nilai absorbansi sampel hasil pengukuran.
2. Analisis Data
Penghitungan kadar air dan kadar abu kitosan dengan pengukuran berat sampel sebelum dan sesudah pemanasan. Kadar air dalam kitosan diketahui dari banyaknya air yang menguap setelah pemanasan, sedangkan kadar abu diketahui dari berat kitosan yang tidak terabukan setelah pemanasan.
Analisa spektra Infra merah kitin, kitosan memakai daerah gugus fungsi dan daerah sidik jari dengan frekuensi sekitar 4000 cm-1- 400cm-1. Derajat deasetilasi kitosan diukur dengan base line yang dikemukakan oleh Baxter (Khan et. al.,2002) .
Data hasil variasi pH dan waktu kontak dibuat kurva sehingga dapat ditentukan pH optimum dan waktu kontak optimum. Variasi konsentrasi larutan
BAB IV
HASIL DAN PEMBAHASAN
A. Preparasi Adsorben
1.Pemurnian Kitin
Proses pemurnian kitin yang berasal dari cangkang bekicot melalui 2 tahap yaitu deproteinasi dan demineralisasi. Tujuan dari proses deproteinasi adalah untuk menghilangkan protein yang terkandung dalam cangkang bekicot. Tahap demineralisasi bertujuan untuk menghilangkan mineral-mineral yang ada pada cangkang bekicot.
Data rendemen akhir pada setiap tahap ditunjukkan pada Tabel lampiran 1 dan perhitungan rendemen akhir pada setiap tahap dapat dilihat pada Lampiran 1. Rendemen pada setiap tahap pemurnian kitin dapat dilihat pada Tabel 1.
Tabel 1. Rendemen pada setiap tahap pemurnian kitin Tahap perlakuan Rendemen (%) Deproteinasi 95,05 ± 3,09 Demineralisasi 19,22 ± 1,92
Kitin dalam cangkang bekicot diperoleh dengan pemurnian yang meliputi proses deproteinasi dan demineralisasi. Proses deproteinasi dilakukan untuk menghilangkan protein yang terkandung dalam cangkang bekicot dengan penambahan NaOH 3,5%. Protein akan larut dalam NaOH. Rendemen yang dihasilkan dari tahap ini adalah sebesar 95,05 ± 3,09 %.
Proses demineralisasi dilakukan dengan menambahkan HCl 1M dengan tujuan untuk menghilangkan mineral yang terkandung dalam sampel. Menurut Salami (1998) contoh reaksi yang terjadi pada kalsium adalah sebagai berikut :
CaCO3 + 2HCl CaCl2 + H2CO3
H2CO3 CO2 + H2O
Gelembung-gelembung CO2 yang dihasilkan pada proses demineralisasi
merupakan indikator adanya reaksi antara HCl dengan garam mineral. Rendemen yang dihasilkan dari proses ini adalah sebesar 19,22 ± 1,92 % berwarna coklat keputihan dan berbentuk serbuk.
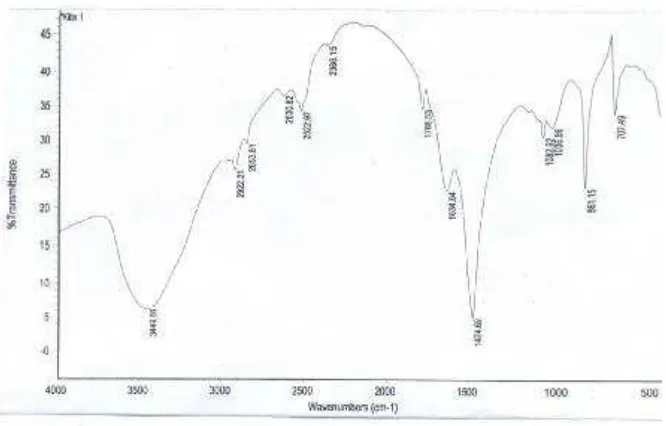
Kitin yang diperoleh selanjutnya diidentifikasi dengan spektroskopi infra merah. Identifikasi ini dilakukan untuk mengetahui gugus fungsi kitin dalam rendemen yang diperoleh. Spektra hasil identifikasi gugus fungsional kitin dengan spektrofotometer infra merah dapat dilihat pada Gambar 5.
Gambar 5. Spektra Infra Merah Kitin
Spektra infra merah kitin pada Gambar 5 memperlihatkan adanya pita serapan pada 3449,66 cm-1 yang merupakan vibrasi ulur gugus –OH (Sastrohamidjojo, 2001). Serapan pada bilangan gelombang 2922,21 cm-1 dan 2853,81 cm-1 muncul sebagai akibat vibrasi ulur gugus C-H dari alkana (Hartomo dan Purba, 1986). Menurut Williams dan Fleming (1987) serapan ulur gugus–CH3
dan –CH2- terletak di daerah 2960-2850 cm-1, sehingga serapan yang terdapat
pada bilangan gelombang 2922,21 cm-1 dan 2853,81 cm-1 menunjukkan serapan ulur gugus –CH2- dan –CH3. Keberadaan gugus –CH3 yang terikat pada amida
(-NHCOCH3), didukung oleh adanya serapan pada bilangan gelombang 1474,69
Hartomo dan Purba (1986) getaran tekuk NH amida berada pada daerah 1570-1515 cm-1, namun karena adanya tumpang tindih antara serapan tersebut dengan serapan ulur gugus C=O sehingga terjadi pelebaran puncak dan hanya muncul satu puncak pada bilangan gelombang 1634,64 cm-1. Adanya serapan pada bilangan gelombang 861,15 cm-1 menandakan masih adanya mineral silika pada kitin.
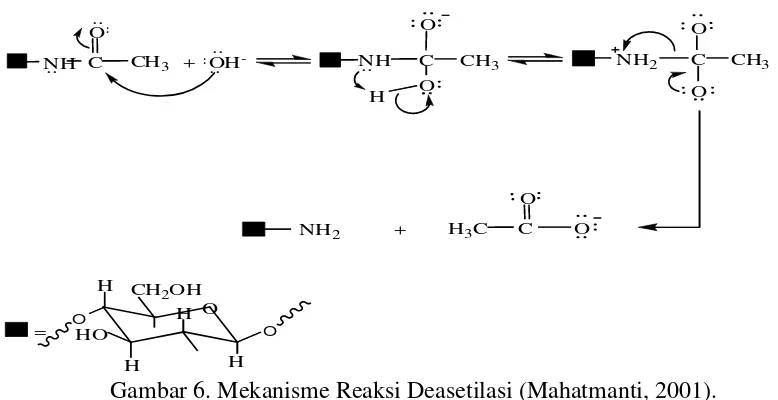
2.Pembentukan Kitosan
Pembentukan kitosan dilakukan melalui proses deasetilasi kitin. Deasetilasi kitin dilakukan dengan mereaksikan kitin dengan NaOH 50% dengan perbandingan 10 : 1 (v/w) pada suhu 1200C (No and Meyers, 1989 dalam Sun-Ok Fernandez-Kim B. S., 1991). Tujuannya adalah untuk menghilangkan gugus asetil yang ada pada kitin. Deasetilasi adalah proses pengubahan gugus asetil (-NHCOCH3) menjadi gugus amina (-NH2). Reaksi deasetilasi kitin pada dasarnya
adalah suatu reaksi hidrolisis amida dari β-(1-4)-2-asetamida-2-deoksi-D-glukosa dengan NaOH, reaksinya ditunjukkan pada Gambar 6.
Kitosan yang diperoleh selanjutnya juga diidentifikasi dengan menggunakan spektroskopi infra merah. Spektra hasil identifikasi gugus fungsional kitosan diperlihatkan pada Gambar 7.
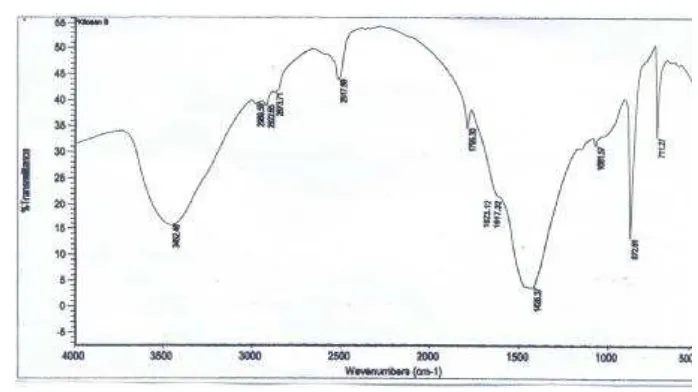
Gambar 7. Spektra Infra Merah Kitosan
Untuk memastikan terbentuknya kitosan dari kitin dilakukan analisis gugus fungsi rendemen dengan menggunakan FTIR. Dari spektra yang dihasilkan terlihat adanya serapan pada bilangan gelombang 3452,49 cm-1 yang merupakan serapan dari gugus –OH. Serapan yang dihasilkan oleh gugus –OH tersebut lebar dan mengalami pergeseran dari bilangan gelombang pada kitin. Hal ini disebabkan adanya tumpang tindih dengan gugus NH dari amina. Serapan pada bilangan gelombang 2922,65 cm-1 mengindikasikan gugus C-H dari alkana yaitu menunjukkan vibrasi ulur gugus –CH2-. Hilangnya pita serapan yang terdapat
pada bilangan gelombang 1634,64 cm-1 menunjukkan hilangnya gugus C=O suatu amida (-NHCO-). Serapan khas kitosan terlihat pada bilangan gelombang 1617,52 cm-1 dan 1623,12 cm-1 yang merupakan getaran tekuk N-H yang menunjukkan keberadaan amina (-NH2) (Silverstein, 1986). Pita serapan pada bilangan
gelombang 1081,57 cm-1 merupakan serapan dari vibrasi ulur gugus –C-O-. Serapan pada bilangan gelombang 872,61 cm-1 menunjukkan masih adanya mineral silika pada kitosan. Masih adanya serapan pada 1425,37 cm-1 yang merupakan serapan gugus –CH3 dari amida menunjukkan bahwa dalam spektra
3.Karakterisasi Kitosan
Karakterisasi kitosan yang dilakukan meliputi warna, bau, bentuk, kadar air, kadar abu, derajat deasetilasi, berat molekul dan derajat polimerisasi. Hasil perhitungan karakterisasi kitosan yang diperoleh ditunjukkan pada Lampiran 3 dan Lampiran 4. Hasil perhitungan Lampiran 3 dan Lampiran 4 selengkapnya diperlihatkan pada Tabel 2.
Tabel 2. Karakterisasi kitosan
Spesifikasi Deskripsi
Warna Putih kecoklatan
Bau Tidak berbau
Bentuk Serbuk
Kadar air 2,06 ± 0,82 %
Kadar abu 26,11 ± 0,45 %
Derajat deasetilasi(Baxter) 74,95%
Berat molekul 2 kilodalton Derajat Polimerisasi 12
Kitosan yang diperoleh dari hasil penelitian ini berwarna putih kecoklatan dan berbentuk serbuk. Menurut Sun-Ok Fernandez-Kim B. S (1991), serbuk kitosan secara alami benar-benar lembut dan warnanya bervariasi dari kuning muda sampai putih.
Penentuan kadar air memperlihatkan jumlah kandungan air dalam kitosan. Perhitungan kadar air dapat dilihat pada Lampiran 3. Hasil perhitungan tersebut memperlihatkan jumlah kandungan air sebesar 2,06 ±0,82 %. Kitosan merupakan biopolimer higroskopis sehingga terjadi penyerapan uap air ketika kitosan dalam keadaan terbuka. Produk kitosan komersial mengandung kadar air kurang dari 10%.
kelarutan, konsekuensinya dapat menurunkan viskositas atau dapat mempengaruhi karakteristik lain yang lebih penting. Kualitas kitosan yang baik memiliki kadar abu kurang dari 1%. Penentuan kadar abu adalah indikator keefektifan tahap demineralisasi untuk menghilangkan mineral yang ada pada kitosan. Tanpa proses demineralisasi, produk menghasilkan kadar abu antara 31-36 %. Besarnya kadar abu yang terkandung memperlihatkan proses demineralisasi yang kurang sempurna.
Berat molekul rata-rata kitosan diukur dengan menentukan waktu alir larutan kitosan yang diukur menggunakan viskometer Ostwald. Data yang diperoleh kemudian dikonversi ke dalam persamaan Mark-Houwink. Hasil perhitungan pada Lampiran 3 memperlihatkan jumlah berat molekul kitosan sebesar 2 kilo Dalton dengan derajat polimerisasi 12. Kitosan adalah biopolimer yang mempunyai berat molekul besar. Berat molekul kitosan bervariasi sesuai dengan sumber bahan mentah dan metode preparasinya. Berat molekul kitosan komersial dari bahan dasar kepiting adalah 6531,99 dalton untuk jenis Vanson 75 dan 7194 dalton untuk jenis Sigma 91.
Penentuan derajat deasetilasi dilakukan untuk mengetahui terbentuknya kitosan dari kitin. Penentuan derajat deasetilasi kitosan dihitung dengan metode
base line oleh Baxter (Khan et. al., 2002). Perhitungan untuk menentukan derajat deasetilasi diperlihatkan pada Lampiran 4 sedangkan gambar penentuan derajat deasetilasi dapat dilihat pada Lampiran 22. Dari perhitungan tersebut, diketahui bahwa dengan rumus Baxter (Khan et. al., 2002) didapat prosentase derajat deasetilasi sebesar 74,95 %.
B. Proses Adsorpsi
1.Penentuan Panjang Gelombang Maksimum Zat Warna Remazol Yellow
Penentuan panjang gelombang maksimum diperoleh dengan mengukur absorbansi larutan zat warna Remazol Yellow 20 ppm menggunakan UV-Vis pada panjang gelombang antara 350 nm sampai 450 nm sehingga didapatkan spektrum absorbansi larutan zat warna Remazol Yellow yang ditunjukkan pada Gambar 8.
0,248
408 410 412 414 416 418 420 422
panjang gelom bang (nm )
Gambar 8. Spektrum Absorbansi Zat Warna Remazol Yellow
Gambar 8 menunjukkan bahwa panjang gelombang maksimum larutan zat warna Remazol Yellow adalah 416 nm. Nilai panjang gelombang ini selanjutnya digunakan dalam pengukuran selanjutnya. Data absorbansi penentuan panjang gelombang maksimum Remazol Yellow dapat dilihat pada Lampiran 5.
2.Penentuan pH Optimum
pH awal larutan dapat mempengaruhi besarnya adsorpsi zat warna Remazol Yellow oleh kitosan. Pada penelitian ini 10 mL larutan zat warna Remazol Yellow
0
Gambar 9. Grafik Hubungan pH vs Konsentrasi Zat Warna Remazol Yellow Terserap.
Gambar 9 menunjukkan pH 2 memiliki daya serap terbesar dibandingkan dengan pH yang lain. Menurut Sakkayawong et. al. (2005), penjelasan untuk hal ini adalah bahwa dibawah kondisi asam atom-atom hidrogen (H+) pada larutan dapat memprotonasi gugus amina (-NH2) dari kitosan seperti ditunjukkan pada
reaksi (6).
R’-NH2 + H+ R’-NH3+ (6)
Dalam larutan encer, zat warna akan terlarut dan gugus sulfonat pada zat warna
Remazol Yelllow terdissosiasi dan berubah menjadi ion-ionnya, seperti ditunjukkan pada reaksi berikut :
DSO3Na DSO3- + Na+ (7)
Proses adsorpsi kemudian dihasilkan dari interaksi elektrostatik antara dua ion tersebut seperti ditunjukkan pada reaksi berikut :
R’-NH3+ + DSO3- R’-NH3+-O3SD (8)
pH 3, 4, 5 dan 6 menghasilkan penyerapan yang lebih kecil dari pH 2. Hal ini dimungkinkan karena belum banyak gugus amina dari kitosan yang terprotonasi oleh hidrogen (H+) dari larutan sehingga menyebabkan kecilnya kemampuan kitosan untuk berikatan dengan zat warna. Sedangkan pada pH 1 dimungkinkan telah terjadi kerusakan pada kitosan sehingga menyebabkan
terjadinya penurunan daya serap kitosan terhadap zat warna. Menurut Sun-Ok Fernandez-Kim B. S (1991) kitosan larut dalam larutan HCl 1%.
Dari gambar 9 juga dapat dilihat pada kondisi basa terjadi penurunan konsentrasi zat warna Remazol Yellow. Hal ini karena terjadi reaksi antara gugus radikal vinil dari larutan zat warna dengan gugus hidroksil dari kitosan. Gugus -SO2- menyebabkan terjadinya kepolaran yang kuat pada gugus radikal vinil
(D-SO2-CH=CH2 ). Ikatan rangkap dari senyawa tersebut bereaksi dengan gugus
hidroksil dari kitosan dengan reaksi berikut :
δ- δ+ δ- δ+
D-SO2-CH=CH2 + R-O-H → D-SO2- CH2-CH2-OR (9)
3.Penentuan Waktu Kontak Optimum
Waktu kontak merupakan waktu yang dibutuhkan oleh kitosan untuk mengadsorpsi zat warna Remazol Yellow. Penentuan waktu kontak optimum dilakukan dengan cara memasukkan kitosan sebanyak 100 mg dalam 10 ml larutan zat warna Remazol Yellow 15 ppm dan pH 2 kemudian dishaker dengan variasi waktu kontak 6, 12, 18, 24, 30, dan 36 jam. Data absorbansi yang diperoleh dimasukkan ke dalam persamaan garis lurus dari kurva standar zat warna Remazol Yellow sehingga dapat dihitung konsentrasi zat warna Remazol Yellow yang terserap. Data pengaruh waktu kontak terhadap konsentrasi zat warna
Waktu kontak optimum tercapai pada saat waktu kontak 24 jam yang menghasilkan konsentrasi zat warna Remazol Yellow terserap sebesar 4,08 ppm. Berdasarkan uji statistik Duncan yang ditunjukkan pada Tabel Lampiran 6 waktu kontak 24 jam menghasilkan daya serap yang optimum. Waktu kontak kurang dari 24 jam menghasilkan penyerapan yang belum maksimal.
4.Penentuan Isoterm Adsorpsi
Penentuan jenis isoterm adsorpsi bertujuan untuk mengetahui proses penyerapan yang terjadi antara kitosan sebagai adsorben dan zat warna Remazol Yellow sebagai zat yang diserap oleh adsorben (adsorbat). Penentuan isoterm adsorpsi ini dilakukan pada kondisi pH dan waktu kontak optimum, yaitu pada pH 2 dan waktu kontak 24 jam dengan cara menvariasi konsentrasi zat warna
Remazol Yellow. Data isoterm adsorpsi kitosan dapat dilihat pada Lampiran 13. Menurut Stum dan Morgan (1995) adsorpsi biasanya ditulis dengan isoterm yang menunjukkan hubungan antara konsentrasi zat yang diserap (adsorbat) dan jumlah yang diserap pada temperatur konstan. Dua jenis adsorpsi yang sering digunakan untuk menentukan jenis adsorpsi pada proses adsorpsi ini adalah isoterm adsorpsi Langmuir dan Freundlich.
1. Isoterm Langmuir
y = 25,562x + 0,3235
Gambar 11. Grafik Isoterm Adsorpsi Langmuir Kitosan
Dari kurva isoterm adsorpsi Langmuir pada Gambar 11 diperoleh persamaan garis lurus y = 25,562x + 0,3235 dengan harga R2 = 0,9962.
2. Isoterm Freundlich
Isoterm Freundlich ditentukan dengan cara membuat kurva hubungan log Cakhir dan log m. Kurva isoterm adsorpsi Freundlich log m versus log Cakhir disajikan oleh Gambar 12. Data selengkapnya ada pada Lampiran 15.
y = 0,8761x - 1,3523
Gambar 12. Grafik Isoterm Adsorpsi Freundlich Kitosan.
Dari kurva isoterm adsorpsi Freundlich diperoleh persamaan garis lurus y = 0,8761x – 1,3523 dengan harga R2 = 0,9861.
zat warna Remazol Yellow oleh kitosan cenderung bersifat kimia yang menyebabkan terbentuknya lapisan tunggal (monolayer adsorption) yang menyeluruh.
C. Aplikasi Limbah
1. Adsorpsi
Limbah industri batik diambil dari bak penampungan setelah proses pencelupan sebelum limbah tersebut dialirkan ke sungai. Proses adsorpsi dilakukan pada kondisi optimum yaitu pada pH 2 waktu kontak 24 jam. Pada penelitian ini sebanyak 10 mL limbah zat warna diadsorpsi dengan penambahan 100 mg kitosan. Data hasil adsorpsi kitosan terhadap limbah zat warna ditunjukkan oleh Tabel 3. Data selengkapnya ada pada Lampiran 16.
Tabel 5. Adsorpsi Kitosan terhadap Limbah Zat Warna Remazol Yellow
Konsentrasi Supriyanto, R (2005) telah meneliti adsorpsi limbah zat warna Remazol Yellow
oleh alang-alang teraktivasi NaOH dan menghasilkan daya serap sebesar 7,851 mg/g, Aryunani (2003) meneliti adsorpsi limbah zat warna Remazol Yellow