KAJIAN POTENSI BAKTERI PELARUT KALIUM DARI
LAHAN PENAMBANGAN BATU KAPUR PALIMANAN
CIREBON
ERNI ANGRAINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Potensi Bakteri Pelarut Kalium dari Lahan Penambangan Batu Kapur Palimanan, Cirebon adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015 Erni Angraini
RINGKASAN
ERNI ANGRAINI. Kajian Potensi Bakteri Pelarut Kalium dari Lahan Penambangan Batu Kapur Palimanan, Cirebon. Dibimbing oleh NISA RACHMANIA MUBARIK dan RAHAYU WIDYASTUTI.
Kalium merupakan makronutrien penting untuk pertumbuhan dan perkembangan tanaman. Penggunaan bakteri pelarut kalium sebagai pupuk hayati disarankan sebagai solusi untuk meningkatkan nutrisi tanaman. Kalium berperan dalam mengaktifkan enzim, memelihara turgor sel, membantu dalam transportasi gula dan pati, untuk metabolisme tanaman, meningkatkan kualitas tanaman karena membantu dalam meningkatkan ketahanan tanaman terhadap hama dan penyakit, serta membantu tanaman pada kondisi cekaman. Sebagian besar kalium (K) dalam tanah terdapat dalam bentuk mineral atau non-tukar K yang tidak tersedia bagi tanaman. Kegiatan mikrob (bakteri pelarut kalium) dapat menyebabkan K dalam bentuk mineral atau non-tukar K berubah menjadi K tukar atau larut dalam air sehingga dapat digunakan bagi tanaman. Penelitian ini bertujuan untuk mengisolasi, menyeleksi, dan mengidentifikasi isolat-isolat bakteri pelarut kalium terpilih dari lahan penambangan batu kapur Palimanan, Cirebon.
Isolasi dan seleksi bakteri dilakukan berdasarkan indeks pelarutan K di medium Aleksandrov yang mengandung feldspar, non-tukar K. Isolat-isolat
pelarut kalium ditandai dengan adanya zona bening di sekeliling koloni. Zona bening menunjukkan kemampuan bakteri dalam melarutkan kalium. Tiga puluh tujuh isolat bakteri pelarut kalium diperoleh dalam penelitian ini. Tiga isolat menunjukkan indeks pelarutan tertinggi, yaitu KQC.4B.1 (tambang), KQC.5A.4 (reklamasi 1 tanaman akasia), dan KQC.5C.5 (reklamasi 3 tanaman petai cina). Semua isolat bakteri bersifat Gram negatif, berbentuk batang pendek, hasil negatif (tidak bersifat patogen terhadap tanaman) setelah uji hipersensitivitas pada daun tembakau, dan mampu melarutkan kalium tertinggi pada hari ke-10 dan ke-20. Ketiga isolat secara fisiologis memiliki tingkat kemiripan 99.9% dengan Burkholderia cepacia. Berdasarkan identifikasi gen 16S rRNA isolat KQC.5C.5 berkerabat dekat dengan Burkholderia cepacia dengan tingkat kemiripan 99%. Aplikasi isolat KQC.5C.5 pada tanah baik yang disterilisasi maupun tanpa sterilisasi memberikan hasil peningkatan jumlah bakteri pelarut kalium dan isolat tersebut mampu melarutkan kalium terikat pada tanah setelah diinkubasi selama 10 hari.
Burkholderia cepacia merupakan PGPR (Plant Growth Promoting Rhizobacteria) karena memiliki peran antara lain: melarutkan kalium dan fosfat, menambat N2, menghasilkan hormon tumbuh (seperti IAA, giberelin, sitokinin,
SUMMARY
ERNI ANGRAINI. Study of Potassium Solubilizing Bacteria from Limestone Mining Area in Palimanan, Cirebon Quarry. Supervised by NISA RACHMANIA MUBARIK and RAHAYU WIDYASTUTI.
Potassium is an essential macronutrient for the growth and development of plants. The use of potassium solubilizing bacteria as a biological fertilizer was suggested as a solution to improve plant nutrition. Potassium play a role in enzyme activation, maintaining cell turgor, transportasion of sugars and starches, played a role in improving crop quality, increasing resistance against pests and diseases, and helping crops on stress conditions. Most of potassium (K) in the soil presented in mineral forms or non-exchangeable K which are not available for
plants. The microbial activity facilitated to release of mineral forms or non-exchangeable K to the exchangeable or water-soluble. This study was aimed
to isolate, select, and characterize of the selected potassium solubilizing bacteria from limestone mining area in Palimanan, Cirebon Quarry.
Isolation and selection of bacteria was done based on K dissolving index in Aleksandrov medium containing feldspar, non-exchangeable K. Potassium solubilizing bacteria characterized by the clear zone around the colony. Clear zone indicates the ability of the bacteria in dissolving potassium. Thirty seven isolates of potassium solubilizing bacteria were obtained in this study. Three isolates showed higher dissolution index, namely KQC.4B.1 (active quarry land), KQC.5A.4 (reclamation 1 plant Acacia), and KQC.5C.5 (reclamation 3 plant petai
cina). All of isolates were Gram negative bacteria, short-rod formed, have a negative result (not pathogenic to plants) after hypersensitivity test in tobacco
leaves, and able to dissolve potassium concentration on 10th and 20th days. The three isolates showed 99.9% physiologically similar with Burkholderia cepacia. By using 16S rRNA gene identification, isolate KQC.5C.5 closely related with Burkholderia cepacia with 99% identity. The application of isolate KQC.5C.5 on soil either sterilization or without sterilization showed that increasing number of potassium solubilizing bacteria and the isolate was able to release the solution K formed after 10th days incubation.
Burkholderia cepacia is PGPR (Plant Growth Promoting Rhizobacteria) because it has a role include: dissolving potassium and phosphate, anchoring N2,
produces growth hormones (such as IAA, gibberellins, cytokinins, ethylene, and others), suppress plant diseases origin of the soil by producing siderophores, glucanase, chitinase, cyanide. Potassium solubilizing bacteria (Burkholderia cepacia) were obtained from this study are expected could use as a biological fertilizer for providing potassium which is available to plants and can be used for plants grown on reclamation area of limestone quarry.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
KAJIAN POTENSI BAKTERI PELARUT KALIUM DARI
LAHAN PENAMBANGAN BATU KAPUR PALIMANAN
CIREBON
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Kajian Potensi Bakteri Pelarut Kalium dari Lahan Penambangan Batu Kapur Palimanan Cirebon.
Nama : Erni Angraini NIM : G351130081
Disetujui oleh Komisi Pembimbing
Dr Nisa Rachmania Mubarik, MSi Dr Dra Rahayu Widyastuti, MScAgr Ketua Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 20 Agustus 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juni 2014 sampai Mei 2015 ini ialah Kajian Potensi Bakteri Pelarut Kalium dari Lahan Penambangan Batu Kapur Palimanan, Cirebon.
Terima kasih penulis ucapkan kepada Dr Nisa Rachmania Mubarik, MSi sebagai ketua komisi pembimbing dan Dr Dra Rahayu Widyastuti, MScAgr sebagai anggota komisi pembimbing, yang telah banyak memberikan nasehat, saran, motivasi, waktu konsultasi, serta solusi dari setiap permasalahan yang dihadapi penulis selama melaksanakan penelitian dan penyusunan karya ilmiah
ini. Selain itu penulis ucapkan terima kasih kepada penguji luar komisi Dr Ir Laksmi Ambarsari, MS atas saran dan diskusi yang diberikan dan Prof Dr Anja Meryandini, MS selaku Ketua Program Studi Mikrobiologi IPB,
yang telah memberikan motivasi selama studi dan masukan pada saat ujian sidang tesis. Kepada DIKTI melalui Beasiswa Unggulan 2013/2014 terima kasih atas kepercayaannya untuk memberikan beasiswa kuliah selama menempuh pendidikan pascasarjana di IPB, dan terima kasih atas dana dari Quarry life Indonesia PT Indocement Tbk Palimanan Cirebon a.n. Dr Nisa Rachmania Mubarik MSi sehingga penelitian yang penulis lakukan dapat terlaksana dengan baik.
Penulis juga mengucapkan terima kasih kepada Bapak Jaka dan Ibu Heni selaku laboran Mikrobiologi IPB, Bapak Andi (Mitra Sejati group) sebagai penyedia feldspar, serta seluruh teman-teman di Laboratorium Mikrobiologi IPB, atas dukungan, motivasi, dan bantuannya selama penelitian ini. Ucapan terima kasih tak terhingga juga penulis ucapkan kepada Ibu Fatmah, Bapak Ruslan Gani (alm), Kakak Salam Yessi Am.Keb, dan Adikku Yogi Anugrah tercinta, seluruh keluarga, serta sahabat-sahabatku tersayang, atas doa, dukungan, kasih sayang,
dan semangat yang diberikan. Terima kasih untuk teman-teman seperjuangan di Pascasarjana Mikrobiologi IPB angkatan 2013 serta seluruh pihak yang telah
memberikan doa dan dukungannya, penulis ucapkan terima kasih. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
2 TINJAUAN PUSTAKA 2
Kalium di dalam Tanah 2
Mekanisme Pelarutan Kalium di dalam tanah 3
Peranan Kalium dalam Tanaman 4
Bakteri Pelarut Kalium 4
Identifikasi Molekuler melalui Amplifikasi Gen 16S rRNA 5
3 METODE 6 Bahan 6
Kerangka Penelitian 6 Waktu dan Tempat 7
Pengambilan Sampel Tanah 7 Isolasi Bakteri Pelarut Kalium 7 Pengujian Kemampuan Bakteri Pelarut Kalium dalam Melarutkan Kalium 7 Kurva Pertumbuhan Isolat Terpilih 8 Uji Hipersensitivitas pada Daun Tembakau 8 Uji Kuantitatif Pelarutan Kalium oleh Bakteri 8 Identifikasi Isolat Bakteri 9 Identifikasi Molekuler 9 Aplikasi Isolat Terpilih pada Tanah 10
4 HASIL DAN PEMBAHASAN 10
Hasil 10
Pembahasan 16
5 SIMPULAN DAN SARAN 19
Simpulan 19
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1 Hasil pengujian isolat dalam melarutkan kalium 11 2 Analisis homologi sekuen gen 16S rRNA dari isolat bakteri pelarut
kalium terpilih dengan program BLASTN 15
3 Hasil analisis K tersedia, K total, dan jumlah sel bakteri pada medium
Aleksandrov pada hari ke-0 dan ke-10 16
DAFTAR GAMBAR
1 Pelepasan dan fiksasi kalium dalam tanah 3
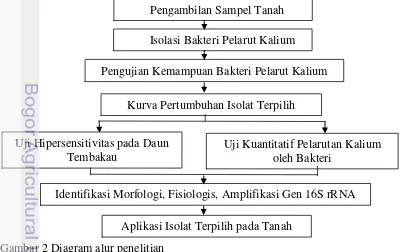
2 Diagram alur penelitian 6
3 Pertumbuhan koloni bakteri pelarut kalium pada media Aleksandrov 10 4 Hasil pengujian isolat terpilih dalam melarutkan kalium secara
kualitatif 12
5 Kurva pertumbuhan tiga isolat terpilih pada media NB 12 6 Hasil pengamatan uji hipersensitivitas pada daun tembakau 13 7 Kemampuan pelarutan K dari isolat bakteri pada media Aleksandrov
cair suhu 28 °C 13
8 Hasil pewarnaan Gram 14
9 Hasil elektroforesis amplifikasi gen 16S rRNA isolat KQC.5C.5 14
10 Konstruksi pohon filogenetik isolat KQC.5C.5 15
DAFTAR LAMPIRAN
1 Lokasi pengambilan sampel di penambangan batu kapur Palimanan
Cirebon 23
2 Hasil analisis tanah reklamasi lahan penambangan batu kapur
Palimanan, Cirebon 24
3 Hasil Total Plate Count (TPC) bakteri sampel tanah dari lahan penambangan batu kapur Palimanan Cirebon pada medium NA 25 4 Kurva Standar Isolat KQC.4B.1, KQC.5A.4, KQC.5C.5 26 5 Hasil karakterisasi morfologi koloni bakteri pelarut kalium dari
penambangan batu kapur Palimanan, Cirebon 28
6 Kurva standar pelarutan kalium dan hasil uji kuantitatif pelarutan kalium oleh bakteri dengan metode SSA (Spektrofotometer Serapan
Atom) 29
7 Hasil standar deviasi uji kuantitatif isolat KQC.4B.1, KQC.5A.4,
KQC.5C.5 31
8 Hasil sekuen isolat KQC.5C.5 33
9 Analisis tanah Cikabayan Darmaga, Bogor 34
1
PENDAHULUAN
Latar Belakang
Indonesia merupakan negara agraris yang sebagian besar mata pencaharian penduduknya adalah bertani, sehingga bisnis utamanya bergantung pada sektor pertanian (Budiman 2013). Pupuk merupakan salah satu faktor produksi yang penting bagi pertanian tetapi kebanyakan petani lebih sering menggunakan pupuk anorganik (kimia). Penggunaan pupuk anorganik secara berlebihan dapat menyebabkan menurunnya kualitas tanah dan pencemaran lingkungan (Lynn et al. 2013). Aplikasi pupuk hayati dianggap dapat membatasi penggunaan pupuk anorganik sehingga mengurangi pencemaran lingkungan, mengurangi biaya pertanian, dan memaksimalkan hasil panen.
Penggunaan mikrob yang dapat merangsang pertumbuhan tanaman (termasuk bakteri pelarut kalium) sebagai pupuk hayati, disarankan sebagai solusi untuk memperbaiki nutrisi pada tanaman (Sutarya 2011). Kalium termasuk unsur hara makro yang penting bagi pertumbuhan dan perkembangan tanaman, berperan dalam mengaktifkan enzim, memelihara turgor sel, membantu dalam transportasi gula dan pati. Selain untuk metabolisme tanaman, kalium juga berperan dalam meningkatkan kualitas tanaman karena membantu dalam meningkatkan ketahanan tanaman terhadap hama dan penyakit, serta membantu tanaman pada kondisi cekaman (Archana 2007).
Konsentrasi kalium terlarut dalam tanah biasanya sangat rendah hanya 1-2% dan lebih dari 90% dari kalium dalam tanah ada dalam bentuk batuan larut dan mineral silikat (mika, muscovite, feldspar, microline, orthoklas), sebagian besar tidak tersedia untuk penyerapan tanaman (Parmar dan Sindhu 2013). Mikrob tanah berperan penting dalam pelarutan kalium terikat dalam bentuk mineral silikat, seperti Pseudomonas dan Bacillus (Murali et al. 2005). Beberapa bakteri yang mampu melarutkan kalium di dalam tanah di antaranya Bacillus sp., Paenibacillus sp., B. mucilaginosus, B. edaphicus (Muralikannan 1996; Sheng 2005; Sugumaran dan Janarthanam 2007; Liu et al. 2012). Bakteri pelarut kalium dapat memberikan teknologi alternatif sebagai pupuk hayati untuk membuat kalium tersedia bagi tanaman selain itu dapat digunakan untuk reklamasi lahan bekas tambang.
2
dapat digunakan sebagai pupuk hayati selain itu juga dapat digunakan untuk mendukung pertumbuhan bibit revegetasi pada lahan bekas tambang.
Perumusan Masalah
Kalium merupakan unsur hara yang penting bagi pertumbuhan dan perkembangan tanaman, tetapi kalium di dalam tanah yang tersedia bagi tanaman sangat sedikit. Penggunaan pupuk anorganik dapat menyebabkan menurunnya kualitas tanah dan mencemari lingkungan, sehingga diperlukan bakteri pelarut kalium yang berpotensi sebagai agen pupuk hayati yang dapat menyediakan kalium bagi tanaman, selain itu dapat mengurangi penggunaan pupuk anorganik.
Tujuan Penelitian
Penelitian ini bertujuan mengisolasi, menyeleksi, dan mengidentifikasi isolat-isolat bakteri pelarut kalium terpilih dari lahan penambangan batu kapur Palimanan, Cirebon.
Manfaat Penelitian
Manfaat dari penelitian ini yaitu untuk mendapatkan bakteri pelarut kalium yang dapat digunakan sebagai pupuk hayati untuk membuat kalium tersedia bagi tanaman selain itu dapat digunakan untuk reklamasi lahan bekas tambang.
Ruang Lingkup Penelitian
Ruang lingkup dalam penelitian ini meliputi isolasi, seleksi, uji hipersensitivitas, identifikasi isolat-isolat bakteri pelarut kalium terpilih dari lahan penambangan batu kapur Palimanan, Cirebon. Seleksi bakteri pelarut kalium terpilih dilakukan berdasakan indeks pelarutan tertinggi (secara kualitatif) dan juga dilakukan uji kuantitatif pelarutan kalium oleh bakteri. Tahap identifikasi meliputi pengamatan morfologi, pewarnaan Gram, fisiologis, dan identifikasi gen 16S rRNA. Uji hipersensitivitas dilakukan pada daun tembakau untuk melihat isolat bakteri bersifat patogen atau tidak terhadap tanaman. Aplikasi isolat terpilih menggunakan tanah dari Cikabayan Darmaga, Bogor (tanah steril dan tidak steril) untuk mengetahui kemampuan isolat dalam melarutkan kalium.
2 TINJAUAN PUSTAKA
Kalium di dalam Tanah
3 perkembangan tanaman (Parmar dan Sindhu 2013). Litosfer mengandung 2.5% kalium dan kalium di tanah terdapat dalam empat bentuk yang berbeda seperti mineral tanah, tersedia, dapat ditukar, dan tidak dapat tukar. Di antara empat bentuk yang berbeda dari kalium dalam tanah, konsentrasi K larut dalam tanah biasanya sangat rendah yaitu hanya sekitar 1-2% dan sebagian besar proporsi yaitu 98% dari K dalam tanah adalah batuan larut dan mineral (Goldstein 1994).
Pada tanah mineral, kalium terikat dalam bentuk mineral silikat yaitu muskovit, orthoklas, biotit, feldspar, illit, mika, vermikulit, smectite dan sebagainya dan kalium dalam bentuk mineral silikat ini dapat dilarutkan oleh
bakteri melalui produksi asam dan akan tersedia untuk tanaman (Ullman et al. 1996). Kalium kebanyakan terikat dalam mineral primer atau
terfiksasi dalam mineral sekunder dari mineral lempung. Oleh karena itu, tanah lempung sebetulnya kaya kadar kalium. Pada tanah tua dan tanah abu vulkanik, umumnya juga kaya kadar K sedangkan tanah gambut kadar K sedang sampai
rendah. Makin dalam dari permukaan, maka kadar K makin rendah (Selian 2008). Banyak tanah yang awalnya kaya K menjadi kekurangan kalium
karena penggunaan kalium oleh tanaman dan adanya erosi tanah (Sheng dan Huang 2002).
Mekanisme Pelarutan Kalium di dalam Tanah
Di tanah ada empat bentuk kalium yang berada dalam keseimbangan yang dinamik yaitu : (1) K larut tersedia bagi tanaman; (2) K dapat ditukar sebagai cadangan yang mudah dimobilisasikan; (3) K tidak dapat ditukar sebagai cadangan yang sukar dimobilisasikan, dan (4) K terikat mineral sebagai cadangan semipermanen. Mekanisme fiksasi dan pelepasannya belum diketahui secara jelas. Hal ini dipengaruhi oleh sifat koloid tanah, penggenangan dan pengeringan, suhu, dan ada tidaknya kapur. Penggenangan dapat meningkatkan ketersediaan K tanah karena dengan adanya penggenangan akan menurunkan potensial redoks (Eh) tanah sehingga meningkatkan kelarutan Fe3+ dan Mn2+. Kation-kation ini dapat menggantikan K yang diabsorpsi liat sehingga K dilepaskan ke dalam larutan tanah. Proses pelepasan lambat kalium yang terjebak pada kisi-kisi mika pada bentuk illit dan vermikulit dengan adanya air dan mengembangnya kisi-kisi liat (Gambar 1) (Setyorini dan Abdulrachman 2007).
Mika Hydrous mika (illit) Vermiculite,
Ion kalium (dehidrasi) Kation dapat dipertukarkan (hidrasi) Gambar 1 Pelepasan dan fiksasi kalium dalam tanah
4
Pelepasan K dari mika diperoleh dari dua proses: (1) transformasi dari mika ke kalium untuk berekspansi 2:1 lapisan silikat dengan bertukar K dengan kation terhidrasi, dan (2) pembubaran mika diikuti oleh pembentukan produk pelapukan. Kepentingan relatif dari kedua mekanisme tergantung pada stabilitas mika dan sifat tanah lingkungan (Sparks 1987).
Pengaruh oksalat dan asam sitrat pada dinamika pelepasan K dari mika dan feldspar dipelajari oleh Song dan Huang (1988). Mereka menemukan bahwa urutan pelepasan K dari mineral K dengan adanya oksalat dan asam sitrat adalah biotit > microcline > orthoklas > muskovit. Aktivitas ion K+ dalam larutan tanah di sekitar partikel mika sangat mempengaruhi pelepasan K+ dari mika dengan pertukaran kation. Ketika tingkat K kurang dari nilai kritis, K diganti dari interlayer dengan kation lainnya dari larutan. Sebaliknya, bila tingkat K lebih besar dari nilai kritis, mika berekspansi 2:1, mineral mengambil K dari pelarutan.
Peranan Kalium dalam Tanaman
Kalium merupakan unsur hara penting dalam metabolisme tanaman seperti fotosintesis, translokasi fotosintat, regulasi pori-pori tanaman (stomata), aktivasi katalis tanaman (enzim), dan ketahanan tanaman terhadap hama dan penyakit. Tanpa kalium yang memadai tanaman akan memiliki akar yang kurang berkembang, tumbuh lambat, menghasilkan benih kecil, dan memiliki hasil yang lebih rendah. Mereka juga lebih rentan terhadap infeksi penyakit (Archana 2007).
Di dalam tubuh tanaman kalium bukanlah sebagai penyusun jaringan tanaman, tetapi lebih banyak berperan dalam proses metabolisme tanaman seperti
mengaktifkan kerja enzim, membuka dan menutup stomata, transportasi hasil-hasil fotosintesis, meningkatkan daya tahan tanaman terhadap kekeringan,
dan penyakit tanaman (Selian 2008).
Salah satu fungsi K adalah dalam pembentukan pati dan sebagai transportasi karbonhidrat hasil fotosintesis, maka bila tanaman kekurangan K maka daun akan berbecak-bercak coklat seperti terbakar (nekrosis), warna coklat ini bermula dari pinggir daun menuju tulang-tulang daun (Selian 2008). Menurut Azinuddin (2009), bahwa tanda-tanda umum dari tanaman kekurangan kalium adalah daun menjadi kuning (klorosis) sepanjang margin daun dan dapat mengakibatkan daun menjadi rontok, sistem akar kurang berkembang dan pertumbuhan akar terhambat serta batang menjadi lemah.
Bakteri Pelarut Kalium
5 Berbagai macam bakteri yaitu Pseudomonas, Burkholderia,
Acidothiobacillus ferrooxidans, Bacillus mucilaginosus, Bacillus edaphicus, B. circulans, dan Paenibacillus sp. telah dilaporkan dapat melarutkan kalium di dalam tanah (Lian et al. 2002; Sheng 2005; Lie et al. 2006; Liu et al. 2012).
Bakteri-bakteri pelarut kalium ini ditemukan dapat melarutkan kalium dalam tanah dalam bentuk batuan larut dan mineral silikat seperti mika, illit dan orthoklas dengan cara memproduksi dan mengekskresikan asam organik yang baik secara langsung dilepaskan pada batuan K atau ion silikat yang dapat membuat K larut sehingga dapat diserap oleh tanaman (Parmar dan Sindhu 2013). Bakteri pelarut kalium dalam bentuk mineral silikat dari sampel tanah yang dikumpulkan dari pohon kelapa mayoritas bakteri tersebut adalah dari kelompok Bacillus sp. dan Pseudomonas sp (Murali et al. 2005).
Pelarutan illit dan feldspar oleh mikrob ini disebabkan oleh produksi asam organik seperti asam oksalat dan asam tartarat dan juga karena produksi polisakarida yang membantu dalam pembubaran mineral untuk melepaskan kalium (Sheng dan He 2006). Dekomposisi mineral silikat oleh B. mucilaginosus karena produksi oksalat, sitrat, dan polisakarida (Liu et al. 2006).
Bakteri pelarut kalium dapat memberikan efek yang menguntungkan bagi pertumbuhan dan perkembangan tanaman sehingga dapat dijadikan sebagai pupuk hayati yang ramah lingkungan. Hal ini dilaporkan oleh Hans dan Lee (2005), bahwa bakteri pelarut kalium yaitu Bacillus mucilaginosus diinokulasi pada tanah yang ditanami terong dapat meningkatkan pertumbuhan tanaman terong tersebut. Peningkatan produksi sebesar 15-20% pada ubi dan tapioka karena aplikasi bakteri pelarut kalium dan dalam kombinasi dengan pupuk hayati lainnya (Chandra et al. 2005). Inokulasi (B. mucilaginosus) pelarut kalium bersama dengan pelarut fosfat (B. megaterium) dan N-fixer (Azotobacter chroococcum) dapat meningkat pertumbuhan, serapan hara secara signifikan pada tanaman jagung (Wu et al. 2005).
Identifikasi Molekuler melalui Amplifikasi Gen 16S rRNA
Identifikasi bakteri berdasarkan karakter fenotip memiliki kelemahan utama, yaitu sering terjadi kesalahan dalam pembedaan spesies dan galur bakteri. Kesalahan tersebut disebabkan hadirnya karakter fenotipe bakteri yang tidak biasa. Terlebih karakter fenotipe bakteri tidak bersifat statis dan dapat berubah seiring dengan perubahan kondisi organisme dan lingkungan hingga menyebabkan evolusi. Kurang akuratnya identifikasi isolat bakteri melalui analisa fenotipe mendorong dilakukannya identifikasi bakteri dengan metode lain yang lebih akurat. Metode identifikasi bakteri yang banyak direkomendasikan adalah analisis genotip melalui pembacaan sekuen basa nitrogen pada nukleotida penyusun fragmen gen 16S rRNA bakteri (Nuroniyah dan Putra 2012).
Berbagai metode dapat dilakukan untuk menganalisis DNA diantaranya AFLP, ARDRA, PFGE, dan sebagainya. Namun dari berbagai
metode yang digunakan, rRNA paling banyak digunakan sebagai marka
molekuler. Pada prokariot terdapat tiga macam ribosomal RNA (rRNA), yaitu 5S rRNA, 16S rRNA, dan 23S rRNA (Jusuf 2001). Analisis phylogenetic-tree
6
mengklasifikasikan organisme. Sekuen gen 16S rRNA pada bakteri merupakan marker molekular universal yang baik karena (i) mengandung daerah yang sangat stabil (conserved region) maupun daerah yang variabel (ii) jarang sekali mengalami transfer gen secara lateral dan (iii) mengalami perubahan yang sangat lambat selama evolusi sehingga dapat digunakan untuk mengetahui hubungan filogenetik (Atlas dan Bartha 1997; Joung dan Cote 2001). Klasifikasi bakteri secara filogenetik sangat dibutuhkan terutama untuk bakteri patogenik karena bakteri yang memiliki kedekatan hubungan kekerabatan dapat dikelompokkan sebagai suatu genus atau spesies.
3
METODE
Bahan
Bahan yang diperlukan yaitu sampel tanah dari lahan penambangan batu kapur Palimanan Cirebon, tanah dari Cikabayan Darmaga, Bogor dan feldspar dari Gunung Kuda, Cirebon. Tanaman tembakau umur tiga bulan yang diperoleh dari Balai Besar Litbang Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor.
Kerangka Penelitian
Kerangka penelitian ini meliputi isolasi bakteri pelarut kalium, kemampuan bakteri dalam melarutkan kalium, uji hipersensitivitas pada daun tembakau, identifikasi berdasarkan morfologi, fisiologis, gen 16S rRNA, pengujian kuantitatif pelarutan kalium oleh bakteri, dan aplikasi isolat terpilih pada tanah (Gambar 2).
Gambar 2 Diagram alur penelitian
Pengambilan Sampel Tanah Isolasi Bakteri Pelarut Kalium
Pengujian Kemampuan Bakteri Pelarut Kalium Kurva Pertumbuhan Isolat Terpilih
Uji Hipersensitivitas pada Daun Tembakau
Uji Kuantitatif Pelarutan Kalium oleh Bakteri
7
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Juni 2014 sampai Mei 2015. Pengambilan sampel tanah dilakukan di lahan penambangan batu kapur Palimanan Cirebon. Isolasi bakteri pelarut kalium sampai identifikasi baik secara morfologi, fisiologi, dan molekuler dilakukan di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB. Uji kuantitatif pelarutan kalium oleh bakteri dilakukan di Laboratorium Kimia FMIPA IPB serta analisis tanah dilakukan di Laboratorium Tanah Departemen Ilmu Tanah dan Sumberdaya Lahan Fakultas pertanian IPB.
Pengambilan Sampel Tanah
Sampel tanah diambil dari lahan penambangan batu kapur Palimanan Cirebon, terdiri atas tiga lokasi dan sebanyak 13 titik yaitu: lahan penambangan yang masih aktif (5 titik), lahan bekas tambang batu kapur (3 titik), dan lahan yang telah dilakukan reklamasi (5 titik) (Lampiran 1). Cara pengambilan sampel ialah dengan cara purpossive random sampling. Pengambilan tanah pada lahan yang telah dilakukan reklamasi diambil di dekat perakaran tanaman dan pengambilan sampel dari permukaan 0-15 cm dan dilakukan analisis tanah (Lampiran 2).
Isolasi Bakteri Pelarut Kalium
Sampel tanah terlebih dahulu dihitung jumlah bakterinya pada medium NA (Lampiran 3). Tanah sebanyak 3 g dimasukkan ke dalam 27 mL larutan fisiologis NaCl 0.85%, kemudian dikocok pada inkubator goyang selama 1 jam dengan kecepatan 120 rpm dan dibuat serial pengenceran 10-1 sampai 10-4. Hasil pengenceran 10-2, 10-3, dan 10-4 masing-masing sebanyak 0.1 mL disebarkan pada medium Aleksandrov (5 g glukosa, 0.5 g MgSO4.7H2O, 0.006 g FeCl3, 0.1 g
CaCO3, 2 g Ca3PO4, 3 g feldspar (sebagai sumber K) dan 20 g agar-agar dalam
1 liter akuades, pH 8) dan diinkubasi pada suhu 28 °C selama 3-7 hari (Prajapati dan Modi 2012). Pertumbuhan bakteri pelarut kalium ditandai dengan adanya zona bening sekeliling koloni. Koloni bakteri yang tumbuh dimurnikan dengan metode gores kuadran. Isolat bakteri yang telah murni disimpan sebagai stok pada Nutrient Agar (NA) miring.
Pengujian Kemampuan Bakteri Pelarut Kalium dalam Melarutkan Kalium
Isolat bakteri pelarut kalium yang telah murni ditumbuhkan pada medium Aleksandrov dengan cara di titik, dan diinkubasi selama 7 hari pada suhu ruang.
Setelah 7 hari waktu inkubasi, kemudian diamati zona bening yang terbentuk di sekitar koloni dan diukur dengan mistar atau jangka sorong lalu dihitung
8
Keterangan : IP = Indeks Pelarutan
Kurva Pertumbuhan Isolat Terpilih
Satu lup isolat-isolat terpilih yang berumur 24 jam diinokulasikan ke dalam 50 mL medium Nutrient Broth (NB) dan diinkubasi dengan inkubator
goyang hingga sel bakteri mencapai 108 sel/mL. Kultur bakteri sebanyak 1 mL yang telah mencapai 108 sel/mL diinokulasikan ke dalam 100 mL medium NB, lalu dinkubasi dengan inkubator goyang pada kecepatan 100 rpm dan suhu 37°C. Pengukuran densitas sel dilakukan setiap 3 jam sekali dengan menggunakan alat spektrofotometer dengan panjang gelombang 620 nm selama 24-48 jam. Kurva standar dibuat sebelum kurva tumbuh untuk mengetahui jumlah sel bakteri yang akan diinokulasikan (Lampiran 4).
Uji Hipersensitivitas pada Daun Tembakau
Uji hipersensitivitas biasanya dilakukan pada daun tembakau (Nicotiana tabacum L.) yang berumur 3 bulan karena bersifat sensitif terhadap bakteri
patogen. Uji hipersensitivitas dilakukan dengan menyuntikkan isolat terpilih (108 sel/mL) pada permukaan bawah daun tembakau pada bagian mesofil antara
tulang daun tembakau dan pada daun yang tidak terlalu muda dan tua, biasanya pada daun yang terdapat di bagian tengah pohon tembakau. Jika di tempat yang telah diinjeksi kultur bakteri berubah warna menjadi kuning atau gejala nekrosis setelah 24-48 jam berarti bakteri uji dikategorikan sebagai patogen tanaman. Akuades digunakan sebagai kontrol negatif dan Xanthomonas oryzae pv. oryzae digunakan sebagai kontrol positif (Mubarik et al. 2014).
Uji Kuantitatif Pelarutan Kalium oleh Bakteri
Uji kuantitatif pelarutan kalium oleh bakteri dilakukan berdasarkan metode (Parmar dan Sindhu 2013) dan metode TPC (Total Plate Count) untuk
menghitung jumlah sel bakteri tiap 5 hari sekali selama 25 hari inkubasi. Isolat-isolat yang terpilih diinokulasikan sebanyak 1 ose ke dalam masing-masing
9 selama 10 menit. Supernatan sebanyak 1 mL diambil kemudian volume dibuat sampai 5 mL dengan akuades dan dicampur secara menyeluruh, kemudian larutan diukur dengan spektrofotometer serapan atom (AA-7000 AAS dengan flame air-C2H2) pada panjang gelombang 765.5 nm. Pengukuran uji kuantitatif pelarutan K
oleh bakteri dilakukan setiap 5 hari sekali selama 25 hari waktu inkubasi selain itu juga dibuat kontrol (tanpa isolat).
Persiapan kurva standar sebanyak 1.908 g KCl dikeringkan pada 60 °C dan dilarutkan dalam akuades dan dibuat volume 1 L, kemudian diambil 10 mL dan diencerkan sampai 100 mL dengan aquades untuk mendapatkan 2 ppm dan digunakan untuk penyusunan standar 0.2, 0.4, 0.8, 1.2, 2 ppm. Standar-standar ini diukur dengan Spektrometer Serapan Atom untuk mendapatkan kurva standar K (Archana 2007).
Identifikasi Isolat Bakteri
Isolat bakteri yang telah terseleksi dilakukan identifikasi secara morfologi (warna koloni, bentuk, elevasi, tepian, bentuk sel bakteri, pewarnaan Gram) (Lampiran 5). Karakterisasi fisiologis isolat bakteri menggunakan kit Analytical Profile Index (API) 20 NE (biomeriux, Inc. Durham, USA).
Identifikasi Molekuler
Ekstraksi DNA
Koloni bakteri tunggal yang telah murni digores kuadran pada medium Nutrient Agar (NA) kemudian diinkubasi pada suhu 37 °C selama 24 jam. Bakteri yang telah tumbuh diambil dengan menggunakan tusuk gigi. Sel bakteri disentrifugasi dengan kecepatan 10,000 rpm selama 1 menit. Ekstraksi DNA mengikuti prosedur PrestoTM gDNA Bakteria Mini Kit (Geneaid). Hasil ekstraksi DNA diukur konsentrasi dan kemurniannya dengan menggunakan spetrofotometer NanoDrop 2000 (Thermo Scientific, Wilmington, DE, USA).
Amplifikasi Gen 16S rRNA, Sekuensing DNA, dan Analisis Filogenetik Gen 16S rRNA diamplifikasi menggunakan mesin Polymerase Chain Reaction (PCR). Mix PCR dibuat sebanyak 50 µL dengan komposisi antara lain :
25 µL GoTaq Green Master Mix 2x (Promega, Madison, WI, USA), masing-masing 0.5 µL primer 63f (5’ CAGGCCTAACACATGCAAGTC-3’) dan
1387r (5’-GGGCGGWGTGTACAAGGC-3’) (100 pmol) (Marchesi et al. 1998), 2 µL cetakan DNA (64.4 ng/µ L), dan 22 µL Nuclease Free Water. Kondisi PCR yang digunakan yaitu pradenaturasi (94 °C, 4 menit), denaturasi (94 °C, 30 detik),
annealing (55 °C, 30 detik), elongation (72 °C, 1 menit), dan post elongasi (72 °C, 7 menit) sebanyak 30 siklus. Terakhir dilakukan penurunan suhu ke 4 °C
10
Produk hasil PCR disekuen dan dikirim ke perusahaan jasa sekuensing company (First Base Malaysia). Hasil sekuen yang diperoleh dilakukan pengeditan dengan menggunakan program Chromas Pro (Lampiran 8) kemudian dibandingkan dengan sekuen pada GeneBank menggunakan program BLASTN kemudian dikonstruksi pohon filogenetiknya dengan menggunakan program MEGA 5.05 dengan metode Neighbour Joining (NJ) dengan bootsrap 1000x. (MegaSoftware, Inc, Arizona, USA).
Aplikasi Isolat Terpilih pada Tanah
Tanah yang berasal dari reklamasi batu kapur Palimanan, Cirebon dan Cikabayan Darmaga dilakukan analisis K tersedia dan kadar air. Tanah Cikabayan Darmaga juga dianalisis unsur-unsur lainnya (Lampiran 9). Tanah yang memiliki K tersedia yang lebih sedikit digunakan untuk uji selanjutnya. Tanah yang terpilih dibuat 4 perlakuan yaitu : (1) tanah tidak steril + isolat, (2) tanah tidak steril tanpa isolat, (3) tanah steril + isolat, (4) tanah steril tanpa isolat. Sterilisasi tanah menggunakan autoklaf suhu 121 °C dan tekanan 1 atm selama 1 jam. Isolat yang diberikan memiliki jumlah sel bakteri sekitar 108 sel/mL sebanyak 10% (10 mL). Masing-masing perlakuan dibuat sebanyak 100 g tanah dan tiga kali ulangan, kemudian tanah tersebut dinkubasi selama 10 hari pada suhu 28 °C. Hari ke-0 dan ke-10 dilakukan analisis K tersedia, K total, kadar air (Lampiran 10) dan dilakukan perhitungan jumlah bakteri dengan metode cawan hitung pada medium Aleksandrov.
4 HASIL DAN PEMBAHASAN
Hasil
Isolasi Bakteri Pelarut Kalium
Hasil isolasi bakteri pelarut kalium pada medium Aleksandrov dari 13 sampel tanah dari lahan penambangan batu kapur PT Indocement Tbk,
Palimanan Cirebon diperoleh sebanyak 37 isolat bakteri (Tabel 1). Isolat-isolat
pelarut kalium ditandai dengan adanya zona bening di sekeliling koloni (Gambar 3). Zona bening menunjukkan kemampuan bakteri dalam melarutkan
kalium.
Gambar 3 Pertumbuhan koloni bakteri pelarut kalium pada media Aleksandrov Koloni dengan zona bening
11
Pengujian Kemampuan Bakteri Pelarut Kalium dalam Melarutkan Kalium
Sebanyak 37 isolat bakteri pelarut kalium yang telah dimurnikan diuji kemampuannya dalam melarutkan kalium secara kualitatif berdasarkan indeks pelarutan kalium (Tabel 1). Bakteri pelarut kalium terbanyak diperoleh dari daerah reklamasi yang ditumbuhi pohon akasia dan daerah yang memiliki sedikit bakteri pelarut kalium hanya satu isolat yaitu daerah bekas tambang. Kisaran indeks pelarutan kalium (IPK) antara 0.2-3.1.
Tabel 1 Hasil pengujian isolat dalam melarutkan kalium
Keterangan : IPK: Indeks pelarutan kalium; T: tidak terukur; Ex tambang: bekas tambang
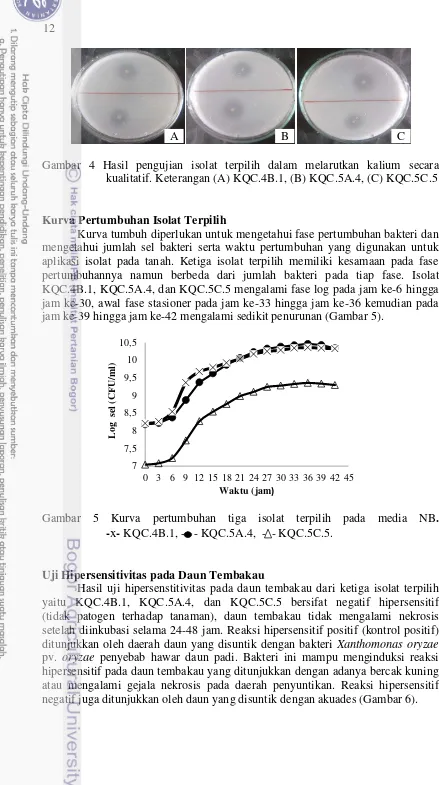
Terpilih tiga isolat yang memiliki indeks pelarutan kalium (IPK) tertinggi yaitu isolat KQC.4B.1 yang berasal dari daerah tambang, KQC.5A.4 yang berasal dari daerah reklamasi 1 dengan tanaman akasia, dan KQC.5C.5 berasal dari daerah reklamasi 3 dengan tanaman petai cina (Gambar 4). Isolat-isolat tersebut memiliki kisaran IPK 2.20, 3.12, dan 3.12.
12
Gambar 4 Hasil pengujian isolat terpilih dalam melarutkan kalium secara kualitatif. Keterangan (A) KQC.4B.1, (B) KQC.5A.4, (C) KQC.5C.5
Kurva Pertumbuhan Isolat Terpilih
Kurva tumbuh diperlukan untuk mengetahui fase pertumbuhan bakteri dan mengetahui jumlah sel bakteri serta waktu pertumbuhan yang digunakan untuk aplikasi isolat pada tanah. Ketiga isolat terpilih memiliki kesamaan pada fase pertumbuhannya namun berbeda dari jumlah bakteri pada tiap fase. Isolat KQC.4B.1, KQC.5A.4, dan KQC.5C.5 mengalami fase log pada jam ke-6 hingga jam ke-30, awal fase stasioner pada jam ke-33 hingga jam ke-36 kemudian pada jam ke-39 hingga jam ke-42 mengalami sedikit penurunan (Gambar 5).
Gambar 5 Kurva pertumbuhan tiga isolat terpilih pada media NB. -x- KQC.4B.1, - - KQC.5A.4, - - KQC.5C.5.
Uji Hipersensitivitas pada Daun Tembakau
Hasil uji hipersenstitivitas pada daun tembakau dari ketiga isolat terpilih
yaitu KQC.4B.1, KQC.5A.4, dan KQC.5C.5 bersifat negatif hipersensitif (tidak patogen terhadap tanaman), daun tembakau tidak mengalami nekrosis
setelah diinkubasi selama 24-48 jam. Reaksi hipersensitif positif (kontrol positif) ditunjukkan oleh daerah daun yang disuntik dengan bakteri Xanthomonas oryzae pv. oryzae penyebab hawar daun padi. Bakteri ini mampu menginduksi reaksi hipersensitif pada daun tembakau yang ditunjukkan dengan adanya bercak kuning atau mengalami gejala nekrosis pada daerah penyuntikan. Reaksi hipersensitif negatif juga ditunjukkan oleh daun yang disuntik dengan akuades (Gambar 6).
13
Gambar 6 Hasil pengamatan uji hipersensitivitas pada daun tembakau. Keterangan (A) daun yang disuntik dengan bakteri Xanthomonas oryzae pv. oryzae sebagai kontrol positif, (B) kontrol negatif (akuades), (C) Isolat KQC.4B.1, (D) Isolat KQC.5A.4, (E) Isolat KQC.5C.5
Uji Kuantitatif Pelarutan Kalium oleh Bakteri
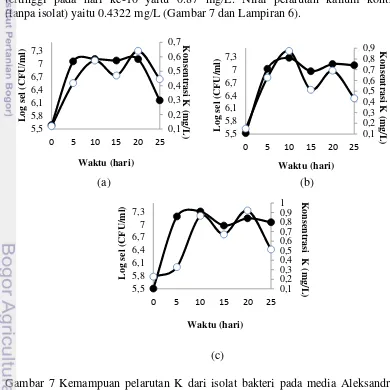
Nilai estimasi kuantitatif pelarutan K oleh isolat-isolat terpilih antara lain isolat KQC.4B.1 dan KQC.5C.5 mampu melarutkan kalium tertinggi pada hari ke-20 yaitu 0.64 mg/L dan 0.92 mg/L, sedangkan KQC.5A.4 melarutkan kalium
tertinggi pada hari ke-10 yaitu 0.87 mg/L. Nilai pelarutan kalium kontrol (tanpa isolat) yaitu 0.4322 mg/L (Gambar 7 dan Lampiran 6).
14
1500 pb 1000 pb 750 pb 500 pb
250 pb
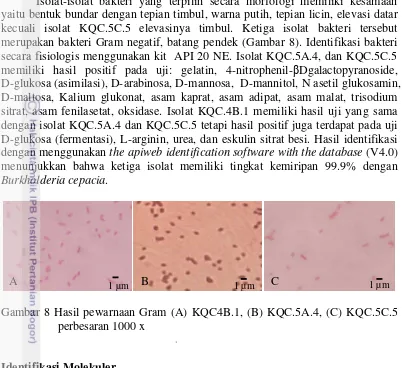
Identifikasi Bakteri secara Morfologi dan Fisiologis
Isolat-isolat bakteri yang terpilih secara morfologi memiliki kesamaan yaitu bentuk bundar dengan tepian timbul, warna putih, tepian licin, elevasi datar kecuali isolat KQC.5C.5 elevasinya timbul. Ketiga isolat bakteri tersebut merupakan bakteri Gram negatif, batang pendek (Gambar 8). Identifikasi bakteri secara fisiologis menggunakan kit API 20 NE. Isolat KQC.5A.4, dan KQC.5C.5 memiliki hasil positif pada uji: gelatin, 4-nitrophenil-βDgalactopyranoside, D-glukosa (asimilasi), D-arabinosa, D-mannosa, D-mannitol, N asetil glukosamin, D-maltosa, Kalium glukonat, asam kaprat, asam adipat, asam malat, trisodium
sitrat, asam fenilasetat, oksidase. Isolat KQC.4B.1 memiliki hasil uji yang sama dengan isolat KQC.5A.4 dan KQC.5C.5 tetapi hasil positif juga terdapat pada uji D-glukosa (fermentasi), L-arginin, urea, dan eskulin sitrat besi. Hasil identifikasi dengan menggunakan the apiweb identification software with the database (V4.0) menunjukkan bahwa ketiga isolat memiliki tingkat kemiripan 99.9% dengan Burkholderia cepacia.
Gambar 8 Hasil pewarnaan Gram (A) KQC4B.1, (B) KQC.5A.4, (C) KQC.5C.5 perbesaran 1000 x
Identifikasi Molekuler
Identifikasi secara molekuler dilakukan pada isolat KQC.5C.5 karena memiliki kemampuan melarutkan kalium tertinggi baik secara kualitatif maupun kuantitatif dan hasil dari standar deviasi KQC.5C.5 lebih baik dibandingkan KQC.5A.4 walaupun isolat KQC.5A.4 memiliki pelarutan kalium tertinggi dengan waktu lebih cepat yaitu 10 hari dibandingkan KQC.5C.5 selama 20 hari (Lampiran 7). Hasil amplifikasi 16S rRNA menggunakan primer 63f dan 1387r (Marchesi et al. 1998) menghasilkan pita sekitar 1300 pb (Gambar 9).
Gambar 9 Hasil elektroforesis amplifikasi gen 16S rRNA isolat KQC.5C.5
1 kb KQC.5C.5
1 µm 1 µm 1 µm
15 Analisis filogenetik menggunakan metode Neigbour Joining (NJ) dengan bootstrap 1000x. Isolat KQC.5C.5 berdasarkan hasil BLASTN memiliki tingkat kemiripan 99% dengan Burkholderia cepacia (Tabel 2 dan Gambar 10).
Tabel 2 Analisis homologi sekuen gen 16S rRNA dari isolat bakteri pelarut kalium terpilih dengan program BLASTN
Gambar 10 Konstruksi pohon filogenetik isolat KQC.5C.5
Aplikasi Isolat Terpilih pada Tanah
Hasil analisis kalium tersedia pada tanah asal Cikabayan Darmaga dan reklamasi batu kapur Palimanan Cirebon yaitu 263.72 mg/kg dan 438.32 mg/kg, sehingga tanah yang dipakai untuk aplikasi ialah tanah Cikabayan Darmaga yang memiliki sedikit kalium tersedia. Aplikasi isolat KQC.5C.5 pada tanah Cikabayan Darmaga baik yang disterilisasi maupun tanpa sterilisasi memberikan hasil peningkatan jumlah bakteri pelarut kalium pada medium Aleksandrov setelah diinkubasi selama 10 hari. Hasil K tersedia pada semua perlakuan meningkat setelah diinkubasi selama 10 hari namun pada perlakuan yang tanpa adanya bakteri, K tersedia lebih rendah dibandingkan perlakuan yang menggunakan bakteri baik pada hari ke-0 maupun hari ke-10.
Kalium tersedia dan kalium total pada tanah steril lebih tinggi dibandingkan tanah tidak steril baik pada hari ke-0 maupun hari ke-10. Pada tanah
Kode Isolat Homologi % Identitas E-Value No Akses
KQC.5C.5 Burkholderia cepacia galur NBRC 14074
99 0.0 NR 113645.1
Burkholderia contaminans
galur J2956
99 0.0 NR 104978.1
Burkholderia lata galur 383
99 0.0 NR 102890.1
Burkholderia metallica galur R-16017
99 0.0 NR 042636.1
Burkholderia seminalis galur R-2419
16
steril masih terdapat bakteri walaupun jumlahnya tidak terlalu banyak seperti tanah yang tidak steril.
Tabel 3 Hasil analisis K tersedia, K total, dan jumlah sel bakteri pada medium Aleksandrov pada hari ke-0 dan ke-10
Hari ke-0 Hari ke-10 BTNS: isolat KQC.5C.5 + tanah tidak steril
Pembahasan
Hasil isolasi didapatkan 37 isolat yang berasal dari satu isolat dari lahan bekas tambang, lima isolat dari tambang, dan 31 berasal dari daerah reklamasi. Hal ini disebabkan pada daerah reklamasi tanaman mengeluarkan eksudat akar yang dapat menstimulasi aktivitas mikroba. Rizosfer kaya akan sumber energi dari senyawa organik yang dikeluarkan oleh akar tanaman berupa eksudat akar yang merupakan tempat berbagai jenis mikrob untuk berkembang dan bersaing (Sorensen 1997). Tiap tanaman mengeluarkan eksudat akar dengan komposisi yang berbeda-beda sehingga berperan sebagai penyeleksi mikrob, pengaruhnya bisa meningkatkan perkembangan mikrob tertentu dan menghambat perkembangan mikrob lain. Semakin banyak eksudat akar, akan semakin besar jumlah dan keragaman mikrob (Husen et al. 2006).
Terpilih tiga isolat yang memiliki indeks pelarutan tertinggi dalam melarutkan kalium secara kualitatif dari 37 isolat yang berhasil diisolasi yaitu isolat KQC.4B.1, KQC.5A.4, dan KQC.5C.5 dengan indeks pelarutan 2.20, 3.12, dan 3.12 yang berasal dari daerah tambang, reklamasi 1 (akasia), dan reklamasi 3
(petai cina) (Tabel 1 dan Gambar 4). Perbedaan nilai indeks pelarutan dari isolat-isolat tersebut dapat disebabkan oleh perbedaan kemampuan setiap bakteri
dalam memproduksi asam organik seperti asam oksalat dan asam tartarat serta produksi polisakarida yang membantu dalam pembubaran mineral silikat seperti feldspar dan illit untuk melepaskan kalium yang terikat (Sheng dan He 2006).
17
bahan organik, yang merupakan hasil kegiatan jasad hidup baik yang terdapat di dalam maupun di permukaan batuan. Senyawa ini umumnya merupakan hasil
buangan (sekresi, eksudat) atau pun rombakan. Asam-asam ini, seperti asam anorganik umumnya karena pada gugus fungsionalnya dapat mengalami disosiasi yang melepaskan proton (H+) dan proton ini dapat menyerang mineral batuan. Selain itu sisa asamnya (anion organik) dapat membentuk senyawa kompleks dengan kation-kation pada tepi mineral atau kation yang terlepas dari mineral. Dengan demikian asam-asam ini nyata berperan dalam pelapukan kimia (Ismangil dan Hanudin 2005).
Ketiga isolat terpilih memiliki kesamaan pada fase pertumbuhannya baik fase lag, log, maupun stasioner. Isolat KQC.5A.4 dan KQC.4B.1 memiliki jumlah bakteri yang lebih banyak dibandingkan dengan isolat KQC.5C.5 (Gambar 5). Perbedaan waktu pertumbuhan dan jumlah bakteri dapat disebabkan oleh beberapa faktor yaitu nutrisi, oksigen, karbondioksida, pH, dan suhu (Moat et al. 2002).
Hasil uji hipersenstitivitas pada daun tembakau dari ketiga isolat terpilih
yaitu KQC.4B.1, KQC.5A.4, dan KQC.5C.5 bersifat negatif hipersensitif (tidak patogen terhadap tanaman), daun tembakau tidak mengalami nekrosis atau
adanya bercak kecoklatan pada daerah yang diinjeksikan kultur isolat setelah diinkubasi selama 24-48 jam (Gambar 6). Menurut Wahyudi et al. (2011), reaksi hipersensitif merupakan program kematian sel yang cepat dan terlokalisasi. Reaksi ini muncul pada tanaman yang terinfeksi saat pengenalan patogen dan bersamaan dengan itu, merupakan usaha untuk menghambat pertumbuhan patogen.
Nilai estimasi kuantitatif pelarutan K oleh isolat-isolat terpilih menunjukkan hasil yang berbeda-beda (Gambar 7). Pelarutan kalium di dalam tanah disebabkan adanya asam-asam organik dan polisakarida yang diproduksi oleh bakteri. Pelarutan kalium pada media yang mengandung mika oleh Bacillus mucilaginosus yang diisolasi dari tanah, batuan, dan mineral sebesar 4.29 mg/L (Sugumaran dan Janarthanam 2007). Bakteri galur WPS73 dan NNY43 mampu melarutkan kalium sebesar 41.0 dan 48.0 mg/L. Bakteri galur WPS73 melarutkan kalium sebesar 49.0 mg/L pada 25 °C (Parmar dan Sindhu 2013). Bakteri-bakteri pelarut kalium ini ditemukan dapat melarutkan kalium dalam tanah dalam bentuk batuan larut dan mineral silikat seperti mika, illit dan orthoklas dengan cara memproduksi dan mengekskresikan asam organik yang baik secara langsung dilepaskan pada batuan K atau ion silikat yang dapat membuat K larut sehingga dapat diserap oleh tanaman. Hasil isolasi dari tanah rizosfer tanaman tembakau dari berbagai Provinsi yaitu Sichuan, Shandong, dan Hubei didapatkan berbagai jenis bakteri yaitu Klebsiella variicola, Enterobacter cloacae, Enterobacter asburiae, Enterobacter aerogenes, Pantoea agglomerans, Agrobacterium tumefaciens, Microbacterium foliorum, Myroides odoratimimus, dan Burkholderia cepacia yang memiliki kemampuan melarutkan kalium berkisar 0.59 mg/L-4.4 mg/L (Zhang dan Kong 2014).
18
jumlah sel bakteri maka semakin banyak kalium terikat pada feldspar yang dilepaskan dan sebaliknya. Pada penelitian ini digunakan medium Aleksandrov cair yang selama 25 hari inkubasi tidak mengalami penambahan medium, sehingga diduga bakteri yang awalnya beradaptasi dan menggunakan sumber karbon dan nutrisi yang berasal dari medium Aleksandrov yang lambat laun sumber karbon dan nutrisi yang ada di medium habis sehingga jumlah bakteri mengalami penurunan tetapi setelah bakteri tersebut mampu melarutkan feldspar yang ada di dalam medium Aleksandrov dan diketahui bahwa di dalam feldspar tidak hanya kalium tetapi kalsium dan natrium kemungkinan dapat dilepaskan karena adanya produksi asam organik dan polisakarida oleh isolat uji, sehingga bakteri dapat menggunakan kalium, kalsium, dan natrium sebagai sumber nutrisi, dan untuk aktivitas metabolismenya. Menurut Epstein (2003), kalium (K+) merupakan elemen yang diperlukan untuk hidup. Pada bakteri kalium memiliki empat peran utama yaitu : mengatur tekanan turgor, zat terlarut osmotik, regulasi pH internal, dan aktivator enzim intraseluler.
Isolat-isolat bakteri yang terpilih secara morfologi memiliki kesamaan. Ketiga isolat bakteri tersebut merupakan bakteri Gram negatif, batang pendek
(Gambar 8), dan setelah diidentifikasi secara fisiologis menggunakan kit API 20 NE menunjukkan bahwa ketiga isolat memiliki tingkat kemiripan 99.9%
dengan Burkholderia cepacia. Identifikasi gen 16S rRNA dilakukan pada isolat KQC.5C.5 karena memiliki kemampuan melarutkan kalium tertinggi baik secara kualitatif maupun kuantitatif yaitu 3.12 dan 0.92 mg/L. Isolat KQC.5C.5 berdasarkan hasil BLASTN memiliki tingkat kemiripan 99% dengan Burkholderia cepacia (Tabel 2). Hasil penelitian Lü dan Huang (2010), diperoleh semua bakteri pelarut kalium yang diisolasi dari rizosfer pohon pinus, di Provinsi Guangxi Cina merupakan genus Burkholderia. Inokulasi Burkholderia glathei PML1 (12) secara signifikan meningkatkan pelapukan biotit dan pertumbuhan akar lateral dan rambut akar pinus yang disebabkan pelepasan K dari mineral tanah (Calvaruso et al. 2006).
Hasil analisis K tersedia dari tanah yang diberikan perlakuan bakteri lebih tinggi dibandingkan perlakuan yang tidak menggunakan bakteri baik pada hari ke-0 maupun hari ke-10 (Tabel 3). Hal ini disebabkan karena adanya penambahan bakteri pelarut kalium ke dalam tanah sehingga dengan kehadiran bakteri tersebut membuat kalium yang awalnya dalam bentuk terikat di dalam tanah menjadi tersedia. Mikrob pelarut kalium berperan penting dalam membuat tersedia kalium. Mikrob tersebut melarutkan kalium dari bentuk tidak larut seperti mika, feldspar, illit, dan lain-lain dengan memproduksi asam organik, siderophores, dan polisakarida. Serapan kalium oleh tanaman dapat ditingkatkan dengan menggunakan pelarut kalium sebagai bio-inokulan untuk meningkatkan produksi tanaman (Shanware et al. 2014).
19 tanah diperoleh pada perlakuan metode sterilisasi autoklaf. Metode sterilisasi autoklaf dan uap dapat mematikan fungi, sedangkan bakteri dan aktinomisetes masih ada yang bertahan hidup, tetapi jumlahnya dapat diabaikan (jumlah kurang dari 30 koloni dalam satu cawan media pertumbuhan).
Aplikasi pada tanah dalam penelitian ini dapat dijadikan acuan bahwa isolat KQC.5C.5 (Burkholderia cepacia) mampu meningkatkan kalium tersedia di dalam tanah sehingga dapat digunakan oleh tanaman untuk pertumbuhan dan perkembangannya. Burkholderia cepacia merupakan PGPR (Plant Growth Promoting Rhizobacteria) karena memiliki peran antara lain: melarutkan kalium dan fosfat, menambat N2, menghasilkan hormon tumbuh (seperti IAA, giberelin,
sitokinin, etilen, dan lain-lain), menekan penyakit tanaman asal tanah dengan memproduksi siderofor, glukanase, kitinase, sianida. Burkholderia sp. berhasil diisolasi dari daerah sekitar tambang (daerah penyangga) batu kapur Palimanan, Cirebon mampu melarutkan kalium tertinggi pada hari ke-25 yaitu 1.7 mg/L dan
mampu melarutkan fosfat tertinggi pada hari ke-5 yaitu 50.83 mg/L (Mursyida et al. 2015). Pemberian isolat bakteri rizosfer Burkholderia cepacia galur
L10.1 dan B. cepacia galur L6.5 memberikan pengaruh terhadap tinggi tanaman dan
jumlah akar lateral pada tanaman Sengon yang hampir sama dengan pemberian pupuk NPK (Afnansyah 2013).
Lima isolat Burkholderia sp. rizosfer (B313, B51a, B52c, B51b, B52a) dan satu Burkholderia sp. endofit (B212) diisolasi dari perkebunan kelapa sawit. Semua isolat Burkholderia sp. menunjukkan aktivitas penghambatan terhadap pertumbuhan Ganoderma boninense secara in vitro dan penghambatan tertinggi oleh Burkholderia B212 dengan nilai PIRG 24.38% (Buana et al. 2014). Glukanase (enzim yang dapat menghidrolisis dinding sel kapang patogen yang menginfeksi tanaman padi) dihasilkan dari bakteri endofitik yaitu Burkholderia cepacia. Aktivitas spesifik enzim glukanase menunjukkan 1207.976 U/mg dengan yield 27% dan tingkat kemurnian 3.9 kali. pH dan suhu optimum dalam
menghidrolisis β-glukan ialah pH 6.0 dan suhu 40 °C dengan aktivitas enzim 293.71 U/mL (Winangsih et al. 2015). Pada beberapa hasil penelitian tersebut diketahui bahwa Burkholderia cepacia berpotensi dijadikan pupuk hayati penyedia kalium, fosfat, nitrogen bagi tanaman.
SIMPULAN DAN SARAN
Simpulan
20
Saran
Perlu dilakukan aplikasi lebih lanjut dari isolat KQC.5C.5 ke tanaman khususnya tanaman yang digunakan untuk reklamasi lahan bekas tambang batu kapur sehingga dapat diketahui pengaruh isolat tersebut dalam memacu pertumbuhan tanaman di area reklamasi.
DAFTAR PUSTAKA
Afnansyah M. 2013. Potensi bakteri rizosfer sebagai pupuk hayati pada persemaian tanaman Sengon (Paraserianthes falcataria) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Archana DS. 2007. Studied on potassium solubilizing bacteria [thesis]. Dharwad (IN): University of Agricultural Sciences.
Atlas RM, Bartha R. 1997. Microbial Ecology. Fundamental and Application. New York (US): An Imprint of Addison Wesley Longman.
Azinuddin A. 2009. Growth optimization of potassium solubilizing bacteria isolated from biofertilizer [thesis]. Pahang (MY): University Malaysia Pahang.
Buana RFN, Wahyudi AT, Mathius NT. 2014. Control activity of potential antifungal-producingBurkholderia sp. in suppressing Ganoderma boninense growth in oil palm. Asian J Agric Res. 8(5): 259-268.
Budiman MA. 2013. Sektor Pertanian dalam Konsep Pendapatan Nasional. Bandung (ID): Universitas Padjadjaran.
Cahyani VR. 2009. Pengaruh beberapa metode sterilisasi tanah terhadap status hara, populasi mikrobiota, potensi infeksi mikoriza dan pertumbuhan tanaman. J Tanah Agroklimat.6(1): 43-52.
Calvaruso C, Turpault MP, Klett PF. 2006. Root-associated bacteria contribute to mineral weathering and to mineral nutrition in trees: a budgeting analysis. Appl Environ Microbiol. 72(2): 1258–1266.
Chandra K, Greep S, Ravindranath P, Sivathsa, RSH. 2005. Liquid biofertilizers. Bangalore (IN):Regional Center for Organic Farming Hebbal.
Epstein W. 2003. The Roles and Regulation of Potassium in Bacteria. Chicago (US): The University of Chicago.
Goldstein A.H. 1994. Involvement of the quino protein glucose dehydrogenase in the solubilization of exogeneous mineral phosphates by Gram negative bacteria. In phosphate in microorganisms: cellular and molecular biology. Cell Mol Biol.2(2): 197-203.
Groudev SN. 1987. Use of heterotrophic micro-organisms in mineral biotechnology. Acta Biotechnol. 7: 299-306.
Han HS, Lee KD. 2005. Phosphate and potassium solubilizing bacteria effect on mineral uptake, soil availability and growth of eggplant. Res J Agric Biol. Sci. 1(2): 176-180.
21 Ismangil, Hanudin E. 2005. Degradasi mineral batuan oleh asam organik. J Ilmu
Tanah Lingk. 5(1): 1-17.
Joung KB, JC Cote. 2001. Phylogenetic analysis of Bacillus thuringiensis serovars based on 16S rRNA gene restriction fragment length polymorphisms. J ApplMicrobiol. 90:115-122.
Jusuf M. 2001. Genetika I : Struktur dan Ekspresi Gen. Jakarta (ID): CV Sagung Seto.
Lian B, Fu, PQ Mo, Liu CQ. 2002. A comprehensive review of the mechanism of potassium release by silicate bacteria. Acta Mineral Sinica. 22: 179–183. Lie FC, Li, Yang YZ, Cheng LJ. 2006. Advances in the study of weathering
products of primary silicate minerals, exemplified by mica and feldspar. Acta Petrol Mineral. 25: 440-448.
Liu W. Xu, Wu S, Yang Q, Luo Y, Christie P. 2006. Decomposition of silicate minerals by Bacillus mucilaginosus in liquid culture. Environ Geochem. Health. 28(2): 133-140.
Liu D, Lian B, Dong H. 2012. Isolation of Paenibacillus sp. and assessment of its potential for enhancing mineral weathering. J Geomicrobiol. 29:413-421. Lynn TM, Win HS, Kyaw EP, Latt ZK, Yu SS. 2013. Characterization of
phosphate solubilizing and potassium decomposing strains and study on their effects on tomato cultivation. JISSR. 3(4):959-966.
Lü C, Huang B. 2010. Isolation and characterization of Azotobacteria from pine rhizosphere. Afri J Microbiol. 4(12): 1299-1306.
Marchesi JR, Sato T, Weightman AJ, Martin TA, Fry JC, Hiom SJ, Wade WG.
Mubarik NR, Wibowo RH, Angraini E, Musyida E, Wahdi E. 2014. Exploration of bacterial diversity at Cirebon Quarry. Final Report: Quarry Life Award Project [Internet]. [diunduh 2014 Nop 12]: 1-13. Tersedia pada http://www.quarrylifeaward.com.
Murali G, Gupta A, Air RV. 2005. Variations in hosting beneficial plant associated microorganisms by root (wilt) diseased and field tolerant coconut palms of west coast tall variety. Curr Sci. 89(11): 1922-1927.
Muralikannan M. 1996. Biodissolution of silicate, phosphate and potassium by silicate solubilizing bacteria in rice ecosystem [thesis]. Coimbatore (IN): University Tamil Nadu Agric.
Mursyida E, Mubarik NR, Tjahjoleksono A. 2015. Selection and identification of phosphate-potassium solubilizing bacteria from area around the limenstone mining in Cirebon Quarry. Res J Microbiol. 10(6): 270-279.
Nuroniyah T, Putra SR. 2012. Identifikasi spesies isolat bakteri S1 dengan metode analisa sekuen fragmen gen 16S rDNA. J Teknik Pomits. 1(1): 1-6.
22
Prajapati KB, Modi HA. 2012. Isolation and characterization of potassium solubilizing bacteria from ceramic industry soil. CIBTech J Microbiol. 1(2): 8-14.
Praptisih M, Safei S, Kamtono, Hendrizan M, Pura PS. 2012. Fasies dan lingkungan pengendapan batuan karbonat formasi parigi di daerah Palimanan Cirebon. Riset Geol Pertamb. 22(1): 33-43.
Rogers JR, Bennett PC, Choi WJ. 1998. Feldspars as a source of nutrients for microorganisms. Am Mineral. 83: 1532-1540.
Selian ARK. 2008. Analisa kadar unsur hara kalium (K) dari tanah perkebunan kelapa sawit Bengkalis Riau secara spektrofotometri serapan atom (SSA) [tugas akhir]. Medan (ID): Universitas Sumatera Utara.
Setyorini D, Abdulrachman S. 2007. Pengelolaan hara mineral tanaman padi [catatan penelitian]. Subang (ID): Balai Besar Penelitian dan Pengembangan Sumber Daya Lahan Pertanian dan Balai Besar Penelitian Tanaman Padi. Shanware AS, Kalkar SA, Trivedi MM. 2014. Potassium solublisers : occurrence,
mechanism, and their role as competent biofertilizer. J Curr Microbiol Appl Sci. 3(9): 622-629.
Sheng XF, Huang WY. 2002. Study on the conditions of potassium release by strain NBT of silicate bacteria scientia. Agric-Sin. 35(6): 673-677.
Sheng XF. 2005. Growth promotion and increased potassium uptake of cotton and rape by a potassium releasing strain of Bacillus edaphicus. Soil Biol Biochem. 37(1): 1918–1922.
Sheng XF, He LY. 2006. Solubilization of potassium bearing minerals by a wild type strain of Bacillus edaphicus and its mutants and increased potassium uptake by wheat. Can J Microbiol. 52(1): 66-72.
Song SK, Huang PM. 1988. Dynamics of potassium release from potassium-bearing minerals as influenced by oxalic and citric acids. J Soil Sci Soc Am. 52(2): 383-390.
Sorensen J. 1997. The Rhizosphere as a Habitat for Soil Microorganisms. p.21-45. In J.E. Van Elsas, J.T Trevors, and E.M.H. Wellington (Eds.). Modern Soil Microbiology. New York (US): Marcel Dekker, Inc.
Sparks DL. 1987. Potassium dynamics in soil; Advances in Soil Science. New York (US): Springer-Verlag.
Sugumaran P, Janarthanam B. 2007, Solubilization of potassium containing minerals by bacteria and their effect on plant growth. World J Agric Sci. 3(3): 350-355.
Sutarya R. 2011. Seleksi mikroba potensial untuk pembuatan pupuk majemuk hayati dalam upaya penghematan pupuk sintetis (25%) pada tanaman cabai [laporan penelitian]. Bandung (ID): Balai Penelitian Tanaman Sayuran. Ullman WJ, Kirchman DL, Welch SA, Vandevivere P. 1996. Laboratory evidence
by microbioally mediated silicate mineral dissolution in nature. Chem Geol. 132(1): 11-17.
23
Winangsih F, Bintang M, Priyatno TR. 2015. Cloning and expression gene
β-1,4-glucanase from Burkholderia cepacia into Escherichia coli system, optimize and characterize the recombinant enzyme. Curr Biochem. 1(3): 116-125.
Wu SC, Cao ZH, Li ZG, Cheung KC, Wong MH. 2005. Effect of biofertilizer
containing N-fixer, P and K soluiblizers and AM-fungi on maize growth : a greenhouse trial. Geoderma. 125(2): 155-166.
Zhang C, Kong F. 2014. Isolation and identification of potassium-solubilizing bacteria from tobacco rhizospheric soil and their effect on tobacco plants. Appl Soil Ecol. 82: 18-25.
LAMPIRAN
24
Lampiran 2 Hasil analisis tanah reklamasi lahan penambangan batu kapur Palimanan, Cirebon
Parameter Tanah Nilai Kriteria
pH (H
2O) 6.7 Netral
pH(KCl) 6
C-org (%) 0.55 Sangat rendah
N-total (%) 0.07 Sangat rendah
P (Bray I) ppm 5.5 Rendah
P (HCl) ppm 317.46 Sangat tinggi
Ca (me/100 g) 38.7 Sangat tinggi
Mg (me/100 g) 0.86 Rendah
K (me/100 g) 0.08 Sangat rendah
Na (me/100 g) 0.24 Rendah
KTK (me/100 g) 4.54 Sangat rendah
KB (%) 100 Tinggi
Al (me/100 g) tr Tidak terukur
H (me/100 g) 0.2 -
Fe (ppm) 9.85 Cukup
Cu (ppm) 0.25 Cukup
Zn (ppm) 1.24 Cukup
Mn (ppm) 0.56 Kurang
Pasir (%) 60.76 Berpasir
Debu (%) 25.47 -
Liat (%) 13.77 -
25 Lampiran 3 Hasil Total Plate Count (TPC) bakteri sampel tanah dari lahan
penambangan batu kapur Palimanan Cirebon pada medium NA Sampel dari Lahan Bekas Tambang Jumlah Sel Bakteri (CFU/mL)
KQC.1A 0.9 x 105
KQC.1B 1 x 105
KQC.1C 1 x 105
Sampel dari Lahan Penambangan (Mining)
KQC.4A 0.6 x 105
KQC.4B 0.9 x 105
KQC.4C 1 x 105
KQC.6A 1 x 105
KQC.6B 0.8 x 105
Sampel dari Lahan yang telah direklamasi
KQC.5A 22 x 105
KQC.5B 18 x 105
KQC.5C 14 x 105
KQC.7A 14 x 105
26
Lampiran 4 Kurva Standar Isolat KQC.4B.1, KQC.5A.4, KQC.5C.5
Kurva Standar Isolat KQC.4B.1 Blanko 0.013
Perbandingan OD (620 nm) Jumlah Sel Bakteri Log Sel (CFU/mL)
1 : 1 0.7955 231 x 107 9.36
Perbandingan OD (620 nm) Jumlah Sel Bakteri Log Sel (CFU/mL)
27 Lanjutan Lampiran 4
Kurva Standar Isolat KQC.5C.5 Blanko 0.009
Perbandingan OD (620 nm) Jumlah Sel Bakteri Log Sel (CFU/mL)
1 : 1 0.802 18.47 x 107 8.26
1 : 2 0.5015 9.23 x 107 7.96
1 : 4 0.297 4.61 x 107 7.66
y = 0,8388x - 6,1479 R² = 0,9881
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8 0,9
7,6 7,8 8 8,2 8,4
O
D
(
6
2
0
nm
)
Log sel (CFU/mL)
28
Lampiran 5 Hasil karakterisasi morfologi koloni bakteri pelarut kalium dari penambangan batu kapur Palimanan, Cirebon
Lokasi Pengambilan
Sampel Morfologi Koloni
Sampel dari Lahan
Bekas Tambang Isolat Warna Bentuk Tepian Elevasi
KQC.1B KQC.1B.1 Putih Konsentris Berombak Datar
Tambang (Mining)
KQC.4A KQC.4A.1 Putih Bundar Licin Datar
KQC.4A.2 Putih Bundar Licin Timbul
KQC.4B KQC.4B.1 Putih
Bundar dengan
tepian timbul Licin Datar
KQC.4B.2 Putih Bundar Licin Timbul
tepian timbul Licin Datar KQC.5A.5 Putih Konsentris Berombak Datar
KQC.5A.6 Putih Bundar Licin Timbul
KQC.5A.7 Putih Konsentris Berombak Datar KQC.5A.8 Putih Konsentris Berombak Datar KQC.5B (Akasia II) KQC.5B.1 Putih Tidak beraturan Berombak Datar KQC.5B.2 Putih Tidak beraturan Berombak Datar KQC.5B.3 Putih Tidak beraturan Berombak Datar KQC.5B.4 Putih Konsentris Berombak Timbul KQC.5B.5 Putih Konsentris Berombak Timbul KQC.5B.6 Putih Konsentris Berombak Timbul KQC.5B.7 Putih Konsentris Licin Timbul
KQC.5B.8 Putih Bundar Licin Cembung
KQC.5B.9 Putih Bundar Licin Timbul
KQC.5B.10 Putih Konsentris Berombak Datar KQC.5C (Petai cina) KQC.5C.1 Putih Bundar berinti Licin Datar KQC.5C.2 Putih Konsentris Berombak Datar KQC.5C.3 Putih Konsentris Berombak Datar KQC.5C.4 Putih Konsentris Berombak Datar KQC.5C.5 Putih
Bundar dengan
29 Lanjutan Lampiran 5
Lampiran 6 Kurva standar pelarutan kalium dan hasil uji kuantitatif pelarutan kalium oleh bakteri dengan metode SSA (Spektrofotometer Serapam Atom)
Kurva standar pelarutan kalium dengan metode SSA
Konsentrasi (ppm) OD (675.5 nm)
0 0
Kurva Standar Pelarutan Kalium (AAS)
KQC.5C.4 Putih Konsentris Berombak Datar KQC.5C.5 Putih
Bundar dengan
tepian timbul Licin Timbul KQC.7A
(Jarak Pagar I) KQC.7A.1 Putih Bundar Licin Timbul
KQC.7A.2 Putih Konsentris Berombak Datar KQC.7A.3 Putih Konsentris Licin Datar KQC.7A.4 Putih Konsentris Licin Datar KQC.7A.5 Putih Konsentris Licin Datar KQC.7A.6 Putih Konsentris Licin Datar KQC.7A.7 Putih Konsentris Licin Datar KQC.7B
30
Lanjutan Lampiran 6
Blanko (tanpa isolat) : 0.4322 ppm
Hasil uji kuantitatif pelarutan kalium oleh bakteri isolat KQC.4B.1
Hari
Konsentrasi
Awal (ppm) Konsentrasi - blanko Jumlah Sel
Log Sel (CFU/mL)
0 0.55125 0.11905 3.9 x 105 5.59
5 0.85 0.4178 1.1 x 107 7.05
10 1.00595 0.57375 1.2 x 107 7.11
15 0.902 0.4698 1.1 x 107 7.07
20 1.073 0.6408 1.2 x 107 7.11
25 0.87725 0.44505 1.4 x 106 6.16
Hasil uji kuantitatif pelarutan kalium oleh bakteri isolat KQC.5A.4
Hari
Konsentrasi
Awal (ppm) Konsentrasi - blanko Jumlah Sel
Log Sel (CFU/mL)
0 0.5815 0.1493 3.3 x 105 5.51
5 1.0584 0.6262 1.0 x 107 7.01
10 1.3067 0.8745 1.8 x 107 7.27
15 0.94435 0.51215 9.1 x 106 6.96
20 1.1225 0.6903 1.3 x 107 7.12
25 0.8641 0.4319 1.2 x107 7.10
Hasil uji kuantitatif pelarutan kalium oleh bakteri isolat KQC.5C.5
Hari
Konsentrasi
Awal (ppm) Konsentrasi - blanko Jumlah Sel
Log Sel (CFU/mL)
0 0.65825 0.22605 3.2 x 105 5.50
5 0.7597 0.3275 1.5 x 107 7.18
10 1.2971 0.8649 2.0 x 107 7.30
15 1.1023 0.6701 9.4 x 106 6.97
20 1.3531 0.9209 1.3 x 107 7.14