KEMAMPUAN FERTILISASI SPERMATOZOA
SEXING
DAN
PERKEMBANGAN AWAL EMBRIO SECARA
IN VITRO
PADA SAPI
ALVIEN NUR AINI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kemampuan Fertilisasi Spermatozoa Sexing dan Perkembangan Awal Embrio Secara In Vitro pada Sapi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2016
RINGKASAN
ALVIEN NUR AINI. Kemampuan Fertilisasi Spermatozoa Sexing dan Perkembangan Awal Embrio Secara In Vitro pada Sapi. Dibimbing oleh MOHAMAD AGUS SETIADI dan NI WAYAN KURNIANI KARJA.
Penelitian ini bertujuan mengkaji kemampuan fertilisasi dan perkembangan awal embrio sapi yang diproduksi secara in vitro menggunakan spermatozoa sexing. Proses sexing spermatozoa dilakukan menggunakan gradien bovine serum albumin (BSA) yang diproduksi oleh Balai Besar Inseminasi Buatan (BBIB) Lembang, Bandung. Oosit sapi dikoleksi dari ovarium menggunakan teknik pencacahan dan pembilasan (slicing dan flushing). Oosit yang digunakan dalam penelitian adalah oosit yang mempunyai sitoplasma yang homogen serta sel kumulus yang kompak. Oosit dimaturasi pada medium tissue culture medium (TCM) 199 yang disuplementasi dengan 10 IU/ml pregnant mare’s serum gonadotropin (PMSG), 10 IU/ml human chorionic gonadotropin (hCG) dan 10% fetal bovine serum (FBS) selama 24 jam dalam inkubator 5% CO2 dan suhu 39oC.
Fertilisasi dilakukan menggunakan tiga jenis spermatozoa (X, Y dan spermatozoa tanpa proses sexing sebagai Kontrol) selama 14 jam dengan konsentrasi akhir 2x106 spermatozoa/mL. Kultur embrio dilakukan selama 96 jam menggunakan medium synthetic oviductal fluid (SOF) yang disuplementasi dengan asam amino esensial dan non esensial serta 0,3% bovine serum albumin (BSA).
Hasil penelitian menunjukkan bahwa kemampuan fertilisasi pada perlakuan X dan Y tidak menunjukkan perbedaan yang nyata (P>0,05) dibandingkan Kontrol dengan persentase masing-masing yaitu 49,1%, 51,4% dan 53,4%. Tingkat pembelahan embrio juga tidak menunjukkan perbedaan yang nyata (P>0,05) pada perlakuan X , Y dan Kontrol dengan persentase masing-masing 47,7%, 48,2% dan 54,4%. Hanya sedikit embrio yang mampu melewati pembelahan lebih dari stadium 8 sel (23,8%, 26,0% dan 23,6%) pada spermatozoa X, Y dan Kontrol yang secara statistik tidak berbeda nyata (P>0,05). Dapat disimpulkan bahwa spermatozoa sexing hasil pemisahan gradien BSA mempunyai kemampuan fertilisasi dan mendukung perkembangan awal embrio in vitro yang sama dengan spermatozoa unsexing.
SUMMARY
ALVIEN NUR AINI. Fertilization Ability of Sexed Spermatozoa and Early Bovine Embryonic Development In Vitro. Supervised by MOHAMAD AGUS SETIADI dan NI WAYAN KURNIANI KARJA.
The aim of this study was to evaluate the fertilization ability and early development bovine embryo produced in vitro with sexed sperm. Sexed sperm sorted by bovine serum albumin (BSA) gradient was produced by Center For Artificial Insemination Lembang, Bandung. Oocytes were collected from ovarium by flushing and slicing technique. Only oocytes with homogenous cytoplasm and intact cumullus cells were used in this study. Oocytes were matured in tissue culture medium (TCM) 199 supplemented with 10 IU/ml pregnant mare’s serum gonadotropin (PMSG), 10 IU/ml human chorionic gonadotropin (hCG) and 10% fetal bovine serum (FBS) for 24 h in 5% CO2 incubator 39oC. Oocytes were
fertilized with three different spermatozoa (X,Y and unsexing spermatozoa as control) for 14 h with final concentration 2x106 spermatozoa/mL. Embryos were then cultured in synthetic oviductal fluid (SOF) supplemented with essential and non essential amino acid and 0,3% bovine serum albumin (BSA) for 96 h.
Results of the study revealed that fertilization ability was not significant difference among the gruop (49,1%, 51,4% and 53,4%) for X, Y and control group, respectively(P>0,05). No significant difference (P>0,05) in the number of embryos development (47,7%, 48,2%, 54,4%) for X, Y and control group, respectively. Only small number of embryos in X, Y and control group could better develop reach more than 8 cells (23,8%, 26,0%, 23,6%), however it was not significant difference among the group (P>0,05). It is concluded that sexed spermatozoa separated by BSA gradient column which is able to support fertilization and early embryonic development produced in vitro that is the same as unsexing spermatozoa.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biologi Reproduksi
KEMAMPUAN FERTILISASI SPERMATOZOA
SEXING
DAN
PERKEMBANGAN AWAL EMBRIO SECARA
IN VITRO
PADA SAPI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
PRAKATA
Puji syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan dengan baik. Tesis ini mengemukakan tentang kemampuan fertilisasi spermatozoa sapi sexing yang dipisahkan melalui metode gradien bovine serum albumin (BSA) serta kemampuannya mendukung perkembangan awal embrio in vitro.
Penulis mengucapkan terima kasih dan penghargaan yang tinggi kepada Prof Dr drh Mohamad Agus Setiadi dan drh Ni Wayan Kurniani Karja MP, PhD sebagai Ketua dan Anggota Komisi Pembimbing atas nasehat, arahan, koreksi, perhatian dan doa sehingga penulis dapat menyelesaikan rangkaian penelitian dan penulisan karya ilmiah ini dengan baik. Ucapan terima kasih disampaikan pula kepada Prof Dr drh Iman Supriatna selaku penguji luar komisi atas saran yang diberikan sehingga dapat memperkaya dan menyempurnakan substansi penulisan tesis.
Ucapan terima kasih disampaikan kepada Kementerian Riset, Teknologi dan Pendidikan Tinggi yang telah memberikan Beasiswa Program Fresh Graduate Pendidikan Pascasarjana Dalam Negeri (BPP-DN) Tahun Anggaran 2014. Ucapan terima kasih disampaikan pula kepada Lembaga Pengelola Dana Pendidikan (LPDP) Kementerian Keuangan yang telah memberikan dukungan dana penelitian melalui Program Beasiswa Tesis dan Disertasi Periode II Tahun 2016.
Penulis mengucapkan terima kasih kepada Dra. Mahriani, M.Si selaku Dosen Pembimbing di Universitas Jember atas segala doa, bimbingan, nasehat serta semangat sehingga penulis dapat menyelesaikan studi dengan baik. Penulis mengucapkan terima kasih kepada staf Rumah Potong Hewan (RPH) Bubulak Kotamadya Bogor atas penyediaan materi penelitian. Kepada Sdri. Magfira, Sdri. Yuli Danofa dan Gusti Agung P, penulis ucapkan terima kasih atas kontribusinya dalam penelitian ini. Kepada teman-teman Program Studi Biologi Reproduksi, penulis ucapkan terima kasih atas segala doa dan kerjasama yang terjalin dengan baik serta ucapan terima kasih kepada berbagai pihak yang tidak dapat disebutkan satu-persatu.
Ungkapan terima kasih mendalam disampaikan pula kepada Bapak, Ibu, Adik serta seluruh keluarga besar atas segala doa, kasih sayang serta dukungan moril dan materil yang tak hentinya diberikan kepada penulis.
Semoga karya ilmiah ini bermanfaat bagi pengembangan ilmu pengetahuan.
Bogor, Desember 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1 Kerangka Pemikiran 2 Tujuan Penelitian 2 Manfaat Penelitian 2 Hipotesis Penelitian 2 2 TINJAUAN PUSTAKA 3 Metode Sexing Spermatozoa 3
Mekanisme Fertilisasi 4
Perkembangan Embrio In Vitro 6
Bovine Serum Albumin (BSA) 7
3 BAHAN DAN METODE 8 Waktu dan Tempat Penelitian 8 Metode Penelitian 8 Penelitian I. Kemampuan Fertilisasi In Vitro Spermatozoa Sexing 8 Proses Sexing Spermatozoa Menggunakan Teknik Gradien BSA 8
Seleksi dan Maturasi Oosit In Vitro 9 Fertilisasi Oosit In Vitro 9 Evaluasi Tingkat Kemampuan Fertilisasi In Vitro 9 Penelitian II. Tingkat Perkembangan Awal Embrio In Vitro Menggunakan Spermatozoa Sexing 10
Seleksi, Maturasi dan Fertilisasi Oosit In Vitro 10
Kultur Embrio In Vitro 10
Evaluasi Tingkat Perkembangan Awal Embrio In Vitro 10
Analisa Data 10
4 HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 14
5 SIMPULAN DAN SARAN 17
DAFTAR PUSTAKA 18
LAMPIRAN 22
DAFTAR TABEL
1 Kualitas spermatozoa sapi sexing dan unsexing post thawing 11 2 Tingkat fertilisasi oosit in vitro menggunakan spermatozoa sexing 12 3 Tingkat pembelahan dan perkembangan embrio sapi yang diamati
secara morfologi pada hari kedua kultur in vitro 13 4 Tingkat perkembangan embrio sapi yang diamati secara
morfologi dan pewarnaan pada hari keempat kultur in vitro 14 5 Rekapitulasi persentase embrio yang berhasil melewati
blokade perkembangan 14
DAFTAR GAMBAR
1 Mekanisme aktivasi oosit oleh spermatozoa pada mekanisme fertilisasi 5
2 Pembentukan pronukleus (PN) 12
3 Embrio sapi tahap 2-32 sel yang diproduksi secara in vitro 13
DAFTAR LAMPIRAN
1 Komposisi medium transportasi ovarium 23
2 Komposisi medium koleksi oosit 23
3 Komposisi larutan PBS 23
4 Komposisi medium maturasi in vitro 24
5 Komposisi medium fertilisasi in vitro 24
6 Komposisi Medium Kultur in vitro Modified Synthetic
1
1 PENDAHULUAN
Latar Belakang
Spermatozoa sexing merupakan salah satu hasil teknologi reproduksi yang dinilai sebagai alternatif dalam upaya efisiensi reproduksi untuk menghasilkan anak dengan jenis kelamin sesuai keinginan. Aplikasi spermatozoa sexing telah diaplikasikan melalui inseminasi buatan (IB) dan transfer embrio dengan hasil yang bervariasi. Vazquez et al. (2003) melaporkan bahwa persentase tingkat kebuntingan pada babi melalui teknik IB menggunakan spermatozoa sexing mencapai 54% dan pada kuda 47,6% (Mari et al 2011); serta pada sapi mencapai 52% (Morotti et al. 2014). Lebih lanjut, Pellegrino et al. (2016) melaporkan bahwa keberhasilan kebuntingan melalui teknik transfer embrio sebesar 35,4%.
Teknik sexing spermatozoa dilakukan melalui pemisahan kromosom X dan Y berdasarkan perbedaan karakteristik morfologi, kandungan DNA, perbedaan protein makromolekul pada kedua kromosom serta perbedaan berat dan pergerakan spermatozoa (Yan et al. 2006). Diperkirakan kandungan DNA spermatozoa kromosom X adalah 3-5% lebih banyak dibandingkan dengan kromosom Y (Grant dan Chamley 2007; Sureka 2013). Berdasarkan kriteria tersebut, maka telah dikembangkan berbagai teknik pemisahan spermatozoa seperti metode flow cytometer (Blondin et al. 2009; Jo et al. 2014), metode gradien percoll (Machado et al. 2009; Villamil et al. 2012), serta metode gradien BSA. Metode sexing menggunakan gradien BSA dinilai efisien dan sederhana dibandingkan dengan metode-metode lainnya dan telah diterapkan pada berbagai spesies diantaranya untuk memisahkan spermatozoa domba (Maxwell et al. 1984); babi (Dixon et al. 1980); Hamster (Dow dan Bavister 1989). Teknik pemisahan spermatozoa dengan gradien BSA dianggap tidak memanipulasi spermatozoa secara berlebihan, selain itu spermatozoa dipaparkan pada medium BSA yang juga sering ditambahkan pada pengencer semen sehingga diharapkan mampu mencegah terjadinya penurunan kualitas spermatozoa setelah proses pemisahan.
Lebih lanjut dilaporkan oleh Dixon et al. (1980) bahwa motilitas spermatozoa hasil sexing mencapai 70%. Afiati (2004) menambahkan bahwa persentase spermatozoa hasil sexing gradien albumin diprediksi membawa kromosom X sebesar 80.88% dan Y sebesar 58.82% dengan motilitas sesudah proses sexing mencapai 75.00%. Sejalan dengan itu, Maxwell et al. (1984) juga melaporkan bahwa konsentrasi gradien BSA 6% dan 12% mampu menghasilkan spermatozoa sexing dengan motilitas yang lebih tinggi pada gradien bawah. Hasil penelitian Kaiin et al. (2008) menyatakan bahwa motilitas spermatozoa sexing gradien kolom BSA 5-10% sesudah thawing tidak berbeda dengan spermatozoa unsexing yaitu 45%. Persentase motilitas tersebut masih memenuhi syarat sesuai Standar Nasional Indonesia (SNI) untuk keperluan inseminasi buatan (IB).
Pembuktian lebih lanjut tentang kemampuan fertilisasi spermatozoa sexing dan kemampuannya dalam mendukung perkembangan embrio secara in vitro belum banyak dilaporkan di Indonesia. Data ini diperlukan untuk menjawab potensi kesuburan dan keakuratan spermatozoa hasil sexing secara tepat. Oleh karena itu
2
penelitian ini dilakukan untuk mengetahui kemampuan fertilisasi spermatozoa hasil
sexing dengan metode gradien BSA dalam mendukung kemampuan perkembangan
embrio secara in vitro.
Kerangka Pemikiran
Proses sexing spermatozoa metode gradien BSA didasarkan pada perbedaan kandungan DNA dan kecepatan spermatozoa kromosom X dan Y menembus gradien kolom BSA. Metode sexing gradien BSA mempunyai prinsip kerja yang sederhana sehingga diharapkan tidak menyebabkan terjadinya stres mekanik pada spermatozoa sesudah proses sexing. Motilitas yang baik dan keutuhan membran plasma spermatozoa sesudah proses sexing penting dipertahankan untuk mendukung keberhasilan proses penetrasi dan fusi spermatozoa dengan oosit. Spermatozoa harus mampu merespon sinyal oosit sehingga dapat berikatan dan menembus zona pelusida oosit melalui reseptor yang spesifik untuk keberhasilan proses fertilisasi. Keberhasilan proses sexing dinilai berdasarkan kemampuan spermatozoa sexing dalam memfertilisasi oosit dan mendukung perkembangan embrio lebih lanjut. Teknik fertilisasi dan produksi embrio in vitro dilakukan untuk mengetahui kemampuan fertilisasi spermatozoa sexing X dan Y serta kemampuan perkembangan awal embrio in vitro.
Tujuan Penelitian
Penelitian ini bertujuan mengkaji kemampuan fertilisasi dan perkembangan awal embrio sapi yang diproduksi menggunakan semen beku sexing X dan Y hasil pemisahan menggunakan gradien bovine serum albumin (BSA) secara in vitro.
Manfaat Penelitian
Manfaat penelitian ini adalah memberikan informasi mengenai kualitas spermatozoa sexing hasil pemisahan menggunakan gradien BSA serta efektivitas metode sexing tersebut berdasarkan kemampuan fertilisasi dan mendukung perkembangan embrio secara in vitro.
Hipotesis Penelitian
3
2 TINJAUAN PUSTAKA
Metode Sexing Spermatozoa
Spermatoza sexing merupakan hasil pemisahan berdasarkan perbedaan kromosom pada spermatozoa yaitu pembawa kromosom betina (X) dan kromosom jantan (Y). Beberapa jenis metode sexing yang telah dilakukan antara lain metode sedimentasi, albumin column, gradien BSA, sentrifugasi gradien percoll, elektroforesis, metode swim up, metode flow cytometry dan filtrasi dengan sephadex
column. Prinsip teknik sexing spermatozoa secara umum didasarkan pada perbedaan
karakteristik fisiologi spermatozoa seperti perubahan ion elektrik, perbedaan protein makromolekular serta perbedaan berat dan pergerakan spermatozoa sebagai pembeda kromosom X dan Y (Yan et al. 2006). Teknik sexing juga didasarkan pada perbedaan kandungan materi genetik yaitu spermatozoa kromosom X yang mempunyai materi genetik (DNA) 3-5% lebih banyak dibandingkan kromosom Y (Grant dan Chamley 2007; Kanesharatnam et al. 2012; Sureka et al. 2013). Teknik sexing spermatozoa menggunakan metode gradien BSA didasarkan pada perbedaan motilitas dan kecepatan bergerak antara spermatozoa X dan Y dalam menembus gradien pemisah larutan BSA. Spermatozoa pembawa kromosom Y mempunyai bentuk kepala yang lebih kecil dan ringan dibandingkan spermatozoa pembawa kromosom X sehingga dapat lebih mudah dan cepat bergerak.
Konsentrasi spermatozoa sesudah proses sexing lebih rendah dibandingkan sebelum dilakukan proses sexing. Hal ini disebabkan terdapat spermatozoa yang tertinggal di kolom serta terdapat pula spermatozoa yang ikut terbuang bersama medium sexing diantara fraksi atas dan bawah. Konsentrasi spermatozoa pada fraksi atas lebih besar dibandingkan fraksi bawah, hal ini menunjukkan bahwa spermatozoa yang bermigrasi menuju fraksi bawah semakin berkurang. Konsentrasi medium BSA pada fraksi bawah lebih tinggi serta dapat meningkatkan viskositas pengencer. Hal ini menyebabkan hanya spermatozoa dengan motilitas tinggi saja yang dapat menembus kolom gradien BSA. Maxwell et al. (1984) menyatakan bahwa faktor yang mempengaruhi keberhasilan proses sexing spermatozoa antara lain konsentrasi BSA yang digunakan sebagai gradien serta lama waktu spermatozoa menembus gradien BSA. Lebih lanjut dilaporkan bahwa proses sexing spermatozoa efektif pada konsentrasi BSA 6-12% dengan waktu pemisahan maksimal 2 jam.
4
Mekanisme Fertilisasi
Fertilisasi merupakan suatu proses kompleks penggabungan dari spermatozoa dan oosit sebagai indikator terbentuknya embrio (Gordon 2003). Proses tersebut terdiri dari beberapa tahapan yaitu perjalanan spermatozoa yang akan membuahi oosit, penetrasi spermatozoa menembus zona pelusida oosit, fusi antara spermatozoa dan membran plasma oosit serta terjadinya syngami yaitu pada saat genom kedua gamet bergabung membentuk genom embrio (Gardner et al. 2007). Fertilisasi diawali dengan proses pengenalan yang diduga melibatkan suatu protein tertentu pada spermatozoa dan oosit. Kemampuan fertilisasi spermatozoa pada kondisi in vitro dapat diketahui melalui teknik fertilisasi in vitro (FIV), Hal ini dikarenakan teknik tersebut mampu mengevaluasi interaksi antara spermatozoa dengan oosit yang terjadi seperti pada fertilisasi in vivo (Papadopoulos et al. 2005). Perubahan spermatozoa yang terjadi selama proses fertilisasi meliputi perubahan motilitas, kapasitasi, reaksi akrosom, penetrasi serta kemampuan fusi dengan oosit. Glikoprotein membran plasma spermatozoa mengalami perubahan selama terjadi proses kapasitasi. Hal tersebut terjadi agar spermatozoa dapat merespon sinyal dari oosit sehingga mampu mengikat dan menembus zona pelusida oosit melalui reseptor yang spesifik. Kegagalan fertilisasi terjadi karena kemampuan penetrasi spermatozoa menembus zona pelusida rendah (Plachot 2000).
5
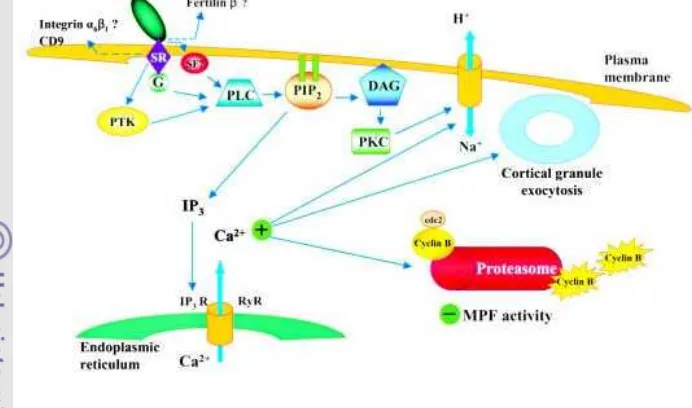
Gambar 1. Mekanisme aktivasi oosit oleh spermatozoa pada mekanisme fertilisasi (Alberio et al. 2001)
Spermatozoa sebagai aktivator menempel pada sperm reseptor (SR) yang terdapat pada permukaan membran plasma oosit. Ikatan spesifik antara keduanya dapat mengaktifkan protein G atau Protein Tyrosine Kinase (PTK) yang kemudian mengaktifkan phosphorilase C (PLC). PLC yang aktif menyebabkan terjadinya proses hidrolisis phosphatidylinositol 4,5-biphosphate (PIP2) pada membran plasma
dapat berjalan. Hidrolisis PIP2 menghasilkan diacylgliserol (DAG) dan inositol
1,4,5-triphosphate (IP3) yang meningkatkan konsentrasi Ca2+ melalui induksi terhadap
retikulum endoplasmik. Peningkatan Ca2+ menyebabkan terjadinya beberapa kejadian antara lain meningkatkan pH sehingga terjadi pertukaran Na+ dari luar sel dan H+ dari dalam oosit. Meningkatnya konsetrasi Ca2+ menyebabkan terjadinya dua hal yaitu pelepasan kortikal granula yang berisi enzim dan glikoprotein kedalam ruang perivitelin oosit yang kemudian mengubah kondisi zona pelusida menjadi keras untuk mencegah polispermia serta inisiasi berlanjutnya siklus pembelahan meiosis sel yang ditandai dengan menurunnya aktivitas maturation promoting factor (MPF) (Alberio
et al. 2001; Jones 2007).
6
dapat mempengaruhi fluktuasi Ca2+. Faktor kedua yaitu faktor dari oosit yang berhubungan dengan keberadaan IP3 dan reseptornya yang berfungsi mengatur
keluarnya Ca2+ (Jones 2007). Penetrasi spermatozoa ke dalam oosit menyebabkan oosit kembali mengalami pembelahan meiosis II. Konsentrasi cytostatic factor (CSF) yang terkandung dalam oosit mengalami penurunan setelah penetrasi spermatozoa dan oosit akan memasuki fase interfase kemudian mengeluarkan badan kutub II dan membentuk pronukleus. Inisiasi pembentukan pronukleus terjadi sesudah penetrasi spermatozoa, pada sapi hal ini terjadi pada 4-6 jam sesudah penetrasi spermatozoa (Alberio et al. 2001).
Mekanisme fertilisasi in vitro pada umumnya dilakukan pada medium yang mempunyai komposisi menyerupai kondisi di dalam uterus dan oviduk. Fungsi utama dari medium tersebut adalah mendukung proses kapasitasi spermatozoa dan pematangan oosit serta penentuan oosit yang mempunyai kompetensi perkembangannya untuk fertilisasi. Hal tersebut perlu diperhatikan karena proses fertilisasi in vitro hanya dapat terjadi apabila spermatozoa tersebut telah mengalami proses kapasitasi. Glikoprotein dalam membran plasma spermatozoa mengalami perubahan selama proses kapasitasi agar dapat merespon sinyal dari oosit sehingga memiliki kemampuan menembus zona pelusida yang mengelilingi oosit melalui reseptor yang spesifik yang terdapat pada membran plasma. Kapasitasi merupakan suatu proses perubahan fisiologis spermatozoa didalam saluran reproduksi betina agar dapat meningkatkan daya fertilisasi. Proses kapasitasi ditandai dengan terjadinya perubahan morfologi spermatozoa serta mekanisme metabolismenya yang berkaitan dengan kemampuan spermatozoa dalam melakukan fusi dan berikatan dengan oosit sebagai faktor penentu keberhasilan fertilisasi (Elder dan Dale 2003).
Perkembangan Embrio In Vitro
Kultur embrio in vitro merupakan tahapan akhir dalam penerapan teknologi produksi embrio in vitro sesudah tahapan fertilisasi dan pematangan oosit. Zigot yang terbentuk dari hasil fertilisasi in vitro mengalami perkembangan dan pembelahan dalam beberapa stadium awal mulai dari 2-32 sel sampai membentuk morula dan blastosis. Blastosis umumnya dapat terbentuk dari embrio yang mencapai tahapan 8 sel pada 48 jam sesudah fertilisasi (Boediono et al. 2003). Persentase zigot yang dapat berkembang mencapai tahap blastosis selama kultur adalah berkisar 30-40% (Rizos et al. 2002). Faktor utama yang berpengaruh terhadap kemampuan perkembangan embrio adalah kualitas oosit serta medium kultur yang digunakan (Lonergan et al. 2004; Nedambale et al. 2006). Upaya yang dapat dilakukan agar kualitas embrio yang dihasilkan baik serta meningkatkan efisiensi sistem produksi embrio in vitro antara lain adalah dengan penggunaan medium dan sistem kultur yang sesuai serta melakukan kultur embrio dalam kelompok besar. Hal ini disebabkan kemampuan perkembangan embrio akan lebih baik apabila dikultur secara kelompok yaitu 20 embrio dalam 500 µL media kultur (Khurana dan Niemann 2000).
7
perkembangan embrio. Kultur embrio harus dilakukan dalam kondisi CO2 5% agar
sel dapat tumbuh dan membelah secara normal. Salah satu komposisi dalam medium kultur yang berperan penting dalam mendukung perkembangan embrio adalah asam amino. Asam amino berperan penting sebagai regulator pada awal perkembangan embrio. Penambahan asam amino non esensial dapat meningkatkan perkembangan embrio mencapai tahap 8-16 sel dan blastosis. Glutamin yang ditambahkan kedalam medium kultur mampu bersinergi dengan asam amino non esensial. Glutamin berfungsi sebagai sumber energi dan mengatur osmolaritas medium. Efek negatif dari asam amino dalam medium kultur adalah dapat meningkatkan level amonium sehingga menghambat perkembangan dan pembelahan embrio (Elder dan Dale 2003).
Embrio bersifat rentan terhadap stres in vitro, beberapa hal yang menjadi penyebab stres embrio antara lain formulasi dan suplementasi medium kultur yang kurang tepat serta terjadinya permasalahan dalam sistem kultur. Efek jangka pendek terjadinya stres embrio in vitro adalah terjadinya perubahan morfologi, proliferasi dan apoptosis sel. Asam amino dalam medium dapat menyebabkan terjadinya peningkatan fragmentasi sitoplasma pada embrio domba sehingga medium kultur embrio harus diganti dengan medium baru setiap 48-72 jam (Gardner et al. 1994). Perkembangan embrio pada tahapan awal sering kali terdapat beberapa hambatan, embrio sapi dan domba seringkali mengalami hambatan pembelahan pada 8 sel (Gordon 2003). Sumber energi berupa glukosa yang terkandung dalam medium kultur bersama dengan piruvat dan laktat berfungsi untuk mendukung perkembangan embrio hingga mencapai tahapan blastosis. Metabolisme glukosa rendah pada saat awal perkembangan embrio atau tahap preimplantasi, selanjutnya mengalami peningkatan sesudah tahap 8-16 sel. Hal ini berkaitan erat dengan mekanisme aktivasi genom embrionik (Goeseels dan Panich 2002; Meirelles et al. 2004). Titik kritis perkembangan embrio pada saat umumnya terjadi pada tahapan pembelahan 8 sel. Embrio yang belum mengalami aktivasi genom maka aktivitas sintesa protein dan ekspresi gen bergantung pada maternal sampai terjadi proses aktivasi genom dan embrio mampu melakukan transkripsi protein sendiri sesuai dengan tahapan perkembangannya. Embrio yang gagal melakukan transkripsi genomnya sendiri akan mengalami kegagalan dalam perkembangannya (Meirelles et al. 2004; Young dan Beaujean 2004).
Bovine Serum Albumin (BSA)
Bovine serum albumin mempunyai peran fisiologis yang penting untuk
mendukung perkembangan embrio. Bovine serum albumin mengandung asam amino, vitamin, asam lemak, hormon, bersifat sebagai surfaktan serta dapat berperan sebagai media transportasi zat nutrisi antar molekul (Blake et al. 2002). Albumin merupakan makromolekul, memiliki permukaan sel yang luas dan bersifat mengikat. Francis (2010) menyatakan bahwa albumin merupakan molekul yang mampu berikatan dengan ligan, antara lain lemak, ion logam dan asam amino yang selanjutnya ditransportasikan ke dalam sel dan meningkatkan pertumbuhan sel. Bovine serum
albumin secara umum merupakan salah satu komponen medium kultur. Hal ini
8
Penambahan BSA mampu mencukupi komponen steroid, vitamin, asam lemak serta kolesterol (Wrenzycki et al. 2001).
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Ovarium diperoleh dari Rumah Potong Hewan (RPH) Bubulak, Kotamadya Bogor. Penelitian dilaksanakan di Laboratorium In Vitro Fertilization (IVF), Bagian Reproduksi dan Kebidanan, Departemen Klinik Reproduksi dan Patologi, Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Penelitian ini berlangsung dari bulan Maret hingga dengan Juni 2016.
Metode Penelitian
Penelitian I. Kemampuan Fertilisasi In Vitro Spermatozoa Sexing
a. Proses Sexing Spermatozoa Menggunakan Teknik Gradien BSA
Spermatozoa sexing yang digunakan dalam penelitian diperoleh dari Balai Besar Inseminasi Buatan (BBIB) Lembang, Bandung. Prosedur sexing berikut mengacu pada BBIB Lembang yaitu menggunakan gradien Bovine Serum Albumin (BSA) dengan persentase 5% dan 10%. BSA dengan kandungan 5% dan 10% serta medium sexing disiapkan kemudian disimpan di dalam water bath. Semen segar hasil koleksi diencerkan dengan medium sexing, kemudian sebanyak 1 mL semen yang telah diencerkan ditempatkan di atas kolom BSA 5% dan 10% dalam tabung-tabung yang sebelumnya telah disimpan dalam water bath. Spermatozoa selanjutnya didiamkan selama 45 menit sampai terbentuk tiga lapisan. Lapisan paling atas diambil sebanyak 1 mL kemudian dibuang. Lapisan tengah merupakan lapisan yang diprediksi sebagai spermatozoa X sedangkan lapisan paling bawah merupakan spermatozoa Y. Lapisan tengah dan lapisan bawah pada masing masing tabung kemudian digabung menjadi satu pada tabung baru. Masing-masing ditambahkan dengan medium sexing untuk pencucian menggunakan sentrifus selama 10 menit dengan kecepatan 1800 rpm dan suhu 25oC. Spermatozoa X dan Y yang telah dicuci selanjutnya ditambah dengan pengencer ± 1 mL dan dilakukan evaluasi. Evaluasi pada masing-masing jenis spermatozoa meliputi motilitas, viabilitas, konsentrasi dan evaluasi membran plasma utuh (MPU). Spermatozoa yang sudah dievaluasi dan dilakukan perhitungan volume akhir serta jumlah straw selanjutnya dikemas dalam
straw kemudian dilakukan equilibrasi di dalam cool top selanjutnya disimpan di
9
b. Seleksi dan Maturasi Oosit In Vitro
Ovarium ditransportasikan dari RPH menuju Laboratorium menggunakan larutan NaCl 0.9% ditambahkan 100 IU/mL Penisilin (Sigma-Aldrich, St. Louis, MO, USA) dan 0.1 mg/mL Streptomisin (Sigma-Aldrich). Koleksi oosit dilakukan dengan teknik pencacahan dan pembilasan (slicing dan flushing) menggunakan Phosphate
Buffer Saline (PBS) yang mengandung 5% Fetal Bovine Serum (FBS).
Seleksi oosit dilakukan dibawah mikroskop stereo berdasarkan kekompakan sel kumulus dan homogenitas sitoplasma. Oosit dimatangkan pada Tissue Culture
Medium (TCM) 199 (Sigma, USA) yang disuplementasi dengan 10%FBS, 10 IU/mL
Pregnant Mare Serum Gonadotrophin (PMSG) (Intergonan, Intervet Deutschland
GmbH), 10 IU/mL Human Chorionic Gonadotrophin (hCG) (Chorulon, intervet international B.V. Boxmeer- Holand) dan 50 µ g/mL Gentamisin (Sigma-Aldrich). Medium dibuat dalam bentuk drop (100 µ L) yang ditutup menggunakan mineral oil (Sigma-Aldrich. Inc, M-8410) dalam petridish steril (Nunclon, Denmark) untuk 10 hingga 15 oosit. Pematangan oosit dilakukan dalam inkubator 5% CO2 suhu 39 oC
selama 24 jam.
c. Fertilisasi Oosit In Vitro
Fertilisasi in vitro dilakukan menggunakan spermatozoa unsexing sebagai kontrol serta spermatozoa sexing X dan Y sebagai perlakuan. Thawing straw semen beku dilakukan pada air suhu 37oC selama 30 detik. Semen ditempatkan pada tabung yang berisi medium fertilisasi untuk menghilangkan pengencer melalui sentrifugasi dengan kecepatan 700 g selama 8 menit. Selanjutnya bagian supernatan dibuang dan endapan spermatozoa diencerkan menggunakan medium fertilisasi dengan konsentrasi akhir 2x106 spermatozoa/mL (Lopez et al. 2013; Muttaqin et al. 2015). Medium fertilisasi yang berisi spermatozoa tersebut dibuat dalam bentuk drop (100 µl) untuk 10 hingga 15 oosit. Oosit yang telah dimaturasi dipindahkan ke dalam drop medium fertilisasi sesuai perlakuan (spermatozoa sexing X (X), sexing Y (Y) dan Kontrol) setelah dilakukan pencucian terlebih dahulu. Inkubasi oosit dan spermatozoa dilakukan selama 14 jam dalam inkubator CO2 5% dengan suhu 39 oC.
d. Evaluasi Tingkat Kemampuan Fertilisasi In Vitro
10
Penelitian II. Tingkat Perkembangan Awal Embrio In Vitro Menggunakan Spermatozoa Sexing
a. Seleksi, Maturasi dan Fertilisasi Oosit In Vitro
Proses seleksi, maturasi dan fertilisasi oosit in vitro dilakukan seperti prosedur penelitian I.
b. Kultur Embrio In Vitro
Oosit hasil fertilisasi didenudasi sebagian kumulusnya kemudian dipindahkan dalam drop medium kultur setelah dilakukan pencucian terlebih dahulu. Medium kultur yang digunakan adalah Modified Synthetic Oviduct Fluid (mSOF) yang disuplementasi dengan 1% Minimum Essential Medium (MEM) (Sigma, M-7145),
2% Basal Medium Eagle (BME) (Sigma, B-6766), 50 µg/mL Gentamisin
(Sigma-Aldrich) dan BSA 0,3%. Medium kultur dibuat dalam bentuk drop (100 µ L) untuk 10 hingga 15 oosit dalam petridish steril (Nunclon, Denmark) dan ditutup dengan mineral oil (Sigma-Aldrich.Inc, M-8410). Kultur dilakukan selama 96 jam dalam inkubator CO2 5% suhu 39 oC.
c. Evaluasi Tingkat Perkembangan Awal Embrio In Vitro
Pengamatan perkembangan embrio dilakukan pada hari kedua (jam ke 48) dan hari keempat (jam ke 96) kultur dibawah mikroskop (Olympus IX 70, Japan) untuk melihat stadium perkembangan embrio. Pewarnaan Aceto Orcein 2% dilakukan sebagai pembuktian jumlah sel embrio yang terbentuk, Teknik pembuatan preparat dan pewarnaan dilakukan sama seperti evaluasi pada penelitian I kemudian diamati di bawah mikroskop fase kontras (Olympus IX 70, Japan). Persentase tingkat pembelahan embrio merupakan perbandingan antara jumlah oosit yang membelah dengan keseluruhan jumlah oosit yang diduga telah dibuahi.
Analisa Data
11
4 HASIL DAN PEMBAHASAN
HASIL
Evaluasi Kualitas Spermatozoa Post Thawing
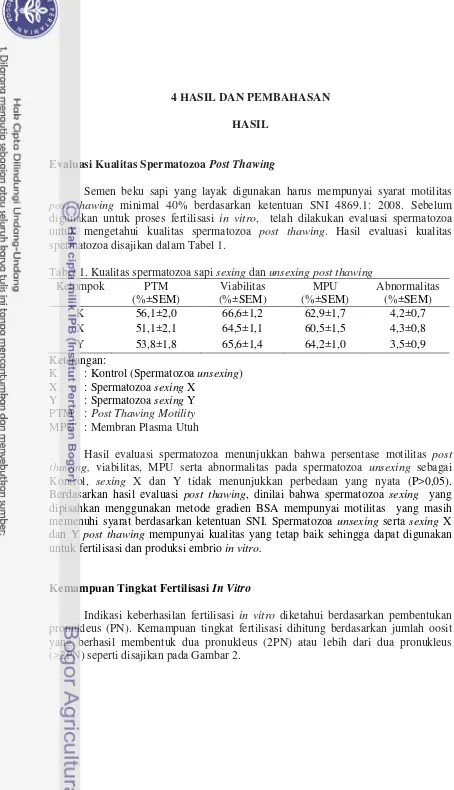
Semen beku sapi yang layak digunakan harus mempunyai syarat motilitas
post thawing minimal 40% berdasarkan ketentuan SNI 4869.1: 2008. Sebelum digunakan untuk proses fertilisasi in vitro, telah dilakukan evaluasi spermatozoa untuk mengetahui kualitas spermatozoa post thawing. Hasil evaluasi kualitas spermatozoa disajikan dalam Tabel 1.
Tabel 1. Kualitas spermatozoa sapi sexing dan unsexing post thawing
Kelompok PTM
K : Kontrol (Spermatozoa unsexing) X : Spermatozoa sexing X
Y : Spermatozoa sexing Y
PTM : Post Thawing Motility
MPU : Membran Plasma Utuh
Hasil evaluasi spermatozoa menunjukkan bahwa persentase motilitas post thawing, viabilitas, MPU serta abnormalitas pada spermatozoa unsexing sebagai Kontrol, sexing X dan Y tidak menunjukkan perbedaan yang nyata (P>0,05). Berdasarkan hasil evaluasi post thawing, dinilai bahwa spermatozoa sexing yang dipisahkan menggunakan metode gradien BSA mempunyai motilitas yang masih memenuhi syarat berdasarkan ketentuan SNI. Spermatozoa unsexing serta sexing X dan Y post thawing mempunyai kualitas yang tetap baik sehingga dapat digunakan untuk fertilisasi dan produksi embrio in vitro.
Kemampuan Tingkat Fertilisasi In Vitro
12 perbedaan yang nyata (P> berturut-turut Kontrol, X da
pronukleus (PN). A. Oosit dengan dua pronukl ebih dari dua pronukleus (>2PN) (Tanda panah
kemampuan spermatozoa sexing serta (PN) disajikan pada Tabel 2. Hasil penelitian isasi spermatozoa sexing tidak menunjukkan pe gkan dengan kontrol, persentase tingkat fertili dan 53,4% untuk spermatozoa sexing X, Y n pengamatan pronukleus, tingkat fertilisasi knya 2PN pada spermatozoa sexing juga tidak P>0,05) dibandingkan dengan Kontrol denga dan Y yaitu 52,3%, 46,4% dan 48,0%.
Tingkat Perkembang
angan Awal Embrio In Vitro
n perkembangan embrio secara in vi X dan Y hasil pemisahan gradien BSA diten yang membelah. Stadium pembelahan embrio
ra in vitro disajikan dalam Gambar 3.
sapi tahap 2-32 sel yang diproduksi secara ahan 2 sel; B. 4 sel; C. 8 sel; D. 16 sel dan E.
itian menunjukkan bahwa kemampuan perkemb yang diproduksi secara in vitro menggunakan an perbedaan yang nyata (P>0,05) dibandingk an 54,4%). Tingkat pembelahan dan perkemba mpat kultur disajikan pada Tabel 3 dan 4.
mbelahan dan perkembangan embrio sapi yang
41(48,2± 2,8) 14(32,6 ±10,1) 20(49,3±8,6
14
Tabel 4. Tingkat perkembangan embrio sapi yang diamati secara morfologi dan pewarnaan pada hari keempat kultur in vitro
Kel. Perkembangan awal embrio n (% ± SEM)
K : Kontrol (Spermatozoa unsexing) X : Spermatozoa sexing X
Y : Spermatozoa sexing Y
Lebih lanjut, berdasarkan keseluruhan jumlah embrio yang berhasil membelah diketahui bahwa persentase embrio yang mampu melewati blokade perkembangan (stadium pembelahan 16 hingga 32 sel) tidak menunjukkan perbedaan yang nyata (P>0,05) pada ketiga perlakuan sexing X, Y dan Kontrol (23,8%; 26,0% dan 23,6%). Rekapitulasi persentase embrio yang berhasil melewati blokade perkembangan disajikan pada Tabel 5.
Tabel 5. Rekapitulasi persentase embrio yang berhasil melewati blokade perkembangan
Kelompok Tingkat pembelahan embrio 16 s/d 32 sel (% ± SEM)
K 23,6± 9,2
X 23,8± 11,0
Y 26,0± 4,5 Keterangan:
K : Kontrol (Spermatozoa unsexing) X : Spermatozoa sexing X
Y : Spermatozoa sexing Y
PEMBAHASAN
Kemampuan Tingkat Fertilisasi In Vitro
Indikator keberhasilan fertilisasi in vitro diketahui berdasarkan kemampuan pembentukan pronukleus (PN). Hasil penelitian menunjukkan bahwa spermatozoa
sexing masih memiliki kemampuan memfertilisasi oosit yang sama dengan
15
proses fertilisasi yaitu kemampuan spermatozoa menembus zona pelusida (ZP), kemampuan membentuk pronukleus serta mendukung perkembangan embrio. Integritas membran plasma dan akrosom spermatozoa penting diperlukan untuk mendukung keberhasilan proses fertilisasi. Spermatozoa dengan membran plasma rusak maka tidak memiliki kemampuan berikatan dengan ZP (zona binding). Hal ini disebabkan hilangnya reseptor pada membran yang berfungsi untuk mengikat zona pelusida (Ducha et al. 2012) serta kemampuan perkembangan embrio (Okabe 2013). Integritas membran spermatozoa penting diperlukan karena komponen seperti protein, phospholipid, kolesterol serta beberapa komponen lain berfungsi melindungi dan menjaga kestabilan membran plasma serta mencegah terjadinya kapasitasi dini dan reaksi akrosom (Carvalho et al. 2014). Salah satu faktor yang mendukung keberhasilan fertilisasi dinilai berdasarkan kemampuan motilitas post thawing spermatozoa. Maxwell et al. (1984) dan Kaiin et al. (2008) melaporkan bahwa proses
sexing menggunakan BSA mampu mempertahankan motilitas spermatozoa sexing
post thawing masing-masing sebesar 49% dan 45%. Persentase motilitas tersebut
masih memenuhi SNI untuk keperluan inseminasi buatan, yaitu sesuai dengan SNI 4869.1:2008 bahwa semen beku sapi yang digunakan untuk inseminasi buatan harus mempunyai motilitas post thawing minimal 40% (Direktorat Pembibitan dan Produksi Ternak 2015).
16
akrosom. Konsentrasi ion Ca2+ intraseluler yang tinggi diperlukan untuk meningkatkan fosforilasi protein tirosin yang memicu pergerakan flagellum spermatozoa. Namun konsentrasi ion Ca2+ yang tinggi pada periode yang lama sebelum terjadi fertilisasi tidak diharapkan karena menyebabkan kematian spermatozoa.
Tingkat Perkembangan Awal Embrio In Vitro
Keberhasilan perkembangan embrio secara in vitro menggunakan spermatozoa sexing X dan Y hasil pemisahan gradien BSA ditentukan berdasarkan persentase embrio yang membelah. Kemampuan perkembangan embrio tersebut mengindikasikan bahwa spermatozoa sexing yang digunakan mempunyai daya fertilisasi yang baik. Hasil penelitian ini didukung oleh laporan Underwood et al. (2010a) bahwa proses sexing spermatozoa secara umum tidak menyebabkan terjadinya penurunan perkembangan embrio.
Keberhasilan perkembangan oosit yang telah difertilisasi ditentukan berdasarkan kemampuannya untuk membelah dan melanjutkan perkembangan. Inisiasi perkembangan awal embrio didukung oleh ketersediaan mRNA dan aktivitas transkripsi oleh maternal sebelum aktivasi genom dimulai. Goeseels dan Panich (2002) menyatakan bahwa aktivasi genom pada embrio sapi dimulai pada stadium pembelahan 8-16 sel sedangkan Meirelles et al. (2004) menyatakan bahwa aktivasi genom dimulai pada stadium 8 sel. Elder dan Dale (2003) menambahkan bahwa sintesis protein baru sebagai penanda dimulainya aktivasi genom pada embrio sapi terjadi pada stadium pembelahan 4-8 sel. Transisi dari maternal ke embrio ditandai dengan aktifnya transkripsi oleh genom embrio karena mRNA maternal dan protein yang tersimpan pada oosit mengalami degradasi (Gandolfi dan Gandolfi 2000; Graf et al. 2014). Apabila terjadi kegagalan proses tersebut maka menyebabkan hambatan ekspresi gen sehingga embrio tidak mampu mengalami pembelahan lebih lanjut (Betts dan King 2001). Selama masa transisi tersebut, nukleus memprogram aktivasi proses transkripsi oleh genom embrio yang sebelumnya mengalami inaktivasi. Keberhasilan aktivasi genom ditandai dengan kemampuan embrio melakukan transkripsi mRNA serta tidak lagi bergantung pada maternal genom (Graf et al. 2014). Mengacu pada uraian diatas, hasil penelitian menunjukkan bahwa persentase embrio yang mampu melewati blokade perkembangan (stadium pembelahan 16-32 sel) menunjukkan perbedaan yang tidak nyata (P>0,05) (Tabel 4) pada ketiga perlakuan. Data tersebut menunjukkan hanya sekitar 23-26% embrio yang mampu melewati blokade perkembangan dari keseluruhan embrio yang berhasil membelah sehingga diharapkan mampu berkembang ke tahap blastosis.
17
dikoleksi dari ovarium yang pada umumnya berasal dari individu yang berbeda, sehingga terjadi variasi kemampuan untuk berkembang menjadi embrio lebih lanjut. Oleh karena itu diperlukan kemampuan teknik pemilihan oosit yang lebih cermat sehingga mampu menghasilkan embrio dengan kualitas baik agar mampu melakukan aktivasi genom untuk mendukung perkembangan dan kelangsungan hidupnya (Meirelles et al. 2004).
5 SIMPULAN DAN SARAN
Berdasarkan hasil penelitian dapat disimpulkan bahwa spermatozoa sexing metode gradien BSA mempunyai kemampuan fertilisasi dan mendukung perkembangan embrio yang sama dengan spermatozoa unsexing. Sebagai saran,
18
DAFTAR PUSTAKA
Afiati F. 2004. Proporsi dan karakteristik spermatozoa X dan Y hasil separasi kolom albumin. Media petern. 27(1):16-20.
Alberio R, Zakhartchenko V, Motlik J, Wolf E. 2001. Mammalian oocyte activation: lessons from the sperm and implication for nuclear transfer. Int J Dev Biol.
Boediono A, Suzuki T, Godke R. 2003. Comparison of hybrid and purebred in vitro-derived cattle embryos during in vitro culture. Anim Reprod Sci. 78:1-11. Breitbart H. 2003. Signaling pathways in sperm capacitation and acrosome reaction.
Cell Mol Biol . 49(3):1-7.
Carvalho JO, Sartori R, Machado GM, GB Mourao, MA Dode. 2010. Quality assessment of bovine cryopreserved sperm after sexing by flow cytometry and their use in in vitro embryo production. Theriogenology. 74:1521-1530.
Dixon KE, Songy EA Jr, Thrasher DM. 1980. Effect of bovine serum albumin on the isolation of boar spermatozoa and their fertility. Theriogenology. 13(6):437-444.
Direktorat Perbibitan dan Produksi Ternak. 2015. Standar Nasional Indonesia (SNI): Semen beku sapi [Internet][diunduh 2016 Okt 28]. Tersedia pada: http//www.bibit.ditjennak.pertanian.go.id.
Dow MP, Bavister BD. 1989. Direct contact is required between serum albumin and hamster spermatozoa for capacitation in vitro. Gamete Res. 23:171-180.
Ducha N, Susilawati T, Aulanni’am, Sri Wahyuningsih, Pangestu M. 2012. Ultrastructure and Fertilizing Ability of Limousin Bull Sperm After Storage in CEP 2 Extender with and without Egg Yolk. Pak. J Biol Sci. 15 (20):979-985. Elder K, Dale B. 2003. In Vitro Fertilization 2nd ed. USA: Cambridge University
Press.
Francis GL. 2010. Albumin and mammalian cell culture: implications for biotechnology applications. Cytotechnology. 62:1-16.
Gandolfi TAIB, Gandolfi F. 2000. The Maternal Legacy to The Embryo: Cytoplasmic Components and Their Effects on Early Development.
Theriogenology. 55:1255-1278.
19
Gardner AJ, Williams CJ, Evans JP. 2007. Establishment of the mammalian membrane block to polyspermy: evidence for calcium-dependent and independent regulation. Reproduction. 133:383–393.
Graf A, Krebs S, Heininen-Brown M, Zakhartchenko V, Blum H, Wolf E. 2014. Genom activation in bovine embryos: review of the literature and new insights from RNA sequencing experiment. Anim Reprod Sci. 149:46-58.
Grant VJ, Chamley LW. 2007. Sex sorted sperm and fertility: An alternative view.
Biol reprod. 76:184-188.
Goeseels SB, P Panich. 2002. Effects of oocyte quality on development and transcriptional activity in early bovine embryos. Anim Reprod Sci. 71:143-155. Gordon I. 2003. Laboratory Production of Cattle Embryos: 2nd edition. London
(GB): CABI publishing.
Jo HT, Bang JI, Kim SS, Choi BH, Jin JI, Kim HL, Jung IS, Suh TK, Ghanem N, Wang Z, Kong IK. 2014. Production of female bovine embryos with sex-sorted sperm using intracytoplasmic sperm injection: Efficiency and in vitro developmental competence. Theriogenology. 81:675-682.
Jones KT. 2007. Intracellular calcium in the fertilization and development of mammalian eggs. Proc Aust Phys Soc. 38:35-41.
Kaiin EM, Said S, Tappa B. 2008. Kelahiran anak sapi hasil fertilisasi secara in vitro dengan sperma hasil pemisahan. Media Petern. 31(1):22-28.
Kanesharatnam N, Eswaramohan T, Balasubramaniam K. 2012. Fractionation of X anf Y chromosome bearing bovine spermatozoa through sugar gradients for sex predermination in dairy cattle. Int J Biosci Biochem Bioinforma. 2(3):203-206. Khurana NK, Niemann H. 2000. Effects of oocyte quality, oxygen tension, embryo
density, cumulus cells and energy substrates on cleavage and morula/blastocyst formation of bovine embryos. Theriogenology. 54 (5):741-756.
Lonergan P, HG Pedersen, D Rizos, T Greve, PD Thomsen, T Fair, A Evans, MP oland. 2004. Effect of post fertilization culture environment on incidence of chromosome abberation bovine blastocyst. Biol Reprod. 71:1096-1100.
Lonergan P, Fair T. 2008. In vitro produced bovine embryos- Dealing with the warts.
Theriogenology. 69:17-22.
Lopez SR, Souza JCd, Gonzalez JZ, AD Sanchez, JR Aguirregomezcorta, RR.de Carvalho, Rath D. 2013. Use of sex sorted and unsorted frozen/thawed sperm
and in vitro fertilization events in bovine oocytes derived from
ultrasound-guided aspiration. J R Bras Zootec. 42(10):721-727.
Machado GM, Carvalho JO, Filho ES, Caixeta ES, Franco MM, Rumpf R, Dode MAN. 2009. Effect of percoll volume, duration and force of centrifugation, on in vitro production and sex ratio of bovine embryos. Theriogenology. 71:1289-1297.
Mari G, Catagnetti C, Rizzato G, Mislei B, Lacono E, Merio B. 2011. Density gradient centrifugation of sperm from subfertile stallion and effect on seminal plasma addition on fertility. Anim Reprod Sci. 126:96-100.
20
Meirelles FV, AR Caetano, YF Watanabe, P Ripamonte, SF Carambula, GK Merighe, SM Garcia. 2004. Genome activation and developmental block in bovine embryos. Anim Reprod Sci. 82-83:13-20.
Morotti F, Sanches BV, Pontes JHF, Basso AC, Siqueira ER, Lisboa LA. 2014. Pregnancy rate and birth rate of calves from a large-scale IVF program using reverse-sorted semen in Bos indicus, Bos indicus-taurus and Bos taurus cattle.
Theriogenology. 81:696:701.
Muttaqin Z, Karja NWK, Setiadi MA. 2015. Kemampuan maturasi dan fetilisasi oosit sapi yang diseleksi menggunakan teknik pewarnaan Brilliant Cresyl Blue. J
Veteriner. 16(2):242-248.
Nedambale TL, F. Du, X. Yang, XC Tian. 2006. Higher survival rate of vitrified and thawed in vitro produced blastocysts following culture in defined medium supplemented with β-mercaptoethanol. Anim Reprod Sci. 93:61-75.
Okabe M. 2013. The cell biology of mammalian fertilization. The Company of
Biologists. 140:4471-4479.
Papadopoulos S, Hanrahan JP, Donovan A, P Duffy, MP Boland, P Lonergan. 2005. In vitro fertilization as a predictor of fertility from cervical insemination of sheep. Theriogenology. 63:150–159.
Pellegrino CAG, Morotti F, Untura RM, Pontes JHF, Pellegrino MFO, Campolina JP, Seneda MM, Barsosa FA, Henry M. 2016. Use of sexed sorted semen for fixed time artificial insemination or fixed tima embryo transfer of in vitro produced embryos in cattle. Theriogenology. xxx:1-6.
Plachot M. 2000. Fertilization. Human Reprod. 15 (4):19-30
Rizos D, Ward F, Duffy P, Boland MP, Lonergan P. 2002. Consequences of bovine oocyte maturation, fertilization or early embryo development in vitro versus in vivo: implications for blastocyst yield and blastocyst quality. Mol Reprod Dev. 61:234-248.
Setiadi MA, Karja NWK. 2013. Tingkat perkembangan awal embrio sapi in vitro menggunakan media tunggal berbahan dasar tissue culture medium (TCM) 1999. J Kedokteran Hewan. 7(2):150-154.
Steel RGD, Torrie JH. 1993. Prinsip dan Prosedur Statistika: Suatu Pendekatan
Biometrik. Penerjemah: B. Sumantri. Jakarta (ID): Gramedia Pustaka.
Sureka P, Nilani K, Eswaramohan T, Balasubramaniam K. 2013. Sex pre-selection by quantification of Y chromosome bearing spermatozoa in goat species. IJSRP. 3(1):1-4.
Toth S, Huneau D, Banrezes B, Ozil J. 2006. Egg activation is the result of calcium signal summation in the mouse. Reproduction. 131:27-34.
Underwood SL, Bathgate R, Maxwell WMC, Evans G. 2010a. Birth of offspring after artificial insemination of heifers with frozen thawed, sex sorted, refrozen thawed bull sperm. Anim Reprod Sci. 118:171–175.
21
Vazquez JM, Martinez EA, Parrilla I, Roca J, Gil MA, Vazquez JL. 2003. Birth of piglets after deep intrauterine insemination with flow cytometrically sorted boar spermatozoa. Theriogenology. 59:1605-1614.
Villamil PR, Wei H, Moreira G, Caccia M, Taranco MF, Bo GA. 2012. Fertilization rate and in vitro embryo production using sexed or non sexed semen selected with silane-coated silica colloid or percoll. Theriogenology. 78:165-171.
Visconti PE, Ning XP, Fornes MW, Alvarez JG, Stein P, Connors SA, Kopf GS. 1999. Cholesterol efflux mediated signal transduction in mammalian sperm: Cholesterol release signal and increase in protein tyrosine phosphorylation during mouse sperm capacitation. Dev. Biol. 214:429-443.
Wrenzycki C, Herrmann D, Keskintepe L, Martins JrA, Sirisathien S, Brackett B, Niemann H. 2001. Effects of culture system and protein supplementation on mRNA expression in pre implantation bovine embryos. Hum Reprod. 16(5): 893-901.
Yan J, Feng HL,Chen ZJ, Jingmei H, Xuan G,Yingying Q. 2006. Influence of swim-up on the ratio of X and Y bearing spermatozoa. Eur J Obstet Gynaecol Reprod
Biol. 129:150-154.
22
LAMPIRAN
23
Lampiran 1. Komposisi Medium Transportasi Ovarium
Bahan Jumlah
NaCl fisiologis 0,9% 1000 mL
Penisilin (100 IU/mL) dan streptomisin 1000 µ L
Lampiran 2. Komposisi Medium Koleksi Oosit
Bahan Jumlah
Larutan PBS 95% 95 mL
Fetal Bovine Serum (FBS) 5% (v/v) 5 mL
Penisilin (100 IU/mL) dan Streptomisin 100 µL
Total 100 mL
Stock penicillin dan streptomycin:
a. Dosis penicillin G (Sigma-Aldrich, St. Louis, MO, USA) : 0,06 g/L b. Dosis streptomycin sulfate (Sigma-Aldrich): 0,1g/L
c. Untuk membuat stock: 0,0006g Penisilin dan 0,001g Streptomisin dilarutkan dalam 10 mL PBS
d. Penisilin- streptomisin yang ditambahkan ke dalam medium koleksi oosit adalah 1 µ g/mL
Lampiran 3. Komposisi Larutan PBS
Bahan Jumlah
CaCl2 0,10 g
KCl 0,20 g
KH2PO4 0,20 g
MgCL2.6H2O 0,10 g
NaCl 8,0 g
Na2HPO4.7H2O 1,15 g
Glucose 1,0 g
Na Pyruvate 0,036 g
Milli-Q water 1000 mL
24
Lampiran 4. Komposisi Medium Maturasi Oosit In Vitro
Bahan Jumlah
Tissue Culture Medium/TCM-199 900 µL
Fetal Bovine Serum (FBS) 10% 100 µL
Pregnant Mare Serum Gonadotropin (PMSG) 10 µ L
Human Chorionic Gonadotropin (hCG) 10 µ L
Gentamycin (50 µ g/mL) 1 µ L
Total 1mL
• Stok PMSG (Kyoritsu Seiyaku ®, Japan)
Dosis = 10 IU/ µL
Untuk membuat stok, maka 1000 IU PMSG dilarutkan dalam 1 mL TCM-199 (1 IU/ µ L)
• Stok hCG (Kyoritsu Seiyaku ®, Japan)
Dosis = 10 IU/ µL
Untuk membuat stok, maka 1500 IU hCG dilarutkan dalam 1,5 mL TCM-199 (1 IU/ µL)
Lampiran 5. Komposisi Medium Fertilisasi In Vitro
Bahan mM g/100 mL
NaCl 90 0,52596
KCl 12 0,08946
NaHCO3 25 0,21003
NaH2PO4anhydrous 0,5 0,006
MgSO4 7H2O 0,5 0,01233
Sodium Laktat (60% sirup) 10 0,19 mL
HEPES 10 0,2383
CaCl2 2H2O 8 0,1176
Sodium Piruvat 2 0,0220
Kafein anhydrous 2 0,03884
BSA 0,5% 5 0,5
Larutan stok dibuat terpisah:
a: NaCl, KCl, NaH2PO4anhydrous, MgSO4 7H2O, Sodium Laktat, HEPES,
CaCl2 2H2O
b: NaHCO3
25
Lampiran 6. Komposisi Medium Kultur In VitroModified Synthetic Oviduct Fluid (SOF)
Bahan g/100 mL
NaCl 0,629
KCL 0,035
KH2PO4 0,016
MgSO4.7H2O 0,029
NaHCO3 0,211
CaCl2.2H2O 0,025
Sodium Pyruvate 0,004
Glutamine 0,015
Glycine 0,075
Alanine 0,009
Taurine 0,044
Myoinositol 0,05
Sorbitol 0,064
Citric acid. H2O 0,011
Apo-transferrin * 0,001
BME (EAA) 2000 µl
MEM (NEAA) 1000 µl
Sodium lactate (60%) 47,4 µl
Insulin -
Gentamicin 100 µl
Penul Pendidikan Tinggi serta Be Lembaga Pengelola Dana P
Publikasi karya ilm
Sexing dan perkembangan
untuk diterbitkan pada Jurna Gadjah Mada, Yogyakarta. master penulis yang diharap pengembangan ilmu penget
RIWAYAT HIDUP
nulis dilahirkan di Lamongan pada tanggal 17 ri pasangan Bapak Timbang Hariyanto dan nulis merupakan anak pertama dari 2 bersauda
rnia Indah Safitri. Penulis lulus dari SMA Un Fattah Lamongan pada tahun 2009. Gelar Si) diperoleh penulis pada tahun 2014 dar
ber di Jurusan Biologi Fakultas Matemati ngetahuan Alam (FMIPA). Penulis diterima
udi Biologi Reproduksi (BRP) FKH-IPB pad Program Fresh Graduate Pendidikan Pascasa n Anggaran 2014 oleh Kementerian Riset, T
Beasiswa Tesis dan Disertasi Periode II Tahu Pendidikan (LPDP) Kementerian Keuangan. ilmiah dengan judul “Kemampuan Fertilisasi
n Awal Embrio Secara In Vitro pada Sapi” t rnal Sain Veteriner, Fakultas Kedokteran Hewa rta. Karya ilmiah tersebut merupakan bagian