POTENSI BIOMASSA DAN KARAKTERISTIK
MAKROALGA Gracilaria verrucosa
SEBAGAI SUMBER ENERGI ALTERNATIF BIOGAS
DEA FAUZIA LESTARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul Potensi Biomassa dan Karakteristik Makroalga Gracilaria verrucosa sebagai Sumber Energi Alternatif Biogas adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2016
Dea Fauzia Lestari
RINGKASAN
DEA FAUZIA LESTARI. Potensi Biomassa dan Karakteristik Makroalga
Gracilaria verrucosa sebagai Sumber Energi Alternatif Biogas. Dibimbing oleh MUJIZAT KAWAROE dan SALUNDIK
Makroalga dari laut menjadi salah satu pilihan sumber biomasaa yang dapat dikonversi menjadi energi biogas melalui proses degradasi anerobik karena memiliki beberapa kelebihan dibandingkan dengan biomassa lainnya seperti pertumbuhan yang relatif cepat, efektif menyerap CO2, kandungan ligninya relatif rendah, dan dapat dibudidaya di air limbah. Ketersediaan sumber makroalga di kawasan tambak Desa Tanara, Banten yang tidak layak jual (rejected) mendorong pemanfaatan biomassa sebagai bahan biogas di daerah tersebut. Kegiatan ini membutuhkan bantuan mikroorganisme pendegradasi seperti konsorsium bakteri pada rumen ataupun feses sapi sebagai starter. Biogas mengandung beberapa senyawa seperti metana (CH4), karbondioksida (CO2), dan hidrogen sulfida (H2S). Gas H2S merupakan salah satu gas yang bisa menimbulkan bau dan korosif sehingga butuh penanganan seperti melakukan filter untuk mengurangi kandungannya dalam biogas.
Metode yang digunakan dalam penelitian ini adalah metode batch dengan volume digester sebesar 1500 L dan volume kerja digester sebesar 1200 L. Biomassa yang digunakan selama satu siklus batch sebanyak 25 kg makroalga kering. Kandungan karbohidrat makroalga rejected dianalisis dengan uji proximat. Sebelum pemasukan substrat tersebut, pertama-tama bakteri yang ada dalam kotoran sapi diaklimatisasi dengan memasukan makroalga sebanyak 2% setiap 4 hari sampai kondisi pH netral dan gas keluar dari digester. Besarnya degradasi dapat dianalisis dengan mengukur Chemical Oxygen Demand (COD), Total Solid (TS),
Volatile Solid (VS), dan kadar air. Volume biogas dari digester diukur menggunakan gas flow meter. Analisis gas CH4, H2S, dan CO2 dilakukan dengan menggunakan gas spektrometri. Gas yang dihasilkan bisa dioptimalisasikan hasilnya menggunakan H2S scrubber dengan tujuan untuk mengurangi bau dan efek korosi. Biogas yang dihasilkan diujicobakan pada lampu dan kompor biogas.
Kandungan karbohidrat makroalga Gracilaria verrucosa rejected adalah sebesar 21.46%, lebih kecil dibandingkan kandungan pada makroalga yang berkualitas baik. Nilai pH saat aklimatisasi dan produksi biogas berfluktuasi karena adanya aktivitas bakteri pendegradasi makroalga. Nilai COD, TS, VS mengalami penurunan dari nilai awal masing-masing sebesar 40%, 77%, dan 92%, sedangkan kadar air meningkat 9% dari nilai awalnya. Volume rata-rata biogas yang dihasilkan selama 31 hari pengamatan adalah 74.4 L.hari-1 atau 92.2 L.kg-1. Volume yang paling tinggi diproduksi pada hari ke-15 sebesar 132 L, sedangkan yang paling rendah pada hari ke-30 sebesar 21.5 L. Proses filter menggunakan H2S scrubber berpengaruh terhadap konsentrasi H2S menjadi tidak terdeteksi, sedangkan konsentrasi CH4 dan H2S meningkat dikarenakan adanya akumulasi biogas yang terfilter dalan scrubber. Uji coba biogas makroalga dilakukan terhadap pemakaian lampu biogas yang menghabiskan 1.8 L.min-1 dan kompor biogas menghabiskan 6 L.min-1 gas dari digester.
SUMMARY
DEA FAUZIA LESTARI. The Biomass Potential and Characteristic of Macroalgae
Gracilaria verrucosa as Biogas Alternative Energy Resource. Supervised by MUJIZAT KAWAROE and SALUNDIK.
Marine macroalgae become one of the biomass resource that can be converted into biogas energy by anaerobic digestion process because it has some advantages compared with others biomass such as high biomass growth rate, high CO2 absorption, low lignin content, and can grow in wase water. Rejected macroalgae availability in ponds at Tanara village, Banten support for biogas energy development. This process requires degraded microorganism such as consorcium bacteria that is very abundant in cow's rumen or feces to start the process. Biogas contain methan (CH4), carbondioxide (CO2), and hydrogen sulphide (H2S). Hidrogen sulphide is a trace gas that cause odour and corrosive effect, thus have to treat by filtering in order to reduce the concentration in biogas. Batch method was applied in digester that its volume was 1500 L and working volume was 1200 L. Biomassa of macroalgae was 25 kg in dry condition. Carbohydrate content was analyzed by proximate test. The first step before anaerobic degradation was bacteria actimatization with macroalgae by inputing these substrate gradually as much 2% every 4 days until neltal pH condition and produce biogas. Degradation activities might be analyze by Chemical Oxygen Demand (COD), Total Solid (TS), Volatile Solid (VS), and water content measurement. Biogas production was measured using gas flow meter. Analysis of CH4, H2S, and CO2 were analyzed by gas spectrometry methods. The resulting biogas was optimized by H2S scrubber in order to reduce odors and corrosion effects. Biogas from digester was applied for switch on biogas lamp and stove.
Carbohydrate content of rejected macroalgae Gracilaria verrucosa was 21.46% lower than high quality macroalgae. The acidity (pH) value were fluctuative, caused by degradation activities of macroalgae substrate. The value of COD, TS, VS were decrease from initial as much 40%, 77%, dan 92%, while water content was increase 9% from initial value. The average volume of biogas production during 31 observation days was 74.4 L.day-1 or 92.4 L.kg-1. The highest volume production was 132 L at 15th days, while the lowest volume production was 21.5 L at 30th days. Filtration process using H
2S scrubber was affected to H2S concentration become undetectable, then CH4 and CO2 were increase because of biogas accumulation on scrubber. Biogas was applied for houshold equipments, volume that required to switch on biogas lamp was L.8 l.min-1, while biogas stove was 6 L.min-1 from the digester.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah, dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Kelautan
POTENSI BIOMASSA DAN KARAKTERISTIK
MAKROALGA Gracilaria verrucosa
SEBAGAI SUMBER ENERGI ALTERNATIF BIOGAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2016
Judul Tesis : Potensi Biomassa dan Karakteristik Makroalga Gracilaria verrucosa sebagai Sumber Energi Alternatif Biogas Nama : Dea Fauzia Lestari
NIM : C551130021
Disetujui oleh Komisi Pembimbing
Dr Ir Mujizat Kawaroe, MSi Ketua
Dr Ir Salundik, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Kelautan
Dr Ir Neviaty P Zamani, MSc
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 16 Desember 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2014 ini adalah mengenai energi alternatif dari laut, dengan judul Potensi Biomassa dan Karakteristik Makroalga Gracilaria verrucosa sebagai Sumber Energi Alternatif Biogas.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Mujizat Kawaroe MSi dan Bapak Dr Ir Salundik MSi selaku pembimbing yang telah banyak memberi saran dan masukan dalam penelitian ini. Di samping itu, penghargaan penulis sampaikan kepada Bapak Haris Nasution SPi dan Bapak Agus sebagai pemilik dan pengelola tambak di Desa Tanara, Banten telah membantu selama pengumpulan data di lapangan. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, seluruh keluarga, sahabat, dan teman-teman atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
2 METODE 4
Waktu dan Lokasi Penelitian 4
Alat dan Bahan 4
Prosedur Penelitian 5
Metode Analisis 7
3 HASIL DAN PEMBAHASAN 14
Produksi Biomassa Makroalga 14
Karakteristik Kandungan Makroalga 15
Kondisi pH Aklimatisasi dan Degradasi Anaerobik 16 Nilai COD, TS, VS, dan Kadar Air Substrat 17 Produksi dan Komposisi Biogas Makroalga 18
Uji Coba dan Konversi Biogas Makroalga 21
4 SIMPULAN DAN SARAN 22
Simpulan 23
Saran 23
DAFTAR PUSTAKA 24
LAMPIRAN 28
DAFTAR TABEL
1 Bahan penelitian potensi biogas dari makroalga G. verrucosa 4 2 Alat penelitian potensi biogas dari makroalga G. verrucosa 5
3 Komposisi kandungan Gracilaria 15
4 Nilai Chemical Oxygen Demand, Total Solid, Volatile Solid, dan kadar air pada substrat selama degradasi anaerobik 18 5 Konsentrasi gas CH4, CO2, dan H2S pada biogas makroalga sebelum dan
sesudah filtrasi dengan H2S scrubber 20 6 Volume biogas makroalga dalam pemanfaatan lampu dan kompor 22
DAFTAR GAMBAR
1 Lokasi penelitian biogas makroalga 4
2 Tahap penelitian biogas makroalga 5
3 Instalasi fix dome digester dilengkapi dengan flow meter dan H2S
scrubber yang disambungkan pada kompor biogas 6
4 Konversi sederhana aplikasi biogas makroalga 13 5 Produksi makroalga di Desa Tanara, Banten 14 6 Nilai pH saat aklimatisasi substrat makroalga dan kotoran sapi 16
7 Nilai pH saat produksi biogas 17
8 Produksi biogas makroalga harian 19
9 Produksi biogas makroalga kumulatif 19
10 Kompisisi gas CH4, CO2, dan H2S dalam biogas makroalga 21 11 Aplikasi biogas makroalga dalam kehidupan sehari-hari: (a) kompor
biogas, (b) lampu biogas 22
DAFTAR LAMPIRAN
1 Data produksi bulanan makroalga Gracilaria verrucosa di Desa Tanara,
Banten 28 2 Data nilai pH harian saat aklimatisasi kotoran sampi dan makroalga 28
3 Data nilai pH harian saat degradasi anaerobik (produksi biogas) 29 4 Data volume produksi biogas harian dan kumulatif biogas makroalga 30 5 Data komposisi gas penyusun biogas makroalga 31
1
PENDAHULUAN
Latar Belakang
Ketergantungan terhadap energi fosil, terutama minyak bumi dalam pemenuhan konsumsi di dalam negeri masih tinggi, yaitu sebesar 96% (minyak bumi 48%, gas 18%, dan batubara 30%) dari total konsumsi energi nasional, sementara upaya untuk memaksimalkan pemanfaatan energi terbarukan belum dapat berjalan sebagaimana yang direncanakan. Total konsumsi energi nasional dengan memperhitungkan biomassa tradisional diproyeksikan meningkat menjadi 300 juta TOE pada tahun 2025 dan 827 juta TOE pada tahun 2050 atau mengalami kenaikan rata-rata masing-masing sebesar 4.9% per tahun selama periode 2013-2025 dan 4.1% per tahun periode 2013-2025-2050. Dalam sepuluh tahun terakhir (2003-2013), konsumsi energi final di Indonesia mengalami peningkatan dari 79 juta TOE menjadi 134 juta TOE, atau tumbuh rata-rata sebesar 5.5% per tahun. Sejalan dengan meningkatnya konsumsi energi tersebut, penyediaan energi primer juga mengalami kenaikan. Namun, upaya untuk memenuhi kebutuhan energi di dalam negeri juga terkendala oleh keterbatasan infrastruktur energi, seperti pembangkit listrik, kilang minyak, pelabuhan, serta transmisi dan distribusi (Dewan Energi Nasional 2014).
Tingginya kebutuhan akan energi tersebut mendorong eksplorasi sumber daya energi terbarukan yang aplikatif dan dapat digunakan langsung oleh masyarakat. Bioenergi menjadi sumber yang paling signifikan diminati dan menawarkan nilai ekonomi dalam skala besar (Romagnoli et al. 2010, Hughes et al. 2012). Bioenergi berbasis biomassa telah banyak diteliti demi terpenuhinya kebutuhan energi yang semakin meningkat salah satunya makroalga yang dapat menghasilkan bahan bakar dan bahan kimia (Kawaroe et al. 2012, Wei et al. 2013).
Makroalga memiliki banyak keuntungan dalam aplikasi energi terbarukan karena efisien dalam mengonversi foton menjadi biomassa melalui asimilasi yang memanfaatkan sinar matahari, karbon dioksida, dan bahan anorganik (Aresta et al. 2005, Subadhra & Edward 2010). Tingkat fiksasi karbon dioksidanya yang lebih tinggi dari biomassa terestrial dan memungkinkan untuk merestorasi karbon yang lebih besar (Gao & McKinley 1994, Jeong & Park 2009, Kawaroe et al. 2012). Selain itu, hasil produksi makroalga per satuan luas secara signifikan lebih tinggi daripada biomassa terestrial (Gao & McKinley 1994, Aresta et al. 2005). Kandungan lignin makroalga lebih rendah daripada kandungan yang dimiliki sebagian besar tanaman darat (Briand & Morand 1997, Bruhn et al. 2011, John et al. 2011) sehingga lebih mudah untuk dipolimerisasi dan dihidrolisis (Wargacki et al. 2012, Horn et al. 2000).
2
proses termasuk proses pemanasan (Zhou et al. 2010) dan fermentasi (Goh & Lee 2010, Adams et al. 2009). Metode yang dapat langsung digunakan untuk memperoleh bioenergi dari biomassa yaitu degradasi anaerobik atau memfermentasi makroalga menjadi biogas dengan bantuan bakteri dari kotoran sapi. Degradasi anaerobik terjadi akibat kegiatan bakteri pada substrat untuk menghasilkan gas metana. Organisme yang berasal dari rumen seperti bakteri, protozoa, jamur, dan bakteriofag bertindak sebagai pengurai bahan organik (Beauchemin et al. 2008). Machado et al. (2014) juga telah menganalisis produksi biogas dari beberapa spesies makroalga menggunakan campuran bakteri rumen. Kotoran sapi memiliki tingkat biodegradabilitas anaerobik yang ideal karena mengandung konsorsium bakteri pendegradasi sebagai inokulum (Sunarso et al. 2010). Bakteri ini memerlukan aklimatisasi untuk beradaptasi di substrat yang berbeda.
Klein dan Shimon (2013) menjelaskan bahwa proses degradasi anaerobik menghasilkan beberapa produk gas seperti metana (CH4), karbon dioksida (CO2), hidrogen sulfida (H2S). Produk gas metana mudah terbakar dan dapat digunakan sebagai sumber energi terbarukan. Hidrogen sulfida menimbulkan bau yang merupakan karakteristik dari biogas. Selain itu, gas ini mejadi kontaminan yang paling bermasalah karena beracun dan korosif bagi sebagian besar peralatan. Pembakaran H2S menyebabkan emisi sulfur dioksida dan memiliki dampak berbahaya bagi lingkungan. Oleh karena itu perlu dilakukan upaya untuk mengurangi efek dari keberadaan gas tersebut salah satunya dengan filtrasi.
Perumusan Masalah
Wilayah pesisir Serang, Banten merupakan salah satu kawasan budidaya makroalga untuk keperluan domestik maupun ekspor. Salah satu spesies yang dibudidayakan adalah Gracilaria verrucosa dari kelas makroalga merah (Rhodophyceae). Kegiatan budidaya tersebut menghasilkan biomassa makroalga yang tidak layak pakai (rejected) dan belum ada upaya pemanfaatannya.
Menindak lanjuti penelitian skala laboratorium yang telah dilakukan sebelumnya mengenai biopotensi beberapa makroalga laut seperti Euchema cottonii (Kawaroe et al. 2015), Ulva sp., dan Gracilaria sp. (Krisye 2015) sebagai bahan energi alternative biogas, maka penelitian selanjutnya akan melakukan aplikasi skala lapang atau skala rumah tangga. Aplikasi yang dilakukan skala lapang ini disesuaikan dengan ketersediaan bahan baku yang ada yaitu spesies makroalga Gracilariaverrucosa. Produk biogas yang dihasilkan akan diujicobakan sebagai sumber penerangan lampu dan bahan bakar kompor biogas. Perumusan masalah yang muncul dari adanya hal-hal di atas diantaranya yaitu:
1. Bagaimana produksi makroalga di tambak Desa Tanara, Banten? 2. Bagaimana karakteristik proksimat substrat G. verrucosa?
3. Bagaimana kondisi pH substrat saat aklimatisasi dan degradasi anaerobik? 4. Bagaimana kondisi Chemical Oxygen Demand (COD), Tota Solid (TS),
Volatile Solid (VS) dan kadar air substrat selama proses degradasi anaerobik berlangsung?
3 6. Bagaimana hasil uji coba dan konversi biogas makroalga menjadi energi
alternatif?
Tujuan
Tujuan dari penelitian ini adalah:
1. Menganalisis produksi biomassa makroalga di Desa Tanara, Banten. 2. Menganalisis karakteristik kandungan substrat dari G. verrucosa.
3. Menganalisis kondisi pH substrat saat aklimatisasi dan degradasi anaerobik.
4. Menganalisis kondisi COD, TS, VS, dan kadar air substrat selama proses degradasi anaerobik.
5. Menganalisis hasil produksi dan komposisi biogas pada saat sebelum dan sesudah fitrasi dengan H2S scrubber.
6. Melakukan uji coba biogas makroalga dan menghitung konversi energi gas menjadi energi alternatif.
Manfaat Penelitian
Penelitian mengenai potensi makroalga G. verrucosa sebagai sumber biogas ini dapat diaplikasikan dalam rangka memenuhi kebutuhan energi alternatif yang ramah lingkungan dalam skala rumah tangga di kawasan peisisir dan mengukur seberapa besar potensi biogas yang dihasilkan dari rejected makroalga G.verrucosa. Selain itu, penelitian ini sebagai upaya meningkatkan nilai sumber daya biomassa yang tidak dimanfaatkan menjadi suatu produk yang lebih bermanfaat. Sebagai implikasinya, diharapkan penelitian ini menjadi dasar ilmu pengetahuan dalam penerapan energi terbarukan yang berasal dari biomassa.
Ruang LingkupPenelitian
Penelitian ini diawali dengan pemilihan lokasi untuk pemasangan fix dome
4
2
METODE
Waktu dan Lokasi Penelitian
Penelitian ini dilaksanakan pada Oktober 2014 sampai dengan Mei 2015 di tambak budidaya Pesisir Desa Tanara, Banten dan Laboratorium Surfactant and Bioenergy Research Centre (SBRC) Institut Pertanian Bogor.
Gambar 1 Lokasi penelitian biogas makroalga
Lokasi tambak ini merupakan wilayah pesisir yang terdapat di daerah serang Banten. Wilayahnya berdekatan dengan laut dan beberapa wilayah ditumbuhi mangrove. Sebagian warga bermata pencaharian sebagai petani tambak udang, bandeng, dan makroalga atau rumput laut. Namun lebih banyak diantaranya memilih makrolaga karena resiko yang usahanya kecil dan nilai jualnya cukup ekonomis. Jenis yang dibududayakan adalah monokultur Gracilaria verrucosa. Selain tambak, terdapat pula gudang yang digunakan sebagai tempat penyimpanan sementara hasil panen. Waktu tempuh ke lokasi tersebut sekitar 1 jam perjalanan dari Kota Serang.
Alat dan Bahan
Bahan dan alat yang digunakan pada penelitian ini dapat dilihat dalam Tabel 1 dan 2 sebagai berikut.
Tabel 1 Bahan penelitian potensi biogas dari makroalga G. verrucosa
Alat Keterangan
G. verrucosa (rejected) 50 kg biomassa basah
Kotoran sapi 200 L
5 Tabel 2 Alat penelitian potensi biogas dari makroalga G. verrucosa
Alat Keterangan
Digester 1500 Liter Bahan fiber
H2S scrubber t = 1.5 m, d = 20 cm
Gas flow meter Itron ACD G1.6
Gas kolektor Bahan plastik, V= 1 L
Kompor dan lampu uji Khusus biogas
Pengaduk t = 2 m
pH meter HANNA instrument
Refraktometer ATAGO S/Mill-E
Gas kromatografi Shimadzu GC-14A, Dilengkapi FID dan TCD
Spektrofotometer λ = 670 nm
Prosedur Penelitian
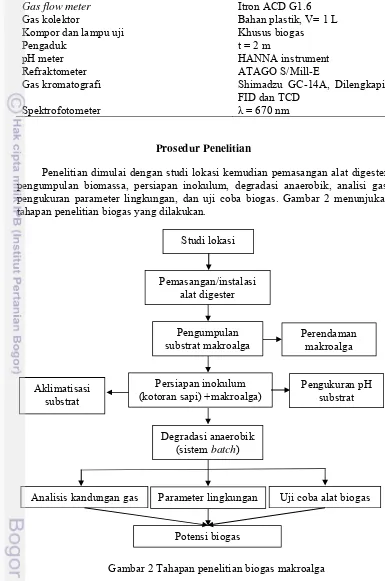
Penelitian dimulai dengan studi lokasi kemudian pemasangan alat digester, pengumpulan biomassa, persiapan inokulum, degradasi anaerobik, analisi gas, pengukuran parameter lingkungan, dan uji coba biogas. Gambar 2 menunjukan tahapan penelitian biogas yang dilakukan.
Gambar 2 Tahapan penelitian biogas makroalga Studi lokasi
Analisis kandungan gas Parameter lingkungan Uji coba alat biogas
6
Studi Lokasi
Studi lokasi dilakukan untuk mengetahui keadaan lapang dan kesesuaian tempat yang membutuhkan aplikasi biogas. Selain itu, studi ini bertujuan untuk memastikan ketersediaan bahan baku (makroalga) dan kualitas lingkungan. Selain itu, kegiatan wawancara dilakukan untuk mendapatkan informasi tambahan mengenai potensi dan produksi makroalga di Desa Tanara, Banten.
Beberapa data yang didapat dari hasil wawancara adalah jumlah produksi makroalga G. verrucosa basah dan kering di tambak seluas ±12 Ha. Data ini dapat digunakan untuk melihat potensi dan penurunan kadar air dalam biomassa makroalga. Jumlah panen dilihat setiap bulan sehingga dapat diketahui bagaimana
trend dari produksinya dalam setahun.
Salah satu yang menjadi pertimbangan lain adalah adanya sumber air tawar yang bisa digunakan untuk menjadi campuran substrat biogas dalam digester. Selain itu air tersebut digunakan untuk pencucian makroalga yang berasal dari tambak. Sungai yang berada di sekitar tambak menjadi salah satu pendukung untuk pengembangan pemanfaatan makroalga sebagai sumber energi dari biomasa Pemasangan Digester
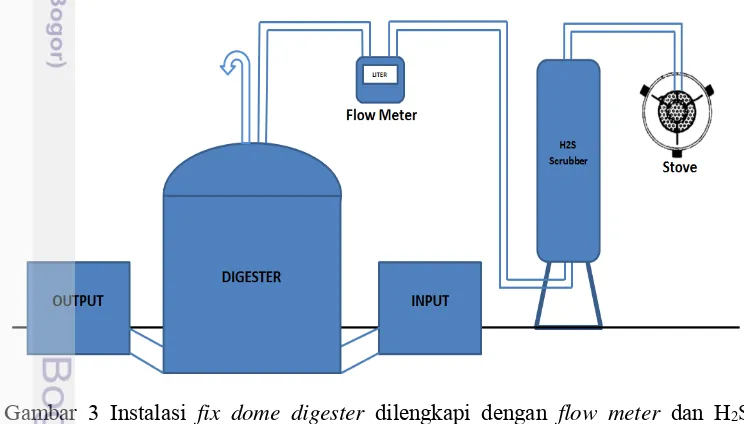
Digester dengan kapasitas 1500 L terbuat dari fiber dilengkapi dengan dua bak sebagai input dan output substrat lumpur. Dua kran atau katup terdapat pada digester untuk mengalirkan biogas, satu terhubung dengan flowmeter dan H2S
scrubber, lainnya dibiarkan tertutup sebagai tempat pengambilan sampel gas sebelum melewati filter. Flowmeter berfungsi untuk mengukur jumlah produksi gas dengan laju aliran Qmax = 3 m3.jam-1; Qmin = 0.16 m3.jam-1. Scrubber yang digunakan merupakan filter biologi, mengandung mikroba pengurai H2S dan dikultur pada media sabut kelapa atau sawit (Suwardin et al. 2007). Selain itu, filter dilengkapi dengan butiran kelereng yang berfungsi sebagai pemecah gas agar terdistribusi merata ke segala arah. Setelah melewati H2S scrubber, biogas diujicobakan untuk menyalakan lampu dan kompor biogas.
Gambar 3 Instalasi fix dome digester dilengkapi dengan flow meter dan H2S
7 Persiapan Substrat
Tahap pertama mencuci substrat G. verrucosa (rejected) yang diambil dari tambak untuk menghilangkan pasir dan lumpur kemudian dikeringkan untuk mengurangi kandungan garam dalam biomassa (Bruhn et al. 2011). Makroalga sebanyak 25 kg siap untuk dicampur dengan kotoran sapi, namun sebelumnya direndam dalam air tawar selama 2 jam untuk mengurangi kadar garam dan lumpur yang menempel. Setelah itu ditambahkan air yang baru hingga volume menjadi 500 L. Sebanyak 100 gram diambil untuk diuji karakteristiknya.
Degradasi Anaerobik
Degradasi anaerobik dilakukan meggunakan sistem batch yaitu memasukan substrat sekaligus pada awal proses dengan kondisi mesopilik yaitu pada suhu 20-45 °C. Substrat terlebih dahulu diaklimatisasi agar bakteri pengurai pada kotoran sapi dapat beradaptasi dengan makroalga sampai inokulum siap untuk diproses. Komponen campuran terdiri dari 800 L air, 100 L kotoran sapi (kondisi basah), dan makroalga. Makroalga dimasukan secara bertahap yaitu 2% (24 L) dari kapasitas substrat setiap 4 hari dan dikeluarkan dengan jumlah yang sama. Pada metode batch
ini digester tidak diisi penuh karena menyediakan ruang untuk hasil produksi gas serta harus dilakukan pengadukan agar proses degradasi berjalan dengan baik (Briand & Morand 1997, Gregor & Grilc 2012). Pemasukan substrat sebanyak 2% dihentikan setelah gas muncul dan atau pH stabil, setelah itu dilanjutkan pemasukan makroalga sekaligus sebanyak 300 L.
Kelebihan sistem batch ini adalah memiliki resiko kecil dari kontaminasi luar dan jangka waktunya yang mudah untuk menentukan siklus degradasi anaerobik. Namun kekurangannya adalah adanya penurunan produksi gas dari waktu ke waktu karena ketersediaan substrat pada digester berkurang sebagai konsekuensi dari proses degradasi yang dilakukan oleh bakteri anaerobik. Pengamatan lapang dilakukan selama 31 hari sebanyak dua ulangan. Suhu dan pH tidak terkontrol, tergantung pada kondisi lingkungan.
Metode Analisis
Produksi Biomassa Makroalga
Data produksi didapat dari hasil wawancara dan data primer berupa bobot basah sebelum dilakukan penjemuran dan bobot kering setelah dilakukan penjemuran sehingga dapat dilakukan perhitungan penurunan kadar air setelah melakukan dilakukam pengeringan.
% penurunan kadar air =
x 100%
Keterangan: W = bobot basah (ton) W1 = bobot kering (ton) Karakteristik Kandungan Makroalga
8
1. Kadar Air (SNI 01-2891-1992)
Pertama, mengeringkan cawan porselen di dalam oven pada suhu 105 °C selama 1 jam. Setelah itu, memasukan cawan tersebut ke dalam desikator selama 10 menit kemudian ditimbang. Memasukan dan menimbang sampel seberat 1-2 gram ke dalam cawan kemudian dioven pada suhu 105 °C selama 3-4 jam sampai beratnya stabil. Selanjutnya, memasukan kembali cawan ke dalam desikator selama 10 menit kemudian ditimbang. Menghitung kadar air menggunakan rumus:
Kadar air (%) = x 100%
Keterangan : W = bobot sampel sebelum dikeringkan (gram) W1 = kehilangan bobot setelah dikeringkan (gram) 2. Kadar Abu (SNI 01-2891-1992)
Mengeringkan cawan porselen di dalam oven pada suhu 105 °C selama 1 jam, kemudian memasukannya ke dalam desikator selama 10 menit dan menimbangnya. Setelah itu, menimbang sampel seberat 2-3 gram dan membakarnya di atas penangas air sampai kering. Setelah itu memasukan cawan tersebut ke dalam tanur untuk pengabuan dengan suhu 550 °C sampai pengabuan sempurna. Selanjutnya memasukan cawan ke dalam desikator selama 10 menit dan menimbangnya. Menghitung kadar abu menggunakan rumus:
Kadar abu (%) =
x 100%
Keterangan : W = bobot sampel sebelum diabukan (gram)
W1 = bobot cawan dan sampel sesudah diabukan (gram) W2 = bobot cawan kosong (gram)
3. Kadar Karbohidrat (SNI 01-2891-1992)
Memasukan sampel sebanyak 5 gram ke dalam labu erlemeyer 500 ml dan menambahkan larutan HCL 3% sebanyak 200 ml kemudian mendidihkannya selama 3 jam dengan pendingin tegak. Selanjutnya menetralkan larutan yang sudah dididihkan dengan larutan NaOH 30% dan CH3COOH 3% kemudian memindahkannya pada labu 500 ml dengan menyaring terlebih dahulu 10 ml larutan dan menambahkan 25 ml Luff serta 15 ml air suling. Setelah itu, mendidihkan larutan campuran tersebut selama 10 menit lalu mendinginkannya menggunakan air es, lalu menambahkan 15 ml larutan KI 20% dan 25 ml larutan H2SO4 25% perlahan-lahan. Menitrasi larutan tersebut dengan Tiosulfat 0.1 N dan menggunakan larutan kanji 0.5% sebagai indikator. Kemudian melakukan hal yang sama pada larutan blanko. Menghitung kadar karbohidrat menggunakan rumus:
Kadar karbohidrat (%) =
x 100%
Keterangan : Karbohidrat = 0.9 x kadar glukosa W1 = bobot sampel (gram)
W = glukosa yang terkandung untuk ml tiosulfat yang digunakan (mg) dilihat dari tabel
9 4. Kadar Protein (SNI 01-2891-1992)
Mencampur 0.51 gram sampel dengan 2 gram selen dan l25 ml arutan H2SO4 pekat kemudian memanaskannya di atas penangas sampai larutan mendidih dan menjadi bening kehijau-hijauan (2 jam). Membiarkan larutan menjadi dingin dan mengencerkannya menjadi 100 ml pada labu ukur sampai garis tera. Memipet 5 ml larutan tersebut dan memasukannya ke dalam alat penyuling, kemudian menambahkan 5 ml larutan NaOH 30% dan dan beberapa tetes indikator PP. Menyuling campuran tersebut selama 10 menit serta menggunakan 10 ml larutan asam borat 2% yang telah dicampur indikator sebagai penampung. Kemudian membilas ujung pendingin dengan air suling dan menitrasi dengan larutan HCl 0.01 N, selanjutnya melakukan hal yang sama pada larutan blanko. Menghitung kadar protein menggunakan rumus:
Kadar protein (%) = .
x 100%
Keterangan : W = bobot sampel (gram)
V1 = volume HCL 0.001 N yang digunakan untuk titrasi sampel V2 = volume HCL 0.001 N yang digunakan untuk titrasi balnko N = normalitas HCl
fk = faktor konversi untuk protein dari sampel secara umum fp = faktor penegnceran
5. Kadar Lemak (SNI 01-2891-1992)
Memasukan sampel sebanyak 1-2 gram ke dalam selongsong kertas yang dialasi dengan kapas. Mengeringkan terlebih dahulu sampel selama satu jam pada suhu 80 °C dan memasukannya ke dalam alat soxhlet yang telah terhubung labu lemak dan bobotnya telah diketahui. Selanjutnya melarutkannya dengan pelarut heksana atau pelarut lemak lain selama 6 jam. Memisahkan larutan heksana dan mengeringkan ekstrak lemak dalam oven pada suhu 105 °C. Kemudian menimbang bobot lemak yang dihasilkan pada labu. Menghitung kadar lemak menggunakan rumus:
Kadar lemak (%) =
x 100%
Keterangan : W = bobot sampel (gram)
W1 = bobot labu sebelum ekstraksi (gram) W2 = bobot labu setelah ekstraksi kososng (gram) 6. Kadar Serat (SNI 01-2891-1992)
10
H2SO4 1.25%, air panas, dan etanol 96%. Mengangkat kertas saring beserta isinya kemudian menimbang dan mengeringkannya pada suhu 105 °C sebelum ditimbang kembali. Jika kasar serat lebih besar dari pada 1% maka mengabukan kertas saring beserta isinya sampai bobot tetap. Menghitung kadar serat menggunakan rumus:
a) Bila serat kasar ≤ 1% Kondisi pH Aklimatisasi dan Degradasi Anaerobik
Nilai pH substrat pada digester diukur setiap hari menggunakan pH meter. Kondisi pH aklimatisasi diukur saat pemasukan awal inokulum dan substrat makroalga secara bertahap untuk mengetahui kapan siklus batch bisa dilakukan. Setelah pH stabil dan biogas keluar dari digester baru dilakukan pemasukan substrat sekaligus dan diukur pH nya setiap hari sampai dengan akhir pengamatan.
Nilai COD, TS, VS, dan Kadar Air Substrat
Nilai Chemical Oxygen Demand (COD), Total Solid (TS), Volatile Solid
(VS), dan kadar air dianalisis setiap pada hari ke-5, 15, dan 25 untuk mengetahui kondisi substrat makroalga selama degradasi anaerobik. Hari tersebut dipilih untuk mewakili waktu awal, pertengahan, dan akhir dari satu siklus batch. Nilai COD, TS, VS, dan kadar awal dan akhir berguna untuk menentukan potensi substrat sebagai sumber energi biogas. Nilai COD, TS, dan VS di analisis berdasarkan APHA 1998, sedangkan kadar air berdasarkan SNI 01-2891-1992.
1. Chemical Oxygen Demand (COD) (APHA 1998)
Memasukan sampel sebayak 30 ml ke dalam erlenmeyer dan menambahkan 5 ml K2Cr2O7 0,025 N, kemudian mendiamkannya selama 1 menit. Menambahkan 7.5 ml asam sulfat pekat lalu mendiamkannya selama 30 menit. Meneteskan 2 tetes indikator ferroin dan mentitrasinya dengan FAS 0.025 N hingga terjadi perubahan warna dari biru kehijauan menjadi merah kecoklatan. Kemudian mencatat volume yang digunakan (B). Dengan melakukan prosedur yang sama, melakukan titrasi terhadap blanko air suling sebanyak 20 ml dengan menggunkan 0.025 FAS (A). Menghitung nilai COD dengan persamaan:
11 2. Total Solid (TS) (APHA 1998)
Mengeringkan cawan porselen dalam oven dengan suhu 105 °C selama 1 jam dan memasukannya ke dalam desikator selama 10 menit kemudian ditimbang. Sampel sebanyak 3 ml dimasukkan ke dalam cawan porselen kemudian memanaskannya dengan suhu 105 °C selama 2-3 jam. Memasukan cawan ke dalam desikator selama 10 menit dan menimbangnya. Menghitung TS menggunakan rumus:
Total Solid (mg.L-1)
Keterangan: A = bobot akhir setelah dikeringkan (mg) B = bobot cawan kosong (mg)
3. Volatile Solid (VS) (APHA 1998)
Analisis VS merupakan lanjutan dari analisis TS. Sampel yang telah diukur kadar TS-nya kemudian dimasukkan ke dalam tanur untuk diabukan dengan suhu 600 °C selama 3 jam. Setelah itu, memasukan cawan tersebut ke dalam desikator selama 10 menit kemudian ditimbang. Menghitung TS menggunakan rumus:
Volatile Solid (mg.L-1) =
Keterangan: A = bobot akhir setelah diabukan (mg) B = bobot cawan kosong (mg)
Produksi dan Komposisi Biogas Makroalga
Produksi biogas harian diukur menggunakan flowmeter dengan melihat selisih jumlah gas hari ini dan sebelumnya. Selain itu, produksi biogas kumulatif merupakan jumlah total gas yang dihasilkan selama proses degradasi anaerobik. Produk biogas dari kran sebelum dan sesudah filtrasi dikumpulkan pada kantong sampel gas. Selama 10-15 detik kran dibuka sebelum dihubungkan langsung pada kantong plastik untuk memastikan sampel merepresentasikan gas dalam digester (Yen & Brune 2007).
Komposisi biogas ditentukan dengan alat gas kromatografi (GC) dilengkapi dengan Flame Ionization Detector (FID) untuk CH4 dan Thermal Conductivity
Detector (TCD) untuk CO2. Kotak penangkap metana dan CO2 memiliki ukuran 40x40x60 cm dan 40x20x15 cm. Sebanyak 0.5 ml sampel gas diinjeksikan ke dalam alat kromatografi pada suhu kolom 45°C dengan menggunakan helium sebagai gas pembawa.
Sensor FID terdiri dari hidrogen atau air flame dan collector plate, sampel yang keluar dari kolom dilewatkan ke flame yang menguraikan molekul organik dan menghasilkan ion-ion. Ion-ion tersebut dihimpun pada biased electrode
(collector plate) dan menghasilkan sinyal elektrik. Sinyal elektrik tersebut diinterpretasikan ke dalam bentuk peak. Analisis sampel gas CH4 menggunakan Gas Kromatografi.
Sensor TCD terdiri dari electrically-heated wire atau thermistor. Temperatur
12
sekitarnya. Perubahan thermal conductivity seperti ketika adanya molekul organik dalam sampel yang dibawa carrier gas menyebabkan kenaikan temperatur pada
sensing element yang diukur sebagai perubahan resistensi. Analisis sampel gas CO2 menggunakan Gas Kromatografi.
Hidrogen sulfida dianalisis dengan metode metilen biru (SNI-7.117.7-2005). Volume contoh uji gas yang diambil, dikoreksi pada kondisi normal (25 0C, 760 mm Hg) dengan menggunakan rumus sebagai berikut:
Vs = V x
x
Keterangan: Vs = volume contoh uji gas yang terambil dalam kondisi normal (L)
Pa = tekanan udara atmosfer (mm Hg) Pm = tekanan dibaca pada gas meter (mm Hg)
Pv = tekanan uap air jenuh pada temperatur, t °C (mm Hg) lihat tabel tekanan uap air jenuh
T = temperatur gas dibaca pada gas meter (°C)
298 = konversi temperatur pada kondisi normal (25 °C) ke dalam Kelvin
273 = konversi temperatur pada kondisi normal (0°C) ke dalam Kelvin
760 = tekanan udara standar (mmHg)
Konsentrasi H2S dalam contoh uji dapat dihitung dengan rumus sebagai berikut:
C =
Keterangan: C = konsentrasi H2S dalam emisi gas (ppm atau µl.L-1) a = jumlah H2S dari contoh uji (µl)
200 = volume contoh uji yang diencerkan dalam labu ukur 200 ml
20 = volume contoh uji yang dipipet
Vs = volume contoh gas uji dalam kondisi normal pada 25 °C, 760 mmHg (L)
Uji Coba dan Konversi Biogas Makroalga
Uji coba gas dilakukan dengan melewatkan biogas pada instalasi selang yang diatur menggunakan kran. Selang biogas disambungkan pada kompor dan lampu. Kompor uji merupakan kompor 1 tungku yang khusus digunakan untuk biogas. Besar kecilnya api dapat diatur menggunakan tombol seperti pada kompor LPG yang biasa. Biogas memiliki tekanan rendah sehingga sifatnya tidak terlalu
explosive. Saat menyalakan kompor ini tidak dapat langsung mengeluarkan api namun harus dibantu dengan pematik agar api bisa keluar dari biogas.
13 dengan kompor biogas membutuhkan pematik untuk bisa menyala. Perawatan yang dilakukan untuk menjaga lampu agar tetap bisa menyala salah satunya adalah dengan mengganti kaos lampu petromaks. Kaos lampu ini dapat berpijar pada suhu yang tinggi sehingga menerangi ruangan di sekitarnya. Berikut adalah mekanisme konversi menggunakan lampu dan kompor uji.
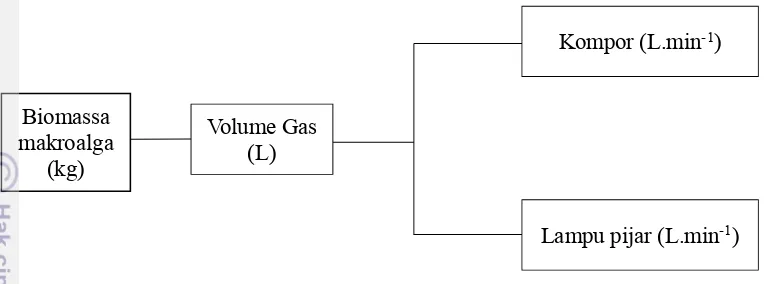
Gambar 4 Konversi sederhana aplikasi biogas
Konversi dilihat dari total gas yang diperlukan untuk menyalakan lampu dan kompor biogas setiap menitnya. Jumlah gas yang digunakan terukur pada flow meter. Uji coba juga dilakukan dengan mendidihkan air tawar sebanyak 1 liter menggunakan kompor biogas. Pengujian dilakukan berulang untuk menghasilkan data pengukuran yang akurat. Beberapa langkah tersebut dilakukan untuk mengetahui volume yang dibutuhkan (L) dalam penggunaan alat-alat di atas.
Konversi biomassa menjadi biogas dihitung dengan mengalkulasikan jumlah biogas yang diproduksi (L) atau volume kumulatif dibagi dengan jumlah hari yang dilakukan dalam pengamatan. Selain itu, untuk melihat potensi per satuan biomassa konversi dilakukan dengan menjumlahkan volume kumulatif biogas dibagi dengan biomassa substrat yang digunakan (kg).
Produksi per biomassa (L.kg-1) =
Keterangan: V = volume kumulatif biogas (L) m = bobot bahan makroalga (mg)
Produksi per hari (L.hari-1) =
Keterangan: V = volume kumulatif biogas (L) t = lama waktu siklus batch (hari)
Volume Gas (L)
Lampu pijar (L.min-1) Kompor (L.min-1)
Biomassa makroalga
14
3
HASIL DAN PEMBAHASAN
Produksi Biomassa Makroalga
Produksi makroalga dapat diketahui dari hasil panen yang dilakukan ditambak. Hasilnya berupa biomassa basah yang kemudian dikeringkan selama beberapa hari tergantung dengan intensitas penyinaran matahari. Pengeringan dilakukan untuk menurunkan kadar air sehingga memudahkan dalam distribusi dan menjaga kualitas biomassa makroalga tersebut. Diagram di bawah menunjukan produksi bulanan makroalga pada lahan ±120 Ha tambak di Desa Tanara, Banten.
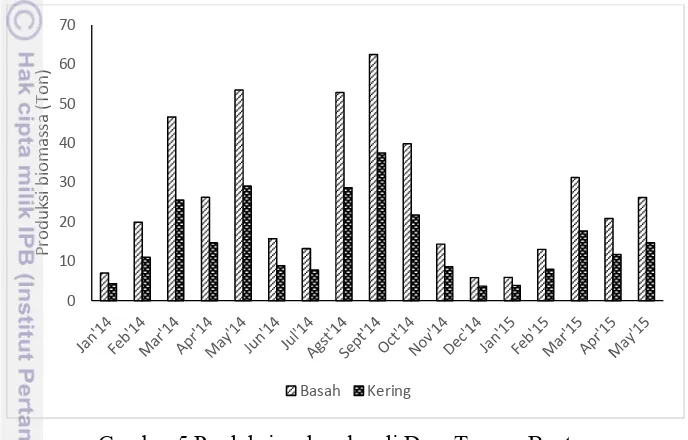
Gambar 5 Produksi makroalga di Desa Tanara, Banten
Penurunan kadar air rata-rata setelah proses pengeringan sebesar 56.64%. Nilai ini berasal dari selisih bobot basah dan kering dari makroalga hasil panen (Lampiran 1). Jumlah produksi makroalga basah paling tinggi terdapat pada bulan September 2014 sebesar 64.5 ton, sedangkan yang paling rendah terdapat pada bulan Desember 2014 sebesar 5.8 ton (Lampiran 2). Hasil panen disortir berdasarkan kualitas morfologinya seperi warna, ukuran, dan tingkat kebersihan talus dari lumpur atau pasir. Kualitas yang tidak layak jual biasanya ditumpuk di pinggir tambak sampai membusuk atau dikumpulkan di gudang dan dijual dengan harga yang semurah-murahnya.
15 Menurut Radiarta et al. 2013 musim tanam produktif umumnya terjadi pada bulan di mana curah hujan rendah (musim kemarau) dan suhu udara juga rendah (24-27°C). Pada musim panas atau bulan-bulan sebelum November petani merasa diuntungkan dengan penyinaran yang baik sehingga pertumbuhan makroalga sangant baik dan juga memudahkan dalam proses pengeringannya yang secara langsung dilakukan di pinggir-pinggir tambak.
Karakteristik Kandungan Makroalga
Gracilaria sp. merupakan genus makroalga yang dapat dimakan, tergolong pada kelas alga merah (Rhodophyta) (Norziah & Ching 2000, Dawczynski et al.
2007) dan memiliki kandungan gizi yang baik bagi tubuh. Makroalga segar dikonsumsi oleh masyarakat luas terutama oleh orang-orang yang tinggal di daerah pesisir. Dalam beberapa tahun terakhir makroalga semakin diminati dalam eksplorasi bidang farmasi bahkan telah terbukti menjadi sumber utama senyawa bioaktif dan biomaterial alami (Francavilla et al. 2013). Namun beberapa negara membudidayakan makroalga untuk produksi biogas (Hughes et al. 2012). Setiap spesies memiliki potensi dan karakteristik yang berbeda. Tabel 3 menunjukkan hasil uji proksimat dari beberapa spesies Gracilaria.
Tabel 3 Komposisi kandungan Gracilaria
Komposisi
(a)Baghel et al. 2014; (b)Kawaroe et al. 2013; (c)Yunizal 2004; (d)Anggadiredja et al. 2006;
(e)Penelitian ini
Substrat G. verrucosa (rejected) merupakan makroalga yang tidak dimanfaatkan karena ditolak dari industri. Makroalga ini memiliki kualitas rendah dilihat dari penampilan morfologi seperti warna yang pucat, ukuran yang lebih kecil, talus yang kurang segar, serta sisa lumpur atau pasir yang masih banyak menepel. Analisis proksimat menunjukkan bahwa rejected sampel memiliki kandungan karbohidrat yang lebih rendah daripada beberapa spesies lainnya. Selisih kandungan karbohidrat dengan G. verrucosa kualitas baik mencapai 18-22%. Kadar abu pada rejected sampel mencapai 40.31% dan nilainya paling besar diantara nilai kandungan proksimat yang lainnya. Kadar abu ini menunjukan nilai mineral yang berguna sebagai suplemen bagi tubuh (Baghel et al. 2014), namun perlu dianalisis jenis mineralnya.
16
Kotoran sapi dipilih sebagai campuran makroalga karena mengandung banyak bakteri pendegradasi sebagai pengurai bahan organik. Beberapa penelitian menggunakan kotoran sapi sebagai campuran substrat makroalga (Hansson 1983, Briand & Morand 1997, Bruhn et al. 2011, Machado et al. 2014), limbah pertanian (Meggyes 2012), limbah makanan (Ni'mah 2014, Somashekar et al. 2014) untuk menghasilkan biogas.
Kondisi pH Aklimatisasi dan Degradasi Anaerobik
Substrat memerlukan aklimatisasi untuk meningkatkan produksi metana dalam proses degradasi anaerobik. Hal ini bertujuan untuk memecah struktur organik kompleks menjadi molekul sederhana yang agar mudah terdegradasi oleh mikroba. Selain itu untuk mengadaptasikan inokulum bakteri tersebut pada substrat yang baru. Ada beberapa cara yang dilakukan dalam aklimatisasi seperti penyesuaian suhu, penambahan asam, penambahan nutrien, ataupun pemasukan substrat secara bertahap. Pada penelitian ini dilakukan aklimatisasi dengan pemasukan substrat secara bertahap agar keadaan pH dalam digester stabil dan bakteri dari kotoran sapi dapat tumbuh baik dalam substrat makroalga.
Keasaman atau pH merupakan parameter penting yang memengaruhi pertumbuhan mikroba selama degradasi anaerobik. Kondisi pH pada digester harus dijaga dalam kisaran yang diinginkan dari 6.8-7.2 atau pH netral dengan masukan substrat yang optimum (Yadvika et al. 2004). Dalam penelitian ini nilai pH lebih dari 7 karena bahan substrat merupakan campuran kotoran sapi dan makroalga
rejected dari tambak masih mengandung kadar garam walaupun sudah mengalami pencucian, sehingga pH-nya lebih dari. Gambar 6 menunjukkan nilai pH selama proses aklimatisasi.
Gambar 6 Nilai pH saat aklimatisasi substrat makroalga dan kotoran sapi
Selama proses aklimatisasi rentang pH berkisar antara 7.0-8.3 (Lampiran 2). Nilai ini berfluktuasi karena dilakukan penambahan makroalga setiap 4 hari ke dalam digester yang telah diisi kotoran sapi dan air. Kecenderungan nilai pH naik setelah penambahan substrat makroalga. Proses loading makroalga (2%) dihentikan ketika digester menghasilkan gas dan atau nilai pH stabil.
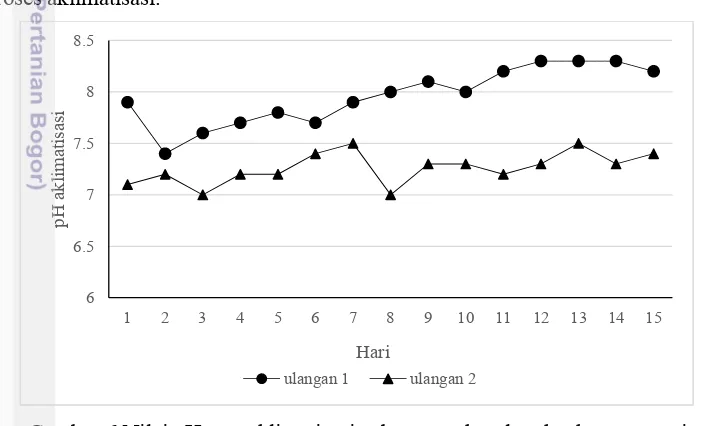
17 Produksi biogas dan efisiensi degradasi susbstrat lebih tinggi pada nilai pH 7 dibandingkan dengan nilai pH lainnya (Ghaly et al. 2000, Mahajoeno et al. 2008, Astuti et al. 2013). Nilai pH selama produksi biogas berkisar antara 7.2-8.4 (Lampiran 3). Nilai pH optimum dalam proses anaerobik makroalga berkisar antara 7.0-7.2 (Nagamani & Ramasamy et al. 1999) dan 7.0-7.7 (Hansson 1983) untuk meningkatkan hasil biogas, sementara pH rendah (<6) akan memberikan dampak negatif pada produksi gas. Kenaikan pH terjadi saat penambahan substrat dan sistem batch dimulai. Gambar 7 menunjukkan nilai pH selama produksi biogas.
Gambar 7 Nilai pH saat produksi biogas
Salah satu faktor yang meningkatkan nilai pH adalah bahan baku makroalga yang berasal dari tambak dengan salinitas dan pH yang lebih tinggi. Hasil pengukuran di menunjukan pH air tambak sebesar 8.5 dan salinitasnya antara 20-27 ‰. Salinitas ditentukan oleh kegiatan pertukaran kation (K+, Na+, Mg2+, dan Ca2+) yang terjadi pada air (Kombo et al. 2005, Saraswat et al. 2011). Selain itu, pH ditentukan oleh aktivitas H+, dimana air yang bersalinitas tinggi memiliki nilai pH yang lebih tinggi pula. Beberapa studi yang dilakukan penelitian biogas menggunakan makroalga menjelaskan bahwa nilai pH selama proses degradasi anaerobik adalah lebih dari 7 (Briand dan Morand 1997, Nkemka et al. 2014).
Fluktuasi nilai pH adalah implikasi dari proses kimia selama proses degradasi anaerobik. Nilai pH relatif menurun pada akhir pengamatan disebabkan oleh bakteri asidogenesis yang memproduksi asam asetat, hidrogen, karbon dioksida, dan Volatile Fatty Acid (VFA) yang tidak semua diubah menjadi biogas tetapi beberapa menjadi bagian atau komponen penghambat (Yadvika et al. 2004).
Nilai COD, TS, VS, dan Kadar Air Substrat
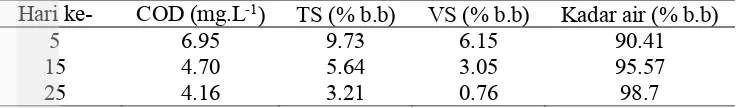
Chemical Oxygen Demand (COD) digunakan untuk menentukan kebutuhan oksigen untuk mengoksidasi jumlah bahan organik yang terkandung dalam substrat. Nilai ini juga bisa menentukan jumlah biogas yang dapat dihasilkan dari aktivitas degradasi anaerobik substrat. Tabel 4 menunjukan hasil analisis substrat selama degradasi anaerobik pada awal, pertengahan, dan akhir siklus batch.
18
Tabel 4 Nilai Chemical Oxygen Demand, Total Solid, Volatile Solid dan kadar air pada substrat selama degradasi anaerobik
Hari ke- COD (mg.L-1) TS (% b.b) VS (% b.b) Kadar air (% b.b)
5 6.95 9.73 6.15 90.41
15 4.70 5.64 3.05 95.57
25 4.16 3.21 0.76 98.7
Hasil analisis menunjukkan bahwa terjadi penurunan nilai COD dari awal sampai akhir proses degradasi anaerobik pada sistem batch. Persentasi degradasi mencapai 40% dari COD awal sebesar 6.95 mg.L-1 menjadi 4.16 mg.L-1, nilai ini lebih besar daripada degradasi campuran kotoran sapi dan ampas tebu yaitu 8.29-38.5% (Saputra et al. 2010). Penurunan COD menunjukkan konsumsi asam untuk produksi metana (Barlaz 1996). Hal ini dapat dilihat dari perubahan substrat dari bentuk yang lebih solid menjadi lebih cair, persentasi kadar air substrat meningkat, sebaliknya penurunan terjadi pada TS dan VS seiring bertambahnya hari.
Nilai TS dan VS menyatakan seberapa besar beban biomassa yang harus didegradasi mikroorganisme pada proses hidrolisis. Setelah mikroorganisme dapat beradaptasi dengan substrat makroalga perubahan kadar TS dan VS cenderung menurun selama berlangsungnya proses produksi biogas. Pada hari ke-5 nilai TS sebesar 9.73% b.b dan menurun 77% menjadi 3.21% b.b pada hari ke-25. Menurut Zennaki et al. 1998 konsentrasi TS yang optimal dalam proses degradasi anaerobik adalah 7-9% b.b, jika terlalu rendah maka akan mengakibatkan ketidakstabilan proses, namun jika terlalu tinggi makan akan menyebabkan overloading.
Nilai VS pada hari ke-5 sebesar 6.15% b.b dan menurun 77% menjadi 0.76 %b.b pada hari ke-25. Penurunan VS berindikasi dengan peningkatan kadar gas metana yang dihasilkan. Volatile solid merupakan substrat (sumber makanan) bagi mikroorganisme non metanogen yang bekerja pada tahap awal produksi biogas. Kadar air pun meningkat 9% dari 90.41% b.b pada hari ke-5 menjadi 98.7% b.b pada hari ke-25.
Degradasi anaerobik meliputi beberapa tahap dan reaksi. Tahap pertama adalah hidrolisis, dimana struktur organik kompleks dari substrat dipecah menjadi struktur yang lebih sederhana. Selanjutnya, pada tahap asidogenesis senyawa organik sederhana yang terbentuk pada saat hidrolisis diubah menjadi asam organik yang mudah menguap atau volatile (asetat, propionat, butirat dan asam valerat), karbon dioksida dan hidrogen. Selanjutnya, asetat, hidrogen dan karbon dioksida disintesis dari asam organik selama asetogenesis tersebut. Dalam methanogensis, produk-produk dari tahap sebelumnya diubah menjadi biogas yang terdiri dari CH4 dan CO2 sebagai komposisi utama (Geraradi 2003, Yebo et al. 2011) serta H2S sebagai sampingan.
Produksi dan Komposisi Biogas Makroalga
19
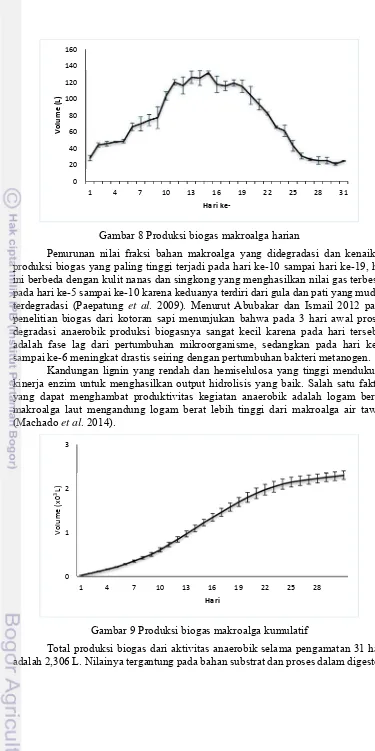
Gambar 8 Produksi biogas makroalga harian
Penurunan nilai fraksi bahan makroalga yang didegradasi dan kenaikan produksi biogas yang paling tinggi terjadi pada hari ke-10 sampai hari ke-19, hal ini berbeda dengan kulit nanas dan singkong yang menghasilkan nilai gas terbesar pada hari ke-5 sampai ke-10 karena keduanya terdiri dari gula dan pati yang mudah terdegradasi (Paepatung et al. 2009). Menurut Abubakar dan Ismail 2012 pada penelitian biogas dari kotoran sapi menunjukan bahwa pada 3 hari awal proses degradasi anaerobik produksi biogasnya sangat kecil karena pada hari tersebut adalah fase lag dari pertumbuhan mikroorganisme, sedangkan pada hari ke-4 sampai ke-6 meningkat drastis seiring dengan pertumbuhan bakteri metanogen.
Kandungan lignin yang rendah dan hemiselulosa yang tinggi mendukung kinerja enzim untuk menghasilkan output hidrolisis yang baik. Salah satu faktor yang dapat menghambat produktivitas kegiatan anaerobik adalah logam berat, makroalga laut mengandung logam berat lebih tinggi dari makroalga air tawar (Machado et al. 2014).
Gambar 9 Produksi biogas makroalga kumulatif
Total produksi biogas dari aktivitas anaerobik selama pengamatan 31 hari adalah 2,306 L. Nilainya tergantung pada bahan substrat dan proses dalam digester.
20
produksi harian biogas adalah 74.4 L.hari-1, hampir sama dengan literatur penelitian sebelumnya (Ghaly et al. 2000). Adapun jika di dilihat dari jumlah biomassa yang digunakan yaitu sebesar 25 kg, maka produksninya adalah 92.2 L.kg-1. Biogas yang dihasilkan mengandung beberapa gas penyusun dengan konsentrasi dan komposisi yang berbeda-beda. Tabel 5 menunjukan besar konsentrasi dari gas penyusun biogas makroalga saat sebelum dan setelah dilakukan filtrasi.
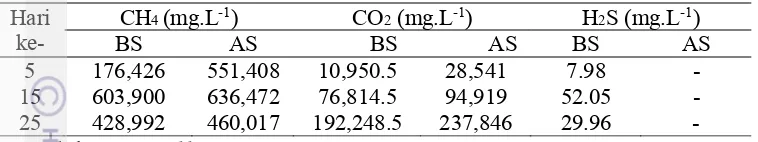
Tabel 5 Konsentrasi gas CH4, CO2, dan H2S pada biogas makroalga sebelum dan sesudah filtrasi dengan H2S scrubber
Hari
BS = Sebelum H2S scrubber
AS = Setelah H2S scrubber
(-) = tidak terdeteksi
Konsentrasi gas CH4 paling tinggi terjadi pada pengamatan hari ke-15, dimana nilainya berbeda antara gas sebelum dan setelah dilakukan filterisasi. Pada hari ke-5 konsentrasi lebih rendah dimungkinkan karena aktivitas metanogenesis belum terlalu efektif, namun pada hari ke-15 bakteri sedang melakukan produksi biogas yang optimum. Ketika produksi biogas sedang meningkat, kadar CH4 mencapai konsentrasi maksimum. Namun pada hari ke-25 nilainya menurun kembali dikarenakan penurunan jumlah padatan substrat dalam digester yang lama-kelamaan habis diuraikan oleh bakteri. Hal tersebut terjadi pada saat BS dan AS. Makroalga adalah bahan yang cepat terdegradasi, namun produksi gas berhenti cepat ketika digester mendapatkan masukan subatrat sehingga kandungan CH4 pun berkurang.
Konsentrasi CO2 semakin meningkat pada pertengahan sampai akhir pengamatan. Kenaikan tersebut terjadi pada perlakuan BS dan AS. Hal disebabkan oleh kegiatan bakteri yang menghidrolisis substrat namun tidak diimbangi dengan tahap metanogenesis karena keberadaan gas H2S dalam digester yang dapat menghambat proses metanogen (Nkemka & Murto 2010). Tingginya kadar CO2 menjadi indikasi rendahnya kandungan metana sehingga nilai energinya lebih rendah. Kandungan CO2 menurunkan nilai pemanasan (heating value) dari biogas. Oleh karena itu, pada saat biogas akan segera habis warna api akan sedikit memerah sebagai tanda tingginya kadar CO2 dalam biogas.
21 Mekanisme yang terjadi pada alat H2S scrubber yang digunakan berupa penyaringan secara fisik dan biologi. Gas melewati rongga-rongga kelereng menyebar ke bagian-bagian filter secara merata dan bakteri pengurai yang tumbuh pada media sabut mengoksidasi H2S sehingga kandungannya berkurang dalam biogas yang melewati filter. Kelebihan dari filter biologi yang digunakan adalah aman, low energy, dan murah. Namun kinerjanya sangat tergantung dengan bakteri yang ada di dalam filter. Pemakaian H2S scrubber yang terus-menerus akan mengurangi kemampuan daya saring dari alat itu sendiri karena aktivitas bakteri yang menurun seiring berkurangnya asupan nutrien dalam filter.
Selain konsentrasinya dapat dilihat juga seberapa besar komposisi gas penyusunnya. Gambar 10 menunjukan komposisi biogas sebelum dan sesudah filtrasi dengan H2S scrubber.
Gambar 10 Komposisi gas CH4, CO2, dan H2S dalam biogas makroalga Komposisi gas sebelum dan sesudah filtrasi tidak menunjukan perbedaan yang cukup besar walaupun pada data konsentrasi menunjukan adanya peningkatan nilai CH4 dan CO2. Besar komposisi CH4 sebelum filter sebesar 83.97% namun setelah filter menjadi 82.67%. Komposisi CO2 bertambah dari 16.02% menjadi 17.33%. Sedangkan H2S komposisinya berkurang menjadi nol karena tidak dapat terseteksi lagi keberadaannya. Menurut penelitian Soerawidjaja 2009 komposisi metan dalam biogas sebesar 50-70%, namun dalam penelitian ini nilainya mencapai lebih dari 80%, beberapa pertimbangan yaitu karena pengukuran hanya dilakukan pada 3 jenis gas saja dan besar kemungkinana ada beberapa gas sampingan lainnya. Gas sampingan lainnya bisa mencapai 16% terkandung di dalam biogas seperti uap air (1%), hidrogen (10%), nitrogen (2%), oksigen (2%), dan amonia (1%) (Soerawidjadja 2009).
Uji Coba dan Konversi Biogas Makroalga
Produk biogas diujicobakan dan dikonversi menjadi energi lain yaitu digunakan untuk menghidupkan lampu dan kompor biogas. Berdasarkan penelitian yang telah dilakukan oleh Widodo et al. 2006 volume biogas kotoran sapi yang dibutuhkan untuk menyalakan lampu sebanyak 0.23 m3.jam-1 (3.8 L.min-1),
22
sedangkan kompor sebesar 0.3 m3.jam-1 (5 L.min-1). Tabel di bawah menunjukan hasil konversi gas yang didapatkan pada penelitian.
Tabel 6 Volume biogas makroalga dalam pemanfaatan lampu dan kompor Alat uji coba Waktu (menit) Volume yang dibutuhkan (L)
Lampu biogas 1 1.8
Kompor biogas 1 6.0
Mendidihkan 1 L air tawar 4 24
Selain itu uji coba dilakukan dengan memanaskan air tawar sebanyak 1 L dan membutuhkan waktu selama ±4 menit sehingga volume biogas yang dibutuhkan sebanyak 24 L. Nyala lampu dan kompor ini tergantung pada kandungan metana pada biogas. Saat kadar metana menurun, warna dari nyala api berubah dari biru menjadi biru kemerahan, sama halnya dengan lampu, tingkat keterangannya berubah-ubah sesuai dengan kadar metana.
(a) (b)
Gambar 11 Aplikasi biogas makroalga dalam kehidupan sehari-hari (a) kompor biogas; (b) lampu biogas
Biogas makroalga ini belum banyak dikembangkan di Indonesia. Namun di beberapa negara subtropik yang memiliki kelimpahan makroalga tinggi serta kejadian blooming si perairannya, makroalga sudah banyak dimanfaatkan untuk mengurangi dampak lingkungan serta eksplorasi energy terbarukan (Briand & Morand 1997, Hughes et al. 2012). Salah satu negara yang telah mengembangkan biogas dengan baik dan memiliki perhitungan yang jelas mengenai biogas adalah Swedia. Volume 1 m3 biogas dengan kandungan CH
4 60% setara dengan 6 kWh, jika CH4 97% setara dengan 10 kWh (SGC 2012). Namun sumber lain menyatakan CH4 60% pada 1 m3 biogas setara dengan 1.25 kWh (Kristoferson and Bolalders 1991). Biogas yang diaplikasikan sebagai bahan bakar kendaraan dikategorikan menjadi 2 tipe yaitu Tipe A digunakan pada kendaraan berat seperti truk dan bus, sedangkan Tipe B digunakan pada mobil pribadi yang tipe pembakarannya sempurna atau stoichiometric combustion.
23
4
SIMPULAN DAN SARAN
Simpulan
Konversi biomassa makroalga menjadi biogas dapat dilakukan dengan bantuan inokulum bakteri yang berasal dari kotoran sapi menggunakan alat digester pada kondisi anaerobik. Biomassa yang digunakan adalah makroalga rejected
karena tidak layak untuk bahan baku industri karena dilihat dari segi fisik dan kandungannya lebih rendah. Nilai pH substrat berfluktuasi seiring dengan proses yang terjadi di dalam digester. Pada saat aklimatisasi pH cenderung meningkat, sedangkan pada saat degradasi anaerobik pH cenderung menurun. Kondisi substrat setelah proses degradasi cenderung menjadi lebih cair, mengindikasikan adanya penguraian bahan padat menjadi biogas dengan menurunnya COD, TS, dan VS. Filtrasi menggunakan H2S scrubber mengurangi kandungan H2S dalam biogas namun tidak terlalu mengubah komposisi gas CH4 dan CO2. Biogas makroalga dapat diaplikasikan dalam kebutuhan rumah tangga sebagai energ alternatif yang aman dan berkelanjutan.
Saran
24
DAFTAR PUSTAKA
Abubakar BSU, Ismail N. 2012. Anaerobic digestion of cow dung for biogas production. Journal of Engineering and Applied Sciences. 7(2): 167-172. Adams JM, Gallagher JA, Donnison IS. 2009. Fermentation study on Saccharina
latissima for bioethanol production considering variable pre-treatments. Apply Phycology. 21:569–574.
Anggadiredja JT, Zatnika A, Purwanto H, Istini. 2006. Rumput Laut Pembudidayaan, Pengolahan, dan Pemasaran Komoditas Perikanan Potensial. Jakarta (ID): Penebar Swadaya.
[APHA] American public Health Assocoation. 1998. Standar Methods for the Examination of Water and Wastewater. 20th Edition. Baltimore (USA): Victor Graphics Inc.
Aresta M, Dibendetto A, Berberio G. 2005. Utilization of macro-algae for enhanced CO₂ fixation and biofuels production: development of a computing software for LCA study. Fuel Process Technology. 86:1679-1693.
Astuti N, TR Soeprobowati, Budiyono. 2013. Observation of temperature and pH during biogas production from water hyacinth and cow manure. Waste Technology. 1(1):22-25.
[BSN] Badan Standarisasi Nasional. 1992. SNI 01-2891-1992: Cara Uji Makanan dan Minuman. Jakarta.
[BSN] Badan Standarisasi Nasional. 2005. SNI 19-7117.7-2005. Emisi Gas Buang, Sumber Tidak Bergerak (Bagian 7: Cara Uji Kadar Hidrogen Sulfida (H2S) dengan Metode Metilen Biru Menggunakan Spektrofotometer). Jakarta.
Baghel RS, Kumari P, Reddy CRK, Jha B. 2014. Growth, pigments, and biochemical composition of marine red alga Gracilaria crassa. Apply Phycology. 26:2143–2150.
Barlaz MA. 1996. Microbiology of Solid Waste Landfills. In: Microbiology of Solid Waste. AC Palmisano and MA Barlaz (eds). Florida (US): CRC Press, Inc. Beauchemin K, Kreuzer M, O’Mara F, McAllister T. 2008. Nutritional
management for enteric methane abatement: a review. Animal Production Science. 48:21–27.
Bird KT, Chynoweth DP, Jerger DE. 1990. Effect of marine algal proximate composition on methane yields. Apply Phycology. 2:207-213.
Briand X, Morand P. 1997. Anaerobic digestion of Ulva sp. 1 relationship between
Ulva composition and methanisation. Apply Phycology. 9:511–524.
Bruhn A, Dahl J, Nielsen HB, Nikolaisen L, Rasmussen MB, Markager S, Olesen B, Arias C, Jensen PD. 2011. Bioenergy potential of Ulva lactuca: biomass yield, methane production and combustion. Bioresource Technology. 102:2595-2604. Chynoweth D, Isaacson R. 1987. Anaerobic Digestion of Biomass. New York (US):
Elsevier Science Publishing.
[DEN] Dewan Energi Nasional. 2014. Outlook Energi Indonesia 2014. Jakarta (ID): Dewan Energi Nasional Republik Indonesia.
Dawczynski C, Schubert R, Jahreis G. 2007. Amino acids, fatty acids, and dietary fiber in edible seaweed products. Food Chemistry. 103:891–899.
Duckworth M, Hong KC, Yaphe W. 1971. The agar polysaccharides of Gracilaria
25 Francavilla M, Franchi M, Monteleone M, Caroppo C. 2013. The red seaweed
Gracilaria gracilis as a multi products source. Marine Drugs. 11:3754-3776. Gao K, McKinley KR. 1994. Use of macroalgae for marine biomass production and
CO2 remediation-a review. Apply Phycology. 6:5–60.
Geraradi MH. 2003. The Microbiology of Anaerobic Digesters. New Jersey (UK): John Wiley & Sons.
Ghaly AE, Ramkumar DR, Sadaka SS, Rochon JD. 2000. Effect of reseeding and pH control on the performance of a two-stage mesophilic anaerobic digester operating on acid cheese whey. Canadian Agricultural Engineering. 42(4):173-183.
Goh CS, Lee KT. 2010. A visionary and conceptual macroalgae based third generation bioethanol (TGB) biorefinery in Sabah, Malaysia as an underlay for renewable and sustainable development. Renewable and Sustainable Energy Review. 14:842–848.
Gregor DZ, Grilc V. 2012. Anaerobic treatment and biogas production from organic waste. Management of Organic Waste. ISBN 978-953-307-925-7
Hansson G. 1983. Methane production from marine, green macroalgae. Resource and Conservation. 8:185-194.
Horn SJ, Aasen IM, Østgaard K. 2000. Production of ethanol from mannitol by
Zymobacter palmae. IndianMicrobiology and Biotechnology. 24:51–57. Hughes AD, Kelly MS, Black KD, Stanley MS. 2012. Biogas from macroalgae: is
it time to revisit the idea? Biotechnology for Biofuels. 5(86):1-7.
Jeong GT, Park DH. 2009. Production of sugars and levulinic acid from marine biomass Gelidium amansii.Apply Biochemical and Biotechnology. 161:41-52. John RP, Anisha GS, Nampoothiri KM, Pandey A. 2011. Micro and macroalgal
biomass: a renewable source for bioethanol. Bioresource Technology. 102:186-193.
Kawaroe M, Bengen DG, Barat WOB. 2012. Pemanfaatan karbondioksida (CO2) untuk optimalisasi pertumbuhan rumput laut Kappaphycus alvarezii. Omni-Akuatika. 11:78 – 90.
Kawaroe M, Prartono T, Kusuma AH. 2013. Effect of acid concentration on hydrolysis efficiency on Caulerpa racemosa, Sargassum crassifolium and Gracilaria salicornia. Environment and Bioenergy. 8(3): 127-134.
Kawaroe M, Agustine D, Sunuddin A, Sofyan F. 2015. Anaerobic biodegradation using macroalgae Eucheuma cottonii to produce bio-methane. International Journal of Applied Engineering Research. 10(15):35559-35565.
Klein, Shimon. 2013. Reforming of hydrocarbon gas with solar energy. US20130181169, WO2013105052A4. Publication number WO2013105052A1. Kombo MM, SA Vuai, M Ishiki, A Tokuyama. 2005. Influence of Salinity on pH and Aluminum Concentration on the Interaction of Acidic Red Soil with Seawater. Journal of Oceanography. 61:591-601.
Kristoferson LA, Bolalders V. 1991. Renewable Energy Technology, Their Application in Developing Countries. London (UK): Intermediate technology publication.
26
Lastella G, Testa C, Cornacchia G, Notornicola M, Voltasio F, Sharma VK. 2002. Anaerobic digestion of semi-solid organic waste: Biogas production and its purification. Energy Conversion and Management. 43:63-75.
Machado L, Magnusson M, Paul NA, de Nys R, Tomkins N. 2014. Effects of marine and freshwater macroalgae on in vitro total gas and methane production.
Plos One. 9(1):e85289. doi:10.1371/journal.pone.0085289.
Mahajoeno E, BW Lay, SH Sutjahjo, Siswanto. 2008. The possibility of palm oil milleffluent for biogas production. Biodiversitas. 9(1):48-52.
Meggyes A. 2012. Biogas and energy production by utilization of different agricultural wastes. Acta Polytechnica Hungarica. 9(6):65-80.
Msuya FE, Shalli MS, Sullivan K, Crawford B, Tobey J Mmochi AJ. 2013. A Comparative Economic Analysis of Two Seaweed Farming Methods in Tanzania. United States Agency for International Development (USAID). Nagamani B, Ramasamy K. 1999. Biogas production technology: an Indian
perspective. Current Science. 77: 44-55.
Ni’mah L. 2014. Biogas from solid waste of tofu production and cow manure mixture: composition effect. Chemica. 1(1):1-9.
Nkemka VN, Murto M. 2010. Evaluation of biogas production from seaweed in batch tests and in UASB reactors combined with the removal of heavy metals.
Environmental Management. 91:1573-1579.
Nkemka VN, JA Rivera, M Murto. 2014. Two-stage dry anaerobic digestion of beach cast seaweed and its codigestion with cow manure. Journal of Waste Management. doi:10.1155/2014/325341.
Norziah MH, Ching CY. 2000. Nutritional composition of edible seaweed
Gracilaria changgi. Food Chemistry. 68:69-76.
Paepatung N, Nopharatana A, Songkasiri W. 2009. Bio-methane potential of biological solid materials and agricultural wastes. Asian Journal of Energy and Environment. 10(1):19-27.
Radiarta IN, Elwana E. 2013. Pengaruh iklim terhadap musim tanam rumput laut Kappaphycus alvarezii di Teluk Gerupuk Kabupaten Lombok Tengah, Nusa Tenggara Barat. Jurnal Riset Akuakultur. 8(3): 453-464
.
Romagnoli F, Blumberga D, Gigli E. 2010. Biogas from marine macroalgae: a new environmental technology life cycle inventory for a further LCA. Riga Technical University Environmental and Climate Technology. 4:97-109.
Saputra T, Triatmojo S, Pertiwiningrum A. 2010. Biogas production from mixture of dairy manure and bagasse with different C/N ratio. Buletin Peternakan. 34(2): 114-122.
Saraswat R, M Kouthanker, S Kurtarkar, R Nigam, VN Linshy. 2011. Effect of salinity induced pH changes on benthic foraminifera: a laboratory culture experiment. Biogeoscience Discussion. 8:8423–8450.
[SGC] Swedish Gas Center. 2012. Basic Data on Biogas. Swedia: Svenskt Gastekniskt Center AB ISBN: 978-91-85207-10-7.
Soerawidjaja TH. 2009. Biogas, Teknologi Kemurgi TK 5038 Modul 13. Bandung (ID): Institut Teknologi Bandung.
27 Stewart WPD. 1974. Algal Physiology and Biochemistry. Botanical Monographs.
Blackwell Scientific Publications. 989 pp.
Subhadra B, Edwards M. 2010. An integrated renewable energy park approach for algal biofuel production in United States. Energy Policy. 38:4897–4902.
Sunarso, Johari S, Widiasa IN, Budiyono. 2010. The effect of feed to inoculums ratio on biogas production rate from cattle manure using rumen fluid as inoculums. Science and Engineering. 1:41-45.
Suwardin D, Setiadi T, Damanhuri E. 2007. Biofiltrasi dalam penyisihan limbah gas H2S dan NH3 aplikasi teknik. Seminar Nasional Fundamental dan Aplikasi Teknik Kimia 2007. Surabaya, 15 November 2007. ISSN 1410-5667.
Wargacki AJ, Leonard E, Win MN, Regitsky DD, et al. 2012. An engineered microbial platform for direct biofuel production from brown macroalgae.
Science. 335:308–313.
Wei N. Quarterman J, Jin YS. 2013. Marine macroalgae: an untapped resource for producing fuels and chemicals. Trends in Biotechology. 31(2):70-77.
Widodo TW, Asari A, N Ana, R Elita. 2006. Design and development of biogas reactor for farmer group scale. Engineering Agriculture. 4(1):41-52.
Yadvika, Santosh, Sreekrishnan TR, Kohli S, Rana V. 2004. Enhancement of biogas production from solid substrates using different techniques––a review.
Bioresource Technology. 95: 1-10.
Yebo L, Park S, Zhu J. 2011. Solid state anaerobic digestion for methane production from organic waste. Reneweable and Sustain EnergyReview. 15:821-826. Yen HW, Brune DE. 2007. Anaerobic co-digestion of algal sludge and waste paper
to produce methane. Bioresource Technology. 98:130–134.
Yunzial. 2004. Teknik Pengolahan Alginat. Jakarta (ID): Pusat Riset Pengolahan Produk dan Sosial Ekonomi Kelautan dan Perikanan.
Zennaki BZ, Zadi A, Lamini H, Aubinear M, Boulif M, 1996. Methane fermentation of cattle manure: effects of HRT, temperature & substrate concentration. Tropicultural. 14 (4): 134–140.
28
LAMPIRAN
Lampiran 1 Data produksi bulanan makroalga Gracilaria verrucosa di Desa Tanara, Banten
Bulan Basah (Ton) Kering (Ton) Penurunan Kadar Air (%)
Jan'14 7.048 4.362 61.89
Feb'14 19.938 11.039 55.37
Mar'14 46.663 25.563 54.78
Apr'14 26.265 14.698 55.96
May'14 53.537 29.123 54.40
Jun'14 15.764 8.898 56.45
Jul'14 13.254 7.796 58.82
Agst'14 52.864 28.731 54.35
Sept'14 62.534 37.534 60.02
Oct'14 39.839 21.775 54.66
Nov'14 14.385 8.616 59.90
Dec'14 5.875 3.72 63.32
Jan'15 5.929 3.882 65.47
Feb'15 13.033 7.984 61.26
Mar'15 31.317 17.744 56.66
Apr'15 20.889 11.746 56.23
May'15 26.232 14.705 56.06
Lampiran 2 Data nilai pH harian saat aklimatisasi kotoran sapi dan makroalga
29 Lampiran 3 Data nilai pH harian saat degradasi anaerobik (produksi biogas)
Hari Ulangan 1 Ulangan 2
1 8.3 8
2 8.4 8
3 8.4 8
4 8.4 8.2
5 8.4 8.2
6 8.3 8.1
7 8.2 8
8 8.3 8
9 8.3 7.9
10 8.2 8
11 8.2 7.8
12 8.2 7.8
13 8.3 7.9
14 8.3 8
15 8.3 7.7
16 8.1 7.8
17 8.1 7.8
18 8.2 7.8
19 8.1 7.8
20 8.2 7.8
21 8.2 7.8
22 8 7.9
23 8 7.8
24 8 7.8
25 8 7.5
26 7.9 7.5
27 7.9 7.5
28 7.9 7.4
29 7.9 7.4
30 7.8 7.2
30
Lampiran 4 Data volume produksi harian dan kumulatif biogas makroalga
Hari Volume kumulatif (L) Volume harian (L) U 1 U 2 Rata-rata U 1 U 2 Rata-rata
1 24 33 28.5 24 33 28.5
2 65 81 73 41 48 44.5
3 107 131 119 42 50 46
4 156 178 167 49 47 48
5 202 230 216 46 52 49
6 262 303 282.5 60 73 66.5
7 320 385 352.5 58 82 70
8 385 469 427 65 84 74.5
9 444 565 504.5 59 96 77.5
10 541 676 608.5 97 111 104
11 657 801 729 116 125 120.5
12 759 932 845.5 102 131 116.5
13 875 1069 972 116 137 126.5
14 988 1207 1097.5 113 138 125.5
15 1123 1336 1229.5 135 129 132
16 1227 1468 1347.5 104 132 118
17 1335 1592 1463.5 108 124 116
18 1449 1717 1583 114 125 119.5
19 1554 1843 1698.5 105 126 115.5
20 1643 1963 1803 89 120 104.5
21 1727 2066 1896.5 84 103 93.5
22 1807 2151 1979 80 85 82.5
23 1871 2219 2045 64 68 66
24 1942 2271 2106.5 71 52 61.5
25 1995 2305 2150 53 34 43.5
26 2031 2331 2181 36 26 31
27 2060 2356 2208 29 25 27
28 2092 2375 2233.5 32 19 25.5
29 2123 2395 2259 31 20 25.5
30 2147 2414 2280.5 24 19 21.5
31 2173 2438 2305.5 26 24 25