OPTIMALISASI PEMBUATAN GLUKOSAMIN HIDROKLORIDA
DARI KITOSAN CANGKANG BELANGKAS (Tachypleus gigas)
SKRIPSI
DINNA DWI DAMAYANTI
110822019
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
OPTIMALISASI PEMBUATAN GLUKOSAMIN HIDROKLORIDA
DARI KITOSAN CANGKANG BELANGKAS (Tachypleus gigas)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat untuk mencapai gelar Sarjana Sains
DINNA DWI DAMAYANTI
110822019
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : OPTIMALISASI PEMBUATAN GLUKOSAMIN HIDROKLORIDA DARI KITOSAN CANGKANG BELANGKAS (Tachypleus gigas) Kategori : SKIRPSI
Nama : DINNA DWI DAMAYANTI Nomor Induk Mahasiswa : 110822019
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di Medan, April 2013
Dosen Pembimbing II Dosen Pembimbing I
Prof.Dr.Zul Alfian,Msc
NIP.195504051983031002 NIP.195308171983031002 Prof.Dr.Harry Agusnar,M. Sc,M.Phill
Diketahui / Disetujui oleh:
Ketua Departemen Kimia FMIPA USU
PERNYATAAN
OPTIMALISASI PEMBUATAN GLUKOSAMIN HIDROKLORIDA DARI KITOSAN CANGKANG BELANGKAS ( Tachypleus Gigas )
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, April 2013
PENGHARGAAN
Puji dan syukur ke hadirat Allah SWT, karena berkat rahmat dan karunia-Nya tugas akhir ini telah selesai disusun dalam rangka memenuhi kewajiban penulis sebagai salah satu syarat memperoleh gelar Sarjana Fakultas Matematika dan Ilmu Pengetahuan Alam di Universitas Sumatera Utara. Shalawat beriring salam penulis kirimkan kepada Nabi Muhammad SAW beserta keluarga dan para sahabat beliau..
Dalam penulisan tugas akhir ini penulis ingin mengucapkan rasa hormat dan terima kasih yang tak terhingga kepada ibunda dan ayahanda tercinta, Minarsih dan Saliman Paridi buat kakak saya Puji Utomo, atas cinta kasih, dukungan baik moril maupun materil, pengorbanan, serta doa tulus tiada hentinya demi kebaikan dan kebahagian penulis.
Selain itu penulis juga ingin megucapkan terima kasih yang sebesar-besarnya kepada:
1. Prof. Dr. Harry Agusnar,M.Sc, M.Phill selaku pembimbing 1 yang telah
memberikan topik dan tunjuk ajar dalam penelitian ini dan banyak memberikan pengarahan dan bimbingan hingga terselesaikannya skripsi ini.
2. Prof. Dr.Zul Alfian.M.Sc. selaku dosen pembimbing 2 yang telah memberikan saran hingga terselesaikannya penelitian ini.
3. Dr. Rumondang Bulan. MS dan Dr. Darwin Yunus, MS selaku Ketua dan
Koordinator Departemen Kimia Ekstensi FMIPA USU.
4. Bapak dan Ibu Dosen yang telah memberikan ilmunya selama masa studi saya di FMIPA USU.
5. Kepala, staf dan seluruh asisten Laboratorium Kimia Analitik FMIPA USU Medan yang telah memberikan segala fasilitas terbaik selama saya melakukan penelitian terutama untuk Bang Boby dan kak Tiwi, terima kasih atas masukan dan kerjasamanya.
6. Teman-teman seperjuangan saya: Aurora khairani Nst, Retno Hutami dan Sri sepadani yang tidaklah dapat saya sebutkan satu per satu namanya, namun sungguh sangat berkesan di hati saya. Terima kasih karena kalian telah menambah warna dalam hidup saya.
7. Untuk Pak aman Laboran di Lab penelitian Kimia Analitik yang banyak
meluangkan waktuny dan membantu penulis dalam pengerjaan penelitian
Saya menyadari bahwa skripsi ini masih banyak kekurangan, karena keterbatasan saya baik dalam literatur maupun pengetahuan. Oleh karena itu, saya mengharapkan kritik dan saran yang membangun demi kesempurnaan skripsi ini, dan semoga skripsi ini bermanfaat bagi kita semua.
Medan, April 2013
ABSTRAK
Optimalisasi pembuatan glukosamin hidroklorida dari kitosan cangkang belangkas, menggunakan metode hidrolisis kimia dengan variasi konsentrasi HCl, waktu dan suhu masing – masing ( 2 M. 1 jam, 500C ; 4 M, 2 jam, 600C ; 8 M, 3 jam, 700C ; 10 M, 4 jam, 800C ; 12 M , 5 jam, 900C) yang telah dilakukan. Penentuan karekteristik glukosamin hidroklorida dilakukan menggunakan analisis FT-IR. Diperoleh karekteristik glukosamin hidroklorida pada pita serapan gugus O-H untuk 2 M = 3457,13 cm-1,4 M = 3446,22 cm-1, 8 M = 3446,22 cm-1, 10 M = 3446,02 cm-1 dan 12 M = 3447,17 cm-1 dan pita serapan gugus N-H 2 M = 1646,50 cm-1, 4 M = 1597,46 cm-1 8 M = 1639,83 cm-1, 10 M = 1541,50 cm-1 dan 12 M = 1422 cm-1, pita serapan gugus C-N 4 M = 1383,61 cm -1, 8 M = 1380,69 cm -1, 10 M = 1387,05 cm-1, 12 M = 1383,60 cm-1 serta pita serapan gugus glikosidik 2 M = 1082 cm-1, 4 M = 1096,91 cm-1, 8 M = 1082 cm-1, 10 M = 1082,93 cm-1 dan 12 M = 1034,55 cm-1.Penentuan konsentrasi glukosamin hidroklorida dengan analisis
spektrofotometer uv pada λ=197 nm merupakan serapan dari kurva kalibrasi dengan N
OPTIMIZATION OF PREPARATION OF GLUCOSAMINE
HYDROCHLORIDE HORSESHOE CRAB SHELL CHITOSAN
(Tachypleus Gigas)
ABSTRACT
Optimization of preparation of glucosamine hydrochloride from chitosan shell crab, using chemical hydrolysis method with variation of HCl concentration, time and temperature of each - each (2 M. 1 hour, 50 0C, 4 M, 2 hours, 60 0C; 8 M, 3 hours, 70 0C; 10 M, 4 hours ,80 0C; 12 M, 5 hours, 90 0C) that has been done. Determination of glucosamine hydrochloride characteristics performed using FT-IR analysis. Obtained characteristics of glucosamine hydrochloride on the absorption band of OH for 2 M = 3457,13 cm-1, 4 M = 3446.22 cm-1, 8, M = 3446.22 cm-1, 10 M = 3446.02 cm-1 and 12, M = 3447.17 cm-1 and N-H group absorption band 2 M = 1646.50 cm-1, 4 M = 1597.46 cm-1, 8 M = 1639.83 cm -1
, 10 M = 1541.50 cm-1 and 12 M = 1422 cm-1 absorption band C -N group 4 M = 1383,61 cm-1, 8, M = 1380,69 cm-1, 10 M = 1387.05 cm-1, 12 M = 1383, 60 cm-1 and the absorption band glycosidic group 2 M = 1082 cm-1, 4 M = 1096.91 cm-1,8 M =1082 cm-1, 10 M = 1082.93 cm-1 and 12 M = 1034, 55 cm-1. Determination concentration of glucosamine
hydrochloride with uv spectrophotometer analysis at λ = 197 nm is the absorption of the
calibration curve with N-acetylglucosamine hydrochloride in 0.01% acetic acid solution. Obtained from calibration curve it was concentrations of glucosamine hydrochloride (20.17 ppm, 25.98 ppm, 34.52 ppm, 41.68 ppm and 48.05 ppm) derived from the standard absorbance 56.22 ppm. The optimum conditions were obtained at a concentration of 12 M and 90 0C temperature for 5 hours.
Halaman
3.5.2.5 Bagan Hidrolisa HCl 10 M 23
3.5.2.6 Bagan Hidrolisa HCl 12 M 24
3.6 Bagan Analisa Spektrofotometer uv/vis 25
3.6.1 Bagan untuk Larutan asam asetat 25 3.6.2 Bagan untuk Larutan N-asetilglukosamin 26
3.6.3 Bagan untuk Larutan Glukosamin HCl 27 BAB 4 HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian 28
4.1.1 Hidrolisa dengan kitosan 28
4.1.2 Pengukuran analisis dengan spektrofotometer 29
4.1.3 Pengkuran analisis N-asetilglukosamindalam asam asetat 0,01 M 30
4.1.4 Perhitungan 31 4.2 Pembahasan 35
4.2.1 Karekteristik Glukosamin HCl dengan FTIR 35
4.2.2 Glukosamin HCl dengan Spektrofotometer uv/vis 36
BAB 5 KESIMPULAN DAN SARAN 5.1. Kesimpulan 37
5.2. Saran 37
DAFTAR TABEL
Halaman
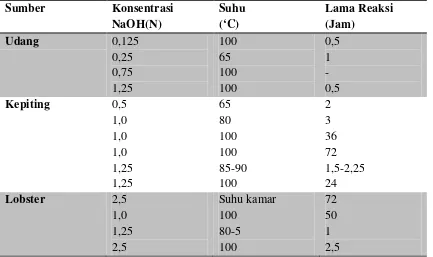
Tabel 2.1 Kondisi Perlakuan dengan NaOH pada proses Deproteinisasi 9
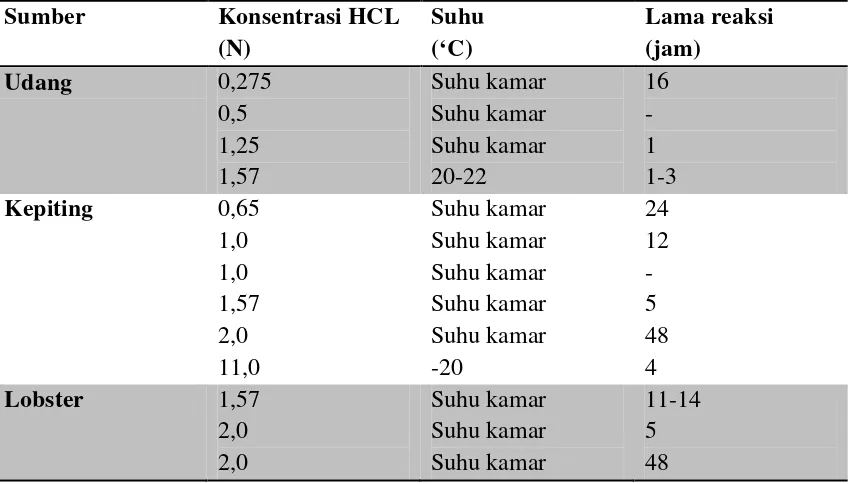
Tabel 2.2 Kondisi Perlakuan dengan HCL pada proses Demineralisasi 10
Tabel 4.1 Perbandingan Serapan FTIR Glukosamin HCl dan standar 28
Tabel 4.2 Data pengukuran absorbansi untuk asam asetat pada λ=197 nm 29
Tabel 4.2.1 Data pngukuran absorbansi untuk N-asetilglukosamin pada λ=197 nm 30
Tabel 4.3 Data Penurunan persamaan regresi untuk N-asetilglukosamin 31
Tabel 4.4 Data absorbansi glukosamin hidroklorida 32
DAFTAR GAMBAR
Halaman
Gambar 2.1 Proses kitin menjadi kitosan 5
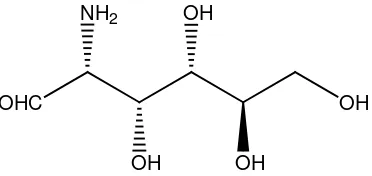
Gambar 2.2 Glukosamin 11
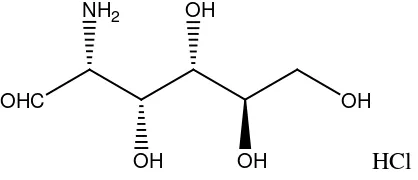
Gambar 2.3 Glukosamin Hidroklorida 11
ABSTRAK
Optimalisasi pembuatan glukosamin hidroklorida dari kitosan cangkang belangkas, menggunakan metode hidrolisis kimia dengan variasi konsentrasi HCl, waktu dan suhu masing – masing ( 2 M. 1 jam, 500C ; 4 M, 2 jam, 600C ; 8 M, 3 jam, 700C ; 10 M, 4 jam, 800C ; 12 M , 5 jam, 900C) yang telah dilakukan. Penentuan karekteristik glukosamin hidroklorida dilakukan menggunakan analisis FT-IR. Diperoleh karekteristik glukosamin hidroklorida pada pita serapan gugus O-H untuk 2 M = 3457,13 cm-1,4 M = 3446,22 cm-1, 8 M = 3446,22 cm-1, 10 M = 3446,02 cm-1 dan 12 M = 3447,17 cm-1 dan pita serapan gugus N-H 2 M = 1646,50 cm-1, 4 M = 1597,46 cm-1 8 M = 1639,83 cm-1, 10 M = 1541,50 cm-1 dan 12 M = 1422 cm-1, pita serapan gugus C-N 4 M = 1383,61 cm -1, 8 M = 1380,69 cm -1, 10 M = 1387,05 cm-1, 12 M = 1383,60 cm-1 serta pita serapan gugus glikosidik 2 M = 1082 cm-1, 4 M = 1096,91 cm-1, 8 M = 1082 cm-1, 10 M = 1082,93 cm-1 dan 12 M = 1034,55 cm-1.Penentuan konsentrasi glukosamin hidroklorida dengan analisis
spektrofotometer uv pada λ=197 nm merupakan serapan dari kurva kalibrasi dengan N
OPTIMIZATION OF PREPARATION OF GLUCOSAMINE
HYDROCHLORIDE HORSESHOE CRAB SHELL CHITOSAN
(Tachypleus Gigas)
ABSTRACT
Optimization of preparation of glucosamine hydrochloride from chitosan shell crab, using chemical hydrolysis method with variation of HCl concentration, time and temperature of each - each (2 M. 1 hour, 50 0C, 4 M, 2 hours, 60 0C; 8 M, 3 hours, 70 0C; 10 M, 4 hours ,80 0C; 12 M, 5 hours, 90 0C) that has been done. Determination of glucosamine hydrochloride characteristics performed using FT-IR analysis. Obtained characteristics of glucosamine hydrochloride on the absorption band of OH for 2 M = 3457,13 cm-1, 4 M = 3446.22 cm-1, 8, M = 3446.22 cm-1, 10 M = 3446.02 cm-1 and 12, M = 3447.17 cm-1 and N-H group absorption band 2 M = 1646.50 cm-1, 4 M = 1597.46 cm-1, 8 M = 1639.83 cm -1
, 10 M = 1541.50 cm-1 and 12 M = 1422 cm-1 absorption band C -N group 4 M = 1383,61 cm-1, 8, M = 1380,69 cm-1, 10 M = 1387.05 cm-1, 12 M = 1383, 60 cm-1 and the absorption band glycosidic group 2 M = 1082 cm-1, 4 M = 1096.91 cm-1,8 M =1082 cm-1, 10 M = 1082.93 cm-1 and 12 M = 1034, 55 cm-1. Determination concentration of glucosamine
hydrochloride with uv spectrophotometer analysis at λ = 197 nm is the absorption of the
calibration curve with N-acetylglucosamine hydrochloride in 0.01% acetic acid solution. Obtained from calibration curve it was concentrations of glucosamine hydrochloride (20.17 ppm, 25.98 ppm, 34.52 ppm, 41.68 ppm and 48.05 ppm) derived from the standard absorbance 56.22 ppm. The optimum conditions were obtained at a concentration of 12 M and 90 0C temperature for 5 hours.
BAB 1
PENDAHULUAN
1.1Latar Belakang
Kitosan merupakan polisakarida alami yang nontoxic, biodegradable, dan biocompatible yang dihasilkan dari proses deasetilasi kitin yang terkandung di dalam cangkang bintang invertebrate terutama crustacean, seperti udang, kepiting, dan rajungan. Kitosan dapat dimanfaatkan secara luas diberbagai bidang industry seperti dalam bidang pangan (nutraceutical,flavor, pembentuk tekstur, emulsifier, penjernihan minuman dan antimikroba), farmasi (antitumor, penurunan kolestrol dan mencegah diabetes militus), kosmetik dan lain-lain (Kumar,2000, Shahidi, et al., 2005, Zainol, et al., 2008). Disisi lain kesesuain kitosan untuk diaplikasikan di berbagai bidang aplikasinya tergantung dari berat molekul dan derajat deasetilasi (Nguyen, et al., 2008)
Glukosamin adalah gula amino yang dihasilkan dari cangkang kitin dan merupakan komponen utama rawan. Glukosamin bertindak untuk merangsangkan fungsi sendi dan memperbaiki. Glukosamin telah terbukti dalam banyak percobaan santifik untuk merawat kesakitan ostheorithis, memulihkan rawan, memperbarui saluran dan memperbaiki sendi – sendi yang rusak akibat ostheorithis.
Banyaknya glukosamin tergantung pada derajat deasetilasi, jika deasetilasi terjadi sepenuhnya maka akan menghasilkan unit glukosamin yang disebut kitan. Pada proses pembuatan kitosan, jika derajat deasetilasi menunjukkan nilai 100% ini berarti yang dihasilkan adalah kitan bukan kitosan, karena kitosan merupakan gabungan senyawa kitan dan kitin.
Beberapa penelitian mengenai glukosamin hidroklorida yang telah dilakukan dari berbagai cara, diantaranya adalah: Elson – Morgan (1983), dengan penggunaan kitin dalam sel jamur dengan menghidrolisis dalam HCl 6 N pada suhu 1000C selama 4 jam. Hasil hidrolisatnya dikeringkan dan merupakan senyawa glukosamin hidroklorida yang kemurniannya 65,5 %. Afriadina (2011) berhasil membuat glukosamin hidroklorida dengan tingkat kemurniaan sebesar 45,4% dari kitin udang dengan suhu pemanasan 900C selama 4 jam. Rismawan (2012) berhasil membuat glukosamin hidroklorida dari kitosan dengan tingkat kemurnian 51,04% dengan menggunakan metode enzimatis. Y.S. El – Saharty (2002) berhasil membuat glukosamin hidroklorida dari kitosan dengan memnghidrolisis dalam 6 M HCl pada suhu 1000
Berdasarkan keterangan diatas timbul keinginan untuk optimalisasi pembuatan glukosamin hidroklorida dari hidrolisis kitosan cangkang belangkas dengan berbagai konsentrasi HCl untuk memperoleh hasil yang optimum.
C selama 10 jam. Mojjarad et al (2007) telah berhasil membuat glukosamin hidroklorida dari kitin udang dengan metode hidrolisis kimia dengan perbandingan (9:1) HCl dengan konsentrasi 37% yang tingkat kemurniaanya 70-80%. Dan putjiah (2011) telah berhasil membuat glukosamin hidroklorida dari kitin dengan metode autoklaf dengan tingkat kemurniaanya sebesar 60%.
1.2Permasalahan
Bagaimana dengan variasi konsentrasi HCl untuk mendapatkan hasil optimum.
1.3Pembatasan Masalah
- Peneletian ini dibatasi dengan penggunaan kitosan dari cangkang belangkas
- Penelitian ini hanya dibatasi pada penentuan kitosan dengan variasai konsentrasi HCl (2, 4, 8, 10, 12 ) M dan variasi waktu hidrolisis (1, 2, 3, 4, 5) jam kemudian dianalisa karekterisasi dengan FTIR dan Spektofotometer UV
1.4 Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kondisi optimum pembuatan glukosamin hidroklorida dari kitosan cangkang belangkas.
1.5Manfaat penelitian
1.6Lokasi penelitian
Penelitian ini dilakukan di Laboratorium Penelitian Fakultas Matematika dan Ilmu Pengetahuan Alam Univrersitas Sumatera Utara (USU) dan Spektrofotometer uv visible dan Spectrofotometer fourier transform infra red di RISPA.
1.7Metodologi Penelitian
BAB 2
TINJAUAN PUSTAKA
2.1 Kitosan
2.1.1 Kitin dan kitosan
Kitin merupakan poli (2-asetamido-2-deoksi –β- (1-4) – D glukopironisa) deangan rumus molekul (C8H13NO5)n yang tersusun atas 47 % C, 6% H, 7 % N, dan 40 % O. Struktur kitin menyerupai struktur selulosa dan hanya berbeda pada gugus yang terikat di posisi C-2. Gugus pada C-2 selulosa adalah gugus hidroksil, sedangkan pada C-2 kitin adalah gugus asetil (-NHCOCH3
Kitosan ditemukan oleh C.Rouget pada tahun 1859.dia menemukan bahwa kitin yang telah didihkan pada larutan KOH juga dapat diperlukan dengan NaOH panas maka akan terjadi pelepasan gugus asetil (proses deasetilasi) yang terikat pada atom nitrogen menjadi gugus amino bebas yang disebut dengan kitosan.(zakaria,B.M.2002)
asetamida).(Hirano, 1986; Knorr, 1991)
Kitin murni mengandung gugus asetamida (NH-COCH3), dan kitosan murni mengandung gugus amino (NH2). Perbedaan gugus ini akan mempengaruhi sifat-sifat kimia senyawa tersebut.(Roberts,G.A.F,1992)
O
2.1.2 Transformasi kitin menjadi kitosan secara enzimatik
Pembelajaran mengenai deasetilasi kitin secara enzimatik dapat diawali dengan pengamatan proses pengubahan kitin menjadi kitosan pada mikrob. Kandungan kitin dalam jamur atau bakteri sangat rendah, sehingga bahan tersebut saat ini belum lazim digunakan sebagai sumber kitin. Namun , penggunaan kitin dan kitosan dari dinding sel jamur sebenarnya sangat berpotensi jika kultivasinya dilakukan dengan baik. Hal tersebut, disebabkan oleh laju pertumbuhan mikroorganisme yang cepat,bahkan biomassa jamur dapat meningkat 2kali lipat hanya dalam waktu 1-3 jam (synowiecky&AL-Khateeb,2003)
memiliki aktivasi enzim deasetilasi yang paling tinggi dibandingkan dengan beberapa mikrob lainnya.
2.1.3 Transformasi kitin menjadi kitosan secara kimia
Purwatiningsih (1992) telah mengekstraksi kitin melalui tahapan deproteinasi, demineralisasi, dan dekolarasi. Sementara untuk menjadi kitosan, kitin didestilasi dalam suasana basa. Tahapan proses merujuk penelitian No et al.,(1989) dan knorr (1991). Setiap proses diikuti dengan tahap pencucian, pembilasan,penetralan pH, dan pengeringan.
2.1.4 Sifat Fisik – Kimia pada Kitin
Kitin merupakan bahan yang tidak beracun dan bahkan mudah terurai secara hayati (biodegradable). Bentuk fisiknya merupakan padatan amorf yang berwarna putih dengan
kalor spesifik 0,373 ± 0,03 kal/g/’C (Knorr,1984) dan derajat rotasi spesifik [α]D18 + 22’
pada konsentrasi asam metanasulfonat 1,0%. Sebagai biopolimer kristalin,kitin terdapat
dalam 3 bentuk kristal dialam, yaitu α,β,γ. Kitin α berbentuk kristal ortorombik dengan
setiap unit selnya mengandung 4 cincin N-asetil-D-glukosamina yang ditautkan dengan 2
ikatan glikosidik β-(1-4) dan tertata secara antipararel, rapat, dan kompak. Kitin –β
berbentuk kristalin monoklin dan setiap unitnya terdiri atas 2 cincin N-asetil-D-glukosamina dan 2 molekul air yang tertata secara pararel. Sementara struktur kitin-γ diduga dalam 2 penataan, yaitu 2 rantai pararel dan 1 antiparare. Ketiga bentuk kristalin tersebut dapat dibedakan dengan menggunakan spektroskopi IR pada bilangan gelombang 3160 dan 3180 cm-1
Kitin hampir tidak larut dalam air, asam encer, dan basa, tetapi larut dalam asam formiat, asam metanasulfonat,N,N-dimetilasemida yang mengandung 5% litium klorida,heksafluoroisopropil alkohol,heksafluoroaseton dan campuran 1,2-dikloroetana-asam trikloroasetat dengan nisbah 35:65(%[V/V](Hirano,1986). Asam mineral pekat seperti H
.
2.1.5Sifat-sifat kitosan
Kitosan adalah padatan amorf putih yang tidak larut dalam alkali dan asam mineral kecuali pada keadaan tertentu.keterlarutan kitosan yang paling baik ialah dalam larutan asam asetat 1% , asam format 10% dan asam sitrat 10%. Kitosan tidak dapat larut dalam asam piruvat, asam laktat, dan asam-asam anorganik pada pH tertentu, walaupun setelah dipanaskan dan diaduk dengan waktu yang agak lama.keterlaluan kitosan dalam larutan asam format ataupun asam asetat dapat membedakan kitosan dan kitin karena kitin tidak dapat melarut dalam keadaan pelarut asam tersebut.
Kitosan dibedakan dari kitin oleh kelarutannya dalam larutan asam encer. Kitosan bermuatan positif karena kelompok amina pada pH asam, yang besarannya tergantung pada tingkat deasetilasi, dan dengan demikian kitosan diklasifikasikan sebagai polielektrik kationik, sedangkan polisakarida yang lain memberikan muatan netral ataupun anionic.(Hwang dan shin,2001)
Kitosan memiliki sifat unik yang dapat digunakan dalam berbagai cara serta memiliki kegunaan yang beragam, antara lain sebagai perekat, aditiif untuk kertas dan tekstil, penjernihan yang beragam, antara lain sebagai perekat, aditif untuk kertas dan tekstil, penjernihan air minum, serta untuk mempercepat penyembuhan luka, dan memperbaiki sifat pengikatan warna. Kitosan merupakan pengkelat yang kuat untuk ion logam transisi. Kitosan mempunyai kemampuan untuk mengadsorbsi logam dan membentuk kompleks kitosan dengan logam(Robert,G.A.F,1992)
2.2Kegunaan Kitin dan Kitosan
Dewasa ini aplikasi kitin dan kitosan sangat banyak dan meluas. Di bidang industri,kitin, dan kitosan berperan antara lain sebagai koagulan polielektrolit pengolahan limbah cair, pengikat dan penjerap ion logam, mikroorganisme,mikroalga,pewarna,residu pestisida,lemak tanin,PCB,(poliklorinasi bifenil), mineral dan asam organik,media kromatografi afinitas,gel dan pertukaran ion,penyalut berbagai serat alami dan sintetik,pembentukan film dan membran mulai terurai,meningkatkan kualitas kertas,pulp,dan produk tekstil. Sementara dibidang pertanian dan pangan kitin dan kitosan digunakan sebagai pencampur ransum pakan ternak,antimikrob,antijamur, serat bahan pangan,penstabil,pembentuk gel,pembentuk tekstur,pengental dan pengemulsi produk olahan pangan,pembawa zat aditif makanan,flavor,zat gizi, pestisida,herbisida,virusida tanaman, dan deasedifikasi buah-buahan,sayuran dan penjernih sari buah. Fungsinya sebagai antimikrob dan antiamur juga diterapkan dibidang kedokteran kitin dan kitosan dapat mencegah pertumbuhan Candida albican dan Staphvlacoccus aureus. Selain itu bipolimer tersebut juga berguna sebagai antikoagulan,antitumor,antivirus,pembuluh darah-kulit dan ginjal sintetik,bahan pembuat lensa kontak,aditif kosmetik,membran dialis,bahan shampoo dan kondisioner rambut, zat hemostatik,penstabil liposom,bahan ortoprdik,pembalut luka dan benang bedah yang mudah diserap, serta mempertinggi daya kekebalan,antiinfeksi. (Purwantiningsih,S.,2009).
Kitosan banyak digunakan oleh berbagai industri antara lain industri farmasi, kesehatan,biokimia,biotekhnologi,pangan,pengolahanlimbah,kosmetik,agroindustri,industr i tekstil,industri perkayuan,industri kertas dan industri elektronika. Aplikasi khusus berdasarkan sifat yang dipunyai antara lain untuk pengolahan limbah cair terutama bahan bersifat resin penukar ion untuk meminimalisasi logam-logam berat,mengkoagulasi minyak/lemak,serta mengurangi kekeruhan,penstabilan minyak,rasa dan lemak dalam produksi industri pangan.(Rismana,2004)
2.3Deproteinisasi
Tabel 2.1Kondisi Perlakuan dengan NaOH pada proses Deproteinisasi
Penggunaan enzim untuk memisahkan protein juga dilakukan dalam beberapa penelitian diantaranya dengan pepsin,tripsin,enzim proteolitik seperti tuna proteinase dan papain, setelah didemineralisasi sebelumnya dengan suatu zat. Perlakuan dengan enzim ini masih menyisakan protein sekitar 5% yang memerlukan proses lanjutan (Roberts,1992)
2.4 Demineralisasi
Tabel 2.2 Kondisi Perlakuan dengan HCL pada proses Demineralisasi
Sumber Konsentrasi HCL
(N)
yang berbentuk seperti ladam kuda berekor. Semuanya (empat jenis) termasuk dalam keluarga Limulidae dan menjadi wakil dari bangsa Xiphosurida yang masih bertahan hidup. Cetakan fosil hewan ini tidak mengalami perubahan bentuk berarti sejak masa Devon (400-250 juta tahun yang lalu) dibandingkan dengan bentuknya yang sekarang, meskipun jenisnya tidak sama. Mimi adalah nama dalam bahasa Jawa untuk yang berkelamin jantan dan mintuna adalah untuk yang berkelamin betina. Dalam bahasa Inggris dikenal sebagai
Belangkas memiliki sejumlah manfaat penting bagi manusia. Sejak permulaan abad ke 20, belangkas ditangkap dalam jumlah besar untuk dijadikan umpan sidat dan siput laut besar. Di luar industri perikanan, darah dari belangkas yang mengandung tembaga digunakan oleh industri farmasi untuk membuat Limulus Ameyboyet lysate ( LAL), senyawa yang berguna untuk mendeteksi toksik yang dihasilkan oleh bakteri. Cangkang dari belangkas bisa diolah menjadi aneka produk seperti lensa kontak, krim kulit, penambal luka jahitan kepala dan kitosan.(Arkive.2010)
horseshoe crab. Belangkas mudah ditangkap di tepi-tepi pantai. Sekitar 500.000 belangkas setiap tahun dikumpulkan di pesisir Timur AS, diatur di bawah hukum antar negara bagian.
2.5.1 Anatomi dan Morfologi
Sudah disinggung di bagian awal kalau belangkas memiliki bentuk yang mirip dengan ikan pari. Tubuh dari belangkas seluruhnya diselubungi oleh cangkang yang keras dan berwarna kecoklatan. Ditinjau dari segi anatomis, tubuh dari belangkas terbagi menjadi 3 bagian utama yang masing – masing dipisahkan oleh sambungan tipis atau segmen : kepala ( prosoma), perut (opathosoma), dan ekor (telson). Di bagian kepala belangkas terdapat 9 mata yang letaknya berpencar – pencar.
2.6. Glukosamin
Glukosamin telah dievaluasi sebagai agen terapi untuk OA di Jerman sejak 1969. senyawa glukosamin sulfat dapat diturunkan dari kitin. kitin adalah polimer yang paling kemelimpahan kedua di dunia dan avaible dari misalnya, kepiting, lobster, udang atau kerang tiram. itu juga dapat diproduksi dengan cara sintetis.(Martin, C.W. 2004).
Glukosamin adalah salah satu dari kelompok biokimia yang dikenal sebagai gula
amino. Senyawa dengan rumus kimia C6H13NO5 ini diproduksi secara alami oleh tubuh
untuk membentuk glikosaminoglikan, protein pembentuk tulang rawan. Glukosamin juga
bermanfaat menjaga metabolisme tulang rawan dan membantu memperbaiki tulang rawan
yang rusak atau terkikis. Glukosamin tersedia dalam beberapa bentuk: glukosamin sulfat
(GS) yang distabilkan oleh natrium klorida atau kalium klorida, glukosamin hidroklorida
(GH) dan N-asetil glukosamin (NAG).(muzzareli,1998)
Selain diproduksi tubuh, glukosamin hadir dalam jumlah sedikit pada makanan
seperti udang, lobster, dan kepiting. Glukosamin sintetis tersedia dalam bentuk pil, kapsul
atau suntik, yang mungkin dikombinasi dengan suplemen lain seperti kondroitin.
Kondroitin juga ditemukan dalam tulang rawan dan dilaporkan berfungsi mempertahankan
viskositas sendi, merangsang mekanisme perbaikan tulang rawan, dan menghambat enzim
yang memecah tulang rawan.(Wang D,P 2008)
Kitosan adalah komponen poli –(β-1-4)- D- glukosamin yang dihasilkan oleh deasetilisasi dari kitin (β-1-4)- N- acetyl – D – glukosamin. Karekteristik dari glukosamin yang berasal dari kitosan yang terhidrolisis dibawah kondisi variasi yang telah dipelajari.(
Z.Holan,J.Votroba.1998)
OHC OH
NH2 OH
OH OH
OHC OH
NH2 OH
OH OH HCl
Gambar 2.3 Glukosamin Hidroklorida
2.7. Spektrofotometer Ultraviolet
Serapan cahaya oleh molekul dalam daerah ultraviolet dan visible (tampak) tergantung
pada struktur elektronik dari molekul. Spektrofotometri uv/vis dari senyawa – senyawa
organic berkaitan erat dengan transisi-transisi diantara tingkatan- tingkatan tenaga
elektronik. Disebabkan karena hal ini maka serapan radiasi uv/vis sering dikenal sebagai
spektroskopi elektronik (Hardjono.S.1985)
Spectrum visible terentang dari sekitar 400 nm (ungu) sampai 750 nm (merah),
sedangkan spketrum ultraviolet terentang 100-400nm. Absorpsi cahaya uv/vis
mengakibatkan transisi elektronik yaitu promosi electron – electron dari orbital keadaan
dasar yang berenergi rendah ke orbital kedalam tereksitasi berenergi lebih tinggi. Transisi
ini memerlukan 40-300 kkal/mol. Energi yang terserap selanjutnya trebuang sebagai kalor,
sebagai cahaya atau tersalurkan kedalam reaksi kimia (misalnya isomerisasi attau
reaksi-reaksi radikal bebas). (Fessenden. R.J dan Fessenden, J.S. 1993)
Spectrum uv/vis adalah suatu gambar antara panjang gelombang atau frekuensi
serapan lawan intesitas serapan (transmitasi atau absorbansi). Spectrum ini terdiri dari pita
absorpsi lebar pada daerah panjang glombang yang lebar. Ini disebabkan oleh terbaginya
keadaan dasar dan keadaan eksitasi sebuah molekul dalam subtingkat- subtingkat rotasi
dan vibrasi.
Komponen – komponen pokok dari spektrofotometer meliputi : (1) sumber tenaga
radiasi yang stabil, (2) system terdiri atas lensa,cermin,celah, (3) monokromator, yang
merubah radiasi menjadi komponen – kompone panjang gelombang tunggal (4) tempat
cuplikan yang transparan (kuvet), dan (5) detector radiasi yang dihubungkan dengan
Hubungan antara absorpsi radiasi dan panjang jalan gelombang melalui medium
yang menyerap dirumuskan oleh Bouger (1729) dan lambert (1768). Beer (1859)
merumuskan hubungan antara konsentrasi zat penyerap dengan besarnya absorpsi.( Day,
R.A,. dan Underwood, A.L,.1992)
2.8. Spektrofotommeter Fourier Transform Inframerah
Konsep radiasi infra merah diajukan pertama kali oleh Sir William Herscel (1800) melalui
percobaannya mendispersikan radiasi matahari dengan prisma. Ternyata pada daerah
sesudah sinar merah menunjukkan adanya kenaikan temperature tertinggi yang berarti pada
daerah panjang gelombang radiasi tersebut banyak kalori (energi tinggi). Daerah spectrum
tersebut selanjutnya disebut infrared. Spektroskopi inframerah ditujukan untuk maksud
penentuan gugus-gugus fungsi molekul pada analisa kualitatif, disamping untuk tujuan
analisa kuantitatif ( Mulja,M., 1995).
Spektrofotometer inframerah konfesional dikenal sebagai alat disperse. Dengan
terhubung pada computer dan mikroposesor sebagai alat dasarnya, hal ini telah tersebar
luas dan dikenal dengan nama alat Fourier transform infrared (FTIR) spectrophotometer,
yang mana mempengaruhi sejumlah keuntungan. Dibandingkan suatu kinerja pada
monokromator, alat FTIR memakai suatu unterferometer untuk mendeteksi peak yang
mengandung penggangu yang terdeteksi.
Pada alat interferometer, radiasi dari sumber IR konfensional dibedakan kedlam
dua alur oleh suatu pemisah berkas cahaya, satu ulur menuju posisi cermin yang
dittentukan, dan yang lainnya menjauhi cermin. Ketika berkas cahaya dipantulkan, salah
satu cahaya dipindahkan (keluar dari tahap) dari yang lainnya sejak ia menjadi lebih kecil
(ataupun lebih besar) tujuan jaraknya untuk menjauhi cermin, dan mereka dikombinasikan,
kembali untuk menghasilkan suatu rumusan gangguan (semua panjang gelombang dalam
berkas cahaya) sebelum melewati sample. Sample mendeteksi secara serentak semua
panjang gelombang, dan menukar rumusan gangguan dengan waktu seperti cermin yang
terus menerus diteliti pada percepatan linear. Hasil penyerapan radiasi oleh sample
merupakan suatu spectrum dalam daerha waktu, yang disebut interefogram, yang
menyerap intesitas sebagai fungsi dari lintasan optis yang membedakannya dengan kedua
Suatu jeni interferogram yang mana tinggi bagian signal yang dihasilkan ketika
kedua kaca diletakkan sama jauh dari pemisah berkas cahaya, ketika gangguan yang
,merusak diantara kedua cermmin tersebut bernilai nol, dan disebut sebagai pusat masalah.
Intensitas mulai menjauh secara cepat dari ini, menuju gangguan. Ini disesuaikan dengan
menggunakan computer, kedalam daerah frekuensi untuk mengertahui operasi matematika
yang dikenal sebagai Fourier transformation (karenanya lebih dikenal dengan nama Fourier
transform infra-red spectrophotometer). Suatu hasil spectrum inframerah yang ditunjukkan
secara konvensional.(Cristian,D.G.2005)
Ketebalan film merupakan parameter krisis dalam mempelajai IR dari degradasi
polimer. Suatu reaksi panas oksidatif mungkin menjadi control difusi jika film tebal lebih
besar dari pada nilai tertentu. Dalam degradasi termal pada polimer, tingkatan difusi pada
produk yang mudah menguap menjadi lebih dominant dan sisi reaksi diantara produk dan
rantai radikal mungkin menjadi lebih besar luasnya dengan meingkatnya ketebalan film.
Hal tersebut dicatat bahwa dalam film yang benar – benar tipis tingkat degradasi dapat
diingkatkan untuk volatilitsa pada radikal – radikal dengan hasil pada reaksi radiakal yang
non-steady-state. Ini merupakan awal tujuan dari florin et all untuk menjelaskan
BAB 3
METODE PENELITIAN
3.1. Bahan – Bahan. 1. Cangkang Belangkas
2. Asam klorida p.a( E Merck)
3. Natrium hidroksida p.a (E Merck)
4. Asam asetat 1% p.a (E Merck)
5. Asam fosfat 85% p.a (E Merck)
5. Aquadest
3.2 Alat – alat
1. Gelas ukur pyrex
2. Labu ukur pyrex
3.Beaker glass pyrex
4. Pipet volume pyrex
5. Mat pipet pyrex
6. Labu leher 3 pyrex
7. Botol aquadest
8. Hot plate
9. Blender
10. Timbangan Elektrik sartorius
11. Water Bath
12.Heating mentle
13. Fourier Transform Infra red
3.3 Prosedur Penelitian
3.3.1 Penyediaan larutan pereaksi 3.3.1.1.Pembuatan NaOH 0,5 %
Ditimbang sebanyak 100 g NaOH dilarutkan dalam beaker glass 1000mL dilakukan pengeceran.
3.3.1.2.Pembuatan NaOH 5%
Ditimbang sebanyak 1000 g NaOH dilarutkan dalam beaker glass 1000mL dilakuakn pengenceran
3.3.1.3.Pembuatan HCl 5%
Diukur sebanyak 2,7 L HCL p.a lalu diencerkan dengan aquadest dalam labu takar 2,0 L H2
3.3.1.4. Pembuatan Asam asetat 1% O kemudian dihomogenkan.
Dipipet Sebanyak 10 mL asam asetat glasial dimasukkan kedalam labu takar 1000ml, kemudian diencerkan dengan akuades sampai garis tanda,kemudian dihomogenkan.
3.3.1.5. Pembuatan NaOH 5%
Ditimbang 250 g NaOH dimasukkan kedalam beaker glass 1000mL kemudian dilarutkan dalam 500 mL aquadest.
3.3.1.6. Pembuatan HCl untuk hidrolisis
Diukur sebanyak ( 8,2, 16,4, 33,18, 41,4, 82,8) ml asam klorida dimasukkan kedalam labu takar 100 ml, kemudian diencerkan dengan akuades sampai garis tanda, kemudian dihomogenkan.
3.3.1.7. Pembuatan NaOH
Ditimbang 40 gr NaOH dimasukkan kedalam beaker glass 150 ml kemudian dilarutkan dalam 100 ml akuades.
3.3.2 .Proses Penyediaan kitin (Agusnar,H. 2006)
dengan H2
3.3.3 Proses Deasetilasi kitin menjadi kitosan (Agusnar, H.2006)
O hingga PH netral, dikeringkan pada suhu kamar. Dan dilakukan uji kelarutan dengan asam Fosfat 1 % diperoleh kitin belangkas II.
Ditimbang 40 g kitin, lalu ditambahkan NaOH 50%. Kemudian direndam kitin belangkas dalam larutan NaOH 50 % dan direfluks selama ± 4 jam. Kemudian dicuci dengan H2O hingga PH ± 6,7. Setelah itu dikeringkan pada suhu kamar dan dihaluskan. Kemudian dilakukan uji kelarutan dengan asam asetat 1 % jika uji kelarutan positif maka diperoleh kitosan dari kitin belangkas.
3.3.4 Proses Hidrolisa Kitosan (Yasser.S.El – Saharty. 2002)
Ditimbang serbuk kitosan sebanyak 5 g, lalu dimasukkan akuades kedalam water bath kemudian dipanaskan hingga suhu 90 0C. Dan dimasukkan serbuk kitosan kedalam labu leher 3 dan diikuti dengan pemasukan HCl dengan variasi konsentrasi (2,4,8,10,12) M dan didiamkan selama variasi waktu ( 1,2,3,4,5) jam setelah itu didinginkan. Kemudian dinetrlkan dengan NaOH 10 M dan disaring dengan kertas saring. Dan dicuci residu dengan akuades setelah itu diambil residunya dan dikeringkan dengan suhu 90 0
3.4. Analisis dengan Spektrofotometri UV (Muzzarelli, 1978 )
C dan dihaluskan lalu dianalisa dengan FTIR dan Spektrofotometer uv.
3.4.1. Untuk Larutan asam asetat
Dibuat larutan asam asam asetat (0,005, 0,010, 0,020, 0,030) M diukur absorbansinya pada panjang gelombang 190-240 nm. Kemudian digunakan air suling sebagai blanko dan dibuat kurva kalibrasinya.
3.4.2. Untuk N-asetilglukosamin
Dibuat larutan standard (10,20,30,40,50,60,70) ppm dalam asam asetat 0,01 M, kemudian diukur absorbansinya pada panjang gelombang 190 – 240 nm. Kemudian dibuat kurva kalibrasinya pada panjang gelombang 197 nm.
3.4.3. Untuk Glukosamin HCl
3.5. Bagan Penelitian
3.5.1 Proses Penyediaan Kitin (Agusnar. H 2006)
Direndam dengan NaOH 0,5% selama 24 jam
Dicuci dengan air hingga pH ±6,7 Dideproteinisasi dengan larutan NaOH 5% selama 24 jam
Dicuci dengan air hingga pH ±6,7 Dilakukan uji kelarutan dengan asam fosfat 85%
Didemineralisasi dengan HCL 5 % selama 24 jam
Dilakukan uji kelarutan dengan asam formiat 37%
Dicuci dengan air hingga pH ±6,7 Dikeringkan pada suhu kamar Dihaluskan
Diayak dengan saringan 80 mesh Cangkang belangkas
3.6. Bagan Pembuatan Kitosan
3.6.1 Bagan Penyediaan Kitosan(Agusnar, H. 2006)
Direndam dalam NaOH 50%
Didiamkan selama 6 Hari
Dibilas dengan air mengalir sampai pH ±6,7
Disaring
Dikeringkan diudara terbuka pada suhu kamar
Diuji kelarutan
Dihaluskan
Kitin kering
Kitosan basah
Kitosan kering
3.6.2. Bagan Hidrolisa Kitosan dengan HCL 2M ( Yasser,S. 2002)
Ditimbang5g
Dimasukkan kedalam labu leher 3
Ditambahkan HCL 2 M
Dipanaskan dalam water bath suhu 500
Didiamkan selama 1 jam
C
Didinginkan
Dinetralkan dengan NaOH 10 M
Disaring dengan kertas saring
Dicuci dengan akuades
Dikeringkan
Dihaluskan sampai menjadi serbuk
Dianalisa
Bubuk Kitosan
Residu
Uji FT – IR dan
3.6.3. Bagan Hidrolisa Kitosan dengan HCl 4 M (Yasser. S. 2002)
Ditimbang5g
Dimasukkan kedalam labu leher 3
Ditambahkan HCL 4 M
Dipanaskan dalam water bath suhu 600
Didiamkan selama 2 jam
C
Didinginkan
Dinetralkan dengan NaOH 10 M
Disaring dengan kertas saring
Dicuci dengan akuades
Dikeringkan
Dihaluskan sampai menjadi serbuk
Dianalisa
Residu
Uji FT – IR dan
3.6.4. Bagan Hidrolisa Kitosan dengan HCl 8 M (Yasser.S 2002)
Ditimbang5g
Dimasukkan kedalam labu leher 3
Ditambahkan HCL 8 M
Dipanaskan dalam water bath suhu 700
Didiamkan selama 3 jam
C
Didinginkan
Dinetralkan dengan NaOH 10 M
Disaring dengan kertas saring
Dicuci dengan akuades
Dikeringkan
Dihaluskan sampai menjadi serbuk
Dianalisa
Residu
Uji FT – IR dan
3.6.5. Bagan Hidrolisa Kitosan dengan HCl 10 M (Yasser. S. 2002 )
Ditimbang5g
Dimasukkan kedalam labu leher 3
Ditambahkan HCL 10 M
Dipanaskan dalam water bath suhu 800
Didiamkan selama 4 jam
C
Didinginkan
Dinetralkan dengan NaOH 10 M
Disaring dengan kertas saring
Dicuci dengan akuades
Dikeringkan
Dihaluskan sampai menjadi serbuk
Dianalisa
Residu
Uji FT – IR dan
3.6.6. Bagan Hidrolisa Kitosan dengan HCl 12 M (Yasser. S. 2002 )
Ditimbang5g
Dimasukkan kedalam labu leher 3
Ditambahkan HCL 10 M
Dipanaskan dalam water bath suhu 900
Didiamkan selama 4 jam
C
Didinginkan
Dinetralkan dengan NaOH 10 M
Disaring dengan kertas saring
Dicuci dengan akuades
Dikeringkan
Dihaluskan sampai menjadi serbuk
Dianalisa
Residu
Uji FT – IR dan
3.7 Bagan Analisa dengan Spektrofotometri UV ( Muzzarelli, 1978 ) 3.7.1 Untuk larutan asam asetat
Diukur absorbansinya pada λ =
190- 240 nm, air suling sebagai blanko
ASAM ASETAT
0,005 % 0,010 % 0,020 % 0,030 %
λ
max. 197 nmKurva kalibrasi pada
3.7.2. Untuk N-asetilglukosamin
Dibuat larutan standard dalam asam asetat 0,01 %
Diukur absorbansinya pada λ = 190 –
240 nm, air suling blanko N - asetilglukosamin
10 ppm 20 ppm 30 ppm 40 ppm 50 ppm 60 ppm 70 ppm
Kurva kalibrasi pada
3.7.3. Untuk Larutan Glukosamin HCl
Di timbang 50 mg/L glukosamin Hidroklorida dalam larutan asam asetat 0,01 %
Diukur absorbansinya pada λ = 197 nm
Larutan Glukosamin HCl
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1.Proses Kitin belangkas menjadi Kitosan Belangkas
Tabel 4.1 Persen Hasil Kitosan dari Kitin Belangkas ( Agusnar, H. 2006 ) Kitin Berat kitin
Metode Perendaman Berat Cangkang
= 0,26 %
4.1.2 Data Karakteristik Glukosamin HCl dengan FTIR
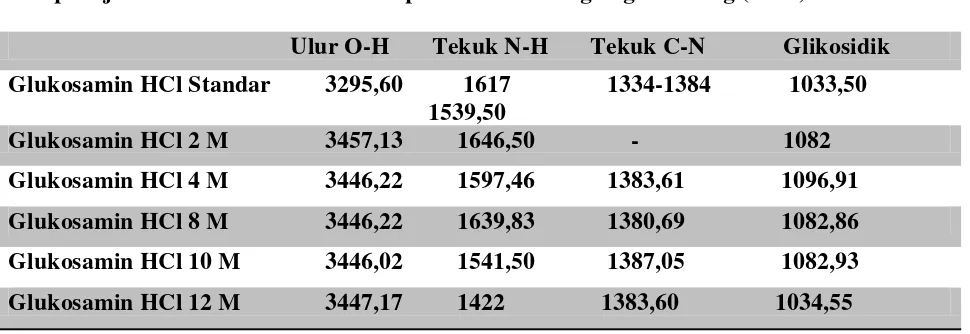
Tabel 4.2 Perbandingan serapan FTIR glukosamin HCl pada berbagai konsentrasi HCl dan standar
Sampel uji Glukosamin HCl Serapan daerah bilangan gelombang (cm -1)
Ulur O-H Tekuk N-H Tekuk C-N Glikosidik Glukosamin HCl Standar 3295,60 1617 1334-1384 1033,50 1539,50
Glukosamin HCl 2 M 3457,13 1646,50 - 1082 Glukosamin HCl 4 M 3446,22 1597,46 1383,61 1096,91 Glukosamin HCl 8 M 3446,22 1639,83 1380,69 1082,86 Glukosamin HCl 10 M 3446,02 1541,50 1387,05 1082,93 Glukosamin HCl 12 M 3447,17 1422 1383,60 1034,55
4.2 Data pengukuran Analisis dengan Spektrofotometer uv/visible 4.2.1 Data Pengukuran Absorbansi untuk Asam Asetat pada λ = 197 nm
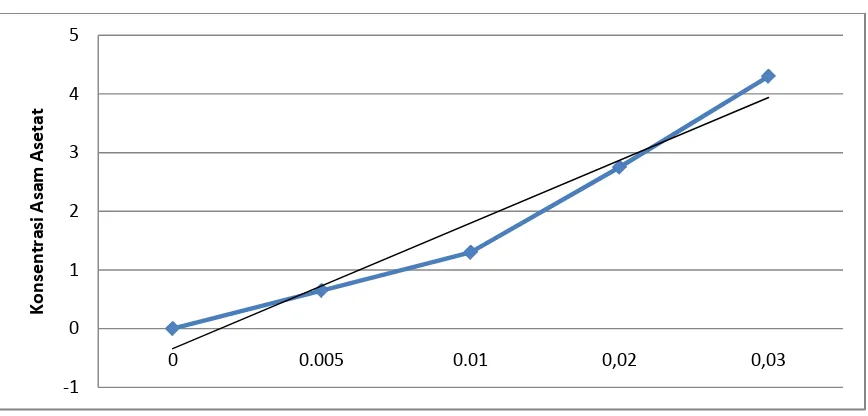
Tabel 4.3 Data Pengukuran Absorbansi untuk Asam Asetat pada λ = 197 nm Konsentrasi Asam Asetat (%) Absorbansi (Ho)
0.000 0,00
0,005 0,65
0,010 1,30
0,020 2,75
0,030 4,30
4.2.2 Data Pengukuran Absorbansi untuk N – asetilglukosamin dalam asam asetat 0,01 % pada λ = 197 nm
Tabel 4.4 Data pengukuran Absorbansi untuk N – asetilglukosamin dalam asam asetat 0,01 % pada λ = 197 nm
Pada pengukuran absorbansi asam asetat menunjukkan nilai absorbansi sebesar 1,30 untuk asam asetat 0,010 %. Dengan demikian hasil seluruh pengukuran absorbansi N-asetilglukosamin dan sampel glukosamin hidroklorida yang dilarutkan dalam asam asetat 0,010 % harus dikurangi dengan 1,30 untuk memperoleh absorbansi yang sebenarnya dari kedua senyawa tersebut.
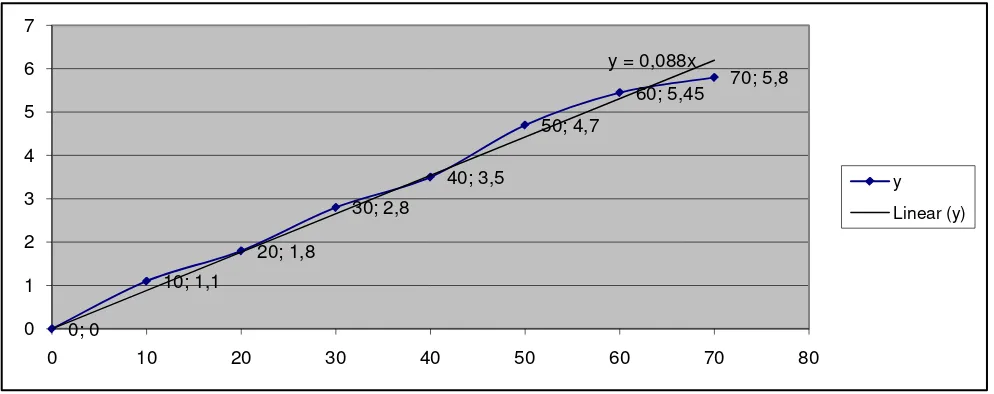
Gambar 4.2. Kurva Kalibrasi N-asetilglukosamin
4.3 Perhitungan
4.3.1Penurunan Persamaan Garis Regresi dengan Metode Least Square
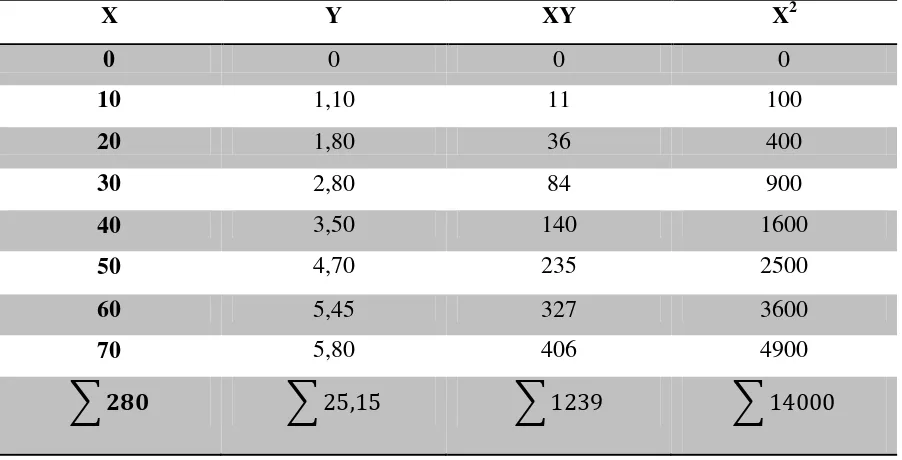
Tabel 4.5 Data penurunan persamaan garis regresi untuk penentuan konsentrasi N-asetilglukosamin
X Y XY X2
0 0 0 0
10 1,10 11 100
20 1,80 36 400
30 2,80 84 900
40 3,50 140 1600
50 4,70 235 2500
60 5,45 327 3600
70 5,80 406 4900
� ��� �25,15 �1239 �14000
Metode Least Square
�= n (∑xy)−(∑x) (∑y) n (∑x2 )– (∑x)2
�= 8(1239)− (280)(25,15) 8(14000)− (280)2
�= 9912−7042
112000−78400
�= 2870 33600
�=(∑x
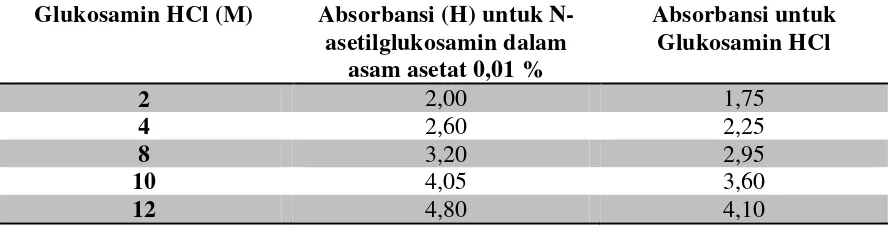
Tabel 4.6Data pengukuran absorbansi untuk sampel glukosamin HCl pada λ = 197 nm
Glukosamin HCl (M) Absorbansi (H) untuk N-asetilglukosamin dalam
- Untuk konsentrasi 2 M
�
=
�−� a�
=
1,75−0,015 0,086- Untuk konsentrasi 4 M
�= � − � a
�= 2,25−0,015 0,086
�= 25,98
- Untuk konsentrasi 8 M
�= � − � a
�= 2,95−0,015 0,086
�= 34,12
- Untuk konsentrasi 10 M
�=� − � a
�=3,60−0,015 0,086
�= 41,68
- Untuk konsentrasi 12 M
�=� − � a
�=4,10−0,015 0,086
- Untuk konsentrasi Glukosamin HCl standar
4.7 Tabel data perhitungan konsentrasi sample dengan spektrofotometer uv/vis Konsentrasi Glukosamin HCl (M) Hasil persamaan Regresi
2 20,17
4.4.1.Karekteristik Glukosamin HCl dengan FTIR
Pembuatan kitin dari cangkang belangkas dengan perendaman NaOH 0,5% selama 24 jam. Lalu dicuci dengan air, dan dilarutkan dengan NaOH 5 % yang bertujuan untuk menghilangkan protein yang terdapat pada cangkang belangkas yang sering disebut deproteinisasi. Untuk mengetahui apakah sudah hilang protein maka di lakukan uji kelarutan dengan menggunakan asam fosfat 85 %. Setelah penghilangan protein, maka dilanjut dengan proses penghilangan mineral dengan dilarutkan HCl 5 % selama 24 jam proses ini sering disebut dimineralisasi. Dan dilakukan uji kelarutan dengan menggunakan asam formiat 37% maka sudah terbentuk kitin yang berupa gumpalan, lalu dicuci dengan air dan dikeringkan sampai menjadi serbuk. Dan hasil nya diayak dengan saringan 80 mesh.
Telah dilakukan, glukosamin hidroklorida dari kitosan cangkang belangkas dengan cara hidrolisis. Kitosan yang berasal dari kitin cangkang belangkas akan di hidrolisis dengan variasi konsentrasi, waktu dan suhu pemanasan.
Hasil pengukuran spectrum FTIR menunjukkan bahwa spectrum glukosamin HCl standard memperlihatkan gugus O-H yang dominant dengan garis yang lebar dan kuat pada bilangan gelombang 3295,60 cm-1
Pita serapan gugus N-H asimetris ditunjukkan pada 1646,50,1597,1638 cm , sedangkan pada glukosamin HCl hasil hidrolisis menunjukkan gugus O-H yang dominant yaitu pada 3447,17 dengan konsetrasi HCl 12 M dengan waktu 5 jam dan 3457,13 untuk konsetrasi HCl 2 M terendah. Spectrum hasil hidrolisis menunjukkan kemiripan dengan spectrum glukosamin HCl standard.
-1 , sedangan pita serapan simetris terdapat pada bilangan gelombang yaitu 1541,50 dan 1442 cm -1. Pita serapan menunjukkan hasil yang sama dengan glukosamin HCl pada bilangan gelombang 1617- 1539,50 cm -1 yang lemah dan tajam dengan pita serapan terdapat pada konsetrasi 12 M yaitu 1422 cm -1
Pita serapan gugus C-N glukosamin HCl hasil hidrolisis pada kisaran 1380 – 1387
cm-.
1
, sedangkan standar berkisar 1334-1384 cm-1
Pita serapan ikatan glikosidik pada glukosamin HCl standard dan menunjukkan hasil kemiripan yang sama terhadap glukosamin HCl pada variasi konsentrasi (2,4,8,10,12)M. Secara keseluruhan pita serapan gugus khas pada glukosamin HCl hasil hidrolisis menunjukkan kemiripan dengan glukosamin HCl standard. Namun masih terdapat selisih pada bilangan gelombang yang ditampilkan, hal ini dapat disebabkan karena konsentrasi yang dihasilkan masih terbilang rendah dan waktu.
hal ini menunjukkan hasil yang sama terhadap glukosamin HCl standar.
4.4.2. Glukosamin HCl dengan Spektrofotometer uv/visible
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Glukosamin hidroklorida dapat dibuat dengan metode hidrolisis kimia. Perlakuan terbaik glukosamin hidroklorida diperoleh pada penggunaan konsentrasi HCl 12 M dengan suhu 900C selama 5 jam. Glukosamin hidroklorida memiliki karekteristik yakni larut dalam air dan berwarna putih kekuningan. Spektrum FT-IR memiliki pola pita serapan OH 3447,17 cm-1, pita serapan N-H 1422 cm-1, pita serapan C-N 1383,60 cm -1 dan pita serapan glikosidik 1034,55 cm-1
5.2. Saran
pada konsentrasi HCl 12 M yang mirip dengan glukosamin hidroklorida standard. Serta penentuan konsentrasi dengan analisis
Spektrofotometer uv pada λ= 197 nm merupakan serapan absorbansi yang timbul oleh N
-asetilglukosamin hidroklorida dalam larutan asam asetat 0,01%. Secara umum dapat disimpulkan dengan menggunakan metode hidrolisis kimia dengan variasi konsentrasi,waktu dan suhu telah berhasil dilakukan.
DAFTAR PUSTAKA
Agusnar H. 2006. Potensi Cangkang Belangkas (Tachypleus gigas ) di perairan sumatera utara seabagai bahan kiktin dan kitosan. Sains kimia. Halaman : 22-27
Allen, S,N. 1983. Degradation and Stabilisation Of Polyolefin. Applied Science Publisihers. NewYork.
Bastaman S. 1989. Studies on Degradation and Extraction of chitin and Chitosan From Prawn Shell (Nephrops norvegicus) [Tesis]. Belfast: Faculty of Engineering, The Quen’s University of Belfast.
Christian,D,G. 2005. Analytical Chemistry. Sixth Edition. John Willey And Sons. NewYork.
Day, R. A,. dan Underwood, A. L,. 1992. Analisa Kimia Kuantitatif . edisi 4. Erlangga, Jakarta.
Fessenden,R.J. dan Fessenden,J.S. 1993. Kimia Organik. Jilid 2, edisi 3, Erlangga, Jakarata.
Hardjono, S. 1985. Spektroskopi . Liberty, Jakarta
Hirano S. 1986.Chitin and Chitosan. In Ullmann’s Encyclopedia of Industrial Chemistry.Completly revised edition.Weinheim,New york.
Hwang, J .K. dan Shin H.H.2001, Rheological Properties of Chitosan Solutions.Korea Australia Rheology Journal,vol 12:3/4,175-179
Knorr D.1984.Use Chitonous in Food.Food Tech.38(1):85
Knorr D.1991.Recovery and Utilization of Chitin and Chitosan in Food processing Waste Management.Food Tech.45 (1):114-122
Martin,C.W.,2004. Glucosamine:review of its effectiveness in treating knee osteoarthritis.New york. Page 3
Mulja, M. 1995. Analisis Instrumental. Airlangga University Press. Airlangga.
Muzzarelli,R.A.A.1973. Natural Chelating Polymer.New York : Peraganon Press.
Muzzarelli,R.A.A. and Roccehetti,R.1974. Enhanced Capacity of Chitosan For Transition Metal Ions in Sulphat- Sulphuric n Acid Solutions.Talanta.Vol 21: pp.1137-1143
Muzarelli,R.A.A.1978.Chitin.New York :perganon Press
Rismana E.2004.Serat Kitosan Mengikat Lemak.Kompas (http://www.kompas .com/kompas – cetak/0301/09/iptek/60155.htm
Robert,G.A.F.1992. Chitin Chemistry.London : The Mac Millan Press.
Tsigos I,Bouriotis V. 1995.Purification and Characterization of Chitin Deacetylase from Collectotrichum Lindemuthianum. The Journal Of Biological Chemistry 270:26286-26291.
Tsigos I, Martinou A,Kafetzopoulus D, Bouriotis V.2000.Chitin Deacetylases: New,Versatile Tools In Biotechnology.TIBTECH 18:305:31