Lampiran 1 Perhitungan % kematian larva Artemia Salina Leach
% �������� = jumlah larva mati
jumlah larva total awal x 100% Konsentrasi 20 ppm :
Perhitungan nilai LC50 Ekstrak Metanol Daun Benalu Kopi
Persamaan regresi garis linier y = ax + b
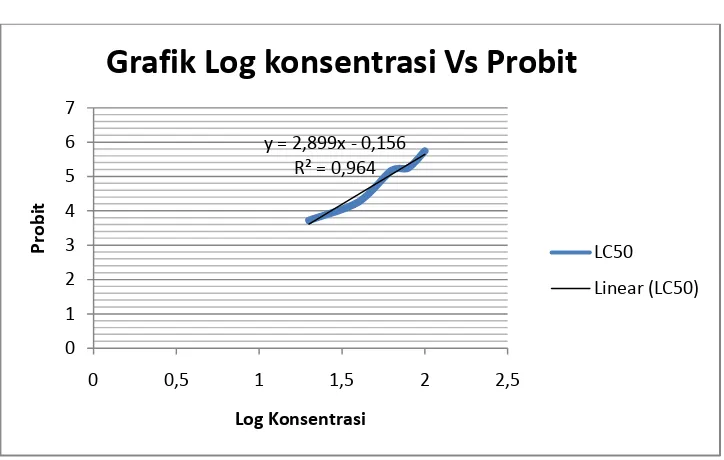
Grafik Log Konsentrasi terhadap Probit y = 2,899x - 0,156
Grafik Log konsentrasi Vs Probit
DAFTAR PUSTAKA
Adfa, M., 2005, Survey Etnobotani, Studi Senyawa Flavonoid dan Uji Brine
Shrimp Beberapa Tumbuhan Obat Tradisional Suku Serawai di Propinsi Bengkulu,Gradien 1 (1): 43, 45-46.
Anderson, J.E. 1991. A blind comparison of simple bench top bioassay and
human tumor cell cytotoxities as antitumor priesscrenns, natural product chemistry. Phytochemical Analysis 2 : 107 – 111
Anonim. 1996. Laporan Pengkajian Tahun Anggaran 1996/1997, Kapsulisasi Ekstrak Daun Benalu di Daerah Istimewa Yogyakarta, sentra P3T Provinsi D.I. Yogyakarta.
Carballo JL,dkk. 2002. Comparison between two brine shrimp assays to detect
in vitro cytotoxicity in marine natural products. BMC Biotechnology.
Dhahiyat, Y dan Djuangsih. 1997. Uji Hayati (Bioassay); LC 50 ( Acute Toxicity Tests) Menggunakan Daphnia dan Ikan. [Laporan Hasil Penelitian]. PPSDAL LP UNPAD.Bandung.
Djarijah, A.S. 1995. Pakan Alami. Kanisius. Yogyakarta
Departemen Kesehatan dan Kesejahteraan Sosial RI Badan Penelitian dan Pengembangan Kesehatan, Inventaris Tanaman Obat Indonesia (I) Jilid 1, 2000. p. 3-4.
Dewi, N.A. 2011. Potensi Ekstrak Daun Rambutan (Naphelium lappaceum L.) sebagai pembasmi larva nyamuk Culex pipiens. Skripsi. Samarinda: Fakultas Farmasi Universitas Mulawarman.
Finney, N.D. (1971). Probit Analysis 3rd ed. Cambrige University Press.
Cambrige. England.
Ganiswarna, Sulistia G. 1995. Farmakologi dan Terapi. FK-UI: Jakarta.
Gordon, M.H. 1990. The mechanism of antioxidants action in vitro. Di dalam: B.J.F. Hudson, editor. Food Antioxidants. Elsivier Applied Science. London.
Hamburger, M., Hostettmann, K., 1991. Bioactivity in plants: the link between phytochemistry and medicine. Phytochemistry 30 (12): 3864-3874
Harborne, J.B. 1996. Metode Fitokimia. Terbitan kedua. Penerbit ITB. Bandung.
Harmita., 2009, Buku Ajar Analisis Hayati,(Edisi III, Cetakan I), Dalam Manurung J., (Editor), Jakarta: EGC, hal: 42-43, 48, 76-78
Harmita dan Radji, M., 2008. Kepekaan Terhadap Antibiotik. Dalam: Buku Ajar Analisis Hayati, Eds.3.EGC. Jakaerta:1-5.
Hieronymus, B. 2008. Ragam dan Khasita Tanaman Obat. Jakarta : AgroMedia Pustaka.
Indiastuti D.N., et al.,. 2008.Skrining Pendahuluan Toksisitas Beberapa Tumbuhan Benalu terhadap Larva Udang Artemia salina Leach,Jurnal Ilmu Kefarmasian Indonesia 6 (2): 82.
Ikawati, Muthi. 2008. Pemanfaatan Benalu Sebagai Agen Antikanker. Paper. Fakultas Farmasi Universitas Gajah Mada. Yogyakarta.
Isnansetyo Alim dan Kurniastuty. 1995. Teknik Kultur Phytoplankton, Zooplankton. Pakan Alam untuk Pembenihan Organisme Laut. Kanisius. Yogyakarta.
Lamson, Davis W, MS, ND, and Brignall, Matthew S. ND. 2000. Antioxidants
and cancer III: Quercetin, Alternative Medicine Review Volume 5
Number 3
Mailandri, M. 2012. Uji Aktivitas Antioksidan Ekstrak Daun Garcinia kydia Roxb dengan Metode DPPH dan Identifikasi Senyawa Kimia Fraksi yang Aktif. FMIPA UI.
Maukar, A. Morein. 2013. Analisis Kandungan Fitokimia Dari Uji Toksisitas Ekstrak Metanol Daun Soyogik (Sauraula bracteosa DC) Dengan Menggunakan Metode Maserasi. Jurnal Ilmiah Sains Vol.13. FMIPA. Universitas Sam Ratulangi, Manado.
McLaughin, J.L. and Rogers, L.L. 1988. The use of biological assay to
evaluate botanicals. Drug Information Journal 32 : 513-524.
Meyer, B.N., Ferrigni, N.R., Putman, J.E., Jacsben, L.b., Nicols, D.E. and McLaughlin, J.L. 1982. Brine Shrimp : a convenient general bioassay
for active plant constituent. Plant Medica45: 31-34
Mudjiman, A. 1988. Udang Renik Air Asin (Artemia Salina). Bhatara Karya Aksara. Jakarta.
Pitojo, S. 1996. Benalu Hortikultura Pengendalian dan Pemanfaatan. Trubus Agriwidya, Tegal, Jawa Tengah.
Pratiwi, S.T. 2008. Mikrobiologi Farmasi. Erlangga. Jakarta.
Priyanto, 2009, Toksikologi: mekanisme, terapi antidotum, dan penilaian resiko,(Cetakan I), Dalam Sunaryo H., (Editor), Jakarta: Lembaga Studi dan Konsultasi Farmakologi, hal: 151-152, 157.
Purnomo, B. 2000. Uji Ketoksikan Akut Fraksi Etanol Daun Benalu (Dendropathe Sp) Pada Mencit Jantan Dan Uji Kandungan Kimia, Skripsi. Fakultas Farmasi Universitas Gadjah Mada. Yogyakarta.
Riset Kesehatan Dasar Indonesia. 2013. Situasi Penyakit Kanker. Pusat Data dan Informasi Kementerian Kesehatan RI.
Rosidah, S. Yulinah ,Elin, S. Gana. 1999. Uji Aktivitas Antiradang pada Tikus Galur Wistar dan Telaah Fitokimia Ekstrak Daun Babadotan dan Ekstrak Rimpang Jahe. http://bahan-alam.fa.itb.ac.id. [18 Maret 2008]
Santoso, S.O. 1993. Perkembangan Obat Tradisional dan Ilmu Kedokteran di Indonesia dan Upaya Pengembangannya Sebagai Obat Alternatif. Pidato Pengukuhan Pada Upacara Penerima Jabatan Sebagai Guru Besar dab Farmakologi Fakultas Kedokteran Universitas Indonesia, Jakarta 4 Sepetember 1993.
Sastrohamidjojo, H. 1996. Sintesis Bahan Alam. Cetakan Pertama. UGM-Press. Yogyakarta.
Sirait, M. 2000. Penuntun Fitokimia Dalam Farmasi. Penerbit ITB. Bandung.
Siregar, J.P. C. Dan Amalia, L. 2004. Farmasi Rumah Sakit Teori dan Penerapan. Jakarta : EGC.
Soejono, 1995. Inventarisasi Pohon Inang Benalu di Kebun Raya Purwodadi. Makalah Seminar Kelompok Kerja Nasional Tumbuhan Obat Indonesia IX 21-22 September 1995. Universitas Gadjah Mada.
Tamaru, C.S., H. Ako, R. Paguirigan, Jr. Pang. 2004. Enrichment of Artemia
for Use in Freshwater Ornamental Fish Production.
http://www.lama.kcc.edu/CSTA/Artemia.htm/ [13 September 2009].
Wongkar, J.S., Max, J.R., Jemmy, A. 2015. Uji Toksisitas Ekstrak Daun Benalu Langsat ( Dendrophthoe petandra (L) Miq) dengan Metode Brine Shrimp Lethality Test (BSLT) LC50. Jurnal FMIPA UNSRAT.
BAB 3
METODE PENELITIAN
3.1 Alat – alat
Peralatan yang digunakan dalam penelitian ini meliputi :
- Rotary Vacum Evaporator Buch
- Penangas Uap Memmert
- Cawan porselen
- Labu alas Pyrex
- Labu Erlenmeyer Pyrex
- Neraca Analitis Mettler Toledo
3.2 Bahan – bahan - Daun benalu kopi
- larva udang Artemia salina Leach
- Methanol
- Metanol p.a p.a Merck
- Aquadest
- HCl (l)
- Air laut sintetik
- DMSO 1%
- Pereaksi Wagner
- Perekasi Meyer
- Pereaksi Dragendorff
- Pereaksi Bouchardart
- HCl (p)
- FeCl35%
- CeSO4 1%
- H2SO4 10%
- Ragi
- Aquadest
- Garam
3.3 Prosedur Penelitian
3.3.1 Pembuatan Serbuk Daun Benalu Kopi
Daun benalu kopi (Loranthus ferruginius Roxb.) segar yang telah dikumpulkan,
dicuci dengan air hingga bersih dari kotoran yang melekat dan ditiriskan. Daun
dikeringkan dengan cara diangin – anginkan. Kemudian dihaluskan dengan
3.3.2 Pembuatan Ekstrak Metanol Daun Benalu Kopi
Pembuatan ekstrak metanol daun benalu kopi dilakukan dengan metode maserasi
sebanyak 200g serbuk daun benalu kopi dimasukkan kedalam labu Erlenmeyer,
ditambahkan pelarut metanol hingga serbuk daun terendam. Didiamkan selama
kurang lebih 48 jam dan ditutup dengan rapat lalu disaring menggunakan kertas
saring. Selanjutnya filtrate yang diperoleh dipekatkan dengan Rotary Vacum
Evavorator untuk memisahkan pelarutnya hingga diperoleh ekstrak metanol dari
daun benalu kopi, kemudian dipanaskan diatas penangas uap untuk menguapkan
pelarut yang masih tersisa.
3.3.3 Skrining Fitokimia Senyawa Metabolit Sekunder 3.3.3.1 Uji Flavonoid
Filtrat metanol dari daun benalu kopi dimasukkan kedalam tabung reaksi,
kemudian ditambahkan larutan pereaksi FeCl3 1%. Jika terjadi perubahan menjadi
endapan berwarna hitam maka menunjukkan adanya senyawa flavonoid.
3.3.3.2 Uji Terpenoid
Filtrat metanol dari daun benalu kopi diteteskan pada plat tipis, kemudian
ditambahkan CeSO4 1% dalam H2SO4 10%. Jika terbentuk warna merah
kecoklatan menunjukkan adanya senyawa terpenoid.
3.3.3.3 Uji Saponin
Filtrat metanol dari daun benalu kopi dimasukkan kedalam tabung reaksi lalu
ditambahkan aquades, kemudian dikocok kuat – kuat selama 10 detik. Jika
terbentuk busa yang stabil tidak kurang dari 10 menit menunjukkan adanya
senyawa saponin.
3.3.3.4 Uji Alkaloid
Filtrat metanol dari daun benalu kopi dimasukkan kedalam 4 tabung reaksi dan
selanjutnya ditambahkan dengan pereaksi alkaloida diantaranya :
1. Tabung I ditambahkan larutn pereaksi Wagner. Jika terbentuk endapan
2. Tabung II ditambahkan larutan pereaksi Meyer. Jika terbentuk endapan
menggumpal berwarna putih atau putih kekuningan, menunjukkan adanya
senyawa alkaloida.
3. Tabung III ditambahkan larutan pereaksi Bouchardat. Jika terbentuk
endapan bewarna coklat kemerahan, menunjukkan adanya senyawa
alkaloida.
4. Tabung IV ditambahkan larutan pereaksi Dragendorff. Jika terbentuk
endapan merah atau jingga, menunjukkan adanya senyawa alkaloida.
3.3.4 Uji Toksisitas dengan Metode Brime Shrimp Lethality Test ( BSLT) 3.3.4.1Pembuatan Air Laut Buatan (ALB)
Siapkan air laut buatan dengan melarutkan 38 gram noniodium dalam 1 liter air
mineral (Harmita, 2009).
3.3.4.2 Pembuatan Ekstrak Ragi
Ditimbang ragi sebanyak 3 mg, lalu ragi dilarutkan dengan 5 ml air laut buatan
diaduk dan dihomogenkan. Disimpan ekstrak ragi didalam vial dan siap untuk
digunakan.
3.3.4.3 Penyiapan Kontrol Negatif
Kontrol negatif yang digunakan untuk uji toksisitas pada larva udang Artemia
salina Leach yaitu dibuat dengan dimasukkan pelarut ( metanol p.a) kedalam vial
dan dikeringkan, lalu ditambahkan 1 ml air laut buatan, 1 tetes dimetil sulfoksida
(DMSO) 1%, 10 ekor larva udang Artemia salina Leach dan 1 tetes ragi kedalam
vial, kemudian ditambahkan air laut buatan sampai volumenya menjadi 5 ml.
3.3.4.4 Persiapan Larva Udang Artemia salina Leach
Telur udang ditetaskan 2 hari sebelum dilakukan uji. Disiapkan bejana untuk
penetasan telur udang. Wadah yang digunakan dibagi menjadi dua bagian, bagian
gelap dan terang kemudian ditambahkan air laut buatan. Satu ruang dalam bejana
tersebut diberi penerangan dengan cahaya lampu pijar/neon 15 watt untuk
terjagadan merangsang proses penetasan. Sebelum ditetaskan telur Artemia salina
Leach sebanyak 20 mg terlebih dahulu dicuci yakni ditaburkan dan direndam pada
wadah berisi akuades selama 1 jam, lalu ditiriskan sampai airnya tuntas, kemudian
telur ditempatkan / direndam pada bagian gelap dari wadah berisi air laut buatan
sekitar 500 mL.
Telur udang yang terendam air laut buatan dibiarkan selama 2 x 24 jam
sampai menetas menjadi benur (nauplius) yang matang dan siap digunakan dalam
percobaan. Telur akan menetas dalam waktu 18-48 jam dan akan bergerak secara
alamiah menuju daerah terang sehingga larva udang terpisahkan dari bagian telur
atau kulit telur. Larva yang sehat bersifat fototropik dan siap dijadikan hewan uji
setelah berumur 48 jam. Nauplius dipisahkan dari telurnya dengan dipipet ke
dalam beker/vial yang berisi air laut buatan.
3.3.4.5 Persiapan Larutan Uji
Ekstrak yang kan diuji dibuat dalam beberapa konsentrsi 20 ppm, 40 ppm,60 ppm
80 ppm, dan 100 ppm. Ekstrak yang telah dalam variasi konsentrasi dipipet
masing – masing sebanyak 100 µl menggunakan alat mikropipet ke dalam botol
vial, dibuat tiga kali pengulangan (triplo).
3.3.4.6 Uji Toksisitas Brime Shrimp Lethality Test ( BSLT)
Vial disediakan untuk tiap kelompok sesuai peringkat konsentrasi dengan
masing-masing disediakan 5 vial dan direplikasi sebanyak 3 kali(triplo), kemudian vial
yang berisi larutan uji sebanyak 100 µl dikeringkan sampai semua pelarutnya
menguap sehingga tidak berbau pelarutdan dapat ditunjukkan dengan proses
pengeringan menghasilkan penimbangan yang konstan dengan bobot tetap (Adfa,
2005), kemudian ditambahkan DMSO 1 % 1-3 tetes (50-150 µL) termasuk vial
kontrol untuk melarutkan sampel kembali jika diperlukan. Selanjutnya vial yang
telah diisi sampel kemudian ditambah air laut buatan 1 mL (Indiastuti, 2008),
kemudian 10 ekor larva udang Artemia salina Leach yang berumur 48 jam
dimasukan dalam vial. Satu tetes ragi (0,6 mg/mL) dimasukkan ke dalam setiap
vial sebagai makanan Artemia (Harmita & Radji, 2008), lalu ditambahkan air laut
kerja yang sama tanpa memasukan ekstrak daun benalu kopi ke dalam vial.
Vial-vial tersebut diletakkan di bawah penerangan. Jumlah Artemia salina Leach
yang mati dalam tiap vial selama 24 jam dihitung dengan cara manual dan
mikroskopik. Kriteria standar untuk menilai kematian larva udang adalah bila
larva udang tidak menunjukkan pergerakan selama beberapa detik observasi.Cara
manual yaitu dengan mengamati larva di dalam vial dengan bantuan lup,
kemudian diamati dalam kaca arloji dengan bantuan cahaya. Jumlah nauplii yang
mati dihitung dengan mengurangkan jumlah total nauplii pada tiap konsentrasi
dengan jumlah nauplii yang masih hidup. Sedangkan cara mikroskopik adalah
dilakukan pengamatan di bawah mikroskop.
3.3.4.7 Analisa Toksisitas
Efek toksik diperoleh dari pengamatan dengan menghitung % kematian
(mortalitas) larva Artemia salina Leach pada tiap konsentrasi. Ciri – ciri larva
Artemia Salina Leach yang mati dilihat dari fisik larva yang sudah tidak bergerak,
lalu dilihat dari warna tubuh yang lebih gelap, serta seolah – olah bentuk tubuh
lebih ramping tidak memiliki sayap.Jumlah Artemia salina Leach yang mati
dalam tiap vial selama 24 jam dihitung. Persen kematian diperoleh dari hasil
perkalian rasio dengan 100%, yaitu larva yang mati dibagi jumlah larva awal
dikali 100% untuk tiap replikasi. Lalu dibandingkan dengan kontrol dan dilakukan
analisis hasil sehingga diperoleh harga LC50.
% ��������= jumlah larva mati
jumlah larva total awal x 100%
Apabila pada kontrol ada yang mati, persen kematian ditetapkan dengan rumus
Abbott (Meyer et al., 1982; Harmita & Radji,2008).
%��������=jumlah larva yang mati pada uji−jumlah larva mati pada kontrol
Dari persen kematian, dicari angka/nilai probit tiap kelompok hewan uji melalui
tabel, menentukan log dosis tiap-tiap kelompok kemudian dibuat grafik dengan
persamaan garis lurus hubungan antara nilai probit vs log konsentrasi, y = bx + a.
Dimana y : angka probit dan x : log konsentrasi, kemudian ditarik garis dari harga
probit 5 (= 50% kematian) menuju sumbu X, didapatkan log konsentrasi. Log
konsentrasi diantilogkan untuk mendapatkan harga LC50atau LC50 dapat juga
dihitung dari persamaan garis lurus tersebut dengan memasukkan nilai 5 (probit
dari 50 % kematian hewan coba) sebagai y sehingga dihasilkan x sebagai nilai log
konsentrasi. LC50 dihitung dan diperoleh dari antilog nilai x tersebut (Priyanto,
3.4 Bagan Penelitian
3.4.1 Ekstraksi Daun Benalu Kopi (Loranthus ferrugineus Roxb.)
200 g serbuk daun benalu kopi
Dimasukkan kedalam labu Erlenmeyer
Direndam dengan 1 liter metanol selama 48 jam (± 2 hari)
Disaring
Residu Filtrat
Dipekatkan dengan Rotary Vacum Evavorator
Dipanaskan diatas penangas air
3.4.2 Skrining Fitokimia Ekstrak Metanol Daun Benalu Kopi
dimasukkan kedalam tabung reaksi
tabung I + pereaksi Wagner
tabung II + pereaksi Maeyer
tabung III + pereaksi Dragendorf
tabungIV + pereaksi Bouchardat
ditambahkan dengan aquadest
dikocok Ekstrak Metanol Daun Benalu Kopi
ditambahkan FeCl3 1%
Alkaloid Terpenoid Flavonoid Saponin ditambahkan
3.4.3 Uji Toksisitas dengan Metode Uji Brine Shrimp Lethality Test (BSLT), ( McLaughlin, 1988)
3.4.3.1 Persiapan Larva Udang
38 g garam non iodium untuk air laut buatan
Dimasukkan kedalam wadah yang telah disekat dua bagian ( setengah terbuka setengah tertutup)
Ditambahkan 1 L aquadest
Dimasukkan 20 gram telur Artemia salina Leach pada bagian sekat yang tertutup
Diberikan lampu dibagian yang terbuka untuk menarik udang pada bagian sekat yang terbuka
Dibiarkan selama 24 jam, hingga telur menetas
Nauplii menuju bagian yang bercahaya
Dibiarkan selama 48 jam
3.4.3.2 Pembuatan larutan Induk 100 ppm
0.025 gram Ekstrak Methanol Daun Benalu Kopi
Dimasukkan kedalam labu takar 25ml
Ditambahkan Metanol p.a hingga garis batas
Dihomogenkan
25 ml Larutan Induk 1000 ppm ppm
Dipipet 2,5 ml larutan induk 1000 ppm
Dimasukkan dalam labu takar 25 ml
Ditambahkan metanol p.a hingga garis batas
Dihomogenkan
3.4.3.3 Uji Toksisitas 3.4.3.3.1 Larutan Ekstrak
25 ml larutan Ekstrak 100 ppm
Dibuat variasi 20,40,60,dan 80 ppm
Dipipet 5 ml
Dipipet 100 µl kedalam botol vial
Dikeringakan/diuapkan
Diisi 3 ml air laut buatan
Diteteskan 1 - 3 tetes DMSO 1%
Dimasukkan 10 ekor larva udang
Diteteskan 1 tetes ekstrak ragi
Dibiarkan selama 24 jam
Diamati jumlah larva yang mati
Dilakukan pengulangan sebanyak 3 kali
Dihitung nilai LC50
3.4.3.3.2 Larutan Kontrol
1 ml Metanol p.a
Dimasukkan kedalam botol vial
Dikeringkan/diuapkan
Ditambahkan 1 ml air laut buatan
Diteteskan 1 tetes DMSO 1%
Dimasukkan 10 ekor larva udang
Diteteskan 1 tetes ragi
Dibiarkan selama 24 jam
Diamati jumlah larva yang mati
Dilakukan pengulangan sebanyak 3 kali
Dihitung nilai LC50
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
4.1.1 Skrining Fitokimia Ekstrak Metanol Daun Benalu Kopi
Ekstrak metanol daun benalu kopi diperoleh dengan metode maserasi
menggunakan pelarut metanol, dilakukan skrining fitokimia untuk mengetahui
senyawa metabolit sekunder golongan flavonoid, terpenoid, saponin dan alkaloid
yang ditunjukkan pada tabel 4.1 sebagai berikut :
Tabel 4.1 Hasil Skrining Fitokimia Ekstrak Metanol Daun Benalu Kopi
Golongan Pereaksi Hasil Skrining Fitokimia
Bouchardat - Tidak terjadi
perubahan
Alkaloid Wagner - Tidak terjadi
perubahan
Meyer - Tidak terjadi
perubahan
Dragendorf - Tidak terjadi
perubahan
Perubahan warna/endapan menunjukkan adanya kandungan senyawa metabolit
4.1.2 Hasil Uji Toksisitas Ekstrak Metanol Daun Benalu Kopi Menggunakan Metode Brine Shrimp Lethality Test (BSLT)
Uji toksisitas ditentukan berdasarkan metode Brine Shrimp Lethality Test
(BSLT), yaitu metode yang menganalisa sifat toksik suatu bahan berdasarkan
mortalitas larva Artemia Salina Leach. Seberapa mampu bahan bersifat racun
terhadap larva Artemia Salina leach dan mampu membunuh larva Artemia Salina
Leach hingga 50% dalam waktu 24 jam. Ekstrak metanol daun benalu kopi
mampu membunuh dan bersifat racun terhadap larva Artemia Salina Leach, dalam
beberapa variasi konsentrasi seperti yang ditunjukkan pada gambar berikut ini :
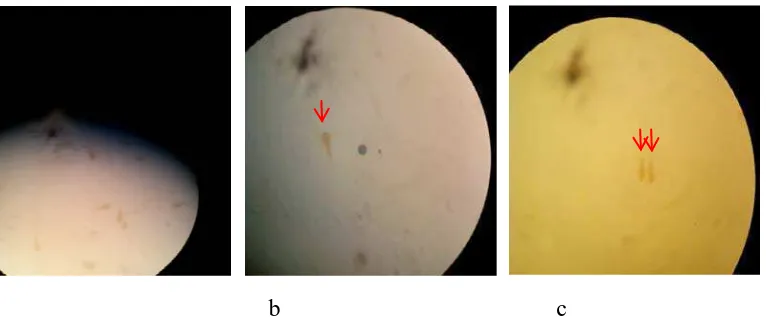
a. Konsentrasi 20 ppm
a b c
b. Konsentrasi 40 ppm
a
a b c
Gambar 4.2 (a) kematian larva sebanyak 3 ekor pada replikasi ke 1, (b)kematian larva sebanyak 1 ekor pada replikasi ke 2 (c)kematian larva sebanyak 3 ekor pada replikasi ke 3.
c. Konsentrasi 60 ppm
a b c
d. Konsentrasi 80 ppm
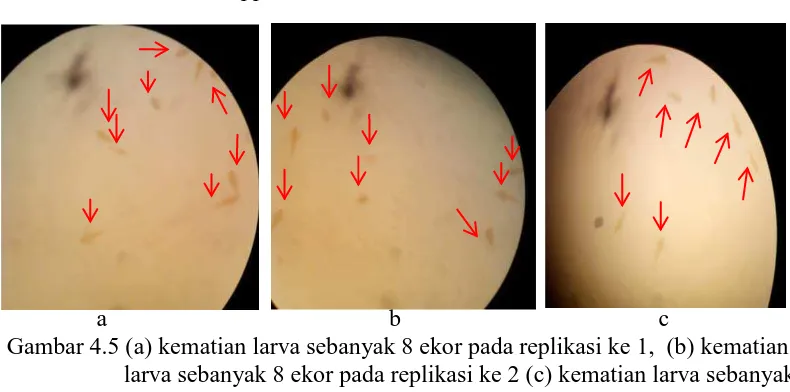
a b c Gambar 4.4 (a)kematian larva sebanyak 6 ekor pada replikasi ke 1, (b)kematian
larva sebanyak 6 ekor pada replikasi ke 2, (c)kematian larva sebanyak 6 ekor pada replikasi ke 3.
e. Konsentrasi 100 ppm
a b c
Gambar 4.5 (a) kematian larva sebanyak 8 ekor pada replikasi ke 1, (b) kematian larva sebanyak 8 ekor pada replikasi ke 2 (c) kematian larva sebanyak 7 ekor pada replikasi ke 3.
Keterangan : larva yang mati gambarnya tampak jelas dan berwarna lebih gelap
Adapun hasil pengukuran jumlah total kematian larva dapat ditunjukkan dalam
tabel 4.2 berikut ini:
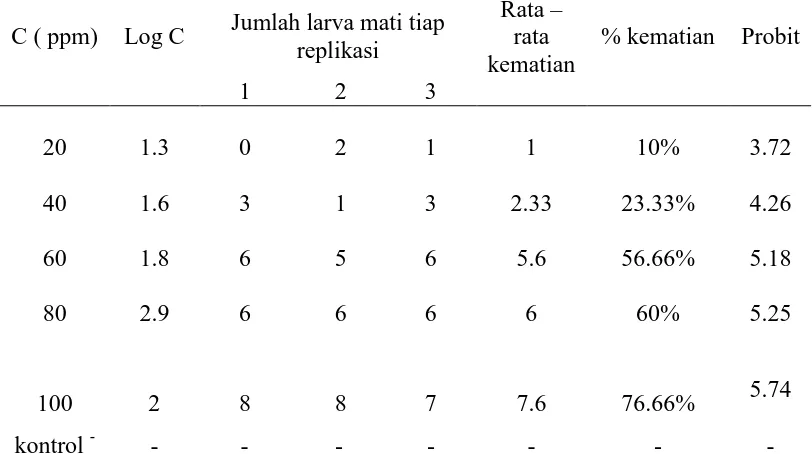
Tabel 4.2 Hasil Pengukuran Jumlah Total Kematian Larva Selama 24 Jam
C ( ppm) Log C Jumlah larva mati tiap
Dari persamaan garis linier diperoleh LC50 sebesar 58.88 ppm
Keterangan:
(-) : tidak ada larva yang mati
4.2 Pembahasan
4.2.1 Skrining Fitokimia Kandungan Senyawa Metabolit Sekunder Ekstrak Metanol Daun Benalu Kopi
Berdasarkan hasil skrining fitokimia, diperoleh bahwa ekstrak metanol daun
benalu kopi pada golongan flavonoid dengan penambahan FeCl3, menunjukkan
adanya terbentuk endapan hitam. Pada golongan terpenoid dengan pereaksi
CeSO4 1% dalam H2SO4 10% menunjukkan adanya pembentukan endapan coklat
kemerahan. Pada golongan saponin dengan penambahan akuades, tidak
menunjukkan adanya pembentukkan busa yang stabil saat dikocok. Pada golongan
alkaloid dengan pereaksi Wagner, Bouchardat, dan Dragendorf tidak terjadi
perubahan warna sedangkan dengan penambahan pereaksi Meyer tidak terjadi
pembentukkan putih kekuningan. Sehingga, ini menunjukkan bahwa ekstrak
metanol daun benalu kopi mengandung senyawa metabolit sekunder golongan
4.2.2 Uji Toksisitas Ekstrak Metanol Daun Benalu Kopi Menggunakan Metode Brime Shrimp Lethality Test (BSLT)
Uji BSLT merupakan uji toksisitas yang paling sederhana dengan menggunakan
larva Artemia Salina Leach sebagai hewan ujinya. Uji ini dimaksudkan untuk
skrining awal potensi sebagai senyawa antikanker. Larva Artemia Salina Leach
yang digunakan berumur 48 jam atau yang disebut dengan nauphilus. Larva
Artemia Salina Leach yang digunakan sebanyak 10 ekor dengan waktu
pengamatan 24 jam.
Ditabel 4.2 diatas telah dijelaskan hasil pengujian ekstrak metanol daun
benalu kopi terhadap larva Artemia Salina Leach dengan waktu pengamatan 24
jam, dimana hasil pengujian terhadap Larva Artemia Salin Leach dengan
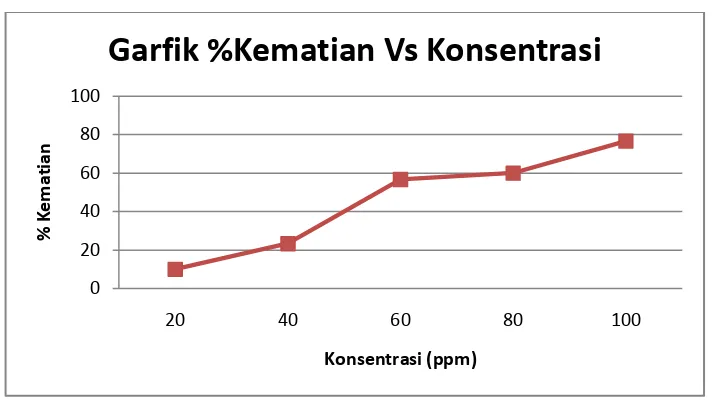
konsentrasi 20,40,60,80, dan 100 ppm didapatkn persen kematian larva berturut –
turut 10%; 23.33%; 56.66%; 60%; dan 76.66%. Untuk kontrol negatif dengan
menggunakan pelarut metanol tidak menunjukkan adanya kematian, sehingga
dapat dikatakan bahwa pelarut yang digunakan tidak mempengaruhi pengujian.
Kematian larva Artemia Salina Leach disebabkan oleh kandungan
senyawa bioaktif yang terdapat dalam sampel yang diujikan. Senyawa bioaktif
tersebut masuk kedalam tubuh larva, yang kemudian bertindak sebagai racun
perut sehingga mengganggu sistem pencernannya. Selain itu, reseptor perasa pada
mulut larva juga dihambat sehingga larva gagal mengenali makanannya yang
kemudian menyebabkan kematian (Djarijah, 1995). Hasil pengujian menunjukkan
bahwa persen kematian Artemia Salina semakin meningkat seiring meningkatnya
Gambar 4.6. Grafik hubungan antara konsentrasi dengan %kematian larva Artemia Salina Leach.
Untuk mengetahui toksisitas dari ekstrak metanol daun benalu kopi yang
diujikan, dihitung nilai LC50 menggunakan persamaan regresi linier log
konsentrasi (x) vs probit (y) pada penelitian ini persamaan regresi linier yang
didapat adalah y = 2,899x – 0,156. Dengan Persamaan tersebut dapat dihitung
LC50 dari ekstrak metanol benalu kopi yang diujikan terhadap larva Artemia
Salina Leach.
Hasil perhitungan menunjukkan bahwa ekstrak metanol benalu kopi
mampu membunuh 50% populasi larva Artemia Salina Leach dengan konsentrasi
58,88 ppm. Berdasarkan hasil LC50 yang diperoleh menandakan bahwa ekstrak
metanol daun benalu kopi bersifat toksik.
4.2.3Hubungan Senyawa Toksik dengan Aktivitas Antikanker
Larva Artemia Salina Leach memiliki kemampuan berkembang biak yang cepat
seperti sel kanker. Kesamaan lain yang dimiliki Artemia Salina Leach adalah
membran kulitnya yang tipis seperti sel kanker. Kandungan senyawa metabolit
sekunder yang ada dalam ekstrak metanol daun benalu kopi ini diharapkan
mampu menyebabkan kematian. Adanya kematian larva Artemia Salina Leach
tersebut dapat diasumsikan bahwa ekstrak metanol daun benalu kopi yang
Kematian larva Artemia Salina Leach dihubungkan dengan adanya
senyawa toksik. Didalam penelitian ini senyawa toksik berasal dari senyawa
metabolit sekunder yang terkandung dalam ekstrak metanol daun benalu kopi
(Loranthus Ferrugineus Roxb.). Berdasarkan uji skirining fitokimia ekstrak
metanol daun benalu kopi mengandung senyawa bioaktif yang dapat larut dalam
metanol yaitu flavonoid dan terpenoid. Flavonoid termasuk senyawa polifenol
alam yang mempunyai bioaktifitas sebagai penangkal radikal bebas dan dapat
menginhibisi protein karena adanya gugus fenol. Berdasarkan penelitian terdahulu
tumbuhan benalu kopi mengandung flavonoid utama yaitu kuersetin. Kuersetin
adalah kelompok flavonol terbesar, kuersetin juga merupakan suatu aglikon yang
apabila berikatan dengan glikonnya akan menjadi glikosida, kuersetin dipercaya
dapat melindungi tubuh dari beberapa jenis penyakit degenerative dengan cara
mencegah terjadinya proses peroksidasi lemak. Kuersetin memperlihatkan
kemampuan mencegah proses oksidasi dari low density lipoproteins (LDL)
dengan cara menangkap radikal bebas dan mengkhelat ion logam transisi.
Senyawa ini dapat beraksi sebagai antikanker pada regulasi siklus sel, berinteraksi
dengan reseptor estrogen (ER) tipe II dan menghambat enzim tirosin kinase
(Lamson et al., 2000).
Larva yang 60% tersusun atas protein mati dikarenakan senyawa metabolit
sekunder yaitu flavonoid, dimana struktur fenol dari flavonoid mampu
menginhibisi aktivitas protein kinase sehingga menghambat jalur transduksi sinyal
dari membran sel ke inti sel, dan menggangu proses pencernaan serta
pertumbuhan larva sehingga lama - kelamaan larva mati. Senyawa fenol pada
senyawa alam yang dikenal sebagai polifenol dalam konsentrasi tinggibekerja
dengan merusak membran sitoplasma secara total dengan mengendapkan protein
sel. Akan tetapi bila dalam konsentrasi rendah , fenol merusak membran sel yang
menyebabkan kebocoran metabolit penting dan menginaktifkan metabolisme pada
tubuh larva (Carballo,2002). Hal ini dianggap bahwa senyawa flavonoid dapat
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Ekstrak metanol daun benalu kopi (Loranthus ferrugineus Roxb.)mengandung
senyawa metabolit sekunder golongan flavonoid dan terpenoid.
2. Uji Toksisitas ekstrak metanol benalu kopi (Loranthus ferrugineus Roxb.)
dengan metode Brime Shrimp Lethality Test (BSLT) memiliki nilai LC50
sebesar 58,88 ppm. Ini menunjukkan bahwa ekstrak metanol daun benalu kopi
(Loranthus ferrugineus Roxb.) bersifat toksik dan berdasarkan hasil LC50 yang
didapatkan pada penelitian ini, ekstrak metanol daun benalu kopi berpotensi
sebagai antikanker karena LC50< 1000 ppm (Meyer,et al., 1982).
5.2 Saran
Diharapkan dari hasil penelitian yang telah dilakukan, peneliti selanjutnya untuk
menguji ekstrak metanol daun benalu kopi (Loranthus ferrugineus Roxb.)dengan
uji sitoksisitas terhadap cell line kanker pada manusia untuk mengetahui apakah
ekstrak metanol daun benalu kopi dapat dijadikan obat yang berpotensi sebagai
BAB 2
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan Benalu Kopi (Loranthus Ferrugineus Roxb.) 2.1.1 Deskripsi Tumbuhan
Benalu kopi (Loranthus Ferrugineus Roxb.) merupakan jenis tumbuhan yang
hidupnya tidak memerlukan media tanah. Ia hidup sebagai parasit, melekat pada
sel inang, dan menghisap nutrisi yang dimilikinya sehingga menyebabkan
kematian pada sel inang tersebut. Adanya klorofil menyebabkan tanaman benalu
memiliki kemampuan melakukan proses fotosintesis. Akan tetapi, tanaman ini
tidak mampu mengambil air dan unsur hara secara langsung dari tanah yang
menjadikannya sebagai tanaman parasit (Pitojo,1996)
Bentuk dari benalu kopi yaitu akar berbentuk ramping, menjalar pada
inangnya dan berwarna kusam. Batang tumbuhan panjang tegak berwarna hijau
kusam. Daun bentuk lonjong kecil – kecil yang memiliki warna hijau tua sedikit
kasar permukaannya. Terdapat biji kecil – kecil disela – sela tangkai daun dan
batang, biji berbentuk kecil seperti isi pensil, memiliki sungut pendek. Habitus
dari tumbuhan ini sangat besar, cukup besar. (Pitojo,1996). Tumbuhan benalu
kopi dapat dilihat pada gambar 2.1 sebagai berikut :
2.1.2 Kandungan Senyawa Kimia Tumbuhan
Kandungan kimia yang terdapat dalam benalu adalah flavonoid, tanin, asam
amino, karbohidrat, alkaloid, dan saponin (Anonim,1996). Berdasarkan berbagai
penelitian, senyawa dalam benalu yang diduga memiliki aktivitas antikanker
adalah flavonoid, yaitu kuersetin yang bersifat inhibitor terhadap enzim DNA
topoisomerase sel kanker (Anonim,1996). Berdasarkan berbagai penelitian yang
ada senyawa flavonoid pada benalu yang berperan dalam melawan kanker adalah
kuersetin. Kuersetin memiliki aktivitas antioksidan yang dimungkinkan oleh
komponen fenoliknya yang sangat reaktif. Kuersetin akan mengikat radikal bebas
sehingga dapat mengurangi reaktifitas radikal bebas tersebut, (Purnomo, 2000).
2.1.3 Sistematika Tumbuhan
Sistematika tumbuhan Benalu Kopi (Loranthus Ferrugineus Roxb.)
hasilidentifikasi tumbuhan di laboratorium Herbarium Medanense, Universitas
Sumatera Utara, adalah sebagai berikut :
Kingdom : Plantae
Divisi : Spermatophyta
Class : Dicotyledoneae
Ordo : Santalales
Famili : Loranthaceae
Genus : Loranthus
Spesies :Loranthus Ferrugineus Roxb.
Nama lokal : Benalu Kopi ( Herbarium Medanense, 2015)
2.1.4 Khasiat Tumbuhan
Benalu kopi adalah salah satu tanaman parasit yang biasa digunakan dalam
pengobatan tradisional. Sebagai tanaman parasit benalu tidak banyak
tanaman inangnya,sementara sebagai salah satu tanaman obat, benalu mempunyai
peranan yang penting. Secara tradisional benalu digunakan antara lain sebagai
obat batuk, amandel, campak, diabetes dan kanker (Pitojo,1996).
2.1.5 Perkembangbiakan Tumbuhan 2.1.5.1 Organ Perkembangbiakan Benalu
Tumbuhan benalu dapat berkembangbiak dengan cara generative dan
vegetative. Pada kebanyakan spesies benalu, cara utama untuk
perkembangbiakannya melalui cara generative, sedangkan bagi beberapa
spesies benalu melalui cara generatif dan vegetative yang saling
melengkapi. Organ perkembangbiakan generative berupa biji dan organ
perkembangbiakan vegetative yaitu haustoria.
2.1.5.2 Pertumbuhan Benalu
Pertumbuhan benalu tidak secepat tanaman yang hidup dan mengambil
makanan langsung dari tanah. Pertumbuhan benalu tersebut sangat
dipengaruhi oleh ketersediaan hara yang dapat dimanfaatkan benalu dari
tanaman yang dihinggapinya.
Pertumbuhan benalu mengeluarkan haustoria, menjalar kebagian lain
tanaman inang, mengadakan penetrasi kejaringan, dan menghisap hara
garam mineral, serta air dari tanaman inang. Benalu memiliki hijau daun
sehingga dapat berasimilasi membentuk karbohidrat untuk mencukupi
kebutuhan hidupnya. Oleh karena itu, benalu termasuk kedalam kategori
tumbuhan hemiparasit. Beberapa hal yang mempengaruhi pertumbuhan
benalu sebagai berikut :
a. Spesies Benalu
Perilaku pertumbuhan benalu berbeda – beda, ada yang tumbuhnya
kuat, ada yang membentuk percabangan banyak, ada yang membentuk
habitus kecil, dan lain – lain. Spesies benalu yang pertumbuhannya
kuat antara lain Dendrophthoe. Benalu yang berhabitus kecil antara
Perilaku perakarannya pun bermacam – macam. Pada spesies Viscum,
tidak membentuk haustoria diluar tanaman inang sedangkan pada
Dendrophthoe menunjukkan cirri bahwa jaringan tanaman sempat
berpijaknya benalu mengalami pertumbuhan abnormal yang dikenal
dengan istilah hipertrofi. Pertumbuhan semacam itu juga terjadi pada
tempat – tempat haustoria menetrasi tanaman. Apabila benalu hidup
lama ditanaman inang, maka akan terbentuk tonjolan tak beraturan dan
kadang – kadang berupa bangunan yang mempunyai nilai artistic.
b. Jenis Tanaman Inang
Walau benalu dapat hidup menumpang pada tanaman berkayu
golongan dikotil, tetapi tidak semua tanaman tersebut terserang benalu.
Ada kelompok tanaman yang seolah – olah disukai benalu dan ada
kelompok tanaman yang tidak disukai oleh benalu. Pada tanaman
berdaun lebar atau yang berkulit lunak, benalu cenderung tumbuh lebih
subur.
c. Letak atau Posisi Benalu
Benalu sering tumbuh dibatang, cabang atau di ranting tanaman.
Adapun letak benalu bermacam-macam, ada yang di bagian tengah,
atas atau samping tanama. Letak benalu tersebut cenderung
mempengaruhi arah pertumbuhan benalu. Benalu yang berada di
bagian tengah pohon biasanya cenderung tumbuh kearah bawah
sehingga ranting-ranting benalu keliatan terkulai. Benalu yang berada
di bagian atas, akan cenderung tumbuh ke atas, kearah sinar, dan
membentuk cabang serta ranting yang kuat.
d. Iklim
Iklim makro maupun iklim mikro, selain mempengaruhi
perkecambahan biji benalu, juga mempengaruhi pertumbuhan benalu.
Di daerah yang mempunyai musim hujan dan musim kemarau jelas,
memberikan pengaruh yang nyata terhadap pertumbuhan benalu. Di
musim hujan,tanaman inang dan tumbuhan benalu sama-sama tumbuh
subur. Sedangkan di musim kemarau, beberapa tanaman inang
bereaksi untuk mengatasi keadaan tersebut. Pada waktu tanaman inang
gugur daunya, benalu akan mengikuti cara tersebut sehingga
penguapan air terbatas. Pengaruh musim kemarau panjang sering
menyebabkan benalu yang tumbuh di dekat batang lebih kuat
mengatasi situasi yang tidak menguntungkan tersebut. Pada
daerah-daerah yang bulan keringnya sedikit, serta di daerah-daerah yang lembab
pertumbuhan benalu lebih baik daripada di daerah kering.
e. Hubungan antara inang dan benalu
Hubungan antara tumbuhan benalu dengan tanaman inangnya telah
lama dipertanyakan oleh ahli botani, apakah hubungan tersebut seperti
okulasi pada tanaman. Docters Van Leeuwen (1945) dalam tulisannya
tentang benalu di jawa, pernah menyinggung kemungkinan adanya
hubungan timbal balik, seperti hubungan okulasi pada benalu
dendrophthoe magna yang hidup di atas Quereus pseudomoliveca yang
hampir semua tajuknya didominasi oleh benalu tersebut. Pada
peristiwa autoparasit atau hiperparasit yang pendukungnya sama-sama
benalu diduga keras hubungannya seperti okulasi(Pitojo,1996).
2.2 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan yang dapat larut sehingga dapat
terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Sampel yang
diekstrak mengandung senyawa aktif yang dapat larut dan senyawa yang tidak
dapat larut seperti serat, protein dan lain – lain. Senyawa aktif yang terdapat
dalam berbagai sampel dapat digolongkan kedalam golongan minyak atsiri,
alkaloid, flavonoid dan lain – lain.
Prosedur ekstraksi yang digunakan bertujuan untuk mendapatkan senyawa
yang diinginkan dan untuk menghilangkan komponen yang tidak diinginkan dari
tanaman menggunakan pelarut yang selektif. Tanaman yang diekstrak
mengandung campuran kompleks dari metabolit seperti alkaloida, glikosida,
Metode ekstraksi dengan maserasi adalah proses pengekstrakkan sampel
dengan menggunakan pelarut dengan beberapa kali pengocokkan atau
pengadukan pada temperature ruangan. Maserasi kinetic berarti dilakukan
pengadukkan yang kontinu (terus – menerus). Remaserasi berarti dilakukan
pengulangan penambahan pelarut setelah dilakukan penyaringan maserat pertama
dan seterusnya (Depkes, 2000).
2.3 Senyawa Metabolit Sekunder
Senyawa metabolit pada makhluk hidup dapat dikelompokkan menjadi dua yaitu,
senyawa metabolit primer dan senyawa metabolit sekunder. Senyawa metabolit
primer didefinisikan sebgai produk akhir dalam proses metabolisme makhluk
hidup yang fungsinya sangat esensial bagi kelangsungan hidup organisme
tersebut, serta terbentuk secara intraseluler. Contohnya, protein, lemak,
karbohidrat dan DNA. Sedangkan senyawa metabolit sekunder dapat
didefenisikan sebagai suatu produk metabolic yang dihasilkan oleh proses
metabolisme sekunder makhluk hidup, dimana produk tersebut bukan merupakan
kebutuhan pokok untuk hidup dan tumbuh, serta terbentuk secara ekstraseluler.
Metabolit sekunder banyak bermanfaat bagi manusia, dan makhluk hidup lain
karena banyak diantaranya bersifat sebagai obat, vitamin, pigmen (Pratiwi, 2008)
Skrining fitokimia merupakan uji kualitatif kandungan kimia dalam suatu
tumbuhan untuk mengetahui golongan senyawa metabolit sekunder yang
terkandung di dalam tumbuhan tersebut. Senyawa metabolit sekunder yang
memiliki khasiat untuk kesehatan diantaranya, alkaloid, flavonoid, terpenoid,
tannin, dan saponin.
2.3.1 Flavonoid
Flavonoid adalah senyawa yang terdiri dari 15 atom karbon. Flavonoid umumnya
terdapat pada tumbuhan sebagai glikosida. Gugusan gula bersenyawa pada satu
atau lebih gugus hidroksil fenolik. Flavonoid terdapat pada seluruh bagian
tumbuhan termasuk pada buah, tepung sari dan akar. Flavonoid dapat bekerja
flavonoid mempunyai rasa pahit hingga dapat menolak sejenis ulat tertentu
(Sastrohamidjojo, 1996). Pemeriksaan senyawa flavonoid dapat dilakukan dengan
menambahkan larutan besi (III) klorida 1% dalam air atau etanol yang
menimbulkan warna hijau, merah ungu, ataupun hitam kuat (Mailandari, 2012).
2.3.2 Alkaloid
Alkaloid adalah metabolit basa yang mengandung satu atau lebih atom nitrogen
yang biasanya dalam gabungan berbentuk siklik.. Alkaloid umumnya memiliki
sifat padatan kristal, sedikit alkaloid berbentuk amorf, dan sebagian ada yang cair,
bersifat basa, berasa pahit, kebanyakkan alkaloid tidak berwarna. Pada umumnya
basa bebas alkaloid hanya larut dalam pelarut organik, tetapi ada beberapa yang
dapat larut dalam air (Sastrohamijdojo, 1996). Alkaloid dapat dideteksi dengan
menggunakan pereaksi Dragendorf, Mayer, dan Bouchardat (Mailandari,2012).
2.3.3 Saponin
Pembentukkan busa sewaktu mengesktraksi tumbuhan atau pada saat memekatkan
ekstrak tumbuhan merupakan bukti adanya saponin. Uji saponin yang sederhana
adalah mengocok ekstrak alcohol – air dari tumbuhan dalam tabung reaksi dan
diperhatikan apakah terbentuk busa tahan lama pada permukaan cairan. Saponin
juga dapat diperiksa dalam ekstrak kasar berdasarkan kemampuannya
menghemolisis sel darah (Harborne, 1996).
2.3.4 Terpenoid
Terpenoid adalah suatau senyawa yang tersusun atas isoprene dan kerangka
karbonnya dibangun oleh penyambungan dua atau lebih satuan C5. Terpenoid
terdiri atas beberapa macam senyawa seperti monoterpene dan seskuiterpen yang
mudah menguap, diterpen yang sukar menguap dan yang tidak menguap
triterpene dan sterol. Secara umum senyawa ini larut dalam lemak dn terdpat
dalam sitoplasma sel tumbuhan. Biasanya senyawa ini diidentifikasi dengan
pereaksi Liberman-Bouchard (anhidrat asetat-asam sulfat) yang memberikan
2.4 Toksitologi
Toksitologi adalah pengetahuan tentang efek racun dari obat terhadap tubuh dan
sebetulnya termasuk pula dalam kelompok farmakodinamika, karena efek
terapeutis obat berhubungan erat dengan efek toksisnya (Tjay, 2002). Toksikologi
merupakan ilmu yang lebih tua dari Farmakologi. Disiplin ini mempelajari
sifat-sifat racun zat kimia terhadap makhluk hidup dan lingkungan. Sedikitnya 50.000
zat kimia kini digunakan oleh manusia dan karena tidak dapat dihindarkan, maka
kita harus sadar tentang bahayanya (Ganiswarna, 1995).
Setiap obat dalam dosis yang cukup tinggi dapat mengakibatkan efek
toksik. Pada umumnya, hebatnya reaksi toksis berhubungan langusng dengan
tingginya dosis, bila dosis diturunkan, efek toksis dapat dikurangi pula
(Tjay, 2002).
Setiap zat kimia pada dasarnya bersifat racun dan terjadinya keracunan
ditentukan oleh dosis dan cara pemberian. Paracelcus pada tahun 1564 telah
meletakkan dasar penilaian toksikologis dengan mengatakan bahwa dosis
menentukan apakah suatu zat kimia adalah racun (dosis sola facit venenum).
Sekarang dikenal banyak faktor yang menentukan apakah suatu zat kimia bersifat
racun, namun dosis tepat merupakan faktor utama yang terpenting. Untuk setiap
zat kimia, termasuk air, dapat ditentukan dosis kecil yang tidak berefek sama
sekali, atau suatu dosis besar sekali yang dapat menimbulkan keracunan dan
kematian. Untuk zat kimia dengan efek terapi, maka dosis yang kuat dapat
menimbulkan efek farmakoterapeutik (Ganiswarna, 1995).
Sintesis zat kimia yang diperkirakan berjumlah 1000 per tahun,
menyebabkan toksikologi tidak hanya meliputi sifat-sifat racun, tetapi lebih
penting lagi mempelajari keamanan setiap zat kimia yang dapat masuk ke dalam
tubuh. Zat-zat kimia itu disebut xenobiotik (xeno = asing). Setiap zat kimia baru
harus diteliti sifat-sifat toksiknya sebelum diperbolehkan penggunaannya secara
Salah satu metode untuk menguji bahan-bahan yang bersifat sitotoksik
adalah dengan uji toksisitas terhadap larva udang dari Artemia Salina Leach
(Brine ShrimpLethality Test). Metode ini sering digunakan untuk praskrining
terhadap senyawa aktif yang terkandung di dalam ekstrak tanaman karena murah,
cepat, mudah (tidak perlu kondisi aseptis) dan dapat dipercaya (Meyer, et all.,
1982).
2.5 Brine Shrimp Lethality Test
Penelitian fitokimia saat ini lebih ditekankan pada penelitian untuk mendapatkan
senyawa bioaktif. Uji hayati yang digunakan untuk tujuan ini sebaiknya
sederhana, cepat, ekonomis, dan memiliki korelasi statistik yang valid dengan
bioaktivitasnya yang diinginkan (Anderson, 1991).
Salah satu uji aktivitas yang mudah, murah, cepat dan akurat yaitu dengan
menggunakan larva Artemia Salina Leach dikenal dengan istilah Brine Shrimp
Lethality Test (BSLT). Uji mortalitas larva udang merupakan salah satu metode
uji bioaktivitas pada penelitian senyawa bahan alam. Penggunaan larva udang
untuk kepentingan studi bioaktivitas sudah dilakukan sejak tahun 1956 dan sejak
saat itu telah banyak dilakukan pada studi lingkungan, toksisitas, dan penapisan
senyawa bioaktif dari jaringan tanaman. Uji ini merupakan uji pendahuluan untuk
mengamati aktivitas farmakologi suatu senyawa. Adapun penerapan untuk system
bioaktivitas dengan menggunakan larva udang tersebut antara lain, untuk
mengetahui residu pestisida, anastetik local, senyawa turuna morpin, mikotoksin,
karsinogenitas suatu senyawa dan polutan untuk air laut serta sebagai alternative
metode yang murah untuk uji toksisitas (Hamburger dan Hostettman, 1991)
Senyawa aktif yang memiliki daya bioaktifitas tinggi diketahui
berdasarkan nilai Lethal Concentration 50% (LC50), yaitu suatu nilai yang
menunjukkan konsentrasi zat toksik yang dapat menyebabkan kematian hewan uji
sampai 50%. Data mortalitas yang diperoleh kemudian diolah dengan analisis
probit yang dirumuskan oleh Finney (1971) untuk menentukan nilai LC50 pada
derajat kepercayaan 95%. Senyawa kimia memiliki potensi bioaktif jika
2.5.1 Larva Artemia Salina Leach 2.5.1.1 Sistematika
Artemia salina merupakan bangsa udang-udangan yang diklasifikasikan sebagai
berikut:
Genus :Artemia (Mudjiman, 1992).
2.5.1.2 Tahap penetasan dan Morfologi.
Nama Artemia diberikan untuk pertama kali oleh Schlosscer yang menemukannya
di suatu danau asin pada tahun 1755. Kemudian oleh Linnaeus (1758)
melengkapkan jasad renik ini menjadi Artemia salina. Keistimewaan Artemia
sebagai plankton adalah memiliki toleransi (kemampuan beradaptasi) pada kisaran
kadar garam yang sangat tinggi dimana tidak ada satupun organisme lain yang
mampu bertahan hidup ternyata Artemia mampu mentolerirnya (Djarijah, 1995).
Artemia salina dijual-belikan dalam bentuk telur istirahat yang disebut
dengan kista. Kista ini apabila dilihat dengan mata telanjang berbentuk
bulatan-bulatan kecil berwarna kecoklatan dengan diameter berkisar antara 200-350
mikron. Kista yang berkualitas baik akan menetas sekitar 18-24 jam apabila
diinkubasikan dalam bentuk dalam air bersalinitas 5-70/mil (Mudjiman,1992).
Artemia salina yang baru menetas disebut nauplius. Nauplius berwarna
orange berbentuk bulat lonjong dengan panjang sekitar 400 mikrometer, lebar 170
mikron dan beratnya 0,002 mg. Ukuran-ukuran tersebut sangat bervariasi
tergantung strainnya. Nauplius mempunyai sepasang antenulla dan sepasang
antena. Selain itu, di antara antenulla terdapat bintik mata yang disebut dengan
ocellus (Mudjiman, 1992).
Artemia salina dewasa biasanya berukuran panjang 8-10 mm yang
ditandai dengan adanya tangkai mata yang jelas terlihat pada kedua sisi bagian
sebelas pasang thorakopoda. Pada Artemia jantan, antena berubah menjadi alat
penjepit (maskular gasper). Sedangkan pada Artemia betina antenna mengalami
penyusutan, sepasang indung telur atau ovarium terhadap di kedua sisi saluran
pencernaan, di belakang thorakopoda. Telur yang sudah matang disalurkan ke
uterus (Mudjiman, 1992). Bentuk dari larva Artemia Salina Leach dapat dilihat
pada gambar 2.2 berikut ini :
Gambar 2.2 Artemia Salina Leach
2.5.1.3. Siklus Hidup
Artemia salina banyak ditemukan di danau-danau yang kadar garamnya sangat
tinggi sehingga disebut brine shrimp. Toleransi terhadap kadar garam sangat
menakjubkan, bahwa pada siklus hidupnya memerlukan kadar garam yang tinggi
agar dapat menghasilkan kista. Kadar garam yang diperlukan agar Artemia salina
tersebut dapat menghasilkan kista bervariasi tergantung strain, pada umumnya
membutuhkan kadar garam di atas 100/ml (Mudjiman, 1992).
Keasaman air (pH) juga mempengaruhi kehidupan Artemia salina. Seperti
halnya hewan-hewan yang hidup di air laut, Artemia salina juga membutuhkan pH
air yang sedikit basa bersifat untuk kehidupannya. Agar Artemia salina dapat
tumbuh dengan baik maka pH air yang digunakan untuk budidaya berkisar antara
7,5-8,5 (Mudjiman, 1992).
Artemia salina bersifat pemakan segala atau omnivora. Artemia salina
mengambil pakan dari media hidupnya terus menerus sambil berenang.
Pengambilan makanan dibantu dengan antena II pada nauplius (Mudjiman, 1992).
Menurut cara reproduksinya, Artemia salina dibagi menjadi dua, yaitu
biseksual berkembangbiak secara seksual, yaitu didahului dengan perkawinan
antara jantan dan betina. Sedangkan Artemia salina partenogonik berkembang
biak secara partenogenesis, yaitu betina menghasilkan telur atau nauplius tanpa
adanya pembuahan (Mudjiman, 1992).
Siklus hidup Artemia salina cukup unik, baik jenis biseksual maupun
partenogenesis. Perkembangannya dapat secara ovovivar maupun ovipar
tergantung kondisi lingkungan terutama salinitas. Pada salinitas tinggi akan
dihasilkan kista yang keluar dari induk betina sehingga disebut dengan
perkembangbiakan secara ovipar. Sedangkan pada salinitas rendah tidak akan
menghasilkan kista akan tetapi langsung menetas dan dikeluarkan sudah dalam
bentuk nauplius sehingga disebut dengan perkembangbiakan secara ovovipar
(Mudjiman, 1992).
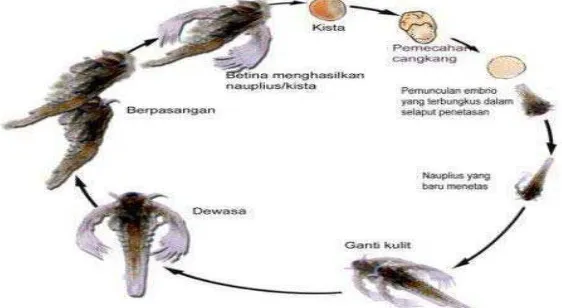
Ada 3 tahapan proses penetesan Artemia ini yaitu tahap hidrasi, tahap
pecah cangkang, dan tahap pengeluaran. Tahap hidrasi terjadi penyerapan air
sehingga kista yang diawetkan dalam bentuk kering tersebut akan menjadi bulat
dan aktif bermetabolisme. Tahap selanjutnya adalah tahap pecah cangkang yang
disusul tahap pengeluaran yang terjadi beberapa saat sebelum nauplius keluar dari
cangkang (Isnansetyo dan Kurniastuty, 1995).
Secara alami makanan Artemia terdiri dari detritus bahan organik (sisa
jasad hidup yang hancur), ganggang, bakteri dan cendawan. Dalam pemeliharaan
makanan yang diberikan adalah katul padi, tepung beras, tepung kedelai atau ragi
(Mudjiman, 1992). Secara keseluruhan siklus hidup larva Artemia Salina Leach
dapat dilihat pada gambar 2.3 berikut ini :
Uji BSLT dengan menggunakan larva udang Artemia salina dilakukan dengan
menetaskan telur – telur tersebut dalam air laut yang dibantu dengan aerasi. Telur
Artemia salina akan menetas sempurna menjadi larva dalam waktu 24 jam. Larva Artemia salina yang baik digunakan untuk uji BSLT adalah yang berumur 48 jam
sebab jika lebih dari 48 jam dikhawatirkan kematian Artemia salina bukAn
disebabkan toksisitas ekstrak melainkan oleh terbatasnya persediaan makanan
(Meyer et al., 1982). Kista ini berbentuk bulatan – bulatan kecil bewarna kelabu
kecoklatan dengan diameter berkisar 200 – 300µm. Kista yang berkualitas baik,
apabila diinkubasi dalam air dengan kadar garam 5 – 70 permil akan menetas
sekitar 18 – 24 jam. Artemia salina yang baru menetas disebut nauplius, bewarna
orange, berbentuk bulat lonjong dengan panjang sekitar 400 mikron, lebar 170
mikron dan berat 0,002mg. Nauplius berangsur – angsur mengalami
perkembangan dengan 15 kali pergantian kulit hingga dewasa. Pada setiap
pergantian kulit disebut instar (Mudjiman,1998).
Keunggulan penggunan larva udang Artemia salina untuk uji BSLTini
adalah sifatnya yang peka terhadap bahan uji, waktu siklus hidup yang lebih
cepat, mudah dibiakkan dan harganya murah. Sifat peka Artemia salina
kemungkinan disebabkan oleh keadaan membran kulitnya yang sangat tipis
sehingga memungkinkan terjadinya difusi zat dari lingkungan yang
mempengaruhi metabolisme dalam tubuhnya. Artemia salina ditemukan hampir
pada seluruh permukaan perairan dibumi yang memiliki kisaran salinitas 10 –
20g/l, hal inilah yang menyebabkannya mudah dibiakkan. Larva yang baru saja
menetas berbentuk bulat lonjong dan berwarna kemerah – merahan dengan
panjang 400 µm dengan berat 15µg. Anggota badannya terdiri dari sepasang
sungut kecil (anteluena atau antenna) dan sepasang sungut besar (anten atau
antenna II). Di bagian depan diantara kedua sungut kecil tersebut terdapat bintik
merah yang berfungsi sebagai mata (oselus). Di belakang sungut besarnya
terdapat sepasang mandibula (rahang) yang kecil, sedangkan dibagian perut
2.5.2 Lethal Consentration -50 ( LC50)
Uji toksisitas merupakan uji hayati yang berguna untuk menentukan tingkat
toksisitas dari suatu zat atau bahan pencemar. Suatu senyawa kimia dikatakan
bersifat racun akut jika senyawa tersebut dapat menimbulkan efek racun dalam
jangka waktu singkat, dalam hal ini 24 jam. Sedangkan jika senyawa tersebut baru
menimbulkan efek dalam jangka waktu yang panjang, disebut racun kronis
(karena kontak yang berulang – ulang walaupun dalam jumlah yang sedikit)
(Harmita, 2009)
LC50 ( Median Lethal Concentration) yaitu konsentrasi yang menyebabkan
kematian sebanyak 50% dari organisme uji yang dapat diestimasi dengan grafik
dan perhitungan pada suatu waktu pengamatan tertentu, untuk beberapa penelitian
LC50 24 jam, LC50 48 jam , LC50 96 jam sampai waktu hidup hewan uji
(Dhahiyat dan Djuangsih, 1997)
Selanjutnya pengujian efek toksik dihitung dengan analisa probit yaitu
menghitung mortalitas dengan cara : akumulasi mati dibagi jumlah akumulasi
hidup dan mati (total) dikali 100%. Grafik dibuat dengan log konsentrasi sebagai
sumbu x terhadap mortalitas sebagai sumbu y. Nilai LC50 merupakan konsentrasi
dimana zat menyebabkan kematian 50% yang diperoleh dengan memakai
persamaan regresi linier y = a + bx. Suatu zat dikatakan aktif atau toksik bilai nilai
LC50 < 1000 µg/ml untuk ekstrak dan < 30 µg/ml untuk suatu senyawa.
Tingkat toksisitas suatu ekstrak dapat diklasifikasikan berdasarkan LC50, yaitu
kategori sangat tinggi / highly toxic bila mampu membunuh 50% larva pada
konsentrasi 1-10 µ g/ml, sedang / medium toxic pada konsentrasi 10 -100 µg/ml,
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Penyakit kanker adalah penyakit yang disebabkan terjadinya berkembangan sel –
sel tubuh yang tidak normal, diluar kewajaran. Penyakit kanker merupakan
penyakit penyebab kematian terbesar kedua setelah kardiovaskular. Selain itu
angka peningkatan penderita yang mengidap penyakit kanker berkembang sangat
pesat, yaitu mencapai angka 347.792 orang pada tahun 2013 dan terus bertambah
setiap tahunnya (Riset kesehatan Dasar, 2013). Belum adanya terapi dan
pengobatan yang dianggap tepat untuk mengatasinya memicu masyarakat pada
umumnya dan peneliti pada khususnya untuk mengeksplorasi bahan – bahan alam
yang dianggap potensial sebagai alternatif agen antikanker. Benalu kopi
(Loranthus Ferrugineus Roxb.) merupakan salah satu dari daftar tanaman yang
telah digunakan masyarakat sebagai tanaman obat yang berpotensi sebagai
antikanker (Santoso,1993).
Benalu merupakan tanaman yang unik, satu sisi benalu merupakan parasit
bagi inang tempat tumbuhnya tetapi benalu dapat dimanfaatkan sebagai tanaman
obat (Soejono,1995). Berdasarkan pengalaman,benalu yang menempel pada
tumbuhan tertentu telah digunakan dalam pengobatan tradisional. Benalu pada
umumnya digunakan sebagai obat campak, sedangkan benalu pada jeruk nipis
dimanfaatkan sebagai ramuan obat untuk penyakit amandel. Benalu teh sendiri
digunakan sebagai obat kanker (Purnomo, 2000).
Kandungan kimia yang terdapat dalam benalu adalah flavonoid, tannin,
asam amino, karbohidrat, alkaloid, dan saponin (Anonim,1996). Berdasarkan
berbagai penelitian, senyawa dalam benalu yang diduga memiliki aktivitas
antikanker adalah flavonoid, yaitu kuersetin yang bersifat inhibitor terhadap
enzim DNA topoisomerase sel kanker (Anonim, 1996).
Penggunaan benalu tanaman sebagai antikanker yang menjanjikan masih
membutuhkan eksplorasi lebih lanjut baik dari sisi budaya maupun formulasi,
untuk meringankan beban penderita kanker dan meningkatkan taraf kesehatan
masyarakat (Ikawati, 2008).
Obat tradisional merupakan obat-obatan yang berasal dari alam dan telah
dikenal oleh masyarakat Indonesia sejak zaman dahulu. Selain digunakan secara
turun menurun dimasyarakat, obat ini lebih murah dan mudah didapat. Namun
diperlukan penelitian lebih lanjut terhadap tanaman yang digunakan sebagai obat
tradisional, karena masih banyak yang belum diketahui bagaimana sifat toksisitas
dari tanaman obat tersebut (Hyeronimus, 2008)
Senyawa toksik adalah suatu senyawa atau zat yang dapat merusak sel
normal dan juga sel kanker, serta digunakan untuk menghambat pertumbuhan sel
tumor maligan (Siregar dan Amalia, 2004). Untuk mengetahui suatu tanaman
memiliki potensi sebagai antitumor dan antikanker perlu dilakukan penelitian
awal, salah satunya melalui uji toksisitas menggunakan metode Brine Shrimp
Lethality Test (BSLT).
Pada penggunaan bahan baku obat baik terbuat secara alami maupun
sintetis, bahan baku tersebut harus dilakukan uji toksisitasnya terlebih dahulu,
sehingga dalam penerapan bisa dinyatakan aman dan diketahui seberapa besar
jumlah senyawa toksik yang terkandung didalam bahan obat tersebut. Uji
toksisitas merupakan salah satu aktivitas biologi terhadap ekstrak atau fraksi
isolate tanaman dengan mengamati respon kematian pada hewan percobaan.
Hewan percobaan untuk uji toksisitas biasanya menggunakan ikan, larva nyamuk
dan larva udang. Kematian dari hewan percobaan dianggap sebagai respon
terhadap pengaruh senyawa tertentu. Berdasarkan studi yang dilakukan oleh
Meyer, senyawa kimia yang mempunyai nilai LC50 kurang dari 1000 ppm
dikatakan memiliki potensi toksik untuk bahan obat antikanker (Dewi, 2011).
Uji toksisitas dengan menggunakan BSLT ini dapat ditentukan dari jumlah
kematian Artemia salina Leach akibat pengaruh ekstrak atau senyawa bahan alam.
Hasil uji dinyatakan sebagai LC50, dinyatakan bersifat toksik/aktif terhadap
Artemia salina Leach bila ekstrak tumbuhan tersebut memiliki LC50< 1000 µg/mL
dan berpotensi sitotoksik serta dapat dikembangkan sebagai antikanker (Meyer,
Jika hasil uji BSLT menunjukkan bahwa ekstrak tumbuhan bersifat toksik
maka dapat dikembangkan ke penelitian lebih lanjut untuk mengisolasi senyawa
sitotoksik tumbuhan sebagai usaha pengembangan obat alternatif antikanker. Jika
hasil uji BSLT menunjukkan bahwa ekstrak tumbuhan tidak bersifat toksik maka
dapat dikembangkan ke penelitian lebih lanjut untuk meneliti khasiat-khasiat lain
dari ekstrak tersebut.
Dari penelitian yang telah dilakukan sebelumnya oleh Ikawati, (2008)
yang berjudul “Pemanfaatan Benalu Sebagai Agen Antikanker”, menyatakan
benalu yang mengandung senyawa flavonoid yaitu kuersetin mempunyai potensi
untuk menjadi agen antikanker salah satu contohnya adalah benalu teh dan
membuka kemungkinan benalu lain yang masih dalam satu famili juga bersifat
sebagai agen antikanker.
Menurut Maukar, (2013) yang berjudul “ Analisis Kandungan Fitokimia
dari Uji Toksisitas Ekstrak Metanol Daun Soyogik (Sauraula bracteosa DC)
Dengan menggunakan metode maserasi”, menghasilkan nilai LC50 yang diperoleh
berdasarkan uji toksisitas menggunakan metode Brine Shrimp Lethality Test
(BSLT) daun soyogik yaitu sebesar 37,30 ppm kandungan fenolik, flavonoid, dan
tannin berturut – turut adalah 43,06 ; 6,52 dan 17,91 ppm. Ini menyatakan bahwa
ekstrak metanol daun soyogik bersifat toksik
Menurut Wongkar, (2015) yang berjudul “Uji Toksisitas Ekstrak Daun
Benalu Langsat (Dendrophthoe petandra (L) Miq) dengan Metode Brine Shrimp
Lethality Test (BSLT) LC50“, menghasilkan nilai LC50 yang diperoleh
berdasarkan uji toksisitas metode BSLT ekstrak daun benalu langsat adalah
sebesar 0,561 ppm ini menyatakan benalu tidak bersifat toksik, dikarenakan tidak
ada terjadi kematian 50% pada masing – masing variasi konsentrasi.
Menurut Indiastuti, (2008) yang berjudul “Skrining Pendahuluan
Toksisitas Beberapa Tumbuhan Benalu terhadap Larva Udang Artemia Salina
Leach”, menghasilkan nilai LC50 dari ekstrak metanol benalu Loranthus
Peretandrus sebesar 29,24 µg/ml dan untuk nilai LC50 ekstrak metanol Viscum
articulatum sebesar 10,83 µg/ml. ini menunjukkan benalu tersebut bersifat toksik
Benalu kopi (Loranthus ferrugineus Roxb.) adalah salah satu contoh dari
beberapa tumbuhan yang dapat ditemukan pada pohon kopi yang berada di Desa
Perbaji, Kecamatan Tigandreket, Kabuaten Kabanjahe, Sumatera Utara yang
digunakan masyarakat setempat sebagai obat untuk mengatasi sakit perut, sakit
pinggang dan dapat mengobati penyakit kanker. Namun sampai saat ini belum ada
penelitian yang menyatakannya secara ilmiah, maka dari itu peneliti tertarik untuk
meneliti ekstrak benalu kopi dengan uji toksisitas menggunakan metode Brine
Shrimp LethalityTest (BSLT) sebagai salah satu penelitian awal untuk mengetahui
aktivitas senyawa toksik dalam tumbuhan tersebut yang dapat bermanfaat untuk
mengobati penyakit kanker.
1.2 Perumusan Masalah
Permasalahan pada penelitian ini adalah :
1. Apa saja golongan senyawa metabolit sekunder yang terdapat didalam
ekstrak metanol daun benalu kopi (Loranthus ferrugineus Roxb.)
berdasarkan uji skrining fitokimia?
2. Bagaimana hasil dari uji toksisitas ekstrak metanol daun benalu kopi
(Loranthus ferrugineus Roxb.) dan berapa nilai LC50 yang dihasilkan?
1.3. Pembatasan masalah
Dalam penelitian ini objek masalah dibatasi oleh:
1. Sampel benalu kopi yang digunakan berasal dari Desa Perbaji, Kecamatn
Tigandreket, kabupaten Kabanjahe, Sumatera Utara.
2. Ekstraksi daun benalu pohon kopi dilakukan dengan metode maserasi
dengan pelarut metanol
3. Skrinning fitokimia pada ekstrak metanol daun benalu kopi meliputi
kandungan senyawa flavonoid, alkaloid, saponin, dan terpenoid.
4. Uji toksisitas dilakukan dengan metode Brine Shrimp Lethality Test
5. Variasi konsentrsi uji toksisitas ekstrak metanol benalu kopi yang
digunakan adalah 20, 40, 60, 80 dan 100 ppm.
6. Volum ekstrak yang digunakan sebesar 100µl yang dipipet menggunakan
mikropipet.
7. Perhitungan nilai LC50 menggunakan analisa Probit.
1.4 Tujuan Penelitian Penelitian ini bertujuan:
1. Untuk mengetahui senyawa metabolit sekunder yang terkandung didalam
ekstrak metanol daun benalu kopi dengan skrinning fitokimia.
2. Untuk menguji daya toksisitas dari ekstrak metanol daun benalu kopi
dengan metode Brine Shrimp Lethality Test (BSLT) terhadap larva udang
Artemia salina Leachdan mengetahui nilai LC50 dengan analisa Probit.
1.5 Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi mengenai
komponen – komponen kimia metabolit sekunder serta memberikan informasi
tentang daya toksisitas dari ekstrak metanol daun benalu kopi, dilihat dari nilai
LC50 sebagai acuan untuk mengetahui apakah ekstrak metanol daun benalu kopi
dapat dijadikan bahan obat herbal yang berpotensi sebagai antikanker.
1.6 Lokasi Penelitian
Penelitian ini dilakukan dibeberapa labotarorium, diantaranya yaitu untuk
pembuatan ekstrak metanol daun benalu kopi dan uji toksisitas dilakukan di
laboratorium Biokimia/KBM FMIPA USU Medan, untuk pengamatan mortalitas
larva udang dilakukan di laboratorium Terpadu USU Medan, dan untuk uji
skrinning fitokimia dilakukan di laboratorium Kimia Organik Bahan Alam
1.7 Metodologi Penelitian
Penelitian ini dilakukan dengan skala laboratorium dan sebagai objek
penelitian adalah daun benalu kopi (Loranthus ferrugineus Roxb.) kering yang
diperoleh dari Desa Perbaji, Kabanjahe. Daun benalu kopi dibersihkan dari
kotoran, dikeringkan dengan cara diangin – anginkan, lalu daun benalu kopi
dihaluskan dan kemudian ditimbang, selanjutnya direndam dengan metanol dan
disaring lalu filtrat yang dihasilkan dari proses perendaman dipekatkan dengan
Rotary Vacum Evavorator, ekstrak metanol diidentifikasi dengan skrinning
fitokimia meliputi senyawa alkaloid, flavonoid, saponin dan terpenoid. Ekstrak
metanol daun benalu kopi diuji toksisitas dengan metode Brine Shrimp Lethality
Test (BSLT) menggunakan larva Artemia Salina Leach dan ditentukan nilai LC50
UJI TOKSISITAS EKSTRAK BENALU KOPI (Loranthus ferrugineus Roxb.) DENGAN METODE Brine Shrimp Lethality Test (BSLT)
ABSTRAK
Uji toksisitas dari ekstrak metanol daun benalu kopi (Loranthus ferrugineus Roxb.) telah dilakukan dengan metode Brine Shrimp Lethality Test (BSLT). Daun benalu kopi yang telah dikeringanginkan dan dihaluskan, diekstraksi dengan menggunakan pelarut metanol selama 2 hari, lalu disaring. Filtrat ekstrak metanol benalu kopi yang diperoleh dipekatkan dengan rotary vacuum evaporator. Ekstrak metanol daun benalu kopi diskrining fitokimia untuk mengidentifikasi senyawa metabolit sekunder. Ekstrak daun benalu kopi dibuat dalam konsentrasi 20; 40; 60; 80; 100 mg/ml, untuk diuji daya toksisitas dengan metode Brine Shrimp Lethality Test (BSLT) menggunakan larva udang sebanyak 10 ekor dengan volume ekstrak yang digunakan sebanyak 100 µl, dan ditentukan nilai LC50 menggunakan analisa
probit. Hasil uji skrining fitokimia ekstrak metanol daun benalu kopi menujukkan adanya golongan flavonoid dan terpenoid. Hasil uji toksisitas ekstrak metanol daun benalu kopi dengan metode Brine Shrimp Lethatility Test (BSLT) menunjukkan bahwa ekstrak metanol daun benalu kopi memiliki potensi sebagai bahan antikanker karena dapat menimbulkan kematian diatas 50% populasi dengan nilai LC50 yang diperoleh sebesar 58,88 ppm.
TOXICITY ASSAY OF EXTRACT PARASITE COFFE (Loranthus
ferrugineus Roxb.) USING Brine Shrimp Lethality Test (BSLT)
ABSTRACT
Toxicity assaythe methanol extract of leaves parasite coffee (Loranthus
ferrugineus Roxb.) Has been performed using Brine Shrimp Lethality Test
(BSLT). Coffee parasite leaves that have been dried and crushed, extracted by using methanol for 2 days, and the methanol extract coffee parasite concentrated by rotary vacuum evaporator. The methanol extract coffee parasiteleavesderived phytochemical screening to identify secondary metabolite coumpounds. Extracts of leaves parasite coffee made in a concentration of 20; 40; 60; 80; 100mg/ml, to test the toxicity of the methods Brine Shrimp Lethality Test (BSLT) using as many as 10 fish shrimp larva extracts used with volume of 100 mL, and the LC50
value is determined using probit analysis. Phytochemical screening test showed appositive results on the class of flavonoid and terpenoid compounds. The toxicity assay methanol extract the parasite coffeeleaves using Brine Shrimp method Lethatility Test (BSLT) showed that the methanol extract coffee parasite leaves has potential as an anticancer substance because it can cause the death of more than 50% of the population with LC50 values obtained at 58.88 ppm.
UJI TOKSISITAS EKSTRAK BENALU KOPI
(Lotanthus ferrugineus Roxb.) DENGAN
METODE Brine Shrimp Lethality
Test (BSLT)
SKRIPSI
SONYA CITRA BRATISCA
120802009
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
METODE Brine Shrimp Lethality
Test (BSLT)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar sarjana sains
SONYA CITRA BRATISCA
120802009
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : Uji Toksisitas Ekstrak Benalu Kopi (Loranthus
ferrugineus Roxb.) dengan Metode Brine
Shrimp Lethality Test (BSLT)
Kategori : Skripsi
Nama : Sonya Citra Bratisca
NomorIndukMahasiswa : 120802009
Program Studi : Sarjana (S1) Kimia
Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara
Disetujui di
Medan, Juni 2016
KomisiPembimbing :
Pembimbing 2, Pembimbing 1,
Dr.Firman Sebayang, MS Dr.RumondangBulan, MS
NIP. 195607261985031001 NIP.195408301985032001
Diketahui/Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
UJI TOKSISITAS EKSTRAK BENALU KOPI (Loranthus ferrugineus
Roxb.) DENGAN METODE Brine Shrimp Lethality Test (BSLT)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing – masing disebutkan sumbernya.
Medan, Juni 2016