INDUKSI MUTAGEN FISIK PADA ANYELIR
(Dianthus caryophyllus Linn.) DAN PENGUJIAN STABILITAS MUTANNYA YANG DIPERBANYAK SECARA VEGETATIF
SYARIFAH IIS AISYAH
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa semua pernyataan dalam disertasi saya yang berjudul Induksi Mutagen Fisik pada Anyelir (Dianthus caryophyllus Linn.) dan Pengujian Stabilitas Mutannya yang Diperbanyak Secara Vegetatif merupakan gagasan dan hasil penelitian disertasi saya sendiri, dengan bimbingan Komisi Pembimbing; kecuali yang jelas dinyatakan rujukannya. Disertasi ini belum pernah diajukan untuk memperoleh gelar pada program sejenis di perguruan tinggi yang lain. Semua data dan informasi yang digunakan telah dinyatakan secara jelas dan diperiksa kebenarannya.
Bogor, Februari 2006
SYARIFAH IIS AISYAH. Induksi Mutagen Fisik pada Anyelir (Dianthus caryophyllus Linn.) dan Pengujian Stabilitas Mutannya yang Diperbanyak Secara Vegetatif. Dibimbing oleh SARSIDI SASTROSUMARJO, HAJRIAL ASWIDINNOOR, BUDI MARWOTO dan ASEP SAEFUDDIN.
Kurangnya varietas unggul lokal tanaman hias, termasuk anyelir menyebabkan tingginya tingkat ketergantungan Indonesia terhadap benih impor. Untuk itu perlu segera dilakukan kegiatan pemuliaan tanaman guna memperluas keragaman genetik anyelir, antara lain dengan perlakuan mutasi induksi. Pengetahuan tentang mutasi induksi fisik pada anyelir akan sangat membantu para pemulia mutasi anyelir dalam melakukan iradiasi sinar gamma pada anyelir. Hasil penelitian ini juga akan menambah sumber plasma nutfah anyelir bagi keperluan program pemuliaan tanaman selanjutnya.
Penelitian ini dilaksanakan untuk mengevaluasi pengaruh iradiasi sinar gamma terhadap pembentukan anyelir mutan yang diinginkan dan menguji stabilitas mutan yang diperbanyak secara vegetatif. Iradiasi sinar gamma diberikan terhadap lima genotipe anyelir (genotipe 10.8, 11.10, 24.1, 24.14 dan 24.15), baik melalui teknik iradiasi tunggal maupun berulang, dan diberikan pada planlet dan stek pucuk sebagai jenis bahan tanamannya. Tujuan penelitian ini adalah (1) mengamati radiosensitivitas dan menentukan LD50 berbagai genotipe klon anyelir terhadap iradiasi sinar gamma, (2)
mendapatkan mutan solid anyelir yang potensial untuk dikembangkan, (3) menguji tingkat kestabilan mutan solid anyelir yang terbentuk akibat iradiasi sinar gamma baik melalui stek pucuk maupun melalui planlet, (4) mempelajari pola perubahan warna bunga dari berbagai warna bunga asal serta (5) mengidentifikasi keragaman genetik pada mutan terseleksi, baik secara sitologi maupun molekuler.
Hasil penelitian menunjukkan bahwa iradiasi sinar gamma pada anyelir dapat menciptakan kisaran warna dan bentuk bunga yang baru tanpa mengubah karakter vegetatif penting lainnya. LD50 sinar gamma pada anyelir didapatkan sekitar 27-60 Gy
untuk planlet dan sekitar 49-72 Gy untuk stek pucuk. Pada planlet, genotipe 24.1 paling tahan terhadap sinar gamma, sedangkan genotipe 10.8 merupakan genotipe yang paling sensitif terhadap sinar gamma. Pada stek pucuk, genotipe 10.8 paling tahan dan genotipe 24.15 merupakan genotipe yang paling sensitif terhadap sinar gamma.
Bahan tanaman berupa planlet lebih mudah bermutasi dibandingkan stek pucuk, teknik iradiasi tunggal masih lebih baik dari teknik berulang. Genotipe 24.1 adalah genotipe yang terbanyak membentuk mutan, sedangkan generasi MV2 adalah generasi yang paling banyak mengekspresikan karakter mutan.
Mutasi induksi fisik dengan iradiasi sinar gamma pada penelitian ini telah mampu menciptakan 106 mutan dari lima genotipe anyelir (19 mutan dari stek pucuk dan 87 mutan dari planlet) selama lima generasi. Berdasarkan karakter kualitatif bunga, penelitian ini berhasil membentuk mutan yang stabil sampai generasi kelima. Pada planlet, mutan mencapai kestabilannya pada generasi kedua (MV2) sedangkan pada stek pucuk, mutan mencapai kestabilannya pada generasi ketiga (MV3).
Dari hasil penelitian ini terbukti bahwa perubahan morfologi yang terjadi pada mutan- mutan anyelir ini disebabkan oleh perubahan genetik, yang dapat diidentifikasi keragaman genetiknya melalui uji sitologi, yaitu dengan adanya perubahan bentuk,
kromosom (13 II + 2 I), mutan 24.1 yang diradiasi 15 Gy menjadi trisomik ganda (2n=2x+1+1=32) atau pasangan kromosom (15 II + 2 II) dan mutan 24.14 yang diradiasi 40 Gy menjadi trisomik (2n=2x+1=31) atau pasangan kromosom (15 II + 1 I).
Beragam variasi perubahan bentuk terjadi pada mutan- mutan anyelir, menghasilkan bentuk kromosom akrosentrik (=subtelosentrik) pada mutan 24.1 akibat iradiasi 15, 50, dan 60 Gy, serta pada mutan 11.10 hal tersebut terjadi akibat iradiasi 30 Gy. Beberapa kromosom mengalami pemendekan karena patahan kromosom akibat iradiasi.
Demikian pula pada tingkat protein, pita polimorfisme antar anyelir normal dan mutan ditunjukkan oleh enzim PER, EST dan ACP. Analisis protein dengan teknik isozim ini menunjukkan adanya perubahan pola enzimatik yang terjadi pada mutan-mutan anyelir akibat iradiasi sinar gamma.
Penelitian ini telah berhasil menggambarkan suatu pola perubahan warna bunga pada mutan anyelir yang berubah akibat iradiasi sinar gamma. Dalam pola tersebut ditunjukkan bahwa warna merah (dengan intensitas warna yang beragam, termasuk merah tembaga) dan pink menyediakan sumber warna yang paling beragam.
Dendogram yang dihasilkan dari penelitian ini menunjukkan bahwa perubahan mutan terkecil dibandingkan tanaman normalnya, adalah mutan pada genotipe 10.8 (tingkat kemiripan 92%) sedangkan mutan dengan perubahan terbesar dibandingkan tanaman normalnya adalah mutan dari genotipe 24.15 (tingkat kemiripan 82%).
Nilai heritabilitas dari karakter-karakter yang diamati pada penelitian ini (kecuali karakter tingi tanaman dari stek pucuk pada MV1 dan MV2) seluruhnya menunjukkan nilai heritabilitas yang tinggi (h2 > 50%). Dengan demikian dapat dinyatakan bahwa faktor genetik lebih besar pengaruhnya dalam penampilan fenotipe karakter-karakter yang diamati tersebut, dibandingkan faktor lingkungan.
Terdapat enam mutan yang cukup prospektif untuk dijadikan sebagai bahan varietas baru yang akan dilepas, yaitu mutan hasil iradiasi tunggal genotipe 24.1 (20 Gy pada MV1-1) dan genotipe 24.15 (20 Gy pada MV4-2); hasil iradiasi berulang genotipe 24.1 (20 Gy pada MV2.2-2), genotipe 24.1 (40 Gy pada MV2.2-1), dan genotipe 24.15 (40 Gy pada MV5.2-9) serta mutan dari stek genotipe 24.1 (45 Gy pada MV3-1). Bunga anyelir pada genotipe-genotipe ini memiliki warna dan corak petal yang menarik dan unik.
SYARIFAH IIS AISYAH. Physically Induced Mutation of Carnation (Dianthus caryophyllus Linn.) and The Stability Test of Vegetatively Propagated Mutants.
Supervised by SARSIDI SASTROSUMARJO, HAJRIAL ASWIDINNOOR, BUDI MARWOTO, and ASEP SAEFUDDIN.
Lack of novel variety of carnation increases the demand of imported seeds. Therefore, breeding program to broaden the genetic variability of carnation is vey important, such as through induced mutation treatment. Knowledge on physically induced mutation breeding on carnation will help mutation breeders of ornamental plant to determine the range’s dose of gamma rays, and to know the pattern of flower colour change of carnation. In additon, the results of this research enrichs the germplasm of carnation and complete it’s collection for further breeding activities.
Attempts to create novel variety on carnation through gamma irradiation were conducted in this research. The gamma irradiation was given to 5 carnation genotypes (genotype number 10.8, 11.10, 24.1, 24.14 and 24.15), either by acute or intermittent irradiation techniques and were irradiated to plantlets and cuttings as plant materials. The observation was conduc ted to five generations of vegetatively propagated carnation, from MV1 to MV5. The objectives of this study were (1) to observe the radiosensitivity of five carnation genotypes to gamma irradiation and determine the LD50 of five carnation
numbers, (2) to obtain solid mutant on carnation, which is potential to be released, (3) to evaluate the stability of each mutant obtained from this research, (4) to study the pattern of color changes of carnation’s petal and (5) to identify the change of mutations genetically, through chromosome test and isozyme technique.
The results of this research shows that gamma irradiation on carnation is able to create new carnation’s color and petal’s shape without any significant changes on their important vegetative characters. LD50 of carnation were obtained around 27-60 Gy for
plantlets and around 49-72 Gy for cuttings. For plantlets, carnation genotype number 24.1 was the most insensitive to gamma rays, whereas number 10.8 was the most sensitive; For cuttings, number 10.8 was the most insensitive number while number 24.15 was the most sensitive.
As plant material, gamma irradiation on plantlets resulted in more variability of mutants than on cuttings, acute irradiation was better tha n intermittent irradiation, genotype number 24.1 was the easiest to be changed by gamma rays induced mutation, while generation MV2 was the best generation expressing mutant’s characters.
become trisomic (2n=2x+1=31), with chromosome pairs : (15 II + 1 I).
Many variabilities of chromosome shape were created on mutants, i.e the acrocentric (=subtelocentric) chromosome on mutant 24.1 caused by 15, 50 and 60 Gy, and mutant 11.10 caused by 30 Gy of gamma rays. Some of them had deletion on part of their chromosomes.
On protein level, polymophism bands recognized by enzyme PER, EST and ACP. Protein analysis through isozyme technique showed that gamma irradiation caused the change on enzymatic pattern on the mutants.
The research has been succesfully created the pattern of flower colour change on mutated carnation by gamma irradiation. For the pattern of color change of carnation’s petal, red (including many intensity of red color) and pink were the rich source of color that provide more color on the mutants.
Dendogram which was evolved from this research showed that the smallest character’s change of mutants is from genotype 10.8 (rate of similarity 92%) whereas the biggest one is from genotype 24.15 (rate of similarity 82%).
The value s of heritability of almost all characters observed (except for plant height from cutting in generation MV1 and MV2) are high (h2 > 50%). Therefore, the genetical factor gave higher impact on the phenotipically performance of all mutants, rather than environmental factors.
There were 6 mutants which were quite prospective as the source of novel variety to be released, namely mutant number (1) 24.1 acute irradiated by 20 Gy in MV1-1, (2) 24.15, acute irradiated by 20 Gy in MV4-2 (3) 24.1, intermittent irradiated by 20 Gy in MV2.2-2 (4) 24.1, intermittent irradiated by 40 Gy in MV2.2-1 (5) 24.15, intermittent irradiated by 40 Gy in MV5.2-9 and (6) 24.1, irradiated by 45 Gy from cutting in MV3-1. The petal color of the genotype is unique and attractive.
MUTANNYA YANG DIPERBANYAK SECARA VEGETATIF
SYARIFAH IIS AISYAH
DISERTASI
sebagai salah satu syarat untuk memperoleh gelar DOKTOR pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCA SARJANA INSTITUT PERTANIAN BOGOR
Diperbanyak Secara Vegetatif
Nama : Syarifah Iis Aisyah
NIM : A 99 5036
Disetujui,
Komisi Pembimbing
Prof. Dr. Sarsidi Sastrosumarjo Dr. Ir. Hajrial Aswidinnoor, MSc.
Ketua Anggota
Dr. Ir. Asep Saefuddin, MSc Dr. Ir. Budi Marwoto, MS
Anggota Anggota
Diketahui,
Ketua Program Studi Agronomi Dekan Sekolah Pasca Sarjana
Dr. Ir. Satriyas Ilyas, MS Prof. Dr. Syafrida Manuwoto, MSc
Syukur Alhamdulillah penulis panjatkan ke Hadirat Allah SWT yang telah melimpahkan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ya ng menjadi tugas Studi Doktor pada Program Studi Agronomi dan Hortikultura, Institut Pertanian Bogor.
Ucapan terimakasih yang sebesar-besarnya penulis sampaikan kepada Prof. Dr. Sarsidi Sastrosumarjo, Dr. Hajrial Aswidinnoor. MSc, Dr. Ir. Asep Saefuddin, MSc dan Dr. Ir. Budi Marwoto yang telah memberi saran, baik selama persiapan dan pelaksanaan penelitian maupun pada penulisan hasilnya. Khususnya kepada Dr. Ir. Budi Marwoto, penulis menyampaikan rasa terimakasih yang mendalam atas ide penelitian, penyediaan plasma nutfah anyelir dan pembiayaan penelitian dari projek kerjasama Balai Penelitian Tanaman Hias Segunung dengan IAEA (International Atomic Energy Agency). Kepada Instalasi Penelitian Tanaman Hias Cipanas, Pusat Aplikasi Teknologi Isotop dan Radiasi, Badan Tenaga Atom Nasional (PATIR BATAN), Laboratorium Pusat Antar Universitas Ilmu Hayati IPB, Pusat Studi Pemuliaan Tanaman IPB, dan Herbarium Bogoriense yang telah memberi fasilitas penggunaan alat, laboratorium dan rumah sere untuk penelitian ini juga disampaikan terimakasih.
Ucapan terimakasih juga disampaikan kepada IPB yang telah memberi kesempatan kepada penulis untuk melanjutkan studi S3 di Sekolah Pasca Sarjana IPB, dan kepada DIKTI yang telah memberi dukungan dana melalui program Beasiswa Program Pasca Sarjana (BPPS), dan dukungan dana penelitian melalui program Due Like
tahun anggaran 2005.
Sebagian dari isi disertasi ini telah diseminarkan pada International Symposium cum Workshop of South East Asia–Germany (SEAG) Alumni Network pada tanggal 24-28 Agustus 2005 di Yogyakarta, dengan judul: Chromosome study on Some Mutants of Carnations (Dianthus caryophyllus Linn.) dan artikel tersebut sedang dalam proses publikasi pada Journal of Agriculture and Rural Development In the Tropics and Subtropics (JARTS), Universitaet Kassel, Germany.
dan mas Bambang di PSPT serta pak Ujang Hafidz di Herbarium Bogoriense. Kepada mahasiwa bimbingan sekaligus asisten Rani, Diah, Bayu dan Tia, terimakasih atas kerjasama yang baik. Kepada rekan seperjuangan pak Sukur, mbak Yusnita, pak Dwi, Pak Boer, Willy, bu Minangsari, pak Samadi, pak Ikhsan dan mbak Krisantini yang telah banyak memberi masukan dan mengirimkan journal internasional, penulis ucapkan terimakasih yang setulus-tulusnya.
Ucapan terimakasih yang mendalam penulis sampaikan pada mamah, ibunda tercinta yang tak pernah henti mendoakan ananda dalam sholat malamnya, juga pada emak dan bapak mertua. Kepada Cahya, Yani, Engkus, mang Usman dan adikku Lia, ucapan terimakasih disampaikan atas bantuannya untuk menjaga anak-anak. Khusus kepada suami tercinta, Ir. Dany Cahya Rukmana, MBA, pengorbanan ya ng begitu besar, dorongan semangat, motivasi, doa, perhatian dan kasih sayang akanglah yang dapat membuat disertasi ini terwujud. Tiada kata yang tepat untuk mengungkapkan rasa terimakasih kepada akang, semoga Allah SWT membalas semua kebaikan akang selama ini.
Akhirnya, penulis berharap karya ilmiah ini dapat melengkapi informasi ilmiah yang sudah ada, dan dapat digunakan untuk kemajuan ilmu dan teknologi pertanian, khususnya di bidang pemuliaan mutasi tanaman hias.
Bogor, Februari 2006
Syarifah Iis Aisyah
Penulis dilahirkan di Pandeglang, Propinsi Banten, pada tanggal 18 Maret 1967 sebagai anak ketujuh dari tujuh orang bersaudara, dari ibunda Hj. Titi Sultinah dan Bapak H. Ayip Rughby (Almarhum). Pendidikan dasar diselesaikan di SDL Pengadilan 1 Bogor pada tahun 1979, SMPN 4 Bogor pada tahun 1982 dan SMAN 2 Bogor pada tahun 1985. Pendidikan sarjana ditempuh pada Fakultas Pertanian Institut Pertanian Bogor, lulus pada tahun 1990. Pada tahun 1991 penulis mendapatkan kesempatan stud i S2 di Georg-August Universitaet, Goettingen, Jerman atas beasiswa dari DAAD (Deutscher Akademischer Austauschd ienst) dan lulus pada tahun 1993. Pada tahun 1995-1997 penulis mendapatkan kesempatan mengikuti beberapa mata kuliah (non degree) di Sydney University, Australia. Pada tahun 1999 penulis mendapatkan beasiswa BPPS untuk menyelesaikan program S3 di Sekolah Pasca Sarjana IPB, pada Program Studi Agronomi.
Pada tahun 1990-1991 penulis bekerja sebagai assistant breeder di PT Benih Prima, Bogor. Penulis bekerja sebagai staff pengajar di Institut Pertanian Bogor (IPB) pada Departemen Agronomi dan Hortikultura, Fakultas Pertanian, sejak tahun 1991 sampai sekarang.
Pada tahun 1994 penulis menikah dengan Ir. Dany Cahya Rukmana, MBA dan dikaruniai tiga orang putera, yaitu Mohammad Rizal Khalilurrahman (9 th), Mohammad Iqbal Abdurrahman (7 th) dan Mohammad Ikhsan Fathurrahman (2 th).
DAFTAR TABEL ……….. xiv
DAFTAR GAMBAR ……….. xvii
DAFTAR LAMPIRAN ... xxi
I. PENDAHULUAN ... 1
Latar Belakang ... 1
Identifikasi dan Perumusan Masalah ……..………. 5
Tujuan Penelitian ... 6
Manfaat Penelitian ... 6
Kerangka Pemikiran ……… 7
Hipotesis ... 8
Alur Penelitian ……… 8
II. TINJAUAN PUSTAKA ... 11
Botani Tanaman Anyelir ………. 11
Budidaya Tana man Anyelir ………. 12
Genetika Tanaman nyelir ……… 13
Pemuliaan Mutasi ……… 14
Radiosensitivitas ………. 15
Teknik Iradiasi ……… 16
Uji Stabilitas ……… 18
Kimera ………..………. 19
Uji Kromosom ………. 20
Analisis Isozim ……… 22
Heritabilitas ………. 23
Pemuliaan Tanaman Hias dengan Mutasi Induksi ………. 23
Pemuliaan Tanaman Anyelir ……….. 24
Peranan Kultivar Hasil Mutasi Induksi Secara Ekonomi ………….. 25
III.INDUKSI MUTASI DENGAN SINAR GAMMA MELALUI IRADIASI TUNGGAL DAN IRADIASI BERULANG PADA PLANLET ANYELIR (Dianthus caryophyllus) SERTA UJI STABILITAS MUTANNYA SAMPAI GENERASI MV5 ………..… 27
Pendahuluan ... 27
Bahan dan Metode ... 28
Hasil dan Pembahasan ... 35
Halaman
IV. INDUKSI MUTASI DENGAN SINAR GAMMA MELALUI IRADIASI TUNGGAL PADA STEK PUCUK ANYELIR (Dianthus caryophyllus)
DAN UJI STABILITAS MUTANNYA SAMPAI GENERASI MV3 ..… 69
Pendahuluan ... 69
Bahan dan Metode ... 70
Hasil dan Pembahasan ... 75
Kesimpulan dan Saran ... 94
V. IDENTIFIKASI KROMOSOM PADA ANYELIR (Dianthus caryophyllus) MUTAN AKIBAT IRADIASI SINAR GAMMA…….……… 95
Pendahuluan ... 95
Bahan dan Metode ... 97
Hasil dan Pembahasan ... 102
Kesimpulan dan Saran ... 124
VI. ANALISIS ISOZIM TERHADAP VARIASI ANYELIR (Dianthus caryophyllus) MUTAN AKIBAT IRADIASI SINAR GAMMA………. 125
Pendahuluan ... 125
Bahan dan Metode ... 127
Hasil dan Pembahasan ... 130
Kesimpulan dan Saran... 143
VII. PEMBAHASAN UMUM ……… 144
VIII. KESIMPULAN UMUM DAN SARAN ………. 162
IX. DAFTAR PUSTAKA ……….. 164
X. LAMPIRAN ……… 174
No Teks Halaman
1. LD50 pada Planlet Beberapa Genotipe Anyelir (Dianthus
caryophyllus Linn.) Akibat Iradiasi Sinar Gamma ... 36
2. Pengaruh Beberapa Genotipe Anyelir (Dianthus caryophyllus Linn.)
Terhadap Jumlah Tunas Planlet Generasi MV1 ……… 43
3. Pengaruh Iradiasi Tunggal Sinar Gamma Terhadap Jumlah Tunas Planlet Beberapa Genotipe Anyelir (Dianthus caryophyllus) Generasi MV1…. 43
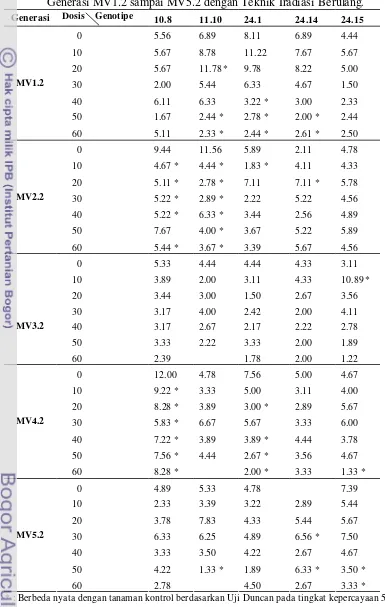
4. Pengaruh Interaksi Dosis Iradiasi Sinar Gamma (Gy) dan Genotipe Anyelir (Dianthus caryophyllus Linn.) Terhadap Karakter Jumlah Tunas Planlet pada Generasi MV2 sampai MV5 dengan Teknik Iradiasi Tunggal …… 44
5. Pengaruh Interaksi Dosis Iradiasi Sinar Gamma (Gy) dan Genotipe Anyelir (Dianthus caryophyllus Linn.) Terhadap Karakter Jumlah Tunas Planlet pada Generasi MV1.2 sampai MV5.2 dengan Teknik Iradiasi Berulang.. 46
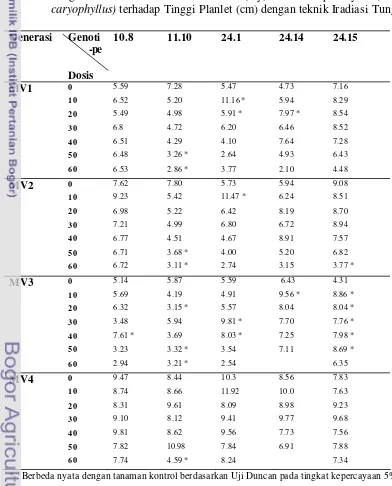
6. Pengaruh Interaksi Dosis Sinar Gamma (Gy) dan Genotipe Anyelir (Dianthus caryophyllus) terhadap Tinggi Planlet (cm) dengan teknik
Iradiasi Tunggal ………. 47
7. Pengaruh Iradiasi Tunggal Sinar Gamma Terhadap Karakter Tinggi Planlet (cm) Beberapa Genotipe Anyelir (Dianthus caryophyllus Linn.) Generasi MV5 ……… 48
8. Pengaruh Beberapa Genotipe Anyelir (Dianthus caryophyllus Linn.)
Terhadap Karakter Tinggi Planlet (cm) Generasi MV5 ... 49
9. Pengaruh Interaksi Antara Dosis Sinar Gamma (Gy) dan Klon Anyelir (Dianthus caryophyllus Linn) terhadap Tinggi Planlet (cm) pada Generasi MV1.2- MV5.2 dengan Teknik Iradiasi Berulang …... 50
10. Pengaruh Iradiasi Sinar Gamma Secara Berulang Terhadap Karakter Tinggi Planlet (cm) Anyelir (Dianthus caryophyllus Linn.) Generasi
MV4.2 ……… 51
11. Pengaruh Beberapa Genotipe Anyelir (Dianthus caryophyllus Linn.) Terhadap Karakter Tinggi Planlet Anyelir (cm) yang diradiasi Secara
Berulang pada Generasi MV4.2 ……… 51
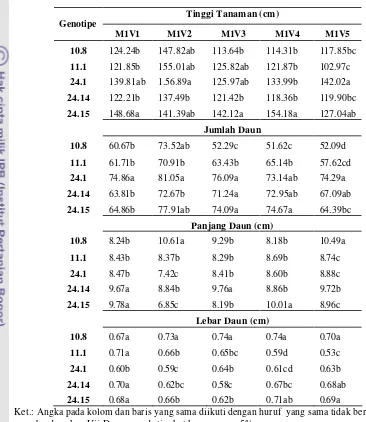
12 Hasil Anova Beberapa Karakter Vegetatif Anyelir Perlakuan Iradiasi
13. Pengaruh Klon Anyelir (Dianthus caryophyllus Linn) Hasil Iradiasi
Tunggal Pada Planlet terhadap Beberapa Karakter Tanaman di
Lapangan ... 53
14. Hasil Anova Beberapa Karakter Vegetatif Anyelir Perlakuan Iradiasi
Berulang ... 55
15. Pengaruh Klon Anyelir (Dianthus caryophyllus Linn) Hasil Teknik IradiasiBerulang pada Planlet terhadap Beberapa Karakter Tana man
di Lapangan ... 56
16. Genotipe Mutan yang Mengalami Mutasi Balik dan Mutasi Maju ... 64 17. Stabilitas Beberapa Karakter Mutan Akibat Iradiasi Tunggal Sinar
Gamma Pada Planlet Anye lir Berdasarkan Besaran Ragam Fenotip ... 65
18. Stabilitas Beberapa Karakter Mutan Akibat Iradiasi Berulang Sinar
Gamma Pada Planlet Anyelir Berdasarkan Besaran Ragam Fenotip ... 67
19. LD50 pada Stek Pucuk Beberapa Genotipe Anyelir (Dianthus
caryophyllus Linn.) Akibat Iradiasi Sinar Gamma ………. 76
20. Hasil Anova Beberapa Karakter Vegetatif Anyelir Akibat Iradiasi
Sinar Gamma ……….. 81
21. Pengaruh Genotipe Anyelir terhadap Jumlah Tunas pada tanaman di
Lapangan Hasil Iradiasi Sinar Gammapada Stek Pucuk ……… 81
22. Pengaruh Genotipe Anyelir terhadap Tinggi Tanaman (cm) Akibat Iradiasi Sinar Gammapada Stek Pucuk Anyelir (Dianthus caryophyllus Linn)… 82
23. Pengaruh Iradiasi Sinar Gamma (Gy) Terhadap Tinggi Tanaman (cm) pada Stek Pucuk Anyelir (Dianthus caryophyllus Linn) ………. 82
24. Pengaruh Interaksi Dosis Sinar Gamma dan Genotipe Anyelir (Dianthus caryophyllus) terhadap Panjang Daun (cm) ………. 83
25. Pengaruh Interaksi Dosis Sinar Gamma dan Genotipe Anyelir (Dianthus caryophyllus) terhadap Lebar Daun (cm) ………. 84
26. Bunga Mutan Hasil Iradiasi TunggalSinar Gamma pada Stek Pucuk
Anyelir (Dianthus carryophyllus Linn) Genotipe 10.8 ……… 88
27. Bunga Mutan Hasil Iradiasi TunggalSinar Gamma pada Stek Pucuk
Anyelir (Dianthus carryophyllus Linn) genotipe 11.10 ……….. 89
28. Bunga Mutan Hasil Iradiasi TunggalSinar Gamma pada Stek Pucuk
Anyelir (Dianthus carryophyllus Linn) genotipe 24.1………. 90
29. Bunga Mutan Hasil Iradiasi TunggalSinar Gamma pada Stek Pucuk
Anyelir (Dianthus carryophyllus Linn) genotipe 24.14 ………. 91
30. Stabilitas Beberapa Karakter Mutan Akibat Iradiasi Sinar Gamma
Terhadap Stek Pucuk Anyelir Berdasarkan Besaran Ragam Fenotip….. 93
31. Bentuk Kromosom Berdasarkan Rasio Lengan Kromosom ... 100
32. Jumlah Kromosom Beberapa Mutan Anyelir Akibat Iradiasi Sinar
Gamma ... 104
33. Kisaran Ukuran Kromosom Beberapa Genotipe Anyelir Normal dan
Mutan Akibat Iradiasi Sinar Gamma ... 106
34. Rumus Kariotipe Beberapa Genotipe Anyelir Normal dan Kromosom
Mutannya Akibat Iradiasi Sinar Gamma ... 108
35. Jumlah Mutan yang Dihasilkan Genotipe- genotipe Planlet Anyelir pada Setiap Perlakuan Dosis Sinar Gamma, dengan Iradiasi Tunggal ……… 147
36. Jumlah Mutan yang Dihasilkan Genotipe- genotipe Stek Pucuk Anyelir
pada Setiap Perlakuan Dosis Iradiasi Sinar Gamma ……… 147
37. Pengaruh Generasi terhadap Pembentukan Anyelir Mutan ………. 149
38. Pengaruh Genotipe Anyelir Terhadap Pembentukan Bunga Mutan
pada Planlet dan Stek Pucuk dengan Iradiasi Tunggal dan Berulang... 150
39. Nilai Heritabilitas Masing- masing Karakter pada Mutan Anyelir ... 156
40. Persentase Bunga Mutan yang Dihasilkan dari Berbagai Perlakuan
Iradiasi ... 161
No Teks Halaman
1. Skema Alur Penelitian ... 9
2. Struktur Jaringan Mersitem Apikal dan Perkembangan Tiga Jenis
Kimera ... 17
3. Bentuk Tepi Petal Anyelir menurut standard UPOV ... 34
4. Gejala Kematian Planlet Akibat Iradiasi Sinar Gamma ... 35
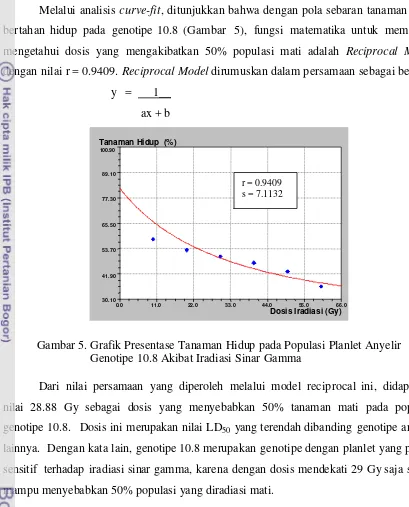
5. Grafik Presentase Tanaman Hidup pada Populasi Planlet Anyelir
Genotipe 10.8 Akibat Iradiasi Sinar Gamma ... 38
6. Grafik Presentase Tanaman Hidup pada Populasi Planlet Anyelir
Genotipe 11.10 Akibat Iradiasi Sinar Gamma ……… 39
7. Grafik Presentase Tanaman Hidup pada Populasi Planlet Anyelir
Genotipe 24.1 Akibat Iradiasi Sinar Gamma ……….. 40
8. Grafik Presentase Tanaman Hidup pada Populasi Planlet Anyelir
Genotipe 24.14 Akibat Iradiasi Sinar Gamma ……… 41
9. Grafik Presentase Tanaman Hidup pada Populasi Planlet Anyelir
Genotipe 24.15 Akibat Iradiasi Sinar Gamma ……… 42
10. Tanaman Anyelir Normal (kiri) dan Anyelir Mutan Kerdil (kanan) Akibat Iradiasi Sinar Gamma 30 Gy, pada MV2, 10 Minggu
Setelah Aklimatitasi ………. 54
11. Bunga Anyelir Genotipe 10.8 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Tunggal ………. 57
12. Bunga Anyelir Genotipe 11.10 Kontrol dan Mutan Hasil Iradiasi Sinar Gamma dengan Iradiasi Tungga l, dan Mutasi Spontan (0 Gy) ……. 57
13. Bunga Anyelir Genotipe 24.1 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Tunggal ………. 58
14. Bunga Anyelir Genotipe 24.14 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Tunggal ……….… 59
15. Bunga Anyelir Genotipe 24.15 Kontrol dan Mutan Hasil Iradiasi Sinar
16. Bunga Anyelir Genotipe 11.10 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Berulang ……….. 61
17. Bunga Anyelir Genotipe 24.1 Kont rol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Berulang ……….. 61
18. Bunga Anyelir Genotipe 24.14 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Berulang ……….. 62
19. Bunga Anyelir Genotipe 24.15 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma dengan Iradiasi Berulang ……….. 62
20. Grafik Persentase Tanaman Hidup pada Populasi Stek Pucuk Anyelir
Genotipe 10.8 Akibat Iradiasi Sinar Gamma ………. 77
21. Grafik Persentase Tanaman Hidup pada Populasi Stek Pucuk
Anyelir Genotipe 11.10 Akibat Iradiasi Sinar Gamma………. 77
22. Grafik Persentase Tanaman Hidup pada Populasi Stek Pucuk
Anyelir Genotipe 24.1 Akibat Iradiasi Sinar Gamma ……… 78
23. Grafik Persentase Tanaman Hidup pada Populasi Stek Pucuk
Anyelir Genotipe 24.14 Akibat Iradiasi Sinar Gamma ……….. 79
24. Grafik Persentase Tanaman Hidup pada Populasi Stek Pucuk
Anyelir Genotipe 24.15 Akibat Iradiasi Sinar Gamma……….. 80
25. Mutan Kerdil pada Anyelir Mutan Genotipe 24.14, Iradiasi 15 Gy
Sinar Gamma, pada Generasi MV2 (2 Tanaman) …………..………… 85
26. Mutan Pucuk Albino, Anyelir Genotipe 24.14, Iradiasi 30 Gy Sinar
Gamma, Generasi MV3 (1 Tanaman) ………..….. 85
27. Mutan Roset, Anyelir Genotipe 11.10, Iradiasi 60 Gy Sinar Gamma
Pada Generasi MV3 (1 tanaman) ………... 86
28. Mutan Daun “Berduri”, Anyelir Genotipe 11.10, Tanaman Kontrol,
Generasi MV3 (3 Tanaman) ……….. 87
29. Bunga Anyelir Genotipe 10.8 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma pada Stek Pucuk ……….. 88
30. Bunga Anyelir Genotipe 11.10 Kontrol dan Mutan Hasil Iradiasi Sinar
Gamma pada Stek Pucuk ………. 89
31. Bunga Anyelir Genotipe 24.1 Kontrol dan Mutan Hasil Iradiasi Sinar Gamma pada Stek Pucuk ……….. 90
32. Bunga Anyelir Genotipe 24.14 Kontrol dan Mutan Hasil Iradiasi Sinar Gamma pada Stek Pucuk ……….. 91
33. Kromosom Anyelir 10.8 Normal ...……… 102
34. Kromosom Anyelir 11.10 Normal ...……….. 102
35. Kromo som Anyelir 24.1 Normal ……….…. 102
36. Kromosom Anyelir 24.14 Normal ………....……… 102
37. Kromo som Anyelir 24.15 Normal ……… 102
38. Kariotipe Kromosom Anyelir Genotipe 10.8 Normal dan Mutannya ... 109
39. Kromosom Anyelir Mutan Genotipe 10.8 ... 110
40. Kariotipe Kromosom Anyelir Genotipe 11.10 Normal dan Mutannya ... 111
41. Kromosom Anyelir Mutan Genotipe 11.10 ... 112
42. Kariotipe Kromosom Anyelir Genotipe 24.1 Normal dan Mutannya ... 112
43. Kariotipe Kromosom Anyelir Genotipe 24.14 Normal dan Mutannya... 113
44. Kariotipe Kromosom Anyelir Genotipe 24.15 Normal dan Mutannya... 114
45. Idiogram Kromosom Anyelir Genotipe 10.8 Normal ... 115
46. Idiogram Kromosom Anyelir Mutan Genotipe 10.8-10 Gy ... 116
47. Idiogram Kromosom Anyelir Genotipe 11.10 Normal... 116
48. Idiogram Kromosom Anyelir Mutan Genotipe 11.10 - 30 Gy ... 117
49. Idiogram Kromosom Anyelir Mutan Genotipe 11.10 – 60 Gy ... 117
50. Idiogram Kromosom Anyelir Genotipe 24.1 Normal ... 118
51. Idiogram Kromosom Anyelir Mutan Genotipe 24.1-30 gy ... 118
52. Idiogram Kromosom Anyelir Mutan Genotipe 24.1-50 gy ... 119
53. Idiogram Kromosom Anyelir Mutan Genotipe 24.1-60 gy ... 119
54. Idiogram Kromosom Anyelir Genotipe 24.14 Normal... 120
55. Idiogram Kromosom Anyelir Genotipe 24.14-30 Gy ... 120
56. Idiogram Kromosom Anyelir Genotipe 24.15 Normal ... 122
57. Idiogram Kromosom Anyelir Mutan Genotipe 24.15- 30 Gy... 122
58. Variasi Pola Pita Isozim Anyelir Genotipe 10.8 dengan Enzim PER... 131
59. Variasi Pola Pita Isozim Anyelir Genotipe 11.10 dengan Enzim PER .... 132
60. Variasi Pola Pita Isozim Anyelir Genotipe 24.1 dengan Enzim PER... 133
61. Variasi Pola Pita Isozim Anyelir Genotipe 24.14 dengan Enzim PER ... 133
62. Variasi Pola Pita Isozim Anyelir Genotipe 24.15 dengan Enzim PER ... 134
63. Variasi Pola Pita Isozim Anyelir Genotipe 10.8 dengan Enzim EST ... 135
64. Variasi Pola Pita Isozim Anyelir Genotipe 11.10 dengan Enzim EST ... 136
65. Variasi Pola Pita Isozim Anyelir Genotipe 24.1 dengan Enzim EST ... 136
66. Variasi Pola Pita Isozim Anyelir Genotipe 24.14 dengan Enzim EST ... 137
67. Variasi Pola Pita Isozim Anyelir Genotipe 24.15 dengan Enzim EST ... 138
68. Variasi Pola Pita Isozim Anye lir Genotipe 10.8 dengan Enzim ACP ... 139
69. Variasi Pola Pita Isozim Anyelir Genotipe 11.10 dengan Enzim ACP ... 139
70. Variasi Pola Pita Isozim Anyelir Genotipe 24.1 dengan Enzim ACP ... 140
71. Variasi Pola Pita Isozim Anyelir Genotipe 24.14 dengan Enzim ACP... 141
72. Variasi Pola Pita Isozim Anyelir Genotipe 24.15 dengan Enzim ACP….. 142
73. Grafik Jumlah Mutan pada Masing- masing Nilai Lethal Dose …………. 148
74. Ilustrasi Terjadinya Mutasi pada MV3 ……….. 149
75. Pola Perubahan Warna Petal Krisan Akibat Mutasi Induksi Fisik.……… 152
76. Pola Perubahan Warna Petal Rhododendron Akibat Mutasi Induksi
Fisik …………..………..….. 152
77. Pola Perubahan Warna Petal Anyelir Akibat Iradiasi Sinar Gamma …… 153
78. Dendogram Jarak Kedekatan Antara Genotipe – genotipe Mutan Anyelir Normal (Asli) dengan Mutannya ……….. 160
DAFTAR LAMPIRAN
No Teks Halaman
1. Deskripsi Lima Genotipe Anyelir ……….. 174
2. Data Suhu di Rumah Sere kebun Percobaan INLITHI Cipanas,
Tahun 2003-2004 ……… 175
3. Data Kelembaban Relatif di Rumah Sere kebun Percobaan INLITHI
Cipanas, Tahun 2003-2004 ………. 176
4. Nilai Beberapa Lethal Dose Lima Genotipe Anyelir Akibat Radiasi
Sinar Gamma pada Planlet dan Stek Puc uk ……… 177
5. Bunga Mutan Hasil Radiasi TunggaldenganSinar Gamma pada Planlet Anyelir (Dianthus carryophyllus Linn) di Tiap Generasi ………... 178
6. Bunga Mutan Hasil Radiasi Berulang denganSinar Gamma pada Planlet Anyelir (Dianthus carryophyllus Linn) di Tiap Generasi ……… 180
7. Bunga Mutan Hasil Radiasi Tunggal denganSinar Gamma pada Stek
Pucuk Anyelir (Dianthus carryophyllus Linn) di Tiap Generasi ……… 181
8. Diagram Pencar Lima Genotipe Anyelir Asli ……… 182
9. Panjang Kromosom dan Bentuk Kromo som Anyelir Normal dan Mutan 185
10. Genotipe Tanaman Mutan pada Analisis Isozim Berdasarkan Perlakuan
Iradiasi dan Fenotipenya ………... 193
11. Skoring Warna Petal dan Bentuk Petal Anyelir ……….. 195
ACP : Enzim acid phosphatase
Alel : Pasangan gen yang terletak pada kromosom homolog
Aneuploid : Individu yang mempunyai jumlah kromosom yang bukan
kelipatan dari kromosom dasarnya
Acute : Teknik iradiasi dengan dosis yang diberikan satu kali (sekaligus).
Irradiation (= iradiasi tunggal)
Buffer gel : Buffer yang digunakan untuk melarutkan pati kentang dalam analisis isozim
Chronic : Teknik iradiasi yang diberikan dengan dosis yang sangat rendah,
Irradiation tapi dalam waktu lama (bisa beberapa bulan)
Diplontic : Situasi dimana terjadi kompetisi antara sel-sel mutan dengan sel-
Selection sel normalnya, pada jaringan somatik
Dendogram : Grafik yang menggambarkan jarak kedekatan (rate of similarity) antara suatu kelompok atau individu, kultivar atau spesies
EST : Enzim esterase
Fenotipe : Karakter yang dapat dilihat dan diukur, sifat yang dapat diamati, merupakan unteraksi antara faktor genotip dan lingkungan
Fractionated : Teknik iradiasi dengan dosis yang diberikan lebih dari satu kali,
Irradiation pemberian kedua dan seterusnya merupakan pembagian dari dosis iradiasi tunggalnya. Misal dosis iradiasi tunggal 100 Gy, maka iradiasi terbagi diberikan 50 Gy dalam 2x pemberian (= iradiasi terbagi)
Genotipe : Suatu ciri yang tidak tampak dari luar, berhubungan dengan konstitusi genetik suatu individu
Gy : gray, satuan energi yang diterima suatu jaringan per satuan
masa, setara dengan 100 rad atau 100 Joule/kg
dari kromosom bersatelit, kromosom dengan lengan pendek terpendek, sampai dengan kromosom dengan lengan pendek terpanjang
Intermittent : Teknik iradiasi dengan dosis yang diberikan lebih dari satu kali
Irradiation kali, pemberian kedua dan seterusnya merupakan dosis tambahan sebelum siklus hidup tanaman usai
(= iradiasi berulang)
Kariotipe : Gambar pasangan kromosom dari suatu individu, disusun dari ukuran pasangan kromosom terbesar sampai terkecil
Kimera : Keadaan dimana suatu jaringan terdiri dari sel mutan dan sel normal, sehingga masing- masing sel memilik konstitusi genetik yang berbeda
LD50 : Lethal Dose 50%, persentase tanaman yang 50% mati akibat
suatu perlakuan, misalnya karena iradiasi sinar gamma
Mutan positif : mutan yang mengalami perubahan pada karakter- karakter yang diinginkan, yaitu perubahan pada karakter warna petal dan atau karakter bentuk tepi petal.
Mutan solid : mutan yang tidak kimera, fenotip mutan tampil merata di semua permukaan jaringan
Panjang Relatif : Panjang sebuah kromosom, dibandingkan dengan jumlah panjang
Kromosom total semua kromosom yang ada dalam genom suatu individu
PER : Enzim peroksidase
Polimorfisme : Bentuk pola pita yang berbeda antar individu
Rasio Lengan : Panjang lengan pendek kromosom dibagi dengan panjang lengan
Kromosom panjang kromosom
Reccurent : teknik iradiasi dengan dosis yang diberikan lebih dari satu kali
Irradiation radiasi kedua dan seterusnya merupakan pengulangan/ tambahan yang diberikan setelah satu iklus hidup tanaman, biasanya diberikan satu tahun kemudian (= iradiasi berulang)
Latar Belakang
Perkembangan florikultura di Indonesia sebenarnya telah dimulai pada akhir 1980-an, ketika para petani mampu memenuhi kebutuhan primernya dari usaha tanaman hias. Tanaman hias bunga umumnya digunakan untuk dekorasi dan bahan dasar parfum. Di Indonesia, sekitar 55% produksi bunga diserap oleh toko bunga (floris), 30% oleh hotel dan perusahaan catering, dan 15% lainnya untuk kebutuhan rumah tangga. Sekitar 10% penduduk Indonesia adalah pengkonsumsi bunga, dimana pengguna tertinggi berada di Jabotabek (Soerdjono 2003).
Produktivitas komoditas florikultura di Indonesia selalu meningkat walaupun persen peningkatannya rendah. Tercatat pada tahun 1993 area produksi tanaman hias mencapai 1 823 ha, dan pada tahun 1995 menjadi 1 996 ha, atau meningkat satu persen per tahun (masih rendah, dibandingkan Thailand yang mengalami peningkatan 10 persen per tahun). Namun sektor ini termasuk tangguh melampaui masa krisis ekonomi dan moneter yang terjadi di Indonesia pada 1997-1998 (Laporan Tahunan ASBINDO 1999). Setelah melampaui masa krisis, diperkirakan pertumbuhan permintaan bunga potong untuk konsumsi dalam negeri bisa meningkat sampai 15-20% per tahun dengan pertumbuhan diperkirakan mencapai Rp 186-428 miliar pada tahun 2005 (SI-LMUK 2004).
Untuk pasar luar negeri, ada empat negara pengimpor utama produk florikultura dari Indonesia, yaitu Singapura, Jepang, Taiwan dan Hongkong. Pada 1994, nilai ekspor ke Singapura mencapai US$ 2.01 juta sedangkan ke Taiwan mencapai US$ 2.41 juta. Untuk pasar internasional ini, pada tahun 1994-1995 tercatat Indonesia mengalami kenaikan sebesar 42% untuk ekspor tanaman hias (Nyuman 2001). Peluang ekspor florikultura dunia diperkirakan mencapai US$ 120 miliar pada tahun 2007 (SI-LMUK 2004). Hal tersebut merupakan peluang yang baik bagi petani dan pengusaha bunga untuk memenuhi kebutuhan konsumen terhadap tanaman hias dan bunga potong.
konsumen terhadap kualitas bunga potong yang tinggi, para pelaku bisnis tanaman hias selalu mendatangkan benih atau bibit introduksi dari luar negeri. Setiap tahun impor benih tanaman hias me ngalami peningkatan. Pada tahun 1995, nilai impor benih tanaman hias mencapai US$ 1.2 juta, dengan volume sekitar 396 kg benih (Nyuman 2001).
Ketergantungan yang tinggi terhadap bibit impor yang berasal dari negara yang menerapkan hukum perlindungan varietas yang sangat ketat membuat biaya produksi yang harus dikeluarkan oleh produsen tanaman hias menjadi tinggi. Untuk itu, beberapa strategi sedang diimplementasikan pemerintah untuk perkembangan sektor florikultura di Indonesia, antara lain dengan mengidentifikasi dan menciptakan varietas tanaman hias yang cocok dan disukai oleh pasar domestik maupun pasar internasional, meningkatkan kualitas sumberdaya manusia serta meningkatkan kerjasama antara beberapa institusi terkait seperti Perguruan Tinggi, Departemen Pertanian, Departemen Perdagangan dan Industri, Pemerintah Daerah serta bank sebagai penanam modal.
Varietas unggul dapat dirakit melalui beberapa cara, antara lain melalui mutasi induksi untuk mendapatkan mutan yang diinginkan. Mutan yang diinginkan adalah mutan yang baru dan unggul, serta memiliki keunikan tersendiri (dalam hal tipe, bentuk dan warna bunga), yang berasal dari tetua yang sudah beradaptasi dengan baik di beberapa sentra produksi tanaman hias di Indonesia.
Anyelir merupakan tanaman hias yang sangat digemari di Indonesia, termasuk komoditas prioritas dalam program pengembangan tanaman hias bunga potong pada Direktorat Tanaman Hias, Departemen Pertanian Republik Indonesia. Anyelir juga termasuk lima besar dalam permintaan pasar bunga potong internasional selain mawar, krisan dan gerbera (Gunn 2003). Selain harga yang relatif stabil, anyelir juga merupakan komoditas bunga potong yang memiliki nilai ekonomi tinggi, secara kultural telah diterima oleh masyarakat, serta dapat diusahakan baik di lahan yang relatif sempit maupun untuk dibudidayakan dalam skala industri.
mempunyai nilai jual yang tinggi (disukai konsumen). Pada penelitian ini, dilakukan mutasi fisik melalui iradiasi sinar gamma sebagai sumber untuk menciptakan keragaman.
Mutasi sebenarnya dapat terjadi secara alamiah di alam, namun peluang kejadiannya sangat kecil, yaitu sekitar 10-7-10-6 (IAEA 1977, Duncan et al. 1995). Penyebab mutasi alami antara lain sinar kosmos, batuan radioaktif dan sinar ultraviolet matahari. Untuk itu dilakukan mutasi induksi guna meningkatkan peluang terjadinya mutasi yang menghasilkan perubahan karakter yang diinginkan. Mutasi induksi dapat dilakukan dengan menggunakan mutagen kimia atau mutagen fisik. Namun dari banyak penelitian yang telah dilakukan, mutasi dengan iradiasi pada bagian vegetatif tanaman memperlihatkan hasil yang lebih baik dibandingkan perlakuan dengan mutagen kimia. Kemungkinan mutagen kimia menjadi kurang efektif, disebabkan oleh rendahnya daya serap jaringan vegetatif tanaman terhadap cairan kimia yang diberikan (Broertjes 1972).
Pada data FAO/IAEA (Maluzynski 2000) tercatat 265 kultivar baru dari 21 spesies tanaman hias yang telah dirilis (lima di antaranya adalah kultivar baru Dianthus sp.) merupakan hasil perlakuan mutasi induksi. Selain itu Micke et al. (1987) juga melaporkan bahwa dari total 698 kultivar mutan berbagai macam tanaman yang telah dirilis, sebanyak 395 kultivar (56 %) di antaranya adalah hasil dari perlakuan mutasi dengan iradiasi sinar gamma. Hal ini menunjukkan keefektivan sinar gamma dalam menghasilkan mutan yang diinginkan pemulia tanaman.
Dalam penelitian ini dilakukan seleksi dosis optimum yang dapat menghasilkan mutan diinginkan yang terbanyak, yang biasanya terjadi di sekitar LD50 (Lethal Dose 50),
yaitu dosis yang menyebabkan kematian 50% populasi tanaman (Ibrahim 1999). Nilai LD50 ini merupakan salah satu parameter untuk mengukur tingkat sensitivitas suatu
jaringan terhadap iradiasi, atau lebih dikenal dengan istilah ‘radiosensitivitas’. Pada stek pucuk krisan, nilai LD50 mencapai 25 gray (Banerji dan Datta 1992). Anyelir yang
memiliki keragaan morfologi yang lebih tegar dari krisan (batang krisan lebih sukulen) diduga memiliki LD50 dua kali lebih besar, atau sekitar 40-50 gray.
Selain dengan LD50, radiosensitivitas dapat diamati dari adanya hambatan
kromosom, pengamatan juga dapat dilakukan dengan lebih detail terhadap adanya perubahan protein akibat perlakuan iradiasi.
Berbeda dengan keragaman genetik yang diperoleh melalui perlakuan non- mutasi (seperti hibridisasi, transformasi ge netik, dan sebagainya), uji stabilitas tanaman mutan secara vegetatif memerlukan perlakuan tersendiri. Hal ini terjadi akibat adanya fenomena
diplontic selection, yaitu keadaan dimana sel-sel mutan akan saling berkompetisi dengan sel-sel normal untuk mengekspresikan karakternya secara fenotipik (Ibrahim 1999).
Datta (2001) melaporkan bahwa dari serangkaian penelitian mutasi pada berbagai macam tanaman hias yang telah dilakukannya, ternyata mutasi somatik terhadap bentuk dan warna bunga masih bisa terdeteksi sebagai kimera baik pada MV1, MV2 bahkan MV3. MV1 adalah populasi tanaman hasil perbanyakan vegetatif pertama (V1) dari mutan generasi pertama (M, kependekan dari ‘mutan’), sedangkan MV2 adalah populasi tanaman hasil perbanyakan vegetatif dari MV1, demikian seterusnya. Ahloowalia (1995) menyatakan bahwa mutan krisan dan streptocarpus memperole h kestabilannya pada generasi MV4. Ahloowalia melakukan uji stabilitas ini secara in vitro, yaitu melalui metode penerusan vegetatif dengan cara melakukan subkultur terus menerus (subkultur berulang) tanpa periode aklimatisasi di lapangan. Sebagaimana kris an, anyelir yang juga termasuk chimer group diduga dapat mencapai kestabilan vegetatif mutannya pada MV4. Pada penggunakan teknik pemuliaan mutasi, harus diperhatikan pemilihan varietas asal yang akan digunakan. Varietas asal tersebut sebaiknya merupakan varietas yang sudah beradaptasi dengan baik di daerah tropis. Keberhasilan penampakan fenotipe galur mutan tidak semata- mata bergantung pada karakter mutan yang baru dibentuk dari hasil mutasi, melainkan juga dari sifat genotipe asal untuk karakter agronomi lainnya, seperti adaptabilitas, resistensi, dan produktivitas. Pemilihan varietas asal yang digunakan pada penelitian ini didasarkan pada daya adaptasinya di daerah tropis.
Menurut Broertjes (dalam Schum and Preil 1988) warna pink atau merah muda merupakan warna yang mempunyai peluang terbesar untuk mengalami perubahan warna pada krisan. Demikian juga menurut Datta (2001) dari bermacam- macam warna bunga krisan yang ada, warna merah muda (pink) memiliki jumlah gen dominan yang maksimum untuk warna bunga.
Identifikasi dan Perumusan Masalah
Keterbatasan jumlah varietas unggul lokal tanaman hias anyelir menyebabkan ketergantungan Indonesia terhadap benih impor sangat tinggi. Hal ini dirasakan sebagai masalah besar bagi petani tanaman hias pada saat terjadinya krisis ekonomi dan moneter di Indonesia. Untuk itu perlu segera dilakukan tindakan pemuliaan tanaman guna memperluas keragaman genetik anyelir lokal, sebagai sumber plasma nutfah bagi keperluan program pemuliaan tanaman selanjutnya.
Dalam rangka meningkatkan keragaman genetik anyelir melalui mutasi induksi dengan sinar gamma, perlu dilakukan penelitian untuk menjawab beberapa permasalahan sebagai berikut :
1. Radiosensitivitas dan LD50. Setiap spesies tana man atau setiap klon dalam suatu
spesies tanaman mempunyai tingkat sensitivitas terhadap radiasi yang berbeda-beda. Tingkat sensitivitas tanaman ini akan sangat menentukan dosis iradiasi yang harus diberikan agar perlakuan iradiasi dapat menghasilkan sebanyak mungkin mutan yang diinginkan. Umumnya mutan yang diinginkan terjadi kisaran dosis sedikit di bawah LD50 (Ibrahim 1999). Pada anyelir, kisaran dosis iradiasi sinar gamma yang pernah
dicobakan masih cukup lebar, yaitu 25-120 gray. Dengan demikian diperlukan penelitian guna mengetahui nilai LD50 untuk stek pucuk maupun planlet anyelir.
3. Keragaman genetik. Perubahan penampakan fenotipik tanaman dapat disebabkan baik oleh faktor genetik maupun faktor lingkungan. Untuk itu perlu dilakukan analisis lebih jauh, faktor apa yang menjadi penyebab mutasi yang teramati. Hal ini dapat dilakukan dengan analisis kromosom maupun analisis isozim.
Tujuan Penelitian
Penelitian ini dilakukan dengan tujuan : (1) mengamati radiosensitivitas dan menentukan LD50 berbagai nomor genotipe anyelir terhadap iradiasi sinar gamma, (2) mendapatkan
mutan positif pada anyelir ya ng solid dan potensial untuk dikembangkan, (3) menguji tingkat kestabilan mutan solid anyelir yang terbentuk akibat iradiasi sinar gamma baik melalui stek pucuk maupun melalui planlet, (4) mempelajari pola perubahan warna bunga, dari berbagai warna bunga asal serta (5) mengidentifikasi keragaman genetik pada mutan terseleksi akibat iradiasi sinar gamma, baik secara sitologi maupun molekuler.
Manfaat Penelitian
Penelitian ini diharapkan dapat menghasilkan mutan- mutan anyelir yang baik untuk dijadikan sebagai koleksi plasma nutfah, atau bahkan untuk dirilis sebagai kultivar yang baru dan unggul, yang mempunyai keunikan dalam warna, corak dan bentuk bunga. Hasil penelitian ini juga diharapkan dapat me ngungkapkan berbagai informasi yang bermanfaat dalam kaitannya dengan pembentukan varietas baru atau peningkatan keragaman genetik anyelir melalui mutasi iradiasi sinar gamma. Diharapkan metode mutasi dengan iradiasi sinar gamma ini dapat menjadi metode yang potensial untuk menginduksi keragaman genetik pada anyelir.
Dengan diketahuinya tingkat radiosensitivitas dan LD50 dari masing- masing
nomor anyelir ini, maka pemulia anyelir berikutnya dapat mengkonsentrasikan perlakuan iradiasi pada sekitar LD50 saja dengan menggunakan bahan tanaman yang lebih banyak,
diinginkan, berdasarkan informasi pola perubahan warna bunga anyelir akibat perlakuan iradiasi sinar gamma pada penelitian ini.
Kerangka Pemikiran
Pengetahuan tentang tingkat radiosensitivitas dan LD50 pada anyelir merupakan
modal yang penting dalam usaha peningkatan keragaman genetik anyelir melalui perlakuan mutasi induksi fisik dengan iradiasi sinar gamma. Menurut Ahnstroem (1977) radiosensitivitas ini dipengaruhi oleh banyak faktor, antara lain faktor biologi (faktor genetik/ perbedaan varietas, volume inti sel) dan faktor lingkungan (oksigen, kadar air, suhu dan penyimpanan pasca iradiasi). Oleh karena itu, iradiasi sinar gamma pada lima genotipe anyelir ini dilakukan guna mengamati radiosensitivitas masing- masing genotipe anyelir serta untuk mencari LD50 planlet maupun stek pucuk dari masing- masing
genotipe anyelir ini.
Untuk meningkatkan peluang terjadinya mutan, telah banyak dilakukan berbagai teknik iradiasi. Salah satunya adalah teknik iradiasi berulang dimana pemberian iradiasi dilakukan dua kali. Basiran dan Ariffin (2002) dapat meningkatkan efek radiasi pada beberapa tanaman hias daun akibat perlakuan ir adiasi berulang, dibandingkan iradiasi tunggal.
Kembalinya karakter mutan menjadi karakter tanaman tetua setelah perlakuan mutagenik, menjadi masalah utama dalam pemuliaan mutasi pada organ somatik. Hal ini terjadi akibat banyaknya sel meristematik pada jaringan yang diradiasi sehingga membuat sel-sel berkompetisi. Pada saat sejumlah mutan telah didapatkan, maka seleksi harus dilakukan pada generasi yang tepat, dimana mutan- mutan yang dihasilkan dari generasi tersebut sudah stabil dan tidak mengalami perubahan lagi akibat fenomena diplontic selection (Nybom 1970). Oleh karena itu, penelitian ini akan mengamati pada generasi keberapa tanaman anyelir mutan mencapai kestabilan, tidak lagi mengalami mutasi balik atau mutasi maju.
secara sitologis telah dijelaskan secara umum oleh Sparrow (1979), antara lain akibat adanya aberasi mitotik dan meiotik pada kromosom mutan. Teknik isozim juga telah banyak terbukti dapat digunakan untuk pertelaan keragaman genetik akibat iradiasi sinar gamma, antara lain akibat perlakuan iradiasi sinar gamma pada manggis (Harahap 2005).
Data dari ketiga studi tersebut, ditambah dengan informasi pola perubahan warna petal anyelir akibat iradiasi sinar gamma, dapat memberi panduan bagi para pemulia mutasi pada anyelir untuk melakukan tindakan pemuliaan anyelir yang efektif dan efisien. Rumusan alur pemikiran yang diuraikan di atas dapat diringkaskan sebaga i bagan skema penelitian yang terdapat pada Gambar 1.
Hipotesis
Hipotesis yang dikemukakan pada penelitian ini adalah (1) setiap genotipe anyelir mempunyai radiosensitivitas yang berbeda terhadap iradiasi sinar gamma, dan memiliki nilai LD50 pada dosis kisaran 40-50 gray, (2) perlakuan iradiasi sinar gamma dapat
menghasilkan mutan solid yang diinginkan, (3) mutan solid anyelir dapat mencapai stabilitasnya pada generasi vegetatif MV4, (4) warna merah muda merupakan warna yang paling mudah berubah dan menghasilkan perubahan warna bunga terbanyak, serta (5) perubahan pada sel-sel mutan dapat dideteksi baik dari perubahan kromosom maupun perubahan protein melalui teknik isozim.
Alur Penelitian
Untuk mencapai tujuan penelitian dan menjawab hipotesis yang diajukan, dilakukan empat percobaan dengan skema penelitian seperti pada Gambar 1. Sebelum percobaan dimulai, dilakukan seleksi materi kegenetikaan terhadap nomor-nomor genotipe anyelir yang digunakan, berasal dari sumber plasma nutfah anyelir yang tersedia di Instalasi Penelitian Tanaman Hias (Inlithi) Cipanas.
Percobaan 1 dan 2 dilakukan untuk mengamati radiosensitivitas, seleksi mutan serta menentukan LD50 dari iradiasi sinar gamma terhadap dua macam sumber bahan
Seleksi materi kegenetikaan nomor- nomor anyelir : 1. Daya adaptasi di lapangan
2. Warna bunga
3. Ketahanan terhadap OPT utama anyelir
Percobaan 1 : Mutasi induksi Percobaan 2: Mutasi induksi stek planlet anyelir dengan sinar gamma pucuk anyelir dengan sinar gamma
iradiasi γ iradiasi γ
OUTPUT :Mutan s tabildan Generasi saat tercapainya stabilitas mutan
OUTPUT : Mutan yang secara genetik solid dan stabil
Untuk meningkatkan peluang terjadinya mutan, dilakukan teknik iradiasi berulang dan iradiasi kedua dilakukan pada dosis 25 gray, dosis yang diperkirakan separuh LD50.
Mengingat efisiensi waktu, maka iradiasi berulang hanya dilakukan pada planlet, dengan harapan dapat lebih memperluas keragaman genetik yang dihasilkan dibandingkan iradiasi tunggal yang diberikan pada stek pucuk.
Tahap berikutnya pada pemuliaan mutasi jika diperoleh mutan solid yang diinginkan, maka dilakukan uji kestabilan mutan. Uji stabilitas mutan pada penelitian ini dikerjakan di akhir Percobaan 1 dan 2, yaitu dengan cara subkultur berulang sampai generasi MV5 untuk perlakuan iradiasi tunggal atau MV5.2 untuk perlakuan iradiasi berulang (Percobaan 1) dan melalui penanaman stek pucuk secara berulang sampai generasi MV3 (Percobaan 2).
II. TINJAUAN PUSTAKA Botani Tanaman Anyelir
Anyelir atau carnation (Dianthus cariophyllus Linn.) adalah tanaman hias bunga yang berasal dari daerah Mediterania. Kata ‘Dianthus’ berasal dari bahasa Yunani, yang berarti dewa (dios) bunga ( anthos).
Menurut Hardjoko (1999) klasifikasi taksonomi anyelir adalah sebagai berikut : Divisio : Spermatophyta
Subdivisio : Angiospermae
Class : Magnoliopsida (Dicotyledonae) Subclass : Carryophyllidae
Ordo : Caryophyllales
Famili : Caryoplyllaceae
Tribe : Diantheae
Genus : Dianthus
Species : caryophyllus (Linn.)
Dianthus sp. termasuk tanaman herba, dapat mencapai tinggi 30-100 cm. Buku batang terlihat nyata pada bagian yang sudah menua. Daun runcing dengan tulang daun yang menyirip, panjang dan sempit, terletak bertolak belakang. Warna daun hijau muda keputih-putihan. Diameter bunga sekitar 5 – 10 cm. Daun mahkota bunga kelipatan lima dengan warna yang sangat bervariasi. Ujung mahkota bunga bergerigi atau tidak bergerigi. Kelopak bunga bergabung membentuk silinder dengan dua putik dan lima benang sari. Tunas samping keluar di antara daun dan batang (Bailey 1953).
Menurut Pertwee (1996) terdapat beberapa tipe anyelir baik berdasarkan teknik budidaya maupun secara genetik :
1. “Standard carnation” (D. caryophyllus) dibentuk dengan cara membuang pucuk lateral pada saat budidaya tanaman dilakukan. Tangkai bunga akan tumbuh kekar dengan panjang berkisar 60-80 cm, dan mempunyai satu bunga yang besar.
3. “Mignon carnation”, merupakan “standar carnation” yang berukuran kecil, akibat dibuangnya pucuk terminal dan beberapa pucuk lateral. Ukuran bunga sekitar setengah dari ukuran “standard carnation”
4. “Spray carnation” (D. caryophyllus) dimana pucuk terminal dibuang, dan pucuk lateral yang dibiarkan berkembang. Panjang tangkai sekitar 40-70 cm.
5. “Micro pink” adalah tipe anyelir yang berkluster dan kecil-kecil, dimana semua pucuk dibiarkan tumbuh dan berkembang.
6. “Diantini carnation”. Bunga ini mirip D. barbatus (Sweet William), tetapi pucuk terminalnya dibuang.
Budidaya Tanaman Anyelir
Perbanyakan anyelir bisa dilakukan melalui biji atau stek pucuk. Biji anyelir dapat berkecambah pada suhu 18-210C. Akan tetapi perbanyakan dengan biji umumnya hanya digunakan untuk tujuan pemuliaan tanaman. Jika menggunakan stek, maka stek yang digunakan harus benarbenar bebas hama dan penyakit terutama virus. Pada suhu -10C (310F ) stek berakar bisa disimpan selama empat bulan, sedang stek tanpa akar bisa mencapai enam bulan (Dole dan Wilkins 1999).
Tanaman anyelir membutuhkan suhu malam yang berkisar antara 8-110C, sedangkan suhu siang sekitar 18-220C. Tanaman ini tumbuh baik pada cahaya matahari penuh, dengan intensitas penyinaran sekitar 44.000 luks. Cahaya merupakan faktor lingkungan yang paling berpengaruh terhadap pertumbuhan dan perkembangan anyelir. Di negara subtropis, minimal dibutuhkan cahaya 21.500 luks selama musim dingin (Besemer 1980).
memberikan pengaruh pada ketegaran tanaman anyelir. Kekurangan kalium mengakibatkan bintik-bintik putih pada daun-daun di bawah bunga, bentuk bunga yang tidak normal, warna bunga pucat dan kelopak bunga menguning. Walaupun secara spesifik tergantung lokasi, tapi secara umum dapat dinyatakan bahwa tingkat kebutuhan nutrisi optimum tanaman anyelir adalah sekitar 40 ppm nitrat, 5-10 ppm phosphat, 25-40 ppm kalium, 150-200 ppm kalsium dan 30-25-40 ppm magnesium. Pada anyelir, direkomedasikan untuk memberikan pupuk 20 ppm N dan K.
Genetika Tanaman Anyelir
Tipe liar anyelir yang berasal dari daratan Mediterania termasuk dalam spesies
Dianthus barbatus, yang memiliki set kromosom diploid (2n=2x=30). Tanaman anyelir yang komersial yang ada sekarang merupakan hasil silangan sejak lebih dari 200 tahun yang lalu. Dalam The International Dianthus Register edisi kedua, Esley (1995) menyatakan terdapat 27.000 nama kultivar Dianthus yang telah terdaftar, dari berbagai macam spesies. Seluruh kultivar tersebut mempunyai jumlah kromosom yang berbeda-beda, umumnya 2n=30 atau 2n=45.
Tindakan hibridisasi telah banyak menghasilkan variasi kromosom pada anyelir. Makin sering tanaman mengalami persilangan, makin tinggi kemungkinan terjadinya perubahan jumlah kromosomnya, sehingga akhirnya menyebabkan perubaha n fenotipe pada anaknya (Darjanto dan Satifah 1990). Perubahan jumlah kromosom ini dapat terjadi misalnya pada hibridisasi interspesifik. Pada persilangan antara D. chinensis dan D. barbatus, yang masing- masing mempunyai kromosom 2n = 2x = 30, menghasilkan tanaman anyelir baru yang mempunyai kromosom 2n = 2x = 52. Dalam hal ini berarti telah terjadi perubahan jumlah kromosom, karena kromosom anak tidak sama dengan kromosom induk (Nakano dan Mii 1993).
Anyelir yang sekarang banyak dikenal dalam industri tanaman bunga potong ini termasuk dalam spesies Dianthus caryophyllus Linn., merupakan spesies anyelir yang sangat bervariasi tingkat ploidinya. Dalam setiap set kromosom anyelir (Dianthus caryophyllus Linn.) terdapat 15 buah kromosom (x= 15). Dianthus caryophyllus
mencapai jumlah 90 kromosom (2n= 6x= 90) (Darlington dan Wylie 1955). Akan tetapi
D. caryophyllus yang dikenal sebagai ‘anyelir greenhouse’, umumnya mempunyai kromosom diploid walau ada sebagian kecil tetraploid (Broertjes dan van Harten 1988).
Pemuliaan Mutasi
Secara umum, mutasi dapat didefinisikan sebagai perubahan materi genetik, dan merupakan sumber pokok dari semua keragaman genetik. Mutasi berperanan penting dalam proses evolusi dan akibat mutasi pula dapat tersedia keragaman materi genetik sebagai ‘bahan baku’ pekerjaan dalam program pemuliaan tanaman. Pada tanaman yang steril atau tanaman apomiktik obligat, mutasi merupakan satu-satunya sumber pencipta keragaman. Penggunaan mutasi, baik mutasi spontan yang terjadi alami maupun buatan yang diinduksi oleh mutagen, inilah yang disebut ‘pemuliaan mutasi’ (Ibrahim 1999).
Definisi mutasi menurut Poespodarsono (1988) adalah suatu perubahan baik terhadap gen tunggal, terhadap sejumlah gen atau terhadap susunan kromosom. Mutasi dapat terjadi pada setiap bagian tanaman dan fase pertumbuhan tanaman, namun lebih banyak terjadi pada bagian yang sedang aktif mengadakan pembelahan sel seperti tunas dan biji. Secara molekuler, dapat dikatakan bahwa mutasi terjadi karena adanya perubahan urutan (‘sequence’) nukleotida DNA kromosom, yang mengakibatkan terjadinya perubahan pada protein yang dihasilkan.
dapat merubah urutan genetik pada kromosom; sedangkan mutagen fisik iradiasi menyebabkan mutasi karena sel yang teradiasi dibebani tenaga kinetik yang tinggi sehingga dapat mempengaruhi atau mengubah reaksi kimia; akibatnya, susuna n kromosom pun berubah.
Broertjes dan van Harten (1988) menyatakan bahwa sinar gamma lebih sering digunakan karena mempunyai daya tembus yang lebih tinggi sehingga peluang terjadinya mutasi akan lebih besar pula. Sinar gamma ditemukan pada tahun 1900 ole h P. Villard setelah ditemukannya sina Alpha dan Beta oleh Rutherford dan Soddy (van Harten 1998). Sinar gamma merupakan radiasi elektromagnetik dengan panjang gelombang yang lebih pendek dari sinar X, yang berarti dapat menghasilkan radiasi elektromagnetik dengan tingkat energi yang lebih tinggi. Tingkat radiasi energi sinar gamma yang dihasilkan dari reaktor nuklir mencapai lebih dari 10 MeV. Daya tembusnya ke dalam jaringan sangat dalam, bisa mencapai beberapa sentimeter dan bersifat merusak jaringan yang dilewatinya (Sparrow 1979, van Harten 1998). Radiasi sinar gamma biasanya diperoleh dari disintegrasi radioisotop- radioisotop 137Cs atau 60Co. Menurut van Harten (1998)
60Co memiliki dua puncak spektrum energi radiasi, yaitu pada 1.33 dan 1.17 MeV,
dengan waktu paruh 5.27 tahun. Karena berbahaya, maka sumber harus diamankan dalam lapisan logam yang tebalnya 2-5 cm, tergantung pada jenis isotop yang digunakan.
Radiosensitivitas
kromosom, kerusakan fisik dan sterilitas, dan pada saat yang sama dapat dikontrol untuk memproduksi mutasi yang diinginkan (Datta 2001).
Secara visual tingkat sensitivitas ini dapat diamati dari respon yang diberikan tanaman, baik dari morfologi tanaman, sterilitas, maupun dosis letal 50 (LD50). LD50
adalah dosis yang menyebabkan kematian 50% dari populasi yang diradiasi. Dari banyak penelitian mutasi induksi, telah diketahui bahwa umumnya mutasi yang diinginkan terletak pada kisaran LD50 atau lebih tepatnya pada dosis sedikit dibawah LD50. Pada
kasus tertentu, misalnya pada perlakuan terhadap kalus, kisaran ini menjadi LD30, yaitu
dosis yang menyebabkan kematian 30% pada populasi kalus (Jain, S.M. November 2001 komunikasi pribadi); atau menjadi LD25 pada perlakuan chronic irradiation.
Dosis optimum untuk menghasilkan mutan yang diinginkan ini selain dipengaruhi oleh teknik iradiasi dan jenis tanaman, juga dipengaruhi oleh jenis sinar radiasi serta bentuk bahan tanaman yang diradiasi. Pada krisan yang diradiasi dalam bentuk stek pucuk, Banerji dan Datta (1992) menemukan dosis optimum sinar gamma untuk menghasilkan mutan yang diinginkan terbanyak (30% dari populasi tana man) adalah 25 gray; Sedangkan melalui planlet krisan, dosis iradiasi sinar gamma yang optimum menghasilkan mutan yang diinginkan berada pada kisaran 19.5-22 gray (Waluyo, 2001). Pada perlakuan dengan sinar X, dosis optimum planlet krisan adalah 80 gray (Broertjes, Roest dan Bokelmann 1976).
Pada tanaman hias berumbi, jika sinar gamma akan diradiasikan pada umbinya, maka tingkat dosis yang diberikan harus lebih rendah lagi, karena tingginya efek letal yang ditimbulkan. Melalui risetnya pada umbi narcissus, Misra (1990) menemukan bahwa perlakuan sinar gamma pada dosis 10 dan 15 gray menyebabkan pembungaan lebih awal, sedangkan lebih dari dosis itu sinar gamma mengakibatkan terhambatnya pertumbuhan daun, bahkan menyebabkan kematian umbi. Demikian juga perlakuan 10 gray sinar gamma terhadap kultivar gladiol, semua parameter pertumbuhan tanaman baik vegetatif maupun generatif memperlihatkan karakter yang inferior dibandingkan kultivar asalnya.
Teknik Iradiasi
ini dinamakan teknik acute irradiation atau radisi tunggal, yaitu teknik pemberian dosis secara sekaligus dalam satu kali penembakan iradiasi. Namun untuk mengurangi kerusakan akibat iradiasi tunggal yang diberikan sekaligus, maka dicobakan pula teknik chronic irradiation. Chronic irradiation yaitu teknik iradiasi dengan cara memberikan dosis yang sangat rendah secara terus menerus dalam waktu beberapa bulan (Nagatomi S. April 2001, komunikasi pribadi).
Selain itu, ada pula pemberian iradiasi dalam beberapa kali penyinaran, dengan dosis yang terbagi sehingga pada akhirnya total dosis yang diberikan sama dengan iradiasi tunggalnya. Hal ini cukup efektif, seperti yang dibuktikan oleh Weather dan Sader (1990) bahwa teknik fractionated irradiation (iradiasi terbagi) pada eksplan pucuk gerbera membuat persentase tumbuh tunas yang lebih tinggi dibandingkan teknik acute irradiation (iradiasi tunggal). Fractionated irradiation atau iradiasi terbagi adalah teknik pemberian dosis yang diberikan dua kali, masing- masing setengah dosis atau split dose.
Teknik pemberian iradiasi lainnya yaitu dengan iradiasi berulang baik secara
intermittent irradiation (jarak antar iradiasi tidak terlalu lama) atau recurrent irradiation
(iradiasi ulangan diberikan dalam waktu lama, bisa dalam hitungan tahun). Intermittent irradiation merupakan teknik iradiasi berulang yang ditujukan untuk meningkatkan efek iradiasi pada suatu jaringan, dibandingkan iradiasi tunggalnya. Pada iradiasi berulang ini, radiasi diberikan sekali atau beberapa kali lagi pada beberapa waktu kemudian dengan dosis yang lebih rendah (Basiran dan Ariffin 2002)
Uji Stabilitas
Stabilitas merupakan suatu hasil yang harus dicapai di akhir suatu program pemuliaan tanaman dalam rangka melepaskan varietas baru yang unggul. Tanpa stabilitas secara genetik, suatu varietas yang baru tidak dapat dilepas ke masyarakat.
Pada tanaman yang membiak secara generatif, uji stabilitas ini menjadi penting untuk mengetahui karakter yang diinginkan merupakan sifat yang dikendalikan secara genetik sehingga dapat diwariskan kepada keturunannya, ataukah hanya bersifat epigenetik saja, misalnya disebabkan oleh faktor lingkungan, transposon dan sebagainya. Pada tanaman yang diperbanyak secara vegetatif uji stabilitas umumnya jarang dilakukan karena secara teoritis perbanyakan vegetatif tidak akan menyebabkan keragaman akibat segregasi. Namun, walaupun diperbanyak secara vegetatif, jika asal keragamannya diperoleh dari perlakuan mutasi, maka perlu diadakan uji stabilitas terhadap “keturunan” vegetatifnya. Hal ini dilakukan untuk mengantisipasi adanya fenomena alam yang dikenal dengan istilah haplontic selection atau diplontic selection (Ibrahim 1999).
Pada situasi diplontic selection, jika sel-sel mutan kalah bersaing dengan sel-sel normal di sekelilingnya, maka pada perkembangan selanjutnya jaringan tanaman akan kembali tumbuh normal. Begitu juga sebaliknya, jika sel-sel mutan yang justru dapat ‘mengalahkan’ sel-sel normal, maka pada pertumbuhan selanjutnya tanaman akan menjadi mutan, sampai pada generasi berikutnya (Ibrahim 1999; IAEA 1977).
Kimera
Salah satu kekurangan metode mutasi menurut Brock (1979) adalah munculnya kimera, sifat-sifat yang justru merugikan atau tidak sesuai dengan harapan. Broertjes dan van Harten (1988) juga menyatakan bahwa salah satu pembatas dalam pemuliaan mutasi untuk tanaman yang diperbanyak secara vegetatif adalah timbulnya kimera. Hal ini terjadi karena umumnya mutasi terjadi pada satu sel, sedangkan jaringan multiseluler terdiri atas sel epidermis (L-I), sub-epidermis (L-II) dan korpus (L-III).
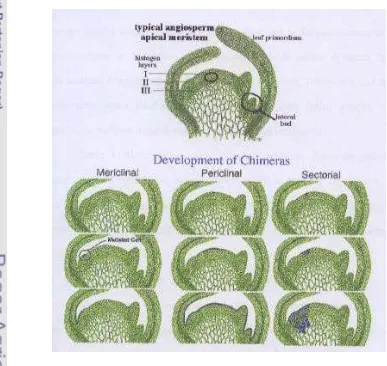
Kimera adalah jaringan tanaman yang mengandung sel yag termutasi dan sel-sel normal, sehingga memiliki konstitusi genetik yang berbeda (van Harten 2002). Berdasarkan posisi terjadinya kimera, terdapat tiga jenis kimera, yaitu kimera meriklinal, kimera sektorial dan kimera periklinal. Gambar 2 menerangkan kejadian ketiga jenis kimera pada struktur jaringan meristem apikal.
Pada kimera periklinal, sel mutan berkembang secara paralel (horisontal) sehingga menjadi suatu lapisan sel yang memiliki karakter yang berbeda. Sebagai contoh pada Gambar 2 tampak sel mutan berkembang menjadi satu lapisan epidermis yang memiliki karakter berbeda (misalnya pada pucuk meristem yang diploid, terdapat lapisan epidermis tetraploid). Pada kimera sektorial, sel mutan berkembang secara vertikal ke dalam jaringan sehingga membentuk suatu sektor dengan karakter yang berbeda dari karakter organ lainnya. Pada kimera meriklinal, sel mutan hanya berkembang horisontal pada sektor suatu organ saja (Steeves dan Sussex 1989).
Uji Kromosom
Umumnya, karakterisasi dan identifikasi keragaman yang timbul pada tanaman akibat mutasi dilakukan secara fenotipik, yaitu melalui penampakan morfologi tanaman. Namun, identifikasi yang terinci dan akurat kadang-kadang cukup sulit dilakukan jika hanya mengandalkan pada penampakan fenotip saja.
Perlakuan mutasi induksi dapat menyebabkan terjadinya mutasi gen atau mutasi kromosom. Crowder (1993) menyebutnya sebagai mutasi mikro (perubahan terjadi pada susunan molekulgen (DNA) atau nukleotida) dan mutasi makro (perubahan terjadi pada struktur dan susunan kromosom). Jadi mutasi gen hanya terjadi pada tingkat gen, bahkan bisa terjadi hanya pada sepasang basa saja yang disebut point mutation atau mutasi titik.
Mutasi kromosom terjadi jika perubahan terdapat di tingkat kromosom baik terhadap jumlah maupun struktur kromosom. Perubahan struktur kromosom bisa terjadi akibat delesi, inversi, duplikasi, atau translokasi. Pada delesi dan inversi, patahan kromosom terjadi hanya pada satu pasang kromosom, sedangkan pada duplikasi dan translokasi, lebih dari satu pasang kromosom yang terlibat dalam peristiwa aberasi kromosom (Schulz dan Schaeffer 1980)