ANALISIS OLIGOSAKARIDA HASIL HIDROLISIS PATI
KENTANG HITAM (
Culeus tuberosus
) OLEH ENZIM
AMILASE DARI
Brevibacterium
sp.
TITI ROHMAYANTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TITI ROHMAYANTI. Analisis Oligosakarida Hasil Hidrolisis Pati Kentang
Hitam (Culeus tuberosus) oleh Enzim Amilase dari Brevibacterium sp. Dibimbing
oleh ANNA P. ROSWIEM dan YOPI
ABSTRACT
TITI ROHMAYANTI. Analysis of Oligosaccharide from Hydrolysis The Black
Potato Starch (Culeus tuberosus) by Amylase Enzyme from
Brevibacterium sp.
Supervised by ANNA P. ROSWIEM and YOPI.
ANALISIS OLIGOSAKARIDA HASIL HIDROLISIS PATI
KENTANG HITAM (
Culeus tuberosus
) OLEH ENZIM
AMILASE DARI
Brevibacterium
sp.
TITI ROHMAYANTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Analisis Oligosakarida Hasil Hidrolisis Pati Kentang Hitam (Culeus
tuberosus) oleh Enzim Amilase dari Brevibacterium sp.
Nama : Titi Rohmayanti
NIM : G84080034
Disetujui
Komisi Pembimbing
Dr. Anna P. Roswiem, MS.
Ketua
Dr. Yopi
Anggota
Diketahui
Dr. I Made Artika M.App.Sc.
Ketua Depertemen Biokimia
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT. yang telah
melimpahkan berkah, rahmat, dan ridho-Nya sehingga penulis dapat
menyelesaikan penelitian untuk memenuhi tugas akhir pada program mayor
Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian
Bogor. Penelitian ini berjudul Analisis Oligosakarida Hasil Hidrolisis Pati
Kentang Hitam (Culeus tuberosus) oleh Enzim Amilase dari
Brevibacterium sp.
Kegiatan ini didanai oleh Projek DIPAN PN LIPI 2012 dan dilakukan di
Laboratorium Biokatalis dan Fermentasi LIPI Cibinong, Bogor dari bulan Juni
hingga November 2012.
Penulis mengucapkan terima kasih kepada semua pihak yang telah
memberikan dukungan selama proses penulisan penelitian ini. Ucapan terima
kasih penulis sampaikan terutama kepada Dr. Anna P. Roswiem, MS. selaku
pembimbing utama dan Dr. Yopi selaku pembimbing kedua yang telah
memberikan saran, kritik, dan bimbingannya. Ucapan terima kasih penulis
sampaikan kepada keluarga tercinta Ayah, Ibu, teh Yani, teh Nisa, dan Mia.
Terima kasih juga untuk segenap tim di LIPI Cibinong Mba Nanik, Mba Ade,
Mba Lia, Mas Alex, Mas Dicki, Pak Awan, Rohanah, dan Sari. Teman-teman
Biokimia angkatan 45 Ines, Osa, Nisa. Teman-teman Al Hurriyyah Tika, Leli,
Arni, Edy, Abas dan teman-teman Al Iffah Filda, Dania, Riska, dan semua yang
tidak bisa disebutkan satu persatu.
Penelitian ini tentu tidak terlepas dari kekurangan. Karena itu penulis
sangat mengharapkan adanya saran dan kritik yang bermanfaat bagi penulis di
masa yang akan datang. Semoga penelitian ini dapat memberikan manfaat.
Bogor, Februari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Serang pada tanggal 6 Oktober 1990 dari Bapak
Muhammad Yamin, SE. dan Ibu Siti Rohimah, S.Pd. Penulis merupakan anak
ketiga dari empat bersaudara. Tahun 2008 penulis lulus dari SMA Negeri 1
Kramatwatu, Serang dan diterima di Institut Pertanian Bogor melalui jalur
Undangan Seleksi Masuk IPB (USMI). Penulis tercatat sebagai mahasiswa
Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam pada
tahun 2008.
Selama mengikuti perkuliahan penulis aktif dalam organisasi LDK Al
Hurriyyah di bagian departemen Hubungan Luar (2009-2011) dan sebagai Badan
Pengawas Nasional LDK di Jawa Barat. Penulis juga aktif di UKM
Forum for
Scientific Studies (FORCES) pada tahun 2009 dan Dewan Perwakilan Mahasiswa
(DPM) FMIPA (2010). Pada tahun 2012 penulis aktif di departemen Sumber
Daya Manusia LDK Al Hurriyyah. Beberapa kepanitian yang pernah penulis ikuti
diantaranya pada tahun 2009 sebagai Penanggung Jawab Kelompok (PJK) Masa
Perkenalan Kampus Mahasiswa Baru (MPKMB), tahun 2010 sebagai divisi acara
Seminar Pertanian Indonesia, tahun 2011 Bendahara kegiatan Puskomdays
nasional, dan divisi acara Gebyar Inspirasi Muslim Intelek serta di tahun 2012
sebagai Steereing Commetee (SC) acara Salam Islamic Student Center IPB.
Penulis juga aktif mengikut berbagai kompetisi. Pada tahun 2009, penulis
pernah mengikuti ajang Muslimah Teladan se-Nasional dan masuk ke dalam lima
besar. Tahun 2010 dan 2011 penulis pernah menjadi juara kedua lomba cipta dan
baca puisi tingkat nasional dan tulisan-tulisan fiksinya beberapa kali diterbitkan di
majalah Annida dan Kompasiana. Penulis pernah mengikuti dan lolos kompetisi
writing paper
“
Sustainable Future for Human Security
”
(SUSTAIN 2011) di
Kyoto, Jepang dan di tahun yang sama penulis juga mengikuti kompetisi writing
paper
pada forum
“
Discussion on Sustainable Women Partnership of Women
Leaders from Asia and Africa”
di Duksung Woman University, Korea. Penulis
juga pernah mendapat hibah dana bersaing dari Direktorat Jenderal Pendidikan
Tinggi dalam Program Kreativitas Mahasiswa (PKM) untuk kategori Bidang
Pengabdian Masyarakat pada tahun 2011. Penulis melakukan Praktik Lapangan di
Balai Besar Penelitian Pascapanen Jl. Tentara No 1, Cimanggu Bogor dengan
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Pati Kentang Hitam ... 1
Enzim Amilase ... 2
Brevibacterium sp. ... 3
Oligosakarida ... 3
Analisis Oligosakarida ... 4
BAHAN DAN METODE
Bahan dan Alat.... ...
5
Metode ...
5
HASIL DAN PEMBAHASAN
Enzim Amilase dari Brevibacterium sp ...
6
Hasil Reaksi Hidrolisis Pati Kentang Hitam dengan Enzim Amilase ...
7
Hasil Analisis TLC, Gula Reduksi, Gula Total ...
8
Hasil Analisis HPLC Sampel Pati Kentang Hitam Hasil Hidrolisis ... 9
SIMPULAN DAN SARAN
Simpulan ... 12
Saran ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
1
Pati Kentang Hitam ...
2
2
Ekstrak Kasar Enzim Amilase ...
7
3
Warna dan Kekentalan Pati Kentang Hitam ... 7
4
Sampel Hasil Freeze Dry dan Evaporasi ... 7
5
Kromatogram TLC Standar dan Sampel ... 8
6
Kromatogram HPLC Standar dengan Perbandingan Fase Gerak 75:25
Kecepatan Aliran 1.4 mL/min dan Fase Gerak 60:40 Kecepatan Aliran
1 mL/min ... 10
DAFTAR TABEL
Halaman
1
Kandungan Nutrisi Kentang Hitam ...
2
2
Jenis Sakarida dan Senyawa Prebiotik Lainnya ...
3
3
Waktu Retensi Kromatogram TLC Standar dan Sampel
………....
... ... 8
4
Nilai Gula Reduksi, Gula Total, dan Derajat Polimerasi ... 9
5
Waktu Retensi HPLC dan Konsentrasi Standar ... 10
6
Waktu Retensi HPLC dan Konsentrasi Sampel Segar ... 10
7
Waktu Retensi HPLC dan Konsentrasi Sampel Freeze Dry ... 12
DAFTAR LAMPIRAN
Halaman
1
Diagram Alir Penelitian ... 16
2
Hidrolisis Substrat ... 17
3
Kurva Standar Glukosa dan Nilai Aktivitas Enzim ... 18
4
Kurva Kalibrasi Standar Glukosa ... 19
5
Hasil Analisis Kandungan Gula pada Sampel Segar ... 20
6
Hasil Analisis Kandungan Gula pada Sampel Hasil Freeze Dry ... 21
7
Hasil Analisis Kandungan Gula pada Sampel Hasil Evaporasi ... 22
8
Kromatogram HPLC Standar dengan Perbandingan Fase Gerak 75:25
Kecepatan Aliran 1.4 mL/min ... 23
9
Kromatogram HPLC Standar dengan Perbandingan Fase Gerak 60:40
Kecepatan Aliran 1 mL/min ... 24
10
Kromatogram HPLC Sampel Segar Hasil Hidrolisis ... 25
11
Kromatogram HPLC Sampel Hasil Freeze Dry 2.5% ... 26
12
Kromatogram HPLC Sampel Hasil Freeze Dry 5% ... 27
13
Kromatogram HPLC Sampel Hasil Freeze Dry 10% ... 28
14
Kromatogram HPLC Sampel Hasil Evaporasi 2.5% ... 29
15
Kromatogram HPLC Sampel Hasil Evaporasi 5% ... 30
1
PENDAHULUAN
Oligosakarida merupakan kelompok penting dari makromolekul karbohidrat yang memiliki gula rantai pendek dari polisakarida dengan 2 sampai 20 unit sakarida. Dewasa ini perkembangan produk oligosakarida menjadi salah satu usaha yang memiliki nilai jual sangat tinggi di dunia industri. Produk oligosakarida memiliki banyak manfaat di bidang pangan dan kesehatan tubuh seperti meningkatkan kualitas makanan dan modifikasi rasa makanan (Marlis 2008), meningkatkan populasi bakteri baik di saluran cerna atau sebagai senyawa prebiotik (Rycroft
et al. 2001), mereduksi reaksi alergi (Nakakuki 2002), meningkatkan penyerapan mineral dan memodulasi metabolisme lipid (Sakuma 2002).
Banyaknya manfaat oligosakarida tersebut menyebabkan tumbuhnya inovasi baru untuk menghasilkan oligosakarida. Penemuan enzim-enzim baru mikroba yang mampu mensintesis oligosakarida dengan struktur yang spesifik meningkatkan produksi bermacam-macam oligosakarida seperti galaktooligosakarida, laktosukrosa, xilo-oligosakarida, maltooligosakarida, dan isomaltooligosakarida (Dinoto 2010). Salah satu bahan dasar untuk memproduksi oligosakarida secara enzimatis adalah pati
yang terdiri dari unit α-D-glukopiranosil yang
terhubung dengan ikatan α-1.4-glikosidik
dan/atau ikatan α-1.6-glikosidik.
Kentang hitam mengandung karbohidrat tinggi terutama pati yaitu sekitar 83% dengan kadar amilosa 32% dan amilopektin sebesar 51% (Rahmani et al. 2011). Tingginya kandungan pati tersebut menyebabkan kentang hitam dapat dijadikan sebagai salah satu sumber pangan dalam upaya pengembangan program diversifikasi pangan. Kadar amilopektin yang lebih tinggi dari amilosa menyebabkan kentang hitam memiliki karakter yang unik yaitu lebih kenyal dan renyah dibanding kentang yang lain. Hal ini dikarenakan struktur amilopektin yang banyak memiliki cabang disisinya. Penelitian terkait manfaat yang terkandung dalam kentang hitam masih terbatas sehingga penelitian tentang analisis oligosakarida kentang hitam ini merupakan suatu langkah menggali potensi sumber daya umbi lokal tersebut.
Beberapa jenis enzim amilase dilaporkan dapat dihasilkan dari mikroorganisme dan diproduksi secara komersial pada industri. Beberapa mikroba yang dapat memproduksi enzim amilase untuk menghasilkan
oligosakarida seperti maltoheksosa, maltopentosa, maltotetrosa, dan maltotriosa diantaranya Aerobacter, Bacillus,
Pseudomonas, dan Streptomyces (Takasaki 1982; Taniguchi 1983; Robyt 1971; Wako et al. 1979).
Saat ini mikroba yang banyak digunakan berasal dari tanah, mikroba yang berasal dari laut belum banyak dimanfaatkan padahal karakteristik mikroba laut sangat unik yaitu tahan terhadap NaCl yang sangat tinggi. Salah satu mikroba laut yang dapat menghasilkan enzim amilase yaitu Brevibacterium sp. (Rahmani et al. 2011). Berdasarkan penelitian Rohanah (2012), kondisi optimum hidrolisis pati kentang hitam dengan enzim amilase dari
Brevibacterium sp. memiliki waktu hidrolisis selama 4 jam, konsentrasi substrat sebesar 2.5%, dilakukan pada suhu 30oC, serta perbandingan enzim dan substrat 1:5 dengan aktivitas enzim amilase yang diperoleh sebesar 2.488 U/mL.
Analisis sakarida hasil hidrolisis secara enzimatik dapat diidentifikasi dengan beberapa cara salah satunya adalah metode
High Performance Liquid Cromatography
(HPLC). Metode tersebut digunakan karena memiliki kecepatan dan sensitivitas yang lebih baik dari kromatografi lainnya. HPLC dapat digunakan untuk mengidentifikasi bahan-bahan yang mengandung karbohidrat dan senyawa organik (Zou & Chen 2008).
Penelitian ini bertujuan untuk menganalisis oligosakarida hasil hidrolisis pati kentang hitam oleh enzim amilase dari
Brevibacterium sp. Adapun hipotesis dari penelitian ini adalah oligosakarida dapat dihasilkan dari pati kentang hitam hasil hidrolisis dengan enzim amilase dari
Brevibacterium sp. Penelitian ini diharapkan dapat memberikan pengetahuan dan nilai guna mengenai manfaat pati kentang hitam dan produk turunannya berupa oligosakarida yang bernilai ekonomis dan berfungsi sebagai komponen pangan sehat.
TINJAUAN PUSTAKA
Pati Kentang Hitam
2
Magnoliophyta, kelas Magnoliopsida, ordo Lamiales, famili Lamiaceae, genus Culeus, dan spesies Culeus tuberosus. Kentang hitam mempunyai kandungan karbohidrat yang tinggi, khususnya pati yaitu sebesar 33.7 gram (Nugraheni 2011). Kompisisi nilai gizi kentang hitam dapat dilihat pada Tabel 1.
Tabel 1 Kandungan nutrisi kentang hitam Kandungan Kadar (per 100 g)
Air 64 %
Energi 142 kal
Karbohidrat 33.7 g
Protein 0.9 g
Lemak 0.4 g
Kalsium 34 mg
Fosfor 75 mg
Besi 0.2 mg
Tiamin 0.02 mg
Vit. C 38 mg
Sumber: Nugraheni (2011)
Kentang hitam yang digunakan pada penelitian ini merupakan kentang hitam varietas 2.12 hasil kultur jaringan di Laboratorium Biak Sel dan Kultur Jaringan, Puslit Biologi, LIPI. Sampel kentang hitam yang digunakan dalam kultur jaringan berasal dari daerah Nganjuk, Jawa Timur. Kentang hitam tersebut diekstrak hingga didapatkan pati umbi kentang hitam dalam bentuk bubuk (Gambar 1).
Gambar 1 Pati kentang hitam
Secara alamiah pati merupakan campuran dari amilosa dan amilopektin. Monomer glukosa dengan hanya terdapat ikatan α-1.4 glikosidik dinamakan amilosa. Di sisi lain, adanya ikatan α-1.6 glikosidik menghasilkan polimer glukosa bercabang yang dinamakan amilopektin. Komposisi amilosa dan amilopektin berbeda-beda pada tiap tumbuhan. Untuk pati yang berasal dari kentang hitam memiliki kadar amilosa 32.31% dan kadar amilopektin 52.56% (Rahmani et al.
2011). Pati kentang hitam memiliki senyawa turunan tripterpenic acid seperti urselic acid,
oleanolic acid, dan maslinic acid, senyawa yang berfungsi sebagai antioksidan, hepatoprotektif, antitumor, anti inflamasi, dan peningkat daya tahan tubuh (Yoon & Liu 2008; Feng et al., 2008; Fai & Tao 2009).
Pati termasuk karbohidrat jenis polisakarida yang banyak terdapat di dalam tumbuhan. Pati atau amilum bersifat tidak larut dalam air pada suhu kamar, berwujud bubuk putih, tidak berasa, dan tidak berbau. Di dalam tumbuhan, pati disimpan dalam sel sebagai granula kecil yang dapat dilihat di bawah mikroskop. Bentuk granula pati berbeda-beda tergantung dari tumbuhan sumber patinya. Pati kentang hitam memiliki granula dengan ukuran 10 m dan baik pada aplikasi industri (Rahmani et al. 2011). Komponen utama polisakarida pada pati kentang hitam dapat dihidrolisis dengan menggunakan enzim-enzim yang memiliki cara kerja spesifik untuk menghasilkan oligosakarida. Enzim spesifik untuk memecah pati menjadi gula-gula sederhana yaitu enzim amilase (Winarno 2008).
Enzim Amilase
Enzim adalah protein yang berfungsi sebagai katalisator, senyawa yang mempercepat proses reaksi tanpa habis bereaksi dalam suatu reaksi kimia. Enzim bekerja secara spesifik, artinya setiap enzim hanya dapat bekerja pada satu macam senyawa atau reaksi kimia. Hal ini karena adanya urutan asam amino spesifik yang membentuk enzim serta mengikat dan mengaktifkan molekul substrat. Sebagai
contoh, enzim α-Amilase hanya dapat digunakan pada proses perombakan pati menjadi gula sederhana (Marks et al. 2000).
Enzim α-Amilase tipe endoenzim yang memotong ikatan amilosa dan amilopektin dengan cepat pada larutan pati kental yang telah mengalami gelatinisasi. Produk akhir yang dihasilkan dari aktivitasnya adalah dekstrin beserta sejumlah kecil glukosa dan maltosa. α-Amilase akan menghidrolisis
ikatan α-1.4 glikosidik pada polisakarida dengan hasil degradasi secara acak di bagian tengah atau bagian dalam molekul (Conkerton
et al. 1983).
3
menghasilkan produk, kondisi lingkungan dapat dikendalikan, menguntungkan secara ekonomis dan memilki siklus hidup pendek sehingga produktivitasnya dapat ditingkatkan. Salah satu bakteri yang dapat menghasilkan enzim amilase tipe endo yaitu Brevibacterium
sp. (Rahmani et al. 2011)
Brevibacterium sp.
Mikroba laut yang dapat menghasilkan enzim amilase diantaranya adalah bakteri
Brevibacterium sp. Isolat tersebut diprediksi dapat memproduksi amilase tipe endo, yaitu enzim yang bekerja menghidrolisis substrat secara random atau acak sehingga dapat menghasilkan produk oligosakarida dalam jumlah yang lebih banyak. Enzim amilase yang dihasilkan oleh Brevibacterium sp. memiliki suhu optimum 25-30oC dan pH optimum 6.6 (Rahmani et al. 2011).
Genus Brevibacterium adalah campuran heterogen organisme coryneform yang memiliki aplikasi khusus untuk produksi industri, asam amino untuk produksi bahan kimia halus, dan produksi keju. Genus ini berisi sembilan spesies dari habitat beragam seperti tanah, unggas, ikan, kulit manusia, dan makanan (Gruner & Alexander 1993). Bakteri yang digunakan pada penelitian ini diisolasi dari laut dan merupakan koleksi dari BTCC (Biotechnology Culture Collection). Isolat ini memiliki koloni yang berwarna putih apabila masih muda dan akan berwarna kuning di pinggir koloni jika sudah tua (Rahmani et al. 2011).
Brevibacterium sp. memiliki bentuk sel batang. Diameter koloni 0.6-1.2 x 1.5-6 µm. Bakteri ini termasuk ke dalam bakteri gram positif, aerob, tidak mampu bergerak dan termasuk ke dalam katalase positif. Bakteri
Brevibacterium sp. yang berasal dari laut tahan terhadap NaCl yang sangat tinggi. Selain itu, bakteri ini juga dapat menghasilkan enzim amilase secara ekstraseluler. Dengan adanya substrat berupa pati yang menjadi nutrisi metabolismenya, bakteri ini akan mengeluarkan zat berupa enzim amilase untuk memotong polisakarida pada pati menjadi gula yang lebih sederhana seperti oligosakarida (Rahmani et al. 2011).
Oligosakarida
Oligosakarida merupakan gula rantai pendek dari polisakarida dengan 2 hingga 20 unit sakarida. Karakteristik senyawa oligosakarida terdiri atas susunan monosakarida antara lain glukosa, galaktosa, xylosa, dan fruktosa. Oligosakarida memiliki
berat molekul lebih rendah dibawah polisakarida (Manning 2004). Sebagian besar oligosakarida berfungsi sebagai bahan pangan prebiotik. Jenis dan senyawa prebiotiknya dapat dilihat pada Tabel 2.
Tabel 2 Jenis sakarida dan senyawa prebiotik lainnya
Kelompok Senyawa Prebiotik
Polylol Xylitol
Sorbitol Mannitol Disakarida Laktulosa
Laktitol Oligosakarida Rafinosa
Fruktooligosakarida Oligofruktosa Galaktooligosakarida Palatinosa Isomaltooligosakarida Laktosukrosa Galaktosil-sukrosa
Polisakarida Inulin Pati resisten Sumber: Suskovic et al. (2001)
Menurut Aiyer (2005) terdapat beberapa oligosakarida turunan pati yang memiliki banyak manfaat di bidang pangan, misalnya maltosa banyak digunakan sebagai pemanis, suplemen gula pada intravena. Sirup maltotetrosa dijadikan sebagai pengganti sukrosa yaitu dapat mengurangi manisnya makanan tanpa mempengaruhi rasa dan aroma, serta dapat menjaga kelembaban dalam pangan. Selain itu, oligosakarida juga dapat digunakan sebagai pangan fungsional yang memiliki potensi besar untuk meningkatkan kualitas bahan makanan, modifikasi rasa makanan, dan karakter fisikokimia yang menguntungkan bagi kesehatan konsumen.
Oligosakarida ditemukan secara alami dalam buah-buahan, sayuran, susu, dan madu. Oligosakarida banyak digunakan dalam minuman, susu bubuk balita, permen, roti, yoghurt, dan produk turunan susu (Marlis 2008). Ada juga oligosakarida campuran (maltooligomer mix) yang diperoleh dari pemecahan pati jagung dengan α-amilase, β -amilase, dan pululanase. Komposisinya yaitu terdiri atas 37.5% glukosa, 2.2% maltosa, dan 46.6% maltotriosa.
4
2007). Prebiotik menyebabkan mikroflora yang bermanfaat bagi kesehatan dapat tumbuh lebih baik dibandingkan mikroflora patogen. Mikroflora tersebut terdapat di dalam usus besar dan bermanfaat untuk pencernaan misalnya Bifidobacterium spp., Eubacterium spp., dan Lactobacilus spp. Mikroflora tersebut akan bersaing dengan mikroflora patogen yang terbawa masuk ke saluran pencernaan melalui makanan (Roberfroid 2007).
Analisis Oligosakarida
Metode yang dikembangkan dalam analisis karbohidrat adalah Kromatografi. Proses kromatografi digunakan dalam metode pemisahan komponen gula dari komponen non gula menjadi fraksi-fraksi terpisah yang diakibatkan oleh perbedaan adsorpsi, difusi dan eksklusi komponen gula dan non gula tersebut terhadap adsorben dan eluen yang digunakan. Jenis kromatografi yang biasa digunakan dalam analisis gula-gula sederhana adalah Kromatografi Lapis Tipis (Thin Layer Cromatography, TLC) dan Kromatografi Cair Kinerja Tinggi (High Performance Liquid Cromatography, HPLC) (Zou & Chen 2008).
TLC merupakan bentuk kromatografi planar yang fase diamnya berupa lapisan yang seragam (uniform) pada permukaan bidang datar yang didukung oleh lempeng kaca, pelat aluminium atau pelat plastik Jel silika atau alumina merupakan fase diam. Fase diam untuk TLC seringkali juga mengandung substansi yang dapat berpendar dalam sinar ultra violet. Fase diam lainnya yang biasa digunakan adalah alumina-aluminium oksida Fase gerak yang biasa digunakan berupa senyawa cair seperti akuades, n-butanol, dan asam asetat (Weston & Brokleblank 1999).
Selain TLC, kromatografi lainnya yaitu HPLC yang mendasarkan analisis terhadap keragaman struktur dan isomeric multiplicity. Mekanisme pemisahan dilakukan dengan interaksi hidrofilik, pertukaran ligan, size exclusion, Deteksi HPLC dilakukan dengan Deteksi Indeks Refraktif (Refractive Index Detection, RID) atau Pulse-Amperometric Detection (PAD) (Soga 2002). HPLC merupakan teknik analisis pemisahan sekaligus penentuan kualitatif maupun kuantitatif yang banyak digunakan pada senyawa-senyawa yang mempunyai titik didih tinggi yang tidak dapat dilakukan dengan analisis secara kromatografi gas (Zou & Chen 2008).
Prinsip pemisahan HPLC sama dengan prinsip kromatografi pada umumnya yaitu
berdasarkan pada perbedaan sifat dalam distribusi kesetimbangan dari 2 komponen yang berbeda fasenya (fase diam dan fase gerak). HPLC terdiri dari fase diam dengan permukaan aktifnya yang berupa padatan, resin penukar ion, atau polimer berpori yang ditempatkan pada kolom serta dialiri fase gerak cair dengan aliran yang diatur oleh suatu pompa. Analisis dengan HPLC dilakukan pada temperatur rendah dengan adanya kompetisi 2 fase (gerak dan diam). Migrasi dari komponen molekul akan sebanding dengan koefisien distribusinya, maka komponen dengan distribusi tinggi pada fase diam akan bergerak lebih perlahan didalam kolom sehingga dapat terpisah dari komponen yang distribusinya rendah (Du & Chen 2009).
Setiap komponen campuran yang keluar dari kolom dideteksi oleh detektor kemudian direkam dalam bentuk kromatogram. Jumlah puncak pada kromatogram menyatakan jumlah komponen, sedangkan luas puncak menyatakan konsentrasi komponen dalam campuran. Komputer dapat digunakan untuk mengontrol kerja sistem HPLC dan mengumpulkan serta mengolah data hasil pengukuran HPLC (Zou & Chen 2008).
Terdapat beberapa perlakuan yang dilakukan pada sampel sebelum dianalisis dengan HPLC yaitu sampel dikeringbekukan terlebih dahulu agar air atau senyawa-senyawa pengotor yang terkandung dalam sampel tidak mengganggu saat proses analisis. Proses yang dapat dilakukan diantaranya freeze dry dan
vacuum evaporator. Proses ini juga bertujuan sebagai bentuk sediaan bahan pangan yang mengandung senyawa oligosakarida dalam jumlah yang banyak.
Prinsip kerja freeze dry adalah pada kondisi tekanan penguapan yang rendah, air dapat diuapkan dari fase es tanpa membuat es mancair. Prinsip penyubliman menjadi dasar
freeze dry ini, air akan tersublimasi pada suhu 0 derajat atau lebih rendah dan diletakkan pada wadah dan tekanan 4,7 mmHg atau kurang dari itu. Selain itu, prinsip utama metode freeze-dry adalah menghilangkan kandungan air suatu bahan sebanyak ± 98 (Du & Chen 2009).
Metode pengeringan vaccum evaporator
dapat menghasilkan produk kering dengan kualitas tinggi. Pada metode ini suhu atau panas pada makanan dan laju penguapan air dari bahan pangan dapat diatur. Panas merambat pada bahan pangan melalui proses radiasi dan konduksi. Setiap alat yang bekerja dengan prinsip vaccum evaporator
5
wadah vakum dengan konstruksi berat untuk menahan tekanan air dari luar yang mungkin melebihi tekanan di dalam, penyuplai panas, sebuah alat untuk menghasilkan dan menjaga kondisi vakum dan sebuah komponen untuk mengumpulkan uap air yang diuapkan dari bahan pangan (Du & Chen 1997).
BAHAN DAN METODE
Bahan dan Alat
Bahan-bahan yang digunakan untuk penelitian ini antara lain pati kentang hitam varietas 2.12, isolat Brevibacterium sp. koleksi Laboratorium Biokatalis dan Fermentasi Puslit Bioteknologi LIPI. Komposisi media cair pre-kultur dan pre-kultur terdiri atas ekstrak khamir,
bacto pepton, ASW (Artificial Sea Water), pati komersil (Merck) 2%, dan akuades. Untuk media padat, komposisi media cair ditambah agar 1.5%. Reagen dinitrosalisilat (DNS) yang terdiri atas DNS murni, NaOH padat, dan kalium natrium tartrat (KNa-tartrat) Merck. Alkohol 70%, es batu, asam sulfat pekat, Na2S, fenol 5%, dan bufer fosfat 2M pH 6.6. Eluen atau fase gerak yang digunakan untuk TLC yaitu n-butanol, asam asetat, dan akuades dengan perbandingan 12:6:6. Adsorben atau fase diam yang digunakan yaitu plat silica gel
60 F254 (Merck Art 20-20 cm). Standar yang digunakan dalam TLC yaitu glukosa, maltosa, maltotriosa, dan maltopentosa. Fase gerak yang digunakan yaitu acetonitril dan akuades steril dengan perbandingan 75:25 dan 60:40. Standar yang digunakan untuk HPLC yaitu glukosa, maltosa, maltotriosa, dan maltopentosa.
Adapun alat-alat yang digunakan antara lain High Performance Liquid Cromatography
(HPLC), Laminar Air Flow, autoklaf, inkubator goyang, evaporator, freeze dryer, hair dryer, spektrofotometer UV-Vis, sentrifus, hot plate, vortex, neraca analitik, labu Erlenmeyer, falcon, gelas beker, kuvet, tabung reaksi, gelas ukur, cawan petri, rak tabung, sudip, tisu, bunsen, pipet mikro, pipet tetes, pinset, tabung Eppendorf, tips, aluminium foil, lemari pendingin, botol semprot, kertas saring, tusuk gigi, membran dialisis, baskom, penjepit membran, corong, tabung sentrifugasi, botol Schott, labu ukur, sarung tangan, dan masker.
Metode Penelitian
Metode penelitian terdiri atas empat tahap yaitu tahap awal produksi ekstrak kasar enzim amilase dari Brevibacterium sp., tahap kedua
proses reaksi hidrolisis pati kentang hitam dengan enzim amilase. Selanjutnya tahap ketiga dilakukan analisis TLC, gula reduksi, dan gula total. Tahap keempat analisis profil oligosakarida dengan HPLC (lampiran 1).
Produksi Ekstrak Kasar Enzim Amilase dari Brevibacterium sp.
Sebelum penelitian, isolat Brevibacterium
sp. diremajakan kembali dengan cara ditumbuhkan dalam media agar. Isolat diinkubasi selama 96 jam pada suhu 30oC dengan inkubator goyang 150 rpm (Rahmani
et al. 2011). Selanjutnya isolat yang sudah diremajakan diinokulasi ke dalam media prekultur dan kultur. Hasil kultur disentrifus dengan kecepatan 12000 rpm selama 15 menit pada suhu 4oC. Setelah itu supernatan diambil dan dipisahkan dengan peletnya. Ekstrak kasar enzim amilase tersebut diuji aktivitasnya dengan cara 0.25 mL larutan pati komersil (Merck) ditambahkan dengan 0.5 mL ekstrak kasar enzim amilase lalu divorteks dan kemudian diinkubasi pada suhu ruang selama 30 menit. Selanjutnya ditambahkan 0.75 mL reagen DNS dan di vortex kembali. Setelah itu dipanaskan di suhu 100oC selama 15 menit dan kemudian didinginkan ke dalam es serta diukur absorbansinya pada panjang
gelombang =540 nm (Bernfeld 1λλ5).
Proses Reaksi Hidrolisis Pati Kentang Hitam dengan Enzim Amilase
Hidrolisis substrat pati kentang hitam dengan enzim amilase pada skala 1 Liter dilakukan pada kondisi optimum berdasarkan Rohanah (2012). Konsentrasi pati yang digunakan sebesar 2.5%, waktu hidrolisis selama 4 jam, perbandingan enzim dan substrat 1:5, dan dilakukan pada suhu 30oC. Pati kentang hitam sebanyak 25 gram dilarutkan ke dalam akuades 1 L dan dipanaskan pada suhu 80oC. Selanjutnya ditambahkan enzim amilase yang memiliki aktivitas sebesar 3.25 U/mL sebanyak 20 mL. Substrat dan enzim tersebut kemudian dihidrolisis selama 4 jam pada inkubator goyang dengan kecepatan 150 rpm dan suhu 30oC. Sampel hasil reaksi hidrolisis tersebut diberikan perlakuan dengan cara freeze dry
dan vacuum evaporator. Sampel sebanyak 1 Liter diberi perlakuan freeze dry pada tekanan 4.7 mmHg dan suhu -50oC. Perlakuan Freeze dry dilakukan di Laboratorium PAU IPB. Perlakuan vacuum evaporator sampel sebanyak 1 Liter dilakukan pada suhu chiller
6
Analisis Kimia Kandungan Karbohidrat
Identifikasi komponen kabohidrat dengan TLC (Thin Layer Cromatography). Plat silica gel 60 F254 (Merck Art 20-20 cm) nm ukuran 10x20 cm diukur jarak 1 cm dari bawah plat sebagai garis start dan 1 cm dari atas sampel sebagai garis finish. Sampel ditotolkan sebanyak 4µL pada plat TLC menggunakan pipet mikro 10 µL. Eluen yang digunakan adalah campuran n-butanol, asam asetat, dan akuades dengan perbandingan 12:6:6. Standar yang digunakan yaitu glukosa, maltosa, maltotriosa, dan maltopentosa. Eluen dikocok dan dijenuhkan selama 60 menit. selanjutnya, plat TLC dikeringkan menggunakan hair dryer kemudian dilakukan proses elusi. Setelah elusi selesai. Plat TLC disemprot dengan larutan pewarna gula yaitu
0.5 gram α-difenilamin,25 ml aseton, 2.5 ml asam fosfat, dan 0.5 ml anilin. Setelah kering, plat TLC dipanaskan pada suhu 100oC selama 15 menit hingga terbentuk spot. Spot yang terbentuk dihitung nilai Rf (Retention factor)nya dengan rumus:
Rf =
Analisis Gula Total (modifikasi Dubois
et al. 1956). Analisis gula total diukur dengan metode fenol-sulfat. Sebanyak 0.5 mL sampel yang sudah diencerkan sebanyak 400 kali ditambahkan 0.5 ml fenol 5% (b/v) dan 2.5 ml asam sulfat pekat. Selanjutnya divorteks dan diinkubasi pada suhu ruang selama 10 menit. Kemudian dipanaskan dalam water bath pada suhu 40oC selama 20 menit dan diukur absorbansinya pada = 4λ0 nm. Hasil absorbansi kemudian dimasukkan ke dalam persamaan kurva standar glukosa.
Analisis Gula Pereduksi (modifikasi Miller 1959). Sebanyak 10 µL sampel ditambahkan 490 µL akuades kemudian divorteks, selanjutnya ditambahkan 750 µL larutan DNS dan divorteks kembali. Setelah itu, dipanaskan pada suhu 100oC selama 15 menit sampai berubah warna. Kemudian didinginkan di dalam es dan selanjutnya diukur dengan spektrofotometer pada panjang
gelombang =540 nm. Hasil absorbansi
kemudian dimasukkan ke dalam persamaan kurva standar glukosa.
Derajat Polimerasi (Apriyantono et al. 1989). Derajat polimerasi dihitung
berdasarkan perbandingan antara gula total dan gula pereduksi.
Analisis Oligosakarida dengan HPLC Penentuan kondisi optimum pada HPLC dilakukan pada tiga variabel yaitu perbandingan fase gerak, kecepatan alir, dan konsentrasi sampel. Optimasi pertama dilakukan pada perbandingan fase gerak asetonitril:akuades sebesar 75:25 dengan kecepatan alir sebesar 1.4 mL/min dan perbandingan fase gerak asetonitril:akuades sebesar 60:40 dengan kecepatan alir sebesar 1 mL/min. Fase gerak yang digunakan di filter dan di degass terlebih dahulu. Sampel terdiri atas sampel segar, sampel freeze dry dengan optimasi konsentrasi 2.5%, 5%, dan 10% serta sampel evaporasi dengan optimasi konsentrasi 2.5%, 5%, dan 10%. Detektor yang digunakan yaitu Refractive Index Detector (RID) dan kolom Zorbax SIL (silika) dengan dilapisi 3-aminopropilen. Volume injek sebesar 10µL. Standar yang digunakan yaitu glukosa, maltosa, maltotriosa, dan maltopentaosa. Standar dan sampel diinjek ke dalam kolom sebanyak 10 µL hingga diperoleh data komatogram pada komputer.
HASIL DAN PEMBAHASAN
Enzim Amilase dari Brevibacterium sp. Produksi enzim amilase diawali dengan meremajakan isolat Brevibacterium sp. Tujuan dari peremajaan ini agar diperoleh isolat yang segar sehingga bakteri Brevibacterium sp. dapat optimal menghasilkan enzim amilase. Isolat yang sudah diremajakan dimasukkan ke dalam media prekultur dan kultur. Tujuan prekultur dan kultur yaitu agar isolat dapat beradaptasi dan sebagai stimulasi atau rangsangan untuk menghasilkan enzim amilase secara optimal. Media kultur bakteri berubah dari kuning bening menjadi kuning keruh. Hal tersebut merupakan salah satu ciri adanya pertumbuhan dan sistem metabolisme bakteri.
7
sebesar 3.25 U/mL yang berarti enzim amilase tersebut dapat menghasilkan 3.25 mikromol produk per menit. Rahmani et al. (2011) menemukan bahwa Brevibacterium sp. yang diisolasi dari Teluk Kamal mampu menghasilkan enzim amilase dengan aktivitas 2.85 U/mL. Semakin tinggi aktivitas enzim amilase maka semakin optimal enzim tersebut memecah pati menjadi gula sederhana seperti oligosakarida.
Enzim amilase ekstrak kasar tersebut berasal dari bakteri laut, sehingga diperlukan dialisis untuk menghilangkan garam-garam berlebih yang kemungkinan berasal dari media
Artificial Sea Water (ASW). Dialisis merupakan bagian dari proses pemurnian enzim menggunakan membran semi-permiabel. Ekstrak kasar enzim amilase hasil dialisis berwarna kuning jernih (Gambar 2).
Gambar 2 Ekstrak kasar enzim amilase dari
Brevibacterium sp.
Hasil Reaksi Hidrolisis Pati Kentang Hitam dengan Enzim Amilase
Reaksi hidrolisis pati kentang hitam pada kondisi optimum berdasarkan Rohanah (2012). Pati kentang hitam berwarna putih kecoklatan kemudian dilarutkan dan dipanaskan pada suhu 80°C selama 5 menit. Sebelum dipanaskan, larutan pati tersebut berwarna putih sedikit kecoklatan akibat warna pati kentang hitam itu sendiri. Setelah mengalami pemanasan pati menjadi lebih coklat dan terlihat bahwa pati tersebut terlarut. Setelah reaksi berlangsung selama 4 jam, substrat berubah warna menjadi cokelat bening karena warna cokelat terpengaruh dari warna enzim dan substrat terlihat lebih encer, seperti yang terlihat pada Gambar 3.
Hasil hidrolisis masih mengandung enzim yang aktif. Kerja enzim dihentikan dengan memanaskan hidrolisat pada suhu tinggi supaya protein enzim terdenaturasi. Sampel hasil hidrolisis mengandung oligosakarida
yang memiliki rantai pendek dan terlarut, maka dilakukan sentrifugasi.
(a) (b)
Gambar 3 Perbedaan warna dan kekentalan substrat pati kentang hitam sebelum ditambahkan enzim amilase (a) dan setelah ditambahkan enzim amilase (b).
Sampel segar hasil hidrolisis sebanyak 1 Liter dikeringbekukan (freeze dry) pada tekanan 10 µHg dengan suhu -50°C. Bobot sampel setelah dikeringbekukan menjadi 2.1 gram. Sampel hasil freeze dry berupa padatan berbentuk bubuk berwarna cokelat. Setelah itu, sampel segar hasil hidrolisis sebanyak 1 Liter juga dipekatkan menggunakan vaccum evaporator. Pemekatan dilakukan hingga didapatkan sampel sebanyak 40 mL dalam bentuk cairan kental. Pada sampel hasil evaporasi, sampel berwarna kuning kecoklatan akibat dari warna asli pati kentang hitam. Tujuan dilakukan pemekatan dan pengeringan beku adalah untuk menguapkan air yang terkandung dalam sampel sehingga konsentrasi sampel menjadi lebih tinggi dan hasil sampel yang berupa padatan akan memudahkan proses analisis dan penyimpanan dalam jumlah yang banyak. Sampel freeze dry
dan evaporasi dapat dilihat pada Gambar 4.
(a) (b)
8
Supernatan hasil sentrifugasi selanjutnya dianalisis. Terdapat tiga sampel untuk dianalisis yaitu sampel segar hasil hidrolisis, sampel freeze dry, dan sampel evaporasi. Analisis sampel terdiri atas analisis profil dengan TLC, analisis gula reduksi, dan analisis gula total serta identifikasi dengan HPLC.
Hasil Analisis TLC, Gula Reduksi, dan Gula Total
Analisis profil oligosakarida pada sampel hasil hidrolisis secara kualitatif salah satunya yaitu dengan menggunakan kormatografi lapis tipis. Glukosa digunakan sebagai standar monosakarida dan maltosa, maltotriosa dan maltopentosa digunakan sebagai standar oligosakarida. Kromatogram TLC dapat dilihat pada Gambar 5.
Gambar 5 Kromatogram TLC standar (1) yang teridiri atas glukosa, maltosa, maltotriosa, dan maltopentosa pada sampel evaporasi (2), sampel
freeze dry (3), dan sampel segar (4)
Sampel hasil hidrolisis secara keseluruhan menunjukkan bahwa telah terjadi pemecahan pati oleh enzim. Spot kromatogram sampel hasil freeze dry dan evaporasi memiliki ketebalan yang lebih jelas dibandingkan spot kromatogram pada sampel segar. Hal ini dikarenakan kedua sampel tersebut telah mengalami pengeringan. Sampel yang sudah dikeringkan lebih tebal karena air yang terkandung pada sampel tersebut telah mengalami penguapan sehingga konsentrasinya lebih tinggi dan menghasilkan spot lebih jelas.
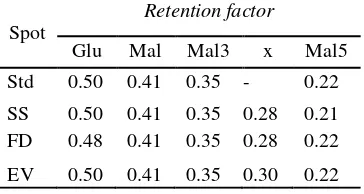
Waktu retensi pada standar glukosa, maltosa, maltotriosa, dan maltopentosa
berturut-turut sebesar 0.50, 0.41, 0.35, dan 0.22. Nilai tersebut dipengaruhi oleh pergerakan karbohidrat selama elusi. Bobot molekul yang lebih besar akan mengalami pergerakan lebih lama sehingga nilai Rf
semakin rendah. Pada sampel segar, sampel
freeze dry, dan sampel evaporasi menghasilkan nilai Rf yang tidak jauh berbeda dengan standar. Seperti nilai maltosa dan maltotriosa pada ketiga sampel sebesar 0.41 dan 0.35 sama seperti nilai standar. Masing-masing nilai Rf standar dan sampel dapat dilihat pada Tabel 3.
Tabel 3 Rf spot standar gulkosa (Glu), maltosa (Mal), maltotriosa (Mal3), dan maltopentosa (Mal5) pada sampel segar (SS), freeze dry (FD), dan evaporasi (EV)
Pada semua sampel menghasilkan lima spot sementara standar yang digunakan hanya empat, hal ini diperkirakan di dalam sampel tersebut mengandung maltotetrosa yang memiliki nilai Rf diantara maltotriosa dan maltopentosa. Keempat spot yang muncul pada sampel oligosakarida segar, sampel hasil
freeze dry, dan sampel hasil evaporasi memiliki nilai Rf yang sama atau mendekati nilai standar sehingga di dalam sampel tersebut menunjukkan adanya senyawa glukosa, maltosa, maltotriosa, dan maltopentosa. Setelah adanya profil sakarida pada analisis TLC, selanjutnya dilakukan analisis gula reduksi dan gula total agar dapat diperoleh derajat polimerasi.
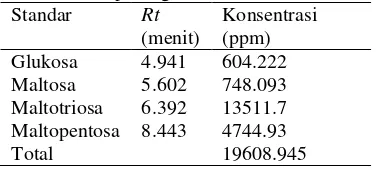
Pada sampel segar, hasil freeze dry, dan evaporasi. Kandungan gula reduksi pada sampel segar hasil hidrolisis sebesar 7485.5 ppm. Gula reduksi menunjukkan terbentuknya gula sederhana seperti oligosakarida pada pati kentang hitam yang terhidrolisis. Jumlah gula-gula pereduksi dan non pereduksi pada sampel dinyatakan dalam gula total yang terdapat pada sampel. Kandungan gula total pada sampel segar sebesar 95600 ppm. Derajat polimerasi (DP) diperoleh dari perbandingan gula total dan gula pereduksi. DP pada sampel segar sebesar 12.776 artinya pada sampel
Spot
Retention factor
Glu Mal Mal3 x Mal5 Std 0.50 0.41 0.35 - 0.22
SS 0.50 0.41 0.35 0.28 0.21 FD 0.48 0.41 0.35 0.28 0.22
EV 0.50 0.41 0.35 0.30 0.22
9
tersebut menghasilkan 12.776 polimer hasil dari degradasi polisakarida menjadi oligosakarida atau gula sederhana yang dipotong oleh enzim amilase tipe endo secara acak.
Kandungan gula reduksi pada sampel hasil
freeze dry mengalami kenaikan yaitu sebesar 9647.5 ppm dengan kandungan gula total sebesar 69000 ppm. DP yang dihasilkan lebih baik yaitu sebesar 7.152. Pada sampel yang diberi vacuum evaporator gula reduksinya lebih meningkat menjadi 14908.3 ppm dengan nilai gula total sebesar 69540 ppm. DP yang diperoleh sebesar 4.664.
Sampel hasil hidrolisis setelah di freeze dry
dan evaporasi memiliki kandungan gula reduksi lebih tinggi dikarenakan air yang terkandung pada sampel mengalami penguapan dan sampel mengalami pemekatan yang menyebabkan konsentrasinya menjadi meningkat sehingga gula-gula sederhana lebih banyak terbentuk. DP yang dihasilkan juga lebih baik karena oligosakarida memiliki DP lebih besar dari 2 dan kurang dari 10 (2<DP<10). Nilai gula reduksi, gula total, dan derajat polimerasi pada sampel dapat dilihat pada Tabel 4.
Tabel 4 Nilai gula reduksi (GR), gula total (GT), dan derajat polimerasi (DP) pada sampel segar (SS), freeze dry
(FD), dan evaporasi (EV)
Sampel GR (ppm)
GT (ppm)
DP
SS 7482.5 95600 12.776 FD 9647.5 69000 7.152 EV 14908.3 69540 4.664
(a)
Hasil Analisis HPLC Sampel Pati Kentang Hitam Hasil Hidrolisis
Analisis profil oligosakarida dengan HPLC menggunakan kecepatan aliran 1.4 mL/min dengan perbandingan fase gerak 75:25 (kondisi 1) dan kecepatan aliran 1 mL/min dengan perbandingan fase gerak 60:40 (kondisi 2). Pada kondisi 1 diperoleh puncak glukosa, maltosa, dan maltotriosa dengan jarak antar puncak yang cukup berjauhan Waktu yang diatur selama analisis adalah 30 menit. Maltopentosa tidak muncul dan diperkirakan muncul jika waktu analisis diperpanjang lebih dari 30 menit. Pada kondisi 2 dan waktu yang diatur selama 10 menit semua standar glukosa, maltosa, maltotriosa, dan maltopentosa muncul dengan waktu retensi yang lebih singkat. Puncak yang di dapat tidak terlalu berjauhan dan lebih tajam dibandingkan kondisi 1 (Gambar 6).
10
(b)
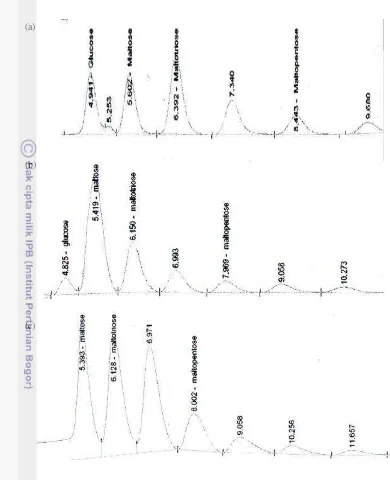
Konsentrasi standar yang digunakan yaitu glukosa sebesar 50000 ppm, maltosa 50000 ppm, maltotriosa 5000 ppm, dan maltopentosa 5000 ppm. Pada waktu injek standar dengan kondisi 1, glukosa muncul di waktu retensi 5.384, maltosa 10.371, maltotriosa 16.783, dan maltopentosa tidak muncul. Sementara itu, pada kondisi 2 waktu retensi standar yang muncul lebih cepat yaitu glukosa muncul di waktu 4.742, maltosa 5.309, maltotriosa 5.997, dan maltopentosa 7.567. Waktu retensi dan konsentrasi standar dapat dilihat pada Tabel 5.
Tabel 5 Waktu retensi (Rt) dan konsentrasi standar glukosa (Glu), Maltosa (Mal), Maltrotriosa (Mal3), dan Maltopentosa (Mal5)
Std Rt
kondisi 1
Rt
kondisi 2
Konsentrasi (ppm) Glu 5.384 4.742 50000 Mal 10.371 5.309 50000 Mal3 16.783 5.997 5000 Mal5 Tidak
muncul
7.567 5000
Berdasarkan hasil standar yang diperoleh, maka kondisi 2 yaitu perbandingan fase gerak asetonitril:akuades 60:40 dengan kecepatan aliran 1 mL/ min digunakan untuk menginjek sampel. Sampel yang dianalisis berupa sampel segar, sampel freeze dry, dan sampel evaporasi (Gambar 7)
Kromatogram pada sampel segar menghasilkan tujuh puncak dengan jarak antar puncak yang stabil dan baseline yang rata. Dari tujuh puncak tersebut memunculkan empat puncak yang waktu retensinya tidak berbeda jauh dengan standar yang digunakan. Pada sampel hasil freeze dry konsentrasi 2.5%
diperoleh tujuh puncak dengan baseline yang rata. Dari tujuh puncak tersebut dihasilkan empat puncak yang waktu retensinya mirip dengan standar. Terbentuknya glukosa menandakan amilase tidak hanya bekerja sendiri pada substrat pati, tetapi ada juga enzim lain yang ikut bekerja yaitu glukosidase. Pada sampel hasil evaporasi dengan konsentrasi 2.5% tidak mengandung senyawa glukosa hal ini dikarenakan konsentrasi yang terlalu kecil yang terdapat dalam senyawa tersebut.
Sampel yang sudah diberi perlakuan freeze dry dan evaporasi menghasilkan puncak yang lebih tajam dibandingkan sampel segar. Oligosakarida yang teridentifikasi juga memiliki puncak yang lebih tinggi dan terdapat banyak puncak yang diperkirakan adalah oligosakarida. Berdasarkan ketiga kromatogram sampel tersebut diperoleh waktu retensi yang tidak jauh berbeda dengan standar yang digunakan. Waktu retensi pada sampel segar dapat dilihat pada Tabel 6.
Tabel 6 Waktu retensi (Rt) dan konsentrasi sampel segar hasil hidrolisis
Standar Rt
(menit)
Konsentrasi (ppm) Glukosa 4.941 604.222 Maltosa 5.602 748.093 Maltotriosa 6.392 13511.7 Maltopentosa
Total
8.443 4744.93 19608.945
Waktu retensi glukosa pada sampel segar muncul di waktu 4.941, maltosa 5.602, maltotriosa 6.392, dan maltopentosa 8.443. Konsentrasi maltotriosa lebih tinggi dibandingkan yang lain yaitu sebesar 13511.7 Gambar 6 Kromatogram HPLC standar dengan perbandingan fase gerak 75:45 dan kecepatan
11
(a)
(b)
(c)
ppm. Total konsentrasi dari empat puncak tersebut sebesar 19608.945 ppm dari konsentrasi sampel oligosakarida segar yang diinjek sebesar 25000 ppm. Sisa konsentrasi yang lain diperkirakan terdapat dalam tiga puncak oligosakarida yang belum diketahui jenisnya hal ini dikarenakan keterbatasan standar yang digunakan.
Analisis HPLC yang dilakukan pada sampel freeze dry dan evaporasi yang terdiri dari konsentrasi 2.5%, 5%, dan 10%. Waktu retensi dan konsentrasi oligosakarida dari sampel hasil freeze dry dapat dilihat pada Tabel 7.
Kromatogram sampel hasil freeze dry
dilakukan dengan tiga konsentrasi yang berbeda sebagai pembanding luas area dari perbedaan konsentrasi yang dilakukan. Semakin tinggi konsentrasi, luas area yang dihasilkan semakin besar. Pada konsentrasi 2.5% waktu retensi glukosa sebesar 4.825, maltosa 5.419, maltotriosa 6.150, dan maltopentosa 7.969. Dari keempat puncak tersebut, senyawa oligosakarida maltosa memiliki konsentrasi tertinggi yaitu sebesar 2605.339 ppm. Pada konsentrasi 5% dan 10% puncak lebih tajam dan luas.. total kosentrasi yang diperoleh pada sampel hasil freee dry 5% Gambar 7 Kromatogram HPLC sampel segar (a), sampel hasil freeze dry 2.5% (b), dan
12
dan 10% lebih besar yaitu berturut-turut sebesar 8911.528 ppm dan 9268.310 ppm. Pada sampel freeze dry 5% senyawa olligosakarida yang memiliki konsentrasi tertinggi yaitu maltosa sebesar 6238.086 ppm dan pada sampel hasil freeze dry 10% senyawa oligosakarida tertinggi yaitu maltosa sebesar 5231.677 ppm.
Tabel 7 Waktu retensi (Rt) dan konsentrasi sampel hasil freeze dry setelah HPLC
Sampel Standar Rt Konsentrasi
(ppm)
2.5% Glukosa 4.825 226.638
Maltosa 5.419 2605.339
Maltotriosa 6.150 616.728
Total
Maltopentosa 7.969 527.390
3976.095
5% Glukosa 4.825 431.913
Maltosa 5.367 6238.086
Maltotriosa 6.148 1225.634
Total
Maltopentosa 7.969 1015.895
8911.528
10% Glukosa 4.817 168.618
Maltosa 5.354 5231.677
Maltotriosa 6.129 1928.908
Total
Maltopentosa 7.951 1939.107
9268.310
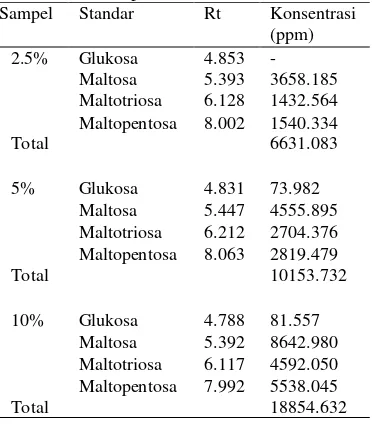
Selain sampel hasil freeze dry dilakukan juga analisis sampel hasil evaporasi. Sampel dilakukan pada tiga konsentrasi yang berbeda yaitu 2.5%, 5%, dan 10%. Waktu retensi dan konsentrasi sampel evaporasi hasil HPLC dapat dilihat pada Tabel 8. Kromatogram sampel oligosakarida hasil evaporasi 2.5% diperoleh tujuh puncak. Dari ketujuh puncak tersebut didapatkan tiga senyawa yang waktu retensinya tidak jauh berbeda dengan standar yaitu glukosa, maltosa, maltotriosa, dan maltopentosa dengan waktu retensi berturut-turut sebesar 4.853, 5.393, 6.128, 8.002. Konsentrasi oligosakarida tertinggi terdapat pada senyawa maltosa sebesar 3658.185 ppm. Pada konsentrasi 5% diperoleh tujuh puncak dengan waktu retensi yang berbeda-beda. Konsentrasi senyawa oligosakarida tertinggi terdapat pada maltosa yaitu sebesar 4555.895 ppm. Pada konsentrasi 10% diperoleh delapan puncak, empat diantaranya memiliki senyawa oligosakarida maltosa, maltotriosa, dan maltopentosa. Senyawa oligosakarida tertinggi yaitu maltosa sebesar 8642.980 ppm. Total konsentrasi tertinggi pada sampel hasil evaporasi 10% yaitu sebesar 18854.632 ppm
Tabel 8 Waktu retensi dan konsentrasi sampel hasil evaporasi
Sampel Standar Rt Konsentrasi
(ppm)
2.5% Glukosa 4.853 -
Maltosa 5.393 3658.185
Maltotriosa 6.128 1432.564
Total
Maltopentosa 8.002 1540.334
6631.083
5% Glukosa 4.831 73.982
Maltosa 5.447 4555.895
Maltotriosa 6.212 2704.376
Total
Maltopentosa 8.063 2819.479
10153.732
10% Glukosa 4.788 81.557
Maltosa 5.392 8642.980
Maltotriosa 6.117 4592.050
Total
Maltopentosa 7.992 5538.045
18854.632
Perbedaan waktu retensi disebabkan adanya perbedaan berat molekul dari senyawa yang terdapat di dalam sampel. Waktu retensi yang mendekati antar komponen sampel dengan standar menunjukkan komponen yang dikandung sampel sama dengan standar. Bobot molekul dari yang terkecil hingga yang terbesar berturut-turut dari glukosa, maltosa, maltotriosa, dan maltopentosa. Glukosa (C6H12O6) memiliki bobot molekul sebesar 180.116, maltosa (C12H22O11) sebesar 342.31, maltotriosa (C18H32O16) sebesar 504.40, maltopentosa (C30H52O26) sebesar 828.70 (Lee 2003). Berdasarkan perbedaan tersebut waktu retensi glukosa lebih cepat dan waktu retensi maltopentosa lebih lama.
SIMPULAN DAN SARAN
Simpulan
Enzim yang digunakan dalam hidrolisis enzimatis pati kentang hitam berasal dari
13
Saran
Analisis oligosakarida pada pati kentang hitam dengan HPLC perlu dilakukan lebih lanjut agar diproleh oligosakarida yang murni. Pemurnian dengan HPLC harus dilakukan dengan kolom yang lebih besar dan volume injek yang lebih besar pula sehingga oligosakarida yang murni dapat diperoleh. Selain itu standar yang digunakan lebih bervariasi sehingga senyawa-senyawa yang terdapat di dalam sampel dapat teridentifikasi lebih banyak.
DAFTAR PUSTAKA
Akyuni D. 2004. Pemanfaatan pati sagu (Metrocylon sp.) untuk pembuatan
sirup glukosa menggunakan α-amilase dan amiloglukosidase [Skripsi]. Bogor: Institut Pertanian Bogor, Fakultas Teknologi Pertanian.
Aiyer PV. 2005. Amylases and their application. J Biotechnol 4 (13): 1525– 1529.
Apriyantono A, Fardiaz, Puspitasari NL, Budiyanto S. 1989. Analisis Pangan. Bogor: PAU Pangan dan Gizi
Bernfeld P. 1λ55. Amylase α- and β -Methodes. J Enzymol: 149-158.
Conkerton EJ, Parrish FW, Capital DC, Ory RL. 1983. Isolation of a stachyose-sucrose complex from soybeans and peanuts. J Food Science 48:1269-1271. Dinoto A, Rahayu RD, Satyaningtijas A.
2010. Perubahan kadar kolesterol serum pada tikus setelah mengkonsumsi maltooligosakarida yang disintesis secara enzimatik menggunakan amilase Bacillus licheniformis BL1. Berita Biologi 10: 1-4
Dubois, Gilles KA, Hamilton JK, Rebers PA, Smith F. 1956. Colorimetric method for determination of sugar and related substance. J Anal Chem 28: 350 – 356. Du H & Chen XQ (2009). Comparative study
of the separation ofoleanolic acid and ursolic acid in Prunella vulgaris by High Performance Liquid Chromatography and Cyclodextrin-Modified Micellar Electrokinetic Chromatography. J. Iran Chem. Soc., 6(2):334-340.
[FAO] Food Agriculture Organization. 2007. FAO Technical Meeting on Prebiotics. Roma: FAO.
Fai YM, Tao CC (2009). Literature review on Pharmacutical activitiesof oleanolic acid. Nat. Proda Med., 2: 291-298. Feng JH, Chen W, Zhao Y, Ju XL (2008).
Anti-tumor activity ofoleanolic, ursolic and glycyrrhetinic acid. Open Nat. Prod. J., 2: 48-52.
Gruner E and Alexander. 1993. Characterization of Brevibacterium sp.
from Clinical Specimens Journal of Clinical Microbiology: American. Vol 3(6), hal.1.
Lee JW, Kwon TO, Moon IS. 2003. Adsorption of monosaccharides,
disaccharides, and
maltooligisaccharides on activated carbon for separation of maltopentaose.
J Carbon 42: 371-380.
Manning T, Gibson GR. 2004. Prebiotics: Best practice and research. J Clinical Gastroenterol 28 (12): 287 – 298.
Marlis Agani. 2008. Isolasi Oligosakarida Ubi Jalar (Ipomoea batatas L.) dan Pengaruh Pengolahan terhadap Potensi Prebiotiknya [Tesis]. Sekolah Pascasarjana. Institut Pertanian Bogor. Tidak dipublikasikan.
Marks, Dawn B, Allan D. Marks & Collen M. Smith. 2000. Biokimia Kedokteran Dasar: Sebuah Pendekatan Klinis (Basic Medical Biochemistry: A Clinical Approach). Joko Suyono, Vivi Sadikin, Lydia I. Mandera (eds). ECG, Jakarta.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. J Anal Chem 31: 426-428.
Nakakuki T. 2002. Present status and future of functional oligosaccharides development in Japan. J Pure Appl Chem 74 (7): 1245 – 1251.
Nugraheni M. 2011. Pengaruh Coleus tuberosus terhadap in vitro antioksidan, mencegah perbanyakan sel, dan apoptosis [Disertasi]. Yogyakarta: Universitas Gajah Mada, Fakultas Teknologi Pertanian.
14
Karbohidrat dari Umbi Kentang Hitam (Coleus tuberosus Benth), Ubi Kayu (Manihot esculenta) [Laporan Teknis]. Bogor: Lembaga Ilmu Pengetahuan Indonesia.
Rahmani N, Yopi, Andriani A, Prima A. 2011. (b) Production and characterization of amylase enzyme from marine bacteria. Proceedings of the International Seminar on Chemistry for a better future, 24-25 November 2011, Jatinangor.
Robyt JF, Ackerman RJ. 1971. Isolation, Purification, and Characterization of a maltotetraose-producing amylase from
Pseudomonas stutzeri. Arch Biochem Biophys. 145: 14-105
Rohanah.2012. Peranan Enzim Amilase dari
Brevibacterium sp. dalam Menghidrolisis Pati Kentang Hitam [Skripsi]. Bogor. Institut Pertanian Bogor, Fakultas Teknologi Pertanian.
Ruberfroid M. 2007. Prebiotics: the concept revisited. J Nut 137: 830-837.
Rycroft CE, MR Jones, GR Gibson, and RA Rastall. 2001. A Comparative in Vitro Evaluation of the Fermentation Properties of Prebiotic Oligossacharides. Journal of Applied Microbiology 91, 878-887
Sakuma K. 2002. Molecular Mechanism of the Effect of Fructooligossacharides on Calcium Absorption, Bioscience Microflora 21, 13-20.
Sachslehner A, Gabriele F, Nikolaus F, Georg Gu bitz, and Dietmar H. 2000. Hydrolysis of Isolated Coffee Mannan and Coffee Extract by Mannanases of
Sclerotium rolfsii. Journal of Biotechnology 80:127-134.
Soga T. 2002. Analysis of carbohidrates in food and bevarages by HPLC and CE. J Cromatogy Library 66:483-502.
Suskovic J et al. 2001. Role of lactic acid bacteria and bifidobacteria in symbiotic effect. J of Food Technology and Biotechnology 39 (3): 227-235.
Takasaki Y. 1982.Producing of Maltohexaosa
by α-amylase from Bacillus circulans
G-6.Agric Biol Chem 46: 52-345. Taniguchi H, Jae CM, Yoshigi N, Maruyama
Y. 1983. Purification of Bacillus
circulans F-2 Amylase and its General Properties. Agric Biol Chem 47: 9-511 Wako K, Hashimoto S, Kubomura S, Yokota
K, Aikawa K, Kanaeda J. 1979. Purification and some Properties of a Maltotriose-producing Amylase. J Jpn Soc Starch Sci. 26: 81-175.
Weston RJ, Brockleblank LK. 1999. The oligosaccharide composition of some New Zealand honeys. Food Chem
64:33-37
Winarno. 2010. Enzim Pangan. Bogor: M-Brio press.
Yoon H, Liu RH (2008). Effect of 2 α -hidroxyursolic acid on NF-Bactivation induced by TNF-α in human breast cancer MCF-7 cells. J.Agric. Food Chem., 56: 8412-8417.
15
16
Lampiran 1 Diagram alir penelitian
Produksi ekstrak kasar enzim amilase
Hidrolisis pati kentang hitam sampel segar, sampel freeze dry, dan
sampel evaporasi
Analisis komposisi karbohidrat (TLC gula reduksi,
gula total, dan derajat polimerasi)
Analisis profil
oligosakarida dengan
17
Lampiran 2 Hidrolisis substrat
Substrat 2.5% + ekstrak kasar enzim amilase
(perbandingan 1:5)
Hidrolisis enzimatis selama 4 jam, suhu 30
oC
Hasil hidrolisis
Dipanaskan disuhu 100
oC
Hidrolisis enzimatis selama 4 jam, suhu 30
oC,
Disentrifus 12000 rpm, 15 menit, 4
oC
Pelet dibuang
supernatan
Analisis gula total,
gulareduksi, derjat
polimerasi, TLC, dan
HPLC
Freeze drying dan evaporasi
Oligosakarida hasil pemekatan
18
Lampiran 3 Standar glukosa dan nilai aktivitas enzim
Aktivitas Enzim Amilase dari Brevibacterium sp. pada panjang gelombang 540
nm
No Enzim
Absorban Sampel Absorban
Kontrol (K) Rerata-K ppm sampel
Aktivitas enzim U/mL
1 2
1 0.394 0.427 0.276 0.134 87.750 3.250
2 0.355 0.352 0.272 0.081 61.250 2.268
3 0.334 0.333 0.214 0.119 80.250 2.972
4 0.380 0.296 0.291 0.047 44.000 1.629
Rumus aktivitas enzim
Aktivitas Enzim =
Keterangan:
C
: Konsentrasi sampel (mg/mL)
Fp
: Faktor Pengenceran
t
: Waktu
BM
: Bobot molekul
[Glukosa] (ppm)
Absorban
RerataAbsorban
(
)
Ulangan 1
Ulangan 2
Blanko
0
0
0
0.2
0.040
0.036
0.038
0.4
0.135
0.158
0.146
0.6
0.284
0.282
0.283
0.8
0.383
0.405
0.394
19
Lampiran 4 Kurva kalibrasi glukosa
[Glukosa]
(ppm)
Absorban
Rerata
Absorban (
)
Ulangan 1
Ulangan 2
0
0
0
0
62.5
0.072
0.085
0.08
125
0.259
0.268
0.26
250
0.579
0.597
0.59
500
1.224
1.24
1.23
1000
2.101
2.114
2.11
20
Lampiran 5 Hasil analisis kandungan gula pada sampel segar
Analisis gula total pada kondisi optimum konsentrasi 2,5%, suhu ruang, waktu 4
jam, perbandingan enzim:substrat = 1:5
Ulangan Absorban Kontrol
S-K
Gula total
1
0.633
0.187
0.446
89,194
2
0.725
0.155
0.570
113,994
3
0.653
0.197
0.456
91,194
Rerata
0.670
0.179
0.490
95600
Fp = 400x
y = 0.002x + 0.012
y = absorbansi
x = konsentrasi gula pereduksi (ppm)
Analisis gula reduksi pada kondisi optimum konsentrasi 2,5%, suhu ruang, waktu
4 jam, perbandingan enzim:substrat = 1:5
Ulangan Absorban Kontrol
S-K
Gula reduksi
1
0.277
0.018
0.259
2
0.280
0.018
0.262
3
0.272
0.018
0.254
Rerata
0.276
0.018
0.258
7482.5
Perhitungan Gula reduksi sampel segar:
Persamaan kurva standar glukosa: y= 0.002x
–
0.041
Fp = 50x
Derajat Polimerasi =
=
21
Lampiran 6 Hasil analisis kandungan gula sampel freeze dry
Gula Total sampel hasil Freeze Dry
Ulangan Absorban Kontrol
S-K
Gula total
1
0.523
0.187
0.336
2
0.538
0.155
0.383
3
0.543
0.197
0.346
Rerata
0.535
0.179
0.357
69000
Fp = 400x
Y = 0.002X + 0.012
Gula reduksi hasil freeze dry
Ulangan Absorban Kontrol
S-K
Gula reduksi
1
0.334
0.020
0.015
2
0.411
0.022
0.023
3
0.352
0.020
0.017
Rerata
0.3656
0.0207
0.345
9647.5
Fp = 50x
Y = 0.002x + 0.041
0.3449= 0.002x
–
0.041
X = 192.95 ppm x 50
= 9647.5 ppm
Derajat Polimerasi =
=
22
Lampiran 7 Hasil analisis kandungan gula sampel evaporasi
Gula total sampel hasil evaporasi
Ulangan Absorban Kontrol
S-K
Gula total
1
0.536
0.187
0.336
2
0.591
0.155
0.383
3
0.489
0.197
0.346
Rerata
0.5387
0.179
0.359
69540
Fp = 400x
Y = 0.002X + 0.012
Gula reduksi hasil sampel evaporasi
Ulangan Absorban Kontrol
S-K
Gula reduksi
1
0.677
0.044
0.259
2
0.535
0.043
0.262
3
0.571
0.030
0.254
Rerata
0.5943
0.039
0.555
14908.3
Perhitungan Gula reduksi oligosakarida hasil evaporasi:
Fp = 50x
Y = 0.002x + 0.041
Derajat Polimerasi =
=
23
Lampiran 8 Kromatogram Standar dengan perbandingan fase gerak 75:25
kecepatan aliran 1.4 mL/min
Standar
Waktu Retensi
Konsentrasi (ppm)
Glukosa
6.314
50000
Maltosa
10.371
50000
Maltotriosa
16.783
5000
24
Lampiran 9 Kromatogram Standar dengan perbandingan fase gerak 60:40
kecepatan aliran 1 mL/min
Standar
Waktu Retensi
Konsentrasi (ppm)
Glukosa
4.742
50000
Maltosa
5.309
50000
Maltotriosa
5.977
5000
25
26
27
28
29
30
31