REFORMULASI MIKROENKAPSULASI MINYAK SAWIT
DENGAN TEKNIK KOASERVASI, PENGERINGAN LAPIS
TIPIS, DAN PENYERAPAN SiO
2RACHEL IRENE M.S.
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Reformulasi Mikroenkapsulasi Minyak Sawit dengan Teknik Koaservasi, Pengeringan Lapis Tipis, dan Penyerapan SiO2 adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013
Rachel Irene M.S.
ABSTRAK
RACHEL IRENE M.S. Reformulasi Mikroenkapsulasi Minyak Sawit dengan Teknik Koaservasi, Pengeringan Lapis Tipis, dan Penyerapan SiO2. Dibimbing
oleh TIEN R. MUCHTADI dan NUR WULANDARI.
Kasus kekurangan vitamin A (KVA) masih sering ditemukan di Indonesia. Di sisi lain, Indonesia merupakan produsen kelapa sawit terbesar di dunia. Kandungan β-karoten dalam minyak sawit sangat tinggi sehingga memiliki potensi besar untuk mengatasi kasus KVA. Dengan membuat mikroenkapsulat minyak sawit, β-karoten dalam minyak sawit yang merupakan provitamin A menjadi lebih stabil dan memiliki masa simpan lebih lama.
Terdapat tiga metode pembuatan mikroenkapsulat yang digunakan dalam penelitian ini, yaitu teknik koaservasi, metode pengeringan lapis tipis, dan metode penyerapan SiO2 – yang secara teoritis sesuai untuk menyalut β-karoten dalam
minyak sawit. Hasil uji ANOVA pada taraf signifikansi 5% menunjukkan bahwa perbedaan metode berpengaruh nyata terhadap daya serap air, kelarutan dalam air, rendemen, efisiensi, serta kandungan dan retensi β-karoten mikroenkapsulat. Mikroenkapsulat hasil pengeringan lapis tipis memiliki kadar β-karoten tertinggi sebesar 200,16 ppm dengan retensi 68,89%. Mikroenkapsulat ini juga memiliki daya serap air yang rendah serta kelarutan dalam air yang tinggi sehingga dapat diaplikasikan sebagai premix.
Kata kunci: β-karoten, kekurangan vitamin A (KVA), mikroenkapsulasi, minyak sawit
ABSTRACT
RACHEL IRENE M.S. Reformulation of Palm Oil Microencapsulation by Coacervation, Thin Layer Drying, and Silicca Dioxide Absorption Technique. Supervised by TIEN R. MUCHTADI and NUR WULANDARI.
Cases of vitamin A deficiency (VAD) are often found in Indonesia. On the other hand, Indonesia is the largest palm oil producer in the world. The content of
β-carotene, which is a provitamin A, in palm oil is relatively high, so that it has a great potential for overcoming cases of VAD. By microencapsulation process of
palm oil, β-carotene content in palm oil will be more stable and have a longer shelf life.
There are three methods used in this study, namely coacervation, thin-layer drying, and SiO2 absorption technique – teoretically they are suitable for
encapsulating β-carotene in palm oil. Results of ANOVA test at 5% significance level showed that the differences in methods significantly affect water absorption, solubility in water, yield, efficiency, and the β-carotene content and retention of microencapsulate. The microencapsulate made by thin-layer drying method had the highest levels of β-carotene at 200.16 ppm with retention 68.89%. It also had low water absorption and high water solubility so that it can be applied as a premix.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
REFORMULASI MIKROENKAPSULASI MINYAK SAWIT
DENGAN TEKNIK KOASERVASI, PENGERINGAN LAPIS
TIPIS, DAN PENYERAPAN SiO
2RACHEL IRENE M.S.
DEPARTEMEN ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
Disetujui oleh,
Judul Skripsi : Reformulasi Mikroenkapsulasi Minyak Sawit dengan Teknik Koaservasi, Pengeringan Lapis Tipis, dan Penyerapan SiO2
Nama : Rachel Irene M.S. NIM : F24090092
Disetujui oleh
Prof. Dr. Ir. Tien R. Muchtadi, MS. Pembimbing I
Dr. Nur Wulandari, S.TP, MSi Pembimbing II
Diketahui oleh
Dr. Ir. Feri Kusnandar, M.Sc Ketua Departemen
PRAKATA
Puji dan syukur kepada Tuhan Yesus Kristus atas kasih, berkat, dan penyertaan-Nya sehingga penulis dapat menyelesaikan tugas akhir ini. Tugas akhir yang telah dilaksanakan sejak Februari hingga Juni 2013 ini dapat terselesaikan dengan baik berkat dukungan dari berbagai pihak, baik secara langsung maupun tidak langsung. Oleh karena itu, penulis ingin menyampaikan ucapan terima kasih kepada:
1. Prof. Dr. Ir. Tien R. Muchtadi, MS selaku dosen pembimbing akademik, atas bimbingan, ajaran, serta perhatian yang telah diberikan selama kuliah hingga penyelesaian tugas akhir ini.
2. Dr. Nur Wulandari, S.TP selaku dosen pembimbing akademik kedua, atas masukan dan perhatian yang diberikan selama penyelesaian tugas akhir ini. 3. Dr. Nugraha Edhi Suyatma, S.TP, DEA selaku dosen penguji yang telah
bersedia menyempatkan waktu serta memberikan saran untuk perbaikan skripsi ini.
4. Papa, Mama, dan Yosef atas dukungan, kasih sayang, perhatian, dan pengertiannya pada penulis selama menyelesaikan pendidikan di Institut Pertanian Bogor. Terima kasih pula kepada keluarga besar penulis atas dukungan dan doanya sehingga tugas akhir ini dapat terselesaikan dengan baik.
5. Pak Yahya, Bu Rubiyah, Mbak Vera, Pak Sobirin, Pak Rojak, dan Bu Antin selaku teknisi laboratorium Departemen Ilmu dan Teknologi Pangan yang telah banyak membantu dan memberi masukan serta ilmu kepada penulis selama melaksanakan tugas akhir. Penulis juga berterima kasih kepada Bu Novi dan Mbak Mei yang telah banyak membantu dalam urusan administrasi selama masa perkuliahan.
6. Pihak Beasiswa Djarum Plus yang telah memberikan bantuan dana serta
softskill yang dapat penulis gunakan tidak hanya pada saat menyelesaikan pendidikan di Institut Pertanian Bogor, tetapi juga dapat menjadi bekal untuk masa depan kelak. Terima kasih pula kepada teman-teman Beswan Djarum Angkatan 27, terutama Pricilia, Charles, dan Trina Kharisma atas persahabatan dan dukungan yang diberikan kepada penulis bahkan sejak tema tugas akhir ini masih berupa gagasan untuk Writing Competition Beswan Djarum.
7. Direktur Penelitian dan Pengabdian kepada Masyarakat, Direktorat Jenderal Pendidikan Tinggi Kementerian Pendidikan dan Kebudayaan RI (DIKTI), atas bantuan pembiayaan penelitian melalui Hibah Kompetensi Nomor 035/SP2H/PL/DIT.LIT ABMAS/V/2013.
teman-teman lainnya yang melakukan penelitian bersama-sama dengan penulis, atas dukungan, kerja sama, serta segala masukan yang diberikan selama melaksanakan penelitian. Terima kasih kepada rekan-rekan Himitepa IPB, baik yang saya kenal dari kepanitiaan maupun dari kepengurusan, khususnya kepada M. Iqbal, Trina Kharisma, Devi Ardelia P., Dewi Ratna Sari, R. Dani Briantoto, Vincentia S. Smaratika, Corazon Nikijuluw, Ananditya Nugraha, Ajie Pambudi, dan Seno Suwikatmono selaku BPH dan Kadiv Himitepa 2011-2012.
9. Pihak-pihak lain yang tidak dapat disebutkan satu per satu yang telah membantu penulis, baik secara langsung maupun tidak langsung, dalam penyelesaian tugas akhir.
Akhir kata, penulis menyadari bahwa skripsi ini masih belum sempurna dan masih memerlukan masukan serta saran. Penulis juga berharap agar skripsi ini dapat bermanfaat bagi seluruh pihak yang membutuhkan dan berdampak terhadap pengembangan ilmu dan teknologi khususnya dalam bidang Ilmu dan Teknologi Pangan.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
METODE 6
Bahan 6
Alat 7
Tahapan Penelitian 7
Rancangan Percobaan 7
Prosedur Analisis Data 8
HASIL DAN PEMBAHASAN 13
SIMPULAN DAN SARAN 27
Simpulan 27
Saran 27
DAFTAR PUSTAKA 27
LAMPIRAN 32
DAFTAR TABEL
1 Metode mikroenkapsulasi 6
2 Hasil analisis minyak sawit sebelum dan setelah degumming 14 3 Karakteristik kimia produk mikroenkapsulat minyak sawit 18
DAFTAR GAMBAR
1 Struktur β-karoten dan isomernya 4
2 Struktur mikroenkapsulat 5
3 Grafik hasil analisis kandungan β-karoten mikroenkapsulat 20 4 Grafik hasil analisis retensi β-karoten mikroenkapsulat 20 5 Grafik hasil analisis rendemen dan efisiensi mikroenkapsulat minyak
sawit 22
6 Grafik hasil analisis kadar lemak tersalut dan kadar lemak tidak tersalut 22 7 Grafik hasil analisis daya serap air dan kelarutan dalam air
mikroenkapsulat minyak sawit 24
8 Reaksi antara formaldehida dan asam kromatoprat 26
DAFTAR LAMPIRAN
1 Diagram umum penelitian 32
2 Diagram alir pembuatan mikroenkapsulat minyak sawit 33 3 Hasil uji t berpasangan analisis minyak sawit sebelum dan setelah
degumming 36
4 Kenampakan produk mikroenkapsulat yang dibuat 37
5 Bentuk mikroenkapsulat dengan mikroskop polarisasi perbesaran
40x100 37
6 Hasil uji kualitatif residu formalin mikroenkapsulat hasil koaservasi
pemisahan fase kompleks 38
7 Hasil uji ANOVA dan uji lanjut Duncan analisis kandungan β-karoten
mikroenkapsulat minyak sawit 39
8 Hasil uji ANOVA dan uji lanjut Duncan analisis retensi β-karoten
mikroenkapsulat minyak sawit 40
9 Penentuan takaran saji mikroenkapsulat minyak sawit 40 10 Hasil uji ANOVA dan uji lanjut Duncan analisis efisiensi
mikroenkapsulat minyak sawit 41
11 Hasil uji ANOVA dan uji lanjut Duncan analisis rendemen
mikroenkapsulat minyak sawit 42
12 Hasil uji ANOVA dan uji lanjut Duncan analisis daya serap air
mikroenkapsulat minyak sawit 43
13 Hasil uji ANOVA dan uji lanjut Duncan analisis kelarutan
mikroenkapsulat minyak sawit 44
PENDAHULUAN
Latar Belakang
Kekurangan vitamin A merupakan salah satu masalah gizi yang tersebar di seluruh dunia, terutama di negara berkembang seperti Indonesia. Berdasarkan studi yang dilakukan Departemen Kesehatan RI pada tahun 2010, hampir 50% atau 10 juta bayi dan balita tidak memperoleh vitamin A secara cukup. Menurut Nadimin (2011), kekurangan vitamin A dalam makanan sehari-hari menyebabkan setiap tahunnya sekitar 1 juta balita di seluruh dunia menderita penyakit mata tingkat berat (xeropthalmia), 25% di antaranya menjadi buta dan 60% dari yang buta ini akan meninggal dalam beberapa bulan. Kematian dapat terjadi apabila penderita KVA terjangkit penyakit infeksi seperti campak dan diare karena infeksi akan menghambat penyerapan zat gizi oleh tubuh serta mengikis habis simpanan vitamin A dalam tubuh (Nadimin 2011).
Di sisi lain, Indonesia merupakan negara penghasil minyak sawit yang merupakan sumber provitamin A terbanyak dibandingkan bahan-bahan alami lainnya. Berdasarkan data yang diperoleh dari Badan Pusat Statistik (2012), pada tahun 2010 luas perkebunan kelapa sawit di Indonesia mencapai 5.161.600 hektar dan angka tersebut terus mengalami peningkatan sejak tahun 1995. Sejak tahun 2006, Indonesia juga telah menjadi produsen minyak sawit terbesar di dunia, di mana pada tahun 2010 produksi minyak sawit kasar Indonesia mencapai 14.038.148 ton. Menurut Sumarna (2006), keunikan minyak sawit dibandingkan dengan minyak lain adalah kandungan β-karotennya yang sangat tinggi, setara dengan 60.000 IU aktifitas vitamin A. Namun, β-karoten sangat tidak stabil, terutama apabila terpapar oksigen, suhu tinggi, serta logam.
Untuk dapat memanfaatkan β-karoten dalam minyak sawit secara optimal, perlu dilakukan upaya untuk melindungi dan menjaga kestabilannya dari lingkungan. Salah satu upaya yang dapat dilakukan adalah dengan melakukan penyalutan dalam bahan penyalut tertentu. Saat ini, penyalutan bahan pangan untuk pembuatan produk farmasetikal dapat dilakukan dengan teknik mikroenkapsulasi.
Penelitian mengenai mikroenkapsulasi minyak sawit telah banyak dilakukan, di antaranya dengan menggunakan teknik koaservasi, spray drying, thin-layer drying, orifice process, serta teknik penyerapan SiO2. Namun, belum diketahui
metode mikroenkapsulasi terbaik untuk menghasilkan mikroenkapsulat minyak sawit dengan kandungan dan retensi β-karoten tertinggi. Oleh karena itu, perlu dilakukan penelitian untuk membandingkan kandungan dan retensi β-karoten dalam mikroenkapsulat yang terbuat dari metode-metode yang umum digunakan, yaitu teknik koaservasi, thin-layer drying, serta teknik penyerapan SiO2. Selain
umum digunakan, ketiga metode tersebut dipilih karena secara teoritis sesuai untuk menyalut β-karoten dalam minyak sawit.
2
vitamin A yang dapat dikonsumsi untuk mencukupi kebutuhan vitamin A masyarakat Indonesia.
Tujuan Penelitian
Penelitian ini dilaksanakan dengan tujuan mendapatkan metode mikroenkapsulasi minyak sawit dengan kandungan dan retensi β-karoten tertinggi disertai karakteristik fisik produk mikroenkapsulat yang baik dengan cara membandingkan produk mikroenkapsulat yang dihasilkan dari tiga metode mikroenkapsulasi, yaitu teknik koaservasi, pengeringan lapis tipis, serta penyerapan SiO2.
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi mengenai metode mikroenkapsulasi terbaik yang menghasilkan mikroenkapsulat minyak sawit yang dapat dimanfaatkan sebagai suplemen vitamin A.
TINJAUAN PUSTAKA
Minyak Sawit
Elaeis guineensis Jacq. atau yang sering disebut kelapa sawit adalah spesies yang paling penting dalam genus Elaeis yang termasuk ke dalam famili Palmae. Jenis E. guineensis dapat dibedakan berdasarkan pigmentasi dan karakteristik buahnya, yang paling umum adalah Dura, Tenera, dan Pisifera yang diklasifikasikan berdasarkan ketebalan endokarp dan isi mesokarp. Jenis Dura memiliki ketebalan endokarp 2-8 mm dengan isi mesokarp medium (35-55% dari berat buah), jenis Tenera memiliki ketebalan endokarp 0.5-3 mm dan isi mesokarp tinggi (60-95% dari berat buah), dan jenis Pisifera tidak memiliki endokarp dan isi mesokarpnya sekitar 95% berat buah (Hai 2002).
Minyak sawit berasal dari bagian buahnya. Buah diproses dengan melunakkan daging buah pada temperatur 90oC, lalu dipisahkan dari bagian inti dan cangkang dengan dikempa (pressing) sehingga dihasilkan minyak sawit kasar (CPO). Pengolahan CPO melalui proses fraksinasi berdasarkan perbedaan titik leleh menghasilkan beberapa fraksi yang selanjutnya diolah sesuai dengan produk yang diinginkan. Fraksi cair atau olein merupakan bahan baku minyak goreng dan memiliki keunggulan daya tahan oksidasi yang lebih baik dan stabil pada suhu tinggi (Syahputra et al. 2008).
3 (Ayustaningwarno 2012). Menurut Bonnie dan Choo (2000), ubiquinon yang terkandung dalam minyak sawit berpotensi meningkatkan sistem imun, mencegah penyakit jantung dan hipertensi, serta mencegah kerusakan sel darah merah karena oksidasi. β-karoten sendiri merupakan provitamin A yang dapat diubah menjadi vitamin A di dalam tubuh.
Selama ini, minyak sawit menjadi bahan baku pembuatan minyak goreng, margarin, shortening, dan vanaspati. Namun, potensi komponen minor dalam minyak sawit dapat dimanfaatkan juga dalam industri farmasetikal dan nutrasetikal. Produk turunan seperti minuman emulsi maupun fat spread yang kaya β-karoten juga dapat dibuat dari minyak sawit (Ayustaningwarno 2012).
Akan tetapi, terdapat pula komponen minor yang perlu dihilangkan dari minyak sawit, misalnya gum dan logam berat. Menurut Sumarna (2006), gum dapat mengganggu proses pengolahan minyak sawit sehingga diperlukan proses untuk menghilangkannya. Beberapa cara yang dapat dilakukan untuk proses
degumming atau penghilangan gum adalah pemanasan, penambahan asam (H3PO4,
H2SO4, dan HCl) atau basa (NaOH), pemisahan gum dengan cara hidrasi, atau
pemisahan gum dengan menggunakan garam seperti natrium klorida dan natrium fosfat (Sumarna 2007). Proses degumming yang baik diharapkan dapat meningkatkan kualitas minyak yang dihasilkan dan meningkatkan rendemen serta menekan kerusakan β-karoten (Sumarna 2006).
β-Karoten
β-karoten merupakan salah satu jenis karotenoid yang dapat dikonsumsi oleh manusia. β-karoten yang memiliki rumus molekul C40H56 dengan 11 ikatan
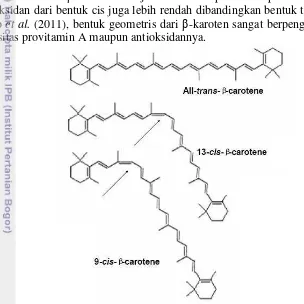
rangkap merupakan bentuk provitamin A yang banyak terkandung dalam buah dan sayur dan biasanya hanya dikonsumsi dalam jumlah sedikit. β-karoten merupakan sumber vitamin A yang efektif baik untuk pangan konvensional maupun suplemen (Hathcock 2004). Vitamin A berguna dalam membantu proses penglihatan, pertumbuhan tulang dan gigi, reproduksi, pertahanan keutuhan jaringan epitel, kekebalan tubuh, pembentukan dan pemeliharaan sel-sel kulit, saluran pencernaan, dan selaput kulit, serta dapat mencegah timbulnya penyakit kanker (Syahputra et al. 2008). Struktur β-karoten dan isomernya dapat dilihat pada Gambar 1.
Studi epidemiologi menunjukkan tingginya asupan β-karoten ataupun tingginya kadar β-karoten dalam darah dapat mereduksi risiko berbagai penyakit, seperti kanker dan penyakit jantung. β-karoten dapat mengikat oksigen singlet dan menghambat reaksi radikal bebas sehingga β-karoten dinyatakan memiliki aktivitas antioksidan (Hathcock 2004). β-karoten tidak beracun karena tidak ada bukti mengenai toksisitas vitamin A yang disebabkan oleh konversi β-karoten menjadi vitamin A, bahkan jika β-karoten dikonsumsi dalam jumlah besar. Asupan sebesar 180 mg per hari selama beberapa bulan dapat diberikan kepada manusia tanpa adanya efek samping selain perubahan pada warna kulit (Hathcock 2004). Recommended Dietary Allowance(RDA) untuk β-karoten adalah 1 mg/hari retinol ekuivalen (sekitar 6 mg β-karoten ekivalen).
-4
karoten. Lebih lanjut lagi, β-karoten yang terisomerisasi mudah mengalami degradasi oleh keberadaan oksigen. β-karoten bersifat tidak larut dalam air. Selain itu, β-karoten bersifat peka terhadap oksigen, panas, dan cahaya sehingga membatasi penggunaannya dalam produk pangan, pangan fungsional, dan farmasi (Pahlevi et al. 2008).
Perbedaan struktur isomer β-karoten mempengaruhi aktivitasnya sebagai provitamin A. Menurut Mueller dan Boehm (2011), aktivitas provitamin A cis-β -karoten jauh lebih rendah dibandingkan trans-β-karoten. Konversi 9-cis-β-karoten menjadi retinol hanya 38%, konversi dari 13-cis-β-karoten hanya 53%, sementara konversi all-trans-β-karoten menjadi retinol dapat mencapai 100%. Aktivitas antioksidan dari bentuk cis juga lebih rendah dibandingkan bentuk trans. Menurut Khoo et al. (2011), bentuk geometris dari β-karoten sangat berpengaruh terhadap kapasitas provitamin A maupun antioksidannya.
Gambar 1. Struktur β-karoten dan isomernya (Khoo et al. 2011)
5
Mikroenkapsulasi dan Mikroenkapsulat
Mikroenkapsulasi secara harfiah dapat diartikan sebagai proses pelapisan suatu partikel inti dengan material lainnya agar mempunyai sifat fisik dan kimia sesuai dengan yang dikehendaki (Yanuwar et al. 2007). Produk dari proses mikroenkapsulasi disebut mikroenkapsulat, yaitu kapsul dengan ukuran mikron dan memiliki bentuk spheric maupun tidak beraturan (Ghosh 2006). Menurut Senatore (2008), partikel yang berukuran antara 1-5.000 mikrometer disebut mikropartikel atau mikroenkapsulat, lebih kecil dari 1 mikrometer biasa disebut nanokapsul atau nanopartikel, dan lebih besar dari 5.000 mikrometer disebut makrokapsul atau partikel tersalut.
Mikroenkapsulat terbagi menjadi dua bagian, yaitu bagian inti (core) dan bagian penyalut (shell). Bagian core mengandung komponen aktif, sementara bagian shell melindungi bagian core, baik secara permanen maupun temporer dari lingkungan luar (Ghosh 2006). Struktur mikroenkapsulat dapat dilihat pada Gambar 2.
Menurut Ghosh (2006), bagian core dapat berbentuk padat, cair, maupun gas, dan umumnya berupa materi terlarut, dispersi, maupun emulsi. Kesesuaian bahan inti dengan penyalut merupakan kriteria penting untuk meningkatkan efisiensi mikroenkapsulasi dan praperlakuan dari bahan inti sangat sering dipengaruhi oleh kesesuaian tersebut.
Gambar 2. Struktur mikroenkapsulat (Ghosh 2006)
Proses mikroenkapsulasi dilakukan dengan berbagai tujuan, di antaranya untuk melindungi substansi reaktif dari pengaruh lingkungan, mengubah komponen aktif cair menjadi sistem solid yang kering, memisahkan komponen yang tidak kompatibel untuk alasan fungsional, melindungi lingkungan dari komponen aktif bahan inti, serta mengontrol waktu pelepasan komponen aktif bahan inti (Umer et al. 2011). Selain itu, pembuatan mikroenkapsulat juga dapat menghasilkan produk yang lebih baik saat diproses, memperpanjang umur simpan produk dengan cara mencegah reaksi oksidasi maupun dehidrasi, menutupi karakteristik seperti bau dan rasa yang tidak diinginkan, serta dapat mengimobilisasi enzim maupun mikroorganisme (Ghosh 2006).
Dengan tujuan-tujuan tersebut, proses mikroenkapsulasi biasanya diaplikasikan untuk produk farmasetikal, nutrasetikal, kosmetik, flavor dan
essences, bahan tambahan pangan, serta hasil industri kimia (Umer et al. 2011). Menurut Ghosh (2006), teknik mikroenkapsulasi terbagi menjadi tiga kelompok besar, seperti yang dapat dilihat pada Tabel 1.
6
yang dapat dilakukan untuk membuat mikroenkapsulat minyak sawit adalah
spray-drying, seperti yang dilakukan oleh Haryanti (2010) dan Fasikhatun (2010), namun metode spray-drying kurang sesuai karena kandungan β-karoten mikroenkapsulat yang dihasilkan rendah. Hadi (2009) meneliti pembuatan mikroenkapsulat minyak sawit dengan beberapa metode pengeringan, yaitu menggunakan oven, tray-dryer, spray-dryer, drum-dryer, serta modifikasi tray-dryer. Hasil penelitian tersebut menunjukkan pengeringan menggunakan tray-dryer tipe box yang paling efektif dan efisien untuk pembuatan mikroenkapsulat minyak sawit.
Sementara itu, perbandingan berbagai metode mikroenkapsulasi pernah diteliti oleh Syamsiah (1996) dan Wardayanie (2000), yaitu metode orifice process, teknik koaservasi, dan penyerapan SiO2. Keduanya menyatakan
mikroenkapsulat hasil penyerapan SiO2 sebagai hasil terbaik. Metode lain yang
juga pernah dilakukan adalah dengan pengeringan lapis tipis yang dilakukan oleh Simanjuntak (2007), Yudha (2008), Novia (2009), dan Kristi (2010). Metode ini cukup baik untuk pembuatan mikroenkapsulat minyak sawit, namun belum dilakukan perbandingan dengan metode lainnya. Dalam penelitian ini, pembuatan mikroenkapsulat minyak sawit menggunakan metode fisiko-kimia, yaitu teknik koaservasi serta metode fisik, yaitu metode pengeringan lapis tipis dan penyerapan SiO2.
Tabel 1 Metode mikroenkapsulasi
Metode kimia Metode fisiko-kimia Metode fisik
Suspensi, dispersi, dan emulsi minyak sawit kasar yang diperoleh dari PT. Sinar Meadow International Indonesia dan bahan penyalut berupa gum arab, gelatin, maltodekstrin, dan Carboxyl Methyl Cellulose (CMC) yang diperoleh dari toko bahan kimia di Bogor, serta SiO2 merk
Fluka-60. Bahan lain yang digunakan adalah asam fosfat untuk proses degumming
7 tanur, alat-alat gelas, desikator, alat Soxhlet, labu lemak, alat destruksi protein, alat destilasi, alat destilasi, High Performance Liquid Chromatography (HPLC), dan mikroskop polarisasi (model Olympus C-35AD-4).
Tahapan Penelitian
Penelitian ini terbagi menjadi dua bagian, yaitu penelitian pendahuluan dan penelitian utama. Penelitian pendahuluan terdiri dari dua bagian, yaitu perlakuan
degumming minyak sawit serta analisis minyak sawit sebelum dan setelah
degumming. Analisis yang dilakukan pada penelitian pendahuluan ini berupa analisis proksimat (kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat), analisis kadar asam lemak bebas, analisis bilangan peroksida, serta analisis kandungan β-karoten. Hasil analisis kedua jenis minyak sawit ini kemudian diolah secara statistik menggunakan uji t berpasangan untuk melihat perbedaan nyata antara keduanya setelah dilakukan proses degumming.
Pada penelitian utama, dilakukan mikroenkapsulasi minyak sawit yang telah di-degumming serta analisis mikroenkapsulat minyak sawit yang dihasilkan. Terdapat tiga metode pembuatan mikroenkapsulat yang digunakan pada penelitian ini, yaitu metode pengeringan lapis tipis (Kristi 2010) yang dimodifikasi, metode koaservasi pemisahan fase kompleks (Mustikawati 1998), dan teknik penyerapan SiO2 (Wardayanie 2000). Meskipun pembuatannya tidak dilakukan secara
bersamaan, namun minyak sawit yang digunakan merupakan minyak sawit hasil
degumming dari batch yang sama untuk meminimalisasi perbedaan hasil analisis mikroenkapsulat.
Penelitian utama dilanjutkan dengan analisis mikroenkapsulat minyak sawit yang dihasilkan dengan analisis sifat kimia produk (kadar air, kadar abu, kadar protein, kadar lemak, kadar karbohidrat, serta analisis kandungan dan retensi β-karoten), analisis proses mikroenkapsulasi (analisis rendemen, analisis efisiensi, serta analisis lemak tersalut dan lemak tidak tersalut), dan analisis sifat fisik (analisis bentuk, analisis daya serap air, dan analisis kelarutan). Selain itu, dilakukan analisis residu formalin pada mikroenkapsulat hasil teknik koaservasi. Hasil analisis mikroenkapsulat minyak sawit ini kemudian diolah secara statistik menggunakan uji One-Way ANOVA untuk melihat adanya perbedaan nyata antara ketiga jenis mikroenkapsulat yang dibuat dengan metode yang berbeda. Diagram alir tahapan penelitian ini secara umum dapat dilihat pada Lampiran 1.
Rancangan Percobaan
One-8
Way ANOVA pada taraf signifikansi 5%. Apabila hasil analisis dinyatakan berbeda berdasarkan uji ANOVA, dilakukan uji lanjut Duncan untuk membuktikan perbedaan nyata di antara ketiga metode tersebut.
Prosedur Analisis Data
1. Perlakuan degumming (Mas’ud 2007)
Pertama-tama, sebanyak 1 liter minyak sawit kasar fraksi cair dipanaskan selama 80oC, kemudian ditambahkan asam fosfat 85% sebanyak 0,15 ml. Setelah itu, dilakukan pengadukan selama 15 menit dan didiamkan selama 15 menit pula. Minyak tersebut kemudian disaring dengan kertas saring.
2. Analisis kadar air, metode oven (AOAC 925.10 1995 )
Sampel sejumlah 1-2 g ditimbang dan dimasukkan dalam cawan yang telah dikeringkan dan diketahui bobotnya. Kemudian, sampel dan cawan dikeringkan dalam oven bersuhu 105oC selama 6 jam. Cawan didinginkan dan ditimbang, kemudian dikeringkan kembali sampai diperoleh bobot tetap.
Kadar air (g/100 g basis basah) = W – (W1– W2) x 100
W Keterangan: W = bobot contoh sebelum dikeringkan (g)
W1 = bobot contoh + cawan kering kosong (g)
W2 = bobot cawan kosong (g)
3. Analisis kadar abu, metode oven (SNI 01-2891-1992)
Cawan porselin kering ditimbang, kemudian 2-3 g contoh ditimbang ke dalam cawan porselin tersebut. Setelah itu, contoh dimasukkan ke dalam tanur listrik yang dipanaskan pada suhu 550oC sampai pengabuan sempurna. Setelah pengabuan selesai, cawan contoh didinginkan di dalam desikator, kemudian ditimbang sampai diperoleh bobot tetap.
Kadar abu (g/100 g basis basah) = (W1– W2) x 100
W Keterangan: W = bobot contoh sebelum diabukan (g)
W1 = bobot contoh + cawan setelah diabukan (g)
W2 = bobot cawan kosong (g)
4. Analisis kadar protein, metode Kjeldahl (AOAC 960.52 1995)
Sebanyak 100-250 mg sampel dimasukkan ke dalam labu Kjeldahl, kemudian ditambahkan 1,0±0,1 g K2SO4, 40±10 mg HgO, dan 2±0,1 ml
H2SO4. Labu Kjeldahl kemudian dipanaskan dalam alat destruksi protein
selama 1 jam sampai cairan menjadi jernih, lalu didinginkan. Setelah itu, air destilata ditambahkan secara perlahan lewat dinding labu agar kristal yang terbentuk dari tahap destruksi larut. Isi labu tersebut didestilasi dengan alat destilasi, kemudian ditambahkan 8-10 ml larutan 60% NaOH-5% Na2S2O3.
Sementara itu, erlenmeyer berisi 5 ml larutan H3BO3 yang ditambahkan 1-2
9 dilakukan hingga diperoleh 50 ml destilat. Setelah itu, destilat dititrasi dengan HCl 0,02 N terstandar sampai terjadi perubahan warna menjadi abu-abu. Volume yang diperlukan untuk titrasi dicatat.
%N = (Volume HCl contoh – volume HCl blanko) x N HCl x 14,007 x100 Berat contoh
Kadar protein (g/100 g basis basah) = %N x 6,25
5. Analisis kadar lemak, metode soxhletasi (SNI 01-2891-1992)
Labu lemak dikeringkan dalam oven bersuhu 105oC selama sekitar 15 menit, lalu didinginkan dalam desikator dan ditimbang (W1). Sebanyak 1-2 g
contoh ditimbang dan dimasukkan ke dalam selongsong kertas saring yang dialasi dengan kapas (W2). Setelah itu selongsong kertas yang berisi contoh
disumbat dengan kapas, lalu dikeringkan dalam oven pada suhu tidak lebih dari 80oC selama ± 1 jam. Selongsong kertas yang sudah dikeringkan kemudian dimasukkan ke dalam alat soxhlet yang telah dihubungkan ke labu lemak. Lemak dalam contoh diekstrak dengan heksana selama ± 6 jam. Heksana disuling dan ekstrak lemak dikeringkan dalam oven pengering pada suhu 105oC, didinginkan pada desikator, lalu ditimbang (W3).
Kadar lemak (g/100 g basis basah) = W3– W1 x 100
W2
Keterangan : W1 = Bobot labu lemak kosong (g)
W2 = Bobot contoh (g)
W3 = Bobot labu lemak + lemak hasil ekstraksi (g)
6. Analisis kadar karbohidrat, metode by difference (SNI 01-2891-1992)
Kadar karbohidrat dihitung sebagai sisa dari kadar air, abu, lemak dan protein. Pada analisis ini diasumsikan bahwa karbohidrat merupakan bobot sampel selain air, abu, lemak, dan protein.
Kadar karbohidrat (%) = 100% - (kadar air + kadar abu + kadar protein + kadar lemak)
7. Kadar asam lemak bebas, metode titrasi (SNI 01-3555 1998)
Sampel minyak ditimbang sebanyak 2 g dalam erlenmeyer 250 ml. Setelah itu, ditambahkan alkohol 95% dan dipanaskan dalam penangas air sambil diaduk. Indikator fenolftalein 1% ditambahkan 1-2 tetes, kemudian dititrasi dalam keadaan panas dengan NaOH 0,1 N sampai terbentuk warna merah muda yang tidak berubah selama 10 detik.
Kadar asam lemak bebas (%) = V x N x M 10W Keterangan : V = Volume NaOH (ml)
N = Normalitas NaOH hasil standardisasi (N) M = berat molekul contoh
10
8. Bilangan peroksida, metode titrasi (AOAC 965.33 1990)
Sampel ditimbang sebanyak 5 g ke dalam erlenmeyer 250 ml kemudian ditambahkan sebanyak 30 ml pelarut, dikocok sampai semua sampel larut. KI jenuh ditambahkan sebanyak 0,5 ml, didiamkan selama 2 menit di dalam ruang gelap kemudian ditambahkan 30 ml air destilata. Kelebihan iod dititer dengan larutan tiosulfat 0,1 N, dengan cara yang sama dibuat penetapan untuk blanko.
Bilangan peroksida (meq peroksida/kg contoh) = (Vs – Vb) x N x 1000 W
Keterangan : Vs = Volume Na2S2O3 untuk titrasi contoh (ml)
Vb = Volume Na2S2O3 untuk titrasi blanko (ml)
N = konsentrasi Na2S2O3
W = berat contoh (g)
9. Kandungan β-karoten, metode HPLC (Parker 1992)
a. Persiapan sampel
Sebanyak 0,5-2 g sampel dimasukkan ke dalam tabung reaksi bertutup, kemudian ditambahkan 10 ml larutan KOH 5% dalam metanol kemudian divorteks. Setelah itu, gas nitrogen dihembuskan ke dalam tabung reaksi selama 30 detik lalu ditutup untuk mencegah terjadinya oksidasi β-karoten. Larutan dipanaskan dalam waterbath 65oC selama 30 menit, lalu didinginkan. Setelah itu, ditambahkan 5 ml air, kemudian divorteks. Selanjutnya, ditambahkan 10 ml heksana kemudian divorteks selama 30 detik, tunggu hingga larutan dalam tabung terpisah menjadi dua fraksi, lalu ambil larutan pada fraksi heksana (bagian atas) dan dipindahkan ke tabung reaksi lain sambil dilewatkan pada kertas saring yang telah diberi natrium anhidrous. Langkah ini dilakukan sebanyak tiga kali. Fraksi heksana yang terkumpul diuapkan dengan gas nitrogen hingga kering. Analat kering yang diperoleh dilarutkan dengan 1000 µl fase gerak untuk menghindari terjadinya tailing
pada kromatogram. Selanjutnya, larutan sampel diinjeksikan ke HPLC. Volume larutan sampel yang diinjeksi minimal 2 kali volume sampel loop (20 µl), yaitu 40 µl.
b. Persiapan larutan standar dan pembuatan kurva standar
Seri pengenceran 5x, 10x, 20x, 50x, dan 100x dibuat dari larutan standar β-karoten konsentrasi 440 µg/ml dalam basis 1000 µl. Setiap larutan standar diinjeksikan ke HPLC, minimal dua kali volume sampel loop (20 µl), yaitu 40 µl. Hubungan antara luas peak yang terbaca dengan konsentrasi larutan yang diinjeksikan kemudian diplotkan, di mana luas peak sebagai sumbu y dan konsentrasi larutan sebagai sumbu x.
c. Penentuan kandungan β-karoten dengan HPLC
11
10.Mikroenkapsulasi minyak sawit
a. Metode teknik koaservasi (Mustikawati 1998)
Pada metode ini, digunakan dua jenis bahan penyalut, yaitu gum arab dan gelatin dengan perbandingan 1:1. Keduanya dicampurkan, kemudian ditambahkan minyak sawit hasil degumming dengan perbandingan konsentrat dengan bahan penyalut 1:2 hingga terbentuk emulsi. Setelah itu, pH emulsi diturunkan dengan HCl 0,1 N menjadi 4,0. Kemudian ditambahkan formalin 37% sebanyak 0,15% (volume/volume), lalu diaduk dengan kecepatan 300 rpm selama 20 menit. Kemudian, dilakukan pendinginan hingga suhu 5oC, lalu ditambahkan NaOH 0,1 N untuk meningkatkan pH menjadi 9,0. Setelah itu, dilakukan sentrifugasi hingga bagian padat dan cair terpisah. Bagian padat yang mengendap dicuci sebanyak 2 kali, kemudian dilakukan pengeringan menggunakan freeze dryer pada suhu -50oC selama 72 jam hingga terbentuk mikroenkapsulat.
b. Metode pengeringan lapis tipis (Modifikasi Kristi 2010)
Penyalut berupa gelatin (3%), CMC (1%), dan maltodekstrin (7,5%) dicampurkan kemudian ditambahkan air sebanyak 78% dan dipanaskan hingga suhu 60oC. Setelah itu, suhu campuran diturunkan hingga 45oC. Selanjutnya, campuran penyalut dan air dihomogenisasi selama 8 menit dengan skala 1425 rpm. Kecepatan 1425 rpm diperoleh dari hasil percobaan Kristi (2010) yang menggunakan homogenizer yang sama pada skala 10 pada alat tersebut. Kemudian, ditambahkan 11% minyak sawit ke dalam campuran, lalu campuran dihomogenisasi kembali pada kecepatan yang sama selama 27 menit. Campuran yang dihasilkan dilapiskan ke atas loyang yang dilapisi plastik mika. Tebal lapisan dibuat 1 mm dan diratakan. Setelah itu, lapisan tersebut dikeringkan dengan oven vakum pada suhu 60oC selama 5 jam.
c. Metode penyerapan minyak dengan microporous SiO2 (Wardayanie 2000)
Sejumlah minyak sawit kasar dicampurkan dengan sejumlah senyawa
microporous SiO2 dengan perbandingan formulasi minyak sawit:SiO2 sebesar
1:1, diaduk hingga rata selama 5-10 menit sampai mikroenkapsulat terbentuk.
11.Penetapan rendemen (Zilberboim et al. 1986; Ahn et al. 2007)
Rendemen mikroenkapsulat merupakan rasio antara bahan setelah diproses dengan bahan sebelum diproses dikalikan 100%.
Rendemen = Berat mikroenkapsulat (g) x 100% Berat bahan pembuat mikroenkapsulat (g)
12. Analisis kadar minyak tidak tersalut (Shahidi dan Wanasundara 1997; Akoh dan Min 2002)
12
sampai mencapai berat tetap, kemudian ditimbang. Kadar minyak yang tidak tersalut diperoleh berdasarkan rumus berikut.
Kadar minyak tidak tersalut (%) = wa – wg x 100% ws
Keterangan: wa : berat labu lemak kering (g) wg : berat labu lemak dan sampel (g) ws : berat sampel (g)
13.Penetapan efisiensi (Komari 1997)
Efisiensi mikroenkapsulat merupakan rasio antara berat minyak yang tersalut dibandingkan dengan berat minyak yang ditambahkan pada pembuatan mikroenkapsulat dan dikalikan 100%. Berat minyak yang tersalut diperoleh dari berat lemak total dikurangi berat minyak yang tidak tersalut.
Efisiensi = Berat minyak sawit dalam mikroenkapsulat x 100% Berat minyak sawit yang ditambahkan
14.Analisis residu formalin (SNI 01-2894-1992)
Sebanyak 25 g contoh dihaluskan dengan mortar dan ditambahkan 100 ml air, kemudian didestilasi dengan alat destilasi. Hasil destilasi ditampung dan diambil 1 ml lalu dimasukkan dalam tabung reaksi bertutup. Setelah itu, ditambahkan 5 ml larutan H2SO4 pekat serta sedikit kristal
1.8-dihidroksinaftalen-3,6-disulfonat. Larutan divorteks, lalu diletakkan dalam penangas air selama 15 menit. Adanya formalin dalam contoh ditunjukkan dengan adanya warna ungu terang sampai ungu tua.
15.Penentuan bentuk mikroenkapsulat (Modifikasi Efendi 1994)
Bentuk mikroenkapsulat dapat dilihat menggunakan mikroskop polarisasi dengan pembesaran lensa okuler sebesar 10 kali dan lensa obyektif sebesar 40 kali. Selanjutnya dilakukan pengamatan terhadap dinding mikroenkapsulat yang dihasilkan.
16.Penentuan daya serap air (Beuchat et al. 1975; Messinger et al. 1987)
Sampel sebanyak 1 g dimasukkan ke dalam tabung sentrifus lalu ditambah dengan 10 ml air destilata. Kemudian diaduk dengan kawat (vortex mixer) dan didiamkan pada suhu kamar selama 30 menit. Setelah itu disentrifus pada 5.000 rpm pada alat sentrifus selama 30 menit. Volume air yang bebas atau tidak terserap oleh sampel diukur dengan gelas ukur.
Daya serap air = Vo – Vi x BJ x 100 Berat sampel Keterangan : BJ = berat jenis air (1 g/cm3)
13
17.Penentuan kelarutan (Fardiaz et al. 1992)
Sebanyak 0,75 g bahan ditimbang lalu dilarutkan dalam 100 ml aquades dan disaring dengan penyaring vakum. Kertas saring sebelum digunakan dikeringkan terlebih dahulu dalam oven 105oC sekitar 30 menit lalu ditimbang. Setelah proses penyaringan, kertas saring beserta residu bahan dikeringkan kembali dalam oven pada 105oC kurang lebih tiga jam, didinginkan dalam desikator selama 15 menit lalu ditimbang.
Kelarutan = ( 1 – c – b ) x 100% 100 - % ka x a
100
Keterangan : a = berat contoh yang digunakan (g) b = berat kertas saring (g)
c = berat kertas saring + residu (g) ka = kadar air contoh (%)
HASIL DAN PEMBAHASAN
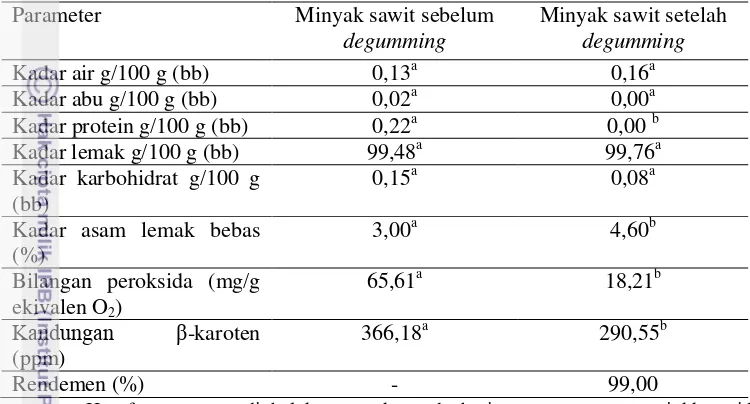
A. Hasil Analisis Minyak Sawit Sebelum dan Setelah Proses Degumming
Pada penelitian pendahuluan, terlebih dahulu dilakukan proses degumming
terhadap minyak sawit. Degumming merupakan proses pemisahan getah atau lendir yang terdiri dari fosfolipid, protein, residu, karbohidrat, air, dan resin (Lin
et al. 1998). Proses degumming yang dilakukan pada penelitian ini merupakan proses dry degumming, yaitu dengan penambahan larutan asam fosfat 85% disertai pemanasan pada suhu 80oC. Rata-rata rendemen dari proses degumming
ini sebesar 99,00%.
Hasil analisis yang diperoleh pada Tabel 2 menunjukkan minyak sawit setelah degumming tidak mengandung abu dan protein. Hal ini menunjukkan bahwa pengotor yang terdapat dalam minyak sawit awal dapat dipisahkan dengan baik melalui proses degumming. Hilangnya abu pada minyak sawit degumming
menunjukkan logam yang ada dalam minyak sawit tersebut juga hilang. Hal ini sejalan dengan hasil analisis bilangan peroksida yang mengalami penurunan setelah dilakukan degumming. Logam yang terdapat dalam minyak merupakan katalis proses oksidasi dalam minyak yang merupakan inisiator terbentuknya peroksida (Sumarna 2007). Asam fosfat yang ditambahkan saat degumming dapat menginisiasi terbentuknya gumpalan sehingga mempermudah pengendapan kotoran, menurunkan bilangan peroksida, dan meningkatkan kestabilan warna minyak (Lin et al. 1998).
14
(Ayustaningwarno 2012). Hasil analisis kadar air juga menunjukkan peningkatan kadar air pada minyak sawit setelah degumming. Oleh karena itu, dapat dibuktikan bahwa telah terjadi reaksi hidrolisis yang menyebabkan kenaikan kadar asam lemak bebas dan kadar air pada minyak sawit degumming.
Tabel 2 Hasil analisis minyak sawit sebelum dan setelah degumming
Parameter Minyak sawit sebelum degumming
Bilangan peroksida (mg/g ekivalen O2)
Pada penelitian ini, pemisahan antara pengotor dengan minyak sawit hasil
degumming dilakukan dengan penyaringan dengan kertas saring. Menurut Ketaren (2008), diperlukan adsorben yang berfungsi menyerap kotoran-kotoran yang tidak diinginkan seperti sedikit logam, air, fosfatida, serta produk degradasi minyak dan kelebihan asam fosfat yang ada setelah proses degumming. Kadar asam lemak bebas minyak sawit degumming masih lebih rendah dibandingkan syarat mutu SNI 01-0016-1998, yaitu 5% sehingga proses netralisasi maupun penambahan absorben tidak dilakukan. Minyak sawit diolah dengan proses minimal berupa
degummingsaja untuk mencegah kerusakan β-karoten lebih lanjut.
Menurut Sumarna (2006), proses degumming yang baik dapat meningkatkan kualitas minyak yang dihasilkan serta menekan kerusakan β -karoten. Namun, hasil analisis β-karoten menunjukkan penurunan kandungan β -karoten minyak sawit setelah proses degumming. Degradasi β-karoten umumnya disebabkan oleh cahaya, oksigen, logam, serta suhu tinggi. Proses degumming
yang dilakukan pada suhu 80oC tentu akan menyebabkan terjadinya kerusakan β -karoten. Selain itu, pigmen dan sebagian kotoran terjebak dalam fosfolipid yang dihilangkan pada proses degumming sehingga kadar β-karoten akan menurun (Sumarna 2006). Namun, selama penyimpanan, penurunan kandungan β-karoten minyak sawit dapat ditekan melalui proses degumming karena pengotor seperti logam yang dapat merusak β-karoten selama penyimpanan telah dihilangkan.
Dari hasil penelitian pendahuluan ini, dapat dilihat adanya pengaruh
15 Lampiran 3. Meskipun kandungan β-karotennya menurun, minyak sawit
degumming memiliki bilangan peroksida yang rendah dan memungkinkan terhambatnya kerusakan β-karoten selama penyimpanan. Selain itu, kadar asam lemak bebas minyak sawit masih di bawah standar SNI 01-0016-1998 sehingga masih layak digunakan untuk bahan baku mikroenkapsulat.
B. Pembuatan Mikroenkapsulat Minyak Sawit
Setelah menghasilkan minyak sawit hasil degumming, penelitian utama dimulai dengan pembuatan mikroenkapsulat minyak sawit dengan tiga metode, yaitu teknik koaservasi, pengeringan lapis tipis, dan penyerapan SiO2. Diagram
alir ketiga metode dapat dilihat pada Lampiran 2. Mikroenkapsulat minyak sawit yang dihasilkan pada penelitian ini dapat dilihat pada Lampiran 4.
1. Teknik Koaservasi
Metode pertama yang digunakan untuk pembuatan mikroenkapsulat minyak sawit adalah teknik koaservasi pemisahan fase kompleks. Secara garis besar, metode ini terdiri dari 3 bagian, yaitu pembentukan tiga fase kimia yang tak tercampurkan, yaitu fase cairan pembawa, fase bahan inti, dan fase bahan penyalut; pencampuran bahan penyalut cair pada bahan inti; dan pengerasan penyalut (Mustikawati 1998). Penyalut yang digunakan adalah gelatin sebagai sumber muatan positif dan gum arab sebagai sumber muatan negatif. Emulsi minyak sawit dan bahan penyalut yang dihasilkan diatur pH-nya hingga mencapai 4,0, yaitu di bawah titik isoelektrik gelatin. Di bawah titik isoelektriknya, gelatin bermuatan positif sedangkan gum arab akan bermuatan negatif. Dari perbedaan muatan tersebut, gum arab yang telah membentuk emulsi dengan minyak sawit akan menarik gelatin yang bermuatan berlawanan membentuk lapisan dinding yang menyelimuti minyak sawit (Efendi 1994).
Penambahan formaldehida sebagai crosslinking agent berfungsi untuk memperkeras dinding mikroenkapsulat yang telah terbentuk sehingga bersifat
irreversible dan mendenaturasikan kompleks protein-gum arab dan mengikat inti lebih permanen (Elisabeth 1992). Menurut Zuidam dan Nedovic (2010), penambahan crosslinking agent merupakan tahap opsional, terutama karena mikroenkapsulat yang dihasilkan akan dikeringkan dengan metode freeze-drying. Akan tetapi, berdasarkan penelitian Siow dan Ong (2013), mikroenkapsulat yang dibuat tanpa penambahan crosslinking agent lebih mudah mengalami kebocoran dibandingkan yang ditambahkan crosslinking agent. Hal ini menyebabkan rendahnya rendemen dan efisiensi mikroenkapsulat yang diperoleh.
Agar dinding mikroenkapsulat semakin kuat, suhu emulsi diturunkan sampai 5oC dan pH-nya dinaikkan menjadi 9,0. Terakhir, dilakukan sentrifugasi dan pencucian untuk memisahkan sisa bahan penyalut yang tidak bereaksi sekaligus mencuci sisa formaldehida. Pengerasan mikroenkapsulat dilakukan dengan freeze-dryeragar kandungan β-karoten dalam mikroenkapsulat tidak rusak akibat suhu tinggi.
16
gumpalan seperti jelly yang porous atau seperti spons yang kenyal karena adanya penambahan gelatin dan dikeringkan dengan freeze-dryer.
Secara teknis, metode ini memiliki kelebihan dan kelemahan. Kelebihannya adalah bahan penyalut yang digunakan, yaitu gum arab dan gelatin, adalah bahan yang mudah diperoleh. Selain itu, proses pengeringan yang dipilih sesuai dengan sifat β-karoten yang mudah rusak pada suhu tinggi. Namun, proses yang harus dilakukan pada metode ini sangat banyak, seperti pengaturan pH, sentrifugasi, dan
freeze-drying sehingga peralatan dan waktu yang dibutuhkan lebih banyak dibandingkan metode lainnya. Banyaknya proses yang dilakukan juga berpotensi merusak β-karoten pada minyak sawit yang digunakan sehingga retensi β-karoten mikroenkapsulat yang dihasilkan akan kurang baik.
Kelemahan lainnya adalah pemakaian formaldehida sebagai cross-linking agent. Formaldehida dilarang penggunaannya pada bahan pangan karena bersifat karsinogen. Bahan lain yang dapat menggantikan formaldehida sebagai cross-linking agent adalah larutan glutaraldehida, seperti yang dilakukan oleh Vahabzadeh et al. (2003). Namun, glutaraldehida jarang ditemui dan juga dapat menyebabkan asma, iritasi pada mata, rhinitis, serta iritasi kulit dan dermatitis pada konsentrasi di bawah 0,2 ppm (OSHA 2006). Selain glutaraldehida, cross-linking agent lain yang dapat digunakan adalah enzim transglutaminase (Zuidam dan Nedovic 2010).
2. Metode Pengeringan Lapis Tipis (Modifikasi Kristi 2010)
Penyalut yang digunakan pada metode pengeringan lapis tipis adalah maltodekstrin, Carboxy Methyl Cellulose (CMC), dan gelatin. Menurut Westing et al. (1988) dalam Simanjuntak (2007), enkapsulasi lipid menggunakan maltodekstrin menyebabkan stabilitas emulsi dan retensi minyak rendah, namun minyak yang terenkapsulasi memiliki daya tahan terhadap oksidasi. CMC digunakan untuk bahan penyalut karena sifatnya sebagai pengikat air, pengental, dan stabilisator emulsi (Simanjuntak 2007). Gelatin merupakan bahan penyalut yang umum digunakan untuk pembuatan mikroenkapsulat karena dapat membentuk film serta dapat membentuk emulsi.
Ketiga bahan tersebut dicampurkan kemudian dilarutkan dalam air dan dipanaskan hingga suhu 60oC. Menurut Simanjuntak (2007), pemanasan bertujuan untuk membuka molekul-molekul bahan penyalut agar dapat berinteraksi satu dengan yang lainnya sehingga terbentuk suspensi bahan penyalut di dalam air. Setelah suhu suspensi diturunkan menjadi 45oC, dilakukan proses homogenisasi agar penyebaran molekul bahan penyalut lebih merata. Setelah suspensi penyalut homogen, dilakukan homogenisasi antara bahan penyalut dan minyak sawit untuk memperkecil ukuran globula. Apabila globula lemak yang terbentuk semakin kecil, semakin kecil pula kecenderungannya untuk bergabung kembali.
17 pengering rak seperti yang digunakan Kristi (2010). Setelah kering, lapisan tipis tersebut diblender kering untuk menghasilkan serbuk mikroenkapsulat. Mikroenkapsulat yang dihasilkan berbentuk butiran seperti serbuk kopi instan dan berwarna kuning.
Secara teknis, mikroenkapsulasi dengan metode ini memiliki beberapa kelebihan dan kelemahan. Kelebihannya adalah penyalut yang digunakan cukup mudah diperoleh, proses pembuatannya tidak memakan waktu terlalu lama dan peralatan yang digunakan tidak terlalu banyak. Mikroenkapsulat yang dihasilkan juga lebih praktis untuk disimpan jika dibandingkan dengan mikroenkapsulat hasil teknik koaservasi karena berbentuk butiran halus. Akan tetapi, proses pengeringan yang dilakukan pada suhu 60oC selama 5 jam berpotensi merusak β-karoten. Kelemahan lainnya adalah kapasitas oven vakum yang digunakan terbatas sehingga tidak dapat digunakan untuk membuat mikroenkapsulat dalam jumlah banyak dalam waktu bersamaan.
3. Teknik Penyerapan SiO2
Metode ketiga yaitu teknik penyerapan SiO2. Pada metode ini, sejumlah
minyak sawit dicampurkan dengan sejumlah SiO2 dengan perbandingan 1:1,
kemudian campuran diaduk menggunakan sudip selama 5-10 menit. Senyawa SiO2 atau bubuk silika merupakan komponen stabil yang inert terhadap reaksi
kimia dan biokimia, tidak memberikan efek terhadap organ tubuh, dan tidak memberikan risiko silicosis (Kofran 1993; Syamsiah 1996).
Metode ini pernah dilakukan oleh Syamsiah (1996) dan Wardayanie (2000). Pada penelitian sebelumnya, diperoleh kesimpulan bahwa mikroenkapsulat minyak sawit dengan perbandingan minyak sawit dan SiO2 2:1 lebih baik
dibandingkan dengan perbandingan 1:1. Pada penelitian ini, mikroenkapsulat yang dibuat dengan perbandingan minyak dan SiO2 2:1 tidak dipilih karena
minyak sawit tidak terserap semua oleh SiO2. Hal ini mungkin terjadi karena SiO2
yang digunakan berbeda dengan yang digunakan pada penelitian sebelumnya. Bentuk mikroenkapsulat yang dihasilkan berupa butiran yang berwarna kecoklatan.
Menurut Syamsiah (1996), mekanisme masuknya minyak dalam bahan pengisi yang inert ini dapat terjadi dengan dua cara. Cara pertama, minyak langsung masuk ke dalam lubang serbuk sehingga minyak yang terenkapsulasi dapat tahan terhadap sinar UV dan senyawa ozon. Kedua, minyak dihisap oleh permukaan serbuk dan menghasilkan minyak yang tidak tahan sinar UV dan senyawa ozon.
Metode ini sangat mudah diaplikasikan dan tidak membutuhkan waktu serta peralatan yang banyak. β-karoten yang tersalut juga seharusnya tidak mengalami kerusakan karena tidak ada proses pengeringan atau pengaturan pH seperti metode lainnya. Namun, senyawa SiO2 bukanlah senyawa yang umum
digunakan sebagai bahan penyalut sehingga sulit untuk memperolehnya.
Menurut Expert group on Vitamins and Minerals (EVM 2003), silicon dioxide (SiO2) biasanya terdapat di alam dalam bentuk kristalin dan amorphous.
Silika amorphous dapat digunakan untuk bahan tambahan pangan, yaitu sebagai
anti-caking. Selain itu, senyawa ini juga dapat digunakan sebagai clarifying agent, pengontrol viskositas, anti-foaming agent, dan dough modifier. EVM menetapkan
18
dengan 12 mg silika/kg berat badan/hari untuk orang dewasa dengan berat badan 60 kg). Sementara itu, tolerable upper intake dari senyawa ini belum dapat ditetapkan (EFSA 2009).
C. Hasil Analisis Mikroenkapsulat Minyak Sawit
Setelah dilakukan mikroenkapsulasi minyak sawit dengan tiga metode berbeda, dilakukan berbagai analisis terhadap setiap jenis mikroenkapsulat yang dihasilkan. Analisis yang dilakukan berupa analisis sifat kimia produk (analisis karakteristik kimia produk serta analisis kandungan dan retensi β-karoten), analisis proses mikroenkapsulasi (analisis rendemen, analisis efisiensi, analisis lemak tersalut dan lemak tidak tersalut), analisis sifat fisik (analisis bentuk, analisis daya serap air, dan analisis kelarutan), serta analisis residu formalin.
1. Analisis Sifat Kimia Produk Mikroenkapsulat Minyak Sawit
a. Analisis Karakteristik Kimia Produk Mikroenkapsulat Minyak Sawit
Analisis karakteristik kimia produk terdiri dari analisis kadar air, kadar abu, kadar protein, kadar lemak total, dan kadar karbohidrat. Analisis ini dilakukan untuk mengetahui kadar komponen penyusun setiap produk mikroenkapsulat. Tidak dilakukan perbandingan di antara ketiganya karena kadar penyalut dan minyak sawit yang digunakan pada tiap metode tidak sama. Sifat kimia lain yang dianalisis adalah kandungan β-karoten mikroenkapsulat. Hasil analisis ini dapat dilihat pada Tabel 3.
Tabel 3 Karakteristik kimia produk mikroenkapsulat minyak sawit
Parameter Teknik
Kandungan β-karoten (ppm) 42,83a 200,16b 1,75c Keterangan: Huruf yang sama di belakang angka pada baris yang sama menunjukkan tidak berbeda nyata (p>0,05)
19 standar ini dilakukan sesuai dengan pendekatan proses sebagai produk hasil pengeringan. Ketiga jenis mikroenkapsulat yang dihasilkan masih sesuai dengan standar tersebut.
Adanya perubahan kadar protein, kadar abu, dan kadar karbohidrat setiap mikroenkapsulat dibandingkan dengan bahan bakunya, yaitu minyak sawit degumming disebabkan oleh adanya penyalut yang ditambahkan. Gelatin menjadi salah satu penyalut yang digunakan pada metode pengeringan lapis tipis dan teknik koaservasi sehingga mikroenkapsulat yang dihasilkan dari kedua metode tersebut mengalami peningkatan kadar protein. Gelatin merupakan protein hewan yang diambil dari pemecahan kolagen yang tidak larut, mengandung 84-90% protein, 1-2% mineral, dan 8-15% air (Simanjuntak 2007).
Sementara itu, CMC dan maltodekstrin yang digunakan pada metode pengeringan lapis tipis serta gum arab yang digunakan pada teknik koaservasi mempengaruhi kadar karbohidrat mikroenkapsulat yang dihasilkan. Ketiganya termasuk golongan hidrokoloid yang termasuk karbohidrat.
Kadar abu juga dipengaruhi oleh penyalut karena berdasarkan hasil analisis proksimat, minyak sawit degumming tidak mengandung abu. Mikroenkapsulat hasil penyerapan SiO2 memiliki kadar abu 49,03%. Hal
ini menunjukkan bahwa mikroenkapsulat dengan metode tersebut memang hanya terdiri dari SiO2 yang berupa mineral sebagai penyalut dan minyak
sawit sebagai zat inti.
Berbeda dengan komponen lainnya, kadar lemak total dipengaruhi oleh jumlah minyak sawit degumming yang ditambahkan. Kadar lemak total mikroenkapsulat terdiri dari kadar lemak tersalut dan kadar lemak tidak tersalut yang diperlukan untuk mengetahui efisiensi penyalutan. Sementara itu, hasil analisis kandungan dan retensi β-karoten akan dijelaskan pada subbab berikutnya.
b. Analisis Kandungan dan Retensi β-karoten Mikroenkapsulat Minyak Sawit
Kandungan dan retensi β-karoten merupakan parameter utama untuk menentukan metode mikroenkapsulasi minyak sawit yang terbaik. Hasil analisis kandungan β-karoten dapat dilihat pada Gambar 3, sedangkan hasil analisis retensi β-karoten dapat dilihat pada Gambar 4. Hasil uji One-Way ANOVA dari analisis kandungan β-karoten dapat dilihat pada Lampiran 7, sementara hasil uji One-WayANOVA dari analisis retensi β -karoten dapat dilihat pada Lampiran 8.
20
Keterangan: Huruf yang sama di belakang angka menunjukkan tidak berbeda nyata (p>0,05)
Gambar 3. Grafik hasil analisis kandungan β-karoten mikroenkapsulat
Keterangan: Huruf yang sama di belakang angka menunjukkan tidak berbeda nyata (p>0,05)
Gambar 4. Grafik hasil analisis retensi β-karoten mikroenkapsulat
Menurut Wardayanie (2000), β-karoten mudah terdegradasi oleh adanya proses oksidasi, panas, serta cahaya. Mikroenkapsulat hasil teknik koaservasi mengandung 42,83 ppm β-karoten dengan retensi 14,74%. Hilangnya β-karoten dengan metode ini dapat terjadi pada saat pengaturan pH serta saat proses pengeringan. Meskipun freeze-drying lebih sesuai untuk mengeringkan mikroenkapsulat minyak sawit, kondisi freeze-dryer yang tembus cahaya dapat menyebabkan β-karoten rusak.
Sementara itu, kandungan β-karoten dalam mikroenkapsulat hasil penyerapan SiO2 sangat rendah, yaitu 1,75 ppm dengan retensi 0,60%.
Menurut Kofran (1993) dalam Syamsiah (1996), senyawa SiO2 merupakan
komponen stabil yang inert terhadap reaksi kimia dan biokimia. Akibatnya, β-karoten dalam minyak sawit yang tersalut di dalam SiO2 tidak dapat
terdeteksi. Kemungkinan mikroenkapsulat hasil penyerapan SiO2 ini juga 42.83a
Teknik Koaservasi Pengeringan Lapis Tipis Penyerapan SiO2
14.74a
21 tidak dapat melepaskan β-karoten yang disalutnya ke dalam tubuh dengan baik.
Menurut Simanjuntak (2007), nilai retensi β-karoten merupakan nilai perbandingan antara kadar β-karoten yang terdapat di dalam minyak setelah menjadi mikroenkapsulat dengan kandungan β-karoten awal minyak sebelum mengalami proses mikroenkapsulasi dikali dengan seratus persen. Besar kecilnya nilai retensi ini sangat ditentukan oleh kondisi proses pengeringan, kandungan β-karoten awal minyak sawit, serta proporsi bahan-bahan mikroenkapsulat yang mampu melindungi β-karoten dari kerusakan selama pengolahan (Simanjuntak 2007).
Berdasarkan hasil penelitian Simanjuntak (2007), penggunaan CMC sebagai salah satu penyalut mengakibatkan peningkatan retensi β-karoten karena diduga gugus nonpolar CMC berikatan dengan molekul minyak atau lemak. Semakin tinggi jumlah CMC yang ditambahkan, semakin tinggi pula jumlah minyak yang terikat pada mikroenkapsulat sehingga jumlah β-karoten yang larut pada minyak semakin banyak yang terikat. Bahan penyalut lain yang dapat meningkatkan retensi β-karoten adalah pektin (Yudha 2008), namun bahan tersebut tidak digunakan pada penelitian ini. Penelitian Fasikhatun (2010) juga menunjukkan penambahan maltodekstrin dapat meningkatkan perlindungan terhadap karoten. Oleh karena itu, metode pengeringan lapis tipis yang menggunakan CMC dan maltodekstrin sebagai penyalut dapat menghasilkan mikroenkapsulat minyak sawit dengan retensi dan kandungan β-karoten tertinggi dibandingkan metode lainnya.
Menurut KMKRI (2005), Angka Kecukupan Gizi (AKG) rata-rata yang dianjurkan untuk vitamin A bagi pria dewasa (19-29 tahun) adalah 600 RE/orang/hari, sementara bagi wanita dewasa (19-29 tahun) adalah 500 RE/orang/hari. Menurut Food and Drug Administration (FDA 2012), suatu pangan diklaim mengandung karoten tinggi apabila dapat memenuhi 20% dari AKG per takaran saji. Oleh karena itu, takaran saji dari produk mikroenkapsulat hasil pengeringan lapis tipis ini adalah sebesar 3,6 g. Perhitungan penentuan takaran saji produk mikroenkapsulat hasil pengeringan lapis tipis dapat dilihat pada Lampiran 9.
2. Analisis Proses Mikroenkapsulasi Mikroenkapsulat Minyak Sawit
Analisis proses ini terdiri dari analisis rendemen, analisis efisiensi, serta analisis lemak tersalut dan lemak tidak tersalut. Dari hasil pembuatan mikroenkapsulat, dapat dilihat pada Gambar 5 bahwa rendemen terendah diperoleh dengan teknik koaservasi, sementara rendemen tertinggi diperoleh dengan penyerapan SiO2. Mikroenkapsulat hasil teknik koaservasi memiliki
rendemen rendah karena melalui proses sentrifugasi dan freeze-drying yang menyebabkan kehilangan air dalam jumlah banyak. Sementara itu, metode penyerapan SiO2 rendemennya sangat tinggi karena pembuatannya hanya berupa
pencampuran antara SiO2 sebagai penyalut dan minyak sawit sebagai zat inti.
22
menyebabkan efisiensi penyalutan dengan metode ini menjadi paling rendah dibandingkan metode lainnya. Mikroenkapsulat diharapkan memiliki efisiensi penyalutan yang baik, di mana zat aktif seharusnya tersalut sempurna oleh bahan penyalut. Apabila lemak yang tidak tersalut lebih banyak dibandingkan lemak yang tersalut, berarti sebagian besar minyak sawit hanya menempel di luar dinding mikroenkapsulat. Hal ini akan menyebabkan β-karoten yang ada dalam minyak sawit tidak terlindungi dan akan mudah rusak.
Keterangan: Huruf yang sama di belakang angka pada parameter yang sama menunjukkan tidak berbeda nyata (p>0,05)
Gambar 5. Grafik hasil analisis rendemen dan efisiensi mikroenkapsulat minyak sawit
Gambar 6. Grafik hasil analisis kadar lemak tersalut dan kadar lemak tidak tersalut
Menurut Yeo dan Park (2004), beberapa faktor yang mempengaruhi efisiensi enkapsulasi adalah kelarutan polimer penyalut dalam pelarut organik, kelarutan pelarut organik dalam air, konsentrasi polimer penyalut, rasio fase
15.35a
Teknik Koaservasi Pengeringan Lapis Tipis Penyerapan SiO2
32.03
23 terdispersi dan fase kontinyu (DP/CP), dan kecepatan penghilangan pelarut. Dalam penelitian ini, pelarut yang digunakan dalam pembuatan mikroenkapsulat adalah air sehingga faktor yang mempengaruhi efisiensi enkapsulasi adalah konsentrasi polimer penyalut, rasio DP/CP, serta kecepatan penghilangan pelarut saja. Pada metode teknik koaservasi, konsentrasi penyalut yang digunakan sangat kecil, sedangkan pada metode penyerapan SiO2, konsentrasi penyalut yang
digunakan sebanding dengan konsentrasi minyak yang ditambahkan sehingga efisiensi penyalutan dengan metode penyerapan SiO2 jauh lebih tinggi
dibandingkan metode teknik koaservasi.
Mikroenkapsulat hasil pengeringan lapis tipis memiliki efisiensi penyalutan yang lebih baik dibandingkan mikroenkapsulat hasil teknik koaservasi karena memiliki rasio DP/CP serta kecepatan pengeringan yang lebih tinggi. Selain itu, penyalut yang digunakan sebagai penyalut pada mikroenkapsulat hasil pengeringan lapis tipis, yaitu CMC, gelatin, dan maltodekstrin memang terbukti dapat menghasilkan mikroenkapsulat dengan efisiensi yang baik (Mustikawati 1998). Menurut Mustikawati (1998), efisiensi serta rendemen yang lebih tinggi dapat diperoleh apabila mengganti gelatin dengan isolat protein kedelai dan dapat ditingkatkan lagi dengan penambahan sukrosa (Jun-xia et al. 2011).
Metode pengeringan juga dapat mempengaruhi efisiensi enkapsulasi. Pengeringan yang cepat dapat meningkatkan efisiensi enkapsulasi. Namun, metode pengeringan juga dapat mempengaruhi kandungan β-karoten dalam mikroenkapsulat sehingga diperlukan pemilihan metode pengeringan yang sesuai.
Pengujian statistik menggunakan uji One-Way ANOVA pada taraf signifikansi 5% menunjukkan metode yang berbeda akan menghasilkan mikroenkapsulat dengan rendemen dan efisiensi penyalutan yang berbeda. Metode penyerapan SiO2 menghasilkan rendemen dan efisiensi penyalutan tertinggi
dibandingkan metode lainnya. Hasil uji One-Way ANOVA terhadap analisis efisiensi mikroenkapsulat dapat dilihat pada Lampiran 10, sementara hasil uji
One-Way ANOVA terhadap analisis rendemen mikroenkapsulat dapat dilihat pada Lampiran 11.
3. Analisis Sifat Fisik Mikroenkapsulat Minyak Sawit
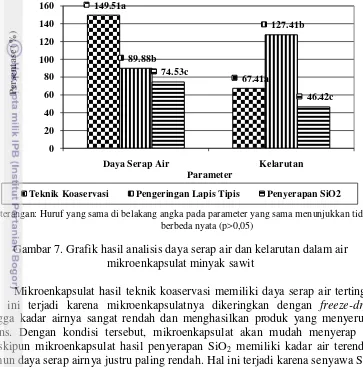
Analisis sifat fisik mikroenkapsulat terdiri dari analisis daya serap air, analisis kelarutan, serta analisis bentuk. Hasil analisis daya serap air dan analisis kelarutan dapat dilihat pada Gambar 7. Hasil uji One-Way ANOVA analisis daya serap air dapat dilihat pada Lampiran 12, sementara hasil uji One-Way ANOVA analisis kelarutan dapat dilihat pada Lampiran 13.
Mikroenkapsulat biasanya berbentuk bubuk dan dapat dikonsumsi sebagai campuran tepung atau premix. Oleh karena itu, daya serap air dan kelarutan mikroenkapsulat perlu diketahui untuk melihat interaksinya dengan air. Apabila mikroenkapsulat dapat larut dalam air dengan baik, seharusnya zat aktif yang tersalut akan lebih mudah dihantarkan ke dalam tubuh. Mikroenkapsulat yang dihasilkan diharapkan memiliki daya serap air yang rendah agar tidak mudah mengalami caking.
24
produk dipengaruhi pula oleh komponen penyusun produk tersebut. Dalam produk mikroenkapsulasi yang dihasilkan, selain inti mikroenkapsulat (minyak sawit), mikroenkapsulat juga mengandung polisakarida hidrofilik yang sangat berpengaruh terhadap daya serap air. Karena penyalut yang digunakan berbeda, daya serap air tiap produk juga berbeda.
Keterangan: Huruf yang sama di belakang angka pada parameter yang sama menunjukkan tidak berbeda nyata (p>0,05)
Gambar 7. Grafik hasil analisis daya serap air dan kelarutan dalam air mikroenkapsulat minyak sawit
Mikroenkapsulat hasil teknik koaservasi memiliki daya serap air tertinggi. Hal ini terjadi karena mikroenkapsulatnya dikeringkan dengan freeze-dryer
hingga kadar airnya sangat rendah dan menghasilkan produk yang menyerupai spons. Dengan kondisi tersebut, mikroenkapsulat akan mudah menyerap air. Meskipun mikroenkapsulat hasil penyerapan SiO2 memiliki kadar air terendah,
namun daya serap airnya justru paling rendah. Hal ini terjadi karena senyawa SiO2
sudah jenuh dengan minyak sawit sehingga tidak dapat menyerap air dalam jumlah banyak.
Mikroenkapsulat dengan penyerapan SiO2 yang memiliki kadar air paling
rendah juga memiliki kelarutan yang paling rendah, sementara mikroenkapsulat dengan pengeringan lapis tipis yang memiliki kadar air paling tinggi justru memiliki kelarutan yang paling tinggi. Hal ini terjadi karena penyalut yang digunakan pada setiap jenis mikroenkapsulat berbeda-beda. Pada metode pengeringan lapis tipis, penyalut yang digunakan adalah CMC, gelatin, dan maltodekstrin. Ketiganya merupakan jenis hidrokoloid yang dapat larut di dalam air.
Di sisi lain, SiO2 yang digunakan sebagai penyalut memiliki kelarutan yang
rendah karena SiO2 telah jenuh menyerap minyak sawit. SiO2 dan minyak sawit
sendiri bersifat tidak larut air sehingga mikroenkapsulat yang dibuat dengan metode ini sangat sulit untuk larut dalam air. Mikroenkapsulat hasil pengeringan lapis tipis memiliki kelarutan tertinggi, yaitu 127,41%. Pada saat analisis, mikroenkapsulat ini larut dengan sangat baik di dalam air sehingga residu yang