i
UIN SYARIF HIDAYATULLAH JAKARTA
EKSTRAKSI DAN KARAKTERISASI GELATIN DARI
KULIT SAPI MENGGUNAKAN METODE
HIDROLISIS ASAM
SKRIPSI
REMAWATI
1112102000046
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
UIN SYARIF HIDAYATULLAH JAKARTA
EKSTRAKSI DAN KARAKTERISASI GELATIN DARI
KULIT SAPI MENGGUNAKAN METODE
HIDROLISIS ASAM
SKRIPSI
Diajukan sebagai Salah Satu Syarat Memperoleh Gelar Sarjana Farmasi
REMAWATI
1112102000046
FAKULTAS KEDOKTERAN DAN ILMU KESEHATAN
PROGRAM STUDI FARMASI
iii
Skripsi ini adalah hasil karya saya sendiri, dan semua sumber baik yang dikutip maupun dirujuk
telah saya nyatakan dengan benar.
Nama : Remawati
NIM : 1112102000046
Tanda Tangan
ABSTRAK
Nama : Remawati
Program Studi : Farmasi
Judul : Ekstraksi dan Karakterisasi Gelatin dari Kulit Sapi Menggunakan Metode Hidrolisis Asam
Pemanfaatan gelatin cukup luas pada industri makanan, farmasi, dan fotografi. Indonesia mengimpor gelatin untuk memenuhi kebutuhan dalam negeri, sehingga produksi gelatin secara lokal di Indonesia perlu dikembangkan. Kulit sapi mempunyai potensi yang tinggi sebagai bahan baku yang mudah didapat untuk diproduksi menjadi gelatin. Tujuan dari penelitian ini adalah mengekstraksi dan mengetahui karakteristik gelatin dari kulit sapi yang diperoleh melalui hidrolisis asam. Kulit sapi dihidrolisis menggunakan asam asetat 0,2 M selama 48 jam pada suhu 5°C, suhu ekstraksi 60-70°C selama 9 jam dan suhu pengeringan 60°C. Rendemen yang diperoleh adalah 6,29 ±0,9%. Gelatin yang dihasilkan diuji meliputi sifat fisika dan kimianya. Hasilnya menunjukkan gelatin memiliki warna kuning lemah berbentuk lambaran dengan bau sedikit amis dan tekstur sedikit halus, pH 5,6 ±0,04, kejernihan 63,51 ±1,32%, kadar air 5%, kadar abu 0,3%, viskositas pada kecepatan 10 rpm sebesar 30 centipoise, kapasitas busa 163,3 ±3,05, stabilitas busa (10 menit) 157,3 ±3,05, stabilitas busa (30 menit) 147,3 ±1,15, stabilitas busa (60 menit) 139,3 ±1,15, indeks aktivitas emulsi 338,5 ±11,0308, indeks stabilitas emulsi 23,59 ±0,4, daya serap air 3,85 ±0,50 ml/g, daya serap lemak 0,53 ±0,22 ml/g, dan kandungan hidroksiprolin 2,57 mg dalam 10 mg sampel gelatin. Sifat Organoleptik, nilai pH, kadar air dan kadar abu pada gelatin sampel memenuhi persyaratan standar mutu gelatin, serta pada uji daya serap air, daya serap lemak, kandungan hidroksiprolin dan indeks stabilitas emulsi, gelatin sampel menunjukkan sifat yang tidak berbeda bermakna dengan gelatin komersial.
vii ABSTRACT
Name : Remawati
Major : Pharmacy
Title : Extraction and Characterization of Gelatin from Bovine Hide with Acid Hydrolysis Method
Gelatin has many benefits in food industry, pharmaceutical industry and photography industry. Indonesia imports gelatin to domestic demand, so that the gelatin production locally in Indonesia needs to be developed. Bovine hide has a high potential as a raw material that is readily available to be produced into gelatin. The purpose of this study was to extract and determine the characteristics of bovine hide gelatin obtained through acid hydrolysis. Bovine hide is hydrolyzed using 0.2 M acetic acid with a soaking time of 48 hours at 5°C, extraction temperature at 60-70°C for 9 hours and drying temperature at 60°C. The yield obtained was 6.29 ±0.9%. Physical and chemical characteristics of gelatin were evaluated. The result showed that gelatin has a yellow colour, shaped sheet gelatin with a little bovine odor and a little refined texture, pH of 5.6 ±0.04, 63.51 ±1.32% clarity, 5% moisture content, 0.3% ash content, the viscosity at a speed of 10 rpm for 30 centipoises, foam expansion of 163.3 ±3.05, foam stability after 10 minutes of 157.3 ±3.05, foam stability after 30 minutes of 147.3 ±1.15, foam stability after 60 minutes 139.3 ±1.15, emulsion activity index of 338.5 ±11.03, emulsion stability index of 23.59 ±0,4, water binding capacity of 3.85 ±0.50 ml/g, fat binding capacity of 0.53 ±0.22 ml/g, and hydroxyproline content of 2.57 mg in 10 mg sample of gelatin. Organoleptic, pH, moisture content and ash content of the gelatin sample meets the requirements of the quality standards of gelatin, as well as characteristic of water binding capacity, fat binding capacity, hydroxyproline content and emulsion stability index of gelatin sample is not significantly different with commercial gelatin.
KATA PENGANTAR
Alhamdulillahirobbil’alamin, puji syukur penulis panjatkan ke hadirat Allah SWT, karena atas rahmat dan karunia Nya penulis dapat menyelesaikan penelitian
dan penulisan skripsi ini hingga selesai. Shalawat dan salam senantiasa tercurah
kepada Rasulullah saw semoga kita sebagai umatnya mendapat syafaat darinya
hingga akhir zaman. Skripsi ini berjudul “Ekstraksi dan Karakterisasi Gelatin dari Kulit Sapi Menggunakan Metode Hidrolisis Asam” yang telah diajukan sebagai persyaratan untuk memperoleh gelar Sarjana Farmasi Program Studi Farmasi
FKIK UIN Syarif Hidayatullah Jakarta.
Dalam proses penelitian dan penyusunan skripsi ini penulis menyadari bahwa
penulisan skripsi ini tidak akan terselesaikan tanpa bantuan dari berbagai pihak. Oleh
karena itu, pada kesempatan ini perkenankan penulis menyampaikan penghargaan
dan rasa terimakasih kepada:
1. Ibu Zilhadia, M.Si., Apt dan ibu Yuni Anggraeni, M.Farm., Apt selaku dosen
pembimbing yang telah memberikan ilmu, arahan, bimbingan serta
meluangkan waktu, tenaga dan pikiran dalam penelitian dan penulisan skripsi
sehingga penulis dapat menyelesaikan skripsi ini.
2. Ibu Ofa Suzanti Betha, M.Si., Apt dan Bapak Supandi, M.Si., Apt selaku
dosen penguji yang telah banyak memberikan evaluasi dan saran dalam
penulisan skripsi ini.
3. Bapak Dr. Arief Sumantri, M.Kes selaku dekan Fakultas Kedokteran dan
Ilmu Kesehatan Universitas Islam Negeri Syarif Hidayatullah Jakarta.
4. Ibu Dr. Nurmeilis, M.Si., Apt selaku ketua Prodi Farmasi Fakultas
Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta.
5. Bapak ibu dosen dan para staf karyawan dan laboran program studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan atas ilmu yang telah diberikan
kepada penulis.
6. Ka Nursitasari Pertiwi, S.Far, ka Eris Risenti, A.Md dan ka Siti Yaenap, S.Si
yang telah membantu dan memberikan arahan dalam penelitian ini.
7. Kedua orang tua tercinta, bapak Rustamin dan ibu Jijah Rosidah serta nenek
ix
8. Adik-adik tercinta, Royhan Adiguna dan Riza Pratama Saputra atas setiap
motivasi, semangat, dukungan dan doanya bagi penulis.
9. Rekan, sahabat, sekaligus keluarga tersayang, Ria Putri Utami, Syahidah,
Ries Yulia, Siti Rosidah, Navila Camalia dan keluarga besar RIMASI Jakarta.
Terima kasih untuk segala motivasi, semangat, dukungan dan doanya.
10.Sahabat seperjuangan penelitian Kimia Farmasi 2012 (Yolan, Sani, Amel,
Vesty), terima kasih atas bantuan, motivasinya selama penelitian.
11.Sahabat tulip family (Yolan, Uyuy, Elsa, Eca, Rani, Lilis, Afra, Ani) atas
setiap dukungan, kebaikan, semangat dan motivasinya selama pendidikan
perkuliahan, khususnya Umi Kulsum sebagai pembimbing yang selalu
memberikan arahan dan solusi dalam penelitian ini. Terimakasih juga
Fakhrun yang selalu memberikan motivasi.
12.Sahabat-sahabat sholehah tercinta (Teh Febie, Suci, Asiah, Aul (Almh.), dan
mba Eki). Terimakasih untuk doanya yang selalu mengalir walau kita
terhalang oleh jarak. Selalu rindu kalian.
13.Teman-teman Farmasi 2012, khususnya farmasi BD untuk kekompakan dan
canda-tawa selama pendidikan perkuliahan.
14.Semua pihak yang tidak dapat disebutkan satu persatu yang telah membantu
penulis selama ini.
Penulis menyadari bahwa skripsi terdapat kekurangan dan masih jauh dari
kesempurnaan. Oleh karena itu penulis mengharapkan kritik dan saran yang
membangun demi hasil yang lebih baik. Penulis berharap penyusunan skripsi ini
mendatangkan banyak manfaat dan pelajaran bagi semua orang khususnya para
pembaca. Penulis berharap semoga Allah SWT membalas segala kebaikan semua
pihak yang telah membantu.
Ciputat, Agustus 2016
HALAMAN PERNYATAAN PERSETUJUAN PUBLIKASI TUGAS AKHIR UNTUK KEPENTINGAN AKADEMIS
Sebagai sivitas akademik Universitas Islam Negeri (UIN) Syarif Hidayatullah
Jakarta, saya yang bertanda tangan di bawah ini:
Nama : Remawati
NIM : 1112102000046
Program Studi : Farmasi
Fakultas : Kedokteran dan Ilmu Kesehatan
Jenis Karya : Skripsi
Demi perkembangan ilmu pengetahuan, saya menyetujui skripsi/karya ilmiah
saya, dengan judul :
EKSTRAKSI DAN KARAKTERISASI GELATIN DARI KULIT SAPI MENGGUNAKAN METODE HIDROLISIS ASAM
Untuk dipublikasikan atau ditampilkan di internet atau media lain yaitu Digital
Library Perpustakaan Universitas Islam Negeri (UIN) Syarif Hidayatullah Jakarta
untuk kepentingan akademik sebatas sesuai dengan Undang-undang Hak Cipta.
Demikian pernyataan persetujuan publikasi karya ilmiah ini saya buat dengan
sebenarnya.
Dibuat di : Ciputat
Pada tanggal : Agustus 2016
Yang menyatakan,
xi DAFTAR ISI
Halaman
HALAMAN SAMPUL ... i
HALAMAN JUDUL... ii
HALAMAN PERNYATAAN ORISINALITAS ... iii
HALAMAN PERSETUJUAN PEMBIMBING ... iv
HALAMAN PENGESAHAN ... v
2.2.2 Protein Berdasarkan Bentuk ... 7
2.2.3 Protein Berdasarkan Fungsi ... 8
2.3Asam Amino ... 9
2.4Kolagen ... 10
2.5Gelatin ... 12
2.5.1 Definisi ... 12
2.5.2 Komposisi dan Struktur Kimia... 13
2.5.3 Tipe Gelatin ... 14
2.5.4 Karakteristik Kimia dan Fisika ... 16
2.5.5 Kolagen Menjadi Gelatin ... 19
2.5.6 Mutu Gelatin ... 21
2.6Analisis Protein Metode Spektrofotometri ... 23
BAB 3 METODE PENELITIAN ... 26
3.3.1 Penyiapan Bahan Baku Kulit... 27
3.3.1.1Proses Pembuangan Bulu... 27
3.3.2.1Proses Hidrolisis Kulit Sapi ... 27
3.3.2.2Proses Ekstraksi Gelatin ... 27
3.3.3 Proses Penyaringan dan Pengeringan ... 28
3.3.4 Menghitung Nilai Rendemen Gelatin ... 28
3.3.5 Karakterisasi Gelatin ... 28
3.3.5.1Uji pH Gelatin... 28
3.3.5.2Uji Kejernihan Larutan Gelatin ... 28
3.3.5.3Uji Kadar Air Gelatin ... 29
3.3.5.4Uji Kadar Abu Gelatin ... 29
3.3.5.5Uji Viskositas Larutan Gelatin ... 29
3.3.5.6Uji Sifat Busa Larutan Gelatin ... 30
3.3.5.7Uji Sifat Emulsifikasi Gelatin... 30
3.3.5.8Uji Daya Serap Air Gelatin ... 31
3.3.5.9Uji Daya Serap Lemak Gelatin ... 31
3.3.5.10 Uji Kandungan Hidroksiprolin ... 32
3.3.6 Analisa Data Statistika ... 34
BAB 4 HASIL DAN PEMBAHASAN ... 35
4.1Pembuatan Gelatin... 35
4.1.1 Tahap Persiapan Bahan Baku ... 35
4.1.2 Tahap Konversi Kolagen Menjadi Gelatin ... 36
4.1.2.1 Proses Hidrolisis Kulit ... 36
4.1.2.2 Proses Ekstraksi Gelatin ... 36
4.1.3 Tahap Pemurnian Gelatin ... 37
4.2Rendemen Gelatin... 37
4.3Karakteristik Gelatin... 38
4.3.1 Organoleptik Gelatin ... 40
4.3.2 pH Gelatin ... 41
4.3.3 Kejernihan Larutan Gelatin ... 42
4.3.4 Kadar Air Gelatin ... 43
4.3.5 Kadar Abu Gelatin ... 43
4.3.6 Viskositas Gelatin ... 44
4.3.7 Sifat Busa Gelatin ... 45
4.3.8 Sifat Emulsifikasi Gelatin ... 46
4.3.9 Daya Serap Air dan Lemak Gelatin... 47
4.3.10 Kandungan Hidroksiprolin dalam Gelatin... 49
4.3.10.1Panjang Gelombang Maksimum... 49
4.3.10.2Kurva Kalibrasi ... 49
4.3.10.3Kandungan Hidroksiprolin sampel ... 49
BAB 5 KESIMPULAN DAN SARAN ... 51
5.1 Kesimpulan ... 51
5.2 Saran ... 51
DAFTAR PUSTAKA ... 52
xiii
DAFTAR GAMBAR
Halaman
Gambar 2.1 Lapisan Utama Kulit Binatang Ternak... 5
Gambar 2.2 Tingkatan Struktur Protein ... 7
Gambar 2.3 Struktur Asam Amino ... 9
Gambar 2.4 Titik Isoelektrik Asam Amino ... 10
Gambar 2.5 Urutan Tahap pada Pembentukan Kolagen ... 11
Gambar 2.6 Struktur Kimia Gelatin ... 13
Gambar 2.7 Struktur Gelatin pada Fase Sol ke Gel ... 16
Gambar 2.8 Pola Distribusi Muatan Gelatin Tipe A dan Tipe B ... 18
Gambar 2.9 Reaksi Pembentukan Gelatin ... 20
Gambar 2.10 Transisi Rantai Helik-Gulungan pada Kolagen ... 20
Gambar 2.11 Reaksi Pemutusan Ikatan Hidrogen Tropokolagen ... 21
Gambar 2.12 Reaksi Hidrolisis Ikatan Silang Kovalen Tropokolagen ... 21
Gambar 4.1 Gelatin Kulit Sapi dan Gelatin Sapi Komersial ... 41
Gambar 4.2 Tingkat Kejernihan Gelatin ... 43
Gambar 4.3 Viskositas Gelatin Sapi Komersial dan Gelatin Kulit Sapi ... 45
Gambar 4.4 Stabilitas Busa Gelatin Kulit Sapi dan Gelatin Sapi Komersial... 46
Gambar 4.5 Indeks Aktivitas Emulsi dan Indeks Stabilitas Emulsi Gelatin .... 47
Gambar 4.6 Kemampuan Daya Serap Air dan Lemak Gelatin ... 49
Gambar 4.7 Kurva Kalibrasi Standar Hidroksiprolin ... 49
DAFTAR TABEL
Halaman
Tabel 2.1 Komposisi Asam Amino Gelatin ... 14
Tabel 2.2 Perbedaan Sifat Gelatin Tipe A dan Tipe B ... 15
Tabel 2.3 Asam Amino Hidrofilik dan Hidrofobik pada Gelatin ... 19
Tabel 2.4 Persyaratan Gelatin Berdasarkan FAO ... 22
Tabel 2.5 Standar Mutu Gelatin Menurut SNI 1995 ... 22
Tabel 4.1 Karakteristik Gelatin Sampel ... 39
Tabel 4.2 Karakteristik Gelatin Sampel dan Gelatin Komersial ... 39
xv
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Skema prosedur penelitian secara umum ... 58
Lampiran 2. Data Rendemen Gelatin Sampel ... 59
Lampiran 3. Perhitungan Rendemen Gelatin sampel ... 59
Lampiran 4. Data pH Gelatin ... 59
Lampiran 5. Data Kejernihan Larutan Gelatin ... 60
Lampiran 6. Perhitungan Kadar Air Gelatin Sampel... 60
Lampiran 7. Perhitungan Kadar Abu Gelatin Sampel ... 60
Lampiran 8. Data Viskositas Gelatin Sampel ... 61
Lampiran 9. Data Viskositas Gelatin Komersial ... 61
Lampiran 10. Data Emulsifikasi Gelatin Sampel ... 62
Lampiran 11. Data Emulsifikasi Gelatin Komersial ... 62
Lampiran 12. Data Sifat Busa Gelatin Sampel ... 63
Lampiran 13. Perhitungan Sifat Busa Gelatin Sampel ... 63
Lampiran 14. Data Sifat Daya Serap Air Gelatin Sampel ... 64
Lampiran 15. Perhitungan Daya Serap Air Gelatin ... 64
Lampiran 16. Data Sifat Daya Serap Lemak Gelatin Sampel ... 64
Lampiran 17. Perhitungan Daya Serap Lemak Gelatin Sampel ... 65
Lampiran 18. Panjang Gelombang Maksimum Hidroksiprolin ... 65
Lampiran 19. Data Kandungan Hidroksiprolin Gelatin Sampel... 66
Lampiran 20. Data Kandungan Hidroksiprolin Gelatin Komersial ... 66
Lampiran 21. Spektrofotometer UV-Vis Hitachi U-2910 ... 66
Lampiran 22. Data Statistik Uji pada Gelatin ... 67
Lampiran 23. Data Statistik Uji Sifat Busa Gelatin ... 67
BAB 1 PENDAHULUAN
1.1 Latar Belakang
Gelatin merupakan polipeptida yang diekstraksi dari jaringan kolagen
hewan yang terdapat pada tulang, kulit dan jaringan ikat (Rosli and Sarbon, 2015).
Sumber utama yang dapat digunakan untuk memproduksi gelatin adalah tulang
dan kulit hewan mamalia. Beberapa sumber alternatif lain yaitu unggas, ikan
(GMIA, 2012). Gelatin mempunyai sifat yang khas di antaranya adalah dapat
menunjukkan perubahan dari bentuk sol ke bentuk gel secara reversible seiring
dengan perubahan suhu (deMan, 1997), dapat mengembang dalam air dingin,
dapat membentuk film, mempengaruhi viskositas suatu bahan, dan dapat
melindungi sistem koloid (Setiawati, 2009).
Sifat gelatin yang khas tersebut menyebabkan pemanfaatan gelatin cukup
luas pada berbagai industri, yaitu industri makanan, farmasi, dan fotografi. Pada
industri makanan gelatin digunakan sebagai whipping agent pada marshmallow,
bahan pengikat pada keju, emulsifier pada krim dan saus, penstabil pada yogurt,
dan koloid pelindung pada es krim. Pada industri farmasi gelatin digunakan untuk
mikroenkapsulasi, bahan pembuat kapsul, pembawa untuk sediaan suppositoria,
pengganti plasma, media pertumbuhan mikroba, juga penstabil dan pembentuk
film pada sediaan emulsi (GMIA, 2012). Dalam industri fotografi, gelatin
digunakan sebagai medium pengikat dan koloid pelindung untuk bahan
pembentuk gambar (Jaswir, 2007).
Kebutuhan gelatin di dunia mempunyai nilai yang cukup tinggi setiap
tahunnya. Hal ini dilaporkan oleh Karim dan Bhat (2008) bahwa jumlah produksi
gelatin secara global pada tahun 2007 mencapai 326.000 ton per tahun, dengan
rincian gelatin dari kulit babi sebesar 46%, kulit sapi sebesar 29,4%, tulang sapi
sebesar 23,1% dan sumber lain sebesar 1,5%. Di sisi lain, Indonesia mempunyai
ketergantungan terhadap perdagangan internasional sebagai mesin penggerak
perekonomian nasional yang cukup besar (Safitriani, 2014). Untuk memenuhi
negara seperti Amerika, Perancis, Jerman, Brazil, Korea, China dan Jepang
(Setiawati, 2009). Dengan demikian, produksi gelatin secara lokal di Indonesia
perlu dikembangkan.
Perdagangan global pada produk makanan halal dapat diperkirakan sekitar
80 miliar US dollar, atau sekitar 12% dari total perdagangan produk
agri-pada sektor perdagangan global (Karim & Bhat, 2008).
Dalam era industrialisasi ini, masih banyak bahan dasar yang mudah
didapat namun belum termanfaatkan secara optimal untuk diolah menjadi produk
yang berdaya guna tinggi. Salah satu bahan dasar tersebut adalah kulit sapi yang
berpotensi tinggi untuk diolah menjadi gelatin. Sapi merupakan hewan yang
termasuk ke dalam kelas mamalia. Penyebaran kolagen yang ada di jaringan kulit
hewan mamalia mempunyai jumlah yang paling tinggi (89%) dibandingkan
jaringan lainnya seperti tulang, tendon dan lain-lain (Setiawati, 2009). Bahan
dasar yang dapat digunakan untuk pembuatan gelatin salah satunya adalah kulit
sapi. Dengan alasan tersebut, maka penelitian ini menggunakan bahan dasar kulit
sapi untuk diproduksi menjadi gelatin.
Kolagen yang terdapat pada kulit sapi tersebut dapat dikonversi menjadi
gelatin dengan perlakuan hidrolisis, salah satunya hidrolisis dengan menggunakan
asam. Penggunaan asam memiliki kelebihan dibandingkan dengan hidrolisis basa,
selain lebih murah (Sompie, 2015), asam mampu menguraikan serat kolagen lebih
banyak dan cepat tanpa mempengaruhi kualitas gelatin yang dihasilkan
(Ramadani, 2014). Asam asetat digunakan karena mampu mengubah kolagen
tripel heliks menjadi rantai tunggal (Sompie, 2015). Selain ramah lingkungan,
menurut Food and Drug Administration (2015) asam asetat juga aman digunakan
di dalam makanan.
Penelitian ekstraksi gelatin menggunakan asam asetat dari kulit sapi belum
3
(2011), telah melakukan penelitian terhadap gelatin dari ikan Aluterus monoceros
menggunakan hidrolisis asam asetat 0,2 M menghasilkan rendemen gelatin
berturut-turut sebesar 5,23% dan dan 9,18%. Shyni et al. (2014) melakukan
penelitian gelatin dari kulit tuna skipjack (Katsuwonus pelamis), dog shark
(Scoliodon sorrakowah), dan rohu (Labeo rohita) dengan hidrolisis asam asetat
0,2 M menghasilkan rendemen sebesar 19,7%, 11,3%, dan 17,2%. Produk gelatin
yang berasal dari ikan kurang menarik perhatian masyarakat karena faktor alergi
dan bau amis. Selain itu, gelatin yang berasal dari ikan diketahui memiliki
kandungan hidroksiprolin yang lebih rendah dari gelatin yang berasal dari
binatang mamalia yang dapat menghasilkan kekuatan gel yang lebih rendah
(Tavakolipour, 2011), sehingga pemanfaatannya dalam berbagai bidang industri
masih terbatas (wahyuni, 2003). Secara histologis, kulit ikan terdapat lapisan
corium yang mengandung serat kolagen (Pusat Pengembangan Pendidikan, 2011),
sama halnya pada kulit sapi juga terdapat lapisan dermis yang mengandung serat
kolagen yang dapat digunakan sebagai sumber utama pembuatan gelatin (Scrieber
& Gareis, 2007). Dari pertimbangan tersebut, maka asam asetat 0,2 M digunakan
dalam proses pembuatan gelatin dari kulit sapi.
Gelatin yang diperoleh dilakukan uji fisika kimia, di antaranya adalah pH,
kejernihan, kadar air, kadar abu, viskositas, sifat busa, sifat emulsifikasi, daya
serap air, daya serap lemak dan kandungan hidroksiprolin. Penelitian ini
dilakukan untuk mengetahui hasil dan karakteristik dari gelatin yang diekstraksi
dari sumber kulit sapi menggunakan metode hidrolisis asam asetat 0,2 M dan
dibandingkan dengan gelatin standar sapi komersial.
1.2 Rumusan Masalah
1. Apakah ekstraksi gelatin dari kulit sapi dengan menggunakan metode
hidrolisis asam asetat dapat dilakukan?
2. Bagaimana karakteristik gelatin dari kulit sapi yang diperoleh dengan
1.3 Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk memanfaatkan kulit sapi
sebagai bahan baku gelatin. Secara khusus, tujuan dari penelitian ini
adalah untuk:
1. Mengekstraksi gelatin dari kulit sapi yang menggunakan metode hidrolis
asam asetat
2. Mengetahui karakteristik dari gelatin kulit sapi yang diperoleh melalui
hidrolisis asam asetat
1.4 Manfaat Penelitian
Manfaat dari penelitian ini adalah dapat menghasilkan gelatin yang
diperoleh dari sumber atau bahan baku yang belum digunakan secara
BAB 2
TINJAUAN PUSTAKA
2.1 Kulit Hewan
Kulit hewan merupakan tenunan dari tubuh hewan yang terbentuk dari
sel-sel hidup. Struktur dasar kulit hewan terdiri dari tenunan serat protein yang
disebut serat kolagen, komponen yang berfungsi sebagai kerangka penguat
(Setiawati, 2009). Kulit mentah segar sebagian besar tersusun dari 64% air, 33%
protein, 2% lemak, dan 0,5% mineral (Asmi, 2014).
Sumber kedua utama kolagen untuk pembuatan gelatin adalah kulit
binatang ternak (sapi) segar. Ketebalan kulit akan dipengaruhi oleh iklim dimana
binatang ternak tersebut diperoleh. Iklim yang lebih hangat akan menghasilkan
kulit yang lebih tipis. Lapisan utama (central layer) secara praktis akan
menghasilkan kolagen murni yang akan menjadi bahan baku untuk pembuatan
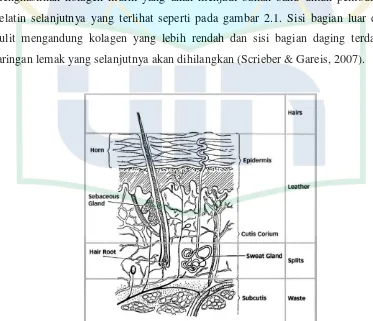
gelatin selanjutnya yang terlihat seperti pada gambar 2.1. Sisi bagian luar dari
kulit mengandung kolagen yang lebih rendah dan sisi bagian daging terdapat
jaringan lemak yang selanjutnya akan dihilangkan (Scrieber & Gareis, 2007).
Gambar 2.1 Lapisan Utama Kulit Binatang Ternak
Protein kulit terdiri dari protein kolagen, keratin, elastin, albumin, globulin
dan musin. Protein albumin, globulin dan musin larut dalam larutan garam dapur.
Protein kolagen, keratin dan elastin tidak larut dalam air dan pelarut organik.
Protein kolagen inilah yang akan direaksikan menjadi gelatin (Suhenry, S. et al.,
2015).
2.2 Protein
Protein merupakan polimer dari sekitar 21 asam amino yang berlainan
disambungkan dengan ikatan peptida (deMan, 1997). Protein adalah sumber asam
asam amino yang mengandung unsur unsur C H O N yang tidak dimiliki oleh
karbohidrat atau lemak. Fungsi utama protein bagi tubuh adalah untuk
membentuk jaringan baru dan mempertahankan jaringan yang telah ada. Sifat
amfoter protein yang dapat bereaksi dengan asam basa, dapat mengatur
keseimbanagan asam basa dalam tubuh (Winarno, 1997). Bila suatu protein
dihidrolisis dengan asam, alkali atau enzim akan menghasilkan campuran
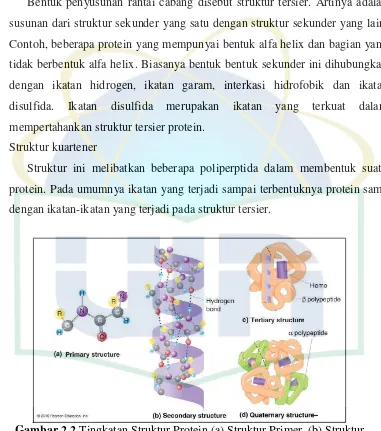
asam-asam amino (Winarno, 1997). Tingkatan struktur protein tertera pada Gambar 2.2.
2.2.1 Struktur protein
Struktur protein dibagi menjadi beberapa bentuk, yaitu struktur primer,
sekunder, tersier dan kuartener (Winarno, 1997).
1. Struktur primer
Susunan linier asam amino dalam protein merupakan struktur primer.
Susunan tersebut merupakan suatu rangkaian unik dari asam amino yang
menentukan sifat dasar dari berbagai protein, dan secara umum menentukan
bentuk struktur sekunder dan tersier. Bila protein mengandung banyak asam
amino dengan gugus hidrofobik, daya kelarutannya dalam air kurang baik jika
dibandingkan dengan protein yang mengandung banyak asam amino hidrofil.
2. Struktur sekunder
Struktur ini merupakan polipeptida yang terlipat lipat, merupakan bentuk 3
dimensi dengan cabang-cabang rantai polipeptidanya yang tersusun saling
berdekatan. Contoh bahan yang memiliki struktur ini adalah bentuk helix pada
7
Ikatan hidrogen antara amida dan oksigen karbonil merupakan gaya yang
menstabilkan yang utama. Ikatan ini dapat terbentuk antara bagian yang
berbeda pada rantai polpeptida yang sama atau antar rantai yang
berdampingan (deMan, 1997)
3. Struktur tersier
Bentuk penyusunan rantai cabang disebut struktur tersier. Artinya adalah
susunan dari struktur sekunder yang satu dengan struktur sekunder yang lain.
Contoh, beberapa protein yang mempunyai bentuk alfa helix dan bagian yang
tidak berbentuk alfa helix. Biasanya bentuk bentuk sekunder ini dihubungkan
dengan ikatan hidrogen, ikatan garam, interkasi hidrofobik dan ikatan
disulfida. Ikatan disulfida merupakan ikatan yang terkuat dalam
mempertahankan struktur tersier protein.
4. Struktur kuartener
Struktur ini melibatkan beberapa poliperptida dalam membentuk suatu
protein. Pada umumnya ikatan yang terjadi sampai terbentuknya protein sama
dengan ikatan-ikatan yang terjadi pada struktur tersier.
Gambar 2.2 Tingkatan Struktur Protein (a) Struktur Primer (b) Struktur Sekunder (c) Struktur Tersier (d) Struktur Kuartener.
2.2.2 Protein Berdasarkan Bentuk
1. Protein globular
Terdiri dari polipeptida yang bergabung satu sama lain (berlipat rapat)
membentuk bulat padat. Misalnya aktin, miosin, tropomiosin, albumin, dan
mioglobin. Protein ini dapat larut dalam garam (protein miofibrillar) dan air
(protein sarkoplasma).
2. Protein serabut (fibrous protein)
Terdiri dari peptida berantai panjang dan berupa serat-serat yang tersusun
memanjang, dan memberikan peran struktural atau pelindung. Protein ini tidak
larut dalam air, asam, basa, maupun etanol (protein stroma). Contoh protein
stroma yaitu kolagen dan elastin yang merupakan protein yang terdapat pada
bagian luar sel otot.
2.2.3 Protein Berdasarkan Fungsi
Winarno (1984), mengatakan bahwa protein mempunyai berbagai
fungsi bagi tubuh, yaitu :
1. Sebagai enzim
Hampir semua reaksi biologis dipercepat atau dibantu oleh suatu
senyawa makromolekul spesifik yang disebut enzim, misalnya tripsin.
2. Zat pengatur pergerakan
Protein merupakan komponen utama daging. Gerakan otot terjadi
karena adanya dua molekul protein yang saling bergesekan, misalnya aktin
dan miosin.
3. Pertahanan tubuh (imunitas)
Pertahanan tubuh biasanya dalam bentuk antibodi yaitu suatu protein
khusus yang dapat mengenal atau mengikat benda-benda asing yang
masuk ke dalam tubuh, seperti virus, bakteri, dan sel-sel lain. Protein dapat
membedakan benda yang menjadi anggota tubuh dan benda-benda asing.
4. Alat pengangkut dan alat penyimpan
Banyak molekul dengan berat molekul kecil serta beberapa ion dapat
diangkut atau dipindahkan oleh protein-protein tertentu. Misalnya
9
5. Penunjang mekanis
Kekuatan dan daya tahan robek kulit dan tulang disebabkan oleh
kolagen.
6. Media perambatan impuls (saraf)
Protein yang mempunyai fungsi ini biasanya berbentuk reseptor,
misalnya rodopsin yaitu suatu protein yang bertindak sebagai
reseptor/penerima warna atau cahaya pada sel-sel mata.
7. Pengendalian pertumbuhan (hormon)
Protein ini bekerja sebagai reseptor (dalam bakteri) yang dapat
mempengaruhi fungsi bagian-bagian DNA yang mengatur sifat dan
karakter bahan. Contohnya yaitu hormon insulin dan paratiroid.
2.3 Asam amino
Sebuah asam amino terdiri dari sebuah gugus amino, sebuah gugus
karboksil, sebuah atom hidrogen dan gugus R (rantai cabang) yang terikat pada
sebuah atom C yang dikenal sebagai karbon alfa seperti pada Gambar 2.3
(Winarno, 1997, h.52). Asam amino yang disambungkan dengan ikatan peptida
akan membentuk struktur primer protein. Susunan asam amino menentukan sifat
struktur sekunder dan tersier. (deMan, 1997).
Gambar 2.3 Struktur Asam Amino
(Sumber: http://study.com)
Pada umumnya, asam amino larut dalam air dan tidak larut dalam pelarut
organik non polar seperti eter, aseton, dan kloroform. Apabila asam amino
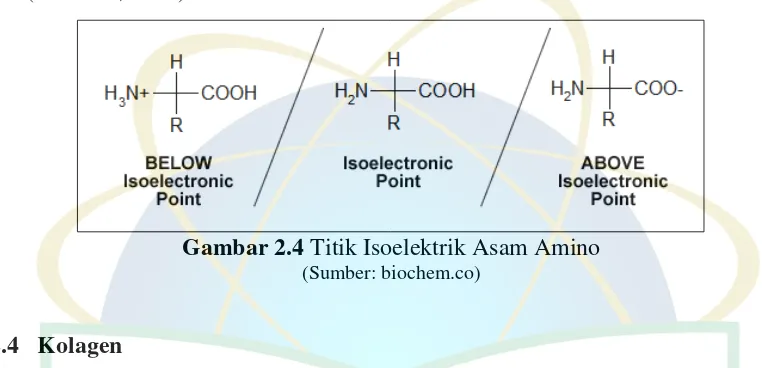
Asam amino dalam kondisi netral (pH isoelektrik) berada dalam bentuk
ion dipolar, gugus amino mendapat tambahan sebuah proton dan gugus karboksil
terdisosiasi. Derajat asam amino dipengaruhi oleh pH. Pada pH yang rendah
misalnya pada pH 1, gugus karboksilnya tidak terdisosiasi, sedang gugus
aminonya menjadi ion. Pada pH yang tinggi misalnya pada pH 11, karboksilnya
terdisosiasi sedang gugusan aminonya tidak, seperti terlihat pada gambar berikut
ini (Winarno, 1997).
Gambar 2.4 Titik Isoelektrik Asam Amino
(Sumber: biochem.co)
2.4 Kolagen
Kolagen merupakan protein fibriler (protein yang berbentuk serabut).
Protein serabut ini tidak larut dalam pelarut encer, sukar dimurnikan, susunan
molekulnya terdiri dari molekul yang panjang dan tidak membentuk kristal dan
bila rantai ditarik memanjang dapat kembali seperti semula (Winarno 1997).
Istilah 'kolagen' berasal dari kata Yunani yang artinya “bersifat lekat atau menghasilkan lekat” dan awalnya digunakan untuk menggambarkan jaringan ikat yang akan menghasilkan gelatin pada kondisi mendidih (Bhattacharjee, A., 2005).
Kolagen adalah komponen struktural utama dari semua jaringan ikat dan juga
ditemukan dalam jaringan interstitial pada semua parenkim organ, di mana
kolagen dapat berfungsi pada stabilitas jaringan dan organ serta dapat
mempertahankan integritas struktur (Gelse, K., 2003).
Kolagen banyak terdapat dalam vertebrata tingkat tinggi. Hampir sepertiga
protein dalam tubuh vertebrata berada sebagai kolagen. Semakin besar hewan,
semakin besar pula bagian total protein yang merupakan kolagen. Jika dididihkan
di dalam air, kolagen akan mengalami transformasi dari bentuk untaian.
Perubahan ini melibatkan hidrolisis beberapa ikatan kovalen pada kolagen.
11
yang jarang ditemukan pada protein selain pada kolagen dan elastin yang paling
tinggi adalah prolin dan 4-hidroksiprolin. Bersama-sama, prolin dan hidroksiprolin mencapai kira-kira 21% dari residu asam amino pada kolagen
(Katili, A.S., 2009).
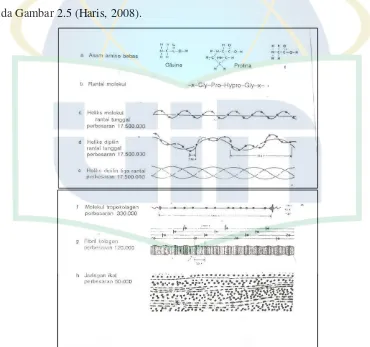
Unit struktural pembentuk kolagen adalah tropokolagen yang mempunyai
struktur batang dengan BM 300.000, didalamnya terdapat tiga rantai polipeptida
yang sama panjang, bersama-sama membentuk struktur heliks. Tiap tiga rantai
polipeptida dalam unit tropokolagen membentuk struktur heliks tersendiri,
menahan bersama-sama dengan ikatan hidrogen antara grup NH dari residu glisin
pada rantai yang satu dengan grup CO pada rantai lainnya. Cincin pirolidin,
prolin, dan hidroksiprolin membantu pembentukan rantai polipeptida dan
memperkuat triple heliks. Urutan tahap pada pembentukan kolagen dapat dilihat
pada Gambar 2.5 (Haris, 2008).
Kolagen tersusun dari struktur seperti serabut berbentuk linear. Sejauh ini
terdapat 27 kolagen yang dapat diidentifikasi. Tipe I kolagen dapat ditemukan
terutama pada jaringan ikat seperti kulit, tulang dan tendon. Tipe II kolagen
umumnya terdapat pada jaringan kartilago. Tipe III kolagen tergantung pada usia
jaringan, seperti pada kulit yang sangat muda dapat mengandung sampai 50%
tetapi akan menurun 5-10% seiring berjalannya waktu. Tipe kolagen yang lain
berjumlah sangat sedikit dan hanya ditemukan pada organ spesifik (Scrieber &
Gareis, 2007).
Kolagen murni yang tidak larut harus harus diberikan perlakuan
sebelumnya dan dapat dirubah menjadi bentuk yang sesuai untuk ekstraksi,
dimana secara normal dilakukan pemanasan pada suhu diatas 45˚C. perlakuan secara kimia akan memecah ikatan non-kovalen dan merusak struktur protein,
sehingga menghasilkan proses mengembang dan pelarutan kolagen yang cukup
(Gomez-Guillén, M.C. et al., 2011)
2.5 Gelatin 2.5.1 Definisi
Gelatin berasal dari bahasa latin ”gelare” yang berarti “membuat beku” (Senning, Alexander, 2007). Gelatin adalah suatu zat yang diperoleh dari hidrolisa
parsial kolagen dari kulit, jaringan ikat
putih dan tulang hewan (Farmakope Indonesia Edisi V, 2014). Sumber
alternatif lainnya adalah unggas dan ikan. mineral pada tulang, lemak dan
albuminoid pada kulit akan dihilangkan secara kimia dan perlakuan fisika untuk
mendapatka kolagen murni (GMIA, 2012).
Gelatin merupakan senyawa yang sangat menarik karena bersifat
multifungsi. Komposisi utama dari gelatin adalah protein. Kandungan protein
berkisar antara 85-92% dengan garam mineral dan kelembaban yang masih
tertinggal setelah pengeringan (Scrieber & Gareis, 2007). Gelatin termasuk
molekul besar. Fraksi protein terdiri dari hampir seluruh asam amino yang
bergabung bersama oleh ikatan amida untuk membentuk polimer linear dengan
berat molekul yang bervariasi dari 20.000-200.000 (Rowe, Raymon C. et al.,
13
2.5.2 Komposisi dan struktur kimia
Gelatin mempunyai susunan senyawa kimia yang bervariasi. Komponen
utama senyawa penyusun gelatin adalah 50,5% karbon, 6,8% hidrogen, 17%
nitrogen dan 25,2% oksigen (Gelatin Manufacturers Institute of America, 2012).
Gelatin umumnya mengandung 88% protein, 10% air dan 1-2% garam (Sikorski,
Zdzislaw E. et al.,1994).
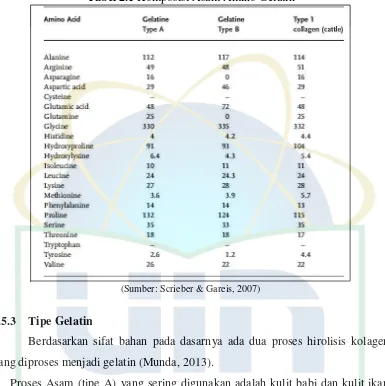
Komposisi asam amino gelatin bervariasi tergantung pada sumber kolagen
tersebut, spesies hewan penghasil, dan jenis kolagen. Penurunan komposisi asam
amino tergantung pada metode pembuatannya. Pembuatan dengan proses alkali
umumnya lebih banyak mengandung hidroksiprolin dan lebih sedikit mengandung
tirosin dibanding dengan proses asam seperti yang dipaparkan pada tabel 2.1.
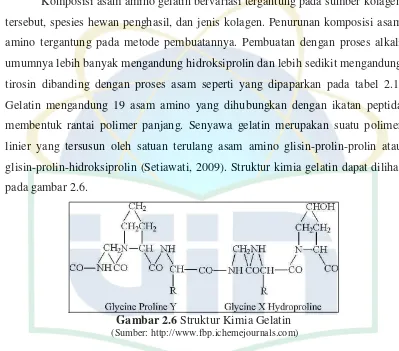
Gelatin mengandung 19 asam amino yang dihubungkan dengan ikatan peptida
membentuk rantai polimer panjang. Senyawa gelatin merupakan suatu polimer
linier yang tersusun oleh satuan terulang asam amino glisin-prolin-prolin atau
glisin-prolin-hidroksiprolin (Setiawati, 2009). Struktur kimia gelatin dapat dilihat
pada gambar 2.6.
Gambar 2.6 Struktur Kimia Gelatin
Komposisi asam amino gelatin dan kolagen yang dinyatakan sebagai
residu per 1000 residu asam amino tercantum pada tabel berikut (Schrieber &
Gareis, 2007):
Tabel 2.1 Komposisi Asam Amino Gelatin
(Sumber: Scrieber & Gareis, 2007)
2.5.3 Tipe Gelatin
Berdasarkan sifat bahan pada dasarnya ada dua proses hirolisis kolagen
yang diproses menjadi gelatin (Munda, 2013).
1. Proses Asam (tipe A) yang sering digunakan adalah kulit babi dan kulit ikan
dan terkadang tulang sebagai bahan baku. Hal ini didasarkan pada di mana
kolagen yang diasamkan menjadi pH sekitar 4 dan kemudian dipanaskan
secara bertahap dari 50°C sampai mendidih mengubah sifat dan melarutkan
kolagen. Setelah itu kolagen di degreasing atau larutan gelatin harus
dihilangkan lemaknya, kemudian disaring untuk kejernihan, dipekatkan
dengan perlakuan penguapan vakum atau membran ultra filtrasi, untuk
mendapatkan konsentrasi yang cukup tinggi untuk gelatin dan kemudian
dikeringkan dengan melewatkan udara kering selama gel. Proses terakhir salah
satunya penggilingan dan pencampuran untuk kebutuhan pelanggan dan
15
2. Proses alkali (tipe B) yang digunakan pada kulit sapi dan sumber kolagen di
mana hewan relatif tua di pemotongan. Salah satu prosesnya di mana kolagen
mengalami proses pengapuran panjang sebelum ekstraksi. Hidrolisis basa
asparagin dan rantai samping glutamin untuk asam glutamat dan aspartat
relatif cepat. Setelah pengolahan alkali, kolagen yang dicuci bebas dari alkali
dan kemudian diberikan perlakuan dengan asam dengan pH ekstraksi yang
diinginkan (yang memiliki efek yang ditandai pada kekuatan gel rasio
viskositas produk akhir). Kolagen ini kemudian didenaturasi dan diubah
menjadi gelatin dengan pemanasan, karena dengan proses asam. Perlakuan
alkali, itu sering perlu untuk demineralisasi gelatin untuk menghapus jumlah
berlebihan garam menggunakan pertukaran ion atau ultrafiltrasi. Setelah itu
proses sama seperti proses asam-vakum penguapan, filtrasi, gelatinisasi,
pengeringan, penggilingan dan pencampuran.
Gelatin tipe A yang diproduksi menggunakan proses asam mempunyai
nilai viskositas setengahnya dari gelatin B yang diproses menggunakan basa.
Gelatin tipe B dengan viskositas yang lebih tinggi dapat menguntungkan proses
produksi stabilisasi emulsi. (Schrieber & Gareis, 2007).
Waktu, pH, suhu, jumlah ekstraksi bervariasi tergantung dari kebutuhan
produk, tipe peralatan yang digunakan, waktu pengoperasian, dan aspek ekonomi.
Prosedur ekstraksi harus dikontrol karena akan mempengaruhi kualitas dan
kuantitas gelatin yang dihasilkan (GMIA, 2012). Perbedaan sifat antara gelatin
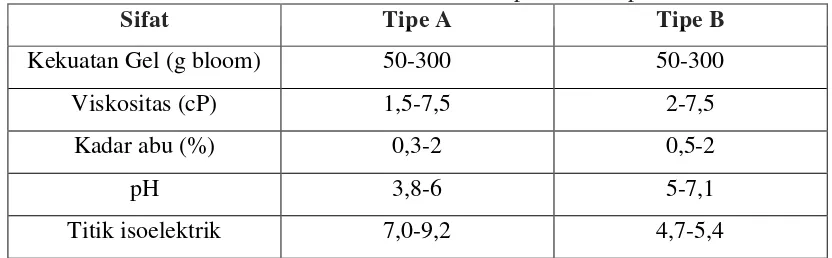
tipe A dan tipe B dapat dilihat pada tabel berikut:
Tabel 2.2 Perbedaan Sifat Gelatin Tipe A dan Tipe B
Sifat Tipe A Tipe B
Kekuatan Gel (g bloom) 50-300 50-300
Viskositas (cP) 1,5-7,5 2-7,5
Kadar abu (%) 0,3-2 0,5-2
pH 3,8-6 5-7,1
Titik isoelektrik 7,0-9,2 4,7-5,4
2.5.4 Karakteristik Kimia dan Fisika
Menurut Farmakope Indonesia Edisi V (2014), Gelatin mempunyai
karakteristik berupa Lembaran, kepingan atau potongan, atau serbuk kasar sampai
halus, kuning lemah atau coklat terang, warna bervariasi tergantung ukuran
partikel. Larutannya berbau lemah seperti kaldu. Jika kering stabil di udara, tetapi
mudah terurai oleh mikroba jika lembab atau dalam bentuk larutan.
Sifat kelarutan dari gelatin adalah tidak larut dalam air dingin,
mengembang dan lunak bila dicelup dalam air, menyerap air secara bertahap
sebanyak 5 - 10 kali beratnya, larut dalam air panas, asam asetat 6 N dan
campuran panas gliserin dan air, serta tidak larut dalam etanol, kloroform, eter,
minyak lemak dan minyak menguap (FI V, 2014). Gelatin larut dalam asam dan
basa walaupun dalam asam dan basa kuat dapat menyebabkan pengendapan.
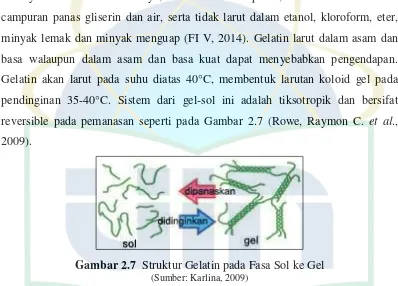
Gelatin akan larut pada suhu diatas 40°C, membentuk larutan koloid gel pada
pendinginan 35-40°C. Sistem dari gel-sol ini adalah tiksotropik dan bersifat
reversible pada pemanasan seperti pada Gambar 2.7 (Rowe, Raymon C. et al.,
2009).
Gambar 2.7 Struktur Gelatin pada Fasa Sol ke Gel
(Sumber: Karlina, 2009)
Berdasarkan Handbook of Pharmaceutical Excipients Ed.6, Gelatin pada
suhu 25°C untuk 1% b/v larutan aqueous, memiliki sifat keasaman dan kebasaan
yaitu pH= 3,8-5,5 (tipe A) dan pH 5-7,5 (tipe B). Gelatin memiliki massa jenis
1.32 g/cm3 untuk tipe A dan 1.28 g/cm3 untuk tipe B. Titik isoelektrik gelatin
adalah 7.0–9.0 untuk tipe A dan 4.7–5.4 untuk tipe B serta memiliki kandungan kelembapan 9-11%.
Gelatin berbentuk larutan juga akan stabil dalam jangka waktu yang lama
jika disimpan dibawah kondisi dingin. Pada suhu diatas 50°C, larutan gelatin akan
17
depolimerisasi akan lebih tinggi jika suhu diatas 65°C. Kecepatan depolimerisasi
tergantung pada berat molekul gelatin. Semakin kecil berat molekulnya, maka
penguraian materilnya akan semakin cepat. Gelatin dapat disterilisasi dengan
pemanasan kering.
Menurut Schrieber & Gareis, sifat fungsional gelatin dapat dibagi menjadi
2 kelompok. pertama, sifat yang berhubungan dengan gel dan sifat yg kedua
adalah berhubungan dengan permukaan gelatin. Berikut adalah sifat yang paling
penting dari gelatin adalah:
1. Sifat yang berhubungan dengan gel
a. Pembentukan gel
b. Sifat tekstur
c. Ketebalan
d. Pengikatan air
2. Efek permukaan
a. Pembentukan dan stabilisasi emulsi
b. Fungsi perlindungan koloid
c. Pembentukan dan stabilisasi busa
d. Pembentukan film
2.5.4.1 Pembentukan Gel, Viskositas dan Tekstur
Pembentukan gel, viskositas dan tekstur adalah sifat yang sangat
ditentukan oleh struktur, ukuran molekul dan suhu dari sistem. gelatin merupakan
campuran rantai polimer dengan panjang yang berbeda. Dengan demikian, larutan
yang sebenarnya tidak terbentuk, namun terbentuk larutan koloidal atau larutan
cair. pada proses pendinginan, bentuk larutan akan berubah menjadi gel,
begitupula sebaliknya pada proses pemanasan akan kembali ke bentuk larutan.
2.5.4.2 Sifat Amfoterik
Larutan gelatin bersifat amfoter karena dapat bereaksi dengan penambahan
asam maupun basa. Dalam suasana asam, gelatin bermuatan positif dan berubah
nol (netral) dan pergerakan tidak terjadi, maka dikenal dengan istilah titik
isoelektrik (GMIA, 2012).
Gelatin Tipe A menunjukkan titik isoelektrik antara pH 7 dan pH 9,
gelatin Tipe B menunjukkan titik isoelektrik antara pH 4,7 dan pH 5,2. (Rowe,
Raymon C. et al., 2009). Semakin tinggi pH, maka gelatin akan bermuatan negatif
dan sebaliknya semakin rendah pH, gelatin akan bermuatan positif. pH pada
larutan gelatin sekitar 5-9. pH dibawah 5 akan bermuatan positif dan pH diatas 9
akan bermuatan negatif. Pola distribusi muatan gelatin tipe A dan tipe B pada
larutan aqueous dalam pH yang berbeda ditunjukkan dalam gambar berikut
(Schrieber & Gareis, 2007):
Gambar 2.8 Pola Distribusi Muatan Gelatin Tipe A dan Tipe B dalam pH yang Berbeda
(Sumber: Scrieber & Gareis, 2007)
2.5.4.3 Sifat Permukaan
Sifat permukaan gelatin terbentuk berdasarkan rantai samping gelatin.
Gelatin tersusun atas protein yang memiliki gugus muatan dan bagian tertentu dari
sekuen kolagen yang mengandung asam amino hidrofilik dan hidrofobik seperti
yang terlihat pada tabel 4. Kedua bagian hidrofilik dan hidrofobik cenderung
berpindah ke permukaan, sehingga dapat menurunkan tegangan permukaan dari
larutan aqueous. Pada waktu yang sama, gelatin mempunyai beberapa sifat yang
dapat melindungi dan menstabilkan permukaan yang telah terbentuk. Sifat dari
multifungsi gelatin ini dapat dimanfaatkan dalam produksi dan stabilisasi busa
19
Kemampuan untuk membentuk dan menstabilkan busa tergantung dari
struktur molekul senyawa. Pada dasarnya, kemampuan tersebut harus dapat
mempengaruhi sifat permukaan aktif yang dapat menurunkan tegangan
permukaan pada interface udara dan larutan.
Tabel 2.3 Asam Amino Hidrofilik dan Hidrofobik pada Gelatin
(Sumber: Gelatine Handbook Scrieber & Gareis, 2007)
2.5.5 Kolagen Menjadi Gelatin
Proses pengubahan kolagen menjadi gelatin melibatkan 3 perubahan
berikut (deMan, 1997):
1. pemutusan sejumlah terbatas ikatan peptida untuk memperpendek rantai,
2. pemutusan atau perusakan sejumlah ikatan samping antar rantai,
3. perubahan konfigurasi rantai.
Perubahan terkahir merupakan satu-satunya perubahan penting untuk
pengubahan kolagen menjadi gelatin. Kondisi yang digunakan selama produksi
gelatin berhubungan dengan tingkat pre-treatment dan proses ekstraksi, seperti
fungsi pH, suhu, waktu ektraksi (Gomez-Guillén, M.C., 2011).
Proses reaksi pembentukan gelatin (Munda, 2013):
Gambar 2.9 Reaksi Pembentukan Gelatin
Tropokolagen akan terdenaturasi oleh pemanasan atau perlakuan dengan
zat, seperti asam, basa, urea, dan potasium permanganat. Selain itu, serabut
kolagen dapat mengalami penyusutan jika dipanaskan di atas suhu penyusutannya
(Ts) (Haris, 2008). Proses penyusutan kolagen ini menyebabkan struktur kolagen
pecah menjadi lilitan acak yang larut dalam air seperti yang ditunjukkan pada
Gambar 2.10 (Martianingsih & Atmaja, 2009).
Gambar 2.10 Transisi Rantai Helik-Gulungan pada Kolagen
(Sumber: Martianingsih & Atmaja, 2009)
Ikatan-ikatan hidrogen yang dirusak dan ikatan-ikatan kovalen yang
dipecah tersebut akan mendestabilkan tripel helik melalui transisi helik
ke-gulungan dan menghasilkan konversi yang larut air. Tropokolagen yang
diekstraksi mengalami reaksi hidrolisis yang sama dengan reaksi hidrolisis
tropokolagen yang terjadi saat hidrolisis dalam larutan asam. Reaksi hidrolisis
tersebut diilustrasikan pada Gambar 2.11 dan Gambar 2.12 di mana ikatan
hidrogen dan ikatan silang kovalen rantai-rantai tropokolagen diputus sehingga
menghasilkan tropokolagen tripel helik yang berubah menjadi rantai dapat larut
21
Gambar 2.11 Reaksi Pemutusan Ikatan Hidrogen Tropokolagen
(Sumber: Martianingsih & Atmaja, 2009)
Gambar 2.12 Reaksi Hidrolisis Ikatan Silang Kovalen Tropokolagen
(Sumber: Martianingsih & Atmaja, 2009)
2.5.6 Mutu Gelatin
Mutu gelatin ditentukan oleh sifat fisika, kimia, dan fungsional yang
menjadikan gelatin sebagai karakter yang unik. Sifat-sifat yang dapat dijadikan
parameter dalam menentukan mutu gelatin antara lain kekuatan gel, viskositas,
dan rendemen. Kekuatan gel dipengaruhi oleh pH, adanya komponen elektrolit
dan non-elektrolit dan bahan tambahan lainnya, sedangkan viskositas dipengaruhi
oleh interaksi hidrodinamik, suhu, pH, dan konsentrasi (Setiawati, 2009).
Menurut Farmakope Indonesia Ed.V (2014), Gelatin dapat mengandung
sulfur dioksida tidak lebih dari 0,15% dan dapat mengandung natrium lauril sulfat
Persyaratan gelatin berdasarkan FAO dan Standar mutu gelatin
berdasarkan SNI (1995) dan dapat dilihat pada Tabel:
Tabel 2.4 Persyaratan Gelatin Berdasarkan FAO
Parameter Persyaratan
Kadar abu Tidak lebih dari 2%
Kadar air Tidak lebih dari 18%
Belerang dioksida Tidak lebih dari 40%
Arsen Tidak lebih dari 1 mg/kg
Logam Berat Tidak lebih dari 50 mg/kg
Timah Hitam Tidak lebih dari 5 mg/kg
Batas cemaran mikroba
Standard plate count
E-coli
Streptococci
Kurang dari 104/gr
Kurang dari 10/gr
Kurang dari 102/gr
(Sumber: JECFA, 2003)
Tabel 2.5 Standar Mutu Gelatin Menurut SNI 1995
Karakteristik Syarat
Warna Tidak Berwarna – kuning pucat
Bau, Rasa Normal (dapat diterima konsumen)
Kadar Air Maksimum 16%
Kadar Abu Maksimum 3,25%
Logam Berat Maksimum 50 mg/kg
Arsen Maksimum 2 mg/kg
Tembaga Maksimum 30 mg/kg
Seng Maksimum 100 mg/kg
Sulfit Maksimum 1000 mg/kg
23
2.6 Analisis Protein Metode Spektrofotometri (Praira, 2008)
Konsentrasi protein dapat diketahui dengan metode spektrofotometri, baik
menggunakan sinar ultraviolet (UV) maupun sinar tampak. Metode
spektrofotometri biasanya menggunakan suatu pereaksi atau reagen pewarna yang
intensitas warna yang dibentuknya sebanding dengan konsentrasi protein dalam
sampel. Metode yang umum digunakan untuk mengukur konsentrasi protein
dengan teknik spektrofotometri di antaranya adalah metode Biuret, Lowry,dan
Bradford.
Prinsip dasar metode spektrofotometri ini adalah pelewatan cahaya yang
memiliki panjang gelombang tertentu melalui suatu sampel. Cahaya tersebut
kemudian sebagian diserap oleh sampel berwarna dan sebagian lagi diteruskan
lalu ditangkap oleh alat pendeteksi/pengukur cahaya yang disebut fotometer.
Intensitas cahaya yang diukur oleh fotometer dikonversi menjadi satuan serapan
(absorbansi) dan kemudian digunakan untuk menghitung konsentrasi sampel
dengan persamaan Lambert-Beer.
cahaya yang diteruskan oleh sampel, ε= Koefisien absorpsi molekul, l= Ketebalan lapisan larutan sampel, C= Konsentrasi, T= Transmitan.
2.6.1 Analisis Protein Metode Biuret (Praira, 2008)
Metode Biuret merupakan metode analisis protein yang paling sederhana
dibandingkan dengan metode Lowry dan Bradford. Metode ini telah ditemukan
pada tahun 1915, kemudian dimodifikasi oleh Gornall et al. pada tahun 1949.
Metode biuret yang dimodifikasi inilah yang sampai saat ini sering digunakan
dalam penentuan protein.
Pereaksi Biuret terdiri atas campuran tembaga dengan kompleks natrium
yang dapat menstabilkan tembaga dalam larutan. Dalam hal ini Gornal et al
Prinsip metode Biuret ini adalah pembentukan kompleks berwarna antara
garam tembaga yang ada pada pereaksi dengan ikatan peptida yang ada pada
sampel. Reaksi ini menghasilkan dua spektrum cahaya maksimum, yaitu pada
panjang gelombang 270 nm dan 540 nm. Penggunaan panjang gelombang 540 nm
lebih disarankan walaupun hasil pada panjang gelombang 270 nm memiliki
sensitivitas 6 kali lebih besar dari pada panjang gelombang 540 nm. Hal ini
disebabkan banyaknya senyawa pengganggu yang juga menyerap cahaya pada
panjang gelombang 270 nm ini.
Metode biuret ini telah banyak digunakan untuk penentuan protein dalam
berbagai bidang, di antaranya adalah penentuan protein total dalam serum atau
plasma, cairan otak dan tulang belakang, dan urin. Selain hanya membutuhkan
beberapa jenis pereaksi saja, metode ini juga tergolong mudah dan cepat.
Kelemahan metode ini adalah kurang sensitif jika dibandingkan dengan dua
metode lainnya, yakni metode Lowry dan Bradford. Metode Biuret ini
membutuhkan sampel dengan konsentrasi yang cukup besar. Metode ini lebih
banyak membutuhkan bahan dan sedikit terganggu dengan adanya senyawa garam
seperti garam-garam amonium. Menurut Alexander dan Griffith (1993) metode ini
baik digunakan untuk identifikasi protein dengan konsentrasi 0,2-2,0 mg/ml.
2.6.2 Analisis Protein Metode Lowry (Praira, 2008)
Metode Lowry merupakan metode yang telah umum digunakan dalam
analisis protein. Metode ini cukup sensitif dan telah banyak digunakan dalam
analisis protein total di antaranya dalam fraksi sel, fraksi kromatografi, dan
preparasi enzim. Prinsip dasar metode Lowry adalah pembentukan kompleks
antara ikatan peptida pada protein dengan ion cupri (Cu2+) dalam kondisi basa. Ion
cupri (Cu2+) kemudian direduksi menjadi ion cupro (Cu+) . Ion cupro (Cu+) ini dan
grup-grup radikal dari beberapa asam amino seperti tirosin, triptofan, asparagin,
histidin, dan sistein akan bereaksi dengan pereaksi Folin Ciocalteu menghasilkan
senyawa molibdat/tungstat biru.
Metode ini memiliki sensitivitas yang cukup tinggi. Menurut Alexander
dan Griffith (1993), metode ini mampu mengidentifikasi protein hingga
konsentrasi 0,02 mg/ml. Namun, kelemahan metode ini adalah senyawa
25
Metode Lowry ini merupakan metode identifikasi protein yang cukup
banyak memiliki senyawa pengganggu dibandingkan metode Biuret dan Bradford.
Senyawasenyawa yang dapat mengganggu dalam metode ini di antaranya adalah
gugus fenolik, lipid, deterjen, amonium sulfat, guanin, melanin, bilirubin,
4-metilumbeliferona, merkaptosistein, tris-HCl, dan RNA.
2.6.3 Analisis Protein Metode Bradford (Praira, 2008)
Metode bradford merupakan metode analisis protein yang menggunakan
coomassie brilliant blue G-250. Metode ini lebih sensitif daripada metode Biuret
dan Lowry. Metode ini baik digunakan untuk protein yang konsentrasinya
0,0-0,02 mg/ml. Selain itu, metode ini juga cukup cepat, mudah, dan sedikit senyawa
penggangu. Walaupun demikian, selain membutuhkan pereaksi yang cukup
mahal, metode ini tidak baik digunakan untuk protein dengan bobot molekul
rendah.
Analisis protein dengan metode Bradford didasarkan atas pembentukan
ikatan antara pewarna coomassie dengan beberapa asam amino seperti arginin dan
residu asam amino hidrofobik yang ada pada protein. Pembentukan ikatan
menghasilkan warna biru dan memiliki spektrum absorbansi maksimum sebesar
595 nm. Bentuk yang tidak berikatan (anionik) ditunjukkan oleh warna hijau atau
merah. Nilai absorbansi yang diperoleh pada panjang gelombang 595 nm
sebanding dengan jumlah senyawa yang berikatan, dan sebanding dengan
konsentrasi protein pada sampel. Metode Bradford sedikit lebih praktis dan lebih
26
METODE PENELITIAN
3.1 Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari-Juli 2016 bertempat di
Laboratorium Kimia Obat dan Laboratorium Penelitian II, Program Studi Farmasi
Fakultas Kedokteran dan Ilmu Kesehatan UIN Syarif Hidayatullah Jakarta, serta
Laboratorium Farmasetika Fakultas Farmasi Universitas Indonesia.
3.2 Alat dan Bahan Penelitian 3.2.1 Alat
Alat yang digunakan dalam penelitian ini adalah gunting, wadah pencuci,
talenan, termometer, stopwatch, batang pengaduk, cetakan gelatin, oven
(Memmert), timbangan analitik (Kern), pengaduk magnetik, pH universal, gelas
ukur, sentrifuge (Hettich-EBA 20 Zentrifugen), tabung sentrifuge, pH meter (F-52
Horiba), hot plate, penangas air (Eyela Digital SB-1000), viskometer Brookfield,
vortex, homogenizer (Nissei AM 11), shaker bath, gelas piala, pipet tetes, spatula,
kertas perkamen, spektrofotometer UV-Vis (Hitachi U-2910), kuvet, erlenmeyer,
labu ukur, kertas saring Whatmann no 1, tabung reaksi, pipet volumetrik, cawan,
desikator, lemari asam, cawan pengabu, tanur (Thermolyne), tissue, lemari
pendingin, corong butchner, vakum filtrasi, oven, alumunium foil, penggaris.
3.2.2 Bahan
Bahan yang digunakan dalam penelitian ini adalah kulit sapi, natrium
sulfida (Na2S), kalsium hidroksida (Ca(OH2), asam asetat 0,2 M, natrium klorida
(NaCl) 0,3 M, aquadest, natrium hidroksida (NaOH) (6N, 1 M), asam klorida
(HCl) (6 N, 3 M), minyak kedelai, minyak palm, Sodium Dodecyl Sulfate 0,1%,
isopropanol, larutan oksidan Chloramin T 7% (w/v) dan buffer asetat/sitrat pH 6
rasio 1:4 (v/v)), reagen Ehrlich’s, buffer asetat-sitrat, larutan standar hidroksiprolin, gelatin standar sapi komersial (Gelatin from bovine skin, Sigma
27
3.3 Prosedur Penelitian
3.3.1 Penyiapan Bahan Baku Kulit
Bahan baku yang digunakan adalah kulit sapi berbulu coklat pendek
sebanyak 1 kg yang diperoleh dari pasar tradisional Ciputat, Tangerang Selatan,
Banten. Pengumpulan bahan baku dilakukan pada hari Senin, 25 Januari 2016.
Kulit sapi dimasukkan dalam kantong plastik dan ditutup rapat, kemudian
disimpan dalam lemari pendingin untuk preparasi dan analisis gelatin berikutnya.
3.3.1.1 Proses Pembuangan Bulu
Proses pembuangan bulu dilakukan menggunakan metode Yusuf (2011)
dengan sedikit modifikasi. Sebelum dibuang bulu, terlebih dahulu dilakukan
pemotongan kulit dengan ukuran berkisar 15x15 cm. Kulit tersebut direndam pada
suhu ruang menggunakan campuran 3 gram natrium disulfida (Na2S), 2 gram
kalsium hidroksida (Ca(OH)2) dan 300 ml air (H2O) selama ±3 jam atau sampai
bulu yang ada pada kulit terlepas sempurna. Kulit dibersihkan dari bulu, lemak
dan daging. Kemudian kulit dicuci dengan cara dialiri menggunakan air mengalir
hingga pH netral (6-7).
3.3.2 Proses Konversi Kolagen Menjadi Gelatin 3.3.2.1 Proses Hidrolisis Kulit Sapi
Hidrolisis gelatin dari kulit sapi dilakukan menggunakan metode Shyni
(2014) dengan modifikasi. Kulit sapi yang sudah bersih ditiriskan dan dipotong
kecil-kecil dengan ukuran 2x2 cm untuk selanjutnya ditimbang sebagai berat
basah. Sebanyak 200 gram potongan kulit direndam dengan 1 liter asam asetat 0,2
M selama 48 jam pada suhu 5°C. Potongan kulit dipisahkan dan dialiri dengan air
mengalir hingga pH netral (6-7).
3.3.2.2 Proses Ekstraksi Gelatin
Ekstraksi gelatin dilakukan menggunakan metode Martianingsih (2009)
dengan sedikit modifikasi. Potongan kulit diekstraksi dalam penangas air pada
3.3.3 Proses Penyaringan dan Pengeringan Gelatin
Proses penyaringan dan pengeringan gelatin ini dilakukan menggunakan
metode Martianingsih (2009) dengan sedikit modifikasi. Ekstrak disaring dengan
kertas saring whatmann nomor 1 menggunakan penyaring vakum. Filtrat yang
diperoleh kemudian dimasukkan ke dalam oven selama 2 jam pada suhu 70°C,
lalu dimasukkan ke dalam lemari pendingin hingga membentuk gel. Setelah
dituangkan ke dalam cetakan, gel dioven dengan suhu 60°C selama 48 jam atau
hingga terbentuk lapisan gelatin yang kering. Lapisan tipis gelatin ditimbang dan
dikecilkan ukurannya untuk disimpan dalam wadah yang tertutup rapat.
3.3.4 Menghitung Nilai Rendemen Gelatin
Nilai rendemen gelatin dihitung berdasarkan berat basah dari kulit, dengan
menggunakan rumus (R. Balti et al.,2011):
% rendemen=Bobot basah kulit segar (g) x 100%Bobot gelatin kering (g)
3.3.5 Karakterisasi Gelatin 3.3.5.1 Uji pH Gelatin
Nilai pH dari larutan gelatin dapat diukur menggunakan metode Alfaro et
al. (2014). Larutan gelatin dibuat dalam konsentrasi 1% (b/v) dengan cara
melarutkan 0,1 gram gelatin dalam 10 ml aquadest pada suhu 60°C. Selanjutnya
diaduk konstan selama 30 menit dan dibiarkan pada suhu ruang (25°C). pH diukur
menggunakan pH meter F-52 Horiba .
3.3.5.2 Uji Kejernihan Larutan Gelatin
Kejernihan dapat diuji dengan menggunakan metode Shyni et al., 2013.
Larutan gelatin dibuat pada konsentrasi 6,67% (b/v) dengan cara dilarutkan
menggunakan aquadest pada suhu 60°C selama 1 jam. Kemudian dilakukan
pengukuran transmittan (%T) pada panjang gelombang 620 nm menggunakan
29
3.3.5.3 Uji Kadar Air Gelatin
Sebanyak 2 gram sampel gelatin dimasukkan dalam botol timbang kering
yang telah dipijarkan dan ditara sebelumnya. Botol timbang yang berisi sampel
tersebut dimasukkan ke dalam oven pada suhu 105°C selama 6 jam atau hingga
diperoleh berat konstan. botol berisi sampel tersebut didinginkan dalam desikator.
Proses selanjutnya adalah penimbangan botol yang berisi sampel setelah
dikeringkan (Rachmania, et al., 2013).
Kadar air dapat dihitung dengan rumus :
% Kadar air= W1-W2W3 x 100%
Keterangan:
W1= berat (sampel + botol) sebelum dikeringkan, W2 = berat (sampel + botol) setelah dikeringkan, W3= berat sampel sebelum dikeringkan
3.3.5.4 Uji Kadar Abu Gelatin
Sampel gelatin sebanyak 2 gram dimasukkan dalam cawan pengabuan
yang telah dipijarkan dan ditara sebelumnya. Cawan yang berisi sampel
dimasukkan ke dalam tanur pengabuan dengan suhu 600°C selama 6 jam atau
sampai didapat abu yang berwarna keabu-abuan (sampai terbentuk abu
sempurna). Cawan berisi sampel didinginkan dalam desikator kemudian
ditimbang (Rachmania, 2013). Kadar abu dihitung dengan rumus:
Kadar Abu=Berat sampel x 100%Barat abu
3.3.5.5 Uji Viskositas Larutan Gelatin
Untuk menentukan viskositas dari gelatin digunakan metode Shyni et al.,
2014. Larutan gelatin dibuat dalam konsentrasi 6,67% (b/v) menggunakan
aquadest yang dipanaskan pada suhu 60°C. Sebanyak 250 ml larutan diukur
viskositasnya menggunakan alat Brookfield Digital Viscometer. Spindel nomor 1
dipasang pada alat, kemudian dicelupkan sampai tanda batas yang ditentukan ke
dalam gelas beker yang berisi larutan gelatin. Kecepatan putaran alat diatur
kemudian pembacaan skala dilakukan dengan mengamati jarum merah pada
3.3.5.6 Uji Sifat Busa Larutan Gelatin
Foaming Expansion (FE) dan Foaming Stability (FS) dari larutan gelatin
diuji menggunakan metode Jellouli et al. (2011) dengan sedikit modifikasi.
Larutan gelatin dibuat dalam konsentrasi 1% (b/v) dengan cara melarutkan 0,5
gram sampel gelatin dalam 50 ml aquadest suhu 60°C. Larutan gelatin tersebut
didinginkan hingga suhu 31°C. Kemudian untuk pembentukan busa, larutan
gelatin dihomogenisasi menggunakan Homogenizer selama 5 menit pada suhu
ruang dengan kecepatan 10.000 rpm. Larutan tersebut dimasukkan ke dalam gelas
ukur 250 ml, dan volume total diukur pada menit ke 0, 10, 30, dan 60 setelah
pencampuran. Kapasitas busa akan terlihat sebagai ekspansi busa pada menit ke 0,
yang dapat di dihitung dengan menggunakan persamaan berikut ini:
FE % =VT-V0 V0 x100 %
Stabilitas Busa dihitung sebagai volume busa yang bertahan setelah 10, 30
dan 60 menit.
FS % = Vt-V0Vo x 100 %
Keterangan:
VT adalah volume total tepat setelah proses homogenisasi larutan gelatin (ml); V0 adalah
volume sebelum proses homogenisasi larutan gelatin (ml); Vt adalah Volume total setelah didiamkan pada suhu ruang untuk waktu yang berbeda.
3.3.5.7 Uji Sifat Emulsifikasi Gelatin
Indeks Aktivitas Emulsifikasi (IAE) dan Indeks Stabilitas Emulsi (ISE)
ditentukan bedasarkan M. Ahmad, S Benjakul (2011). Minyak kacang kedelai
sebanyak 2 ml dan larutan gelatin (1%, 6 ml) dihomogenisasi menggunakan
Homogenizer dengan kecepatan 20.000 rpm selama 1 menit kemudian diambil
sebanyak 100 μl dari dasar tabung menggunakan pipet mikro pada menit ke 0 dan ke 10. Larutan gelatin tersebut dimasukkan ke dalam 5 ml larutan SDS (Sodium
Dodesil Sulfat) 0,1 % hingga volume total 5 ml, selanjutnya dicampur
menggunakan vortex mixer selama 10 detik sampai homogen. Absorbansi dari
larutan tersebut diukur menggunakan Spektrofotometer UV-Vis pada panjang
31
Indeks Aktivitas Emulsi dan Indeks Stabilitas Emulsi dapat dihitung
menggunakan rumus berikut ini:
IAE (mg2)=(2x 2,303 x A x DF) l∅C
Keterangan:
A= A500, DF= Faktor dilusi (100), l= panjang kuvet (m), ø= fraksi volume minyak dan C=
konsentrasi protein dalam fasa air (g/m3).
ISE min = A0-A10 ∆tA0
Keterangan: A0= A500 pada menit ke 0, A10= A500pada menit ke 10 dan Λt= 10 menit.
3.3.5.8 Penentuan Daya Serap Air Gelatin
Kemampuan daya serap air ditentukan dengan menggunakan metode
Razali et al., 2015. Sebanyak 0,5 gram gelatin dimasukkan dalam tabung
sentrifugasi. Kemudian sebanyak 10 ml aquadest ditambahkan ke dalam tabung
tersebut dan divortex selama 30 detik. Larutan tersebut dibiarkan pada suhu ruang
selama 25 menit. Kemudian Larutan gelatin disentrifugasi dengan kecepatan 4800
rpm selama 25 menit. Supernatan yang terbentuk disaring dengan kertas
Whattman no 1. Kemudian diukur volume sisa supernatan yang diperoleh
menggunakan gelas ukur. Daya serap air dapat dihitung dengan menggunakan
rumus sebagai berikut:
Daya Serap Air (mlg )=Volume awal-volume supernatan (ml)berat gelatin (g)
3.3.5.9 Penentuan Daya Serap Lemak Gelatin
Kemampuan daya serap lemak ditentukan dengan menggunakan metode
Razali et al., (2015) dengan sedikit modifikasi. Sebanyak 0,5 gram gelatin
dimasukkan ke dalam tabung sentrifugasi. Kemudian sebanyak 10 ml minyak
palm ditambahkan ke dalam tabung tersebut dan divortex selama 30 detik.
Supernatan yang terbentuk disaring dengan kertas Whattman no 1. Kemudian
diukur volume sisa supernatan yang diperoleh menggunakan gelas ukur. Daya
serap lemak dapat dihitung dengan menggunakan rumus sebagai berikut: