ISOLASI DAN SITOTOKSISITAS EKSTRAK FLAVONOID
DAUN TIN (
Ficus carica
Linn.)
ARIDO YUGOVELMAN AHADDIN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi yang berjudul Isolasi dan Sitotoksisitas Ekstrak Flavonoid Daun Tin (Ficus carica Linn.) adalah benar karya saya dengan arahan pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2014
Arido Yugovelman Ahaddin
ABSTRAK
ARIDO YUGOVELMAN AHADDIN. Isolasi dan Sitotoksisitas Ekstrak Flavonoid Daun Tin (Ficus carica Linn.). Dibimbing oleh GUSTINI SYAHBIRIN dan KUSDIANTORO MOHAMAD.
Penggunaan daun tin (Ficus carica) sebagai obat mulai dikembangkan di Indonesia sejak tahun 2011. Studi mengenai potensi bioaktif tanaman tin telah banyak dilakukan di dunia, tetapi belum banyak dilakukan di Indonesia. Penelitian ini dilakukan untuk menentukan sitotoksisitas ekstrak flavonoid daun tin berdasarkan metode uji letalitas larva udang (BSLT) dan toksisitas embrio ikan zebra (ZFET). Hasil penelitian menunjukkan rendemen ekstrak flavonoid pada sampel sebesar 2.36% dengan nilai LC50 sebesar 422 ppm dengan metode BSLT
dan 181 ppm dengan metode ZFET. Hasil ini lebih tinggi dibandingkan dengan ekstrak kasar metanol. Uji kualitatif terhadap ekstrak menunjukkan kandungan flavonoid berupa flavon dan flavonol dalam fraksi etil asetat dari ekstrak metanol. Pemberian ekstrak kasar flavonoid daun tin pada embrio ikan zebra menimbulkan abnormalitas mayor pada sirkulasi darah. Berdasarkan hasil ini ekstrak kasar flavonoid daun tin cukup toksik dan efek toksiknya diduga dominan pada sistem sirkulasi darah makhluk hidup.
Kata kunci: daun tin, flavonoid, toksisitas embrio ikan zebra, uji letalitas larva udang
ABSTRACT
ARIDO YUGOVELMAN AHADDIN. Isolation and Cytotoxicity of Theen Leaves (Ficus carica Linn.) Flavonoid Extract. Supervised by GUSTINI SYAHBIRIN and KUSDIANTORO MOHAMAD.
Theen leaves have been used as traditional medicine in Indonesia since 2011. The bioactivity potential of the leaves has been acknowledged in international research, but lack of information in Indonesia so far. This study aims to examine the cytotoxicity of theen leaves flavonoid extract against brine shrimp (Artemia salina) and zebrafish (Danio rerio) embryo. The result showed that flavonoid in the sample was 2.36% and the 50% lethal concentrations (LC50)were
422 and 181 ppm against brine shrimp and zebrafish embryo, respectively. The qualitative assay for flavonoid class indicated the presence of flavones and flavonols class. The zebrafish embryo test indicated a major malformation on blood circulation. Based on these facts, the flavonoid extract is toxic and has effect to blood circulation of living organism.
ISOLASI DAN SITOTOKSISITAS EKSTRAK FLAVONOID
DAUN TIN (
Ficus carica
Linn.)
ARIDO YUGOVELMAN AHADDIN
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUANALAM INSTITUT PERTANIAN BOGOR
Judul skripsi : Isolasi dan Sitotoksisitas Ekstrak Flavonoid Daun Tin (Ficus carica
Linn.)
Nama : Arido Yugovelman Ahaddin NIM : G44090073
Disetujui oleh
Dr Gustini Syahbirin, MS Pembimbing I
drh Kusdiantoro Mohamad, MSi, PAVet Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen Kimia
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT karena atas berkat rahmat dan keridhoan-Nya, skripsi yang berjudul Isolasi dan Sitotoksisitas Ekstrak Flavonoid Daun Tin (Ficus carica Linn.) ini dapat terselesaikan dengan baik. Masih banyak kekurangan yang penulis rasakan dalam penyusunan skripsi ini, baik pada teknis penulisan maupun materi yang disampaikan. Oleh karena itu, saran dan masukan dari pembaca untuk karya selanjutnya yang lebih baik sangat diharapkan.
Ucapan terima kasih penulis sampaikan kepada Ibu Dr Gustini Syahbirin, MS selaku pembimbing pertama dan Bapak drh Koesdiantoro Mohamad, MSi, PAVet selaku pembimbing kedua yang telah dengan sabar memberikan arahan dan bimbingannya serta membagi ilmunya kepada penulis. Tidak lupa ucapan terima kasih juga penulis sampaikan kepada seluruh pihak yang turut membantu dan mendukung kelancaran penulis dalam menyelesaikan penelitian dan penulisan skripsi ini, termasuk seluruh dosen, laboran dan staf Departemen Kimia IPB, teman-teman Departemen Kimia, juga seluruh keluarga. Ucapan terima kasih penulis sampaikan kepada kedua orang tua yang selalu mendukung dan mendoakan penulis.
Semoga skripsi ini dapat bermanfaat dan menjadi sumbangan pemikiran bagi semua pihak yang membutuhkan. Aamiin.
Bogor, Agustus 2014
vi
DAFTAR ISI
DAFTAR GAMBAR vii
DAFTAR TABEL vii
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
BAHAN DAN METODE 2
Alat dan Bahan 2
Metode 2
HASIL DAN PEMBAHASAN 4
Kadar Air 4
Rendemen Ekstrak 4
Hasil Kualitatif Flavonoid 5
Toksisitas Akut terhadap Larva Udang 6 Toksisitas Akut dan Efek Teratogenik Ekstrak terhadap Embrio Ikan Zebra 7
SIMPULAN DAN SARAN 10
Simpulan 10
Saran 10
DAFTAR PUSTAKA 10
LAMPIRAN 13
vii
DAFTAR GAMBAR
1 Hasil uji fitokimia ekstrak kasar flavonoid daun tin 5 2 Hasil uji kualitatif golongan flavonoid dalam fraksi etil asetat daun tin 6 3 Nilai LC50 hasil uji toksisitas ekstrak daun tin terhadap A.salina 7
4 Tingkat kematian embrio pada berbagai konsentrasi ekstrak kasar flavonoid
daun tin 8
5 Hasil pengamatan embrio ikan zebra 9
DAFTAR TABEL
1 Hasil uji fitokimia ekstrak kasar metanol dan flavonoid daun tin 5 2 Hasil uji kualitatif golongan flavonoid dalam fraksi etil asetat daun tin 6 3 Pengaruh ekstrak kasar flavonoid daun tin terhadap embrio ikan zebra 7 4 Hasil pengamatan abnormalitas embrio ikan zebra 10
DAFTAR LAMPIRAN
1 Kadar air daun tin 14
2 Rendemen ekstrak daun tin 14 3 Toksisitas ekstrak kasar metanol daun tin dengan metode BSLT 14 4 Toksisitas ekstrak kasar etanol daun tin dengan metode BSLT 15 5 Toksisitas ekstrak kasar flavonoid daun tin dengan metode BSLT 15 6 Toksisitas ekstrak kasar flavonoid daun tin dengan metode ZFET pada 24 jam
pasca-fertilisasi 16
7 Toksisitas ekstrak kasar flavonoid daun tin dengan metode ZFET 48 jam pasca-
fertilisasi 16
8 Hasil pengamatan pengaruh pemberian ekstrak kasar flavonoid pada kematian, abnormalitas, dan penetasan embrio ikan zebra pada 24, 48, 72, dan 96 jam
PENDAHULUAN
Tin merupakan salah satu tanaman famili Moraceae yang banyak tersebar luas di daerah tropis maupun subtropis (Patil VV dan Patil VR 2011a). Di Indonesia, daun tin digunakan sebagai obat untuk mengatasi penyakit hipertensi, batu ginjal, dan diabetes. Aktivitas daun tin yang telah dilaporkan ialah sebagai antioksidan (Konyahoglu et al. 2005; Patil VV dan Patil VR 2011a; Raj dan Joseph 2011; Ghazi et al. 2012), hepatoprotektan (Krishna et al. 2007), antimikrob (Jeong et al. 2009), antibakteri (Lee dan Cha 2010), antipiretik (Patil
et al. 2010a), imunomodulator (Patil et al. 2010b) antidiabetes (El-Shobaki et al.
2010), antiradang (Patil VV dan Patil VR 2011b), dan antikanker (Refli 2012). Tin memiliki beragam metabolit sekunder, tetapi yang terbesar adalah flavonoid. Kandungan flavonoid dalam daun tin menurut Konyahoglu et al.
(2005) kira-kira 1.15% dengan pelarut metanol. Beberapa kandungan flavonoid yang telah teridentifikasi oleh Oliveira et al. (2009) dan Sirisha et al. (2010) adalah kuersetin-3-O-glukosida dan kuersetin-3-O-rutinosida. Refli (2012) melaporkan kandungan flavon, flavonol, isoflavon, flavanon, dihidroflavonol, kalkon, auron, antosianin, dan antosianidin, serta melaporkan bahwa ekstrak flavonoid daun tin berdasarkan uji hayati memiliki nilai konsentrasi letal 50% (LC50)sebesar 191 ppm.
Nilai LC50 tersebut tergolong toksik dan sejalan dengan hasil penelitian
mengenai berbagai aktivitas yang dimiliki. Ekstrak flavonoid daun tin memiliki aktivitas antioksidan dengan kapasitas total 17.1 ± 1.5 mM -tokoferil asetat/g massa kering (Konyahoglu et al. 2005) dan konsentrasi penghambatan 50% (IC50)
sebesar 150 mg/L (Refli 2012). Efek antiglikemik dilaporkan dengan pemberian ekstrak sebesar 8% (b/b) (El-Shobaki et al. 2010). Chon et al. (2008) melaporkan bahwa pemberian ekstrak flavonoid daun tin dapat menghambat pertumbuhan
Tetranychus urticae hingga 92% dengan penanaman di luar ruangan. Aktivitas antibakteri dilaporkan oleh Lee dan Cha (2010) dengan nilai konsentrasi hambat minimum 2.5 ̶ 20 mg/mL dan konsentrasi bunuh minimum 5 ̶ 20 mg/mL. Penelitian terakhir menunjukkan adanya aktivitas antikanker dari ekstrak flavonoid daun tin dengan nilai IC50 800 ppm dan besar penghambatan 57.18%
(Refli 2012).
2
daun tin serta menentukan sitotoksisitasnya menggunakan metode BSLT dan ZFET.
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah alat kaca yang umum di laboratorium, mikropipet, neraca analitik, filter 20 mikron, oven, penguap putar, multiwell, dan mikroskop cahaya (inverted) yang dilengkapi dengan kamera.
Bahan-bahan yang digunakan adalah daun tin, metanol, etanol, n-heksana, dan etil asetat teknis, HCl 2 N, dimetil sulfoksida (DMSO), larva A. salina, embrio ikan zebra, air sumur, air laut, Pb(CH3COO)2, NaOH 0.1 N, H2SO4 pekat,
FeCl3 5%, amil alkohol, serbuk Mg, dan HCl pekat.
Metode
Identifikasi dan Preparasi Sampel
Tanaman tin yang diperoleh dari diidentifikasi di Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (Puslit Biologi LIPI). Daun tin dikeringudarakan selama 7 hari, lalu dihaluskan hingga berukran 40 mesh.
Penentuan Kadar Air (AOAC 2005)
Cawan porselen dikeringkan di dalam oven dengan suhu 105 °C selama 60 menit. Kemudian cawan didinginkan dalam eksikator selama 30 menit dan ditimbang bobot kosongnya. Sampel sebanyak 5 g dimasukkan ke dalam cawan dan dikeringkan di dalam oven bersuhu 105 °C selama 24 jam. Setelah itu, cawan tersebut didinginkan kembali dalam eksikator selama 30 menit, lalu ditimbang sampai diperoleh bobot konstan. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo).
Kadar Air (%) = − × %
A = Bobot sampel sebelum dikeringkan (gram)
B = Bobot sampel setelah dikeringkan (gram)
Isolasi Flavonoid Daun Tin (Markham 1988)
3
Uji Fitokimia (Harborne 1987)
Uji Senyawa Fenolik. Sebanyak 0.1 g sampel (ekstrak kasar metanol dan flavonoid) dilarutkan dalam kloroform ̶ air (1:1) dan dipisahkan lapisan airnya. Lapisan air dimasukkan ke dalam tabung reaksi dan ditambahkan FeCl3 5%. Hasil
positif uji senyawa fenolik berupa warna hijau, biru, atau ungu.
Uji Flavonoid. Sebanyak 0.1 g sampel dilarutkan dalam kloroform:air (1:1) dan dipisahkan lapisan airnya. Lapisan air dimasukkan ke dalam tabung reaksi dan ditambahkan serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Hasil positif berupa warna kuning atau jingga.
Uji Kualitatif Flavonoid (Markham 1988)
Sampel dimasukkan ke dalam 3 buah tabung reaksi masing-masing sebanyak 1 mL. Tabung pertama ditambahkan 3 tetes larutan Pb(CH3COO)2,
tabung kedua ditambahkan 3 tetes NaOH 0.1 N, dan tabung ketiga ditambahkan 3 tetes H2SO4 pekat. Perubahan warna yang terjadi pada setiap tabung diamati.
Uji Toksisitas Metode BSLT (Krishnaraju et al. 2005)
Larutan sampel dibuat dengan konsentrasi 2000 µg/mL kemudian diencerkan dengan air laut hingga diperoleh konsentrasi 50, 100, 250, 500, 750,
Larutan ekstrak kasar flavonoid dibuat dalam konsentrasi 2000 g/mL, kemudian diencerkan hingga diperoleh konsentrasi akhir 50, 100, 250, 500, dan 750 g/mL. DMSO ditambahkan apabila ekstrak tidak larut. Sebanyak 36 telur ikan zebra dalam 150 µL air tawar dan 150 L ekstrak dimasukkan ke dalam
multiwell dengan jumlah 1 embrio per sumur. Embrio diinkubasi dalam suhu kamar selama 96 jam. Embrio diamati pada 24, 48, 72, dan 96 jam pasca-fertilisasi (jpf) menggunakan mikroskop cahaya. Kelainan yang diamati meliputi pigmentasi, jantung, kuning telur, mata, kepala, sumbu tubuh, ekor, trunk, dan sirkulasi darah. Nilai LC50 ditentukan dengan menggunakan kurva hubungan
4
HASIL DAN PEMBAHASAN
Kadar Air
Lama penyimpanan suatu bahan sangat ditentukan oleh banyaknya air yang terdapat di dalamnya. Untuk penyimpanan bahan dalam jangka waktu lama, kadar air maksimum yang dianjurkan menurut Winarno (1995) adalah 10%. Selain menentukan lama masa simpan, kadar air juga dapat digunakan sebagai faktor koreksi dalam penentuan rendemen. Kadar air ditentukan dengan memanaskan sampel pada suhu 105 ºC yang bertujuan menghilangkan air bebas maupun yang terikat secara fisis pada sampel (Harjadi 1987). Kadar air sampel daun tin diperoleh sebesar 6.04% (Lampiran 1). Kadar air di bawah 10% ini menunjukkan bahwa sampel tersebut dapat disimpan dalam jangka waktu yang cukup lama tanpa mengalami kerusakan.
Rendemen Ekstrak
Daun tin diekstraksi dengan metode maserasi dalam pelarut metanol. Cara maserasi digunakan karena stabilitas bahan terhadap kalor belum diketahui. Harborne (1987) menyatakan bahwa alkohol merupakan pelarut serbaguna yang dapat dijadikan sebagai bahan pengekstrak awal karena dapat melarutkan senyawa polar maupun nonpolar. Pelarut yang digunakan pada penelitian ini adalah metanol. Alkohol (metanol dan etanol) telah banyak digunakan sebelumnya untuk mengekstraksi berbagai komponen aktif dalam daun tin, seperti yang dilakukan oleh Konyahoglu et al. (2005), Krishna et al. (2007), Cheng et al. (2008), Khalaskar et al. (2010), dan Lee dan Cha (2010).
5
Hasil Kualitatif Flavonoid
Ekstrak kasar metanol dan flavonoid (etil asetat) diuji lebih lanjut keberadaan flavonoidnya melalui uji fitokimia. Hasil uji (Tabel 1) menunjukkan kandungan senyawa fenolik dan flavonoid pada ekstrak kasar metanol, dengan kandungan senyawa fenolik lebih besar. Fraksi etil asetat juga ditunjukkan mengandung senyawa fenolik dan flavonoid (Gambar 1). Namun, kandungan senyawa flavonoid di dalam fraksi ini cukup rendah. Hasil uji hanya memberikan warna kuning pudar pada lapisan atas untuk uji flavonoid (Gambar 1b).
Gambar 1 Hasil uji fitokimia ekstrak kasar flavonoid daun tin: senyawa fenolik (A), flavonoid (B)
Hasil fitokimia ini jika dibandingkan dengan Refli (2012) menunjukkan perbedaan kandungan berupa adanya senyawa fenolik di dalam kedua ekstrak. Perbedaan tersebut diduga karena perbedaan varietas dan vegetasi dari sampel yang digunakan, yang dapat memengaruhi kandungan metabolit sekunder dalam sampel.
Tabel 1 Hasil uji fitokimia ekstrak kasar metanol dan flavonoid daun tin Uji Ekstrak kasar metanol Ekstrak kasar flavonoid Refli (2012)
Fenolik +++ +++ ̶
Flavonoid ++ + +++
Keterangan: (+): terdeteksi (jumlah (+) menunjukkan intensitas warna atau endapan yang terbentuk); ( ̶ ): tidak terdeteksi
Pada uji senyawa fenolik, sampel direaksikan dengan larutan FeCl3 5% dan
menghasilkan warna hijau agak hitam. Perubahan warna tersebut disebabkan oleh reaksi pembentukan kompleks antara gugus fenol dan FeCl3 membentuk
kompleks fenol-FeCl2 (Miroslav 1971). Kandungan flavonoid dapat diuji dengan
uji Shinoda (Mg/HCl) atau Pew (Zn/HCl) yang menghasilkan hasil positif berupa perubahan warna kuning-merah (Markham 1988). Pembentukan warna pada uji Shinoda didasarkan pada reaksi reduksi flavonoid oleh HCl yang menghasilkan garam flavilium. Pembentukan garam flavilium tersebut mengakibatkan pergeseran ke panjang gelombang yang lebih besar (Miroslav 1971). Uji flavonoid yang dilakukan menunjukkan perubahan warna larutan menjadi warna kuning pada lapisan atas tabung (Gambar 1B).
Selain uji fitokimia, dilakukan pula uji golongan flavonoid menggunakan pereaksi seperti timbel(II) asetat, NaOH, dan asam sulfat. Hasil uji (Gambar 2) menunjukkan bahwa flavonoid yang terkandung di dalam fraksi etil asetat berupa flavon dan flavonol. Hasil ini didasarkan pada warna yang terbentuk pada saat pengujian (Tabel 2).
6
Tabel 2 Hasil uji kualitatif golongan flavonoid dalam fraksi etil asetat daun tin Pereaksi Warna Dugaan golongan Pb(CH3COO)2 Jingga Flavon
NaOH 0.1 N Kuning Flavon dan flavonol H2SO4 Kuning-jingga Flavon dan flavonol
Pada uji menggunakan timbel(II) asetat, larutan berubah warna menjadi jingga. Hal ini diakibatkan terjadinya reaksi timbel(II) asetat dengan 2 buah gugus hidroksil dalam flavonoid (Lysiuk dan Antonyuk 2011). Reaksi flavonoid dengan basa (NaOH) akan mengionkan gugus fenolik bebas pada flavonoid sehingga terjadi pergeseran batokromik yang mengubah warna (Markham 1988). Pada reaksi dengan H2SO4, flavonoid terprotonasi dengan adanya asam dan terbentuk
garam flavilium yang memberikan warna kuning-jingga (Miroslav 1971).
Gambar 2 Hasil uji kualitatif golongan flavonoid dalam fraksi etil asetat daun tin dengan Pb(CH3COO)2 (A), NaOH 0.1N (B), dan H2SO4 (C)
Toksisitas Akut terhadap Larva Udang
Uji letalitas larva udang (BSLT) dilakukan untuk mengetahui potensi tingkat toksisitas dari suatu bahan. Larva udang yang digunakan berumur 48 jam karena memiliki daya tahan yang paling rendah terhadap kondisi lingkungan. Kematian larva dapat disebabkan oleh 2 hal, yaitu inhalasi dan difusi. Pada proses inhalasi, toksikan masuk ke tubuh melalui saluran pernapasan, sedangkan pada proses difusi, toksikan akan masuk melalui kulit larva yang tipis. Melalui kedua proses tersebut, toksikan dapat menyebar ke jaringan lain dan memberikan efek letal (Sukardiman et al. 2004).
Hasil uji BSLT menunjukkan nilai LC50 ekstrak kasar flavonoid yang lebih
rendah daripada ekstrak kasar etanol maupun metanol (Gambar 3). Menurut Meyer et al. (1982), suatu bahan dikatakan sangat toksik jika memiliki nilai LC50
di bawah 30 ppm, toksik jika berada pada kisaran 30 ̶ 1000 ppm, dan tidak toksik jika lebih dari 1000 ppm. Nilai LC50 ekstrak kasar metanol didapatkan sebesar
1796 ppm (r2= 0.90) (Lampiran 3) dan ekstrak kasar etanol sebesar 1528 ppm (r2= 0.97) (Lampiran 4). Hasil ini menunjukkan bahwa ekstrak kasar metanol maupun etanol tidak bersifat toksik. Ekstrak kasar flavonoid memiliki nilai LC50
lebih rendah, yaitu 433 ppm (r2 = 0.96) (Lampran 5), yang berarti bahwa ekstrak ini lebih toksik daripada ekstrak awalnya. Ekstrak kasar metanol diuji karena metanol merupakan pelarut awal yang digunakan dalam mengisolasi sampel. Sementar ekstrak kasar etanol digunakan sebagai pembanding karena merujuk aturan BPOM (2011), bahan obat hanya boleh dilarutkan dengan etanol dan air.
7
Gambar 3 Nilai LC50 hasil uji toksisitas ekstrak daun tin terhadap A.salina
Nilai LC50 ekstrak kasar flavonoid hasil penelitian ini masih lebih tinggi
dibandingkan dengan yang dilaporkan oleh Refli (2012), yaitu 191 ppm. Perbedaan nilai toksisitas tersebut mungkin diakibatkan perbedaan letak pengambilan sampel maupun perbedaan jenis daun yang digunakan. Selain itu, perbedaan prosedur isolasi juga dapat memengaruhi banyaknya komponen aktif yang terekstraksi sehingga nilai toksisitas menjadi lebih rendah.
Toksisitas Akut dan Efek Teratogenik Ekstrak terhadap Embrio Ikan Zebra
Penggunaan ikan zebra untuk uji toksisitas telah banyak dilakukan, seperti pada penelitian Hill et al. (2005) mengenai toksisitas bahan kimia, Zon dan Peterson (2005) mengenai uji in vivo dari obat, Zhu et al. (2007) mengenai limbah buckminsterfulerena dan fulerol, Bar-Ilan et al. (2009) mengenai toksisitas nanopartikel emas dan perak, serta Bai et al. (2010) mengenai studi fisikokimia mekanisme toksisitas nanopartikel zink oksida. Berbagai kesamaan sistem organ yang dimiliki oleh ikan zebra dengan manusia menyebabkan pengembangan toksisitas obat melalui hewan ini semakin meningkat (Rubinstein 2006).
Pengamatan terhadap embrio ikan zebra menunjukkan bahwa pemberian ekstrak kasar flavonoid dari daun tin dapat menimbulkan berbagai abnormalitas maupun kematian. Semakin lama waktu pemaparan bahan, semakin banyak jumlah embrio yang mengalami abnormalitas atau kematian. Pemberian ekstrak juga memengaruhi tingkat penetasan embrio. Pada saat pengamatan 48 jpf, embrio yang tidak mengalami koagulasi (kematian) tidak seluruhnya dapat menetas, seperti pada konsentrasi 50 ppm yang hanya menetas sebanyak 83% (Tabel 3).
Tabel 3 Pengaruh ekstrak kasar flavonoid daun tin terhadap embrio ikan zebra
8
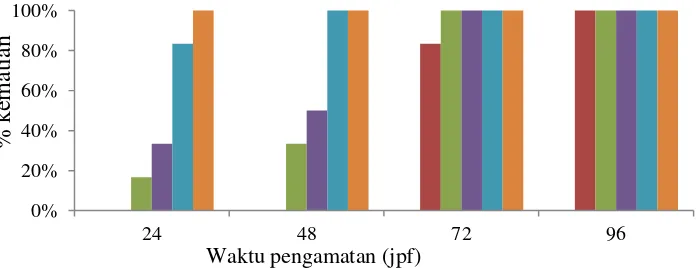
Pemberian konsentrasi yang semakin tinggi juga meningkatkan tingkat kematian. Gambar 4 memperlihatkan bahwa tingkat kematian ikan zebra pada 96 jpf telah mencapai 100%, yang menunjukkan bahwa semua hewan uji telah mengalami kematian pada waktu tersebut. Penentuan nilai LC50 umumnya
dilakukan pada pengamatan 96 jpf (Grush et al. 2004; D’Amico et al. 2012). Namun, beberapa penelitian menggunakan pengamatan pada 24 maupun 48 jpf (Sisinno et al. 2000; Selderslaghs et al. 2009; Hagner et al. 2010). Pada penelitian ini, nilai LC50 untuk 96 jpf tidak dapat ditentukan karena semua hewan uji telah
mati, sehingga digunakan nilai LC50 pada 24 dan 48 jpf. Nilai LC50 pada 24 dan
48 jpf didapatkan berturut-turut sebesar 235 ppm (r2= 0.93) dan 181 ppm (r2= 0.96) (Lampiran 6–7).
Gambar 4 Tingkat kematian embrio pada berbagai konsentrasi ekstrak kasar flavonoid daun tin selama 24, 72, 48, dan 96 jam pasca fertilisasi Keterangan: = kontrol, = 50 ppm, = 100 ppm, = 250 ppm, = 500 ppm, = 750 ppm
Pengamatan terhadap embrio ikan zebra dengan mikroskop cahaya (inverted) menunjukkan bahwa pemberian ekstrak kasar flavonoid dapat menyebabkan berbagai macam kelainan. Kelainan ini dikarenakan embrio ikan zebra sangat peka sehingga bahan uji mudah untuk berdifusi dan menginfeksi organ (Chakraborty et al. 2009). Pada pemberian ekstrak dengan konsentrasi 50 ppm, embrio belum mengalami kelainan maupun kematian, tetapi pada konsentrasi 750 ppm, tingkat kematian embrio telah mencapai 100%. Embrio yang tidak mati mengalami kelainan seperti pembengkakan kantung kuning telur pada pemberian ekstrak dengan konsentrasi 500 ppm. Pada Gambar 5B, terlihat bahwa kantung kuning telur memiliki ukuran yang lebih besar dan bentuk yang tidak lagi simetris jika dibandingkan dengan kontrol.
9
embrio meningkat jika dibandingkan dengan 24 jpf. Namun, nilai LC50 masih
dapat ditentukan.
Gambar 5 Hasil pengamatan embrio ikan zebra: kontrol 24 jpf (A), 500 ppm 24 jpf (B), 750 ppm 24 jpf (embrio koagulasi/ mati) (C), kontrol 48 jpf (D), 50 ppm 48 jpf (E), 100 ppm 48 jpf (F), 250 ppm 48 jpf (embrio tidak menetas) (G), kontrol 72 jpf (H), dan 50 ppm 72 jpf (I). Keterangan kelainan: ek = edema kuning telur, kd = koagulasi darah, ep = edema perikardium.
Pada pengamatan 72 jpf setelah pemaparan, embrio ikan zebra hampir seluruhnya mengalami kematian, yang ditunjukkan dengan koagulasi embrio. Pengamatan hanya dapat dilakukan pada konsentrasi 50 ppm yang menunjukkan terjadinya kelainan meliputi pembengkakan kuning telur, tidak terbentuknya sirkulasi darah, edema pada jantung, dan ukuran tubuh yang cenderung lebih pendek dibandingkan dengan embrio normal (Gambar 5H–I). Pada inkubasi 96 jpf, semua embrio telah mati mulai pemberian ekstrak dengan konsentrasi 50 hingga 750 ppm.
10
Tabel 4 Hasil pengamatan abnormalitas embrio ikan zebra
Abnormalitas Jenis abnormalitas Jumlah Persentase (%)* Sumbu tubuh Bengkok 2 15 Otak Kelainan bentuk, nekrosis 1 8 Sirkulasi Tidak ada sirkulasi, penggumpalan darah 7 54 Mata Kelainan bentuk, tidak terbentuk,
membesar, mengecil
1 8
Jantung Kelainan bentuk, edema 4 31 Pigmentasi Kurang, lebih 1 8
Trunk Pendek, tidak terbentuk, kelainan bentuk 3 23 Kuning telur Edema, besar 6 46 Ekor Tidak tersambung 2 15
*Jumlah kelainan yang diamati /jumlah embrio abnormal pada seluruh dosis dan waktu pengamatan
SIMPULAN DAN SARAN
Simpulan
Ekstrak kasar flavonoid telah diisolasi dari daun tin asal Bogor dengan rendemen 2.36%. Ekstrak ini tergolong toksik dengan nilai LC50 berturut-turut
sebesar 433 dan 181 ppm dengan uji pada larva udang dan embrio ikan zebra. Hasil uji kualitatif menunjukkan kandungan flavonoid berupa flavon dan flavonol. Semua embrio ikan zebra mati pada perlakuan ekstrak dengan konsentrasi 750 ppm. Dosis yang lebih rendah menimbulkan berbagai kelainan embrio dengan kelainan utama (54%) pada sirkulasi darah.
Saran
Perlu dilakukan pemisahan lebih lanjut pada ekstrak kasar flavonoid serta uji toksisitas pada fraksi-fraksi yang diperoleh untuk mengetahui komponen flavonoid teraktif dalam daun tin. Komponen lain dari sampel juga perlu dipisahkan untuk mengetahui komponen teraktif dalam sampel, selain flavonoid.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2005. Official Method of Analysis of The Association of Official Analytical of Chemist Ed ke-5. Arlington (US):AOAC.
Andersen ØM, Markham KR. 2006. Flavonoids Chemistry, Biochemistry, and Application. New York (US): Taylor & Francis.
11
tentang Persyaratan Teknis Cara Pembuatan Obat Tradisional yang Baik. Jakarta (ID): BPOM.
Bai W, Zhang Z, Tian W, He X, Ma Y, Zhao Y, Chai Z. 2010. Toxicity of zinc oxide nanoparticles to zebrafish embryo: a physicochemical study of toxicity mechanism. J Nanopart Res. 12:1645-1654. doi: 10.1007/s11051-009-9740-9.
Bar-Ilan O, Albrecht RM, Fako VE, Furgeson DY. 2009. Toxicity assessments of multisized gold and silver nanoparticles in zebrafish embryos. Small. 5(16):1897-1910.
Chakraborty C, Hsu CH, Wen ZH, Lin CS, Agoramoorthy G. 2009. Zebrafish: a complete animal model for in vivo drug discovery and development. Curr Drug Metab. 10(2):116-124.
Cheng NAL, Masakuni T, Isao H, Hajime T. 2008. Antioxidant flavonoid glycosides from the leaves of Ficus pumila L. Food Chem. 109:415-420. doi: 10.1016/j.foodchem.2007.12.069.
Chon SU, Kim DI, Kang KS. 2008. Insecticidal potential of methanol extract and its fraction from fig (Ficus carica Linn.) leaves. J Microbiol Biotechnol. 17: 858-864.
Coelho S, Oliveira R, Pereira S, Musso C, Domingues I, Bhujel RC, Soares AMVM, Nogueira AJA. 2011. Assessing lethal and sub-lethal effects of trichlorfon on different trophic levels. Aqua Toxicol. 103:191-198.
Colegate SM, Molyneux RJ. 2008. Bioactive Natural Products: Detection, Isolation, and Sturtural Determination. California (US): CRC Pr.
D’Amico l, Li C, Wen LS, McGrath P. Zebrafish: A Predictive Model for Assessing Development Neurotoxicity. Massachusetts (US): Phylonix Pharmaceutical.
El-Shobaki, El-Bahay AM, Esmail RSA, El Megeid AAA, Esmail NS. 2010. Effect of fig fruit (Ficus carica L.) and its leaves on hyperglycemia in alloxan diabetics rats. World J Dairy & Food Sci. 5(1):47-57.
Ghazi F, Rahmat A, Yassin Z, Ramli NS, Buslima NA. 2012. Determination of total polyphenol and nutritional composition of two different types of Ficus carica leaves cultivated in Saudi Arabia. Pak J Nutr. 11(11):1061-1065. Grush J, Noakes DLG, Moccia RD. 2004. The efficacy of clove oil as an
anesthetic for the zebrafish, Danio rerio (Hamilton). Zebrafish. 1(1):46-53. Harborne JB. 1987. Metode Fitokimia: Penentuan Cara Modern Menganalisis
Tumbuhan. Pandawinata K, Sudiro I, penerjemah. Bandung (ID): ITB Pr. Terjemahan dari: Phytochemical Methods.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta (ID): Gramedia.
Hagner M, Olli-Pekka P, Pasanen T, Tiilikkala K, Setala H. 2010. Acute toxicity of birch tar oil on aquatic organism. J Agric Food Sci. 19: 24-33.
Hill AJ, Teraoka H, Heideman W, Peterson RE. 2005. Zebrafih as a model vertebrate for investigating chemical toxicity. Toxicol Sci. 86(1):6-19. Hill DS, Wlodarczyk BJ, Palacios AM, Finnell RH. 2010. Teratogenic effect of
antiepileptic drugs. Expert Rev Neurother. 10(6):943-959. doi: 10.1093/toxsci/kfi110.
12
Khalaskar MG, Shah DR, Raja NM, Surana SJ, Gond NY. 2010. Pharmacognistic and phytochemical investigation of Ficus carica Linn. Ethnobotan Leaflets. 14:599-609.
Konyahoglu S, Saglam H, Kivcak B. 2005. -Tocopherol, flavonoid, and phenol contents and antioxidant activity of Ficus carica leaves. Pharmaceut Biol. 43(8):683-686. doi: 10.1080/13880200500383538.
Krishna MG, Pallavi E, Kumar RB, Ramesh M, Venkatesh S. 2007. Hepatoprotective activity of Ficus carica Linn. leaf extract against carbon tetrachloride-induced hepatoxicity in rats. DARU.15(3):162-166.
Krishnaraju AV, Rao TVN, Sundararaju D, Venisree M, Tsay HS, Subbaraju GV. 2005. Assessment of bioactivity of Indian medicinal plants using brine shrimp (A. salina) lethality assay. Int J Appl Sci Eng.3:125-134.
Lee YS, Cha JD. 2010. Synergistic antibacterial activity of fig (Ficus carica) leaves extract against clinical isolates of methicillin-resitant Staphylococcus aureus. Kor J Microbiol Biotechnol. 38(4):405-413.
Lysiuk RM, Antonyuk VO. 2011. A Textbook of Pharmacognosy. Lviv (UA): Danylo Halytskyi Lviv National Medical University.
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung (ID): ITB Pr. Terjemahan dari: Techniques of Flavonoid Identification.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughlin JL. 1982. Brine shrimps: a convenient general bioassay for active plant constituent. Planta Med.45:31-34.
Miroslav V. 1971. Detection and Identification of Organic Compounds. New York (US): STNL.
Oliveira AP, Valentao P, Pereira JA, Silva BM, Tavares F, Andrade PB. 2009.
Ficus carica L.: metabolic and biological screening. Food & Chem Toxicol. 47(11):2841-2846. doi: 10.1016/j.fct.2009.09.004.
Patil VV, Bhangale SC, Patil VR. 2010a. Evaluation of anti-pyretic potential of
Ficus carica leaves. Int J Pharmaceut Sci Rev & Res. 2(2):48-50.
Patil VV, Bhangale SC, Patil VR. 2010b. Studies on immunomudulatory activity of Ficus carica. Int J Pharmaceut Sci. 2(4):97-99.
Patil VV, Patil VR. 2011a. Ficus carica Linn.-an overview. Res J Med Plants. 5(3):246-253. doi: 10.3923/rjmp.2011.246.253.
Patil VV, Patil VR. 2011b. Evaluation of anti-inflammatory activity of Ficus carica Linn. leaves. Ind J Nat Prod & Resour.2(2):151-155.
Raj SJ, Joseph B. 2011. Pharmacognistic and phytochemical properties of Ficus carica Linn.- an overview. Int J Pharm Tech Res. 3(1):8-12.
Refli R. 2012. Potensi ekstrak daun Tin (Ficus carica L.) sebagai antioksidan dan aktivitas hambatannya terhadap proliferasi sel kanker HeLa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Rubinstein AL. 2006. Zebrafish assay forr drug toxicity screening. Expert Opin. Drug Metab Toxicol. 2(2):231-240.
13
Sirisha N, Sreenivasulu M, Sangeeta K, Chetty CM. 2010. Antioxidant properties of Ficus spesies-a review. Int J Pharm Tech Res. 2(4):2174-2182.
Sisinno CLS, Oliveira-Filho EC, Dufrayer MC, Moreira JC, Paumgartten FJR. 2000. Toxicity evaluation of municipal dump leachate using zebrafish acute test. Bull Environ Contam Toxicol.64:107-113.
Sukardiman, Rahman A, Pratiwi FN. 2004. Uji praskrining aktivitas antikanker ekstrak eter dan ekstrak metanol Marchantia cf planiloba Steph. dengan metode uji kematian larva udang dan profil densitometri ekstrak aktif.
Airlangga J Pharm. 4(3):7-10.
Wei X, Bugni TS, Harper MK, Sandoval IT, Manos EJ, Swift J, Wagoner RMV, Jones DA, Ireland CM. 2010. Evaluation of pyridoacridine alkaloids in a zebrafish phenotypic assay. Mar Drugs. 8:1769-1778.
Winarno FG. 1995. Kimia Pangan dan Gizi. Jakarta (ID): Gramedia.
Zhu X, Zhu L, Li Y, Duan Z, Chen W, Alvarez PJJ. 2007. Developmental toxicity in zebrafish (Danio rerio) embryos after exposure to manufactured nanomaterials: buckminsterfullerene aggregates (nC60) and fullerol. Environ Toxicol & Chem. 26(5):976-979.
14
LAMPIRAN
Lampiran 1 Kadar air daun tin Ulangan Bobot sampel
Lampiran 2 Rendemen ekstrak daun tin
Bahan Bobot Ekstrak kasar metanol 300.02 203.1452 255.3062 17.39
Ekstrak kasar etanol 300.02 172.4713 202.8696 10.13 Ekstrak kasar flavonoid 300.02 366.0216 373.1139 2.36
Rendemen = B e
B e × %
= . − .
. × %
= 17.39%
Lampiran 3 Toksisitas ekstrak kasar metanol daun tin dengan metode BSLT
15
LC50 = − /
= − − . / .
= 1795.80
Lampiran 4 Toksisitas ekstrak kasar etanol daun tin dengan metode BSLT
LC50 = − /
= − − . / .
= 1527.98 ppm
Lampiran 5 Toksisitas ekstrak kasar flavonoid daun tin dengan metode BSLT
LC50 = − /
1.6000 1.8000 2.0000 2.2000 2.4000 2.6000 2.8000 3.0000 3.2000
16
Lampiran 6 Toksisitas ekstrak kasar flavonoid daun tin dengan metode ZFET pada 24 jam pasca fertilisasi
LC50 = . − /
= . − − . / .
= 234.83 ppm
17
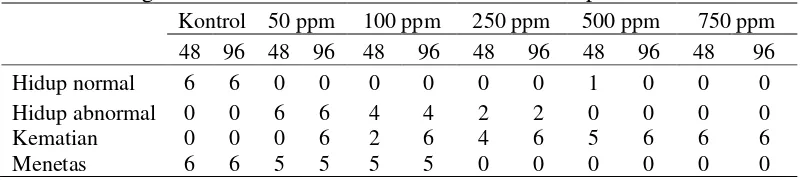
Lampiran 8 Hasil pengamatan pengaruh pemberian ekstrak kasar flavonoid pada kematian, abnormalitas, dan penetasan embrio ikan zebra pada 24, 48, 72, dan 96 jam pasca fertilisasi
Kontrol 50 ppm 100 ppm 250 ppm 500 ppm 750 ppm
24 48 72 96 24 48 72 96 24 48 72 96 24 48 72 96 24 48 72 96 24 48 72 96
Hidup normal 6 6 6 6 6 1 0 0 5 0 0 0 4 0 0 0 1 0 0 0 0 0 0 0 Hidup abnormal 0 0 0 0 0 5 6 6 0 4 4 4 0 2 2 2 0 0 0 0 0 0 0 0 Menetas 0 6 6 6 0 5 6 6 0 5 5 5 0 0 0 0 0 0 0 0 0 0 0 0 Kematian 0 0 0 0 0 0 5 6 1 2 6 6 2 6 6 6 5 6 6 6 6 6 6 6 Abnormalitas
Sumbu tubuh: bengkok,
patah 0 0 0 0 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Otak: kelainan bentuk,
nekrosis 0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 Sirkulasi: tidak ada
sirkulasi, koagulasi darah 0 0 0 0 0 3 1 0 0 3 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Mata: kelainan bentuk,
tidak terbentuk, lebih besar, lebih kecil
0 0 0 0 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0
Jantung: kelainan bentuk,
edema 0 0 0 0 0 0 1 0 0 0 0 0 0 3 0 0 0 0 0 0 0 0 0 0 Pigmentasi: kurang, lebih 0 0 0 0 0 0 0 0 0 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Trunk: pendek, kelainan
bentuktidak terbentuk 0 0 0 0 0 2 1 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 0 Kuning telur: edema,
membengkak 0 0 0 0 0 1 1 0 0 3 0 0 0 0 0 0 1 0 0 0 0 0 0 0 Ekor tidak menempel 0 0 0 0 0 0 0 0 0 0 0 0 0 2 0 0 0 0 0 0 0 0 0 0
18