PERFORMA AUTOTRIPLOID DAN ALLOTRIPLOID IKAN PATIN SIAM
Pangasianodon hypophthalmus
x PATIN JAMBAL
Pangasius djambal
YUSRAN IBRAHIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Performa Autotriploid dan Allotriploid
Ikan Patin Siam Pangasianodon hypophthalmus x Patin Jambal Pangasius djambal
adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini. Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2016
Yusran Ibrahim
RINGKASAN
YUSRAN IBRAHIM. Performa Autotriploid dan Allotriploid Ikan Patin Siam
Pangasianodon hypophthalmus x Patin Jambal Pangasius djambal. Dibimbing oleh DINAR TRI SOELISTYOWATI dan ODANG CARMAN.
Industri filet ikan patin terus dikembangkan karena permintaan pasar yang terus meningkat, baik pasar lokal maupun luar negeri. Dalam beberapa tahun terakhir produksi ikan patin dihadapkan dengan masalah inefficiency karena tingginya biaya operasional yang tidak sebanding dengan harga jual yang salah satunya diakibatkan oleh lambatnya pertumbuhan. Hal tersebut dapat memengaruhi produksi ikan patin yang berdampak juga pada industri filet. Upaya untuk memperbaiki pertumbuhan ikan patin diantaranya adalah hibridisasi dan rekayasa set kromosom.
Induk ikan patin siam yang digunakan berumur 2-2,5 tahun dengan bobot jantan rata-rata 2 kg, betina rata-rata 3 kg, sedangkan patin jambal jantan berumur 1,5-2 tahun dengan rata-rata bobot 1,5 kg. Pemijahan ikan dilakukan secara buatan. Ikan betina yang sudah matang gonad disuntik menggunakan hormon Human Chorionic Gonadotropin
(hCG) 500 IU per kg bobot tubuh, berselang 24 jam dilakukan penyuntikan kedua dengan menggunakan hormon GnRHa + anti dopamin (Ovaprim) 0,6 ml per kg bobot tubuh. Induk jantan disuntik satu kali dengan menggunakan Ovaprim 0,3 ml per kg bobot tubuh, kemudian ikan di-stripping setelah 8-10 jam. Telur yang sudah dibuahi kemudian dilakukan pencucian dengan suspensi tanah agar tidak saling melekat. Selanjutnya dilakukan induksi triploidisasi dengan metode kejut suhu panas (heat shock) dua menit setelah fertilisasi pada suhu 42 °C selama dua menit di dalam boks styrofoam berukuran 40×20×10 cm3. Autotriploid dibuat dengan mengejut zigot patin siam, sedangkan
allotriploid dibuat dengan mengejut zigot dari telur patin siam yang dibuahi sperma patin jambal (hibrida). Telur diinkubasi dalam corong penetasan (hatching jar) dengan suhu 28-29 °C. Derajat pembuahan (DPh) dan derajat penetasan (DPt) diamati masing-masing pada jam ke 6 dan 24 setelah fertilisasi. Larva dipelihara secara indoor dalam bak fiber ukuran 3×1×0,4 m3 selama tiga bulan dengan kepadatan 450 ekor per fiber.
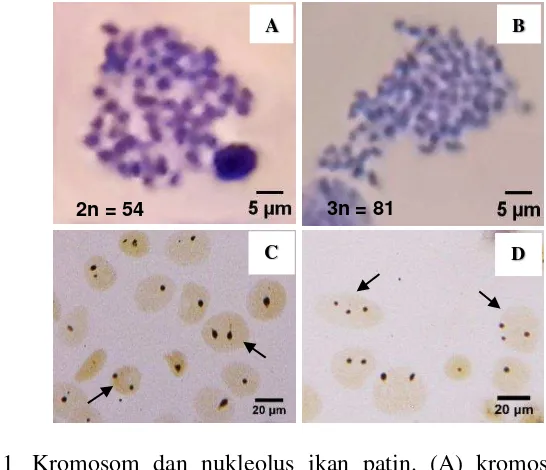
Identifikasi ploidi (diploid dan triploid) dilakukan dengan penghitungan nukleolus (Howell dan Black 1980) yang dikonfirmasi dengan penghitungan kromosom (Kligerman dan Bloom 1977). Preparasi kromosom dilakukan pada ikan berumur dua minggu, sedangkan preparasi nukleolus dilakukan setelah ikan berumur 3 bulan. Sebelum memasuki fase pembesaran, ikan di-screening untuk memisahkan diploid dan triploid, kemudian dipelihara secara terpisah dalam jaring apung ukuran 1×1×0.8 m3 dengan kepadatan 30 ekor per jaring selama tiga bulan, dan dilanjutkan pemeliharaan dalam jaring apung ukuran 2×1×0,8 m3 selama tiga bulan. Selanjutnya, kelompok diploid (SS),
Hasil penelitian menunjukkan derajat pembuahan (DPh) tidak berbeda nyata antar perlakuan (p>0,05). Sedangkan derajat penetasan (DPt) menunjukkan perbedaan yang nyata antar perlakuan (p<0,05). Persentase DPt kelompok diploid (SS dan SJ) sebesar 80-83%, sedangkan kelompok triploid (SSS dan SSJ) sebesar 27-28%. Pemeliharaan secara soliter menunjukkan laju pertumbuhan harian (LPH) tidak berbeda nyata antar perlakuan (p>0,05). Sedangkan pemeliharaan secara komunal menunjukkan laju pertumbuhan berbeda nyata antar perlakuan (p<0,05). Laju pertumbuhan harian kelompok SSS berbeda nyata dengan SS, SJ dan SSJ (p<0,05). Perbedaan juga terlihat antara SS dengan SJ dan SSJ (p<0,05), sedangkan SJ dengan SSJ tidak menunjukkan perbedaan yang nyata (p>0,05).
Bobot akhir pada pemeliharaan secara soliter dan komunal menunjukkan kelompok non hibrida (SS, SSS) tumbuh lebih cepat secara signifikan (p<0,05) dibandingkan dengan hibrida (SJ, SSJ). Namun, bobot akhir kelompok SS sama dengan SSS (p>0,05) pada pemeliharaan secara soliter, sedangkan pemeliharaan secara komunal menunjukkan bobot akhir kelompok SS lebih tinggi dibandingkan SSS (p<0,05). Perbandingan antara kelompok SJ dengan SSJ tidak menunjukkan perbedaan yang signifikan (p>0,05) baik pada pemeliharaan secara soliter maupun komunal. Rasio konversi pakan (RKP) dan tingkat kelangsungan hidup (TKH) tidak berbeda nyata antar perlakuan (P>0,05). Indeks gonadosomatik (IGS) jantan dan betina ikan triploid lebih kecil dibandingkan diploid (P<0,05) yang mengindikasikan perkembangan gonad tidak normal atau steril. Hasil histologi menunjukkan gonad diploid berkembang normal, gonad betina rata-rata sudah mencapai fase oosit previtelogenik (OPV) dan pada jantan rata-rata sudah mencapai fase spermatid (SPT). Sedangkan gonad ikan triploid menunjukkan perkembangan yang tidak normal, pada gonad betina terlihat adanya degradasi oosit (DO) dan hanya sebagian kecil yang mencapai fase oosit previtelogenik (OPV) dan gonad jantan triploid terlihat adanya ruang kosong dan hanya sebagian kecil yang mencapai fase spermatid (SPT).
Pengujian performa selama 2 bulan (umur 9-11 bulan) menunjukkan bahwa pertumbuhan non hibrida (SS, SSS) lebih tinggi dibandingkan hibrida (SJ, SSJ). Pemeliharaan secara soliter tidak menunjukkan perbedaan antara diploid dan triploid (SS=SSS dan SJ=SSJ). Sedangkan pemeliharaan secara komunal, pertumbuhan diploid lebih tinggi dibandingkan autotriploid (SS>SSS) dan diploid hibrid sama dengan
allotriploid (SJ=SSJ). Triploidisasi mengakibatkan perkembangan gonad jantan dan betina triploid tidak normal yang mengindikasikan sterilitas.
SUMMARY
YUSRAN IBRAHIM. Performance of Autotriploid and Allotriploid Stripped Catfish
Pangasianodon hypophthalmus x Pangasius djambal. Supervised by DINAR TRI SOELISTYOWATI and ODANG CARMAN.
Catfish fillet industry has been continuously developed as the market demand increased, both for local and overseas markets. In recent years the production of catfish is faced with the problem of inefficiency due to high operating costs which unbalance to their selling price, caused by the low growth rate. It can affect the production of catfish fillet and also bring impact to the whole industry. Efforts to improve the growth rate genetically are hybridization and chromosome set manipulation.
Broodstock of P. hypophthalmus used in this experiment were 2-2.5-year-old males and females with an average body weight of 2 kg and 3 kg respectively, while P. djambal were 1.5-2-year-old males with an average body weight of 1.5 kg. Spawning was conducted artificially; mature females were injected using 500 IU per kg body weight of Human Chorionic Gonadotropin (hCG), 24 hours later the second injection was applied using 0.6 ml per kg of body weight of Ovaprim (GnRHa + anti-dopamine). At the same time, males were single injected using 0.3 ml per kg of body weight of Ovaprim, then the fish were stripped 8-10 hours after second injection. The fertilized eggs then were washed with a soil suspension in order to remove adhesive material. Furthermore, the induction of triploidy were conducted using heat shock at 42°C for two minutes, two minutes after fertilization of zygots in a 40×20×10 cm styrofoam box. Autotriploids were produced by shocking normal P. hypophthalmus zygots, while allotriploids were produced by shocking zygots of P. hypophthalmus eggs fertilized whith P. djambal sperms (hybrid). The eggs were then incubated in a funnel-hatching jar at 28-29°C. The fertilization and hatching rate were calculated 6 and 24 hours after fertilization, respectively. Hatched larvae were reared indoor in 3×1×0.4 m fiber tanks for three months at density of 450 fish per tank.
Ploidi levels (diploid and triploid) were identified by calculating the maximum number of nucleoli per cell (Howell and Black 1980) and confirmed by chromosome counting (Kligerman and Bloom 1977). Chromosome preparations were done using two-weeks-old lavae samples, while the nucleoli preparations using three-months-old samples. Prior to the grow-out stage, the fish were screened to separate the diploid and triploid groups, then reared separately in 1×1×0.8 m cages at a density of 30 fish per cage for 3 months, and in 2×1×0.8 m for 3 months. Further, the diploid (SS), autotriploid (SSS), diploid hybrid (SJ) and allotriploid (SSJ) groups were tagged with passive integrated transponder (TN Pocket Tracker) and reared in 2.5×2×0.8 m cages both solitary and communal system for 2 months to collect performance and gonadal development data. Density of solitary rearing was 5 fish per cage, while density of communal rearing was 25 fish per cage consisted of 5 fish of each group.
shocked group (SS and SJ) was 80-83%, while the shocked group (SSS and SSJ) was 27-28%. When the fish reared solitary, the specific growth rate (SGR) was not different between groups (p>0.05), but in communal rearing showed that the specific growth rate (SGR) of SS was highest and significantly different with other groups (p<0.05). SJ and SSJ groups showed the same SGR (p>0.05) but higher than SSS (p<0.05).
Final body weight in the solitary and communal rearing showed that non-hybrid groups (SS, SSS) grew significantly (p<0.05) better than the hybrids (SJ, SSJ). In addition, the final body weight of SSS group was same as SS group (p>0.05) when reared solitary, but when reared communally SS group showed higher final weight than SSS group (p<0.05). Growth performance comparisons between SSJ and SJ groups showed that both in solitary and communal rearing indicated a similar performance. Feed conversion ratio (FCR) and the survival rate (SR) were not significantly different between groups (P>0.05). Gonadosomatic Index (GSI) male and female triploid fish smaller than diploid (P<0.05) indicated an abnormal gonadal development or sterile. Histological results showed normal development of the diploid gonads; in average female ganads reached the oocyte previtellogenic (OPV) stage and male gonads reached spermatids (SPT) phase. While the triploid gonads showed abnormal development; the female gonads indicated oocytes degradation (DO) and only a small portion of germinal cells reached the phase of oocyte previtellogenic (OPV) and male triploid gonads indicated the empty space with only a small portion testicular cells reached the phase of spermatid (SPT).
Performance test during two months (9- to 11-months-old) showed that the growth of non-hybrid (SS, SSS) was higher than the hybrids (SJ, SSJ). Solitary rearing showed no differences between diploid and triploid groups (SS=SSS and SJ=SSJ). While communal rearing showed that the growth of diploid was higher than autotriploid (SS>SSS) and diploid hybrid was same as allotriploid (SJ=SSJ). Triploidy caused abnormal development of both male and female gonads which indicated sterility symptom.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PERFORMA AUTOTRIPLOID DAN ALLOTRIPLOID IKAN PATIN SIAM
Pangasianodon hypophthalmus
x PATIN JAMBAL
Pangasius djambal
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
z
Judul Tesis : si Performa Autotriploid dan Allotriploid Ikan Patin Siam
Pangasianodon hypophthalmus x Patin Jambal Pangasius djambal
Nama : Yusran Ibrahim NIM : C151140271
Disetujui oleh Komisi Pembimbing
Dr Ir Dinar Tri Soelistyowati, DEA Ketua
Dr Ir Odang Carman, MSc Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 02 November 201630 Oktober 2016
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Judul penelitian yang dilaksanakan sejak bulan September 2015 di Balai Pengembangan Budidaya Ikan Patin dan Lele (BPBIPL) Cijengkol Subang, Jawa Barat ini ialah “Performa Autotriploid dan Allotriploid Ikan Patin Siam Pangasianodon hypophthalmus x Patin Jambal Pangasius djambal”.
Terima kasih penulis ucapkan kepada Ibu Dr Ir Dinar Tri Soelistyowati, DEA selaku Ketua pembimbing dan Bapak Dr Ir Odang Carman, MSc selaku anggota pembimbing, Ibu Dr Ir Mia Setiawati, MSi dan Ibu Dr Ir Widanarni, MSi yang telah banyak memberikan saran dan masukan. Ucapan terima kasih juga penulis sampaikan kepada Lembaga Pengelola Dana Pendidikan (LPDP) yang telah memberikan beasiswa penuh, Balai Pengembangan Budidaya Ikan Patin dan Lele (BPBIPL) Cijengkol, Subang, Jawa Barat atas fasilitas penelitian ini, nyanyak, ayah, adik, seluruh keluarga, teman-teman mahasiswa Pascasarjana Ilmu Akuakultur 2014 serta awardee LPDP IPB atas bantuan, doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat. Amin.
Bogor, November 2016
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan dan Manfaat Penelitian 3
2 METODE 3
Hewan Uji 3
Prosedur Penelitian 3
Parameter Uji 4
Analisis Data 6
3 HASIL DAN PEMBAHASAN 6
Hasil 6
Pembahasan 10
4 SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 14
LAMPIRAN 19
DAFTAR TABEL
1 Skema persilangan dan perlakuan poliploidi antara ikan patin siam
dengan ikan patin jambal 3
2 Derajat pembuahan dan penetasan pada kelompok diploid (SS, SJ)
dan triploid (SSS, SSJ) 6
3 Performa pertumbuhan ikan patin pada pemeliharaan secara soliter
dan komunal umur 9-11 bulan 9
4 Indeks gonadosomatik 9
DAFTAR GAMBAR
1 sil Kromosom dan nukleolus ikan patin 7
2 Pertambahan bobot ikan patin umur 9-11 bulan 8 3 Perkembangan gonad ikan patin umur 10 bulan 10
DAFTAR LAMPIRAN
1 2 3 4
Jumlah nukleolus dengan ploidi level hasil triploidisasi Jumlah kromosom ikan patin diploid (2n) dan triploid (3n) Metode identifikasi ploidi
Analisis statistik
1
1 PENDAHULUAN
Latar Belakang
Ikan patin merupakan salah satu komoditas ekonomis penting, harga ikan patin di pasar saat ini sekitar Rp. 20.000-27.000 (http://www.wpi.kkp.go.id). Industri filet ikan patin terus dikembangkan untuk memenuhi permintaan pasar yang terus meningkat, baik di pasar lokal maupun luar negeri. Dalam beberapa tahun terakhir produksi ikan patin dihadapkan dengan masalah inefficient karena tingginya biaya operasional yang tidak sebanding dengan harga jual yang salah satunya diakibatkan oleh lambatnya pertumbuhan. Beberapa metode dapat dilakukan untuk meningkatkan produksi ikan patin, diantaranya seleksi, hibridisasi atau persilangan, rekayasa set kromosom dan transgenesis. Masing-masing metode tersebut mempunyai kelebihan dan kekurangan untuk diterapkan pada ikan patin. Metode seleksi (selective breeding)mudah dilakukan, tetapi membutuhkan jumlah ikan dan fasilitas budidaya yang banyak serta membutuhkan waktu yang lama (Gjedrem dan Baranski 2009). Hibridisasi merupakan perkawinan antar individu atau populasi yang berbeda secara genetik (Bartley et al. 2001; Liu et al. 2007). Pada beberapa spesies ikan menunjukkan hasil yang positif seperti hibrida lele Afrika
x
lele Mesir (Essa et al. 2011), Pseudoplatystoma corruscans xPseudoplatystoma reticulatum (Mello et al. 2012), Ictalurus furcatus x Ictalurus punctatus (Bosworth dan Waldbieser 2014), Epinephelus coioides x Epinephelus lanceolatus (Sutthinon et al. 2014) dan Oreochromis niloticus x Oreochromis urolepis hornorum (Mbiru et al. 2016). Namun, hasil negatif juga ditemukan pada beberapa ikan hibrida diantaranya Oreochromis niloticus x Oreochromis macrochir
(Micha et al. 1996) dan Sparus aurata x Pagrus pagrus (Paspatis et al. 1999). Sedangkan metode transgenesis masih menjadi perdebatan terkait isu keamanan pangan, etika, kelestarian lingkungan serta persepsi masyarakat terhadap produk
genetically modified organism (GMOs) (Beaumont dan Hoare 2003; Dunham 2004).
Ikan patin siam (Pangasianodon hypophthalmus) merupakan ikan introduksi dari Thailand yang saat ini banyak dibudidaya oleh masyarakat di Indonesia. Ikan patin siam memiliki tingkat ketahanan yang lebih baik terhadap kondisi lingkungan yang kurang optimal. Namun kelemahan dari ikan patin siam yaitu dagingnya berwarna kekuningan yang kurang diminati oleh konsumen di negara-negara maju. Sedangkan ikan patin jambal (Pangasius djambal) merupakan ikan patin lokal Indonesia dengan ciri daging putih yang sangat diminati oleh konsumen, namun kelemahan ikan patin jambal yaitu fekunditas rendah dan tidak mampu bertahan pada kondisi lingkungan yang tidak optimal (Gunadi et al. 2006). Hasil hibridisasi antara betina patin siam dengan jantan patin jambal sudah resmi dirilis berdasarkan Keputusan Menteri Kelautan dan Perikanan No. KEP.25/MEN/2006 yang diberi nama Patin Pasupati dengan keunggulan fekunditas tinggi dan daging berwarna putih. Namun, patin pasupati masih memiliki beberapa kekurangan, yaitu sintasan dan toleransi terhadap lingkungan yang rendah.
keseimbangan populasi di alam, meningkatkan sintasan dan pertumbuhan. Ovarium dan testis pada ikan triploid secara signifikan tidak berkembang dan tidak ada tanda-tanda kematangan ovum dan spermatid (Nam et al. 2004). Produksi ikan triploid sangat penting dilakukan dalam kegiatan budidaya, karena dapat mengalihkan energi dari pematangan gonad ke pertumbuhan somatik dan dapat memperbaiki kualitas daging (Benfey 1999; Piferrer et al. 2009; Berrill et al. 2012).
Triploidisasi terdiri dari autotriploid dan allotriploid. Autotriploid adalah triploidisasi yang dilakukan pada ikan hasil perkawinan spesies yang sama, sedangkan allotriploid adalah triploidisasi yang dilakukan pada spesies yang berbeda. Allotriploid diduga memiliki performa yang lebih baik dibandingkan
autotriploid dan diploid (normal) karena allotriploid merupakan gabungan dari hibridisasi dan rekayasa set kromosom. Park et al. (2006) menyatakan bahwa pertumbuhan triploid hibrid (allotriploid) hasil persilangan antara ikan Misgurnus mizolepis x Misgurnus anguillicaudatus lebih baik dibandingkan ikan diploid. Triploidisasi pada ikan dapat dilakukan dengan perlakuan fisik, yaitu dengan kejutan suhu panas (heat shock), kejutan suhu dingin (cold shock) dan tekanan (hydrostatic pressure). Sedangkan perlakuan kimia dapat dilakukan dengan menggunakan zat-zat anti pembelahan seperti colchicine, cytochalasin dan
vincristine. Pada penelitian ini akan digunakan metode kejut suhu panas karena murah dan murah diterapkan. Semua perlakuan tersebut dilakukan untuk menghambat pelepasan polar body II, pada beberapa spesies ikan pelepasan ini terjadi 3-7 menit setelah fertilisasi (Carman et al. 1991).
Kondisi pemeliharaan sangat memengaruhi performa dan tingkah laku ikan triploid, terutama saat dipelihara dalam satu wadah yang sama dengan ikan diploid (komunal). Carter et al. (1994) melaporkan bahwa ikan triploid kurang agresif dibandingkan diploid sehingga kalah dalam mendapatkan makanan yang berdampak pada laju pertumbuhan. Beberapa hasil penelitian menunjukkan bahwa tidak ada perbedaan performa pertumbuhan antara diploid dan triploid pada pemeliharaan secara campuran (komunal) seperti pada ikan lele Afrika (Clarias gariepinus) (Henken et al. 1987) dan Atlantik salmon (Salmo salar) (McGeachy et al. 1995). Namun, pada ikan rainbow trout menunjukkan bahwa pertumbuhan ikan triploid lebih rendah dibandingkan diploid (Thorgaard et al. 1982). Oleh karena itu, pada penelitian ini dilakukan pengamatan performa ikan patin diploid dan triploid dari dua cara pemeliharaan, yaitu secara soliter dan komunal.
Rumusan Masalah
3
Tujuan dan Manfaat
Mengevaluasi performa ikan patin autotriploid dan allotriploid, sehingga hasil penelitian ini diharapkan dapat menjadi acuan untuk budidaya ikan patin triploid.
2 METODE PENELITIAN
Hewan Uji
Ikan uji untuk pemijahan yang digunakan pada penelitian ini adalah induk ikan patin siam (P. hypophthalmus) dan patin jambal (P. djambal). Patin siam berumur 2-2,5 tahun dengan bobot jantan rata-rata 2 kg, betina rata-rata 3 kg. Sedangkan patin jambal jantan berumur 1,5-2 tahun dengan rata-rata 1,5 kg. Tabel 1 Skema persilangan dan perlakuan poliploidi antara ikan patin siam dengan
ikan patin jambal.
Tanpa Kejut Suhu Diploid (SS) Diploid Hibrid (SJ) Kejut Suhu 42°C Autotriploid (SSS) Allotriploid (SSJ)
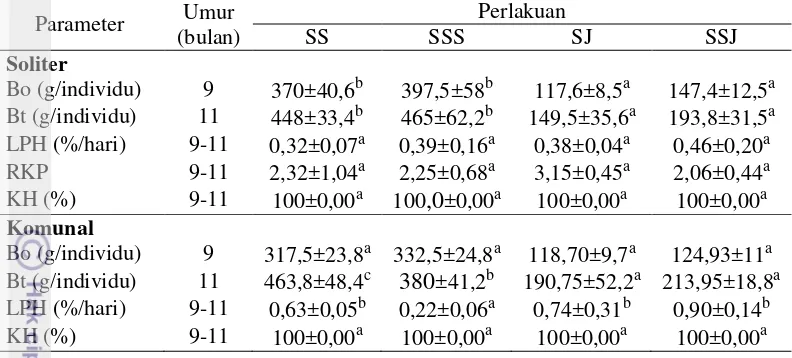
Ikan uji untuk pemeliharaan selama 60 hari adalah ikan diploid dan triploid hasil koleksi Balai Pengembangan Budidaya Ikan Patin dan Lele (BPBIPL) Cijengkol umur 9 bulan dengan bobot rata-rata: SS 370±40,6, SSS 397,5±58, SJ 117,6±8,5 dan SSJ 147,4±12,5 g untuk pemeliharaan secara soliter. Sedangkan untuk pemeliharaan secara komunal bobot rata-rata: SS 317,5±23,8, SSS 332,5±24,8, SJ 118,70±9,7 dan SSJ 124,93±11 g.
Prosedur Penelitian Pemijahan
Pemijahan dilakukan secara buatan, induk betina dua kali penyuntikan sedangkan jantan satu kali. Penyuntikan pertama patin siam betina dengan menggunakan hormon Human Chorionic Gonadotropin (hCG) 500 IU per kg bobot tubuh, penyuntikan kedua dilakukan setelah 24 jam dengan menggunakan hormon GnRHa + anti dopamin (Ovaprim) 0,6 ml per kg bobot tubuh. Sedangkan induk jantan hanya disuntik dengan menggunakan Ovaprim 0,3 ml per kg bobot tubuh, ikan siap di-stripping setelah 8-10 jam.
Perlakuan Kejut Suhu Panas (heat shock)
induksi triploid yang dilakukan pada penelitian ini berdasarkan hasil penelitian pendahuluan dengan tingkat keberhasilan triploid sekitar 65-70%.
Analisis Ploidi
Analisa ploidi dilakukan dengan preparasi nukleolus menggunakan modifikasi metode Howell dan Black (1980) dan dikonfirmasi dengan preparasi kromosom menggunakan modifikasi metode Kligerman dan Bloom (1977). Preparasi kromosom dilakukan pada ikan berumur 14 hari, sedangkan preparasi nukleolus dilakukan setelah ikan berukuran 2-3 inci (umur 2-3 bulan) agar pada saat pengambilan jaringan ikan tidak mati.
Perhitungan Kromosom dan Nukleolus
Perhitungan kromosom dilakukan pada 10 sebaran yang ditemukan, dari hasil tersebut kemudian ditentukan jumlah kromosom berdasarkan jumlah yang sering muncul. Perhitungan nukleolus dilakukan pada 500 sampel dengan menghitung jumlah maksimal nukleolus per sel. Masing-masing sampel diamati 400-500 sel, kemudian dihitung jumlah sel dengan satu, dua dan tiga nukleolus. Pemeliharaan
Pemeliharaan larva diploid dan triploid dilakukan secara indoor dalam bak fiber ukuran 3 x 1 x 0,4 m3. Larva diberikan artemia setelah kuning telur habis (30-36 jam) dilanjutkan dengan pemberian artemia secara at satiation selama 14 hari dengan durasi pemberian 2 jam sekali selama 7 hari pertama kemudian 4 jam sekali selama 7 hari selanjutnya. Umur 14 hari larva diberikan cacing sutera secara at satiation selama 10 hari dengan durasi pemberian 4 jam sekali. Larva mulai diberikan pakan buatan setelah berukuran 1 inci, pakan buatan yang diberikan adalah PF500 (umur 1-2 bulan) dan PF1000 (umur 2-3 bulan). Sebelum dilakukan pendederan, ikan di-screening untuk memisahkan diploid dan triploid, kemudian dipelihara secara terpisah dalam jaring apung ukuran 1×1×0,8 m3 dengan kepadatan 30 ekor/jaring selama 3 bulan, kemudian dipelihara dalam jaring apung ukuran 2×1×0,8 m3 hingga umur 9 bulan. Selanjutnya, 5 ekor dari masing-masing kelompok SS, SSS, SJ dan SSJ di-tagging dengan passive integrated transponder
(TN Pocket Tracker). Uji performa pertumbuhan dilakukan selama 2 bulan dengan dua cara pemeliharaan yaitu soliter (terpisah) dan komunal (pencampuran). Pemeliharaan secara soliter dilakukan dalam jaring apung ukuran 2,5×2×0,8 m3 dengan kepadatan 5 ekor/jaring, sedangkan pemeliharaan secara komunal dilakukan dengan mencampur 5 ekor dari masing-masing kelompok (SS, SSS, SJ dan SSJ) dalam satu wadah yang sama berukuran 2,5×2×0,8 m3.
Parameter Uji
Derajat Pembuahan (DPh)
Derajat pembuahan dihitung setelah 6-8 jam fertilisasi, parameter ini untuk melihat kualitas. Rumus yang digunakan sebagai berikut:
5
Telur yang dibuahi dilihat dari warnanya yang transparan, sedangkan telur yang tidak dibuahi berwarna putih keruh.
Derajat Penetasan (DPt)
Derajat penetasan dihitung 3 jam setelah telur menetas, parameter ini untuk melihat perbedaan tingkat penetasan antar perlakuan pasca kejutan suhu panas. Dihitung dengan menggunakan rumus sebagai berikut:
DPt = Jumlah telur yang menetasJumlah telur yang dibuahi x
Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian dihitung dengan menggunakan rumus berikut: α = 100 × [ln(Wt)−ln(W0)]/t
Keterangan: α = Laju Pertumbuhan Harian (% hari-1) Wt = Bobot Akhir (gr)
Wo = Bobot Awal (gr)
t = Lama Pemeliharaan (hari) Indeks Gonadosomatik (IGS)
Indeks gonadosomatik dihitung berdasarkan perbandingan bobot gonad dengan bobot tubuh dengan rumus sebagai berikut:
IGS = Bobot Tubuh x Bobot Gonad
Setelah ditimbang, gonad dimasukkan ke dalam larutan BNF selama 24 jam kemudian dilakukan histologi untuk mengamati tingkat perkembangannya.
Rasio Konversi Pakan
Konversi pakan dihitung dengan menggunakan rumus berikut:
Keterangan: RKP = Rasio konversi pakan
F = Jumlah pakan yang dikonsumsi (gr) Bo = Bobot ikan awal (gr)
Bt = Bobot ikan akhir (gr)
Bd = Bobot ikan mati selama pemeliharaan (gr) RKP
=
FTingkat Kelangsungan Hidup (TKH)
Tingkat kelangsungan hidup dihitung dengan menggunakan rumus berikut: TKH = N x Nt
Keterangan: TKH = Tingkat kelangsungan hidup (%)
N0 = Jumlah ikan pada awal pemeliharaan (ekor) Nt = Jumlah ikan pada akhir pemeliharaan (ekor)
Analisis Data
Data penelitian ditabulasi dan dianalisis menggunakan program MS. Office Excel 2013 dan analisis sidik ragam ANOVA dengan selang kepercayaan 95% menggunakan program SPSS 22,0. Apabila berbeda nyata maka dilakukan uji lanjut Duncan, sedangkan histologi dianalisis secara deskriptif.
3 HASIL DAN PEMBAHASAN
Hasil
Derajat Pembuahan dan Penetasan
Tabel 2 menunjukkan derajat pembuahan (DPh) tidak berbeda nyata antar perlakuan (P>0,05). Persentase DPh kelompok SS, SSS, SJ dan SSJ masing-masing 97,69±1,8, 97,17±0,89, 98,03±0,82 dan 98,79±0,63%. Sedangkan derajat penetasan (DPt) menunjukkan perbedaan yang nyata antar perlakuan (P<0,05). Persentase DPt kelompok SS, SSS, SJ dan SSJ masing-masing 80,24±4,63, 27,10±3,04, 83,49±2,79 dan 28,66±1,35%.
Tabel 2 Derajat pembuahan dan penetasan pada kelompok diploid (SS, SJ) dan triploid (SSS, SSJ).
Parameter Perlakuan
SS SSS SJ SSJ
DPb (%) 97,69±1,80a 97,19±0,89a 98,03±0,82a 98,79±0,63a
DPt (%) 80,24±4,63b 27,10±3,04a 83,49±2,79b 28,66±1,35a
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan hasil yang berbeda nyata (P<0,05), nilai yang tertera merupakan nilai rata-rata dan simpangan baku. Derajat pembuahan (DPb), derajat penetasan (DPt).
Perhitungan Kromosom dan Nukleolus
7
Gambar 1 Kromosom dan nukleolus ikan patin. (A) kromosom diploid, (B) kromosom triploid, (C) nukleolus diploid dan (D) nukleolus triploid. Performa Pertumbuhan
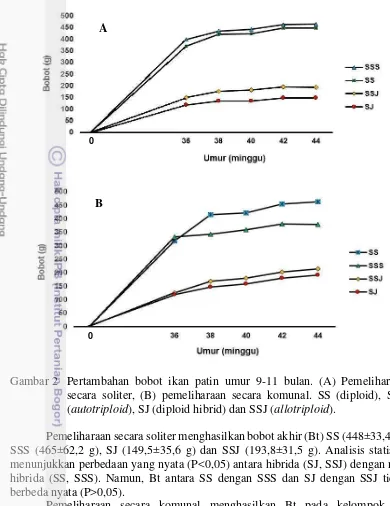
Hasil penelitian performa pertumbuhan umur 9-11 bulan dengan pemeliharaan soliter dan komunal disajikan pada Gambar 2 dan Tabel 3. Pemeliharaan secara soliter menunjukkan hasil tidak berbeda nyata antar perlakuan (P>0,05), LPH kelompok SS, SSS, SJ dan SSJ masing-masing 0,32±0,07, 0,39±0,16, 0,38±0,04 dan 0,46±0,20%/hari.
Pemeliharaan secara komunal, LPH terendah diperoleh kelompok SSS sebesar 0,22±0,06% dan tertinggi pada kelompok SSJ sebesar 0,90±0,14%/hari. Laju pertumbuhan harian SSS berbedanya nyata dengan SS, SJ dan SSJ (P<0,05). Perbedaan juga terlihat antara SS dengan SJ dan SSJ (P<0,05), sedangkan SJ dengan SSJ tidak menunjukkan perbedaan yang nyata (P>0,05).
3n = 81
B
2n = 54
A
0 0
Gambar 2 Pertambahan bobot ikan patin umur 9-11 bulan. (A) Pemeliharaan secara soliter, (B) pemeliharaan secara komunal. SS (diploid), SSS (autotriploid), SJ (diploid hibrid) dan SSJ (allotriploid).
Pemeliharaan secara soliter menghasilkan bobot akhir (Bt) SS (448±33,4 g), SSS (465±62,2 g), SJ (149,5±35,6 g) dan SSJ (193,8±31,5 g). Analisis statistik menunjukkan perbedaan yang nyata (P<0,05) antara hibrida (SJ, SSJ) dengan non hibrida (SS, SSS). Namun, Bt antara SS dengan SSS dan SJ dengan SSJ tidak berbeda nyata (P>0,05).
Pemeliharaan secara komunal menghasilkan Bt pada kelompok SS (463,8±48,4 g), SSS (380±41,2 g), SJ (190,75±52,2 g) dan SSJ (213,95±18,8 g). Analisis statistik menunjukkan perbedaan yang nyata (P<0,05) antara hibrida (SJ, SSJ) dengan non hibrida (SS, SSS). Bobot akhir antara SS dengan SSS menunjukkan perbedaan yang nyata (P<0,05), sedangkan SJ dengan SSJ tidak berbeda nyata (P>0,05).
Rasio konversi pakan (RKP) dan tingkat kelangsungan hidup (TKH) tidak berbeda nyata antar kelompok (P>0,05). Nilai RKP pada kelompok SS, SSS, SJ dan SSJ masing-masing 2,32±1,16, 2,25±0,76, 3,69±0,5, dan 2,06±0,49. Kelangsungan hidup 100% selama 2 bulan pengamatan, baik pada pemeliharaan secara soliter maupun komunal.
A
9
Tabel 3 Performa pertumbuhan ikan patin pada pemeliharaan secara soliter dan komunal umur 9-11 bulan.
Bo (g/individu) 9 370±40,6b 397,5±58b 117,6±8,5a 147,4±12,5a Bt (g/individu) 11 448±33,4b 465±62,2b 149,5±35,6a 193,8±31,5a LPH (%/hari) 9-11 0,32±0,07a 0,39±0,16a 0,38±0,04a 0,46±0,20a
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata antar perlakuan (P<0,05). Bobot awal (Bo), bobot akhir (Bt), laju pertumbuhan harian (LPH), rasio konversi pakan (RKP) kelangsungan hidup (KH).
Indeks Gonadosomatik
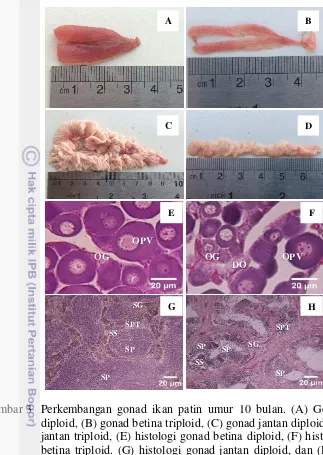
Indeks gonadosomatik jantan dan betina ikan triploid lebih kecil dibandingkan diploid (P<0,05) yang mengindikasikan perkembangan gonad tidak normal atau steril. Nilai IGS jantan diploid sebesar 1,54±0,88 dan triploid sebesar 0,11±0,02, sedangkan IGS betina diploid sebesar 0,25±0,08 dan triploid sebesar 0,03±0,00%/bobot tubuh (Tabel 4).
Keterangan: Huruf yang berbeda pada baris yang sama menunjukkan perbedaan nyata antar perlakuan (P<0,05). Indeks gonadosomatik (IGS).
Gambar 3 Perkembangan gonad ikan patin umur 10 bulan. (A) Gonad betina diploid, (B) gonad betina triploid, (C) gonad jantan diploid, (D) gonad jantan triploid, (E) histologi gonad betina diploid, (F) histologi gonad betina triploid. (G) histologi gonad jantan diploid, dan (H) histologi gonad jantan triploid.
Pembahasan
Derajat pembuahan (DPh) sangat penting diperhatikan, karena dapat dijadikan sebagai indikator kualitas dan keseragaman telur. Pada penelitian ini kualitas telur yang digunakan baik dan relatif seragam dengan rata-rata DPh 98%. Derajat penetasan diploid lebih tinggi daripada triploid, SS dan SJ masing-masing 80,24±4,63 dan 83,49±2,79 sedangkan SSS dan SSJ masing-masing 27,10±3,04 dan 28,66±1,35. Rendahnya DPt pada kelompok triploid disebabkan oleh efek kejutan suhu panas (heat shock). Hasil serupa juga dilaporkan pada beberapa spesies lainnya seperti ikan maskoki menghasilkan derajat penetasan 13% pasca kejut suhu 42ºC selama 2 menit (Carman et al. 1991), Salmo trutta L. 9,4-47,9% (Moffett dan Crozier 1995), udang Fenneropenaeus chinensis 37,3-51,4% (Li et al.
11
2003) dan ikan nila 3,4-28% (Mukti 2016). Suhu air sangat memengaruhi perkembangan embrio, perlakuan kejut suhu panas dapat mengakibatkan kerusakan pada mikrotubulus yang membentuk spindel selama meiosis (Gervai et al. 1980), menyebabkan depolimerisasi pada polimer tubulin dalam mikrotubulus yang esensial untuk pembentukan spindel (Bidwell et al. 1985). Perlakuan kejut suhu panas memengaruhi kondisi telur dan dapat mengakibatkan kerusakan pada spindel yang terbentuk saat proses meiosis dalam telur (Mukti 2016). Namun kerusakan tersebut tidak terjadi pada keseluruhan telur, sebagian kecil telur tetap mampu berkembang dengan baik. Pandian dan Varadaraj (1990) mengatakan beberapa embrio mati sebelum atau sesaat setelah menetas.
Rasio konversi pakan tidak berbeda nyata antar perlakuan (P>0,05). Hasil penelitian menunjukkan nilai RKP pada kelompok SSS sama dengan SS (autotriploid = diploid) begitu pula antara SSJ dengan SJ (allotriploid = diploid hibrid). Pengamatan RKP pada ikan triploid sudah dilakukan pada beberapa spesies seperti ikan grass carp (Wiley dan Wike 1986), Clarias gariepinus (Henken et al.
1987) dan rainbow trout (Oliva-Teles dan Kaushik 1990). Tidak ada perbedaan dalam rasio efisiensi protein, pemanfaatan protein, efisiensi energi pertumbuhan, total asupan energi dan keseimbangan nitrogen pada spesies tersebut.
Hingga umur 11 bulan, bobot akhir pada pemeliharaan secara soliter tidak menunjukkan hasil yang berbeda antara kelompok SSS dengan SS (autotriploid = diploid), begitu juga kelompok SSJ dengan SJ (allotriploid = diploid hibrid). Hasil serupa telah diketahui pada beberapa spesies ikan seperti Oreochromis aureus (Don dan Avtalion 1986), Pagrus major (Sugama et al. 1992), Misgurnus mizolepis (Kim
et al. 1995), Japanese flounder“hirame” (Tabata 1991; Arai 2001), Sparus aurata
Ikan triploid tidak dapat melakukan proses berpasangan kromosom karena jumlah set kromosomnya ganjil, sehingga dapat menghambat proses meiosis dan menyebabkan sterilitas. Hasil penelitian menunjukkan IGS pada ikan triploid lebih kecil dibandingkan diploid dengan perbandingan gonad SSS:SS (1:14) untuk jantan dan (1:8,3) untuk betina. Sedangkan SSJ:SJ (1:1,4) untuk jantan dan (1:1,5) untuk betina. Pada umumnya testis dan ovari ikan triploid memiliki ukuran lebih kecil dibandingkan ikan diploid dan perkembangan gonadnya tidak normal (Carman 1992; Jiang et al. 1993). Hasil histologi menunjukkan bahwa gonad jantan ikan diploid berkembang dengan baik dan hampir semuanya mencapai fase spermatid. Sedangkan pada ikan triploid gonad tidak berkembang dengan baik, hanya sedikit yang mampu mencapai fase spermatid. Spermatogenesis pada ikan triploid menunjukkan penggandaan spermatogonium menuju fase spermatosit, tetapi kemungkinan terjadi infertilitas dan merupakan calon sperma aneuploid (Benfey et al. 1986; Ueda et al. 1987; Hussain 1996; Benfey 1999; Felip et al. 2001; Devlin dan Nagahama 2002; Haffray et al. 2005). Triploid jantan pada penelitian ini diduga mampu menghasilkan sperma tetapi dalam jumlah yang lebih sedikit dibandingkan diploid, namun untuk kualitas sperma belum diamati. Hasil serupa juga dilaporkan pada beberapa spesies seperti ikan Pleuronectes platessa (Lincoln 1981); rainbow trout (Lincoln dan Scott 1984); fighting fish (Kavumpurath dan Pandian 1992) dan
common carp (Cherfas et al. 1994).
Gonad betina ikan patin masih pada fase awal yaitu oosit previtelogenik, namun perbedaan antara diploid dan triploid sudah mulai terlihat. Pada gonad betina triploid menunjukkan adanya degradasi oosit yang mengindikasikan sterilitas. Peningkatan pertumbuhan ikan triploid tergantung pada spesies dan waktu pemijahannya. Pada beberapa spesies, efek triploidisasi terhadap performa pertumbuhan baru terlihat ketika gonad mulai berkembang hingga pematangan akhir, seperti pada ikan Oncorhynchus mykiss, pertumbuhan triploid lebih rendah dibandingkan diploid dari larva hingga perkembangan gonad awal, namun triploid lebih unggul ketika sudah memasuki tahap pematangan gonad akhir (Solar et al.
1984; Lincoln dan Scott 1984; Chourrout et al. 1986). Hasil serupa juga laporkan pada ikan Misgurnus anguillicaudatus (Suzuki et al. 1985), Salvelinus fontinalis
(Boulanger 1991), Tilapia (Bramick et al. 1995; Pechsiri dan Yakupitiyage, 2005),
13
4 SIMPULAN DAN SARAN
Simpulan
Pengujian performa selama 2 bulan (umur 9-11 bulan) menunjukkan bahwa pertumbuhan non hibrida (SS, SSS) lebih tinggi dibandingkan hibrida (SJ, SSJ). Pemeliharaan secara soliter tidak menunjukkan perbedaan antara diploid dan triploid (SS=SSS dan SJ=SSJ). Sedangkan pemeliharaan secara komunal, pertumbuhan diploid lebih tinggi dibandingkan autotriploid (SS>SSS) dan diploid hibrid sama dengan allotriploid (SJ=SSJ). Triploidisasi mengakibatkan perkembangan gonad jantan dan betina triploid tidak normal yang mengindikasikan sterilitas.
Saran
DAFTAR PUSTAKA
Aliah RS, Inada Y, Yamaoka K dan Taniguchi N. 1991. Effects of triploidy on haematological characteristics and oxygen consumption of ayu. Nip Sui Gakkai. 57:833-836.
Arai K. 2001. Genetic improvement of aquaculture finfish species by chromosome manipulation techniques in Japan. Aquaculture. 197:205-228.
Bartley D, Rana K, Immink A. 2001. The use of interspecific hybrids in aquaculture and fisheries. Rev Fish Biol Fish. 10:325-337.
Beaumont AR, Hoare K. 2003. Biotechnology and Genetics in Fisheries and Aquaculture. Oxford [GB]: Blackwell Science. hlm 158.
Benfey TJ, Solar II, de Jong G, Donaldson EM. 1986. Flowcytometry confirmation of aneuploidy in sperm from triploid rainbow trout. Trans Am Fish Soc. 115:838-840.
Benfey TJ. 1999. The physiology and behaviour of triploid fishes. Rev Fish Sci. 7:39-67.
Berrill IK, MacIntyre CM, Noble C, Kankainen M, Turnbull JF. 2012. Bio-economic Costs and Benefits of Using Triploid Rainbow Trout in Aquaculture: Reduced Mortality. Aquacult Eco Mgmnt. 16:365-383.
Bidwell CA, Chrisman CL, Libey GS. 1985. Polyploidy induced by heat shock in channel catfish. Aquaculture. 51:25-32.
Bosworth B, Waldbieser G. 2014. General and specific combining ability of male blue catfish (Ictalurus furcatus) and female channel catfish (Ictalurus punctatus) for growth and carcass yield of their F1 hybrid progeny.
Aquaculture. 420-421:147-153.
Boulanger Y. 1987. Preliminary results on the growth of sterile rainbow trout (triploidy induced by a pressure shock) in fish culture. Proc Ann MeetAquac Assoc Can 1:55-58.
Boulanger Y. 1991. Performance comparison of all-female, diploid and triploid brook trout. In: Pepper VA. (Ed.), Proceedings of the Atlantic Canada Workshop on Methods for the Production of Non Maturing Salmonids: 19-21 February 1991, Dartmouth, Nova Scotia: Can Tech Rep Fish Aquat Sci.
1789:111-119.
Brämick U, Puckhaber B, Langholz HJ, Hörstgen-Schwark G. 1995. Testing of triploid tilapia Oreochromis niloticus under tropical pond conditions.
Aquaculture. 137:342-353.
Cal RM, Vidal S, Gomez C, Ivarez-Blazquez BA, Martinez P, Piferrer F. 2006. Growth and gonadal development in diploid and triploid turbot Scophthalmus maximus. Aquaculture. 251:99-108.
Carman O, Oshiro T, Takashima F. 1991. Estimation of effective condition for induction of triploidy in goldfish Carassius auratus Linnaeus. J Tokyo Univ Fish. 78(2):127-135.
15
Carter CG, McCarthy ID, Houlihan DF, Johnstone R, Walsingham MV dan Mitchell AI. 1994. Food consumption, feeding behavior, and growth of triploid and diploid Atlantic salmon, Salmo salar L., parr. Can J Zool. 72:609-617.
Cassani JR, Caton WE. 1986. Growth comparisons of diploid and triploid grass carp under varying conditions. Prog Fish-Cult. 48:184-187.
Cherfas NB, Gomelsky B, Ben-Dom N, Pertez Y, Hulzata G. 1994. Assessment of triploid common carp Cyprinus carpio L. for culture. Aquaculture. 127:11-18.
Chourrout D, Chevassus B, Krieg F, Happe A, Burger G, Renard P. 1986. Production of second generation triploid and tetraploid rainbow trout by mating tetraploid males and diploid females potential of tetraploid fish. Theor Appl Genet. 72:193-206.
Devlin RH, Nagahama Y. 2002. Sex determination and sex differentiation in fish: an overview of genetic, physiological and environmental influences.
Aquaculture. 208:191-364.
Don J, Avtalion RR. 1986. The induction of triploidy in Oreochromis aureus by heat shock. Theor Appl Genet. 72:186-192.
Dunham RA. 1990. Production and use of monosex or sterile fishes in aquaculture.
Rev Aquat Sci. 2:1-17.
Dunham RA. 2004. Aquaculture and Fisheries Biotechnology: Genetic Approaches. Cambridge [US]: CABI. hlm 372.
Essa MA, Mabrouk HA, Mohamed RA, Michael FR. 2011. Evaluating Different Additive Levels of Yeast, Saccharomyces cerevisiae, on the Growth and Production Performances of a Hybrid of Two Populations of Egyptian African Catfish, Clarias gariepinus. Aquaculture. 320:137-141.
Felip A, Piferrer F, Carrillo M, Zanuy S. 2001. A comparison of gonadal development and plasma levels of sex steroid hormones in diploid and triploid sea bass, Dicentrarchus labrax L. J Exp Zool. 290:384-395.
Galbreath PF, Jean WS, Anderson V, Thorgaard GH. 1994. Freshwater performance of all-female diploid and triploid Atlantic salmon. Aquaculture.
128: 41-49.
Gervai J, Marian T, Krasznai Z, Nagy A, Csanyi V. 1980. Occurrence of aneuploidy in radiation gynogenesis of carp Cyprinus carpio L. J Fish Biol. 16(4):435-439.
Gjedrem T, Baranski M. 2009. Selective Breeding in Aquaculture: An Introduction. London [GB]: Springer. hlm 221.
Gunadi B, Tahapari E, Ariyanto D. 2006. Keragaan pertumbuhan ikan patin siam (Pangasianodon hypophthalmus), prtin jambal (Pangasius djambal) dan hibridanya pada keramba jaring apung di perairan bekas galian pasir.
Prosiding Seminar Nasional Ikan IV [internet]. 2006 Agustus 29-30; Jatiluhur, Indonesia. Jatiluhur (ID). hlm 25-29; [diunduh 2016 Oktober 15]. Tersedia pada: http://repository.ipb.ac.id/handle/123456789/42158.
Henken AM, Brunink AM dan Richter CJJ. 1987. Differences in growth rate and feed utilization between diploid and triploid African catfish, Clarias gariepinus (Burchell 1822). Aquaculture. 63:233-242.
Howell WM, Black DA. 1980. Controlled silver staining of nucleolus organizer regions with protective colloidal developer: a1-step methods. Experientia.
36:1014-1015.
Hussain MG. 1996. Advances in chromosome engineering research in fish: review of methods, achievements and applications. Asian Fish Sci. 9:45-60.
Inada Y dan Taniguchi N. 1992. Studies on jumping, territorial and algae feeding behaviors of induced triploid ayu Plecoglossus altivelis. Suisanzoshoku.
40:99-104.
Jiang W, Li G, Xu G, Lin Y, Qing N. 1993. Growth of the induced triploid pearl oyster Pinctada martensii D. Aquaculture. 111:245-253.
Kavumpurath S dan Pandian TJ.1992. Effects of induced triploidy on aggressive display in the fighting fish, Beta splendens Regan. Aquacult Fish Mgmnt
23:281-290.
Kim DS, Nam YW, Park I-S. 1995. Survival and karyological analysis of reciprocal diploid and triploid hybrids between mud loach Misgurnus mizolepis and cyprinid loach Misgurnus anguillicaudatus. Aquaculture. 135:257-265. Kligerman AD, Bloom SE. 1977. Rapid Chromosome Preparations from Solid
Tissues of Fishes. J Fish Res Board Can. 34:266-269.
Li F, Xiang J, Zhou L, Wu C, Zhang X. 2003. Optimization of triploid induction by heat shock in Chinese shrimp Fenneropenaeus chinensis. Aquaculture. 219:221-231.
Lincoln R.F dan Scott AP. 1984. Sexual maturation in triploid rainbow trout (Salmo gairdneri, Richardson). J Fish Biol. 25:385-392.
Lincoln RF, Bye VJ. 1987. Growth rates of diploid and triploid rainbow trout Salmo gairdneri over the spawning season. In: Proceedings of the Third
International Symposium on Reproductive Physiology of Fish (Idler, D. R., L. W. Crim, and J. M. Walsh, Eds.). p 134. St. John’s: Memorial University of Newfoundland.
Lincoln RF. 1981. Sexual maturation in triploid male plaice (Pleuronectes platessa) and plaice x flounder (Platichthys flesus) hybrids. J Fish Biol. 19:415-426. Linhart O, Haffray P, Ozouf-Costaz C, Flajšhans M, Vandeputte M. 2001.
Comparison of methods for hatchery-scale triploidization of European Catfish (Silurus glanis L.). J Appl Ichth. 17:247-255.
Liu SJ, Qin QB, Xioa J, Lu WT, Shen JM, Li W, Liu JF, Duan W, Zhang C, Tao M, Zhao RR, Yan JP, Liu Y. 2007. The formation of the polyploid hybrids from different subfamily fish crossings and its evulotionary significance.
Genetics. 176(2):1023-1034.
Maxime V. 2008. The physiology of triploid fish: current knowledge and comparisons with diploid fish. Fish Fish. 9:67-78.
17
McGeachy S, Benfey TJ, Friars, GW. 1995. Freshwater performance of triploid Atlantic salmon (Salmo salar) in New Brunswick aquaculture. Aquaculture. 137:333-341.
Mello PH, Arau BC, Venturieri RLL, Moreira RG. 2012. Fatty acids as a tool to compare cachara (Pseudoplatystoma reticulatum) (Siluriformes: Pimelodidae) and hybrid (Pseudoplatystoma corruscans x Pseudoplatystoma reticulatum) larvae during early development. Aquacult Int. 20:1139-1160. Micha JC, Cuvelier R, Tilquin CH, Muraille B, Bourgois M, Falter U. 1996.
Comparative Growth of Hybrids (F1, F2 and F3) of Oreochromis niloticus L. and O. macrochir Blgr. Di dalam: Pullln RSV, Lazard J, Legendre M, Amon Kothias JB, Pauly D, editor. The Third International Symposium on Tilapia inAquaculture, ICLARM Conf. Proc. 41. Manila [PH]: ICLARM. hlm 354-360.
Moffett IJJ, Crozier WW. 1995. An investigation into the reproducibility of triploid brown trout, Salmo trutta L., production using heat shock. Aquacult Res. 26:67-70.
Mukti AT. 2016. Triploidi dan dimorfisme seks, performa reproduksi dan produksinya pada ikan nila Oreochromis niloticus [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Nam YK, Park IS, Kim DS. 2004. Triploid hybridization of fast-growing transgenic mud loach Misgurnus mizolepis male to cyprinid loach Misgurnus anguillicaudatus female: the first performance study on growth and reproduction of transgenic polyploid hybrid fish. Aquaculture. 231:559-572. Oliva-Teles A, Kaushik SJ. 1990. Growth and nutrient utilization by 0+ and 1+
triploid rainbow trout, Oncorhyncus mykiss. J Fish Biol. 37:125-133.
Pandian TJ, Varadaraj K. 1990. Techniques to produce 100% male tilapia. AGA.
The ICLARM Quarterly. 13(34):3-5.
Park I, Nam YK, Kim DS. 2006. Growth performance, morphometric traits and gonad development of induced reciprocal diploid and triploid hybrids between the mud loach (Misgurnus mizolepis Günther) and cyprinid loach (Misgurnus anguillicaudatus Cantor). Aquacult Res. 37:1246-1253.
Paspatis M, Markakis G, Koumoundouros G, Kentouri M. 1999. Preliminary results on rearing of Sparus aurata
x
Pagrus pagrus hybrids. Performance comparison with the parental species. Aquacult Int. 7:295-306.Pechsiri J, Yakupitiyage A. 2005. A comparative study of growth and feed utilization efficiency of sex reversed diploid and triploid Nile tilapia, Oreochromis niloticus L. Aquacult Res. 36:45-51.
Piferrer F, Beaumont A, Falguière JC, Flajšhans M, Haffray P, Colombo L. 2009. Polyploid fish and shellfish: production, biology and applications to aquaculture for performance improvement and genetic containment.
Aquaculture. 293:125-156.
Solar II, Donaldson EM, Hunter GA. 1984. Induction of triploidy in rainbow trout
Salmo gairdneri Richardson by heat shock, and investigation of early growth.
Aquaculture. 42:57-67.
Sutterlin AM, Collier C. 1991. Some observations on the commercial use of triploid rainbow trout and Atlantic salmon in Newfoundland, Canada. Can Tech Rep Fish Aquat Sci. 1789:89-96.
Sutthinon P, Thongprajukaew K, Saekhow S, Ketmanee R. 2014. Juvenile Hybrid Grouper (Epinephelus coioides x E. lanceolatus) are Euryhaline and Can Grow in a Wide Range of Salinities. Aquacult Int. 23:(2) pp.
Suzuki R, Nakanishi T, Oshiro T.1985. Survival, growth and sterility of induced triploid in the cyprinid loach Misgurnus anguillicaudatus. Bull. Jpn Soc Sci Fish. 51:889-894.
Tabata K. 1991. Application of the chromosome manipulation in aquaculture of hirame Paralichthys olivaceus. Bull. Hyogo Prefect Fish Exp Stn. 28:1-134. Tave D. 1993. Growth of triploid and diploid bighead carp, Hypophthalmichthys
nobilis. J Appl Aquacult. 2(2):13–25.
Thorgaard GH, Rabinovitch PS, Shen MW, Gall GAE, Propp J, Utter FM. 1982. Triploid rainbow trout identified by flow cytometry. Aquaculture. 29:305-309.
Ueda T, Sawada M, Kobayashi J. 1987. Cytogenetical characteristics of the embryos between diploid female and triploid male in rainbow trout. Jpn J Genet. 62:461-465.
19
Lampiran 1 Jumlah nukleolus dengan ploidi level hasil triploidisasi.
Lampiran 2 Jumlah kromosom ikan patin diploid (2n) dan triploid (3n).
Sampel ∑ Kromosom Keterangan
Lampiran 3 Metode Identifikasi Ploidi
Preparasi Nukleolus
Preparasi nukleolus dilakukan pada ikan berukuran 2-3 inci (umur 2-3 bulan). Jaringan sirip ekor difiksasi dengan larutan Carnoy (acetic acid glacial :
21
dengan AgNO3 yang diinkubasi dalam staining box selama 15 menit, pengamatan dengan mikroskop pada pembesaran 1000x.
Preparasi Kromosom
Preparasi kromosom untuk mengonfirmasi level ploidi dilakukan pada ikan berumur dua minggu, larva direndam dengan kolkisin 70 mg/L selama 8 jam, dilanjutkan perendaman dengan KCl 5,6 gr/L selama 60 menit. Kemudian fiksasi dengan larutan Carnoy selam 60 menit. Jaringan dikeringkan, dimasukkan ke dalam tube 0,6 ml dan ditetesi 3 tetes acetic acid 50%. Jaringan digerakkan hingga terbentuk suspensi sel, kemudian dilakukan pembuatan ring pada gelas objek dengan menggunakan mikropipet di atas hot plate (45-50ºC). Pewarnaan menggunakan Giemsa 100% selama 4 menit kemudian diamati dengan mikroskop pada pembesaran 1000x.
Bobot akhir dan laju pertumbuhan harian pemeliharaan secara soliter
Test of Homogeneity of Variances
Levene Statistic df1 df2 Sig.
Bobot Akhir 2,000 3 12 ,168
ANOVA
Sum of Squares df Mean Square F Sig.
Bobot Akhir Between Groups 331326,037 3 110442,012 53,933 ,000
Within Groups 24572,988 12 2047,749
Uji lanjut bobot akhir pemeliharaan secara soliter
Perlakuan N Subset for alpha = 0.05
Bobot akhir dan laju pertumbuhan harian pemeliharaan secara komunal
Test of Homogeneity of Variances
Bobot Akhir Between Groups 207869,508 3 69289,836 29,209 ,000
Within Groups 28466,210 12 2372,184
Uji lanjut bobot akhir pemeliharaan secara komunal
Perlakuan N Subset for alpha = 0.05
Uji lanjut laju pertumbuhan harian pemeliharaan secara komunal