OPTIMASI PRODUKSI SELULASE
BERBASIS AMPAS KELAPA
OLEH
Trichoderma hamatum
PRIO SULISTYATNO
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi Optimasi Produksi Selulase Berbasis Ampas Kelapa oleh Trichoderma hamatum adalah benar karya saya dengan arahan dari komisi pembimbing. Seluruh data yang ada di dalam skripsi ini adalah milik Pusat Penelitian Kimia Lembaga Ilmu Pengetahuan Indonesia dan telah dipublikasikan dalam Prosiding Seminar Nasional Kimia Terapan Indonesia 2013. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
ABSTRAK
PRIO SULISTYATNO. Optimasi Produksi Selulase Berbasis ampas kelapa oleh Trichoderma hamatum. Dibimbing oleh Suryani dan Teuku Beuna Bardant.
Produksi selulase berbasis ampas kelapa dilakukan dengan menggunakan Trichoderma hamatum dan selulase yang dihasilkan untuk konversi Tandan Kosong Kelapa Sawit (TKKS) menjadi bioetanol. Kondisi optimum fermentasi Trichoderma hamatum berbasis ampas kelapa belum diketahui. Penelitian ini bertujuan untuk memperoleh kondisi optimum untuk produksi selulase melalui fermentasi padat dengan variasi volume air, kadar urea, dan bobot Trichoderma hamatum. Kondisi optimum produksi selulase yang diperoleh adalah dengan variasi volume air 64.28%, kadar urea, dan bobot Trichoderma hamatum berturut-turut 2.51%, 0.83%, dan 1.30% adalah 6.75 ± 1.31 FPU/gds. Kombinasi selulase dari T. hamatum dan β-glukosidase komersial untuk produksi etanol dari TKKS adalah 3.93% v/v, sedangkan dengan hanya β-glukosidase komersial adalah 0.47% v/v. Substitusi selulase komersial dengan enzim yang diproduksi dalam penelitian ini menghasilkan bioetanol 0.07% v/v, sedangkan penggunaan selulase yang diproduksi secara bersamaan dengan selulase komersial adalah 0.20% v/v. Kadar bioetanol yang diperoleh menggunakan selulase dari T. hamatum lebih rendah dibandingkan dengan menggunakan selulase komersial.
Kata kunci: Ampas kelapa, Bioetanol, Selulase, Tandan Kosong Kelapa Sawit (TKKS), Trichoderma hamatum
ABSTRACT
PRIO SULISTYATNO. Optimization Cellulase Production Based Coconut Pulp by Trichoderma hamatum. Supervised by Suryani and Teuku Beuna Bardant.
Cellulase production based coconut pulp is done by using Trichoderma hamatum and cellulose produced for conversion of Oil Palm Empty Fruit Bunch (EFB) into bioethanol. The optimum fermentation conditions of Trichoderma hamatum based coconut pulp is unknown. This research aims to obtain optimum conditions for cellulase production through solid fermentation with variations of volume water, urea, and Trichoderma hamatum weight. The optimum conditions for cellulose production is obtained by variation water volume 64.28%, urea, and the weight of Trichoderma hamatum consecutive 2.51%, 0.83%, and 1.30% is 6.75 ± 1.31 FPU/gds. Combination of cellulose from Trichoderma hamatum and commercial β-glucosidase for the production of ethanol from EFB is 3.93% v/v, whereas the only commercial β-glucosidase is 0.47% v/v. Substitution with commercial cellulose enzymes produced in this research produce bioethanol 0.07% v/v, while the use of cellulase produced simultaneously with commercial cellulase is 0.20% v/v. Ethanol levels obtained using cellulose from Trichoderma hamatum lower than using commercial cellulose.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
OPTIMASI PRODUKSI SELULASE
BERBASIS AMPAS KELAPA
OLEH Trichoderma hamatum
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Optimasi Produksi Selulase Berbasis Ampas Kelapa Oleh Trichoderma hamatum
Nama : Prio Sulistyatno NIM : G84090043
Disetujui oleh
Dr Suryani, SP, MSc Pembimbing I
Teuku Beuna Bardant, ST, MSc Pembimbing II
Diketahui oleh
Dr Ir I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji syukur penulis panjatkan ke hadirat Allah SWT atas segalah rahmat-Nya sehingga penulis dapat menyelesaikan penelitian ini. Shalawat dan salam semoga selalu tercurahkan kepada Nabi Muhammad SAW dan keluarganya. Penelitian ini merupakan bagian dari penelitian di Pusat Kimia Lembaga Ilmu Pengetahuan Indonesia, LIPI-Serpong yang dilaksanakan di Laboratorium Biokatalis BPTK LIPI, dari bulan Januari hingga Juni 2013.
Penulis mengucapkan terima kasih kepada ibu Dr Suryani SP., MSc, ibu Popi Asri Kurniatin SSi, Apt, MSi selaku dosen pembimbing utama dan bapak Teuku Beuna Bardant ST., MSc selaku pembimbing lapangan yang telah membimbing serta memberi saran dan kritik yang membangun. Ucapan terima kasih penulis juga sampaikan kepada para peneliti, teknisi, staf, serta sesama mahasiswa penelitian di Laboratorium Biokatalis BPTK LIPI. Penulis juga mengucapkan terima kasih kepada kedua orang tua dan teman-teman Biokimia atas dukungan yang selalu diberikan.
Semoga tulisan ini bermanfaat dalam bidang ilmu pengetahuan khususnya bidang biokimia serta memberikan kemaslahatan bagi masyarakat terutama untuk pengembangan bioetanol sebagai alternatif sumber energi.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan 2
Alat 2
Prosedur 2
HASIL 5
Aktivitas Ekstrak Kasar Selulase 5
Simulasi Produksi Selulase dengan Metode RSM 6
Produksi Bioetanol pada kondisi optimum 8
PEMBAHASAN 8
Aktivitas Ekstrak Kasar Selulase 8
Simulasi Produksi Selulase dengan Metode RSM 9
Produksi Bioetanol pada Kondisi Optimum 11
SIMPULAN 12
SARAN 13
DAFTAR PUSTAKA 13
LAMPIRAN 15
DAFTAR TABEL
1 Variasi penambahan enzim komersial (selulase, β-glukosidase), EAK 5 2 Aktivitas selulase yang diukur & perkiraan aktivitas selulase 5
3 Validasi persamaan empiris menggunakan RSM 8
DAFTAR GAMBAR
1 Kurva tiga dimensi hasil persamaan empiris 6
2 Titik optimum dari kurva tiga dimensi 7
3 Produksi etanol pada kondisi optimum 8
DAFTAR LAMPIRAN
1 Strategi penelitian optimasi media Trichoderma hamatum 15
2 Kadar gula sebelum fermentasi 16
PENDAHULUAN
Bioetanol dapat diproduksi dari bahan yang mengandung glukosa, pati, dan selulosa. Namun bahan yang mengandung glukosa dan pati digunakan juga sebagai kebutuhan pangan sehingga menimbulkan kontradiksi bila diterapkan di negara berkembang, contohnya Indonesia. Salah satu substrat yang dapat digunakan untuk produksi bioetanol adalah selulosa. Selulosa merupakan homopolimer yang tersusun dari subunit D-glukosa yang ditautkan satu sama lain
melalui ikatan β-(1,4) glikosida. Banyak peneliti mengungkapkan bahwa limbah yang mengandung selulosa dapat digunakan sebagai sumber gula yang murah dan mudah didapat untuk menggantikan bahan pati dalam proses fermentasi (Graf dan Koehler, 2000 dalam Kamara et al 2007). Hal ini yang mendorong usaha penggunaan bahan baku dari limbah pertanian (biomassa).
Salah satu limbah pertanian yang mengandung selulosa adalah tandan kosong kelapa sawit (TKKS). Menurut Dea (2009), TKKS memiliki potensi yang besar menjadi sumber biomassa selulosa dengan kelimpahan dan kandungan selulosa tinggi, kandungan lignin relatif rendah serta sifatnya terbarukan. Menurut Richana (2011) kandungan selulosa, hemiselulosa, dan lignin pada TKKS secara berturut-turut adalah 50.29%, 25.54%, dan 24.15%. Kandungan selulosa dan hemiselulosa dalam TKKS berpotensi cukup besar untuk dikonversi menjadi bioetanol (Alejandro et al 2007).
Produksi bioetanol melalui beberapa tahapan, yaitu biomassa lignoselulosa dikonversi menjadi gula, kemudian gula yang diperoleh dikonversi menjadi etanol. Produksi bioetanol pada tahap sakarifikasi membutuhkan enzim selulase untuk memutuskan ikatan β-1,4-glukosidik di dalam selulosa. Produksi selulase umumnya menggunakan fungi atau bakteri yang telah diisolasi. Fungi merupakan mikroorganisme utama yang dapat memproduksi selulase. Fungi berfilamen, seperti Trichoderma adalah penghasil selulase dan enzim kasar secara komersial. Fungi-fungi tersebut sangat efisien dalam memproduksi selulase (Ikramul et al 2005).
2
Penelitian ini bertujuan untuk memperoleh kondisi optimum untuk produksi selulase melalui fermentasi padat dengan variasi volume air, kadar urea dan bobot Trichoderma hamatum. Kurva RSM digunakan untuk simulasi dalam menentukan komposisi media tumbuh dan nutrisi yang tepat untuk T. hamatum untuk menghasilkan selulase dengan aktivitas tinggi. Selulase yang diproduksi dalam kondisi optimum dapat digunakan untuk hidrolisis TKKS untuk menghasilkan glukosa yang dapat dikonversi menjadi bioetanol.
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan selama enam bulan mulai bulan Januari sampai bulan juni 2013. Tempat penelitian di Laboratorium Bidang Teknologi Proses dan Katalisis (BTPK), Pusat Penelitian Kimia Lembaga Ilmu Pengetahuan Indonesia (LIPI), kawasan Puspiptek Serpong, Tangerang Selatan, Banten.
Bahan
Bahan-bahan yang digunakan adalah ampas kelapa yang diperoleh dari pasar Pondok Labu, Jakarta Selatan. Bubur tandan kosong kelapa sawit (TKKS) diperoleh dari Pusat Penelitian Kimia (P2K) LIPI, Serpong. Urea, nitrogen fosfat kalium (NPK), plastik, Trichoderma hamatum yang berasal dari produk komersial Trichowish (biofungisida) dari produsen Wish Indonesia, dan ragi (Saccaromyces cereviciae) dari fermipan. Selain itu larutan asam sitrat, larutan Na-asetat 0.05 N, Na2CO3 anhidrat, CuSO4.H2O, larutan Na- asetat 0.5 N pada pH 4.5 sampai 5, natrium tiosulfat 0.1 N, reagen Luff Schoorl, larutan pati, aquades, kalium iodida (KI), larutan kanji, larutan asam sulfat (H2SO4), asam klorida (HCl), Selulase komersial (C-tech) dan β-glukosidase komersial (H-Tech) Novo Nordisk A/S Bagesvaerd Denmark, serta Span 85 sebagai surfaktan.
Alat
Alat- alat yang digunakan dalam penelitian ini adalah neraca analitik, gelas ukur, pipet 1 mL, pipet 2 mL, pipet 5 mL, pipet 10 mL, labu Erlenmeyer, bak plastik, buret, corong, kertas saring Whatman no 1, penangas air, shaker, kain saring, plastik, sudip, pengaduk, kertas indikator pH, tabung reaksi beserta raknya, destilator, dan Density/Spesific Gravity Meter DA-640.
Prosedur
Pembuatan Media Trichoderma hamatum (Bardant TB et al 2013)
3 berukuran 1 liter. Sampel tersebut akan membentuk lempengan dengan ketebalan kurang lebih 1.5 cm. Kantong plastik dilubangi dengan diameter 3 mm dengan jarak 1.5 x 1.5 cm antar lubang di sisi atas dan bawahnya untuk pertukaran udara di dalam plastik. Media tanam diletakkan dan diatur dalam ruang kedap cahaya dalam rak-rak, dengan jarak antar rak 7 cm. Fermentasi padat dilakukan pada suhu 30-32oC dalam media berkantung plastik selama 5 hari.
Penyiapan Ekstrak Kasar Selulase
Setelah inkubasi selama 5 hari, kemudian sampel tersebut ditimbang. Hasil fermentasi padat kemudian diekstraksi dengan rasio air berbanding hasil fermentasi 1:1. Ekstraksi diawali dengan pengadukan menggunakan sudip, dilanjutkan dengan penyaringan dua tahap, yaitu penyaringan menggunakan kain saring dilanjutkan menggunakan kertas saring.
Penentuan Aktivitas Ekstrak Kasar Selulase (SNI 01-2891-1992)
Ekstrak yang telah disaring diencerkan sebanyak empat konsentrasi menggunakan larutan Na-asetat 0.05 N. Kertas saring Whatman No.1 yang digunakan berukuran 3x6 cm dimasukan ke dasar tabung reaksi dan dibasahi 1 mL larutan Na-asetat. Ekstrak yang telah diencerkan dipipet sebanyak 5 mL, dimasukan ke dalam tabung reaksi yang berisi kertas Whatman No.1, kemudian dipanaskan di dalam water bath dengan suhu 50oC selama 1 jam. Setelah 1 jam, sampel diangkat dan didinginkan. Aktivitas enzim dinyatakan dalam FPU/gds (Filter Paper Unit/ gram dry solid) untuk memudahkan dalam membandingkan (Dhillon et al 2011).
Ekstrak enzim yang telah diberi perlakuan kertas Whatman No 1, diukur kadar gula pereduksinya menggunakan metode Luff Schoorl (SNI 01-2891-1992). Kadar gula pereduksi awal dalam ekstrak enzim diukur dengan menambahkan 2 gelembung hilang yang timbul akibat penambahan H2SO4 tersebut. Kemudian ditambahkan 0.5 mL KI kedalam sampel, kocok hingga merata dan sampel akan berwarna coklat. Setelah itu dititrasi dengan menggunakan natrium tiosulfat sebagai titran. Sampel tersebut kemudian ditambahkan 1 sampai 2 tetes kanji, kemudian dititrasi kembali hingga tidak berubah lagi warnanya (warna ungu menghilang). Volume titran yang terpakai dihitung. Tahapan diatas diulangi ekmbali menggunakan ekstrak enzim yang telah diberi perlakuan kertas Whatman No. 1 menggunakan sampel yang telah dipanaskan. Hasil kadar glukosa digunakan untuk menentukan nilai aktivitas selulase dalam satuan FPU (Filter Paper Unit).
4
Simulasi Optimasi Produksi Selulase dengan Kurva Response Surface Methodology (RSM) Bradley (2007)
Kurva RSM dibentuk dengan menggunakan tiga variabel bebas, yaitu bobot T. hamatum, kadar urea, dan volume air serta variabel respon berupa aktivitas selulase. Keempat data tersebut diolah menggunakan program statistika SPSS hingga diperoleh persamaan garis. Persamaan garis yang diperoleh divisualisasikan menjadi kurva 3 dimensi dengan menggunakan program Mathcad 14. Selanjutnya penentuan titik pengujian dilakukan dengan menentukan titik optimum di masing-masing kurva.
Produksi Bioetanol (Bardant TB et al 2012)
Produksi bioetanol pada kondisi optimum. Kondisi optimum fermentasi selulase yang telah ditentukan berdasarkan RSM digunakan untuk produksi bioetanol. Kondisi optimum tersebut dilakukan pada skala 4 kg substrat. Tempat inkubasi fermentasi padat menggunakan kardus yang dilapisi alumunium foil bagian dalamnya. Enzim selulase yang diproduksi oleh T. hamatum pada media berbasis ampas kelapa disebut enzim ampas kelapa (EAK). Variasi penambahan enzim komersial berupa selulase dan β-glukosidase serta EAK dalam memproduksi bioetanol disajikan pada Tabel 1. Ada empat kelompok dengan variasi selulase dan β-glukosidase komersial dan EAK (Tabel 1). Enzim komersial
β–glukosidase dan span 85 digunakan pada keempat kelompok tersebut. Selulase komersial digunakan pada kelompok 1 dan kelompok 4, sedangkan kelompok 3 dan kelompok 4 menggunakan EAK sebagai pengganti selulase komersial. Produksi bioetanol melalui beberapa tahapan, yaitu dimulai dari proses sakarifikasi, fermentasi, destilasi, dan pengukuran kadar etanol.
Sakarifikasi. Sebanyak ± 0.06804 gram Natrium asetat trihidrat ditimbang dan dilarutkan ke dalam 50 mL aquades pada rentang nilai pH 4.5 sampai 5.0 dengan penambahan ± 2 tetes asam asetat glasial. Variasi penambahan enzim komersial pada kelompok 1 dan 2 dimasukkan ke dalam labu Erlenmeyer yang berisi larutan Na-asetat 0.5 M, sehingga volumenya 50 mL. Selanjutnya pada kelompok 3 dan 4, enzim komersial dimasukkan ke dalam EAK sehingga volume totalnya adalah 50 mL. Seluruh variasi tersebut ditambahkan 0.5 mL span 85. Kemudian ditambahan 10 gram bubur TKKS sedikit demi sedikit hingga semuanya larut dalam labu Erlenmeyer. Sampel didiamkan sambil diaduk dengan menggunakan magnetic stirer selama 48 jam. Setelah 48 jam, sampel diukur kadar gulanya dengan metode Luff Schoorl.
Fermentasi. Botol fermentasi disiapkan dan dimasukan 10 gram ragi (S. cereviciae), urea, dan NPK (1% volume ekstrak). Sampel yang sudah diaduk selama 48 jam dimasukan ke dalam botol fermentasi, kemudian difermentasi selama 48 jam dalam keadaan tertutup (anaerob) pada suhu 28oC.
Destilasi. Sampel yang sudah difermentasi dimasukkan ke dalam labu ukur 50 mL (± volume dicatat). Sampel yang telah diukur dimasukkan kedalam tabung destilasi dan labu ukur dibilas dengan 50 mL aquades. Selanjutnya tabung berisi sampel dipasang dan destilator dihidupkan. Hasil destilat ditampung menggunakan labu ukur 50 mL sampai tanda batas, kemudian destilator dimatikan.
5 botol kaca untuk selanjutnya diukur menggunakan alat Density/Spesific Gravity Meter DA-640.
Tabel 1 Variasi penambahan enzim komersial (selulase, β-glukosidase) dan EAK
Kelompok Selulase β-glukosidase Na-asetat EAK Span 85 komersial
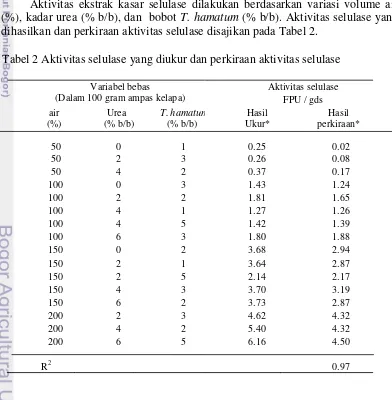
Aktivitas ekstrak kasar selulase dilakukan berdasarkan variasi volume air (%), kadar urea (% b/b), dan bobot T. hamatum (% b/b). Aktivitas selulase yang dihasilkan dan perkiraan aktivitas selulase disajikan pada Tabel 2.
Tabel 2 Aktivitas selulase yang diukur dan perkiraan aktivitas selulase
6
*Keterangan : Hasil perkiraan adalah aktivitas selulase yang diperoleh dari persamaan empiris yang telah diperoleh, sedangkan hasil ukur adalah aktivitas selulase yang diperoleh dari hasil pengukuran di laboratorium.
Volume air mulai 50% sampai 200 %. Kadar urea dan bobot Trichoderma hamatum secara berturut-turut mulai 0% sampai 6% b/b dan 1% sampai 5% b/b. Volume air 50% terdapat 3 variasi kadar urea mulai 0%, 2%, 4% dan T. hamatum mulai 1%, 2%, dan 3%. Volume air 100%, variasi urea mulai 0%, 2%, 4%, 6% dan bobot T. hamatum mulai 1%, 2%, 3% dan 5%. Variasi urea mulai 0%, 2%, 4%, 6% dan bobot Trichoderma hamatum 1%, 2%, 3%, dan 5% pada kelompok volume air 150%. Kelompok volume air 200% terdapat 3 variasi yaitu kadar urea mulai 2%, 4%, 6% dan bobot Trichoderma hamatum 2%, 3%, dan 5%.
Aktivitas selulase hasil ukur akan dibandingkan dengan perkiraan aktivitas selulase berdasarkan persamaan empiris. Hal ini dilakukan untuk memperoleh persamaan empiris yang dapat memperkiraan aktivitas selulase hasil ukur. Aktivitas selulase pada Tabel 2 terdapat nilai R2. Nilai R2 adalah besarnya keragaman (informasi) di dalam variabel yang dapat diberikan oleh model regresi yang didapatkan. Nilai R2 berkisar antara 0 sampai 1. Apabila nilai R2 dikalikan 100%, maka hal ini menunjukkan persentase keragaman (informasi) didalam variabel yang dapat diberikan oleh model regresi yang didapatkan. Semakin besar nilai R2, semakin baik model regresi yang diperoleh.
Simulasi Produksi Selulase dengan Metode RSM
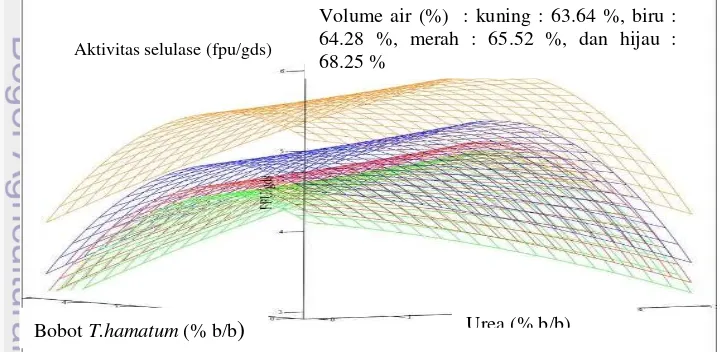
Produksi selulase menggunakan metode RSM untuk memperoleh kondisi fermentasi optimum selulase melalui variasi bobot T. hamatum, volume air, dan kadar urea. Bentuk kurva tiga dimensi disajikan dalam Gambar 1. Kurva tersebut berbentuk cekung ke bawah dengan sumbu-x, -y, dan –z secara berturut-turut adalah kadar urea, bobot T. hamatum, dan aktivitas selulase. Kurva tiga dimensi ini akan menunjukkan titik optimum yang disajikan dalam Gambar 2. Titik optimum digunakan sebagai titik validasi untuk mengetahui persamaan empiris yang digunakan sudah valid atau belum. Volume air (%) dibedakan berdasarkan perbedaan warna pada kurva tiga dimensi. Aktivitas selulase tertinggi diperoleh pada volume air 63.25 %, sedangkan aktivitas selulase paling kecil pada volume air 68.25% ( Gambar 1).
Gambar 1 Kurva tiga dimensi hasil persamaan empiris
7 Persamaan empirisnya sebagai berikut :
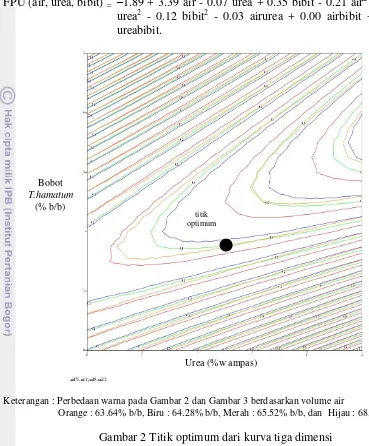
FPU (air, urea, bibit) = –1.89 + 3.39 air - 0.07 urea + 0.35 bibit - 0.21 air2 - 0.02 urea2 - 0.12 bibit2 - 0.03 airurea + 0.00 airbibit + 0.10 ureabibit.
Keterangan : Perbedaan warna pada Gambar 2 dan Gambar 3 berdasarkan volume air
Orange : 63.64% b/b, Biru : 64.28% b/b, Merah : 65.52% b/b, dan Hijau : 68.25%
Gambar 2 Titik optimum dari kurva tiga dimensi
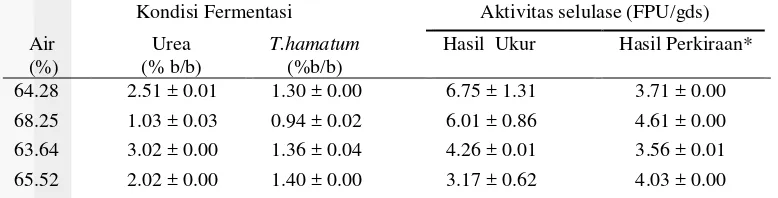
Hasil validasi persamaan empiris menggunakan RSM disajikan pada Tabel 3. Data yang disajikan dalam Tabel 3 menunjukkan dari empat data, hanya tiga data yang memenuhi persamaan empiris. Persamaan empiris dianggap valid jika aktivitas selulase hasil ukur lebih tinggi dibandingkan perkiraan aktivitas selulase (Tabel 3). Berdasarkan hasil validasi RSM, persamaan empiris tersebut dikatakan valid untuk rentang kondisi optimum pada kadar urea 1.03% b/b sampai 3.02% b/b, volume air 63.64% sampai 68.25%, dan bobot T. hamatum 0.94% b/b sampai 1.36% b/b. Aktivitas selulase maksimum yang dapat dihasilkan adalah sebesar 6.75±1.31 FPU/gds. Sedangkan pada volume air 65.52%, urea 2.02% b/b, dan bobot T. hamatum 1.40% b/b tidak valid, karena perkiraan aktivitas selulase lebih tinggi dibandingkan aktivitas selulase hasil ukur.
Urea (%w ampas) Bobot
T.hamatum (% b/b)
8
Tabel 3 Validasi persamaan empiris menggunakan RSM
Kondisi Fermentasi Aktivitas selulase (FPU/gds)
Keterangan : Hasil perkiraan berdasarkan Persamaan empirisnya sebagai berikut :
FPU (air, urea, bibit) = –1.89 + 3.39 air - 0.07 urea + 0.35 bibit - 0.21 air2 - 0.02 urea2 - 0.12 bibit2
0.02 airurea + 0.00 airbibit + 0.10 ureabibit.
Produksi Bioetanol pada kondisi optimum
Selulase yang diproduksi dalam kondisi optimum dapat digunakan untuk hidrolisis TKKS dalam menghasilkan glukosa yang dapat dikonversi menjadi bioetanol. Hasil produksi bioetanol pada Gambar 3 menunjukkan kadar etanol berdasarkan volume yang dihasilkan oleh beberapa variasi penambahan enzim (Tabel 1). Selulase dan β-glukosidase komersial (Kelompok 1) menghasilkan etanol sebesar 3.93% v/v, sedangkan β-glukosidase komersial (Kelompok 2) hanya mampu menghasilkan etanol 0.47% v/v. EAK dengan enzim β-glukosidase komersial (Kelompok 3) menghasilkan etanol sebesar 0.07% v/v dan EAK dengan selulase, β-glukosidase komersial (Kelompok 4) menghasilkan etanol sebesar 0.20% v/v.
Keterangan: Kelompok 1: selulase dan β-glukosidase komersial, Kelompok 2: β-glukosidase komersial, Kelompok 3: EAK dengan enzim β-glukosidase komersial, dan Kelompok: 4 EAK dengan selulase β-glukosidase komersial.
Gambar 3 produksi etanol pada kondisi optimum
PEMBAHASAN
Aktivitas Ekstrak Kasar Selulase
Pertumbuhan Trichoderma hamatum pada proses fermentasi ditandai dengan adanya miselium. Secara visual pertumbuhan miselium dapat dilihat dengan adanya serabut-serabut menyerupai benang halus dan memadatnya ampas kelapa. Setelah inkubasi yang dilakukan terjadi kehilangan bobot air. Hal ini
Kelompok 1 Kelompok 2 Kelompok 3 Kelompok 4
9 terjadi disebabkan oleh adanya perubahan senyawa kompleks menjadi senyawa yang lebih sederhana selama inkubasi, yaitu ketika terjadi pelepasan molekul air. Secara visual pelepasan molekul air dapat terlihat dengan adanya air pada plastik yang digunakan sebagai wadah ampas kelapa selama masa inkubasi.
Variabel yang mempengaruhi respon adalah variabel bebas (Tabel 2). Variabel bebas terdiri atas volume air, kadar urea dan bobot T. hamatum. Keterkaitan ketiga variabel tersebut menghasilkan persamaan empiris yang digunakan untuk menentukan aktifitas selulase. Selanjutnya aktivitas selulase yang telah diukur dibandingkan dengan perkiraan aktivitas selulase berdasarkan persamaan empiris (Gambar 1). Aktivitas selulase yang diperoleh lebih tinggi dibandingkan dengan perkiraan aktivitas selulase. Hal ini menunjukkan bahwa persamaan empiris tersebut dapat digunakan. Persamaan empiris memiliki nilai R2 sebesar 0.97 (Tabel 2) menunjukkan bahwa sebagian besar variasi yang dilakukan memiliki keterkaitan dengan ketiga variabel bebas.
Aktivitas ekstrak kasar selulase tertinggi diperoleh pada volume air 200%, kadar urea 6% b/b, dan bobot T. hamatum 5% b/b sebesar 6.16 FPU/gds. Aktivitas selulase terkecil diperoleh pada volume air 50%, kadar urea 0% b/b, dan bobot Trichoderma hamatum 1% b/b sebesar 0.25 FPU/gds. Kandungan protein dalam ampas kelapa digunakan untuk pertumbuhan T. hamatum, sedangkan sumber karbon digunakan untuk mencukupi kebutuhan sel biomassa dan produksi enzim (Ray et al 2007). Ketersedian sumber karbon yang semakin banyak dalam media tumbuh, akan meningkatkan selulase yang diekspresikan oleh T.hamatum. Namun, sumber karbon yang berlebihan dalam media tumbuh menyebabkan pertumbuhan sel terhambat, karena mengurangi jumlah O2 dalam media tersebut. Jumlah oksigen yang kurang dari kebutuhan minimal akan menghambat pertumbuhan sel dan sintesis produk. Hal ini akan menurunkan produksi selulase oleh Trichoderma hamatum.
Simulasi Produksi Selulase dengan Metode RSM
Response surface Methodology (RSM) merupakan kumpulan teknik matematis dan statistik yang digunakan untuk pemodelan dan analisis masalah dalam suatu respon yang dipengaruhi oleh beberapa variabel dan tujuannya untuk melakukan optimasi respon tersebut. RSM dapat digunakan untuk mengetahui secara langsung hubungan antara satu variabel dengan variabel lainnya. Metode ini telah banyak digunakan dalam mengoptimalkan sejumlah unit industri, proses dan sistem (Albert 2009). Keuntungan utama dari RSM adalah berkurangnya jumlah ekperimental yang diperlukan untuk memberikan informasi yang cukup untuk hasil yang diterima secara statistik, sehingga metode ini lebih cepat dan lebih murah untuk mengumpulkan hasil penelitian.
Kurva tiga dimensi disajikan pada Gambar 1. Kurva tersebut digunakan untuk menentukan kondisi optimum media T. hamatum berbasis ampas kelapa untuk memproduksi selulase. Kurva tiga dimensi tersebut terdiri atas sumbu-x, -y, dan -z secara berturut-turut sebagai kadar urea, bobot T. hamatum (% b/b), dan aktivitas selulase (FPU/gds). Selanjutnya dari kurva tersebut diperoleh titik optimum pertumbuhan T. hamatum dalam memproduksi selulase.
10
yang dihasilkan semakin kecil. Volume air yang berlebihan menghambat pertumbuhan T. hamatum dalam menghasilkan selulase. Volume air sangat berpengaruh terhadap metabolisme jamur pada sistem fermentasi padat, jika jumlah air tidak mencukupi dan tidak memungkinkan difusi yang baik dari zat terlarut dan gas, maka metabolisme sel melambat atau dapat berhenti. Hal ini disebabkan kurangannya substrat atau konsentrasi metabolit inhibitif di sel yang terlalu tinggi (Gervais dan Molin 2003). Hal ini terkait penggunaan air untuk metabolisme jamur pada sistem fermentasi padat untuk mencukupi difusi baik zat terlarut dan gas, sehingga metabolisme sel aktif.
Penambahan kadar urea dan T. hamatum juga berpengaruh terhadap aktivitas enzim yang dihasilkan. Urea digunakan sebagai sumber nitrogen diperlukan oleh mikroorganisme untuk pertumbuhan dan sekresi enzim. Penambahan urea memperlihatkan urea dapat meningkatkan aktivitas selulase. Menurut Noferdiman et al (2008), pemberian urea mulai 0.5% sampai 1.5% menyebabkan pertumbuhan yang baik pada jamur. Kondisi ini mengindikasikan bahwa pemberian urea diperlukan untuk pertumbuhan jamur dalam pembentukan sel baru.
Biomassa T. hamatum meningkat hingga titik tertentu, kemudian menurun setelah titik tersebut pada aktivitas enzimnya (Gambar 1). Penambahan Trichoderma hamatum secara berlebih berpengaruh terhadap aktivitas selulase. Pertumbuhan dan peningkatan biomassa diatas titik tersebut sudah tidak optimal lagi. Kemungkinan sudah terjadi akumulasi senyawa yang menyebabkan penurunan kecepatan pertumbuhannya (Landecker 2000). Kondisi ini dapat membatasi atau menghambat pertumbuhan jamur T. hamatum secara maksimal.
Titik optimum yang disajikan pada Gambar 2 untuk memperjelas kurva tiga dimensi pada Gambar 1. Volume air menunjukkan bahwa semakin besar volume air yang digunakan, akan memperkecil aktivitas selulase yang dihasilkan (Gambar 2). Penambahan urea semakin besar akan meningkatkan aktivitas selulase yang dihasilkan, sedangkan penambahan T. hamatum akan memperkecil aktivitas enzim yang dihasilkan.
Selanjutnya dilakukan validasi terhadap persamaan empiris. Validasi persamaan empiris dilakukan dengan membandingkan aktivitas selulase yang diukur dibandingkan dengan perkiraan aktivitas selulase yang disajikan dalam Tabel 3. Aktivitas selulase yang diukur mulai 3.17 sampai 6.75 FPU/gds, sedangkan perkiraan aktivitas selulase mulai 3.56 sampai 4.61 FPU/gds.
11 3.17 ± 0.62 FPU/gds, sedangkan perkiraan aktivitas selulase adalah 4.03 FPU/gds. Variasi tersebut tidak valid disebabkan memiliki aktivitas selulase yang diukur lebih kecil dibandingkan dengan perkiraaan aktivitas selulase.
Produksi Bioetanol pada Kondisi Optimum
Konversi substrat selulosa melalui hidrolisis enzimatik masih sulit diperoleh dengan cepat. Selama hidrolisis terjadi penurunan hasil dan membutuhkan waktu yang lama untuk hidrolisis dengan cepat (Bardant et al 2010). Penelitian sebelumnya oleh Bardant et al (2012), aktivitas selulase sebesar 7 FPU/gds, akan diperoleh hasil etanol sedikit diatas nol berdasarkan validasi yang telah dilakukan. Untuk melihat kinerja enzim yang dihasilkan dalam media tumbuh ampas kelapa, yaitu dengan menggunakan konsentrasi kecil kemudian dinaikkan sedikit dari sebelumnya.
Kadar gula awal kelompok 2, 3, dan 4 pada tahap sakarifikasi secara berturut-turut adalah 3.18 mg/ml, 3.25 mg/ml, dan 4.28 mg/ml (Lampiran 2). Kadar gula awal pada kelompok tersebut akan menentukan jumlah etanol yang dikonversi oleh Saccaromyces cereviciae. Kadar gula yang diperoleh setelah tahap sakarifikasi pada kelompok 2, 3, dan 4 kemudian dikonversi menjadi etanol. Jika gula awal yang diperoleh sangat kecil, maka hasil etanol yang diperoleh juga akan sedikit. Hal ini disebabkan gula yang akan dikonversi menjadi etanol hanya sedikit.
Selama proses fermentasi berlangsung, kadar gula semakin menurun, karena gula hasil hidrolisis telah difermentasi menjadi etanol oleh S. cereviciae. Kadar gula cenderung menurun disebabkan gula yang terdapat dalam media digunakan sebagai sumber karbon bagi S. cereviciae untuk mensintesis energi melalui proses fermentasi etanol. Besarnya kadar etanol yang dihasilkan berbanding terbalik dengan sisa gula reduksi. Semakin tinggi kadar etanol yang diperoleh, maka semakin sedikit gula reduksi yang tersisa. Hal ini disebabkan selama proses fermentasi gula diubah menjadi etanol dengan bantuan ragi (Kristina et al 2012).
Etanol pada proses fermentasi alkohol terbentuk melalui beberapa jalur metabolisme bergantung jenis mikroorganisme yang terlibat. S. cereviciae menggunakan jalur Embden Meyernof Parnas (EMP) untuk membentuk etanol (Rizani 2000). Mekanisme pembentukan etanol oleh khamir melalui jalur Embden Meyerhof Parnas Pathways (EMP) atau glikolisis. Hasil EMP adalah memecah glukosa menjadi 2 molekul piruvat. Setelah melalui tahap glikolisis, piruvat yang terbentuk diubah menjadi asetaldehida dan CO2 oleh enzim piruvat dekarboksilase, lalu diubah menjadi etanol oleh enzim alkohol dehidrogenase. Fermentasi dilakukan secara anaerob oleh S. cereviciae yang merupakan khamir sangat baik dalam produksi etanol. Setelah proses fermentasi berlangsung, dilanjutkan proses destilasi. Destilasi merupakan proses penguapan dan pengembunan kembali, yaitu untuk memisahkan campuran dua atau lebih zat cair ke dalam fraksi-fraksinya berdasarkan titik didihnya. Titik didih etanol murni adalah 780C, sedangkan air adalah 1000C (kondisi standar). Oleh karena itu, memanaskan larutan pada suhu rentang 78-790C akan mengakibatkan sebagian besar etanol menguap.
12
Hasil yang diperoleh kelompok 1 dibandingkan dengan kelompok 2, maka hasil kelompok 1 lebih besar etanol yang diperoleh. Kinerja β-glukosidase komersial hanya sebagai pendukung dari selulase komersial. Selulase komersial dan β -glukosidase komersial harus digunakan bersamaan untuk menghasilkan kinerja yang lebih baik dibandingkan hanya menggunakan salah satu enzim tersebut.
Selanjutnya, kelompok 1 dibandingkan dengan hasil kelompok 3 yang terdiri atas EAK dan β-glukosidase komersial. Perbedaan antara kelompok 3 dengan kelompok 1 adalah kelompok 3 menggunakan EAK, sedangkan kelompok 1 menggunakan selulase komersial. Kelompok 3 diharapkan hasil etanolnya mendekati kelompok 1 dengan mengganti selulase komersial dengan EAK. Hasil etanol dari EAK dan β-glukosidase komersial 0.07% v/v. Hasil ini sangat kecil jika dibandingkan dengan kelompok 1 yang mencapai 3.93% v/v. EAK belum bisa menggantikan fungsi dari selulase komersial. Hasil penelitian yang diperoleh oleh Epriyani (2013) menggunakan substrat berupa dedak dengan metode yang sama dengan enzim produksi dari ampas kelapa, diperoleh hasil etanol sebesar 3.51% v/v.
Kelompok 4 yang terdiri atas EAK, selulase komersial dan β-glukosidase komersial dibandingkan dengan kelompok 1. Jika EAK bersifat inert, maka hasil antara kelompok 1 dengan kelompok 4 adalah sama. Namun, hasil etanol kelompok 4 lebih kecil dibandingkan dengan kelompok 1, yaitu 0.20% v/v. Penggunaan EAK dimaksudkan untuk menggantikan enzim komersial, namun hasilnya belum bisa menggantikan enzim komersial.
Hal ini dapat disebabkan beberapa faktor, diantaranya ketebalan biakan skala 4 kg untuk menghasilkan EAK yang terlalu tebal sekitar 1.5 cm jika dibandingkan dengan biakan skala 100 g dengan ketebalan sekitar 1 cm pada saat mencari titik optimum T. hamatum. Ketebalan biakan berpengaruh terhadap aerasi di dalam biakan, sehingga pertukaran oksigen yang digunakan untuk metabolisme aerob dan membuang CO2, panas, uap air, serta komponen volatil yang dihasilkan selama metabolisme berlangsung menjadi semakin sedikit. Selain itu skala kecil kotak fermentasi yang digunakan adalah berasal dari plastik, sedangkan pada skala besar menggunakan kardus yang dilapisi alumunium foil. Penggunaan alumunium foil menyebabkan udara panas tertahan pada kotak tersebut, sehingga meningkatkan suhu fermentasi. Meningkatnya suhu tersebut mengganggu pertumbuhan T. hamatum dalam memproduksi EAK.
SIMPULAN
13
SARAN
Perlu dilakukan penelitian lanjutan terkait parameter lain yang mempengaruhi produksi ekstrak kasar selulase, yaitu kebutuhan nutrisi Trichoderma hamatum dalam produksi selulase. Selain itu, modifikasi fermentasinya pada media berbasis ampas kelapa oleh Trichoderma hamatum.
DAFTAR PUSTAKA
Albert. 2009. Studi penerapan Response Surface Methodology (RSM) dalam proses pembuatan botol untuk peningkatan produktivitas produk botol di CV. BOBOFOOD. [Skripsi]. Medan : Universitas Sumatera Utara.
Alejandro R et al. 2007. Bioresource Technology. 93(3): 554-559.
Adney B, J. Baker. 2008. Measure of Cellulase Activities Laboratory Analitical Procedure (LAP). Technical Report NREL/TP-510-42628.
Bardant TB et al. 2010. Improvement of saccarification of empty fruit bunch and Japanese cedar pulps with an amphiphilic lignin derivative. Mokuzai Gakkaishi. 56(6):420-426.
Bardant TB, Tami I, Selviyanti. 2012. Study Response Surface Methodology (RSM) on the effect of Span 85 in high substrate loading enzymatic hydrolysis of palm oil EFB. The 2nd Korea-Indonesia Workshop & International Symposium on Bioenergy from Biomass.(145-151).
Bardant et al. 2013. Optimasi produksi selulase dari Trichoderma hamatum dalam media tanam berbasis ampas kelapa. Prosiding Seminar Nasional Kimia Terapan Indonesia (SNKTI) . 4:66-72.
Barlina R. 1999. Pengembangan berbagai produk pangan dari daging buah kelapa hibrida. Indonesia. Agricultural Research and Development Journal.Diakses pada 13 April 2013 dari http:// google.com.
Bradley N. 2007. The responses surface methodology [Tesis]. South Bend : Indiana University.
[BSN] Badan Standarisasi Nasional. 1992. SNI 01-2891-1992. Cara Uji Makanan dan Minuman.
Dea IA. 2009. Kajian awal biokenversi tandan kosong kelapa sawit (TKKS) menjadi etanol melalui sakarifikasi dan fermentasi alkoholik. Bandung: ITB. Dhillon GS et al. 2011. Value addition of agricultural wates for augmented
cellulose and xylanase production through solid state tray fermentation employing mixed cultural of fungi. J.Indrcop. 34: 1160-1167.
Epriyani PL. 2013. Pemodelan Response Surface Methodology untuk penentuan kondisi optimum fermentasi padat Trichoderma hamatum dalam produksi selulase [skripsi]. Bogor (ID): Institut Pertanian Bogor.
14
Gervais P, Molin P. 2003. The role of water in solid state fermentation. Journal biochemical engineering 13:85-101.
Ikramul Haq et al. 2005. Cotton saccharifying activity of cellulases produced by co-culture of Aspergilus niger and Trichoderma viride. Res. J. Agric & Boil.Sci.1: 241-245.
Kamara et al. 2007. Degradasi enzimatik selulosa dari batang pohon pisang untuk produksi glukosa dengan bantuan aktivitas selulolitik Trichoderma viride. [online]. Tersedia : http://pustaka. unpad. ac. id/wp. content/uploads/ 2009/ 06/ lap akhir-litsar-dian-dkk.pdf [18 Mei 2014]. Kristina et al 2012. Alkaline pretreatment dan proses simultan skarifikasi-
fermentasi untuk produksi etanol deri tandan kosong kelapa sawit. J Tek Kim. 18(3):32-43.
Landecker EM. 2000. Fundamentals of the fungi. New Jersey:Prentice Hall hal 251-308.
Noferdiman et al. 2008. Penggunaan urea sebagai sumber nitrogen pada proses biodegradasi substrat lumpur sawit oleh jamur Phanerochaete chrysosporium. J ilmiah ilmu Peternakan. 6(4):75-82.
Oil World. 2006. Global analysis, all major oil seeds, oils & oil meals supply, demand & price Otlook.
Ray AK et al. 2007. Optimization of fermentation conditions for cellulose production by Bacillus subtilis CY5 & Bacillus circulans TP3 Isolated from fish Gut. Acta Ichthyol. Piscat. 37 (1): 47-53.
Richana N et al. 2011. Diversifikasi tandan kosong kelapa sawit untuk biofuel generasi 2 dan reduksi 3 MCPD. Pusat Penelitian dan Pengembangan Perkebunan. hal 106.
15
Penyiapan ekstrak kasar selulase
Lampiran 1 Strategi penelitian optimasi media Trichoderma hamatum
Pembuatan media Trichoderma hamatum
Penentuan aktivitas ekstrak kasar selulase
Simulasi Optimasi produksi selulase dengan metode Response Surface Methodology (RSM)
Lampiran 2 Kadar gula sebelum fermentasi
Sampel
Pengenceran
Sebelum Sesudah
Gula total Gula dari
100 mg Volume
Titran ml ml (mg/ml)
Volume
Titran ml ml (mg/ml)
Kelompok 2 asli 17.10 6.05 6.35 3.18
0.67 2.13 17.0 6.15 6.46 3.23 6.60 2.20
0.50 1.59 18.8 4.35 4.57 2.28 4.17 1.39
0.33 1.05 20.0 3.15 3.31 1.65 3.63 1.21
0.17 0.54 21.5 1.65 1.73 0.87 1.96 0.65
Kelompok 3 Asli 11.25 10.55 6.50 3.25
0.67 2.18 11.3 10.5 6.47 3.23 6.34 2.11
0.50 1.62 13.5 8.3 5.11 2.56 5.59 1.86
0.33 1.07 15.7 6.1 3.76 1.88 4.84 1.61
0.17 0.55 17.4 4.4 2.71 1.35 4.82 1.61
Kelompok 4 Asli 15.0 8.15 8.56 4.28
0.67 2.87 15.0 8.15 8.56 4.28 8.48 2.82
0.50 2.14 17.6 5.55 5.83 2.91 4.64 1.55
0.33 1.41 19.3 3.85 4.04 2.02 3.65 1.22
0.17 0.72 21.0 2.15 2.26 1.13 2.41 0.80
17
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta pada tanggal 7 Maret 1991 dari pasangan Suyatno dan Warsi. Penulis merupakan putra pertama dari dua bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMA Cenderawasih 1 Jakarta tahun 2009. Tahun yang sama, penulis lolos seleksi masuk dan melanjutkan studi di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI). Di IPB, penulis mengambil mayor Departemen Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.