BAB II
TINJAUAN PUSTAKA
2.1. Komposisi Sekam Padi Dan Abu Sekam Padi
Sekam memiliki kerapatan jenis (bulk densil)1125 kg/m3, dengan nilai kalori 1 kg sekam sebesar 3300 k. kalori, serta memiliki bulk density 0,100 g/ ml, nilai kalori antara 3300 -3600 kkalori/kg sekam dengan konduktivitas panas 0,271 BTU (Houston, 1972). Sekam dikategorikan sebagai biomassa yang dapat digunakan untuk berbagai kebutuhan seperti bahan baku industri, pakan ternak dan energi atau bahan bakar ataupun sebagai adsorpsi pada logam-logam berat. Sekam tersusun dari jaringan serat-serat selulosa yang mengandung banyak silika dalam bentuk serabut-serabut yang sangat keras. Pada keadaan normal, sekam berperan penting melindungi biji beras dari kerusakan yang disebabkan oleh serangan jamur, dapat mencegah reaksi ketengikan karena dapat melindungi lapisan tipis yang kaya minyak terhadap kerusakan mekanis selama pemanenan, penggilingan dan pengangkutan. ( Haryadi. 2006 ).
[image:1.595.116.510.336.739.2]Ditinjau dari komposisi kimiawinya, sekam mengandung beberapa unsur penting sebagai yang tercantum pada tabel 2.1:
Tabel 2.1. Komposisi Kimia Sekam Padi (% berat)
Komponen % Berat
Kadar air 32,40 – 11,35
Protein kasar 1,70 – 7,26
Lemak 0,38 – 2,98
Ekstrak nitrogen bebas 24,70 – 38,79
Serat 31,37 – 49,92
Abu 13,16 – 29,04
Pentosa 16,94 – 21,95
Sellulosa 34,34 – 43,80
Lignin 21,40 – 46,97
Sumber: Ismunadji, 1988 dalam Sihombing
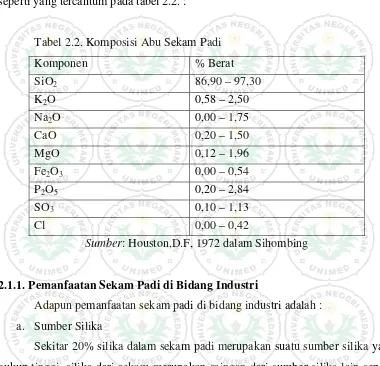
Sedangkan kandungan kimia dari abu hasil pembakaran sekam padi adalah seperti yang tercantum pada tabel 2.2. :
Tabel 2.2. Komposisi Abu Sekam Padi
Komponen % Berat
SiO2 86,90 – 97,30
K2O 0,58 – 2,50
Na2O 0,00 – 1,75
CaO 0,20 – 1,50
MgO 0,12 – 1,96
Fe2O3 0,00 – 0,54
P2O5 0,20 – 2,84
SO3 0,10 – 1,13
Cl 0,00 – 0,42
Sumber: Houston,D.F, 1972 dalam Sihombing
2.1.1. Pemanfaatan Sekam Padi di Bidang Industri
Adapun pemanfaatan sekam padi di bidang industri adalah : a. Sumber Silika
Sekitar 20% silika dalam sekam padi merupakan suatu sumber silika yang cukup tinggi, silika dari sekam merupakan saingan dari sumber silika lain seperti pasir, bentonit dan tanah diatomae tetapi biasanya silika dari sekam padi mempunyai keuntungan karena jumlah elemen lain (pengotor) yang tidak diinginkan adalah sangat sedikit dibandingkan jumlah silikanya. Silika diperoleh dari pembakaran sekam untuk menghasilkan abu atau secara ekstraksi sebagai natrium – silikat dengan larutan alkali.
b. Pemurnian Air
sekam padi berfungsi sebagai koagulan pembantu dengan menyerap atau menurunkan logam – logam pada air yang tercemar.
c. Bahan Bakar
Pembakaran merupakan satu metode yang umum dan sering digunakan dalam proses akhir pengolahan sekam padi. Sekam padi yang dibakar secara langsung untuk meneruskan aliran uapnya atau digunakan di dalam generator untuk menghasilkan tenaga penguat dengan minyak yang memiliki nilai bahan bakar.
d. Bahan Bangunan
Manfaat sekam padi adalah sebagai bahan bangunan yang berhubungan dengan pengerasan balok, batu bata, ubin, batu tulis dan sifat lunak. Yang dapat dimanfaatkan sesuai dengan fungsinya.
2.2. Silika Gel
Salah satu bahan yang telah berhasil dibuat dengan bahan dasar abu sekam padi adalah silika gel. Kegunaan silika gel didasarkan pada keberadaan situs aktif berupa gugus silanol (Si – OH) dan siloksan (Si – O – Si) di permukaan dan sifat fisiknya seperti kestabilan mekanik, dan luas permukaan. Gugus silanol (Si – OH) inilah yang memberikan sifat polar pada silika gel dan merupakan sisi aktif dari silika gel. Permukaan yang kompleks dari silika gel yakni terdiri atas lebih dari satu macam tipe gugus hidroksil – OH yang terikat pada permukaan silika gel (Narsito,2005).
Luas permukaan silika gel yang besar 300- 800 m2/g, akibat dari banyaknya pori yang dimilikinya. Sifat yang paling penting dari silika gel adalah sebagai adsorben yang dapat diregenerasi. Silika gel memiliki kemampuan menyerap yang sangat besar terhadap molekul-molekul air. Dengan bertambahnya luas permukaan silika gel, porositas silika gel juga akan bertambah.
ukuran pori rata-rata 2,2- 2,6 nanometer dan memiliki afinitas yang kuat untuk molekul air. Silika gel merupakan suatu bentuk dari silika yang dihasilkan melalui penggumpalan sol natrium silikat (NaSiO2). Sol mirip agar – agar ini dapat didehidrasi sehingga berubah menjadi padatan atau butiran mirip kaca yang bersifat tidak elastis. Sifat ini menjadikan silika gel dimanfaatkan sebagai zat penyerap, pengering dan penopang katalis. Garam – garam kobalt dapat diabsorpsi oleh gel ini (http://id.wikipedia.org/wiki/silika gel).
[image:4.595.114.506.163.584.2]Adanya gugus -OH yang mampu membentuk ikatan hidrogen dengan gugus yang sama dari molekul lain yang mengakibatkan silika dapat digunakan sebagai pengering dan fasa diam pada kolom kromatografi (Narsito, 2005).
Gambar 2.1. Penataan tetrahedral SiO4 pada Silika Gel
2.3. Logam Berat
Logam berat masih termasuk golongan logam dengan kriteria - kriteria yang sama dengan logam-logam yang lain. Perbedaan terletak pada dari pengaruh yang dihasilkan bila logam berat ini masuk atau diberikan ke dalam tubuh mahklup hidup. Istilah logam berat sebetulnya sudah dipergunakan secara luas, terutama dalam perpustakaan ilmiah, sebagai unsur yang menggambarkan bentuk dari logam tertentu.
2. Mempunyai nomor atom 22 - 23 dan 40 - 50 serta unsur laktanida dan aktinida.
3. Mempunyai respon biokimia yang khas (spesifik) pada organisme hidup. Semua logam berat dapat dikatakan sebagai bahan beracun yang akan meracuni makhluk hidup. Sebagai contoh logam berat air raksa (Hg), kadmium (Cd), timbal (Pb), dan krom (Cr). Namun demikian, meskipun semua logam berat dapat mengakibatkan keracunan atas makhluk hidup, sebagian dari logam - logam berat tersebut dibutuhkan oleh makhluk hidup. Kebutuhan tersebut dalam jumlah yang sedikit. Tetapi apabila kebutuhan tersebut tidak terpenuhi dapat berakibat fatal terhadap kelangsungan makhluk hidup. Karena tingkat kebutuhan yang sangat diperlukan sehingga logam - logam tersebut juga dinamakan sebagai logam - logam esensial tubuh. Bila logam - logam esensial yang masuk ke dalam tubuh dalam jumlah yang berlebihan, maka berubah fungsi menjadi racun. Contoh dari logam berat esensial ini adalah kadmium (Cd), seng (Zn), dan nikel (Ni), magnesium (Mg) (Sudarwin, 2008).
2.3.1. Kadmium ( Cd )
Kadmium (Cd) adalah logam putih keperakan, yang dapat ditempa, lunak dan tahan korosi. Kadmium melebur pada 321 0C dan melarut dengan lambat dalam asam encer dengan melepaskan hidrogen (disebabkan oleh adanya potensial elektodanya yang negatif) (Vogel,1984). Kadmium merupakan logam transisi. Oleh karena sifat-sifatnya kadmium banyak dipakai sebagai stabilizer dalam pembuatan polyvinilclorida. Dimasa silam kadmium malah digunakan dalam pengobatan syphilis dan malaria. Kadmium didapat pada limbah berbagai jenis pertambangan logam yang tercampur kadmium seperti timah hitam, dan seng. Dengan demikian, kadmium dapat ditemukan di dalam perairan baik di dalam sedimen maupun di dalam penyediaan air minum (Cooke, 1977).
Massa atom logam kadmium 112,411 g/mol, deret kimia logam Cd merupakan logam transisi, rapatan pada suhu kamar 8,65 g/cm3,massa jenis cair padat titik lebur 7,996 g/cm3, titik didih 767 0
penguapan 99,87 kj/mol, elektronegativitas 1.69 (Pauling scale),jari-jari atom 151 pm, struktur kristal hexagonal (http://id. wikipedia.org/wiki/kadmium.html).
Berdasarkan teori kadar Cd dalam air berkisar antara <0,001 ppm. Kadar ini masih sesuai dengan kadar Cd normal dalam air laut yakni 0,11 pprn (WALDICHUK 1974), dan NAB yang ditetapkan oleh KMNKLH (1988) untuk kepentingan biota laut yaitu <0,01 ppm. Demikian juga bila dibandingkan dengan Baku Mutu Air Laut untuk biota laut yang ditetapkan oleh KMNKLH Nomer 51, Tahun 2004 yakni 0,001 pprn.
2.3.1.1. Efek toksik
Bagi manusia, kadmium sebenarnya merupakan logam asing. Tubuh sama sekali tidak memerlukannya dalam proses metabolisme. Karena Cd sangat beracun bagi manusia dan dapat diabsorpsi tubuh dalam jumlah yang tidak terbatas, karena tidak adanya mekanisme tubuh yang dapat membatasinya. Apabila Cd masuk ke dalam tubuh maka sebagian besar akan terkumpul di dalam ginjal, hati, dan sebagian yang dikeluarkan lewat saluran pencernaan. Kadmium dapat mempengaruhi otot polos pembuluh darah secara langsung maupun tidak langsung lewat ginjal. Sebagai akibatnya terjadi kenaikan tekanan darah.
2.3.2. Zink ( Zn )
Zink merupakan unsur kimia berupa logam putih kebiruan dan mengkilap dan bersifat diamagnetik dengan lambang kimia Zn, nomor atom 30. Logam ini cukup mudah ditempa dan liat pada 110 - 1500C. Zink melebur pada 4100C dan mendidih pada 9060C (Vogel,1984). Zink memiliki massa atom relatif 65,39. meleleh pada suhu 419,58 0C dan mendidih pada suhu 907 0C, jari- jari logam 135 pm, struktur kristal hexagonal, Pada suhu kamar zink keras dan getas, namun melunak bila dipanaskan di atas 100 0C (Eksiklopedi nasional Indonesia, 1991).
Massa atom logam zink 65,409(4) g/mol, deret kimia merupakan logam transisi, rapatan pada suhu kamar 7,14 g/cm3,massa jenis cair padat titik lebur 6,57 g/cm3
Sifat kimiawi seng mirip dengan logam-logam transisi periode pertama seperti nikel dan tembaga dan hampir tak berwarna. Jari-jari ion seng dan magnesium juga hampir identik Oleh karenanya, garam kedua senyawa ini akan memiliki struktur kristal yang sama. Pada kasus dimana jari-jari ion merupakan faktor penentu, sifat-sifat kimiawi keduanya akan sangat mirip. Seng cenderung membentuk ikatan kovalen berderajat tinggi.
Kadar normal Zn dalam air laut adalah 2,O ppb atau 0,002 ppm (WALDICHUK 1974). Kadar Zn ini berbahaya bagi kehidupan organisme perairan. Kadar ini masih sesuai dengan NAB yang ditetapkan oleh Baku Mutu Air Laut (KMNKLH. 1988) untuk kepentingan kehidupan biota laut yakni <0,1 ppm. Demikian juga bila dibandingkan dengan Baku Mutu Air Laut yang ditetapkan oleh Keputusan Menteri Negara Lingkungan Hidup Nomor: 5 1 Tahun 2004 untuk kehidupan biota laut yakni: 0,05 ppm.
2.3.2.1 Manfaat Zink (Zink)
Seng ditemukan dalam suatu pertambangan logam, sebagai bentuk sulfida. Seng dan beberapa bentuk senyawanya digunakan dalam produksi logam campuran misalnya, perunggu, loyang dan kuningan. Senyawa seng ini juga sering digunakan dalam pelapisan logam seperti baja, besi yang merupakan produk anti karat. Juga digunakan zat warna untuk cat, lampu, gelas, bahan keramik, pestisida dan sebagainya
Zn terlibat dalam proses penyembuhan luka, dalam hal ini Zn terlibat dalam proses pembentukan protein baru untuk menyembuhkan luka. Penyakit defisiensi Zn pada orang dapat menyebabkan meningkatnya pertumbuhan dalam tubuh manusia, kedewasaan masa kelamin terhambat, timbul penyakit kulit dan sebagainya (Darmono, 1995).
2.4. Adsorpsi
2.4.1. Defenisi Adsorpsi
Adsorpsi adalah peristiwa penyerapan suatu zat, ion atau molekul yang melekat pada permukaan, dimana molekul dari suatu materi terkumpul pada bahan pengadsorpsi atau adsorben. Sifat adsorpsi partikel koloid banyak dimanfaatkan dalam proses penjernihan air atau pemurnian suatu bahan yang masih mengandung pengotor, partikel koloid mempunyai permukaan luas sehingga mempunyai daya serap adsorpsi yang besar. Terjadinya adsorpsi pada permukaan larutan disebabkan karena adanya kekuatan atau gaya tarik – menarik antara atom atau molekul pada permukaan larutan. Peristiwa penyerapan suatu zat pada permukaan zat lain disebut adsorpsi, zat yang diserap disebut fase terserap sedangkan zat yang menyerap disebut adsorben. Peristiwa adsorpsi disebabkan oleh gaya tarik molekul dipermukaan adsorben (Estein, 2005).
2.4.2. Jenis Adsorpsi
Berdasarkan daya tarik molekul adsorben dengan adsorbat, adsorpsi dibedakan menjadi dua, yaitu:
a. Adsorpsi fisika
Adsorpsi yang disebabkan oleh gaya Van Der Wall yang ada pada permukaan adsorben, panas adsorpsinya rendah dan lapisan yang terjadi pada permukaan adsorben biasanya lebih kecil dari satu molekul.
b. Adsorpsi kimia
molekul di permukaan adsorben. Adsorpsi menurunkan ketidakseimbangan daya tarik yang terjadi di permukaan (Alberty, 1992).
Beberapa gaya yang dapat menyebabkan terjadinya adsorpsi diantaranya adalah : (1) interaksi non polar Van der Wall, (2) pembentukan ikatan hidrogen, (3) pertukaran ion dan (4) pembentukan ikatan kovalen. Adsorpsi fisika sering sekali menunjukkan adsorpsi dari adanya gaya Van der Wall, terjadi karena adanya gaya adhesi antara zat terlarut dengan adsorben. Gaya-gaya paling kuat yang ada dalam adsorpsi molekul-molekul kecil dari larutan cair yaitu pertukaran ion dan ikatan hidrogen. Adsorpsi zat terlarut oleh adsorben padat cenderung membentuk ikatan hidrogen jika salah satu mempunyai kelompok ikatan hidrogen sebagai donor dan yang lainnya sebagai akseptor (Yun dkk., 2001 dan Alberty dkk, 1992).
2.4.3. Faktor – Faktor yang Mempengaruhi Adsorpsi
Secara umum, faktor-faktor yang mempengaruhi dari proses adsorpsi adalah sebagai berikut:
a. Luas permukaan
Semakin luas permukaan adsorben, maka makin banyak zat yang teradsorpsi. Luas permukaan adsorben ditentukan oleh ukuran partikel dan jumlah dari adsorben.
b. Jenis adsorbat
Peningkatan polarisabilitas adsorbat akan meningkatkan kemampuan adsorpsi molekul yang mempunyai polarisabilitas yang tinggi (polar) memiliki kemampuan tarik-menarik terhadap molekul lain dibandingkan molekul yang tidak dapat membentuk dipol (nonpolar). Peningkatan berat molekul adsorbat dapat meningkatkan kemampuan adsorpsi. Adsorbat dengan rantai yang bercabang biasanya lebih mudah diadsorp dibandingkan rantai yang lurus.
c. Struktur molekul adsorbat
Hidroksil dan amino mengakibatkan mengurangi kemampuan penyisihan sedangkan nitrogen meningkatkan kemampuan penyisihan.
Semakin besar konsentrasi adsorbat dalam larutan maka semakin banyak jumlah substansi yang terkumpul pada permukaan adsorben.
e. Temperatur
Pemanasan atau pengaktifan adsorben akan meningkatkan daya serap adsorben terhadap adsorbat menyebabkan pori-pori adsorben lebih terbuka. Pemanasan yang terlalu tinggi menyebabkan rusaknya adsorben sehingga kemampuan penyerapannya menurun.
1. pH, pH larutan mempengaruhi kelarutan ion logam, aktivitas gugus fungsi pada biosorben dan kompetisi ion logam dalam proses adsorpsi.
2. Kecepatan pengadukan, menentukan kecepatan waktu kontak adsorben dan adsorbat. Bila pengadukan terlalu lambat maka proses adsorpsi berlangsung lambat pula, tetapi bila pengadukan terlalu cepat kemungkinan struktur adsorben sepat rusak, sehingga proses adsorpsi kurang optimal.
3. Waktu kontak, penentuan waktu kontak yang menghasilkan kapasitas adsorpsi maksimum terjadi pada waktu kesetimbangan. Waktu kesetimbangan dipengaruhi oleh tipe biomassa (aktif atau tidak aktif), ion yang terlibat dalam system biosorpsi, konsentrasi ion logam.
(http://www.newworldencyclopedia.org.entry/Adsorption.htm)
Hubungan antara jumlah adsorbat yang terserap dengan konsentrasi adsorbat dalam larutan pada keadaan kesetimbangan dan suhu tetap dapat dinyatakan dengan isoterm adsorpsi.
2.5. Model Isoterm Langmuir
Persamaan Langmuir dapat ditulis sebagai berikut:
b.c a.b.c
m x
+ =
1 dimana:
a.b = tetapan empiris yang tergantung pada sifat dari jenis adsorben serta suhu.
c = jumlah zat terlarut yang teradsorpsi per satuan massa adsorben x/m = jumlah zat terlarut yang teradsorpsi persatuan massa adsorben
a c
a.b m x
c
+ = 1
Dan apabila dialurkan c (x/m) terhadap c akan dihasilkan kurva berupa garis lurus dengan kemiringan 1/a dan titik perpotongan dengan ordinat 1/ab.
2.6. Kromatografi Kolom
Kromatorgafi kolom didasarkan pada distribusi solut diantara dua cairan dalam suatu kolom. Fase diam tipis cairan yang melapisi permukaan dari peralatan inert yang berpori-pori dan memberikan pemisahan yang lebih tajam dan tidak bergantung pada kadar.
Gambar 2.2. Alat Kromatografi Kolom
Peralatan utama kromatografi sederhana terdiri dari kolom dan labu Erlenmeyer penampung eluen. Kolom umumnya terbuat dari pipa kaca dengan ukuran bervariasi tergantung pada keperluan. Kolom dilengkapi dengan kran untuk mengatur aliran pelarut. Di atas kran dipasang wol kaca (glass wool) untuk menahan fasa diam.
Fasa diam berupa adsorben yang tidak boleh larut dalam fasa gerak, ukuran partikel fasa diam harus seragam. Sebagai fasa diam dapat digunakan alumina, silika gel, arang, bauksit, magnesium karbonat, talk, pati, selulosa. Pengisian fasa diam ke dalam kolom dapat dilakukan dengan cara kering dan basah. Dalam cara basah, fasa diam diubah dulu menjadi bubur lumpur (slurry), dengan pelarut yang akan digunakan sebagai fasa gerak, kemudian baru diisikan ke dalam kolom. Fase gerak pada kromatografi kolom dapat berupa pelarut tunggal atau campuran beberapa pelarut dengan komposisi tertentu (Soebagio, 2003).
tertentu, pada sistem kolom, larutan selalu dikontakkan dengan adsorben sehingga adsorben dapat mengadsorpsi dengan optimal sampai kondisi jenuh yaitu pada saat konsentrasi effluen (larutan yang keluar) mendekati konsentrasi influen (larutan awal). Oleh karena itu, sistem kolom ini lebih menguntungkan karena pada umumnya memiliki kapasitas lebih besar dibandingkan dengan sistem batch, sehingga lebih sesuai untuk aplikasi dalam skala besar. Pada sistem kolom dapat dilakukan dengan dua cara aliran yaitu aliran dari atas kebawah (down flow) atau aliran dari bawah ke atas (up flow) (Setiaka, 2010).
2.7. Ekstraksi Fase Padat
Ekstraksi fasa padat atau Solid Phase Extraction (SPE) merupakan metode ekstraksi yang berkembang saat ini dengan menggunakan kolom yang berbasis kromatografi. Jika dibandingkan dengan ekstraksi cair-cair, ekstraksi fase padat yang biasa disebut Solid Phase Extraction (SPE) merupakan teknik yang relatif baru akan tetapi SPE cepat berkembang sebagai alat yang utama untuk pra-perlakuan sampel atau untuk clean-up sampel yang kotor, misal sampel-sampel yang mempunyai kandungan matriks yang tinggi seperti garam-garam, protein, polimer, resin, dll.
Keunggulan Ekstraksi Fase Padat atau Solid Phase Extraction (SPE) dibandingkan dengan ekstraksi cair-cair adalah:
1. Proses ekstraksi lebih sempurna.
2. Pemisahan analit dari penganggu yang mungkin ada menjadi lebih efisien. 3. Mengurangi pelarut organik yang digunakan.
4. Fraksi analit yang diperoleh lebih mudah dikumpulkan. 5. Mampu menghilangkan partikulat.
6. Lebih mudah diotomatisasi.
adalah banyaknya jenis cartridge (berisi penyerap tertentu) yang beredar di pasaran sehingga reproduksibilitas hasil bervariasi jika menggunakan cartridge yang berbeda dan juga adanya adsorpsi yang bolak-balik pada cartridge SPE.
Ada dua strategi untuk melakukan penyiapan sampel menggunakan SPE ini. Strategi pertama adalah dengan memilih pelarut yang mampu menahan secara total analit yang dituju pada penyerap yang digunakan, sementara senyawa-senyawa yang mengganggu akan terelusi. Analit yang dituju yang tertahan pada penyerap ini selanjutnya dielusi dengan sejumlah kecil pelarut organik yang akan mengambil analit yang tertahan ini dan bermanfaat jika analit yang dituju berkadar rendah. Strategi kedua adalah dengan mengusahakan supaya analit yang tertuju keluar (terelusi), sementara senyawa pengganggu tertahan pada penyerap yang dipakai (http://lansida.blogspot.com/2010/08/ekstraksi-fase-padat.html).
2.8. Spektroskopi Serapan Atom (SSA)
Spektrokopi Serapan Atom (SSA) merupakan bentuk spektoskopi serapan yang umum digunakan untuk menganalisis konsentrasi berbagai macam unsur logam dalam matiks kompleks. Spektroskopi ini didasarkan pada jumlah radiasi elektromagnetik dilewatkan melalui sistem yang mengandung atom-atom bebas tersebut. Analisis kuantitatif logam dengan metode SSA didasarkan pada fakta yang mana bahwa atom – atom suatu unsur pada keadaan dasar (ground state) dapat menyerap energi radiasi dengan panjang gelombang tertentu tergantung pada sifat unsurnya, dimana jumlah energi yang diserap sebanding dengan jumlah atom yang menyerap energi tersebut (Haswel, 1991). Konsentrasi analit dikolerasikan terhadap jumlah energi radiasi yang diserap melalui penggunaan kurva kalibrasi yang dibuat dari suatu seri larutan standart. Batas deteksi metode SSA sangat bervariasi dan dapat mencapai puluhan ppb, tergantung sifat analit dan matriks serta kesensitifan instrument SSA yang digunakan (Mulia, 1995).
Prinsip penentuan metode ini didasarkan pada penyerapan energi radiasi oleh atom-atom netral pada keadaan dasar, dengan panjang gelombang tertentu yang menyebabkan tereksitasinya dalam berbagai tingkat energi.
Keuntungan penggunaan SSA adalah analisanya peka, teliti, cepat dan pengerjaannya relatif sederhana, dengan tidak diperlakukannya proses-proses pemisahan dan logam yang dianalisa terhadap logam lain yang ada dalam larutan.
Pemilihan panjang gelombang maksimum (λ maksimum) yang tepat, pengaturan
nyala yang optimum, serta penggunaannya sumber radiasi dari unsur tertentu akan diperoleh hasil dengan selektivitas yang tinggi. Dengan membandingkan absorban larutan sampel dengan absorban larutan standart pada kurva kalibrasi dari larutan standart yang berada garis lurus (Suharta, 2005). Persamaan dari regresi linier yaitu :
y = bx + a dimana :
y = absorban x = konsentrasi
Dasar suatu pengukuran SSA dalam menentukan konsentrasi suatu larutan sampel adalah dengan mengukur intensitas radiasi yang diteruskan (transmitan) atau mengukur intensitas radiasi yang diserap (absorban) pada panjang gelombang tertentu.
Hubungan antara absorban dan konsentrasi dikemukakan oleh Lambert Beer dengan rumus sebagai berikut:
A = log I0/It = log I/T = a.b.c dimana:
A = absorban
I0 = intensitas cahaya yang masuk It = intensitas cahaya yang keluar a = absortivitas