Lampiran 1 . Perhitungan Larutan Standar Cd2+ 1. Larutan Induk Cd2+ 1000 ppm
Gram Cd2+ = Ar Cd
Mr CdCl2x gram CdCl2
= 112
201,4x 0,897 gram = 0,5006 gram
Larutan Induk 1000 ppm
ppm= gram Cd 2+
1000 mL x 1000 ppm
= 0,5006
500 mL x 1000 ppm
= 1001 ppm ≈ 1000 ppm
2. Larutan Seri Standar Cd2+ 100 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 100 ppm
V1 = 25 mL
3. Larutan Seri Standar Cd2+ 200 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 200 ppm
V1 = 50 mL
4. Larutan Seri Standar Cd2+ 300 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 300 ppm
5. Larutan Seri Standar Cd2+ 400 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 400 ppm
V1 = 100 mL
6. Larutan Seri Standar Cd2+ 500 ppm V1 x N1= V2 x N2
V1 x 1000 ppm = 250 mL x 500 ppm
V1 = 125 mL
Lampiran 2 . Perhitungan Daya Serap (%) Zat Hasil Reaksi
% Daya Serap =Kadar Awal − Kadar Akhir
Kadar Awal x 100 %
1. % Daya Serap Selulosa Hasil Isolasi a. Selulosa-Larutan Standar 100 ppm
% Daya Serap = 100 – 89,6752
100 x 100 %
= 0,103248 x 100 %
= 10,3248 %
b. Selulosa -Larutan Standar 200 ppm % Daya Serap = 200 – 170,5713
200 x 100 %
= 0,147143 x 100 %
= 14,7143 %
c. Selulosa -Larutan Standar 300 ppm % Daya Serap = 300– 273,7210
300 x 100 %
= 8,7596 %
d. Selulosa -Larutan Standar 400 ppm % Daya Serap = 400 – 350,6309
400 x 100 %
= 0,123422 x 100 %
= 12,3422%
e. Selulosa -Larutan Standar 500 ppm % Daya Serap = 500 – 474,5672
500 x 100 %
= 0,063582 x 100 %
= 6,3582%
2. % Daya Serap Selulosa Sitrat
a. Selulosa sitrat-Larutan Standar 100 ppm % Daya Serap = 100 – 25,2128
100 x 100 %
= 0,747872 x 100 %
= 74,7872 %
b. Selulosa sitrat -Larutan Standar 200 ppm % Daya Serap = 200 – 98,7235
200 x 100 %
= 0,506382 x 100 %
= 50,6382%
c. Selulosa sitrat -Larutan Standar 300 ppm % Daya Serap = 300 – 232,7350
300 x 100 %
= 0,224216 x 100 %
d. Selulosa sitrat -Larutan Standar 400 ppm % Daya Serap = 400 – 337,7189
400 x 100 %
= 0,155702 x 100 %
= 15,5702 %
e. Selulosa sitrat -Larutan Standar 500 ppm % Daya Serap = 500 – 435,5375
500 x 100 %
= 0,128925 x 100 %
= 12,8925 %
Lampiran 3. Hasil SEM Senyawa Pembanding (Thanh, N. 2009)
DAFTAR PUSTAKA
Almeida, J. A., Barreto, R. E., Novelli, L. B., Castro, F. J. and Moron, S. E., 2009. Oxidative Stress Biomarkers and Aggressive Behavior in Fish Exposed to Aquatic Cadmium Contamination. Neotropical Ichtyology, Vol 7, pp. 103-108, 2009.
Apelblat, A., 2014. Citric Acid.London : Springer.
Anonim, 1952.The Merck Index. New Jersey. USA : Merk and Co., Inc.
Atalla, R.H., 1987.The Structures of Cellulose, Characterization of The Solid States, ACS Symposium series , NO. 340, Washington.
Bai, R., and Li, N., 2005. Novel Chitosan-Cellulose Hydrogel Adsorbents for Lead Adsorption.Environtment Science Technology.
Barrow, G.M., 1979.Physical Chemistry,Fourth Edition, Mc Graw Hill International Book Company, Tokyo.
Bethel, J.S., 1962. Forest Products Their Sources, Production, and Utilization.Second Edition. New York. Mc Graw-Hill Book Company Inc. Coffey, D.G., Bell, D.A., and Handerson, A., 1995.Cellulose and Cellulose Derivate,
NewYork: John Wiley & Son.
Davidek, J. J., Valisel and Pokorny., 1990. Chemical Changes During Food Processing Development In Food Science 21. Elsevier.
Fan, L. T., Gharpuray, M.M., and Lee, Y. H., 1987.Cellulose Hydrolysis. Berlin: Springer-Verlag Berlin Heidelberg.
Fengel, D., and Wegener, G., 1995.Kayu : Kimia, Ultrastruktur, Reaksi-reaksi, Gajah Mada University press, Yogyakarta.
Fessenden, R. J., dan Fessenden, J. S., 1992. Kimia Organik. Edisi Ketiga. Jilid II. Jakarta: Erlangga.
Ganstrom, M. 2009. Cellulose Derivatives: Synthesis, Properties and Applications. Helsinki: Helsinki University Printing House.
Ghandi, N. N.,1997.Application of Lipase.J.Am.Oil Chem.Soc.74,6.
Grimaux, A., 1880. Synthese de l’acide citrique. C R Acad Sci 90:1252 - 1255 .
Hardjono, S., 1995.Kimia Kayu:Dasar-Dasar dan Penggunaannya. Edisi kedua, Yogyakarta: Gajah Mada University Press.
Hart, H., Craine, L.E., and Hart, D.J., 2003.Kimia Organik.Edisi Kesebelas, Jakarta : Erlangga.
Hidayat, P., 2008. Teknologi Pemanfaatan Serat Daun Nanas sebagai Alternatif Bahan Baku Tekstil, Teknoin,Vol 13,31-35.
Ibbet,R.N., Kaenthong,S.,Philips,D.A.S., Wilding, M.A., 2006. Characterisatim of Porosity of Regenerated Cellulosil Fibres Using Classical Dye Adsorbtion Techniques, Lenzinger Berichte,Vol 88, 77-86.
Klemm, D., Philipp, B., and Heinze, T., 1998.Comprehensive Cellulose Chemistry Volume 2. Weinheim: WILEY-VCH Verlag.
Lehninger, A.L., 1988.Dasar-DasarBiokimia.Jilid 1.Jakarta: Erlangga.
Low, K. S., C. K. Lee and S. M. Mak., 2004.Sorption of copper and lead by citric acid modified wood. Wood Sci Technol, 38: 629-640.
Maron, S.H., Prutton, C.F., 1964.Principles of Physical Chemistry, The Macmillan Company, New York.
Marshall, W.,Wartelle,L.,Chatters,A., 1999. Enhanced Metal Adsorption by Soybean Hulls Modified with Citric Acid. New Orleans : Elsevier.
Norman, A. G., 1937.The Composition of Same Less Common Vegetable Proses. Biochemistry Section, 1575-1578.
Ohwoavworhua, F. O.,Adelan, T.A., 2005. Some Physical Characteristics of Microcrystalline Cellulose Obtained from Raw Cotton of Cochlospermum planchonii. Tropical Journal of Pharmaceutical Research. Nigeria.
Ozgulsun, A., Karaosmanoglu, F., dan Tuter, M., 2000. Esterification Reaction of Oleic Acid With a Fuel Oil Fraction for Production of Lubricating Oil. J.Am.Oil.Chem.Soc.77,11.
Pearson ,R,G., 1963. Hard and Soft Acids and Bases, J.Am.Soc. 85: 3533-3539
Rakhmat, F.A dan Fitri, H., 2007.Budidaya dan Pasca Panen Nanas.Balai Pengkajian Teknologi Pertanian Kalimantan Timur Departemen Pertanian.
Setiyawan, Y., 2010.Peranan Polimer Selulosa Sebagai Bahan Baku dalam Pengembangan Produk Manufaktur Menuju Era Globalisasi. Bandung: Universitas Islam Indonesia.
Siregar, M., 1988.Dasar-dasar Kimia Organik.Jakarta : P2LPTK.
Smook, G.A., 1982. Hand Book For Pulp and Pare Technologist.Boston: Miller Freeeman,Inc.
Solomons, G., 2014. Organic Chemistry.Eleventh Edition. United States of America : John Wiley & Sons.
Thanh, N dan Nhung,H ., 2009. Cellulose Modified With Citric Acid and Its Absorption of Pb2+and Cd2+Ions. Hanoi: ECSOC.
Widowati, W., Astiana, S., Raymond, J.R., 2008.Efek Toksik Logam. Andi Offset, Yogyakarta.
Wilbraham, A dan Matta, M., 1992.Pengantar Kimia Organik dan Hayati.Bandung : penerbit ITB.
Winarno, F. G., 1997.Kimia Pangan dan Gizi.Cetakan Kedelapan. Jakarta: Penerbit PT. Gramedia Pustaka Utama.
Wurzburg, O.B., 1986. Modified Starches : Properties and Uses. Florida : CRC Press.
Yan, Y., Born Scheuer, U.T., Stadler, G., Lutz-Wahl, S., Reuss, M. and Schmid, R.D., 2001. Production of Sugar Fatty Acid Ester by Enzimatic Esterification in a Stireed-Thank Membrane Reactor. Optimization of Parameters by Response Surface Methodology. J.Am.Oil.Chem.Soc.78,2.
Zugenmaier,P., 2008. Crystalline Cellulose and Derivates, Springer-Verlag, Jerman.
BAB 3
METODE PENELITIAN
3.1. Alat Penelitian
- Spektrofotometer FT-IR Agilent Technologies - Spektrofotometer Serapan Atom GF Perkin Elmer - Scanning Electron Microscope JSM-35 C Shumandju
- Labu takar 250 mL Pyrex
- Beaker glass 250 mL Pyrex
- Gelas ukur 100 mL Pyrex
- Indikator pH universal Sartorius
- Hotplate stirrer Fishons
- Neraca analitis Metler PM 480
- Termometer 110oC Fisher
3.2. Bahan Penelitian - Aquadest - Asam Sitrat
- CH3COOH glasial p.a E’Merck
- CdCl2 p.a E’Merck
- Daun Nenas
- HCl p.a E’Merck
- NaNO2 p.a E’Merck
- NaOCl 12%
- HNO3 p.a E’Merck
- H2O2 30% p.a E’Merck
- Indikator Phenolftalein
- Kertas saring Whatman No. 42
3.3. Prosedur Penelitian
3.3.1. Pembuatan Pereaksi
3.3.1.1. PembuatanLarutanNaOH 17,5%
DitimbangNaOH pellet sebanyak 175 gram dandilarutkandenganaquadestdalam labutakarvolume 1000 mL.
3.3.1.2. PembuatanLarutan H2O2 10%
Sebanyak 333 ml H2O2 30% dimasukkan ke dalam labu takar volume 1000 ml,
ditambahkan aquadest hingga garis tanda, dihomogenkan.
3.3.1.3. Pembuatan Larutan NaOCl 1,7%
Sebanyak 136 ml NaOCl 12% dimasukkan ke dalam labu takar volume 1000 ml, ditambahkan aquadest hingga garis tanda, dihomogenkan.
3.3.1.4. Pembuatan Larutan Buffer Asetat
Sebanyak 27 gram NaOH pellet dilarutkan dengan 500 ml aquadest dalam gelas Beaker, diaduk hingga larut, lalu dimasukkan ke dalam labu takar volume 1000 ml yang telah berisi 75 ml asam asetat glasial, ditambahkan dengan aquadest hingga garis tanda, dihomogenkan.
3.3.1.5. Pembuatan NaOH 2%
3.3.1.6. Pembuatan HNO3 3,5%
Sebanyak 54,6 ml HNO3 65% diencerkan dengan aquadest dalam labu takar volume
1000 ml hingga garis batas, lalu dihomogenkan.
3.3.1.7. Larutan Seri Standar Cd2+
3.3.1.7.1. Larutan Induk Cd2+ 1000 ppm
Sebanyak 0,897 gram CdCl2 dimasukkan ke dalam labu takar volume 500 mL,
ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.3.1.7.2. Larutan Seri Standar Cd2+ 100 ppm
Sebanyak 25 mL larutan induk CdCl2 1000 ppm dimasukkan ke dalam labu takar
volume 250 mL, ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.3.1.7.2. Larutan Seri Standar Cd2+ 200 ppm
Sebanyak 50 mL larutan induk CdCl2 1000 ppm dimasukkan ke dalam labu takar
volume 250 mL, ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.3.1.7.3. Larutan Seri Standar Cd2+ 300 ppm
Sebanyak 75 mL larutan induk CdCl2 1000 ppm dimasukkan ke dalam labu takar
3.3.1.7.4. Larutan Seri Standar Cd2+ 400 ppm
Sebanyak 100 mL larutan induk CdCl2 1000 ppm dimasukkan ke dalam labu takar
volume 250 mL, ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.3.1.7.5. Larutan Seri Standar Cd2+ 500 ppm
Sebanyak 125 mL larutan induk CdCl2 1000 ppm dimasukkan ke dalam labu takar
volume 250 mL, ditambahkan aquadest hingga garis batas dan dihomogenkan.
3.3.2. Preparasi Sampel
Daun nenas dibersihkan dan dicuci dengan air bersih.Kemudian dipotong-potong sedemikian rupa lalu dikeringkan di dalam oven pada suhu sekitar 50oC - 60oC, kemudian diblender hingga menjadi serbuk lalu ditimbang.
3.3.3. Isolasi α-Selulosa dari Serbuk Daun Nenas
Sebanyak 75 g serbuk daun nenas dimasukkan ke dalam gelas Beaker 5 L, kemudian ditambahkan 1 L campuran yang berisi HNO3 3,5% dan 10 mg NaNO2, dipanaskan di
atas hotplate pada suhu 900C selama 2 jam. Setelah itu disaring dan endapan dicuci hingga filtrat netral.Selanjutnya didigesti dengan 1 L larutan NaOH 2% pada suhu 800C selama 4 jam.Kemudian disaring dan endapan dicuci sampai netral. Selanjutnya dilakukan pemutihan dengan 1 L larutan yang terbuat dari larutan buffer asetat dan NaOCl 1,7% dengan perbandingan 1:1 (v/v) pada suhu 800C selama 6 jam. Kemudian disaring dan endapan dicuci sampai pH filtrat netral. Setelah itu dilakukan pemurnian
α-selulosa dari sampel dengan 500 ml larutan NaOH 17,5 % pada suhu 800C selama 30 menit. Kemudian disaring, dicuci endapan hingga filtrat netral. Dilanjutkan pemutihan dengan 500 ml H2O2 10% pada suhu 600C selama 15 menit dan
dalam desikator (Ohwoavworhua, 2005). Selanjutnya α-selulosa yang diperoleh dikarakterisasi dengan analisis FT-IR dan analisis SEM.
3.3.4. Sintesis Selulosa Sitrat
Pembuatan selulosa sitrat berdasarkan metode yang telah dimodifikasi dari Thanh (Thanh et al,.2009). Asam sitrat sebanyak 1,5 g dilarutkan dengan 8 ml aquadest dalam gelas Beaker 100 ml, kemudian dicampur dengan 0,5 g selulosa kering sambil diaduk selama 30 menit. Kemudian ditempatkan pada cawan porselen dan dikeringkan dalam oven pada suhu 500 C selama 12 jam, lalu suhu dinaikkan menjadi 1200 C selama 12 jam. Hasil campuran kemudian dicuci dengan aquadest hangat untuk memisahkan asam sitrat yang tidak ikut bereaksi. Selanjutnya hasil dikeringkan didalam oven pada suhu 500 C selama 6 jam untuk menghilangkan air. Kemudian selulosa sitrat dihitung derajat substitusinya serta dianalisis dengan spektroskopi FT-IR dan analisis SEM.
3.3.5. Karakterisasi Hasil Reaksi
3.3.5.1. Analisis Gugus Fungsi FT-IR
Masing-masing selulosa dan selulosa sitrat dicampurkan dengan KBr anhidrat lalu dicetak sesuai plat hingga membentuk pellet lapisan tipis, selanjutnya diukur spektrum masing-masing cuplikan dengan alat spektrofotometer FT-IR.
3.3.5.2. Analisis Morfologi dengan SEM
3.3.5.3. Penentuan Derajat Substitusi (DS)
Penentuan derajat substitusi (DS) berdasarkan metode Genung dan Mallat (1941), dimana 0,1 gram selulosa sitrat kering terlebih dahulu dilarutkan dalam 5 ml NaOH 0,5 N kemudian dimasukkan kedalam labu Erlenmeyer 250 ml, diaduk selama 30 menit dengan menggunakan magnetik stirrer. Kemudian ditambahkan 3 tetes indikator Fenolftalein, lalu dititrasi dengan larutan HCl 0,5 N sampai larutan berwarna merah muda berubah menjadi bening. Percobaan blanko diulang menggunakan 0,1 gram selulosa sampel. Derajat substitusi dapat dihitung dengan persamaan berikut :
% sitrat =(Vblanko −V sampel )x 0,1 x molaritas asam
Berat sampel (gram ) x 100%
DS = 162 x %sitrat
1000 − (99% × % sitrat )
3.3.6. Perlakuan dan Analisis Penyerapan Ion Cd2+
Tabel 3.1 Cek Alat SSA
Element Kadmium (Cd)
Lampu / Current Hallow cathode lamp / 12 Ma
Panjang gelombang Cd = 228,8 nm
Slit 0,7 nm (low)
Atomisation site Pyro / platform
Tipe pengukuran Area grafik
Tipe signal Atomic absorption – Background absorption
Waktu integrasi 4 menit
Waktu koreksi grafik 2 menit
Temperatur inject 20 oC
Tekanan gas Asetilena 3,6 bar atau 52 psig atau 360 kPa
Kecepatan alir gas Asetilena 300 mL/min
(AAS-Grafite Furnace Perkin Elmer)
3.3.6.1. Penentuan Waktu Kontak Optimum
Sebanyak 50 mL larutan standar Cd2+ 400 ppm dimasukkan ke dalam gelas Beaker 250 mL, kemudian ditambahkan selulosa sitrat sebanyak 0,1 g. Diaduk dengan pengaduk magnet selama 30 menit lalu campuran disaring menggunakan kertas saring Whatmann no. 42. Diatur pH filtrat hingga pH = 3 dengan menggunakan HNO3(p). Diukur absorbansinya dengan menggunakan spektrofotometer serapan atom
pada �spesifik 228,8 nm. Dilakukan perlakuan yang sama dengan variasi waktu kontak 60 menit, 90 menit, 120 menit, dan 150 menit.
3.3.6.2. Selulosa dalam Larutan Standar
HNO3(p). Diukur absorbansinya dengan menggunakan spektrofotometer serapan atom
pada �spesifik 228,8 nm. Dilakukan perlakuan yang sama dengan variasi larutan standar Cd2+ 200 ppm, 300 ppm, 400 ppm, dan 500 ppm.
3.3.6.3. Selulosa Sitrat dalam Larutan Standar
Sebanyak 50 mL larutan standar Cd2+ 100 ppm dimasukkan ke dalam gelas Beaker 250 mL, kemudian ditambahkan Selulosa Sitrat sebanyak 0,1 g. Diaduk dengan pengaduk magnet selama waktu kontak optimum lalu campuran disaring menggunakan kertas saring Whatmann no. 42. Diatur pH filtrat hingga pH = 3 dengan menggunakan HNO3(p). Diukur absorbansinya dengan menggunakan
3.4. Bagan Penelitian 3.4.1. Preparasi Sampel
Daun nenas
Dibersihkan dan dicuci dengan air
Dipotong kecil-kecil
Dikeringkan
Dihaluskan dengan blender
3.4.2. Isolasi α-Selulosa dari Serbuk Daun Nenas
75 g serbuk daun nenas
dimasukkan kedalam gelas Beaker 5 L
ditambahkan 1 L campuran HNO3 3,5 %dan 10 mg NaNO2 dipanaskan diatas hotplate sambil diaduk pada suhu 90oC selama 2 jam
disaring dan dicuci residu hingga filtrat netral
residu filtrat
ditambahkan 1 liter larutan NaOH 2 %
dipanaskan pada suhu 80oC selama 4 jam sambil diaduk diatas hotplate disaring dan dicuci residu hingga filtrat netral
residu filtrat
diputihkan dengan 1 L larutan yang terbuat dari larutan buffer asetat dan NaOCl 1,7 % dengan perbandingan 1 : 1(v/v)
dipanaskan pada suhu 80oC selama 6 jam sambil diaduk di atas hotplate disaring dan dicuci residu hingga filtrat netral
residu filtrat
ditambahkan 500 mL larutan NaOH 17,5 %
dipanaskan pada suhu 80oC selama 30 menit sambil diaduk diatas hotplate disaring dan dicuci residu hingga filtrat netral
ditambahkan dengan500 mL H2O2 10 %
dipanaskan pada suhu 60oC selama 15 menit sambil diaduk diatas hotplate disaring dan dicuci residu hingga filtrat netral
dikeringkan pada suhu 60oC didalam oven selama 4 jam disimpan dalam desikator
hasil residu
residu filtrat
filtrat
3.4.3. Sintesis Selulosa Sitrat
0,5 g selulosa kering
Dimasukkan kedalam gelas Beaker
Dicampurkan dengan larutan dari 1,5 g asam sitrat dalam 8 ml aquadest
Diaduk selama 30 menit
Dituang kedalam cawan porselen
Dikeringkan dalam oven pada suhu 50oC selama 12 jam, lalu suhu dinaikkan menjadi 120oC selama 12 jam
Didinginkan
Dicuci dengan aquadest hangat
Dikeringkan dalam oven pada suhu 50oC selama 6 jam
Disimpan di dalam desikator
Hasil
Analisis SEM Penentuan DS
3.4.4. Perlakuan dan Analisis Penyerapan Logam Cd2+ dengan Zat Hasil Sintesis 3.4.4.1. Penentuan Waktu Kontak Optimum
50 mL Larutan Standar Cd2+ 400 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 228,8 nm.
Residu dimasukkan ke dalam gelas Beaker 250 mL
ditambahkan 0,1 g selulosa sitrat
diaduk dengan pengaduk magnet selama 30 menit
disaring dengan menggunakan kertas saring Whatman no. 42
λ
Hasil
3.4.5.2. Penyerapan Logam Cd2+ dengan Selulosa dalam Larutan Standar
50 mL Larutan Standar Cd2+ 100 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 228,8 nm.
Residu dimasukkan ke dalam gelas Beaker 250 mL
ditambahkan 0,1 g selulosa
diaduk dengan pengaduk magnet selama 60 menit
disaring dengan menggunakan kertas saring Whatman no. 42
λ
Hasil
3.4.5.3. Penyerapan Logam Cd2+ dengan Selulosa Sitrat dalam Larutan Standar
50 mL Larutan Standar Cd2+ 100 ppm
Filtrat
diatur pH hingga 3 dengan menambahkan HNO3 (p)
diukur absorbansinya dengan menggunakan spektrofotometer serapan atom pada spesifik 228,8 nm.
Residu dimasukkan ke dalam gelas Beaker 250 mL
ditambahkan 0,1 g selulosa sitrat
diaduk dengan pengaduk magnet selama 60 menit
disaring dengan menggunakan kertas saring Whatman no. 42
λ
Hasil
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Hasil Analisis Menggunakan Spektrofotometer FT-IR
4.1.1.1.Hasil Analisis Spektrofotometer FT-IR Selulosa
Selulosa yang digunakan dalam penelitian ini adalah selulosa hasil isolasi dari daun nenas. Pada tahap isolasi α- selulosa digunakan 75 g serbuk daun nenas dan pada
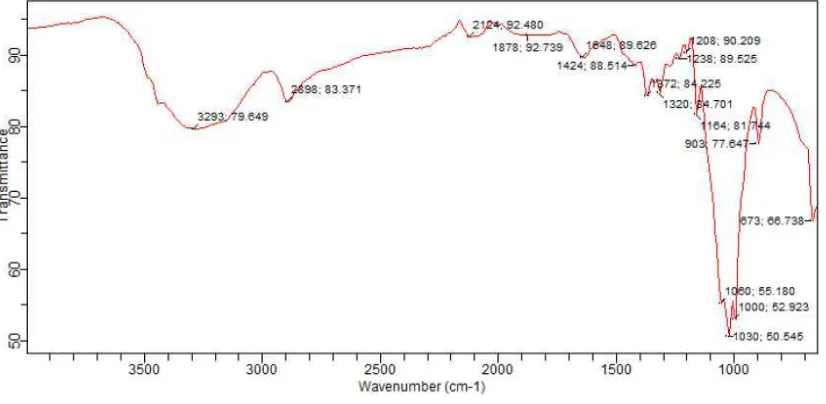
akhir proses diperoleh α- selulosa sekitar 14,5153 g (sebanyak 27,65% dari berat awal serbuk daun nenas). Dari data spektroskopi FT-IR selulosa memberikan spektrum dengan puncak-puncak vibrasi pada daerah bilangan gelombang 3293 cm-1, 2898 cm
-1
, 2124 cm-1,1320 cm-1, 1030 cm-1, 903 cm-1, 673 cm-1 (Gambar 4.1).
4.1.1.2.Hasil Analisis Spektrofotometer FT-IR Selulosa Sitrat
Selulosa sitrat merupakan hasil reaksi antara selulosa yang sudah diisolasi terlebih dahulu dari daun nenas yang kemudian direaksikan dengan asam sitrat yang dilarutkan terlebih dahulu dengan aquadest dengan pemanasan pada suhu 55oC selama 12 jam, lalu suhu dinaikkan menjadi 120oC selama 12 jam. Kemudian dicuci dengan aquadest hangat lalu dikeringkan. Hasil yang diperoleh berupa selulosa sitrat berupa serbuk halus berwarna putih kekuningan yang selanjutnya dianalisis menggunakan spektroskopi FT-IR, dimana memberikan spektrum puncak-puncak serapan pada daerah bilangan gelombang 3337 cm-1, 2805 cm-1, 2124 cm-1, 1729 cm
-1
, 1432 cm-1, 1372 cm-1, 1060 cm-1, 903 cm-1, 673 cm-1 (Gambar 4.2).
4.1.2. Hasil Analisis Morfologi Menggunakan SEM (Scanning Electron Microscopic)
4.1.2.1.Hasil Analisis MorfologiSEM dari Selulosa Hasil Isolasi dari Daun Nenas Adapun hasil SEM dari selulosa hasil isolasi dari daun nenas dapat dilihat pada Gambar 4.3 berikut.
(a) (b) Gambar 4.3 SEM dari Selulosa : (a) perbesaran 250 kali dan (b) perbesaran 500 kali
4.1.2.2.Hasil Analisis MorfologiSEM dari Selulosa Sitrat
Adapun hasil SEM dari selulosa sitrat dapat dilihat pada Gambar 4.4 berikut.
(a) (b)
(Spektrofotometer Serapan Atom)
Hasil absorbansi larutan seri standar ion kadmium (Cd2+) menggunakan spektrofotometer serapan atom ditunjukkan pada Tabel 4.1 dibawah ini.
Tabel 4.1. Data Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+)
Konsentrasi (mg/L) Absorbansi Rata-Rata (A)
0,2 0,1093
0,4 0,2192
0,6 0,3196
0.8 0,4251
1,0 0,5175
Dari data absorbansi larutan seri standar ion kadmium pada Tabel 4.1, maka diperoleh kurva kalibrasi larutan seri standar kadmium yang ditunjukkan pada Gambar 4.5 berikut ini.
Gambar 4.5. Kurva Kalibrasi Larutan Seri Standar Cd2+
Dari kurva yang dihasilkan pada Gambar 4.5, diperoleh harga koefisien korelasi (R2) kurva kalibrasi di atas yakni sebesar 0,9992 yang menunjukkan bahwa
y = 0,519x + 0,005
alat yang digunakan mempunyai respon yang baik. Setelah kurva kalibrasi diperoleh, dilakukan analisis absorpsi terhadap 0,1 g sampel selulosa hasil isolasi dan selulosa sitrat hasil sintesis dengan faktor pengali 1000 kali menggunakan SSA.
4.1.3.1. Hasil Penentuan Waktu Kontak
Dari data SSA yang diperoleh, penentuan waktu kontak dilakukan terhadap selulosa sitrat dengan konsentrasi larutan standar Cd2+ 400 ppm diuraikan pada Tabel 4.2berikut.
Tabel 4.2.Waktu Kontak Adsorpsi Terhadap Ion Cd2+
No Waktu Kontak (menit)
Konsentrasi Awal (ppm)
Berdasarkan data Tabel 4.2 menunjukkan bahwa waktu kontak penyerapan optimum terhadap ion logam Cd2+ adalah 60 menit dengan serapan sebesar 23,33 %.
4.1.3.2. Hasil Analisis Absorpsi Selulosa Terhadap Ion Cd2+
Dari data SSA yang diperoleh, hasil analisis selulosa terhadap ion kadmium (Cd2+) diuraikan pada Tabel 4.3 berikut.
Tabel 4.3.Hasil Pengukuran Absorpsi Selulosa dengan SSA
1 100 0,1948 89,6752 ± 10,3248
2 200 0,3602 170,5713 ± 14,7143
3 300 0,3699 350,6309 ± 12,3422
4 400 0,5711 273,7210 ± 8,7966
5 500 0,4966 474,5672 ± 6,3582
Berdasarkan data Tabel 4.3 menunjukkan bahwa penurunan kadar ion logam kadmium (Cd2+) optimum adalah 14,7143 %, sedangkan penurunan kadar ion logam kadmium (Cd2+) minimum adalah 6,3582 %.
4.1.3.3. Hasil Analisis Absorpsi Selulosa Sitrat Terhadap Ion Cd2+
Dari data SSA yang diperoleh, hasil analisis selulosa sitrat terhadap ion kadmium (Cd2+) diuraikan pada Tabel 4.4 berikut.
Tabel 4.4.Hasil Pengukuran Absorpsi Selulosa Sitrat dengan SSA
No Konsentrasi Awal (ppm)
Absorbansi (A)
Konsentrasi Akhir (ppm)
% Terserap
1 100 0,0630 25,2129 ± 74,7872
2 200 0,2133 98,7235 ± 50,6382
3 300 0,4873 232,7350 ± 22,4216
4 400 0,3567 337,7189 ± 15,5702
5 500 0,4568 435,5375 ± 12,8925
4.2. Pembahasan
4.2.1. Isolasi α-Selulosa dari Daun Nenas
Sebelum proses isolasi maka daun nenas terlebih dahulu dipotong kecil-kecil dan dibersihkan dengan air. Setelah itu dikeringkan dan dihaluskan dengan menggunakan
blender untuk mempermudah proses isolasi. Tahapan pertama dalam proses isolasi α -selulosa adalah proses delignifikasi dengan menggunakan HNO3 3,5 % dan NaNO2
yang bertujuan untuk menghilangkan lignin dari serbuk daun nenas. Selanjutnya dilakukan proses swelling dengan menggunakan NaOH 2% yakni membuka pori-pori selulosa sehingga zat pengotor yang tidak diinginkan keluar. Pulp yang dihasilkan dari proses swelling ini berwarna kuning kecoklatan sehingga dilakukan proses pemutihan dengan menggunakan NaOCl 1,7%. Selulosa yang dihasilkan pada tahap
ini masih mengandung β-selulosa dan ϒ -selulosa sehingga dilakukan pemurnian
dengan menggunakan NaOH 17,5% dimana α-selulosa akan mengendap sedangkan
β-selulosa dan ϒ -selulosa akan larut. α-Selulosa yang diperoleh pada tahap ini berwarna kuning, maka dilakukan pemutihan menggunakan H2O2 10%. α-Selulosa
yang dihasilkan berbentuk serbuk berwarna putih yang kemudian dikeringkan di dalam oven pada suhu 60oC.
4.2.1.1. AnalisisSelulosa dengan Spektrofotometer FT-IR
gelombang 2898 cm-1 merupakan vibrasi stretching C-H yang didukung oleh vibrasi C-H bending pada daerah bilangan gelombang 673 cm-1. Munculnya puncak vibrasi pada daerah bilangan gelombang 2124 cm-1 menunjukkan vibrasi C-C stretching dan didukung dengan daerah bilangan gelombang 903 cm-1 yang merupakan C-C bending.
4.2.2. Esterifikasi Selulosa dengan Asam Sitrat
Selulosa Sitrat merupakan hasil reaksi esterifikasi antara selulosa direaksikan dengan asam sitrat yang dilarutkan terlebih dahulu dengan aquadest dan dilakukan pemanasan pada suhu 50oC selama 12 jam, dan selanjutnya suhu dinaikkan menjadi 120oC. Kemudian dicuci dengan aquadest hangat untuk menghilangkan asam sitrat yang tidak bereaksi lalu dikeringkan selama 6 jam pada suhu 50oC (Thanh dan Nhung, 2009).
4.2.2.1. AnalisisSelulosa Sitrat dengan Spektrofotometer FT-IR
Spektrum yang ditunjukkan dari data FT-IR memberi dukungan bahwa selulosa sitrat yang terbentuk memiliki gugus karbonil (C=O) yang berasal dari asam sitrat dengan munculnya puncak vibrasi pada daerah bilangan gelombang 1729 cm-1 serta didukung oleh puncak serapan pada daerah bilangan gelombang 1060 cm-1 menunjukkan vibrasi dari gugus C-O simetris dan puncak serapan pada daerah bilangan gelombang 1372 cm-1 yang menunjukkan vibrasi dari gugus C-O anti-simetris.
serapan pada daerah bilangan gelombang 1432 cm-1 menunjukkan vibrasi gugus metilena (-CH2-) dari penambahan asam sitrat. Penambahan asam sitrat menyebabkan
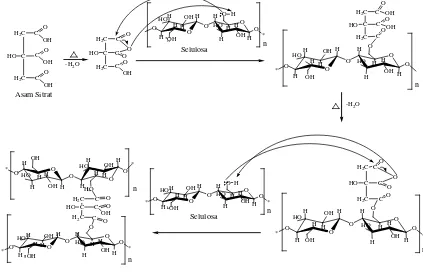
reaksi esterifikasi berlangsung dimana O- pada atom C-6 selulosa yang bersifat nukleofil akan menyerang gugus karbonil dari asam sitrat anhidrat yang bersifat elektrofil dan membentuk selulosa sitrat. Secara hipotesis reaksi selulosa dengan asam sitrat untuk membentuk selulosa sitrat dapat dilihat pada Gambar 4.6berikut :
H2C
Gambar 4.6. Reaksi Pembentukan Selulosa Sitrat melalui Esterifikasi Selulosa ( Thanh, 2009)
4.2.3. Analisis Morfologi dengan SEM (Scanning Electron Microscopic)
penelitian ini uji SEM dilakukan pada selulosa hasil isolasi dari daun nenas dan selulosa sitrat dengan perbesaran gambar mencakup 250 kali dan 500 kali.
Adapun hasil SEM dari selulosa hasil isolasi dari daun nenas dari Gambar 4.3, menunjukkan morfologi permukaan.Permukaan pada perbesaran 250 kali dan 500 kali tampak homogen, halus, dan memiliki permukaan yang kecil.
Adapun hasil SEM dari selulosa sitrat hasil isolasi dari daun nenas dari Gambar 4.4, menunjukkan telah terjadi perubahan morfologi permukaan.Permukaan pada perbesaran 250 kali dan 500 kali tampak lebih kasar dan memiliki permukaan yang lebih besar daripada selulosa hasil isolasi.Ini menunjukkan perubahan morfologi yang mendukung telah terjadi reaksi antara gugus hidroksil selulosa dan gugus karbonil dari asam sitrat.
4.2.4. Penentuan Derajat Substitusi (DS)
Derajat Substitusi (DS) adalah jumlah rata-rata gugus per anhidroglukosa unit yang disubstitusikan oleh gugus lain. Apabila gugus yang menggantikan berupa satu gugus anhidroksil pada setiap unit anhidroglukosa diesterifikasi dengan satu buah gugus asetil, nilai DS sebesar 1.Jika terdapat tiga buah gugus hidroksil yang diesterifikasi, maka nilai DS sebesar 3 (Wurzburg, 1986). Penentuan DS dari senyawa selulosa sitrat yang dihasilkan dapat dihitung berdasarkan persamaan di bawah ini :
% sitrat =[volume blanko −volume sampel ] x 0,1 x molaritas asam
Berat Sampel (gram ) x 100 %
= [4,4−5,8] x 0,1 x 0,48
0,1 x 100 %
DS = 162 x % sitrat
1000 − (99 × % sitrat )
= 162 x 67,2
1000 − (99 × 67,2)
= 1,925
Derajat substitusi selulosa sitrat terhadap selulosa yakni sebesar 1,925 yang mengindikasikan bahwa rata-rata sebanyak 1,925 gugus OH dari setiap monomer selulosa mengalami substitusi dengan asam sitrat membentuk selulosa sitrat.
4.2.5.Analisis Absorpsi Selulosa dan Selulosa Sitrat Terhadap Ion Cd2+
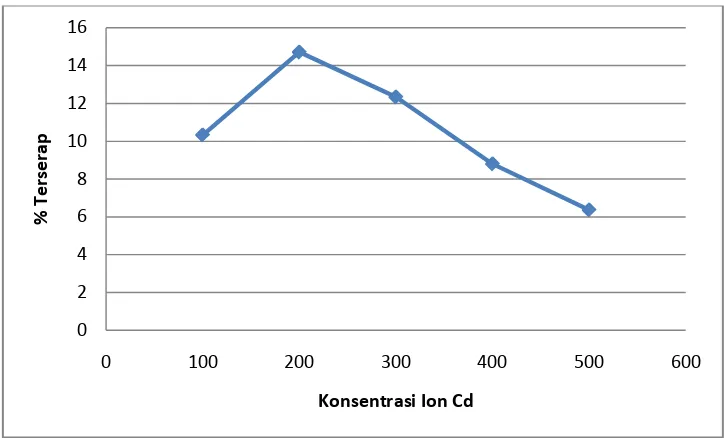
Kurva daya serap selulosa dapat dilihat pada Gambar 4.7 berikut.
Gambar 4.7. Kurva Daya Serap Selulosa
0 2 4 6 8 10 12 14 16
0 100 200 300 400 500 600
% T
e
rs
e
ra
p
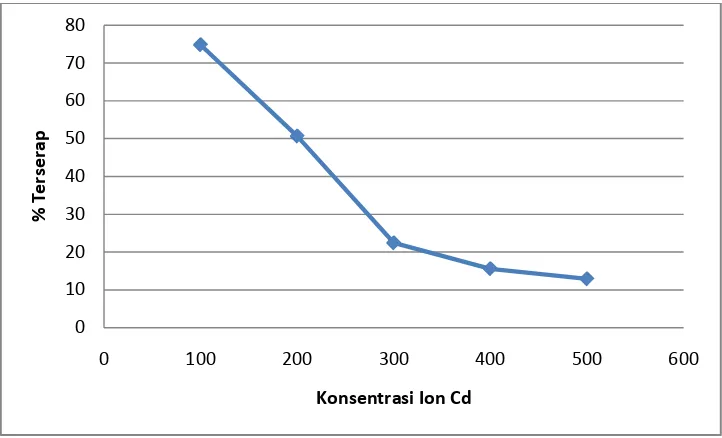
Kurva daya serap selulosa sitrat dapat dilihat pada Gambar 4.8 berikut.
Gambar 4.8. Kurva Daya Serap Selulosa Sitrat
Berdasarkan kurva padaGambar 4.7 menyatakan bahwa selulosa memiliki kemampuan serapan.Hal ini disebabkan karena adanya gugus hidroksil yang dapat berinteraksi dengan ion logam Cd2+. Adanya gugus OH yang merupakan Lewis Hard base memberikan interaksi dengan ion Cd2+ yang merupakan kation besar. Hasil serapan oleh selulosa dapat dilihat bahwa terjadi peningkatan serapan terhadap ion Cd2+ pada konsentrasi 100 ppm hingga 200 ppm sedangkan pada konsentrasi 300 ppm hingga 500 ppm mengalami penurunan. Ini menyatakan bahwa jumlah adsorben yang digunakan sudah optimum pada konsentrasi 200 ppm dan interaksi antara adsorben dan adsorbat yang kuat sehingga ion logam tertahan pada permukaa adsorben.Sementara pada konsentrasi 300 ppm hingga 500 ppm sudah melewati batas optimum sehingga menurunkan ikatan kovalen antara adsorben dan adsorbat yang menyebabkan ion logam terlepas dari permukaan adsorben.
0 10 20 30 40 50 60 70 80
0 100 200 300 400 500 600
% T
e
rs
e
ra
p
Adapun reaksi pengikatan ion kadmium dengan selulosa dapat dilihat pada Gambar 4.9 berikut :
O
Gambar 4.9. Pengikatan ion kadmium dengan Selulosa (House, 2008)
Berdasarkan kurva yang ditunjukkan sebelumnya menyatakan bahwa adanya modifikasi terhadap selulosa jelas mempengaruhi kemampuan serapannya terhadap ion logam Cd2+. Selulosa tersusun atas rantai-rantai panjang yang terikat satu sama lain sehingga membentuk struktur seperti anyawan yang disebut fibril dan menjadikan selulosa mampu menyerap ion logam secara fisika. Adanya modifikasi pada selulosa menjadikannya lebih reaktif karena memiliki gugus fungsi yang lebih banyak dari selulosa itu sendiri.
memiliki orbital kosong pada �* sebagai akseptor yang dapat berinteraksi dalam transfer muatan. Namun, tipe interaksi ini bukanlah interaksi yang paling disukai sehingga menyebabkan penyerapan ion logam yang kurang optimal.Adanya gugus O-H yang merupakan Lewis hard base juga memberikan interaksi dengan ion Cd2+ yang merupakan kation besar (House. 2008).
Dari kurva pada Gambar 4.8 dapat dilihat bahwa terjadi peningkatan serapan terhadap ion logam Cd2+ pada konsentrasi 100 ppm hingga 200 ppm sedangkan pada konsentrasi 300 ppm hingga 500 ppm mengalami penurunan. Ini disebabkan jumlah adsorben yang digunakan sudah optimum pada konsentrasi 200 ppm dan interaksi antara adsorben dan adsorbat yang kuat sehingga menyebabkan ion logam tertahan pada permukaan adsorben.Sementara pada konsentrasi 300 ppm hingga 500 ppm sudah melewati batas optimum sehingga menurunkan interaksi antara adsorben dan adsorbat yang menyebabkan ion logam terlepas dari permukaan adsorben. Pada konsentrasi 500 ppm terlihat persentase serapan yang sangat rendah, ini disebabkan selain selulosa sitrat yang telah jenuh dalam menyerap logam juga dipengaruhi oleh sifat selulosa sitrat yang sedikit higroskopis sehingga sebagian selulosa sitrat menjadi larut dalam larutan yang turut serta menjadikan jumlah ion yang terserap tidak maksimal.
O
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Esterifikasi sebanyak 0,5 gram selulosa hasil isolasi dari daun nenas menggunakan asam sitrat dengan perbandingan (b/b) 1:3 menghasilkan 0,5546 gram selulosa sitrat berbentuk serbuk dan berwarna kuning pucat, yang dalam penelitian ini memberikan karakteristik :
a. Pada analisis gugus fungsi menggunakan FT-IR memunculkan pita serapan vibrasi stretching O-H pada daerah bilangan gelombang 3337 cm-1, dan didukung oleh vibrasi gugus karbonil (C=O) pada daerah bilangan gelombang 1729 cm-1.
b. Pada analisis morfologi permukaan menggunakan SEM menunjukkan bahwa permukaan selulosa sitrattampak lebih kasar dan memiliki permukaan yang lebih besar menandakan selulosa dan asam sitrat telah bereaksi.
2. Hasil analisis adsorpsi terhadap ion logam Cd2+ menggunakan SSA menunjukkan bahwa serapan optimum dengan waktu kontak 60 menit terdapat pada konsentrasi 200 ppm, di mana selulosa memiliki serapan sebesar 14,7143 %, sedangkan selulosa sitrat serapan optimum pada konsentrasi 100 ppm dengan serapan sebesar 74,7872 %.
5.2. Saran
1. Disarankan untuk penelitian selanjutnya melakukan sintesis selulosa sitrat dengan melakukan sejumlah variasi perbandingan massa selulosa dengan asam sitrat .
BAB 2
TINJAUAN PUSTAKA
2.1. Daun Nenas (Ananas comosus (L) Merr)
Tanaman nenas (Ananas cosmosus (L) Merr)yang termasuk family Bromeliaceae merupakan tumbuhan tropis dan subtropis yang banyak terdapat diIndonesia.Bentuk daun nenas menyerupai pedang yang meruncing diujungnyadengan warna hijau kehitaman dan pada tepi daun terdapat duri yang tajam seperti pada Gambar 2.1. Tergantung dari spesies atau varietas tanaman, panjang daun nenas berkisar antara 55 sampai 75 cm dengan lebar 3,1 sampai 5,3 cm dan tebal daun antara 0,18sampai 0,27 cm.Serat nenas terdiri atas selulosa dan non selulosa yang diperolehmelalui penghilangan lapisan luar daun secara mekanik. Lapisan luar daun berupapelepah yang terdiri atas sel kambium, zat pewarna yaitu klorofil, xantofill dankaroten yang merupakan komponen kompleks dari jenis tanin, serta lignin yangterdapat di bagian tengah daun.Selain itu lignin juga terdapat pada lamela dariserat dan dinding sel serat (Hidayat, 2008).
Adapun klasifikasi tanaman nenas menurut Anonim, 2010 sebagai berikut :
Kingdom : Plantae
Sub kingdom : Spermatophyta Superdivisio : Magnoliophyta Divisio : Magnoliophyta Kelas : Angiospermae Sub-kelas : Asteridae Ordo : Farinosae Familia : Bromiliaceae Genus : Ananas
Spesies : Ananas comosus (L) Merr.
Berdasarkan pengamatan dengan mikroskop, sel-sel dalam serat daun nanas mempunyai ukuran diameter rata-rata berkisar 10 μm dan panjang rata-rata 4,5 mm dengan ratio perbandingan antara panjang dan diameter adalah 450. Rata-rata
ketebalan dinding sel dari serat daun nanas adalah 8,3 μm.Komposisi kimia dari serat daun nenas ditunjukkan pada Tabel 2.1.
Tabel 2.1 Komposisi Kimia Serat Daun Nenas (Rahmat, 2007)
NO Komposisi kimia Kadar (%)
1 Alpha Selulosa 69,5 – 71,5
2 Pentosan 17,0 – 17,8
3 Lignin 4,4 – 4,7
4 Pektin 1,0 – 1,2
5 Lemak dan wax 3,0 – 3,3
6 Abu 0,7 – 0,87
Serat yang diperoleh dari daun nenas muda kekuatannya relatif rendah dan seratnya lebih pendek dibanding serat dari daun yang sudah tua.Sama halnya dengan serat-serat alam lainnya yang berasal dari daun (leaf fibres), secara morfologi jumlah serat dalam daun nanas terdiri dari beberapa ikatan serat (bundleof fibres) dan masing-masing ikatan terdiri dari beberapa serat (multi-cellulerfibre) (Onggo, 2005).
2.2. Selulosa
Selulosa merupakan biopolimer yang berlimpah dialam yang bersifat dapat diperbaharui, mudah terurai, tidak beracun, dan juga merupakan polimer karbohidrat yang tersusun atas β-D glukopiranosa dan terdiri dari tiga gugus hidroksi per anhidro glukosa menjadikan selulosa memiliki derajat fungsionalitas yang tinggi.Sebagai materi yang diperbaharui, selulosa dan turunannya dapat dipelajari dengan baik.Bahan dasar selulosa telah digunakan lebih dari 150 tahun dalam berbagai macam aplikasi, seperti makanan, produksi kertas, biomaterial, dan dalam bidang kesehatan(Coffey et al, 1995).
Selulosa merupakan konstituen utama kayu kira-kira 40-50% bahan kering dalam kebanyakan spesies kayu adalah selulosa, terutama terdapat dalam dinding sel sekunder. Selulosa merupakan homo-polisakarida yang tersusun atas unit-unit β -D-Glukopiranosa yang terikat satu sama lain dengan ikatan-ikatan glikosida (Hardjono, 1995).
Seperti halnya amilosa, selulosa adalah polimer linier yang terdiri dari unit D-glukosa. Semua unit D-glukosa ini berkisar dari 300 sampai 15000, dihubungkan oleh
ikatan β-(1 4) ,bukan alfa. Bentuk molekul selulosa dan amilosa berbeda karena
ikatan α-(1 4) pada amilosa cenderung membentuk struktur spiral yang longgar,
sedangkan ikatan β-(1 4) pada selulosa cenderung membentuk rantai lurus.Semua
Secara alamiah molekul-molekul selulosa tersusun dalam bentuk fibril- fibrilyang terdiri dari beberapa molekul selulosa yang dihubungkan dengan ikatan glikosidik. Fibril-fibril ini membentuk struktur kristal yang dibungkus oleh lignin. Komposisi kimia dan struktur yang demikian membuat kebanyakan bahan yang mengandung selulosa bersifat kuat dan keras.Sifat kuat dan keras yang dimiliki oleh sebagian besar bahan berselulosa membuat bahan tersebut tahan terhadap peruraian secara enzimatik.Secara alamiah peruraian selulosa berlangsung sangat lambat (Fan et al., 1982).
Selulosaadalahsenyawaseperti serabut, liat, tidak larut dalam air dan ditemukan didalam dinding sel pelindung tumbuhan, terutama pada tangkai, batang, dahan dan semua bagian berkayu dari jaringan tumbuhan. Kayu terutama mengandung selulosa dan senyawa polimer lain. Selulosa tidak hanya merupakan polisakarida struktural ekstraselular yang paling banyak dijumpai pada dunia tumbuhan, tetapi juga merupakan senyawa yang paling banyak diantara semua biomolekul pada tumbuhan atau hewan. Karena selulosa merupakan homopolisakarida linear tidak bercabang, terdiri dari 10.000 atau lebih unit D-glukosa yang dihubungkan oleh ikatan β 1,4 glikosida senyawa ini akan kelihatan seperti amilosa, dan rantai utama glikogen (Lehninger, 1988).
Selulosa merupakan salah satu jenis polisakarida yang tersusun dari molekul glukosa dalam bentuk rantai panjang tidak bercabang yang mirip dengan amilosa. Unit-unit dari glukosa dalam selulosa terikat pada ikatan β-1,4- ikatan glikosidik.
Isomer β tidak membentuk gulungan seperti isomer α, tetapi selaras dalam berbasis
O
Gambar 2.2 Struktur Selulosa (Setiyawan, 2010)
Menurut Clark, berdasarkan panjang rantainya membagi selulosa menjadi tiga bagian yaitu :
1. Alpha selulosa merupakan selulosa rantai panjang, tidak larut dalam larutan 17,5 % NaOH dengan DP sekitar 600 – 1500
2. Beta selulosa merupakan selulosa rantai pendek, larut dalam larutan 17,5 % NaOH, memiliki DP sekitar 15 – 90
3.Gamma selulosa merupakan selulosa rantai pendek, larut dalam larutan 17,5 % NaOH dan larutan asam, dan memiliki DP kurang dari 15 (Smook, 1987).
Selulosa membentuk komponen serat dari dindng sel tumbuhan.Ketegaran selulosa disebabkan oleh struktur keseluruhannya. Molekul selulosa merupakan rantai-rantai, atau mikrofibril, dari D-glukosa sampai sebanyak 14.000 satuan yang terdapat sebagai berkas-berkas terpuntir mirip tali, yang terikat satu sama lain oleh ikatan hidrogen. Hidrolisis lengkap dalam HCl 40% dalam air, hanya menghasilkan D-glukosa.Disakarida yang terisolasi dari selulosa yang terhidrolisis sebagian adalah selobiosa, yang dapat dihidrolisis lebih lanjut menjadi D-glukosa dengan suatu katalis asam atau dengan emulsion enzim (Fesenden, 1994).
ikatan hidrogen yang kuat, selulosa mempunyai kekuatan tarik yang tinggi dan tidak larut dalam kebanyakan pelarut (Atalla, 1987).
Setiap unit β-D-glikopiranosa didalam rantai selulosa mempunyai tiga gugus hidroksil reaktif, dua sekunder (HO-2 dan HO-3) dan satu primer (HO-6).Untuk eterifikasi, gugus hidroksil sekunder (HO-2) biasanya paling mudah bereterifikasi sedangkan untuk esterifikasi, gugus hidroksil primer (HO-6) memiliki reaktifitas yang lebih tinggi. Aksesbilitas berarti kemudahan relatif gugus-gugus hidroksil untuk dicapai oleh pereaksi-pereaksi gugus (HO-6) reaktifitasnya lebih tinggi terhadap substituen-substituen yang besar dari pada gugus-gugus hidroksil yang lain karena paling sedikit halangan steriknya (Fengel, 1995).
2.3. AsamSitrat
Asam sitrat terdapat pada jeruk nipis sebanyak kira-kira 6%.Asam sitrat selalu ditambahkan kepada minuman-minuman ringan dan gula-gula sebagai penyedap.Asam ini juga merupakan perantara yang penting pada metabolisme karbohidrat dan merupakan komponen dalam darah dan urin (Siregar, 1988).Asam sitrat memiliki karakteristik seperti asam hidrosikarboksilat lainnya dalam bentuk garam, esterifikasi, anhidrida, amida dan reaksi kimia lainnya (Grimaux, 1880). Rumus kimia asam sitrat adalah C6H8O7atauCH2
(COOH)-COH(COOH)-CH2(COOH), rumus struktur asam sitrat ini tercermin pada nama IUPAC-nya, asam
pemanasan di atas 740C.(id.wikipedia.org). Struktur asam sitrat dapat dilihat pada gambar 2.3.
H2C
C
COOH
HO COOH
H2C COOH
Gambar 2.3. Struktur Asam Sitrat (Apelblat, 2014)
Sifat-sifat asam sitrat adalah sebagai berikut : a. Rumus molekul : C6H8O7
b. Berat Molekul : 192.12 g/mol c. Titik lebur : 1530 C d. Titik didih : 1750 C
e. Densitas : 1.665 g/cm3 (Anonim, 1952)
Konversi dari asam sitrat anhidrat ditunjukkan melalui interaksi asam padat dengan asetat anhidrat berlebih dalam asam asetat glasial pada suhu 360C – 380C. Titik lebur dari kristal anhidrat putih yaitu 1210 – 1230C. Identifikasi dari senyawa ini dapat dilihat melalui analisis dasar, titrasi potensiometri,cryoscopic dan pengukuran NMR. Sintesis alkil sitrat (gugus alkil rantai pendek) merupakan cairan berminyak. Namun dengan meningkatnya rantai, maka akan berubah menjadi seperti lilin dan bubuk padatan dengan variasi kelarutan dalam air dan pelarut organik (Apelblat,2014).
2.4. Esterifikasi
dan air akan terjadi. Proses ini disebut esterifikasi Fischer, yang ditemukan oleh Emil Fischer Seorang ahli kimia yang menonjol pada abad ke-19. Walaupun reaksi berada dalam kesetimbangan, reaksi ini dapat digunakan untuk membuat ester dengan hasil yang memuaskan dengan jalan mendorong kesetimbangan ke kanan (Siregar, 1988).
Esterifikasi juga dapat didefenisikan sebagai reaksi antara asam karboksilat dan alkohol (Gandhi, 1997).Esterifikasi dapat dilakukan dengan menggunakan katalis enzim (lipase) dan asam anorganik (asam sulfat dan asam klorida), dengan berbagai variasi alkohol biasanya metanol, etanol, 1-propanol, 1-butanol, amyl alkohol, dan lain-lain (Ozgulsun, 2000).
Asam anorganik yang digunakan sebagai katalis akan menyebabkan asam karboksilat mengalami konjugasi sehingga asam konjugat dari asam karboksilat tersebutlah yang akan berperan sebagai substrat. Cara lain dalam pembentukan ester adalah dengan melewatkan HCl ke dalam campuran reaksi tersebut dan direfluks. Cara ini dikenal dengan nama metode Fischer-Spieser. Esterifikasi tanpa katalis dapat juga dilakukan dengan satu molekul asam karboksilat dan satu pereaksi secara berlebih.Pertambahan hasil juga dipengaruhi oleh dehidrasi yang artinya menarik air terbentuk sebagai hasil samping reaksi. Air dapat dipisahkan dengan cara menambahkan pelarut yang bersifat non polar seperti misalnya benzene dan kloroform sehingga air yang terbentuk akan segera terikat pada pelarut yang digunakan atau dengan menambahkan molekular sieves (Yan, 2001).
2.5. Esterifikasi Selulosa
Untuk mendapatkan sifat fisik dan kimia yang lebih baik dan memperluas aplikasinya, selulosa dibuat dalam berbagai turunannya diantaranya turunan ester dan eter. Ester selulosa banyak digunakan sebagai serat dan plastik, sedangkan eter sebagai pengikat dan bahan tambahan untuk mortar khusus atau kimia khusus untuk bangunan dan konstruksi juga stabilisator viskositas pada cat, makanan, produk farmasetik, dan lain-lain (Zugenmaier, 2008).
Pembentukan ester selulosa menggunakan asam organik melalui proses esterifikasi terhadap gugus hidroksi alkohol, yang umum menggunakan asam klorida atau asam anhidrat lainnya sebagai agen yang meningkatkan derajat esterifikasi secara signifikan. Esterifikasi gugus hidroksi alkohol umumnya berlangsung dalam reaksi setimbang, di mana ikatan ester yang dibentuk dipengaruhi dan diputus dalam suasana asam encer, dan penggunaan alkali pekat secukupnya membentuk ester penyabunan yang bersifat irreversible.
2.5.1. Selulosa Xantate
Cell OH CS2 NaOH Cell O C S
S- Na+ Selulosa Xantate
Larutan dari selulosa xantate ini dilewatkan melalui suatu lubang kecil atau celah ke dalam larutan yang bersifat asam. Regenerasi gugus –OH dari selulosa ini menyebabkan lapisan endapan seperti jaringan atau lembaran :
Cell O C S
S- Na+ H3O
+
Cell OH
Rayon atau kertas kaca(Solomons, 2014)
2.5.2. Selulosa Nitrat
Modifikasi ester selulosa dengan asam organik dan asam anorganik membentuk turunan selulosa bersifat kovalen yang pertama kali disintesis dalam laboratorium.Selulosa nitrat, selulosa asetat dan selulosa xantogenat telah diproduksi dalam skala industri pada pertengahan abad yang lalu dan saat ini telah mencakup lebih dari 90 % total produksi selulosa.Diawali dengan ester selulosa dari asam anorganik, hingga asam organik telah dipersiapkan dalam esterifikasi konvensional, demikian juga reaksi yang dirancang secara khusus.Selulosa nitrat merupakan turunan selulosa pertama yang diproduksi dalam skala industri untuk pembuatan kain sutera sintetik. Ini dapat dibentuk melalui reaksi antara polimer dengan HNO3
berdasarkan reaksi :
Cell OH HNO3 Cell O NO2 H2O
2.5.3. Selulosa Asetat
pada Gambar 2.4.Seiring perkembangan zaman, Franchimont (1879) menemukan penggunan katalis yang efisien yakni H2SO4 dan HClO4. Kedua percobaan ini
menjadi dasar pembuatan selulosa asetat dengan asetat anhidrat sebagai agen dalam proses esterifikasi dan asam sulfat atau asam perklorat sebagai katalis.
O
Gambar 2.4. Ester Selulosa-asetat (Ganstrom, 2009)
2.5.3. Selulosa Sulfat
Sebagian besar asam sulfat, asam sulfit, atau asam klorosulfonat dapat digunakan sebagai agen sulfonasi, yang juga dapat dikombinasikan dengan pelarut inert seperti alkohol. Secara umum reaksi pembentukan selulosa sulfat dapat ditunjukkan oleh reaksi berikut :
Cell-OH + SO3 Cell-OSO3H
Cell-OH + XSO3H Cell-OSO3H + HX (X = NH2, OH, Cl)
Selulosa sulfat secara detail dapat dibentuk melalui beberapa tahap berikut: (i) Sulfonasi gugus hidroksi biasanya dimulai dalam sebuah sistem heterogen.
(ii)Sulfonasi gugus hidroksi yang bebas sebagian membentuk ester selulosa atau eter selulosa di mana subtituent primer bertindak sebagai gugus pelindung.
(iii)Sulfonasi oleh pertukaran tempat gugus ester atau eter dengan makromolekul yang datang.
2.2.5. Selulosa Fenil Karbamat
trikarbanilat dengan penggunaan reagen berlebih dalam 10 jam reaksi pada suhu 70-1000 C. Reaksi secara perlahan akan berubah dari heterogen menjadi homogen dan disertai karbanilasi melalui degradasi cincin yang dapat diabaikan. Jalur ini cocok untuk mengubah selulosa polimer analog menjadi turunan selulosa yang memiliki kelarutan dalam larutan. Reaksi pembentukan selulosa fenil karbamat ditunjukkan pada Gambar 2.5 berikut :
Cell OH N C O Cell O C
O H
N
Gambar 2.5. Reaksi Pembentukan Selulosa Fenil Karbamat (Klem, 1998)
2.6. Adsorpsi
Adsorpsi atau penyerapan adalah proses pemisahan komponen tertentu dari suatu fluida berpindah ke permukaan zat padat yang menyerap (adsorben). Biasanya partikel-partikel kecil adsorben ditempatkan dalam suatu hamparan tetap dan fluida dialirkan melalui hamparan itu sampai adsorben mendekati jenuh dan pemisahan yang dikehendaki tidak dapat berlangsung lagi. Pemisahan adsorpsi banyak digunakan pada industry kimia, misalnya pada pemisahan gas, mengurangi kelembaban udara, penghilangan bau, dan penyerapan gas yang tidak diinginkan dari suatu hasil proses (Maron, 1984).
Jenis adsorpsi yang umum dikenal adalah adsorpsi kimia (Kemisorpsi) dan adsorpsi fisika (Fisisorpsi).
1. Adsorpsi Kimia (Kemisorpsi)
adsorpsi kimia hanya satu lapisan gaya yang terjadi. Besarnya energi adsorpsi kimia sekitar 100 kj/mol.
2. Adsorpsi Fisika (Fisisorpsi)
Molekul-molekul yang diadsorpsi secara fisika tidak terikat kuat pada permukaan, dan biasanya terjadi proses balik cepat, sehingga mudah diganti dengan molekul yang lain. Adsorpsi fisika didasarkan pada gaya Van Der Waals dan dapat terjadi pada permukaan yang polar dan non polar. Adsorpsi juga mungkin terjadi dengan mekanisme pertukaran ion.Oleh karena itu ion pada gugus senyawa permukaan padatan adsorbennya dapat bertukar dengan ion-ion adsorbat.Mekanisme pertukaran ini merupakan penggabungan dari kemisorpsi dan fisisorpsi, karena mengikat ion-ion dengan ikatan secara kimia tetapi ikatan mudah dilepas kembali untuk terjadinya pertukaran ion.Besarnya energi adsorpsi fisika sekitar 10 kj/mol (Barrow, 1979).
1.7. Logam Kadmium (Cd)
Kadmium adalah suatu unsur kimia dalam tabel periodik yang memiliki lambang Cd dan nomor atom 48.Kadmium merupakan salah satu jenis berbahaya karena elemen ini beresiko tinggi terhadap berpengaruh terhadap manusia dalam jangka waktu panjang dan dapat terakumulasi pada tubuh khususnya berefek terhadap gangguan pa yang kronis.Jumlah normal kadmium di tertinggi (1.700 ppm) dijumpai pada permukaan sampel tanah yang diambil di dekat pertambangan biji seng (Zn) (https:id.wikipedia.org/wiki/Kadmium).
kadmium dapat masuk ke dalam tubuh melalui berbagai cara, diantaranya dari udara yang tercemar, kontaminasi perairan, jalur rantai makanan dan wadah makanan/minuman yang berlapis kadmium. Kadmium dalam tubuh dapat merusak sistem fisiologis tubuh antara lain sistem urinaria, sistem respirasi (paru-paru), sistem sirkulasi darah dan jantung, kerapuhan tulang dan sistem reproduksi (Widowati, 2008).
Kadmium dan bentuk garamnya banyak digunakan pada beberapa jenis pabrik untuk proses produksinya. Industri pelapisan logam adalah pabrikyang paling banyak menggunakan kadmium murni sebagai pelapis, begitu juga pabrik yang membuat Ni-Cd bateri.Kadmium lebih beracun bila terisap melalui saluran pernapasan daripada saluran pencernaan. Kasus keracunan akut kadmium kebanyakan dari mengisap debu dan asap cadmium, terutama kadmium oksida (CdO). Dalam beberapa jam setelah mengisap, korban akan mengeluh gangguan saluran pernapaan, muntah, kepala pusing, dan sakit pinggang ( Darmono, 2001).
Kadmium dengan tingkat oksidasi +2 mempunyai konfigurasi (36Kr) 4d10 5s0
5p0 5d0 sehingga pada orbital d elektron belum terisi penuh. Adanya peran d-orbital back donation dari logam ini dapat menjadi dasar konsep pembentukan khelat.Pearson (1963) mengklasifikasikan asam-basaLewis menurut sifat kuat dan lemahnya. Menurut Pearson, situs aktif pada permukaan padatan dapat dianggap sebagai ligan yang dapat mengikat logam secara selektif. Logam dan ligan dikelompokkanmenurut sifat kuat dan lemahnya berdasarkan pada polarisabilitas unsur.
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Selulosa merupakan senyawa yang memiliki karakter hidrofilik karena adanya gugus hidroksil pada tiap unit polimernya.Gugus fungsi selulosa alam ataupun turunannya dapat berinteraksi secara fisik atau kimia. Selulosa memiliki gugus fungsi yang dapat melakukan pengikatan dengan ion logam (Ibbet,et al., 2006 ). Selulosa adalah biopolimer alami yang paling berlimpah dengan kekuatan mekanik yang relatif kuat hingga 10.000 Mpa dan selulosa memiliki struktur kimia mirip dengan kitosan, memungkinkan untuk menghasilkan campuran homogen yang menggabungkan sifat dari kitosan dan selulosa dengan baik (Bai,2005). α- Selulosa digunakan dalam
perkamen vulkanisir, resin kertas, dan kertas khusus sesuai dengan kebutuhan.α- Selulosa yang sangat murni, disebut larutan pulp, digunakan dalam pembuatan rayon, kertas kaca, nitro selulosa, selulosa asetat, dan turunan selulosa lainnya (Bethel, 1962).
meningkatdisebabkan sebagian gugus -OH mengalami asilasi oleh asam sitrat dan terbentuk gugus karboksilat yang kekuatan adsorbsinya sebagai pengkhelat lebih tinggi dari gugus hidroksil sehingga dapat diaplikasikan mengadsorpsi ion ��2+ dan ��2+
.
Tanaman nanas merupakan salah satu tanaman yang memiliki kandungan serat yang tinggi. Dalam Norman (1937),disebutkan bahwa dalam serat daun nenas mengandung 62-79% selulosa. Sedangkan dalam Hidayat (2008), disebutkan terdapat 69,5-71,5% selulosa dalam daun nanas ini diharapkan dapat dijadikan sumber selulosa sebagai alternatif baru untuk adsorben logam berat.
Berdasarkan uraian diatas, peneliti tertarik untuk melakukan sintesis selulosa sitrat dari selulosa hasil isolasi dari daun nenas dengan asam sitrat melalui reaksi esterifikasi serta membandingkan kekuatan serapan terhadap ion logam Cd2+.
1.2. Permasalahan
1. Bagaimana mensintesis selulosa sitrat melalui reaksi esterifikasi dari selulosa daun nenas dengan asam sitrat ?
2.Bagaimana daya adsorpsi selulosa hasil isolasi dari daun nenas dibandingkan selulosa sitrat hasil esterifikasi terhadap ion Cd2+ ?
1.3. Pembatasan Masalah
1. Selulosa yang digunakan adalah selulosa dari daun nenas yang diambil dari daerah Pancur Batu, Kabupaten Deli Serdang.
2. Senyawa selulosa sitrat diperoleh dari hasil esterifikasi selulosa dengan asam sitrat.
3. Ion logam Cd (II) yang digunakan adalah larutan standar CdCl2.
1.4. Tujuan Penelitian
1. Untuk mensintesis selulosa sitrat melalui reaksi esterifikasi dari selulosa daun nenas dengan asam sitrat ?
1.5. Manfaat Penelitian
Sebagai sumber informasi dalam reaksi sintesis dan pengembangan dari reaksi- reaksi organik dalam reaksi alkilasi untuk menghasilkan senyawa turunan selulosa yang dapat digunakan sebagai adsorben terhadap ion logam Cd2+.
1.6. Lokasi Penelitian
Penelitian ini dilaksanakan di Laboratorium Kimia Organik FMIPA-USU Medan.Analisisperubahan gugus fungsi menggunakan spektrofotometer FT-IR dilakukan di laboratoriumsalah satu perusahaan swasta di Medan. Analisis morfologi permukaan menggunakan SEM (Scanning Electron Microscopic)dilakukan di Pusat Laboratorium Forensik Mabes Polri Jakarta.Analisis penyerapan ion logam menggunakan SSA (Spektrofotometer Serapan Atom) dilaksanakan di Laboratorium Badan Riset dan Standarisasi (Baristand) Medan.
1.7. MetodologiPenelitian
SINTESIS SELULOSA SITRAT DARI SELULOSA DAUN NENAS (Ananas comosus (L)Merr )MELALUI REAKSI ESTERIFIKASI DENGAN ASAM
SITRAT SEBAGAI PENGADSORPSI ION KADMIUM (Cd2+)
ABSTRAK
Selulosa dari daun nenas diisolasi lalu diesterifikasi menggunakan asam sitrat membentuk selulosa sitrat. Terbentuknya selulosa sitrat dari hasil esterifikasi selulosa dengan asam sitrat pada hasil analisis spektroskopi FT-IR menunjukkan adanya vibrasi gugus C=O pada daerah bilangan gelombang 1729 cm-1 dan didukung oleh vibrasi gugus O-H pada daerah bilangan gelombang 3337 cm-1. Hasil analisis morfologi menggunakan SEM juga menunjukkan perubahan morfologi menjadi lebih besar dan kasar. Pengujian daya adsorpsi terhadap ion Cd2+ (pada konsentrasi 100, 200, 300, 400, dan 500 ppm) menggunakan spektrofotometer serapan atom (SSA) menunjukkan penyerapan optimum selulosa terdapat pada konsentrasi 200 ppm yakni menyerap sebesar 14,7143 %, dan penyerapan optimum selulosa sitrat pada konsentrasi 100 ppm yakni menyerap sebesar 74,7872 %.
SYNTHESIS CITRIC CELLULOSE FROM CELLULOSE OF PINEAPPLE’S LEAVES THROUGH ESTERIFICATION REACTION WITH CITRIC
ACIDAS AN ADSORBENT ONCADMIUM IONS (Cd2+)
ABSTRACT
Cellulose from pineapple’s leaves was isolated then esterificated with citric acid gave citric cellulose. The result of FT-IR spectroscopy in the forming of citric cellulose from esterification of cellulose with citric acid showed that C=O vibration in the region 1729 cm-1 and in the 3337 cm-1 region attributed to vibration of O-H group. Morphological analysis using SEM showed to be bigger and crude at their structure. Their adsorption capability for Cd2+ ions (at concentrations of 100, 200, 300, 400, and 500 ppm) have been investigated and the maximum sorption of cellulose indicated at concentration 200 ppm, about 23,1046 %, and the maximum sorption of citric cellulose at concentration 100 ppm about 96,4350 %.
SINTESIS SELULOSA SITRAT DARI SELULOSA DAUN NENAS (Ananascomosus (L) Merr) MELALUI REAKSI ESTERIFIKASI
DENGAN ASAM SITRAT SEBAGAI PENGADSORPSI ION KADMIUM (Cd2+)
SKRIPSI
SEVTY RAGUSTINA SURBAKTI
120802041
DEPARTEMEN KIMIA
FAKULTASMATEMATIKA DAN ILMUPENGETAHUANALAM
UNIVERSITAS SUMATERA UTARA
SINTESIS SELULOSA SITRAT DARI SELULOSA DAUN NENAS (Ananascomosus (L) Merr)MELALUI REAKSI ESTERIFIKASI DENGAN
ASAM SITRAT SEBAGAI PENGADSORPSI ION KADMIUM (Cd2+)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SEVTY RAGUSTINA SURBAKTI 120802041
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERNYATAAN
SINTESIS SELULOSA SITRAT DARI SELULOSA DAUN NENAS (Ananas comosus (L)Merr )MELALUI REAKSI ESTERIFIKASI DENGAN ASAM
SITRAT SEBAGAI PENGADSORPSI ION KADMIUM (Cd2+)
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Juni 2016
PERSETUJUAN
Judul : Sintesis Selulosa Sitrat dari Selulosa Daun Nenas (Ananas comosus (L)Merr ) Melalui Reaksi Esterifikasi dengan Asam Sitrat Sebagai Pengadsorpsi Ion Kadmium (Cd2+)
Kategori : Skripsi
Nama : Sevty Ragustina Surbakti NomorIndukMahasiswa : 120802041
Program : Sarjana (S1) Kimia Departemen : Kimia
Fakultas : Matematika dan Ilmu Pengetahuan Alam (MIPA)Universitas Sumatera Utara
Disetujui di
Medan, Juni 2016
KomisiPembimbing :
Pembimbing II Pembimbing I
Dr. Mimpin Ginting, M.S Dr. Adil Ginting, M.Sc NIP. 195510131986011001 NIP.195307041980031002
Diketahui/ Disetujui oleh
Departemen Kimia FMIPA USU Ketua,
PENGHARGAAN
Segala puji dan syukur penulis ucapkan kepada Tuhan Yesus Kristus sumber segala kasih sebab atas berkat dan rahmatNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini dengan baik.Dalam pelaksanaan hingga penyelesaian skripsi ini, penulis menyadari banyak mendapat bantuan, dukungan maupun motivasi dari berbagai pihak. Untuk itu pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Adil Ginting, M.Sc sebagai pembimbing I dan Bapak Dr. Mimpin Ginting, M.S sebagai pembimbing II yang dengan sabar telah memberikan bimbingan dan saran sehingga skripsi ini dapat terselesaikan.
2. Ibu Dr. Rumondang Bulan, M.S dan Bapak Drs. Albert Pasaribu, M.Sc sebagai Ketua dan Sekretaris Departemen Kimia FMIPA USU serta kepada Bapak Dr. Firman Sebayang, M.S selaku dosen PA penulis dan kepada semua staff dosen Departemen Kimia FMIPA USU.
3. Bapak Prof. Dr. Jamaran Kaban, M.Sc selaku Ketua bidang Kimia Organik FMIPA USU.
4. Kepala Laboratorium Kimia Organik FMIPA USU Bapak Dr. Mimpin Ginting, M.S beserta Dosen dan Staff Laboratorium Kimia Organik FMIPA USU.
5. Rekan - rekan Asisten Laboratorium Kimia Organik FMIPA USU ( Bg Daniel, Bg Bernard, Bg Hotlan, Bg Lianta, Kak Yulia, Kak Friska, Kak Oes, Hardy, Eben, Deasy, Lois, May, Yeski)
6. Saudara Kelompok Belajar (Deasy, Laura, Harpina, Juwita, Defrista, Novi T, Mega)
7. Teman-teman Stambuk 2012 beserta adik- adik stambuk 2013, 2014, 2015 yang tidak dapat disebutkan namanya satu per satu
8. Saudara Kelompok kecil “EKLESIA”, Teman IMKA “Merga Silima”, Teman Permata “Lau Meciho”
9. Pihak yang tidak disebutkan namun dengan tulus membantu penulis dalam menyelesaikan penulisan skripsi ini.
Secara khusus, penulis mengenang Alm.Ayah tercinta (Swasta Surbakti) atas jasa-jasa beliau mendidik dan membesarkan penulis dan mengucapkan terima kasih yang sebesar-besarnya kepada Ibu tercinta (Ely Berti Br Sembiring) yang senantiasa memberikan doa atas dukungan moril dan materil hingga akhirnya penulis menyelesaikan studi. Penulis juga mengucapkan terimakasih kepada adik penulis: Jimmy Surbakti dan Erwina Surbakti yang telah memberikan doa dan motivasi dalam menyelesaikan skripsi ini.Akhir kata penulis berharap semoga skripsi ini dapat bermanfaat bagi penelitian dan kemajuan ilmu pengetahuan.Kiranya Kasih Kristus menaungi kita semua.
SINTESIS SELULOSA SITRAT DARI SELULOSA DAUN NENAS (Ananas comosus (L)Merr )MELALUI REAKSI ESTERIFIKASI DENGAN ASAM
SITRAT SEBAGAI PENGADSORPSI ION KADMIUM (Cd2+)
ABSTRAK
Selulosa dari daun nenas diisolasi lalu diesterifikasi menggunakan asam sitrat membentuk selulosa sitrat. Terbentuknya selulosa sitrat dari hasil esterifikasi selulosa dengan asam sitrat pada hasil analisis spektroskopi FT-IR menunjukkan adanya vibrasi gugus C=O pada daerah bilangan gelombang 1729 cm-1 dan didukung oleh vibrasi gugus O-H pada daerah bilangan gelombang 3337 cm-1. Hasil analisis morfologi menggunakan SEM juga menunjukkan perubahan morfologi menjadi lebih besar dan kasar. Pengujian daya adsorpsi terhadap ion Cd2+ (pada konsentrasi 100, 200, 300, 400, dan 500 ppm) menggunakan spektrofotometer serapan atom (SSA) menunjukkan penyerapan optimum selulosa terdapat pada konsentrasi 200 ppm yakni menyerap sebesar 14,7143 %, dan penyerapan optimum selulosa sitrat pada konsentrasi 100 ppm yakni menyerap sebesar 74,7872 %.
SYNTHESIS CITRIC CELLULOSE FROM CELLULOSE OF PINEAPPLE’S LEAVES THROUGH ESTERIFICATION REACTION WITH CITRIC
ACIDAS AN ADSORBENT ONCADMIUM IONS (Cd2+)
ABSTRACT
Cellulose from pineapple’s leaves was isolated then esterificated with citric acid gave citric cellulose. The result of FT-IR spectroscopy in the forming of citric cellulose from esterification of cellulose with citric acid showed that C=O vibration in the region 1729 cm-1 and in the 3337 cm-1 region attributed to vibration of O-H group. Morphological analysis using SEM showed to be bigger and crude at their structure. Their adsorption capability for Cd2+ ions (at concentrations of 100, 200, 300, 400, and 500 ppm) have been investigated and the maximum sorption of cellulose indicated at concentration 200 ppm, about 23,1046 %, and the maximum sorption of citric cellulose at concentration 100 ppm about 96,4350 %.
DAFTAR ISI
Halaman
Pernyataan ii
Persetujuan iii
Penghargaan iv Abstrak v Daftar Lampiran xii Bab 1. PENDAHULUAN 1.1. Latar Belakang 1
Bab 2. TINJAUAN PUSTAKA 2.1. Daun Nenas (Ananas comosus (L) Merr) 5 Bab 3. METODE PENELITIAN 3.1. Alat – Alat Penelitian 19 3.2. Bahan – Bahan Penelitian 19
3.3. Prosedur Penelitian
3.3.2. Preparasi Sampel 22 3.3.3. Isolasi α-Selulosa dari Serbuk Daun Nenas 22
3.3.4. Sintesis Selulosa Sitrat 22
3.3.5. Karakterisasi Hasil Reaksi 23
3.3.6. Perlakuan dan Analisis Penyerapan Ion Cd2+ 24
3.4. Bagan Penelitian
3.4.1. Preparasi Sampel 26
3.4.2. Isolasi α-Selulosa dari serbuk Daun Nenas 27
3.4.3. Sintesis Selulosa Sitrat 28
3.4.4. Perlakuan dan Analisis Penyerapan Logam Cd2+ 29
Bab 4. HASIL DAN PEMBAHASAN 4.1. Hasil Penelitian
4.1.1. Hasil Analisis Gugus Fungsi Menggunakan
Spektrofotometer FT-IR 32
4.1.2. Hasil Analisis Morfologi Menggunakan SEM (Scanning Electron Microscopic) 34 4.1.3. Hasil Analisis Adsorbsi Ion Logam Cd2+
Menggunakan SSA (Spektrofotometer Serapan Atom) 35 4.2. Pembahasan
4.2.1. Isolasi α-Selulosa dari Daun Nenas 37 4.2.2. Esterifikasi Selulosa dengan Asam Sitrat 38 4.2.3. Analisis Morfologi dengan SEM (Scanning
Electron Microscopy) 40
4.2.4. Penentuan Derajat Substitusi (DS) 40 4.2.5. Analisis Adsorpsi Ion Logam Cd2+ Menggunakan SSA
(Spektrofotometer Serapan Atom) 41
Bab 5. KESIMPULAN DAN SARAN
5.1. Kesimpulan 45
5.2. Saran 45
Daftar Pustaka 46
DAFTAR GAMBAR
Nomor Gambar
Judul Halaman
2.1 Tanaman Nenas (Ananas comosus (L) Merr) 5
2.2 Struktur Selulosa 9
2.3 Struktur Asam Sitrat 11
2.4 Ester Selulosa-asetat 14
2.5 Reaksi Pembentukan Selulosa Fenil Karbamat 15
4.1 Spektrum FT-IR Selulosa 31
4.2 Spektrum FT-IR Selulosa Sitrat 32
4.3 SEM dari Selulosa :
(a) perbesaran 250x dan (b) perbesaran 500x
34
4.4 SEM dari Selulosa Sitrat :
(a) perbesaran 250x dan (b) perbesaran 500x
34
4.5 Kurva Kalibrasi Larutan Seri Standar Cd2+ 35
4.6 Reaksi Pembentukan Selulosa sitrat melalui Esterifikasi Selulosa
39
4.7 Kurva Daya Serap Selulosa 41
4.8 Kurva Daya Serap Selulosa Sitrat 42
4.9 Pengikatan ion kadmium dengan Selulosa 43
DAFTAR TABEL
Nomor Halaman
Judul Halaman
2.1 Komposisi Kimia Serat Daun Nenas 6
3.1 Cek Alat SSA 24
4.1 Data Absorbansi Larutan Seri Standar Ion Kadmium (Cd2+) 35
4.2 Waktu Kontak Adsorbsi Terhadap Ion Cd2+ 36
4.3 Hasil Pengukuran Absorpsi selulosa dengan SSA 36
DAFTAR SINGKATAN
DAFTAR LAMPIRAN
Nomor Lampiran
Judul Halaman
1. Perhitungan Larutan Standar 49
2. Perhitungan Daya Serap (%) Zat Hasil Reaksi 50