PENGARUH KONSENTRASI LIMBAH CAIR TAHU
TERHADAP PERTUMBUHAN MIKROALGA
Scenedesmus
sp.
ZAHARA FADILLA
PROGRAM STUDI BIOLOGI
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
PENGARUH KONSENTRASI LIMBAH CAIR TAHU TERHADAP
PERTUMBUHAN MIKROALGA Scenedesmus sp.
SKRIPSI
Sebagai Salah Satu Syarat untuk Memperoleh Gelar Sarjana Sains Pada Program Studi Biologi Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
ZAHARA FADILLA 105095003149
PROGRAM STUDI BIOLOGI FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH JAKARTA
PENGESAHAN UJIAN
Skripsi berjudul “Pengaruh Konsentrasi Limbah Cair Tahu Terhadap Pertumbuhan Mikroalga Scenedesmus sp.” yang ditulis oleh Zahara Fadilla, NIM 105095003149 telah diuji dan dinyatakan LULUS dalam sidang Munaqosyah Fakultas Sains dan Teknologi Universitas Islam Negeri Syarif Hidayatullah Jakarta pada tanggal 19 Mei 2010. Skripsi ini telah diterima sebagai salah satu syarat untuk memperoleh gelar Sarjana Strata Satu (S1) Program Studi Biologi.
Menyetujui,
DR. Lily Surayya Eka Putri, M.Env.Stud NIP. 19690404 200501 2 005
PERNYATAAN
DENGAN INI SAYA MENYATAKAN KEASLIAN SKRIPSI INI BENAR-BENAR HASIL KARYA SENDIRI YANG BELUM PERNAH DIAJUKAN SEBAGAI SKRIPSI ATAU KARYA ILMIAH PADA PERGURUAN TINGGI ATAU LEMBAGA MANAPUN.
Jakarta, 19 Mei 2010
ABSTRAK
Zahara Fadilla. Pengaruh Konsentrasi Limbah Cair tahu terhadap pertumbuhan Mikroalga Scenedesmus sp. Skripsi. Program Studi Biologi. Fakultas Sains dan Teknologi. Universitas Islam Negeri Syarif Hidayatullah Jakarta.
Penelitian ini bertujuan untuk mengetahui pengaruh konsentrasi limbah cair tahu terhadap pertumbuhan mikroalga Scenedemus sp. yang dihasilkan dengan menggunakan limbah cair tahu sebagai medium pertumbuhan. Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak Lengkap (RAL) yang terdiri atas enam perlakuan. Kultur Scenedemus sp. dipelihara pada laboratorium kultur dengan 6 perlakuan yang berbeda, yaitu limbah cair tahu konsentrasi 10%, 20%, 30%, dan 40%, Medium Basal Bold (kontrol positif), dan akuades (kontrol negatif) selama 13 hari. Analisis data menggunakan analisis varian yang dilanjutkan dengan uji Duncan. Berdasarkan hasil analisis varian diketahui bahwa terdapat perbedaan kerapatan jumlah sel Scenedesmus sp. di antara keenam konsentrasi limbah cair tahu dan kontrol. Pertumbuhan sel tertinggi berada pada konsentrasi limbah cair tahu 30% dengan rata-rata jumlah sel 541.666,67 sel/ml yang dicapai pada hari ke-3 dan konsentrasi 0% Medium Basal Bold (kontrol positif) dengan rata-rata jumlah sel 930.833,33 sel/ml yang dicapai pada hari ke-10.
ABSTRACT
Zahara Fadilla. Effect of The Liquid Waste Tofu Concentration on Growth of Microalgae Scenedesmus sp. Minithesis. Departement of Biology. Faculty of Science and Technology. State Islamic University of Jakarta.
The liquid waste of tofu is use as a medium of Scenedesmus sp. growth. The research was conducted the effect of the liquid waste to the growth of microalgae Scenedesmus sp. It was a completely random design which has 6 variety concentration 10%, 20%, 30%, 40%, Bold Basal Medium (Positive control) and aquades (negative control). It was observed for 13 days. Data obtained were analyzed by analysis of variance then continued with Duncan analysis. The result showed differences on the density of cell Scenedesmus sp. The highest cell density is 30% consentration, with 541.666,67 cell/ml wich was achieved at 3rd day observation and 0% consentration with 930.833,33 cell/ml wich was achieved at 10th day observation.
KATA PENGANTAR
Bismillahirohmanirrohim,
Puji syukur kehadirat Allah SWT, Tuhan Semesta Alam yang telah
memberikan nikmat, rahmat dan Hidayah-Nya kepada penulis sehingga dapat
menyelesaikan skripsi ini. Tidak lupa shalawat serta salam semoga senantiasa
dilimpahkan kepada Nabi dan Rasul mulia, Muhammad SAW yang diutus Allah
sebagai rahmat bagi seluruh semesta alam, beserta keluarganya, para sahabatnya,
dan orang-orang yang tegak diatas Din-Nya hingga akhir zaman.
Skripsi berjudul “ Pengaruh Konsentrasi Limbah Cair tahu terhadap pertumbuhan Mikroalga Scenedesmus sp. ” disusun untuk memenuhi syarat dalam
meraih gelar S.Si.
Pada kesempatan kali ini penulis ingin menyampaikan ucapan terima kasih
yang tulus dan tak terhingga kepada kedua orang tua dan semua pihak yang telah
memberikan bantuan baik moril maupun materil dalam menyelesaikan skripsi ini.
Untuk itu penulis mengucapkan terima kasih yang sedalam-dalamnya kepada:
Untuk itu penulis mengucapkan terima kasih yang sedalam-dalamnya
kepada:
1. Bapak DR. Syopiansyah Jaya Putra, M.Sis selaku Dekan Fakultas Sains dan
Teknologi UIN Syarif Hidayatullah Jakarta beserta seluruh stafnya.
2. Ibu DR. Lily Surayya Eka Putri, M.Env.Stud selaku Ketua Program Studi
3. Ibu DR. Lily Surayya Eka Putri, M.Env.Stud selaku pembimbing I dan ibu
Dasumiati, M.Si selaku pembimbing II yang telah meluangkan waktu untuk
memberikan bimbingan, saran, dan nasihatnya untuk penulis.
4. Ibu Fahma Wijayanti M.Si dan Ibu Dra.Nani Radiastuti, M.Si selaku penguji
dalam sidang munaqosyah.
5. Bapak Paskal Sukandar, M.Si dan ibu Etyn Yunita, M.Si selaku penguji yang
telah memberikan masukan untuk proposal dan hasil penelitian ini.
6. Ibu Mega R. Pikolli selaku ketua Laboratorium Biologi (PLT UIN) dan
staf-staf laboran yang telah membantu penulis selama penelitian.
7. Mama, Ayah, kakak dan adik tercinta yang selalu memberikan motivasi, do’a yang tulus , serta dukungan materil dan moril.
8. Mba Dini Damayanti, S.Si yang telah banyak membantu penulis dalam
melaksanakan penelitian.
9. Teman-teman Mahasiswa Biologi khususnya angkatan 2005 (Bioma), Wulan, Nelly, Habibah, Diah, Susti, Mai, k’ Qq, k’ Helma, Devi, Ainul, k’Iis dan
orang-orang “spesial” yang tak lelah memberikan semangat, tausiyah dan saran kepada penulis.
Penulis menyadari bahwa karya ini masih memiliki banyak kekurangan,
untuk itu saran dan kritik yang bersifat membangun sangat penulis harapkan demi
terciptanya karya yang lebih sempurna. Semoga karya ini dapat bermanfaat tidak
hanya untuk penulis tetapi juga untuk pembaca.
Di akhir kalimat ini, penulis memohon kepada Allah SWT, semoga
dan semoga amalnya menjadi amal yang sholeh dan mendapatkan balasan yang
dari Allah SWT. Amin
Jakarta, Mei 2010
Penulis
DAFTAR ISI
2.3.2. Faktor Yang berpengaruh terhadap Kultur Mikroalga ... 13
2.3.3. Kurva Tumbuh ... 15
2.4. Kerangka Berfikir ... 18
3.2. Bahan dan Alat ... 19
3.4.11. Pengukuran Kondisi Fisik Ruang Kultur ... 26
DAFTAR TABEL
Halaman
Tabel 1. Data Kerapatan Sel Scenedesmus sp. (sel/ml) pada enam
Perlakuan yang berbeda ... 34
Tabel 7. Pembanding (Duncan) Untuk Konsentrasi Limbah Cair Tahu dan Waktu (Hari) Terhadap Rata-Rata Jumlah Sel Scenedesmus sp. ... 56
Tabel 8. Uji Jarak Berganda Duncan untuk konsentrasi Limbah Cair Tahu Terhadap Rata-Rata Jumlah Sel Scenedesmus sp. ... 56
Tabel 9. Uji Jarak Berganda Duncan untuk Waktu (Hari) Pengamatan Terhadap Jumlah Rata-Rata Jumlah Sel Scenedesmus sp. ... 57
Tabel 10. Ringkasan Pengujian Pengaruh Interaksi Limbah Cair Tahu TerhadapWaktu (Hari) Pengamatan Dalam Bentuk Tabel Dua Arah ... 59
Tabel 11. Komposisi Medium Basal Bold ... 60
Tabel 12. Pengukuran pH Medium Perlakuan ... 61
Tabel 13. Data Kondisi Lingkungan Ruang kultur meliputi : Suhu, dan Intensitas Cahaya ... 61
DAFTAR GAMBAR
Halaman
Gambar 1. Sel Scenedesmus sp. ... 7
Gambar 2. Sel Scenedesmus sp. ... 7
Gambar 3. Reproduksi Scenedesmus obliquus... 9
Gambar 4. Fase Pertumbuhan Mikroalga... 16
Gambar 5. Budidaya Mikroalga Skala Laboratorium ... 25
Gambar 6. Pola Kotakkan pada Haemocytometer (Improved Neubauer) ... 26
Gambar 7. Hubungan antara Log Jumlah Sel Perlakuan Limbah Cair Tahu dan Kontrol (MBB dan Akuades) Dengan waktu ... 36
Gambar 8. Hubungan antara nilai pH Dengan waktu ... 39
Gambar 9. Bagan Proses Pembuatan Tahu ... 63
Gambar 10. Rak Perlakuan ... 65
Gambar 11. Pemeliharaan Kultur Starter Sel Scenedesmus sp. ... 65
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Alir Penelitian... 48
Lampiran 2. Data Hasil Pengamatan dan Analisis Data Kerapatan Jumlah Sel Scenedesmus sp... 49
Lampiran 3. Komposisi Medium Basal Bold... 60
Lampiran 4. Data Derajat Keasaman (pH) dan Pengukuran Kondisi Fisik
Ruang Kultur... 61
Lampiran 5. Hasil Analisis Limbah Cair Tahu ... 62
Lampiran 6. Bagan Proses Pembuatan Tahu ... 63
Lampiran 7. Penampakan Makroskopis kultur Mikroalga Scenedesmus sp
Pada Medium Perlakuan ... 64
BAB I PENDAHULUAN
1.1. Latar Belakang
Tahu merupakan salah satu produk olahan kedelai yang telah lama dikenal
dan banyak disukai, karena harganya murah dan mudah didapat. Selain itu industri
tahu ini juga ikut berperan dalam meningkatkan nilai gizi masyarakat, karena
terbuat dari protein nabati (Fatha, 2007). Zat gizi utama yang terkandung dalam
tahu adalah protein yang berbentuk gumpalan pada proses pembuatan tahu
(Hariyadi, 2002).
Industri tahu di Indonesia semakin berkembang dengan meningkatnya
kebutuhan gizi masyarakat. Industri tahu saat ini telah menjadi salah satu industri
rumah tangga yang tersebar luas baik di kota-kota besar maupun kecil. Dalam
proses produksinya, industri tahu menghasilkan limbah padat dan cair
(Rossiana,2006).
Limbah padat berupa ampas tahu, umumnya telah dapat ditanggulangi
dengan memanfaatkannya sebagai bahan pembuatan oncom dan bahan makanan
ternak. Limbah cairnya adalah whey tahu yang merupakan cairan buangan
(Rossiana,2006).
Sebagian besar industri tahu mengalirkan langsung limbah cairnya ke
saluran-saluran pembuangan, sungai ataupun badan air penerima lainnya tanpa
diolah terlebih dahulu. Hal ini seringkali menjadi masalah bagi lingkungan
sekitarnya karena dapat menyebabkan pencemaran. Jumlah limbah cair tahu yang
menyebabkan terganggunya kualitas lingkungan perairan di sekitar industri tahu
(Rossiana, 2006).
Limbah cair tahu dapat diolah dengan cara fisika, kimia, maupun biologi.
Pengolahan limbah cair secara biologi memanfaatkan mikroorganisme sebagai
dasar fungsional dalam proses penanganan (Citroreksono, 1996). Hal utama dalam
penanganan limbah cair adalah pengembangan dan pemeliharaan kultur
mikoorganisme yang cocok (Jenie & Rahayu, 1993).
Vegetasi tingkat rendah terutama kelompok mikroalga lebih dominan
diangkat sebagai agen pengolahan limbah mineral di lingkungan perairan.
Pemilihan mikroalga ini adalah karena mikroalga dapat memanfaatkan mineral
yang terlarut di dalam air untuk pertumbuhan dan perkembangannya, serta
mikroalga dapat hidup di kolom air mulai dari permukaan hingga ke batas daya
tembus cahaya di badan air tersebut (Mulyadi, 1999).
Menurut Nurtiyani (1998), salah satu mikroalga yang sering digunakan
dalam memecahkan masalah pencemaran limbah adalah Scenedesmus sp.
Mikroalga ini mampu merombak nutrient yang terkandung di dalam limbah cair
tahu menjadi biomassa. Steenblock (1987 dalam Sriharti dan Carolina, 2000)
menyatakan bahwa Scenedesmus sp. merupakan sumber daya potensial yang
mempunyai prospek yang cerah di masa mendatang, karena kandungan proteinnya
cukup tinggi, juga mengandung karbohidrat, lemak, vitamin, asam-asam amino
esensial, asam lemak esensial, enzim, beta karoten dan klorofil. Sebagai salah satu
sumber daya hayati, mikroalga ini memiliki beberapa potensi yang dapat
bahan makanan non-konvensional, bahan baku industri kimia dan farmasi,
indikator pencemaran air serta sebagai agen bioremediasi (Prihantini dkk, 2007).
Dari penelitian ini diharapkan mikroalga Scenedemus sp. dapat
menghasilkan biomasa sel Scenedesmus sp. yang dapat dimanfaatkan.
1.2. Perumusan Masalah
1. Apakah limbah cair tahu dapat dimanfaatkan sebagai medium
pertumbuhan mikroalga Scenedesmus sp.?
2. Apakah konsentrasi limbah cair tahu berpengaruh terhadap kerapatan sel
Scenedesmus sp.?
1.3. Hipotesis
1. Limbah cair tahu dapat dimanfaatkan sebagai medium pertumbuhan
mikroalga Scenedesmus sp.
2. Konsentrasi limbah cair tahu berpengaruh terhadap kerapatan sel
Scenedesmus sp.
1.4. Tujuan Penelitian
1. Memanfaatkan limbah cair tahu sebagai medium pertumbuhan
Mikroalga Scenedesmus sp.
2. Mengetahui pengaruh konsentrasi limbah cair tahu terhadap kerapatan
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan solusi terhadap penanganan
limbah cair tahu dan limbah cair tahu juga dapat digunakan sebagai medium
BAB II
TINJAUAN PUSTAKA
2.1. Limbah Cair Tahu
Limbah cair industri tahu berasal dai proses pencucian dan perendaman
kedelai, serta dari proses pengepresan dan pencetakan tahu (Djarwati dkk, 2000).
Selain itu juga dari sisa larutan serta dari proses pencucian peralatan. Pada proses
pembuatan tahu akan dihasilkan limbah (Lampiran 6). Limbah dari pengolahan
tahu ini berupa limbah padat dan limbah cair (Hariyadi, 2002).
Limbah padat berupa ampas tahu dapat digunakan sebagai bahan pangan
yaitu tempe gambus dan oncom, sedangkan limbah cairnya adalah whey (air
buangan) sisa proses penggumpalan tahu. Di dalam whey tahu masih terdapat sisa
protein yang tidak menggumpal dan zat-zat lain yang larut dalam air, termasuk
lesitin dan oligosakarida. Whey tahu yang tidak dimanfaatkan akan dapat
menyebabkan pencemaran lingkungan karena membusuknya senyawa-senyawa
organik tersebut, sedangkan pemanfaatannya masih sangat terbatas
(Hariyadi, 2002).
Limbah cair dan ampas tahu berbeda dengan ampas kedelai yang diperoleh
dari kedelai segar, dimana limbah cair dan ampas tahu berasal dari kedelai yang
sudah dimasak. Protein limbah cair dan ampas tahu mempunyai nilai lebih tinggi
dari pada biji kedelai itu sendiri (Dahiyat, 1990).
Buangan dalam limbah cair tahu masih banyak mengandung zat organik,
tersuspensi (Sola, 1994). Dalam hasil analisis limbah cair tahu oleh Kantor
Pengkajian Perkotaan dan Lingkungan DKI Jakarta (1995, dalam Johari 1999)
lihat (Tabel 14), terdapat unsur-unsur hara makro dan mikro yang dibutuhkan bagi
pertumbuhan mikroalga antara lain N, P, K, dan Mg.
Berdasarkan kandungan nutrisi yang masih terdapat pada limbah cair tahu,
maka pemanfaatannya sebagai medium alternatif pertumbuhan mikroalga
merupakan salah satu bentuk pemecahan masalah limbah cair tahu. Cara ini
memiliki banyak keunggulan di antaranya adalah penanganannya mudah dan
murah (Aspuranto, 1989).
Pengolahan limbah cair tahu dengan mikroalga telah dilakukan oleh Johari
pada tahun 1999 dengan menggunakan Chlorella. Hasil dari penelitian tersebut
menunjukan bahwa Chlorella mempunyai kemampuan untuk tumbuh pada
medium limbah cair tahu, sehingga dapat diasumsikan bahwa limbah cair tahu
juga dapat digunakan sebagai medium alternatif untuk pertumbuhan Scenedesmus.
2.2. Mikroalga Scenedesmus sp.
2.2.1. Klasifikasi dan Struktur Scenedesmus sp.
Dalam Bold dan Wyne (1985), Scenedesmus sp. diklasifikasikan sebagai
berikut:
Divisi : Chlorophyta
Kelas : Chlorophyceae
Ordo : Chlorococcales
Genus : Scenedesmus
Spesies: Scenedesmus sp.
Scenedesmus talusnya terdiri dari 1 atau 2 sel terkadang 3 sel, biasanya
membentuk koloni yang terdiri dari 2,4, atau 8 bahkan bisa mencapai 16 sel
sampai 32 sel pada setiap koloninya (Gambar 2.). Sel berbentuk silindris, oval,
bulat, dengan ujung sel berbentuk bulat atau lancip (John dkk, 2002). Sel
Scenedesmus memiliki 1 inti sel, dan kloroplas yang terdapat satu pyrenoid
(Graham dan Wilcox, 2000).
Gambar 2. Sel Scenedesmus sp. Gambar 3. Sel Scenedesmus sp. Sumber: Zahara Fadilla Sumber: Zahara Fadilla
Pada bagian terminal sel Scenedesmus terdapat ornamen sel yang disebut
dengan spina, yang ukurannya dapat mencapai panjang sampai 20 mikrometer.
Spina ini berguna untuk menjaga keseimbangan, mendeteksi keberadaan prey
(predator) atau juga dapat membantu sel dalam mencapai tempat yang memiliki
cahaya dan nutrien yang optimum (Graham dan Wilcox, 2000). Scenedesmus
berwarna hijau rumput karena adanya klorofil a dan b yang lebih dominan
terhadap cahaya panas. Dinding sel lapisan luar terbentuk dari bahan pektin
sedangkan lapisan dalam dari selulosa (Bachtiar, 2007).
2.2.2. Habitat dan Reproduksi Scenedesmus sp.
Bold dan Wynne (1985) menyatakan bahwa Scenedesmus merupakan alga
hijau yang terdistribusi secara luas. Terdapat pada hampir semua tipe perairan dan
tanah.
Reproduksi aseksual Scenedesmus sp. terjadi melalui pembentukan
autokoloni. Sel induk membelah membentuk koloni anakan. Pembelahan akan
dilakukan sampai terbentuk empat sel anakan. Pelepasan autokoloni dilakukan
dengan cara memecah dinding sel induk, tiap koloni yang dihasilkan mempunyai
kemampuan untuk memproduksi autokoloni (Graham dan Wilcox, 2000).
Beberapa spesies Scenedesmus sp. Dapat melakukan reproduksi seksual
dengan pembentukan zoospore biflagel dan isogami, menurut Pickett-Heaps (1975
dalam Damayanti, 2006) reproduksi seksual diawali dengan pembentukan sel
gamet pada masing-masing sel induk. Dua buah sel gamet akan melebur dan
membentuk zigot. Zigot kemudian akan tumbuh menjadi koloni anak dan
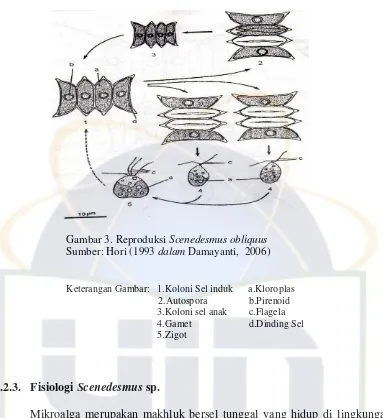
Gambar 3. Reproduksi Scenedesmus obliquus
Sumber: Hori (1993 dalam Damayanti, 2006)
Keterangan Gambar: 1.Koloni Sel induk a.Kloroplas 2.Autospora b.Pirenoid
3.Koloni sel anak c.Flagela 4.Gamet d.Dinding Sel 5.Zigot
2.2.3. Fisiologi Scenedesmus sp.
Mikroalga merupakan makhluk bersel tunggal yang hidup di lingkungan
yang mengandung air, tumbuh dan berkembang dengan memanfaatkan sinar
matahari sebagai sumber energi untuk melakukan fotosintesis serta dapat
memanfaatkan nutrien anorganik sederhana seperti CO2 serta komponen
N, P, K dan komponen lainnya (Setiawan dkk, 2008). Namun dalam kondisi
tanpa cahaya, mikroalga menggunakan bahan organik sama halnya seperti
dengan menggunakan energi kimia dari degradasi simpanan pati atau minyak, atau
dari konsumsi protoplasma alga itu sendiri (Saeni, 1989).
Menurut (Muslimin, 1995) Mikroalga bersifat fotoautotrof yang akan
menggunakan cahaya matahari sebagai sumber energi dan CO2 sebagai sumber
karbonnya. Pada proses ini CO2 akan diubah menjadi karbohidrat melalui proses
fotosintesis.
2.3. Kultur Mikroalga
2.3.1. Teknik Kultur Mikroalga
Menurut Isnansetyo dan Kurniastuty (1995), tahapan yang akan dilakukan
dalam kultur mikroalga, yaitu koleksi, isolasi dan perbanyakan.
1. Koleksi
Proses koleksi ini bertujuan untuk mendapatkan satu atau beberapa jenis
mikroalga yang diinginkan yang berasal dari alam untuk dikultur secara murni.
Pengambilan fitoplankton dapat dilakukan dengan menggunakan plankton net.
Kemudian diperiksa dengan bantuan mikroskop kemudian dilakukan isolasi.
2. Isolasi
Ada lima metode isolasi yang dapat dilakukan, yaitu:
a) Metode Isolasi secara Biologis
Metode ini dilakukan berdasarkan pergerakan fitoplankton, yaitu
menggunakan pengaruh fototaksis positif organisme. Organisme akan bergerak
menuju cahaya, sehingga dapat dikumpulkan.
Metode yang akan dilakukan bila jumlah organisme yang terkumpul
sangat banyak dan ada salah satu spesies yang dominan. Cara ini dilakukan
dengan memindahkan sampel ke dalam beberapa tabung reaksi dengan komposisi
hara, suhu dan cahaya yang cocok untuk pertumbuhan fitoplankton yang akan
diisolasi.
c) Metode Isolasi Pengulangan Sub-Kultur
Metode ini dilakukan jika organisme yang terkumpul jumlah dan jenisnya
sedikit sehingga dilakukan kultur pada media dengan komposisi hara, suhu dan
intensitas cahaya yang sesuai untuk pertumbuhan fitoplankton yang akan disolasi.
d)Metode Isolasi Pipet Kapiler
Metode ini dilakukan dengan cara meletakkan sampel sebanyak 10-15
tetes ditengah-tengah cawan petri. Kemudian memasukan 6-8 tetes medium yang
sesuai di sekeliling sampel tersebut. Isolasi dilakukan dengan memindahkan
sampel air pada salah satu tetesan media dengan pipet kapiler steril, kemudian
diamati di bawah mikroskop hingga diperoleh unit fitoplankton tunggal yang
diinginkan.
e) Metode Isolasi Goresan
Metode ini menggunakan media agar-agar sebanyak 1,5% yang dicampur
dengan sampel air, kemudian dipanaskan hingga mendidih dan terlarut sempurna
dan berwarna kuning jernih. Larutan agar-agar ini disterilisasi dan dituangkan
kedalam cawan petri atau tabung reaksi yang sudah steril. Setelah agar membeku
dengan menggunakan ose. Bibit fitoplankton digoreskan pada agar dengan pola
zig-zag untuk mencegah kontaminasi
Untuk proses penumbuhannya diletakkan pada rak kultur yang disinari
dengan lampu TL 40 watt secara terus menerus. Setelah beberapa hari
fitoplankton akan tumbuh pada goresan agar, tetapi masih tercampur dengan
fitoplankton jenis lain, kemudian dilakukan penggoresan berulang-ulang pada
media agar-agar yang sama sampai diperoleh fitoplankton yang telah murni. Hasil
Kultur murni dari media agar dikembangkan dalam media cair yang sesuai untuk
pertumbuhan fitoplankton yang diinginkan.
3. Perbanyakan
a) Kultur Skala Laboratorium
Kultur skala laboratorium dimulai dari volume 0,5 liter hingga 5 liter.
Pupuk yang digunakan adalah stok pupuk cair dengan unsur-unsur hara yang
lengkap baik hara makro (N, P, K, S, Mg) maupun hara mikro (Fe, Mn, Cu, Zn,
Mo, Si, dan unsur mikro lainnya). Untuk pemeliharaanya dilakukan pada rak
kultur dengan pencahyaan lampu TL dan dilakukan aerasi pada kultur.
b) Kultur Skala Massal
1) Kultur Skala Massal Semi Out-Door
Kultur ini dimulai dari volume 30 liter hingga 100 liter dalam wadah
berupa akuarium yang diletakkan di luar laboratorium. Pupuk yang digunakan
sama dengan pupuk pada skala laboratorium yang diberikan sesuai takaran yang
2) Kultur Skala Massal Out-Door
Kultur skala massal out-door ini dimulai dari volume 1 ton hingga 20 ton
atau lebih. Pada kultur skala massal out-door ini pupuka yang digunakan adalah
pupuk pertanian seperti ZA, Urea dan TSP.
2.3.2. Faktor-Faktor yang berpengaruh terhadap kultur Mikroalga
Pertumbuhan suatu jenis fitoplankton atau mikroalga sangat erat kaitannya
dengan ketersedian hara makro dan mikro serta dipengaruhi oleh kondisi
lingkungan berupa nutrien, suhu, cahaya, pH dan Karbondioksida (Isnansetyo
dan Kurniastuty, 1995).
a.) Nutrien
Fitoplankton (mikroalga) membutuhkan berbagai unsur untuk
pertumbuhannya. Beberapa unsur ini dibutuhkan dalam jumlah yang relatif besar
dan disebut hara makro (macro-nutrient) misalnya C (karbon), H (hidrogen), O
(oksigen), N (nitrogen), P (fosfor), Si (silikon), S (sulfur), Mg (magnesium), K
(Kalium) dan Ca (kalsium). Selain hara makro diperlukan juga hara mikro (
micro-nutrient) untuk pertumbuhan alga fitoplankton. Menurut Nontji (2006), hara
mikro ini berupa unsur-unsur kelumit (trace elements) yang diperlukan dalam
jumlah yang sangat kecil seperti Fe (besi), Mn (mangan), Cu (tembaga), Zn
(seng), B (boron), Mo (molybdenum), V (vanadium), dan Co (kobal).
Setiap unsur hara ini mempunyai fungsi-fungsi khusus yang tercermin
pada pertumbuhan dan kepadatan yang dicapai, tanpa mengesampingkan
protein, dan K berfungsi dalam metabolism karbohidrat. Fe dan Na berperan
untuk pembentukan klorofil, sedangkan Si dan Ca merupakan bahan untuk
pembentukan dinding sel atau cangkang. Vitamin B12 banyak digunakan untuk
memacu pertumbuhan melalui rangsangan fotosintetik (Isnansetyo dan
Kurniastuty, 1995).
b.) Suhu
Suhu berpengaruh langsung karena reaksi kimia enzimatik yang berperan
dalam proses fotosintesis dikendalikan oleh suhu. Peningkatan suhu sampai batas
tertentu akan menaikkan laju fotosintesis (Nontji, 2006). Suhu optimal kultur
fitoplankton secara umum antara 20-24 °C. hampir semua fitoplankton toleran
terhadap suhu antara 16-36 °C. Suhu di bawah 16 °C dapat menyebabkan
kecepatan pertumbuhan turun, sedangkan suhu di atas 36 °C dapat menyebabkan
kematian pada jenis tertentu (Cotteau, 1998; Taw, 1990).
c.) Cahaya
Cahaya matahari mutlak diperlukan untuk reaksi fotosintesis. Cahaya
merupakan sumber energi dalam proses fotosintetis yang berguna untuk
pembentukan senyawa karbon organik. Kebutuhan akan cahaya bervariasi
tergantung kedalaman kultur dan kepadatannya. Intensitas cahaya yang terlalu
tinggi dapat menyebabkan fotoinbihisi dan pemanasan. Intensitas cahaya 1000 lux
cocok untuk kultur dalam Erlenmeyer, sedangkan intensitas 5000-10000 lux untuk
volume yang lebih besar (Cotteau, 1998; Taw, 1990). Pertambahan intensitas
setelah intensitas cahaya meningkat melebihi batas optimum bisa menjadi faktor
penghambat (Darley, 1982).
d.) pH
Derajat keasaman merupakan gambaran jumlah atau aktivitas ion
hydrogen dalam perairan. Secara umum nilai pH menggambarkan seberapa besar
tingkat keasaman atau kebasaan. Menurut Suriawiria (2005), batas pH untuk
pertumbuhan mikroorganisme merupakan suatu gambaran dari batas pH bagi
kegiatan enzim. Untuk tiap mikroorganisme dikenal dengan nilai pH minimum,
optimum dan maksimum. Variasi pH dapat mempengaruhi metabolisme dan
pertumbuhan mikroalga dalam beberapa hal, antara lain mengubah keseimbangan
dari karbon organik, mengubah ketersediaan nutrien, dan dapat mempengaruhi
fisiologis sel.
2.3.3. Kurva Tumbuh
Pertumbuhan jasad hidup, dapat ditinjau dari dua segi, yaitu pertumbuhan
secara individu dan pertumbuhan secara kelompok dalam satu populasi.
Pertumbuhan individu diartikan sebagai adanya penambahan volume sel serta
bagian-bagian lainnya dan diartikan pula sebagai penambahan kuantitas isi dan
kandungan di dalam selnya. Pertumbuhan populasi merupakan akibat adanya
pertumbuhan individu. Pada mikroorganisme, pertumbuhan dapat berubah
Gambar 4. Fase Pertumbuhan Mikroalga (Sumber: Isnansetyo dan Kurniastuty, 1995).
Isnansetyo dan Kurniastuty (1995) dan Suriawiria (2005) menyatakan,
hingga saat ini kerapatan sel digunakan secara luas untuk mengetahui
pertumbuhan fitoplankton dalam kultur pakan alami. Ada empat fase
pertumbuhan yaitu fase lag, logaritmik, stasioner dan kematian (gambar 4).
a) Fase Lag (Adaptasi)
Selam fase ini pertumbuhan tidak secara nyata terlihat, karena itu fase ini
juga dinamakan fase adaptasi (Sesaat setelah penambahan inokulum ke dalam
media kultur, populasi tidak mengalami perubahan). Ukuran sel pada saat ini pada
umumnya meningkat. Secara fisiologis fitoplankton sangat aktif dan terjadi proses
sintesis protein baru. Organisme mengalami metabolism, tetapi belum terjadi
pembelahan sel hingga kepadatan sel belum meningkat.
b) Fase Logaritmik (Eksponensial)
Fase ini diawali oleh pembelahan sel dengan laju pertumbuhan tetap. Pada
kondisis kultur yang optimum. Laju pertumbuhan pada fase ini mencapai
maksimal karena pada fase ini sel melakukan konsumsi nutrient dan proses
c) Fase Stasioner
Pada fase ini pertumbuhan mulai mengalami penurunan dibandingkan
dengan fase logaritmik. Pada fase ini laju reproduksi sama dengan laju kematian.
Dengan demikian penambahan dan pengurangan jumlah fitoplankton relatif sama
atau seimbang sehingga kepadatan fitoplankton tetap.
d) Fase Kematian
Pada fase ini laju kematian lebih cepat daripada laju reproduksi. Jumlah
sel menurun secara geometrik. Penurunan kepadatan mikroalga ditandai dengan
perubahan kondisi optimum yang dipengaruhi oleh suhu, cahaya, pH air, jumlah
2.4. Kerangka Berfikir
Tingginya tingkat konsumsi tahu di Indonesia
Limbah cair tahu
Limbah cair tahu Berlimpah
Pemanfaatan limbah padat menjadi sumber pakan Pemanfaatan limbah cair
tahu sebagai medium kultur mikroalga Scenedesmus sp.
Produksi sel mikroalga Scenedesmus sp.
BAB III
METODE PENELITIAN
3.1. Tempat dan Waktu Pelaksanaan Penelitian
Penelitian ini dilaksanakan di Laboratorium Ekologi dan Laboratorium
Fisiologi Tumbuhan, Pusat Laboratorium Terpadu (PLT) Universitas Islam
Negeri Syarif Hidayatullah Jakarta. Adapun waktu penelitian adalah selama lima
bulan, mulai dari bulan Juni sampai dengan November 2009.
3.2. Bahan dan Alat
Bahan yang diperlukan adalah biota peliharaan yang digunakan berupa
mikroalga Scenedesmus sp. yang sebelumnya diisolasi terlebih dahulu dari danau
Agathis Universitas Indonesia, limbah cair tahu yang digunakan sebagai medium
kultur mikroalga berasal dari pabrik tahu sumedang “Mekar Sari” Pamulang-Tangerang Selatan, akuades steril, formalin, alkohol, alumunium foil. Bahan
kimia untuk Medium Basal Bold (MBB) berupa NaNO3, CaCl.2H2O,
MgSO4.7H2O, K2HPO4, KH2PO4, NaCl, EDTA, FeSO4.7H2O, H3BO3,
ZnSO4.7H2O, MoO3, CuSO4.5H2O, MnCl2.4H2O, Co(No3)2.6H2O , dan Medium
Ekstrak Tauge (MET).
Alat-alat yang digunakan adalah akuarium, wadah isolat Scenedesmus sp.
berupa akuarium, erlenmeyer, aerator, timbangan analitik, sentrifuge, autoclave,
(Improved Neubauer), object glass, cover glass, hand counter, thermometer, dan
luxmeter.
3.3. Rancangan Penelitian
Rancangan yang digunakan dalam penelitian ini adalah Rancangan Acak
Lengkap (RAL) yang terdiri atas enam perlakuan dan tiga kali ulangan. Variabel
yang digunakan dalam penelitian ini adalah variasi konsentrasi limbah cair tahu
dan kerapatan rata-rata jumlah sel mikroalga Scenedesmus sp. Berikut ini
merupakanperlakuan yang akan diberikan.
1. Perlakuan I : Limbah Cair Tahu konsentrasi 10%
2. Perlakuan II : Limbah Cair Tahu konsentrasi 20%
3. Perlakuan III : Limbah Cair Tahu konsentrasi 30%
4. Perlakuan IV : Limbah Cair Tahu konsentrasi 40%
5. Perlakuan V : Medium Basal Bold (MBB) sebagai kontrol positif.
6. Perlakuan VII : Akuades streril sebagai control negatif
3.4. Cara Kerja
3.4.1. Persiapan Alat
Erlenmeyer, tabung ukur, dan pipet yang akan digunakan dicuci,
dikeringkan, dan dibungkus dengan kertas kemudian disterilisasi menggunakan
3.4.2. Isolasi mikroalga Scenedesmus sp.
Untuk mengisolasi spesies yang diinginkan dari alam, diambil 5 liter air
danau Agathis UI Depok. Kemudian air danau tersebut dimasukkan ke dalam
wadah isolasi berupa akuarium dan ditambahkan dengan pupuk NPK yang
sebelumnya telah dilarutkan dengan akuades terlebih dahulu. Selanjutnya wadah
tersebut diletakkan di tempat terbuka yang terkena sinar matahari dan dimasukkan
selang aerator. Pembiakan mikroalga ini ditunggu hingga hari ke-4 setelah
didapatkannya biota yang diinginkan yaitu Scenedesmus sp.
3.4.3. Pembuatan Medium Basal Bold (MBB)
Sebelum membuat MBB, terlebih dahulu dibuat larutan stok MBB yang
terdiri atas :
a) NaNO3
b) CaCl2.2H2O
c) MgSO4.7H2O
d) K2HPO4
e) NaCl
f) Trace element EDTA dan KOH
g) Trace element FeSO4.7H2O
h) Trace element H3BO3
i) dan Trace element ZnSO4.5H2O, MoO3, CuSO4.5H2O, MnCl2.4H2O,
Larutan stok MBB ini dibuat dengan cara melarutkan bahan kimia sesuai
dengan komposisi medium yang ditetapkan (Tabel 11). Menurut Nichols (1973
dalam Damayanti, 2006), Pembuatan Medium Basal Bold (MBB) dilakukan
dengan cara menambahkan 10 ml dari setiap larutan stok makronutrien dan
mikronutrien ke dalam erlenmeyer 1 liter kemudian ditambahkan akuades.
Larutan yang telah dihomogenkan tersebut selanjutnya disterilisasi menggunakan
autoclave pada suhu 121oC dengan tekanan 2 atm selama 15 menit.
3.4.4. Pemurnian Scenedesmus sp.
Kultur Scenedesmus dimurnikan menggunakan metode pengenceran.
Sebanyak 1 ml biakan Scenedesmus dari hasil isolasi dimasukkan ke dalam
tabung reaksi yang berisi 9 ml MBB kemudian dicampur hingga homogen.
Selanjutnya dari kultur tersebut diambil 0,1 ml dan dimasukkan ke dalam tabung
reaksi ke dua. Proses ini dilakukan hingga tabung reaksi keempat. Kultur
selanjutnya diletakkan di rak kultur dan diinkubasi selama 14 hari. Kultur
Scenedesmus yang tumbuh dengan baik dan murni (tanpa kontaminan)
diperbanyak lagi secara bertahap hingga didapatkan 100 ml kultur murni
Scenedesmus (Damayanti, 2006).
3.4.5. Pembuatan Medium Ekstrak Tauge (MET)
Tauge kacang hijau seberat 100 gram dicuci di bawah air mengalir sampai
bersih, kemudian direbus di dalam air sebanyak 500 ml selama 1 jam. Air rebusan
(ekstraknya). Selanjutnya ekstrak tauge disterilisasi selama 15 menit dengan suhu
121oC. Medium ekstrak tauge yang dinginkan adalah dengan MET dengan
konsentrasi 4%. Dengan menggunakan rumus M1.V1=M2.V2 untuk membuat
MET 4% sebanyak 300 ml, maka dibutuhkan 12 ml ekstrak tauge yang di
tambahkan dengan aquades steril sebanyak 288 ml.
3.4.6. Perbanyakan Kultur Mikroalga Scenedesmus sp.
Dalam memperbanyak kultur mikroalga Scenedesmus sp. digunakan
medium ekstrak tauge (MET) 4% yang digunakan sebagai kultur starter.
Pemberian ekstrak tauge ini dilakukan secara kontinyu setiap 3-4 hari sebanyak
200-300 ml sampai tercukupinya kebutuhan akan sel-sel Scenedesmus sp. yang
akan diinokulasikan pada medium perlakuan.
3.4.7. Pembuatan Medium Limbah Tahu
Pembuatan medium limbah cair tahu dibuat sesuai perlakuan penelitian
yaitu, konsentrasi 0%, 10%, 20%, 30%, dan 40%, masing-masing perlakuan
dibutuhkan sebanyak 250 ml. Pembuatan limbah cair tahu adalah sebagai berikut :
a. 0% (250 ml medium MBB tanpa limbah cair tahu) sebagai kontrol positif
b. 0% (250 ml aquades steril) sebagai kontrol negatif
c. 10% (25 ml limbah cair tahu steril+ 225 ml akuades steril)
d. 20% (50 ml limbah cair tahu steril + 200 ml akuades steril)
e. 30% (75 ml limbah cair tahu steril + 175 ml akuades steril)
3.4.8. Inokulasi Scenedesmus sp.
Sel Scenedesmus sp. dari hasil pemurnian yang ditumbuhkan pada
medium ekstrak tuage (MET) disentrifugasi dengan kecepatan 5000 rpm selama
15 menit untuk memisahkan biomassa mikroalga Scenedesmus sp. dari media.
Supernatan dibuang dan endapan sel diinokulasikan ke dalam medium perlakuan
kontrol dan limbah cair tahu dengan jumlah sel antara 5x 104sel/ml. Berikut ini
cara penghitungan jumlah sel/ml yang akan di inokulasikan.
Inokulum yang dibutuhkan: 50.000 sel/ml
Volume kultur : 250 ml
Total sel yang dibutuhkan : 50.000 sel/ml x 250 ml = 12.500.000 sel/ml
1 ml = 2.905.000
x ml = 12.500.000
1/x = 2.905.000/12.500.000
x = 12.500.000/ 2.905.000
= 4,30 sel/ml
Jadi dalam pada setiap perlakuan akan dimasukkan 4,30 sel/ml kultur sel
Scenedesmus sp. ke dalam 250 medium perlakuan. Labu kultur diletakkan di rak
kultur dan diberi pencahayaan dari dua buah lampu TL masing-masing
berkekuatan 36 watt.
Gambar 5. Budidaya Mikroalga Skala Laboraotium Sumber: (Jusadi, 2003)
3.4.9. Penghitungan Jumlah Sel Scenedesmus sp.
Penghitungan jumlah sel untuk mendapatkan data kerapatan sel dilakukan
setiap 24 jam sekali mulai dari t0 (hari ke-0) hingga t10 (hari ke-10). Sebanyak 1
ml kultur diambil secara aseptik dari tiap-tiapperlakuan. Penghitungan jumlah sel
dilakukan dengan menggunakan kamar hitung Haemocytometer (Improved
Neubauer).
Rumus yang digunakan untuk menghitung kerapatan sel Scenedesmus sp.
adalah :
dalam Michael (1994)
Keterangan:
K = kerapatan sel Scenedesmus sp. (sel/ml)
n = jumlah total sel dalam 4 kotak kamar hitung Improved Neubauer (white)
p = adalah tingkat pengenceran yang digunakan.
Cara penghitungan kerapatan sel mikroalga adalah pertama-tama
Haemocytometer dibersihkan dan dipasang cover glass. Sampel air mikroalga
yang akan dihitung kerapatannya diteteskan dengan pipet pada bagian parit yang
mikroskop serta dilakukan penghitungan jumlah sel pada setiap bidang kotak (sel
darah putih/leukosit) dengan bantuan hand counter.
Gambar 6. Pola Kotakkan pada Haemocytometer (Improved Neubauer) Sumber: (Isnansetyo dan Kurniastuty, 1995)
3.4.10.Pengukuran pH medium
Pengukuran pH dilakukan setiap hari selama penelitian dengan cara
menyelupkan kertas pH universal ke dalam sampel kultur yang akan dihitung.
3.4.11. Pengukuran kondisi fisik ruang kultur
Pengukuran kondisi fisik ini dilakukan setiap hari selama penelitian.
Pengukuran ini meliputi suhu ruang (oC), kelembaban (%), dan intensitas cahaya
(lux).
3.4.12. Pembuatan Kurva Tumbuh
Pembuatan kurva tumbuh dilakukan setelah dilakukan kultur sampai hari
ke14 dengan cara mentransformasikan data dari rata-rata kerapatan pertumbuhan
3.6. Analisis Data
Data hasil pengamatan kerapatan jumlah sel Scenedesmus sp. diolah secara
statistik dengan menggunakan matode analisis sidik ragam dengan rancangan acak
lengkap pada taraf signifikansi 5%.
Hipotesis0 (H0) = parameter pada kontrol dan perlakuan tidak berbeda nyata.
Hipotesis1 (H1) = parameter pada kontrol dan perlakuan berbeda nyata.
Dasar penentuan keputusan:
1. Jika F hitung > F tabel maka Ho ditolak.
2. Jika F hitung < F tabel maka Ho diterima.
Jika hasil berbeda nyata maka dilakukan uji lanjutan dengan menggunakan uji
BAB IV
HASIL DAN PEMBAHASAN
4.1. Isolasi dan Perbanyakan Sel Scenedesmus sp.
Untuk mendapatkan isolat Scenedesmus sp. dilakukan pengambilan
sampel air di danau Agathis UI. Sebagai medium pertumbuhan digunakan akuades
yang di tambahkan dengan 1% pupuk NPK, karena untuk mendapatkan biomassa
mikroalga dibutuhkan unsur-unsur hara yang digunakan sebagai nutrisi dalam
pertumbuhannnya.
Setiap unsur mempunyai fungsi-fungsi khusus yang tercermin pada
pertumbuhan dan kerapatan yang dicapai dan pada kultur mikroalga N, P, dan K
termasuk hara makro yang dibutuhkan oleh mikrolaga (Isnansetyo dan
Kurniastuty,1995). Pemeliharaan mikroalga dalam tahap isolasi dilakukan
ditempat yang langsung terkena sinar matahari, karena cahaya sangat dibutuhkan
sebagai sumber energi dalam proses fotosintesis mikroalga (Darley, 1982).
Metode yang digunakan dalam mengisolasi mikroalga yang diinginkan
dalam hal ini Scenedesmus sp. adalah menggunakan metode pengenceran berseri
(Isnansetyo dan Kurniastuty, 1995). Pada proses isolasi Scenedesmus ini
digunakan medium basal bold (MBB) yang merupakan medium selektif bagi
pertumbuhan mikroalga khusunya dari divisi Chlorophyta atau alga hijau.
Penggunaan medium selektif ini sangat penting karena pada media ini hanya dapat
jenis-jenis lain (Suriawiria, 2005). Pemeliharaan dalam tahap isolasi ini dilakukan
selama 14 hari.
Setelah didapatkan isolat murni Scenedemus sp. akan dilakukan
perbanyakan sel. Dalam tahap perbanyakan sel ini digunakan medium ekstrak
tauge (MET) 4%, ini dilakukan berdasarkan penelitian Damayanti (2006) yang
menggunakan ekstrak tauge dalam kultur Scenedesmus sp. dan kerapatan sel yang
dihasilkan cukup tinggi. Selain itu perbanyakan kultur sel Scenedesmus sp.
dengan menggunakan medium ekstrak tauge (MET) juga mudah dilakukan serta
menghemat biaya bila dibandingkan dengan penggunaan bahan kimia sebagai
medium kultur.
Kultur Scenedemus sp. ini akan digunakan sebagai kultur stok yang
nantinya akan dipersiapkan untuk diinokulasikan kedalam medium perlakuan
yaitu limbah cair tahu. Pemeliharan kultur sel Scenedesmus sp. dilakukan pada
ruang kultur dengan kondisi yang disesuaikan untuk pertumbuhan sel
Scenedesmus sp. Suhu ruangan kultur selama penelitian berkisar antara 20-22 0C
(Tabel 13). Suhu tersebut masih berada dalam kisaran suhu yang optimal bagi
pertumbuhan sel Scenedesmus sp. karena suhu yang optimal untuk kultur
fitoplankton secara umum adalah antara 20-24 °C. Suhu ruangan untuk kultur ini
sangat penting bagi pertumbuhan mikroalga, Oh-Hama dan Miyachi (1992)
menyatakan bahwa suhu mempengaruhi aktivitas fisiologi membran tilakoid pada
kloroplas sehingga mempengaruhi kecepatan transpor elektron dalam proses
fotosintesis. Sedangkan kelembapan berkisar antara 55-65 % dengan intensitas
Scenedesmus sp. yang ditumbuhkan pada medium ekstrak tauge pada
awalnya berwarna hijau muda kemudian setelah hari ketujuh kultur Scenedesmus
sp. menjadi berwarna hijau tua yang pekat lihat (Gambar 12). Menurut Agustini
dan Kabinawa (1993), kadar klorofil meningkat sejalan dengan waktu kultur.
Warna hijau pada kultur menandakan bahwa pigmen fotosintesis (klorofil) ini
yang dominan dalam sel mikroalga tersebut (Sze, 1993). Sel Scenedemus sp. yang
dihasilkan pada medium ekstrak tauge ini tumbuh sangat baik dengan bentuk sel
yang utuh tanpa adanya kontaminasi mikroalga lainnya.
4.2. Rata-Rata Kerapatan Jumlah Sel Scenedesmus sp.
Pertumbuhan mikroalga diamati berdasarkan rata-rata kerapatan jumlah sel
Scenedesmus sp. Hasil penelitian pertumbuhan mikroalga Scenedesmus sp. pada
kontrol dan perlakuan yang menggunakan medium limbah cair tahu disajikan
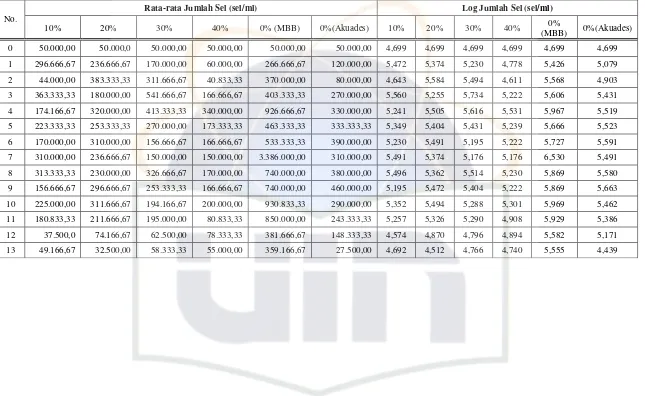
dalam data kerapatan rata-rata sel selama 13 hari pengamatan, lihat (Tabel 1).
Hasil penelitian menunjukan bahwa rata-rata kerapatan sel Scenedesmus sp. dalam
perlakuan limbah cair tahu bervariasi.
Hasil hasil analisis sidik ragam (Tabel 6) pada taraf nyata 5% menunjukan
bahwa terdapat pengaruh yang nyata terhadap konsentrasi limbah cair tahu, waktu
(hari), dan interaksi antara keduanya.
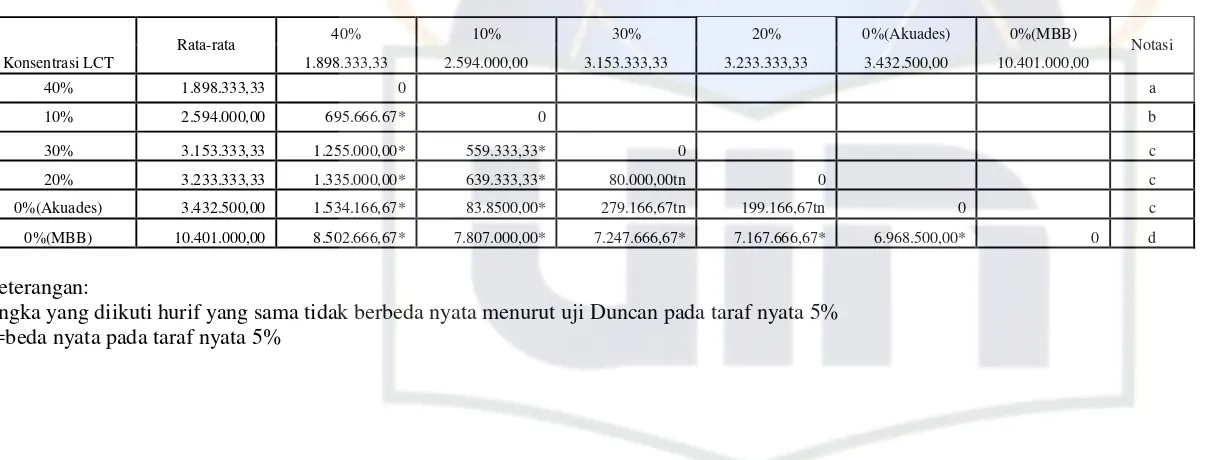
Hasil uji Duncan untuk konsentrasi berdasarkan jumlah kerapatan sel
Scenedesmus menunjukan bahwa terdapat perbedaan yang nyata pada konsentrasi
40% dengan konsentrasi 10%, 20%, 30%, kontrol (MBB), dan kontrol (akuades).
20%, 30%, kontrol (MBB), dan kontrol (akuades). Hal ini menunjukan bahwa
konsentrasi limbah cair tahu mempengaruhi pertumbuhan Scenedesmus sp.
Namun, pada konsentrasi 20% berdasarkan uji Duncan menunjukan tidak
terdapat perbedaan yang nyata terhadap konsentrasi 0% (akuades). Sama halnya
dengan konsentrasi 30% yang menunjukan tidak terdapat perbedaan yang nyata
dengan konsentrasi 20% dan 0% (akuades).
Unsur-unsur yang terdapat pada limbah cair tahu sangat dibutuhkan untuk
pertumbuhan Scenedesmus sp. karena unsur tersebut digunakan sebagai nutrisi
pertumbuhan. Berdasarkan daftar komposisi tahu Pranoto dalam Fatha (2007),
kandungan limbah cair tahu yang dihasilkan oleh industri tahu antara lain
kalsium, Phospor dan besi. Masing-masing unsur tersebut mempunyai
fungsi-fungsi khusus, unsur Kalsium dan Posphor penting untuk metabolisme
karbohidrat dan pembentukan protein. Unsur besi (Fe) penting bagi pembentukan
pigmen fotosintesis yaitu klorofil (Isnansetyo dan Kurniastuty, 1995).
Pengaruh konsentrasi medium memang terlihat nyata pada medium
perlakuan 40% yang konsentrasi limbah cair tahunya lebih tinggi, kerapatan
jumlah selnya paling rendah. Menurut (Chrismada dan Nofdianto, 1994)
penurunan pertumbuhan pada konsentrasi yang tinggi adalah karena konsentrasi
nutrien yang tinggi tersebut meracuni sel-sel mikroalga, sehingga keberadaan
nutrsi dalam konsentrasi yang tinggi malah menghambat pertumbuhan.
Perbedaan yang nyata juga terdapat pada konsentrasi limbah cair tahu 10%
dengan konsentrasi limbah cair tahu 20%, 30%, dan kontrol (MBB dan akuades).
nutrien dalam medium akibat pengenceran atau pemberian akuades steril pada
limbah cair tahu. Sehingga nutrisi menjadi faktor pembatas bagi pertumbuhan
yang akan berpengaruh terhadap kecepatan pertumbuhan dan ketersedian nutrien
yang cukup akan menyebabkan terjadinya pembelahan sel dengan cepat (Sriharti
dan Carolina, 2000).
Pada konsentrasi limbah cair tahu 20% dan 30% tidak menunjukan
perbedaan yang nyata. Hal ini diduga karena pengenceran yang dilakukan dengan
penambahan akuades ini mengurangi kepekatan limbah, sehingga sel dapat
menyerap nutrien dengan mudah.
Pada uji Duncan untuk lamanya waktu pengamatan terhadap jumlah
kerapatan sel menunjukan perbedaan yang nyata antara hari 0 dengan hari
ke-1 sampai hari ke-ke-13, begitupula pada hari ke-ke-13 terdapat perbedaan yang nyata
terhadap hari ke-1 sampai hari ke-11 kecuali pada hari ke-12 yang menunjukan
tidak berbeda nyata. Ini tampak dari notasi yang didapatkan pada uji Duncan, lihat
(Tabel 9) hari ke-0, hari ke-4, dan hari ke-7 memiliki notasi yang berbeda dengan
hari yang lain.
Perbedaan nyata yang tampak pada lamanya waktu pengamatan ini
membuktikan bahwa sesungguhnya sel Scenedesmus sp. dalam selang waktu
tertentu mencoba untuk beradaptasi dengan lingkungan. Perbedaan yang nyata
pada hari ke-0 dengan hari berikutnya selama pengamatan selama 13 hari
membuktikan bahwa pada awal inokulasi terdapat ketersedian nutrisi yang cukup
dalam media. Sama halnya dengan hari ke-4 dan hari ke-7. Selain itu faktor lain
sp. tersebut. Isnansetyo dan Kurniastuty (1995) menyatakan bahwa mikroalga
umumnya mempunyai daur hidup yang cukup singkat berkisar antara 3 sampai 7
hari setelah inokulasi. Untuk hari ke-13 menunjukan perbedaan yang nyata
dengan hari pertama sampai hari ke-11. Hal ini menunjukan bahwa setelah
meningkatnya pertumbuhan sel mengakibatkan semakin tingginya kebutuhan akan
nutrisi. Sementara ketersediaan nutrisi tidak bertambah, maka berakibat
terjadinya penurunan populasi mikroalga Scenedesmus sp.
Pada perlakuan kontrol (MBB) dan perlakuan limbah cair tahu terdapat
perbedaan waktu pada saat kerapatan tertinggi. Kontrol MBB (medium basal
bold) kerapatan tertinggi terjadi hari ke 9 sedangkan perlakuan limbah air tahu
antara hari ke 2 sampai hari ke 4. Kemungkinan hal ini terjadi karena pada
perlakuan kontrol MBB tidak terdapat unsur trace element EDTA yang berfungsi
sebagai ion pengelat atau sebagai unsur yang berfungsi untuk mengikat ion-ion
logam yang memang dibutuhkan mikroalga dalam metabolisme selnya
(Damayanti, 2006).
Rata-rata kerapatan sel Scenedesmus sp. pada ke enam perlakuan berbeda
yang dihitung pada saat puncak yaitu pada media limbah cair tahu 10% sebesar
363.333,33 sel/ml yang dicapai pada hari ke-3, 20% sebesar 383.333,33 sel/ml
yang dicapai pada hari ke-2, 30% sebesar 541.666,67 sel/ml yang dicapai pada
hari ke-3, 40% sebesar 340.000 sel/ml yang dicapai pada hari ke-4. Pada
perlakuan tanpa limbah cair tahu yaitu 0% (kontrol MBB) sebesar 930.833,33
sel/ml dicapai pada hari ke-10, dan 0% (kontrol akuades) sebesar 460.000 sel/ml
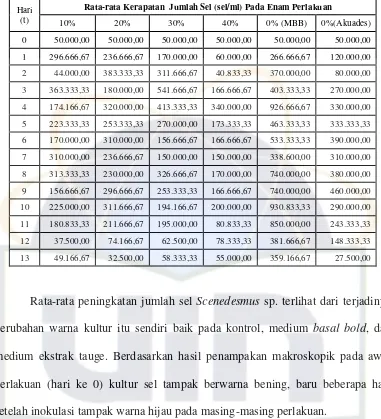
Tabel 1. Data rata-rata kerapatan pertumbuhan sel Scenedesmus sp. pada enam perlakuan (konsentrasi) yang berbeda selama 13 hari pengamatan.
Hari (t)
Rata-rata Kerapatan Jumlah Sel (sel/ml) Pada Enam Perlakuan
10% 20% 30% 40% 0% (MBB) 0%(Akuades)
0 50.000,00 50.000,00 50.000,00 50.000,00 50.000,00 50.000,00
1 296.666,67 236.666,67 170.000,00 60.000,00 266.666,67 120.000,00
2 44.000,00 383.333,33 311.666,67 40.833,33 370.000,00 80.000,00
3 363.333,33 180.000,00 541.666,67 166.666,67 403.333,33 270.000,00
4 174.166,67 320.000,00 413.333,33 340.000,00 926.666,67 330.000,00
5 223.333,33 253.333,33 270.000,00 173.333,33 463.333,33 333.333,33
6 170.000,00 310.000,00 156.666,67 166.666,67 533.333,33 390.000,00
7 310.000,00 236.666,67 150.000,00 150.000,00 338.600,00 310.000,00
8 313.333,33 230.000,00 326.666,67 170.000,00 740.000,00 380.000,00
9 156.666,67 296.666,67 253.333,33 166.666,67 740.000,00 460.000,00
10 225.000,00 311.666,67 194.166,67 200.000,00 930.833,33 290.000,00
11 180.833,33 211.666,67 195.000,00 80.833,33 850.000,00 243.333,33
12 37.500,00 74.166,67 62.500,00 78.333,33 381.666,67 148.333,33
13 49.166,67 32.500,00 58.333,33 55.000,00 359.166,67 27.500,00
Rata-rata peningkatan jumlah sel Scenedesmus sp. terlihat dari terjadinya
perubahan warna kultur itu sendiri baik pada kontrol, medium basal bold, dan
medium ekstrak tauge. Berdasarkan hasil penampakan makroskopik pada awal
perlakuan (hari ke 0) kultur sel tampak berwarna bening, baru beberapa hari
setelah inokulasi tampak warna hijau pada masing-masing perlakuan.
Berdasarkan pengamatan makroskopis (lampiran 7) tampak bahwa pada
seluruh perlakuan limbah cair tahu, kontrol MBB dan kontrol aquades pada akhir
pengamatan (hari ke-13) kultur tampak semakin hijau padahal rata-rata kerapatan
sel sudah menurun jumlahnya. Pemberian cahaya secara terus menerus selama
penelitian diduga dapat memacu peningkatan kadar klorofil. Tidak adanya fase
banyak dilakukan oleh kloroplas, sehingga klorofil sebagai pigmen penangkap
cahaya akan semakin banyak terbentuk (Irawati, 1998).
Pada pengamatan akhir limbah cair tahu yang digunakan sebagai medium
pertumbuhan Scenedesmus sp. di ketahui bahwa bau aroma limbah cair tahu telah
berkurang bahkan untuk perlakuan yang konsentrasi limbahnya lebih kecil bau
limbah tersebut telah hilang. Perubahan warna juga terjadi pada masing-masing
perlakuan, hampi semua limbah yang telah di tumbuhi Scenedesmus sp. ini telah
berubah warna menjadi hijau kecuali pada perlakuan limbah cair tahu 40% yang
masih tampak kekuningan.
Bila dibandingkan dengan penelitian Damayanti (2006) yang mengkultur
mikroalga Scenedesmus sp. dengan menggunakan medium ekstrak tauge,
kepadatan sel Scenedesmus sp.yang didapat dengan medium limbah cair tahu jauh
lebih rendah. Walaupun limbah cair tahu juga mengandung bahan organik sama
halnya dengan medium ekstrak tauge, namun faktor lingkungan berupa nilai pH
yang sangat rendah diduga sebagai penyebab terhambatnya pertumbuhan sel
Scenedesmus sp. Berbeda dengan medium ekstrak tauge yang mempunyai pH
cendrung mendekati netral yang memang sesuai untuk pertumbuhan
Scenedesmus sp.
4.3. Kurva Pertumbuhan Scenedesmus sp.
Berdasarkan pengamatan yang telah dilakukan terhadap pertumbuhan
didapatkan kurva pertumbuhan pada masing-masing perlakuan yang
ditransformasikan dalam bentuk logaritma.
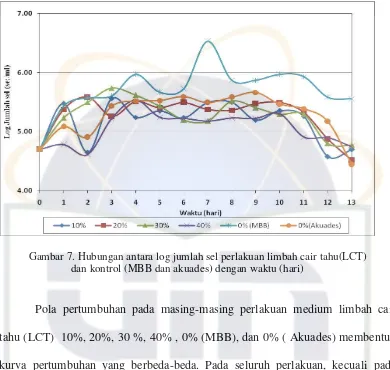
Gambar 7. Hubungan antara log jumlah sel perlakuan limbah cair tahu(LCT) dan kontrol (MBB dan akuades) dengan waktu (hari)
Pola pertumbuhan pada masing-masing perlakuan medium limbah cair
tahu (LCT) 10%, 20%, 30 %, 40% , 0% (MBB), dan 0% ( Akuades) membentuk
kurva pertumbuhan yang berbeda-beda. Pada seluruh perlakuan, kecuali pada
perlakuan limbah cair tahu 40% fase lag (adaptasi) tidak tampak nyata, karena
jumlah pertumbuhan biomassa sel langsung meningkat setelah hari ke-1. Hal ini
dapat terjadi karena kemungkinan fase lag ini berlangsung singkat kurang dari 24
jam sehingga tidak dapat diamati. Hal ini membuktikan bahwa sel Scenedesmus
sp. yang diinokulasikan kedalam medium limbah cair tahu (LCT) dan medium
membelah diri dengan cepat. Menurut (Fogg & Thake, 1987) lamanya fase lag
bergantung pada jumlah dan umur inokulum serta substrat yang digunakan
sebagai media.
Fase eksponensial pada masing-masing perlakuan tampak berbeda, untuk
perlakuan yang menggunakan medium limbah cair tahu (LCT) 10%, 20%, 30%,
40% kerapatan jumlah sel tertinggi adalah pada hari ke-2 sampai hari ke-4.
Berbeda dengan perlakuan kontrol, baik kontrol (MBB) atau akuades mengalami
fase eksponensial ini pada hari ke-10 dan hari ke-9. Fase eksponensial tertinggi
terdapat pada perlakuan 30% dan kontrol (MBB) sedangkan untuk seluruh
perlakuan yang menggunakan medium limbah cair tahu (LCT) kepadatan selnya
lebih rendah.
Peningkatan kerapatan jumlah sel Scenedesmus sp. pada periode awal
pertumbuhan disebabkan karena tersedianya nutrisi dalam media (Sriharti dan
Carolina, 2000). Menurut Graham dan Wilcox (2000), kandungan nutrisi pada
medium sangatlah penting. Unsur N berperan dalam pembentukan senyawa asam
amino dan klorofil, unsur P berperan dalam pembentukan ATP, DNA dan
fosfolipid pada sel sedangkan Cl dan Mg membantu proses fotosintesis.
Pada perlakuan yang kosentrasinya lebih rendah yaitu 10 % dan 20 %
kepadatan jumlah selnya lebih rendah, hal ini diduga terjadi karena rendahnya
nutrien yang terdapat dalam medium. Walaupun pada kondisi yang demikian,
sel-sel mikroalga dapat tetap tumbuh tetapi proses pembelahannya terhambat
(Chrismada dan Nofdianto, 1994). Pada medium kontrol (MBB) jumlah
dalam MBB (Lampiran 3) dapat memenuhi kebutuhan nutrien mikroalga. Dalam
penelitian ini juga tampak jelas pada perlakuan 20%, 30%, kontrol (MBB), dan
kontrol (akuades) mengalami beberapa kali fase peningkatan dan penurunan
kerapatan jumlah sel sehingga fase stasioner tidak tampak nyata. Jadi kerapatan
jumlah sel Scenedesmus sp. setelah fase lag mengalami fluktuasi kerapatan
jumlah sel. Fluktuasi kerapatan jumlah sel ini terjadi kemungkinan disebabkan
oleh perubahan nilai pH pada medium. Pertumbuhan sel Scenedesmus sp.
dipengaruhi oleh pH medium. Berdasarkan data pengukuran pH tampak bahwa
nilai pH seluruh perlakuan selama 13 hari mengalami perubahan . Nilai pH dari
masing-masing perlakuan mengalami peningkatan selama pengamatan
berlangsung.
Nilai pH medium pada perlakuan yang mengunakan limbah cair tahu 10%,
20%, 30% dan 40 % pada awalnya adalah 4 sampai pada hari ke-5 .Kemudian
nilai pH pada media limbah cair tahu yang konsentrasinya lebih rendah yaitu
10% dan 20% mulai mengalami peningkatan di hari ke-6 menjadi 5 hingga hari
ke-9, sedangkan untuk media limbah cair tahu yang konsentrasinya lebih tinggi,
yaitu 30% dan 40% nilai pHnya tetap yaitu 4. Kenaikan nilai pH itu berlanjut
hingga nilai pH pada medium limbah cair tahu mendekati pH netral yaitu 6,
kecuali pada medium limbah cair tahu konsentrasi 40% nilai pH tertingginya
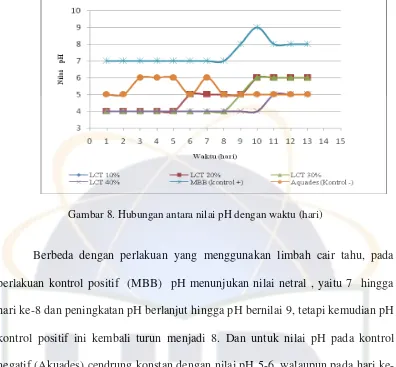
Gambar 8. Hubungan antara nilai pH dengan waktu (hari)
Berbeda dengan perlakuan yang menggunakan limbah cair tahu, pada
perlakuan kontrol positif (MBB) pH menunjukan nilai netral , yaitu 7 hingga
hari ke-8 dan peningkatan pH berlanjut hingga pH bernilai 9, tetapi kemudian pH
kontrol positif ini kembali turun menjadi 8. Dan untuk nilai pH pada kontrol
negatif (Akuades) cendrung konstan dengan nilai pH 5-6, walaupun pada hari
ke-9 pH turun menjadi 5.
Pada awal penelitian nilai pH untuk perlakuan 10%, 20%, 30% dan 40%
bersifat asam yaitu 4, kemudian di hari ke-6 dan ke-10 pH meningkat menjadi 5
dan 6. Kemungkinan pH yang awalnya asam ini menyebabkan terganggunya
proses metabolisme sel pada awal inokulasi, sehingga menyebabkan kemampuan
sel untuk menyerap nutrien tidak optimal dan mempengaruhi proses pertumbuhan
sel selanjutnya (Putri, 2005).
Peningkatan nilai pH dapat terjadi karena terjadinya penguraian protein
Nitrit (NO2-) (Darley, 1982). Menurut Goldman & Horne (1983), peningkatan
nilai pH ini terjadi karena adanya aktivitas fotosintesis dari mikroalga, pada saat
dilakukan fotosintesis yang menggunakan CO2, karbonat (CO32-) dan bikarbonat
(HCO3-). Penyerapan CO2 bebas dan bikarbonat ini dapat menyebabkan
penurunan konsentrasi CO2 terlarut sehingga akan meningkatkan nilai pH
(Sze,1993).
Fase kematian ini diawali dengan berkurangnya kerapatan sel. Sel-sel alga
mengalami kematian dan materi organik yang bersifat menghambat pertumbuhan
dilepaskan oleh sel-sel alga (Becker, 1994). Berkurangnya kerapatan jumlah sel
Scenedesmus sp. ini ditandai dengan perubahan kondisi optimum yang
dipengaruhi oleh temperatur, cahaya, pH, dan ketersediaan nutrisi (Isnansetyo dan
Kurniastuty, 1995).
Pada masing-masing perlakuan mengalami fase kematian yang ditandai
dengan semakin menurunnya kerapatan sel. Pada fase kematian ini rata-rata
dimulai pada hari ke-11 sampai hari ke-13, kecuali pada perlakuan 10% jumlah
kerapatan selnya masih mengalami peningkatan. Peningkatan kerapatan sel
kembali setelah mengalami fase stasioner diduga sel-sel Scenedesmus sp.
mengalami periode kriptik, yaitu sel-sel yang masih hidup memanfaatkan
tambahan nutrisi dari sel-sel yang lisis untuk pertumbuhannya (Suantika dan
Hendrawandi, 2008). Terjadinya penurunan kerapatan sel ini diduga karena
semakin melimpahnya zat padatan tersuspensi di dalam medium sehingga
menghambat cahaya yang masuk kedalam medium yang menyebabkan sel
dengan penelitian yang dilakukan oleh Johari (1999), yang juga mengalami
penurunan kerapatan pada kultur sel Chlorella sp. karena adanya zat padatan yang
tersuspensi dalam medium limbah cair tahu.
Selain itu umur kultur juga diduga sebagai pemicu terjadinya fase
kematian pada kultur perlakuan. Serta mulai tumbuhnya kontaminan dalam kultur,
terutama dari golongan Cilliata. Dalam penelitian Suantika dan Hendrawandi,
(2008), kontaminan dalam kultur berasal dari golongan Cilliata yang mampu
memanfaatkan bahan-bahan organik (sel mati dan hasil metabolit) dan juga bahan
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Berdasarkan hasil penelitian pengaruh konsentrasi limbah cair tahu
sebagai medium pertumbuhan terhadap kerapatan sel mikroalga Scenedesmus sp.
dapat disimpulkan bahwa :
1. Sel Scenedesmus sp. memiliki kemampuan untuk beradaptasi dan
hidup pada medium limbah cair tahu, sehingga medium ini dapat
dijadikan sebagai medium alternatif untuk pertumbuhan mikroalga
Scenedesmus sp.
2. Hasil analisis sidik ragam pada taraf nyata 5% terdapat perbedaan
pertumbuhan sel Scenedesmus sp. diantara keenam konsentrasi limbah
cair tahu yang digunakan (10%, 20%, 30% dan 40%) dengan kontrol
(Medium Basal Bold dan Akuades). Pertumbuhan sel tertinggi berada
pada konsentrasi limbah cair tahu 30% dan Medium Basal Bold
(kontrol positif).
5.2. Saran
Dari hasil penelitian dapat disarankan untuk:
1. Dilakukan analis kandungan klorofil sel Scenedesmus sp. serta
kandungan gizinya.
2. Memperhatikan faktor pH pada kultur mikroalga Scenedesmus sp.
3. Dilakukan analisis limbah cair tahu sebelum dan sesudah dipakai
DAFTAR PUSTAKA
Agustini, N.W.S dan I.N.K. Kabinawa 1993. Pengaruh Konsentrasi Nitrat sebagai Sumber N dalam Media Kultur terhadap Pembentukan As. Arakidonat dari Mikroalga Poryphyridium cruentum. Jurnal: Pusat Penelitian Bioteknologi-LIPI, Bogor.
Anonim.2008.http:///www.dr-ralf-wagner.de/Bilder/Scenedesmus_longispina.jpg. Tanggal 13Mei 2009 pukul 16:45
Aspuranto.1989. Identifikasi dan Studi Peranan Mikroalga Dalam Proses Stabilisasi Mikrobiologis Beberapa Jenis Limbah Cair. Skripsi: Fakultas Teknologi Pertanian IPB,Bogor.
Bachtiar, E. 2007. Penelusuran Sumber Daya Hayati Laut (Alga) Sebagai Biotarget Industi. Makalah: Universitas Padjajaran, Bandung.
Becker, E.W. 1994. Microalgae.: Biotechnology dan Microbiology. Cambridge University Press, Cambridge.
Bold, H.C dan M, J. Wynne. 1985. Introduction to The Algae Structure and Reproduction. Prentice-Hall Inc,New Jersey.
Coetteau, P. 1998. Alga Production. University of Gent, Rome.
Chrismandha,T. dan Nofdianto, 1994. Pengaruh Konsentrasi Nutrien Terhadap Pertumbuhan dan Produktifitas Chlorella sp pada system Kultur Semikontinyu. Limnotek perikanan darat Tropis di Indonesia, Bogor.
Citroreksono,P.1996.Pengantar Bioremediasi. Prosiding:Pelatihan dan Lokakarya Peranan Bioremediasi dalam Pengelolaan Lingkungan. Puslitbang Bioteknologi-LIPI Cibonong.1-11
Dahiyat. 1990. Kandungan Limbah Cair Pabrik Tahu dan Pengolahannya dengan Eceng Gondok (Eicchornia craaipers (Mart) Solms). Tesis : Program Pasca Sajana IPB, Bogor.
Damayanti, D. 2006 . Pengaruh Beberapa Konsentrasi Medium Ekstrak Tauge Terhadap Kerapatan Sel Mikroalga Marga Scenedesmus Meyen Selama 10 hari Pengamatan. Skripsi: Universitas Indonesia, Depok.
Darley, W.M. 1982. Alga Biology: A Physiological Approach. Black Well Scientific Publications, London.
Fatha A. 2007. Pemanfaatan Zeolit Aktif Untuk Menurunkan BOD dan COD Limbah Tahu. Skripsi: Universitas Negeri Semarang, Semarang.
Foog, G.E. dan B.Thake.1987. Algal Cultures and phytoplankton ecology 3rd .The Univ. of Wisconsin Press, London.
Goldman, C.R. dan A. J. Horne. 1983. Limnology. McGraw-Hill Inc., Auckland.
Graham, L.E & L, W. Wilcox. 2000 . Algae.Prentice Hall, New Jersey
Hariyadi, P. 2002 . Pemanfaatan Limbah Cair Tahu Untuk Memproduksi Ingredien Pangan Fungsional. Karya Ilmiah: IPB, Bogor.
Irawati, R.P. 1998. Pengaruh Limbah cair Pabrik Karet Terhadap kadar Kadar Klorofil Chorella pyrenoidosa Chick. Skripsi: Universitas Indonesia, Depok.
Isnansetyo A. dan Kurniastuty. 1995. Teknik Kultur Phytoplankton & Zoozplankton Pakan Alami Untuk Pembenihan Organisme Laut. Kanisius, Yogyakarta.
Jenie, B.S.L dan W.P. Rahayu. 1993. Penanganan Limbah Industri Pangan. Pusat Antar Universitas Pangan dan Gizi IPB, Bogor.
Johari, A.I. 1999. Pengaruh Beberapa Konsentrasi Limbah Cair Tahu Terhadap Pertumbuhan Chlorella sp. Skripsi: Univ. Indonesia, Depok.
John, D.M., B.A. Whitton dan A.J. Brook. 2002 . The Freshwater AlgaFlora of the British Isles. The Natural History & The British Phycological Society, United Kingdom.
Jusadi, D. 2003. Modul: Budidaya Pakan Alami Air Tawar (Budidaya Chorella). Departemen Pendidikan Nasional, Jakarta.
Kantor Pengkajian Perkotaan Dan Lingkungan (KPPL) DKI Jakarta. 1995. Laporan pengolahan limbah organik (industri tahu). Kerjasama Kantor Pengkajian Perkotaan dan Lingkungan DKI Jakarta dengan Puslitek ITB, Jakarta.