AKUMULASI HIDROKARBON AROMATIK POLISIKLIK
(PAH) DALAM KERANG HIJAU (
Perna viridis L
.) DI
PERAIRAN KAMAL MUARA, TELUK JAKARTA
Oleh :
Dina Augustine C64103031
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul:
AKUMULASI HIDROKARBON AROMATIK POLISIKLIK (PAH) DALAM KERANG HIJAU (Perna viridis L.) DI PERAIRAN KAMAL MUARA, TELUK JAKARTA
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, 2008
RINGKASAN
DINA AUGUSTINE. Akumulasi Hidrokarbon Aromatik Polisiklik (PAH) dalam kerang hijau (Perna viridis L.) di perairan Kamal Muara, Teluk Jakarta. Dibimbing oleh TRI PRARTONO dan HARPASIS SLAMET SANUSI
Penelitian ini dilakukan untuk mengidentifikasi jenis-jenis senyawa PAH yang terakumulasi dalam tubuh organisme kerang hijau di perairan Teluk Jakarta dan keterkaitannya dengan kualitas air laut di perairan tersebut. Hal ini didasarkan pada kenyataan akan informasi PAH yang masih terbatas di wilayah penelitian (Kamal Muara) sebagai salah satu wilayah dimana limbah industri mengalir dan tempat kegiatan pembesaran kerang hijau (Perna viridis).
Penelitian dilakukan pada bulan Mei sampai Agustus 2007 dan terbagi menjadi 2 bagian yakni pengambilan contoh biota dan air laut serta analisis laboratorium. Pengambilan contoh biota dilakukan sebanyak 5 kali yang dibagi menjadi 4 selang ukuran (1,0-1,5; 2,5-3,0; 4,0-4,5 dan 5,5-6,0 cm) dalam selang waktu 2 minggu dan pengambilan contoh air laut dilakukan sebanyak 3 kali setiap 4 minggu sekali di daerah budidaya kerang hijau tepatnya di Kamal Muara, Perairan Teluk Jakarta. Analisis contoh dilakukan selama bulan Juli sampai Agustus di Laboratorium Lingkungan danGas Chromatography(GC), Bidang Proses, Pusat Penelitian dan Pengembangan Teknologi Minyak dan Gas Bumi ”Lemigas”, Jakarta Selatan. Dalam penelitian, beberapa parameter fisika dan kimia pendukung diukur seperti salinitas, pH dan Total padatan tersuspensi (TSS). Metode yang digunakan untuk preparasi contoh air laut dan kerang hijau adalah
Environmental Protection Agencyatau EPA nomor 3510c untuk air laut, nomor 3540 untuk kerang hijau dan nomor 8270d untuk analisis PAH dengan
Kromatografi Gas Detektor Spektrofotometri Massa (GC-MS) dalam air laut dan kerang hijau.
AKUMULASI HIDROKARBON AROMATIK POLISIKLIK
(PAH) DALAM KERANG HIJAU (
Perna viridis L
.) DI
PERAIRAN KAMAL MUARA, TELUK JAKARTA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Ilmu dan Teknologi Kelautan
Oleh :
Dina Augustine C64103031
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : AKUMULASI HIDROKARBON AROMATIK POLISIKLIK (PAH) DALAM KERANG HIJAU (Perna viridis L.) DI PERAIRAN KAMAL
MUARA, TELUKJAKARTA
Nama Mahasiswa : Dina Augustine
Nomor Pokok : C64103031
Disetujui,
Pembimbing I Pembimbing II
Dr. Ir. Tri Prartono, M.Sc Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc
NIP. 131 578 849 NIP. 130 536 669
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indrajaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji syukur penulis ucapkan ke hadirat Tuhan Yang Maha Kuasa atas berkat, rahmat dan karunia yang telah diberikan kepada penulis dapat
menyelesaikan Skripsi yang berjudul ”Akumulasi Hidrokarbon Aromatik Polisiklik (PAH) dalam Kerang Hijau (Perna viridis L.) di Perairan Kamal Muara, Teluk Jakarta.”
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana selama belajar di Program Studi Ilmu Kelautan, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan IPB. Dalam penyusunan skripsi ini, penulis banyak menerima bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada :
1. Dr. Ir. Tri Prartono, M.Sc dan Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc selaku dosen pembimbing yang telah memberikan saran, masukan serta bimbingan spiritual selama proses penelitian dan penulisan.
2. Dr.Ir. Yusli Wardiatno, M.Sc selaku dosen penguji tamu dan Dr.Ir. Jonson Lumban Gaol, M.Si selaku komisi pendidikan yang telah memberi banyak masukan dan saran kepada penulis untuk menjadikan skripsi ini lebih baik. 3. Dra. Roza Adriany, M.Si dan Staf Laboratorium Kromatografi PPTMGB
Lemigas selaku pembimbing lapang yang telah memberikan bimbingan dan arahan selama proses penelitian.
4. Kedua orang tua yang telah memberikan dukungan moril dan materi yang tak ternilai harganya dan teman-teman seperjuangan ITK 40 yang telah memberikan dukungan dan semangat kepada Penulis.
Akhir kata, Penulis mengharapkan saran dan kritik yang membangun dari semua pihak untuk kesempurnaan dan perbaikan di masa mendatang.
Bogor, September 2008
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN... xii
1. PENDAHULUAN... 1
1.1 Latar belakang ... 1
1.2 Tujuan ... 2
2. TINJAUAN PUSTAKA ... 3
2.1 Kerang hijau (Perna viridisL.) ... 3
2.1.1 Klasifikasi dan morfologi kerang hijau (Perna viridisL.) ... 3
2.1.2 Habitat dan distribusi kerang hijau (Perna viridisL.) ... 4
2.1.3 Faktor lingkungan yang mempengaruhi ... 6
2.2 Pencemaran laut oleh senyawa PAH ... 6
2.2.1 Sumber PAH ... 6
2.2.2 Karakteristik PAH ... 7
2.2.3 Distribusi PAH ... 10
2.2.4 Toksisitas senyawa PAH ... 12
3. BAHAN DAN METODE... 13
3.1 Waktu dan tempat ... 13
3.2 Kondisi lokasi penelitian ... 13
3.3 Bahan dan alat ... 15
3.4 Pengumpulan data ... 15
3.4.1 Penentuan lokasi pengambilan contoh ... 15
3.4.2 Teknik pengambilan contoh ... 15
3.4.3 Analisis parameter pendukung ... 17
3.4.4 Analisis PAH ... 17
3.5 Analisis data ... 20
3.5.1 Metode grafik ... 20
3.5.2 Metode analisis PAH... 20
4. HASIL DAN PEMBAHASAN... 21
4.1 Hasil ... 21
4.1.1 Parameter fisika dan kimia... 21
4.1.2Polycyclic Aromatic Hydrocarbon(PAH) ... 24
4.1.3 Faktor biokonsentrasi PAH... 40
5. KESIMPULAN DAN SARAN... 49
5.1 Kesimpulan ... 49
5.2 Saran... 50
DAFTAR PUSTAKA... 51
LAMPIRAN... 54
DAFTAR TABEL
Halaman
1. Konsentrasi PAH dalam air, biota dan sedimen... 11
2. Parameter pendukung yang akan dianalisis ... 17
3. Konsentrasi total senyawa PAH dalamρg L-1dalam air laut per
stasiun di perairan Kamal Muara, Teluk Jakarta ... 26
4. Konsentrasi total senyawa PAH dalam µg g-1berat basah pada
kerang hijau per stasiun di perairan Kamal Muara, Teluk Jakarta ... 31
DAFTAR GAMBAR
Halaman
1. Senyawa PAH dengan berat molekul rendah (Σcincin < 4 buah)
dan tinggi (Σcincin≥4 buah) ... 8
2. Peta lokasi penelitian dan letak stasiun pengambilan contoh
di perairan Kamal Muara, Teluk Jakarta ... 14
3. Nilai rerata dan kisaran salinitas di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2... 21
4. Nilai rerata dan kisaran pH di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2 ... 23
5. Nilai rerata dan kisaran TSS di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2... 24
6. Diagram cakram komposisi PAH rerata di perairan Kamal Muara, Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2 ... 25
7. Diagram batang konsentrasi PAH (ρg L-1) dalam contoh air laut
menurut waktu pengambilan di Stasiun 1 (a) dan Stasiun 2 (b)... 26
8. Diagram batang komposisi senyawa PAH rerata dalam kerang hijau di Stasiun 1 (a) dan 2 (b) perairan Kamal Muara,
Teluk Jakarta ... 29
9. Contoh kromatogram total ion 7 senyawa PAH dalam kerang
hijau di Stasiun 1 (ukuran 1,0-1,5 cm pengambilan 1) ... 30
10. Diagram batang komposisi PAH dalam 4 ukuran tubuh kerang
hijau (Perna viridis) pada 2 waktu pengambilan di Stasiun 1 ... 32 11. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh
kerang hijau (Perna viridis) pada 3 waktu pengambilan
di Stasiun 2... 33
12. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh kerang hijau (Perna viridis) pada 2 waktu pengambilan
AKUMULASI HIDROKARBON AROMATIK POLISIKLIK
(PAH) DALAM KERANG HIJAU (
Perna viridis L
.) DI
PERAIRAN KAMAL MUARA, TELUK JAKARTA
Oleh :
Dina Augustine C64103031
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Skripsi yang berjudul:
AKUMULASI HIDROKARBON AROMATIK POLISIKLIK (PAH) DALAM KERANG HIJAU (Perna viridis L.) DI PERAIRAN KAMAL MUARA, TELUK JAKARTA
adalah benar merupakan hasil karya sendiri dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Semua sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Skripsi ini.
Bogor, 2008
RINGKASAN
DINA AUGUSTINE. Akumulasi Hidrokarbon Aromatik Polisiklik (PAH) dalam kerang hijau (Perna viridis L.) di perairan Kamal Muara, Teluk Jakarta. Dibimbing oleh TRI PRARTONO dan HARPASIS SLAMET SANUSI
Penelitian ini dilakukan untuk mengidentifikasi jenis-jenis senyawa PAH yang terakumulasi dalam tubuh organisme kerang hijau di perairan Teluk Jakarta dan keterkaitannya dengan kualitas air laut di perairan tersebut. Hal ini didasarkan pada kenyataan akan informasi PAH yang masih terbatas di wilayah penelitian (Kamal Muara) sebagai salah satu wilayah dimana limbah industri mengalir dan tempat kegiatan pembesaran kerang hijau (Perna viridis).
Penelitian dilakukan pada bulan Mei sampai Agustus 2007 dan terbagi menjadi 2 bagian yakni pengambilan contoh biota dan air laut serta analisis laboratorium. Pengambilan contoh biota dilakukan sebanyak 5 kali yang dibagi menjadi 4 selang ukuran (1,0-1,5; 2,5-3,0; 4,0-4,5 dan 5,5-6,0 cm) dalam selang waktu 2 minggu dan pengambilan contoh air laut dilakukan sebanyak 3 kali setiap 4 minggu sekali di daerah budidaya kerang hijau tepatnya di Kamal Muara, Perairan Teluk Jakarta. Analisis contoh dilakukan selama bulan Juli sampai Agustus di Laboratorium Lingkungan danGas Chromatography(GC), Bidang Proses, Pusat Penelitian dan Pengembangan Teknologi Minyak dan Gas Bumi ”Lemigas”, Jakarta Selatan. Dalam penelitian, beberapa parameter fisika dan kimia pendukung diukur seperti salinitas, pH dan Total padatan tersuspensi (TSS). Metode yang digunakan untuk preparasi contoh air laut dan kerang hijau adalah
Environmental Protection Agencyatau EPA nomor 3510c untuk air laut, nomor 3540 untuk kerang hijau dan nomor 8270d untuk analisis PAH dengan
Kromatografi Gas Detektor Spektrofotometri Massa (GC-MS) dalam air laut dan kerang hijau.
AKUMULASI HIDROKARBON AROMATIK POLISIKLIK
(PAH) DALAM KERANG HIJAU (
Perna viridis L
.) DI
PERAIRAN KAMAL MUARA, TELUK JAKARTA
SKRIPSI
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Ilmu dan Teknologi Kelautan
Oleh :
Dina Augustine C64103031
PROGRAM STUDI ILMU DAN TEKNOLOGI KELAUTAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
Judul Skripsi : AKUMULASI HIDROKARBON AROMATIK POLISIKLIK (PAH) DALAM KERANG HIJAU (Perna viridis L.) DI PERAIRAN KAMAL
MUARA, TELUKJAKARTA
Nama Mahasiswa : Dina Augustine
Nomor Pokok : C64103031
Disetujui,
Pembimbing I Pembimbing II
Dr. Ir. Tri Prartono, M.Sc Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc
NIP. 131 578 849 NIP. 130 536 669
Mengetahui,
Dekan Fakultas Perikanan dan Ilmu Kelautan
Prof. Dr. Ir. Indrajaya, M.Sc NIP. 131 578 799
KATA PENGANTAR
Puji syukur penulis ucapkan ke hadirat Tuhan Yang Maha Kuasa atas berkat, rahmat dan karunia yang telah diberikan kepada penulis dapat
menyelesaikan Skripsi yang berjudul ”Akumulasi Hidrokarbon Aromatik Polisiklik (PAH) dalam Kerang Hijau (Perna viridis L.) di Perairan Kamal Muara, Teluk Jakarta.”
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar sarjana selama belajar di Program Studi Ilmu Kelautan, Departemen Ilmu dan Teknologi Kelautan, Fakultas Perikanan dan Ilmu Kelautan IPB. Dalam penyusunan skripsi ini, penulis banyak menerima bantuan dari berbagai pihak. Oleh karena itu, penulis mengucapkan banyak terima kasih kepada :
1. Dr. Ir. Tri Prartono, M.Sc dan Prof. Dr. Ir. Harpasis S. Sanusi, M.Sc selaku dosen pembimbing yang telah memberikan saran, masukan serta bimbingan spiritual selama proses penelitian dan penulisan.
2. Dr.Ir. Yusli Wardiatno, M.Sc selaku dosen penguji tamu dan Dr.Ir. Jonson Lumban Gaol, M.Si selaku komisi pendidikan yang telah memberi banyak masukan dan saran kepada penulis untuk menjadikan skripsi ini lebih baik. 3. Dra. Roza Adriany, M.Si dan Staf Laboratorium Kromatografi PPTMGB
Lemigas selaku pembimbing lapang yang telah memberikan bimbingan dan arahan selama proses penelitian.
4. Kedua orang tua yang telah memberikan dukungan moril dan materi yang tak ternilai harganya dan teman-teman seperjuangan ITK 40 yang telah memberikan dukungan dan semangat kepada Penulis.
Akhir kata, Penulis mengharapkan saran dan kritik yang membangun dari semua pihak untuk kesempurnaan dan perbaikan di masa mendatang.
Bogor, September 2008
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL... ix
DAFTAR GAMBAR... x
DAFTAR LAMPIRAN... xii
1. PENDAHULUAN... 1
1.1 Latar belakang ... 1
1.2 Tujuan ... 2
2. TINJAUAN PUSTAKA ... 3
2.1 Kerang hijau (Perna viridisL.) ... 3
2.1.1 Klasifikasi dan morfologi kerang hijau (Perna viridisL.) ... 3
2.1.2 Habitat dan distribusi kerang hijau (Perna viridisL.) ... 4
2.1.3 Faktor lingkungan yang mempengaruhi ... 6
2.2 Pencemaran laut oleh senyawa PAH ... 6
2.2.1 Sumber PAH ... 6
2.2.2 Karakteristik PAH ... 7
2.2.3 Distribusi PAH ... 10
2.2.4 Toksisitas senyawa PAH ... 12
3. BAHAN DAN METODE... 13
3.1 Waktu dan tempat ... 13
3.2 Kondisi lokasi penelitian ... 13
3.3 Bahan dan alat ... 15
3.4 Pengumpulan data ... 15
3.4.1 Penentuan lokasi pengambilan contoh ... 15
3.4.2 Teknik pengambilan contoh ... 15
3.4.3 Analisis parameter pendukung ... 17
3.4.4 Analisis PAH ... 17
3.5 Analisis data ... 20
3.5.1 Metode grafik ... 20
3.5.2 Metode analisis PAH... 20
4. HASIL DAN PEMBAHASAN... 21
4.1 Hasil ... 21
4.1.1 Parameter fisika dan kimia... 21
4.1.2Polycyclic Aromatic Hydrocarbon(PAH) ... 24
4.1.3 Faktor biokonsentrasi PAH... 40
5. KESIMPULAN DAN SARAN... 49
5.1 Kesimpulan ... 49
5.2 Saran... 50
DAFTAR PUSTAKA... 51
LAMPIRAN... 54
DAFTAR TABEL
Halaman
1. Konsentrasi PAH dalam air, biota dan sedimen... 11
2. Parameter pendukung yang akan dianalisis ... 17
3. Konsentrasi total senyawa PAH dalamρg L-1dalam air laut per
stasiun di perairan Kamal Muara, Teluk Jakarta ... 26
4. Konsentrasi total senyawa PAH dalam µg g-1berat basah pada
kerang hijau per stasiun di perairan Kamal Muara, Teluk Jakarta ... 31
DAFTAR GAMBAR
Halaman
1. Senyawa PAH dengan berat molekul rendah (Σcincin < 4 buah)
dan tinggi (Σcincin≥4 buah) ... 8
2. Peta lokasi penelitian dan letak stasiun pengambilan contoh
di perairan Kamal Muara, Teluk Jakarta ... 14
3. Nilai rerata dan kisaran salinitas di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2... 21
4. Nilai rerata dan kisaran pH di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2 ... 23
5. Nilai rerata dan kisaran TSS di perairan Kamal Muara,
Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2... 24
6. Diagram cakram komposisi PAH rerata di perairan Kamal Muara, Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2 ... 25
7. Diagram batang konsentrasi PAH (ρg L-1) dalam contoh air laut
menurut waktu pengambilan di Stasiun 1 (a) dan Stasiun 2 (b)... 26
8. Diagram batang komposisi senyawa PAH rerata dalam kerang hijau di Stasiun 1 (a) dan 2 (b) perairan Kamal Muara,
Teluk Jakarta ... 29
9. Contoh kromatogram total ion 7 senyawa PAH dalam kerang
hijau di Stasiun 1 (ukuran 1,0-1,5 cm pengambilan 1) ... 30
10. Diagram batang komposisi PAH dalam 4 ukuran tubuh kerang
hijau (Perna viridis) pada 2 waktu pengambilan di Stasiun 1 ... 32 11. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh
kerang hijau (Perna viridis) pada 3 waktu pengambilan
di Stasiun 2... 33
12. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh kerang hijau (Perna viridis) pada 2 waktu pengambilan
13. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh kerang hijau (Perna viridis) pada 3 waktu pengambilan
di Stasiun 2... 35
14. Grafik sebaran berat tubuh dengan panjang tubuh kerang hijau
(Perna viridis) di Stasiun 1 (a) dan Stasiun 2 (b) ... 38 15. Grafik sebaran konsentrasi PAH kerang hijau
(Perna viridis) menurut 4 kisaran panjang tubuh di Stasiun 1 (a) dan Stasiun 2 (b). ... 39
16. Grafik sebaran kandungan PAH (µg) di tiap berat individu
kerang hijau (Perna viridis) (a) Stasiun 1 (b) Stasiun 2 ... 43 17. Grafik sebaran konsentrasi PAH dalam berat tubuh kerang hijau
(Perna viridis) (a) Stasiun 1 (b) Stasiun 2 ... 45 18. Grafik hubungan salinitas perairan Kamal Muara dan konsentrasi
PAH dalam air laut di Stasiun 1 (kiri) dan 2 (kanan) ... 47
19. Grafik hubungan TSS perairan Kamal Muara dan konsentrasi
DAFTAR LAMPIRAN
Halaman
1. Data parameter fisik dan kimia air laut di perairan Kamal Muara,
Teluk Jakarta... 54
2. Hasil perhitungan konsentrasi PAH (µg L-1) dalam air ... 54
3. Hasil perhitungan konsentrasi PAH (µg g-1) dalam kerang hijau .. 56
4. Data berat tubuh dan konsentrasi total 7 senyawa PAH pada
kerang hijau di Stasiun 1... 63
5. Data berat tubuh dan konsentrasi total 7 senyawa PAH pada
kerang hijau di Stasiun 2... 66
6. Prosedur analisis PAH pada air dan biota... 70
7. Prosedur analisis TSS ... 71
8. Kromatografi... 72
9. Kromatogram ion total 7 senyawa PAH dalam contoh air laut ... 76
10. Kromatogram ion total 7 senyawa PAH dalam contoh
kerang hijau... 79
11. Foto lokasi penelitian ... 99
1. PENDAHULUAN
1.1 Latar belakang
Keberadaan suatu organisme pada suatu perairan dapat mengindikasikan
kualitas perairan. Salah satu organisme yang umum digunakan sebagai indikator
adalah organisme dasar seperti kerang hijau (Perna viridis). Kerang hijau ini banyak ditemukan di perairan Teluk Jakarta yang menjadi salah satu daerah
budidaya kerang hijau yang berhasil, selain di daerah Teluk Banten (Djamali,
1982). Pemanfaatan kerang hijau sudah dilakukan sejak tahun 1985 khususnya
Kamal Muara, Teluk Jakarta dengan jumlah produksi sebesar 5680 ton kerang
hijau per hari. Pertumbuhan kerang hijau tersebut relatif cepat dan hal ini
mengindikasikan wilayah perairan sangat cocok untuk kehidupan kerang hijau.
Kerang hijau merupakan organisme yang hidupnya menetap (sesil) dan
memiliki cara makan dengan sistemfilter feeder yakni menyaring semua makanan yang masuk kedalam mulutnya. Hal ini memungkinkan kerang hijau dapat
tumbuh dan berkembang dengan cepat di daerah bertekanan ekologis yang tinggi
karena tingginya masukan bahan pencemar dari laut dan darat seperti buangan
limbah industri dan buangan kapal penangkapan ikan. Intensitas tekanan ekologis
telah mengakibatkan perairan Teluk Jakarta menjadi kritis dari masalah
pencemaran laut (Kantor Kependudukan dan Lingkungan Hidup, 1989). Salah
satu senyawa pencemar yang terkandung dalam limbah tersebut adalah
PAH merupakan senyawa yang dapat dihasilkan dari pembakaran yang tak
sempurna (pirogenik) ataupun dari kegiatan perminyakan (petrogenik) dan harus
mendapat perhatian karena bersifat karsinogen. Senyawa PAH dapat
terakumulasi dalam tubuh kerang hijau karena rendahnya kemampuan sistem
metabolisme terhadap senyawa organik yang masuk ke dalam tubuhnya
(Mortimer, 2005).
Penelitian tentang senyawa organik PAH sudah banyak dilakukan terkait
dengan sifat persistensinya di perairan. Namun demikian, informasi penelitian
yang berkaitan dengan keberadaan PAH dalam organisme lain di Teluk Jakarta,
khususnya kerang hijau masih terbatas. Penelitian ini diharapkan dapat
memberikan informasi tambahan tentang pencemaran organik perairan Teluk
Jakarta, terutama senyawa polihidrokarbon aromatis (PAH).
1.2 Tujuan
Penelitian ini bertujuan untuk menduga kandungan jenis-jenis senyawa PAH
dalam air laut dan tubuh organisme kerang hijau di perairan Teluk Jakarta dan
2. TINJAUAN PUSTAKA
2.1 Kerang hijau (Perna viridis L.)
2.1.1 Klasifikasi dan morfologi kerang hijau (Perna viridis L.)
Menurut Vakily (1989), kerang hijau (Perna viridis L.) diklasifikasikan sebagai berikut :
Filum : Molusca
Kelas : Bivalvia
Sub Kelas : Lamellibranchiata
Ordo : Anisomyria
Famili : Mytilidae
Sub Famili : Mytilinae
Genus : PernaL.
Spesies : Perna viridisL.
Kerang hijau merupakan hewan invertebrata (tidak bertulang belakang) yang
bertubuh lunak (mollusca), mempunyai dua cangkang (bivalvia) yang simetris
satu sama lain dan berkaki kecil yang berbentuk kampak. Kerang hijau juga
memiliki insang yang berlapis-lapis yang seluruhnya dihubungkan dengan silia
(lamellibranchiata). Kerang hijau umumnya hidup di laut dengan cara menempel
pada substrat yang keras menggunakanbyssus.
Secara morfologi, anggota famili Mytilidae mempunyai cangkang yang tipis,
keduanya simetris dan umbonya melengkung ke depan. Persendiannya halus
agak pipih, cangkang padat, dan mempunyai umbo pada tepi vertikal. Tipe alur
cangkangnya konsentrik, bersinar, berwarna hijau, dan kadang-kadang tepinya
berwarna kebiruan. Kedua cangkangnya berukuran sama meskipun salah satu
cangkang agak sedikit lebih cembung daripada yang lainnya.
Pernajuga dicirikan hanya dengan satu atau dua gigi yang berkembang pada gigi hinge dan hilangnya otot aduktor interior. Pada jenis ini di cangkang bagian
kiri terdapat dua gigi kecil dan tumbuh satu gigi besar di sebelah kanan. Bagian
interior cangkang keperak-perakan dan berkilau, bekas tempat otot terlihat sangat
jelas. Otot aduktor anteriornya menghilang, sedangkan otot aduktor posteriornya
menipis dan memanjang terletak pada pertengahan bagian posterior. PadaPerna viridis, tepi mantel berwarna hijau kekuningan, tidak memiliki tentakel dan
papillae.
2.1.2 Habitat dan distribusi kerang hijau (Perna viridis L.)
Habitat alami dari biota ini adalah di daerah litoral dan sublitoral hingga
kedalaman 15 m yang kaya akan plankton dan kandungan organik. Kerang hijau
umumnya hidup menempel pada dasar (substrat) yang keras seperti kayu, bambu,
batu, bangunan beton, dan lumpur keras dengan bantuanbyssus(serabut penempel). Kerang hijau dapat hidup subur di muara-muara sungai dan
hutan-hutan bakau di Indonesia dengan kondisi dasar perairan lumpur berpasir,
pergerakan air dan cahaya cukup serta kadar garam tidak terlalu tinggi (Kastoro,
1988). Untuk jenisP.viridisdapat ditemukan di daerah pesisir berbatu, di mulut estuari atau sungai dengan salinitas yang hampir sama dengan laut. Selain itu,
kerang hijau juga hidup di daerah yang memiliki kandungan sedimen
Kelimpahan kerang ini besar sekali di daerah intertidal dan subtidal, menempel
secara bergerombol pada batu-batu karang, tanggul-tanggul pelabuhan dan
tonggak-tonggak penangkapan (Cheong dan Chein, 1980).
Dalam penyebarannya, kerang hijau dapat ditemukan di hampir seluruh Benua
Asia, karena hewan tersebut termasuk spesies spesifik Benua tersebut. Kerang
hijau dapat ditemukan di sepanjang wilayah Indo Pasifik, kemudian ke bagian
utara hingga Hongkong, Cina, Selatan Jepang, perairan India, Semenanjung
Malaysia, Singapura, Laut Cina Selatan, Thailand, Philipina, Indonesia sampai
New Guinea (Vakily, 1989).
Kondisi perairan yang cocok untuk kehidupan kerang hijau adalah perairan
dekat estuaria yang subur dan pantai dengan dasar berlumpur. Habitatnya
memiliki kisaran suhu antara 23-34 °C, salinitas 27-34‰, pH 6-8, kecerahan
2,6-4,0 m dan kedalaman sampai 20 m. Pertumbuhan yang maksimal berada pada
perairan dengan salinitas 27-35‰, suhu 26-32 °C, pH 6,2-8,2 dan kandungan
oksigen (DO) 6 mg/l (Sivalingam, 1977). Menurut Menzel (1990)P.viridis
mampu mentolerir salinitas hingga mencapai 16‰. Pada salinitas ini ditemukan
bahwaP.viridismengalami penurunan aktivitas pembentukanbyssus. Kisaran salinitas bagiP.viridis20,7‰ sampai 45,6‰. Salinitas optimum bagi aktivitas dan ekskresi benangbyssusdari 20,7‰ sampai 35,4‰ (Walker, 1982inVakily, 1989). Menurut Sivalingam (1977)P.viridislebih tahan lama terhadap perubahan kadar garam, suhu, dan pH dibandingkan denganMytilus edulis.
Selain suhu dan salinitas yang menjadi pembatas kehidupan kerang hijau
dalam suatu perairan, kedalaman dan arus juga memegang peranan penting.
berpengaruh terhadap ketersediaan makanan dan penempelan larva (Vakily,
1989). Dan menurut Bayne (1976) kecepatan arus adalah salah satu faktor yang
harus diperhitungkan karena berhubungan dengan penyebaran makanan dan
bentuk substrat.
Kelas Bivalvia telah banyak digunakan oleh ahli ekologi dalam menganalisis
pencemaran air. Hal ini disebabkan sifatnya yang menetap dan cara makannya
yang pada umumnya bersifatfilter feeder, sehingga memiliki kemampuan untuk mengakumulasi bahan-bahan polutan. Apabila keadaan di sekitarnya tidak cocok
untuk hidupnya, kerang hijau akan melepaskanbyssusnya, kemudian
mengeluarkan gelembung dan terapung terbawa oleh arus. Jika ia mendapat
tempat yang cocok, maka ia akan kembali menempel (Robert, 1976).
2.2 Pencemaran laut oleh senyawa PAH
2.2.1 Sumber PAH
PAH (Polycyclic Aromatic Hydrocarbons) merupakan salah satu bahan polutan yang dihasilkan oleh bahan bakar fosil yang tidak terbakar secara
sempurna dan biasanya menghasilkan ikatan aromatik dari hidrokarbon (Killops
dan Killops, 1993). Menurut Neff (1979) PAH merupakan salah satu bagian yang
signifikan dari bahan kimia pencemar yang meningkat. PAH biasanya terdiri dari
dua atau lebih cincin aromatik (benzen).
PAH yang terdapat di lingkungan perairan dapat bersumber dari alam dan
kegiatan manusia (antropogenik). Sumber PAH yang berasal dari alam biasanya
disebabkan oleh adanya proses pyrolisis materi organik yang menghasilkan
temperatur tinggi, adanya temperatur rendah ke moderat dari diagenesis
mikroba dan tumbuhan. Ketiga sumber tersebut menghasilkan PAH sehingga
ikatan-ikatan kompleks yang ada dalam senyawa tersebut dipecahkan lagi menjadi
ikatan sederhana. Dengan sumber PAH yang dihasilkan karena adanya kegiatan
manusia yang terus bertambah, maka PAH menjadi mudah terbentuk dan
ikatannya semakin sulit disederhanakan (Neff, 1979).
Kegiatan manusia yang menghasilkan PAH biasanya bersifat industri dan
bahan bakar. Sumber-sumbernya antara lain : persiapan asetilen dari gas alam;
pyrolisis dari kerosin untuk membuat larutan benzen, toluen dan pelarut organik
lainnya; pyrolisis kayu untuk membentuk karbon hitam, charcoal dan tar kayu;
pabrik alumunium elektrolitik yang menggunakan elektroda grafit; produksi soda;
produksi gas dari petrolum; gasifikasi batubara; produksi alkohol sintetik; dan
operasi penyaringan minyak (Andelman dan Snodgrass, 1972inNeff, 1979). Kegiatan antropogenik di atas dapat menjangkau lingkungan perairan melalui
buangan industri dan domestik, masukan dari daratan, deposisi partikulat udara,
dan tumpahan petrolum serta produknya ke badan air.
PAH juga bisa berasal dari bahan bakar fosil yang akhir-akhir ini semakin
banyak digunakan di kota-kota besar. Untuk PAH yang terdeteksi di dalam
jaringan tubuh kerang, biasanya berasal dari pembakaran dan sumber kimia
petrolum, terutama jika kerang tersebut berada pada habitat dimana terdapat
proses penyaringan minyak atau area yang digunakan sebagai pelabuhan kapal
(Mortimer, 2005).
2.2.2 Karakteristik PAH
PAH dapat terbentuk selama temperatur lingkungannya tinggi minimal 700
menyebabkan produksi PAH (Blumer, 1976inNeff, 1979). PAH bisa terdegradasi dalam lingkungan perairan melalui proses fotooksidasi, oksidasi
kimia, dan transformasi biologis oleh bakteri, jamur dan hewan akuatik. PAH
mampu bertahan secara tak menentu pada basin air yang miskin oksigen atau
sedimenanoxic. PAH yang mengalami degradasi dengan proses fotooksidasi lebih sering didapati dengan adanya bantuan oksigen. PAH juga dapat
terdegradasi secara anaerobik dengan bantuan reduksi dari sulfat dalam perairan.
Karakter reaksi kimia yang terdapat pada hidrokarbon aromatik ada 3 tipe yakni
substitusi elektrofilik, oksidasi dan reduksi.
Karakter fisik dan kimia PAH bervariasi dalam mode reguler lebih atau
kurang dengan berat molekulnya. Konsistensi tiap senyawa PAH dalam peristiwa
oksidasi dan reduksi cenderung berkurang seiring dengan bertambahnya berat
molekul. Tekanan uap dan kelarutan dalam air berkurang secara logaritmik
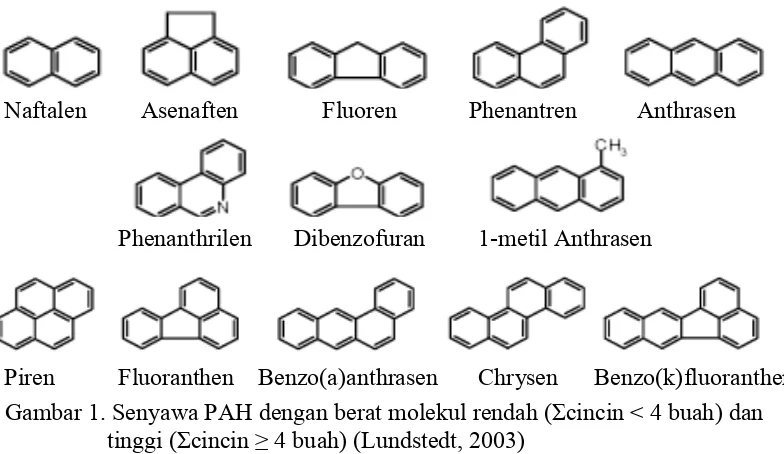
dengan bertambahnya berat molekul. Dalam Neff (1979) disebutkan bahwa
Naftalen (C10H8) yang terdiri dari 2 cincin aromatik adalah pemilik berat molekul
terendah. Selain Naftalen, ada beberapa jenis lainnya yang memiliki berat
molekul yang rendah yakni fluorene, phenanthrene dan anthracene (Gambar 1)
PAH yang berat molekulnya rendah bersifat toksik secara akut terhadap
organisme perairan, dibandingkan dengan yang memiliki berat molekul lebih
tinggi. Selain itu, PAH dengan berat molekul yang rendah dapat terdegradasi
dengan cara evaporasi dan aktivitas mikroba. Sedangkan berat molekul yang
tinggi umumnya terdegradasi oleh sedimentasi dan fotooksidasi. Penyebab relatif
dari berbagai proses degradasi pada PAH adalah karakter dari masing-masing
Gambar 1. Senyawa PAH dengan berat molekul rendah (Σcincin < 4 buah) dan tinggi (Σcincin≥4 buah) (Lundstedt, 2003)
PAH dalam lingkungan air diperkirakan lebih sensitif terhadap fotooksidasi
dibandingkan PAH di udara. Dengan demikian, PAH akan lebih persisten di
dalam air dibandingkan di udara. PAH yang masuk ke dalam perairan dari
berbagai sumber akan diserap menjadi bahan partikulat organik dan inorganik.
PAH dalam bentuk partikulat lebih banyak terdeposit ke dalam sedimen dasar.
Kemudian dengan mudahnya PAH diakumulasikan oleh biota akuatik ke level
lebih tinggi dari medium yang sebelumnya. PAH yang terdegradasi dalam tubuh
organisme akuatik disebut dengan biotransformasi. Karena PAH tidak dapat
dimetabolisme oleh organisme akuatik, maka PAH hanya dapat diakumulasi dan
dilepaskan secara pasif oleh jenis-jenis hewan tertentu seperti Kelas Bivalvia,
khususnya kerang hijau. PAH mengalamiremovaldari lingkungan akuatik dengan rute sebagai berikut : fotooksidasi, oksidasi kimia, metabolisme mikrobial
dan metabolisme metazoa yang lebih tinggi (Neff, 1979).
Naftalen Asenaften Fluoren Phenantren Anthrasen
Phenanthrilen Dibenzofuran 1-metil Anthrasen
2.2.3 Distribusi PAH
PAH menyebar ke bagian kolom, sedimen dan biota yang ada di sekitar di
lingkungan perairan. PAH dalam kolom air terdistribusi dalam bentuk terlarut
dan partikel. Dalam hal ini, temperatur sangat berpengaruh terhadap kelarutan
PAH dalam air. PAH dapat dilarutkan dengan peleburan menjadimicelles. Micellesdibentuk dari agregat surfaktan, masing-masing memiliki rantai hidrokarbon hidrofobik dan sekelompok hidrofilik yang dapat terionisasi
(Elsworthyet al., 1968inNeff, 1979). PAH yang terdistribusi dalam bentuk partikel mengalami adsorpsi dan terkonsentrasi ke dalam beberapa jenis substrat
seperti karbon aktif, material kapur, silika, partikel tanah, kaca dan partikel
organik lain (Andelman dan Suess, 1970; Herbes, 1977; Mayet al.,1978ainNeff, 1979).
Distribusi PAH di sedimen mengalami proses sedimentasi dan memiliki nilai
konsentrasi yang cukup besar terutama dalam senyawa BaP (benzo-a-pyrene).
Partikel organik yang terserap ke kolom air membawa PAH di dalamnya. Saat
terdeposisi ke dalam sedimen, maka PAH akan sangat sulit untuk mengalami
fotokimia atau oksidasi biologis, terutama pada kondisi sedimenanoxic(miskin oksigen) sehingga endapan PAH cenderung lebih persisten dan dapat diakumulasi
menjadi nilai konsentrasi yang besar.
Untuk distribusi PAH dalam organisme akuatik, biasanya PAH terkonsentrasi
di bagian jaringan tubuh organisme tersebut. Senyawa PAH yang sering
ditemukan di dalam jaringan tubuh hewan akuatik adalah BaP (benzo-a-pyrene).
Dan organisme yang mudah mengakumulasi PAH dalam jumlah banyak pada
organisme tersebut bisa dijadikan bioindikator untuk memonitor polusi dalam
lingkungan perairan (Neff, 1979).
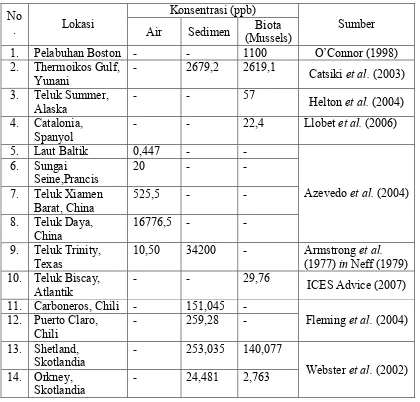
Menurut Neff (1979) jika diurutkan dari konsentrasi PAH tertinggi sampai
terendah, maka urutannya adalah sedimen, organisme dan terakhir kolom
perairan. Hal ini disebabkan karena PAH lebih banyak terdeposisi dari kolom air
ke sedimen dasar perairan baik dalam bentuk partikel ataupun terlarut. Nilai
konsentrasi yang didapat dari berbagai hasil penelitian yang telah dilakukan oleh
para peneliti PAH dapat dilihat pada Tabel 1.
Tabel 1. Konsentrasi PAH dalam air, biota dan sedimen No
1. Pelabuhan Boston - - 1100 O’Connor (1998)
2. Thermoikos Gulf,
Yunani
- 2679,2 2619,1
Catsikiet al.(2003)
3. Teluk Summer,
Alaska
- - 57
Heltonet al.(2004) 4. Catalonia,
Spanyol
- - 22,4 Llobetet al.(2006)
5. Laut Baltik 0,447 -
-Azevedoet al.(2004)
6. Sungai
10,50 34200 - Armstronget al.
(1977)inNeff (1979) 10. Teluk Biscay,
Atlantik
- - 29,76
ICES Advice (2007)
11. Carboneros, Chili - 151,045
-Fleminget al.(2004) 12. Puerto Claro,
Websteret al.(2002)
14. Orkney,
Skotlandia
2.2.4 Toksisitas senyawa PAH
PAH termasuk senyawa organik yang dapat melakukan aktivitas pencemaran
di lingkungan laut, bahkan sampai menghasilkan toksisitas. Faktor-faktor yang
mempengaruhi toksisitas PAH diantaranya adalah karakteristik senyawa PAH,
kadar PAH, jenis biota laut, aktivitas mikroba dan lamanya pemaparan (Sanusi,
2006). Menurut karakteristik senyawa PAH, toksisitasnya dapat dibagi menjadi 2
yaitu :
1. Senyawa PAH jumlah karbon rendah (C8-C14) memberikan toksisitas akut
terhadap biota laut. Hal ini dikarenakan kelarutan dari senyawa tersebut
tinggi.
2. Senyawa PAH jumlah karbon tinggi (>C14) memberikan toksisitas kronis
terhadap biota laut. Hal ini dikarenakan kelarutan dari senyawa tersebut
rendah.
Efek kronis yang dapat ditimbulkan diantaranya adalah :
a. Meningkatkan permeabilitas sel tubuh, menimbulkan gangguan terhadap
osmosis dalam pertukaran ion sel
b. Akumulasi secara biologik
c. Mengganggu perkembangan stadia embrio dan larva biota laut
d. Menghambat kemampuan makan
e. Mengganggu sistem reproduksi organisme air
Efek toksik PAH pada biota laut tersebut bersifat lokal dan sementara dan
tidak berdampak nyata dalam jangka panjang. Selain itu, efeknya juga dapat pulih
3. BAHAN DAN METODE
3.1 Waktu dan tempat
Penelitian ini dilakukan pada bulan Mei sampai Agustus 2007 dan terbagi
menjadi 2 bagian yakni pengambilan contoh biota dan air laut serta analisis
laboratorium. Pada bulan Mei sampai Juni, pengambilan contoh biota dilakukan
sebanyak 5 kali dalam selang waktu 2 minggu dan pengambilan contoh air laut
dilakukan sebanyak 3 kali setiap 4 minggu sekali. Lokasi pengambilan contoh
biota dan air dilakukan di daerah budidaya kerang hijau tepatnya di Kamal Muara,
Perairan Teluk Jakarta, Jakarta Utara (Gambar 2). Analisis contoh dilakukan di
Laboratorium Lingkungan danGas Chromatography(GC), Bidang Proses, Pusat Penelitian dan Pengembangan Teknologi Minyak dan Gas Bumi ”Lemigas”,
Jakarta Selatan selama bulan Juli sampai Agustus.
3.2 Kondisi lokasi penelitian
Perairan Kamal Muara terletak di Teluk Jakarta, Jakarta Utara. Perairan ini
merupakan daerah penghasil budidaya terbesar di Indonesia selain Teluk Banten
(Akbar, 2002). Lokasi penelitian terletak tidak jauh dari area pelelangan dan
penjualan ikan serta hasil laut yang lain. Area budidaya kerang hijau yang
dikembangkan sejak tahun 1985 ini sudah mencapai jumlah lebih dari 100 tempat
penanaman bibit yang berjarak 2-10 km dari pantai dan kedalaman perairan
kurang lebih 10 m. Produksinya sendiri menghasilkan sekitar 5680 ton per hari
dan diekspor sebanyak 20 ton dalam satu bulan ke negara-negara tetangga
(Ningtyas, 2002). Luas area bagan yang dibuat memiliki ukuran yang bervariasi
Secara visual perairan di bagian pantai sangat kotor karena dipenuhi oleh sampah
hasil pelelangan ikan dan hasil laut lain ataupun dari masyarakat sekitar. Ke arah
laut, sampah semakin berkurang dan menjadi lokasi bagan penanaman bibit
kerang hijau.
3.3 Bahan dan alat
Bahan-bahan yang digunakan selama penelitian adalah contoh kerang dengan
kisaran ukuran 1,0-1,5 cm; 2,5-3,0 cm; 4,0-4,5 cm; 5,5-6,0 cm dan contoh air, es
gel, diklorometan, n-hexan, silika gel dan larutan standar PAH. Peralatan yang
digunakan adalah kotak pendingin, water samplerVan Dorn, SCTmeter, kertas lakmus,waterbath,oven, tempat contoh dari bahan gelas, kondensor, tabung soklet,rotavapor, desikator, kolom kromatografi, kromatografi gas (GC-MS).
3.4 Pengumpulan data
3.4.1 Penentuan lokasi pengambilan contoh
Stasiun pengambilan contoh berjumlah sebanyak 2 stasiun. Stasiun 1 berada
pada posisi 6º4’44,28’’ BT dan 106º44’36,6’’ LS dan Stasiun 2 berada pada posisi
6º4’23,34’’ BT dan 106º44’18,7’’ LS. Kedua stasiun ditentukan berdasarkan
dengan keterwakilan lokasi yang dekat dan jauh dari area budidaya.
3.4.2 Teknik pengambilan contoh
3.4.2.1 Tahap pra pengambilan contoh
Penanganan contoh dari lapangan ke laboratorium dilakukan dalam 3 tahap.
Tahap pertama adalah pembersihan alat-alat sebelumsamplingdilakukan. Pada tahap pembersihan alat-alat, peralatan gelas seperti botol-botol kaca 2 L direndam
dikeringkan dalamovenbersuhu 100 °C. Untuk alat tempat menyimpan contoh biota kerang hijau, dapat digunakan kertasallumunium foilyang sudah
dibersihkan dengan larutan metanol 50% agar kertas bebas dari kontaminan atau
steril.
3.4.2.2 Tahap pengambilan contoh
Contoh yang diambil di setiap stasiun adalah biota dengan empat ukuran
panjang tubuh yang berbeda dan air laut. Ukuran contoh kerang hijau yang
diambil pada kedalaman antara 6-7 m dimana terdapat variasi ukuran yang
diperlukan dalam penelitian yaitu kisaran 1,0-1,5 cm; 2,5-3,0 cm; 4,0-4,5 cm dan
5,5-6,0 cm. Pengambilan contoh biota dilakukan sebanyak 5 kali secara acak
sederhana pada setiap stasiun dengan interval waktu 2 minggu sekali. Seluruh
contoh dibungkus denganallumunium foiluntuk mencegah kontaminasi dari luar dan diberikan label bertuliskan kisaran ukuran dan stasiun.
Contoh air laut diambil sebanyak 3 kali dengan interval waktu 4 minggu
menggunakanwater samplerdari bahan gelas pada kedalaman kurang lebih 5 m. Kedalaman ini ditentukan dengan dasar bahwa bagian ini berada antara
permukaan dan dasar perairan. Pengambilan contoh air laut diulang sebanyak 3
kali tiap pengambilan. Botol-botol tersebut dibilas terlebih dahulu dengan air laut
agar terjadi penyesuaian kondisi antara botol contoh dengan air contoh. Jumlah
contoh air yang diperlukan adalah sebanyak 6 liter per stasiun. Seluruh contoh air
dan biota kerang hijau dimasukkan ke dalam kotak pendingin yang berisi es gel
3.4.2.3 Tahap pasca pengambilan contoh
Pada tahap ini dilakukan penyimpanan contoh di laboratorium dimana air laut
tanpa disaring dan kerang hijau disimpan/didinginkan dalam lemari pendingin
bersuhu 4-10 °C. Contoh disimpan selama 2 bulan sampai saat digunakan untuk
analisis.
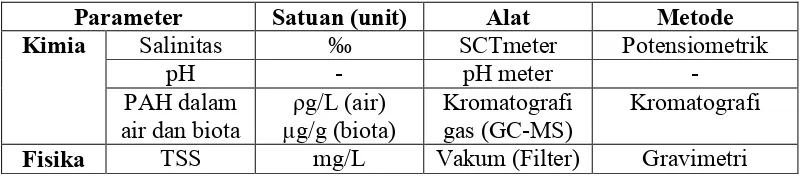
3.4.3 Analisis parameter pendukung
Penelitian ini juga mengukur beberapa parameter penunjang yang secara rinci
ditampilkan pada Tabel 2.
Tabel 2. Parameter pendukung yang dianalisis
Parameter Satuan (unit) Alat Metode
Kimia Salinitas ‰ SCTmeter Potensiometrik
pH - pH meter
-Fisika TSS mg/L Vakum (Filter) Gravimetri
3.4.4 Analisis PAH
Analisis PAH dalam contoh air dan biota dilakukan dengan menggunakan
kromatografi gas jenis Spektrofotometri Massa (GC-MS) tipe Hewlett Packard
6890. Prosedur untuk analisis keduanya dapat dilihat pada Lampiran 8.
3.4.4.1 Analisis PAH dalam air laut
Metode yang digunakan untuk melakukan analisis PAH dalam air laut
mengacu padaEnvironmental Protecting Agencyatau EPA nomor 3510c (untuk preparasi) dan EPA nomor 8270d (untuk injeksi GC). Metode preparasi dapat
dilakukan untuk menganalisis contoh zat cair dengan alat corong pisah berukuran
Proses ekstraksinya diawali dengan menuang contoh 400 ml air laut ke dalam
corong pisah 500 ml, setelah itu 25 ml pelarut diklorometan dituang juga ke dalam
corong pisah. Selama 1-2 menit, corong pisah tersebut dikocok-kocok sampai
contoh dan pelarut menyatu. Tunggu selama 10 menit hingga terjadi pemisahan
antara kedua zat cair. Setelah memisah, hasil ekstrak yang berada di lapisan
bawah corong dialirkan ke dalam tabung erlenmeyer. Perlakuan memasukkan 25
ml pelarut diklorometan ini diulangi sebanyak 2 kali. Setelah itu, hasil ekstrak
dipindahkan ke dalam bola ukur dan diuapkan pada suhu di atas titik didih pelarut
diklorometan (65 °C) denganrotavaporhingga mencapai kurang lebih 1 ml. Contoh tersebut diuapkan lagi dengan menggunakan aliran gas Nitrogen hingga
mencapai 0,5 ml. Setelah mencapai 0,5 ml, contoh dimasukkan ke dalam botol
vialberukuran 2 ml untuk diinjeksikan ke alat Kromatografi Gas Spektrofotometri Massa.
3.4.4.2 Analisis PAH dalam kerang hijau
Metode yang digunakan untuk melakukan analisis kandungan PAH dalam
kerang hijau mengacu padaEnvironmental Protecting Agencyatau EPA nomor 3540 (dalam preparasi) dan EPA nomor 8270d (dalam injeksi GC). Metode
preparasi dapat digunakan untuk menganalisis contoh biota dengan menggunakan
alat soklet (EPA, 1996b).
Proses ekstraksinya diawali dengan menimbang contoh jaringan kerang hijau
seberat 10 gram berat basah dan dihaluskan denganblendersampai homogen. Contoh yang telah dihaluskan selanjutnya dibungkus dalam kertas saring yang
sudah dibentuk kemudian dimasukkan ke dalam ruang soklet. Di atas dan bawah
keluar dari kertas saring. Tabung soklet berisi contoh dipasang antara tabung
pendingin di sebelah atas dan bola ukur yang berisi 200 ml diklorometan serta alat
pemanas di sebelah bawah. Setelah semuanya terpasang dengan baik, proses
ekstraksi dapat dilangsungkan selama 3 jam untuk mendapat hasil ekstraksi yang
maksimal. Setelah itu, hasil ekstrak dalam bola ukur diuapkan pada suhu di atas
titik didih diklorometan (65 °C) denganrotavaporhingga mencapai kurang lebih dari 1 ml lalu dipindahkan ke dalam botolvialberukuran 2 ml untuk diinjeksikan ke alat Kromatografi Gas Spektrofotometri Massa.
3.4.4.3 Analisis PAH dengan Kromatografi Gas Detektor Spektrofotometri Massa (GC-MS)
Metode injeksi GC nomor 8270d digunakan untuk menganalisis PAH dengan
detektor Spektrofotometri Massa (GC-MS). Metode ini tidak hanya mendeteksi
PAH, terdapat 244 komponen senyawa kimia lain yang dapat dideteksi dengan
menggunakan metode ini. GC yang digunakan adalah GC Hewlett Packard 6890
(EPA, 1998). Metode ini digunakan untuk mendeteksi kandungan PAH dalam air
laut dan biota kerang hijau.
Kondisi GC saat contoh diinjeksi adalah suhu awaloven50 °C, inlet depan modesplitless, kolom kapiler jenis HP-5 dari bahan 5 % fenil metil siloxane yang memiliki panjang 30 m, diameter 250μm dan ketebalan lapisan film 0.5μm. Gas
yang digunakan adalah gas helium dengan kecepatan aliran 30 cm/detik. Jumlah
contoh yang diambil saat proses injeksi sebanyak 2μL dengan suhuoven
terprogram dari 50 °C dengan laju perpindahan 8 °C per menit hingga mencapai
3.5 Analisis data
3.5.1 Metode grafik
Analisis data dengan metode grafik meliputi:
1. Parameter pendukung
2. Konsentrasi total dan tiap senyawa PAH dalam air laut dan kerang hijau
3. Panjang dan berat tubuh kerang hijau
4. Kandungan PAH dalam berat per individu kerang hijau
5. Konsentrasi PAH per 1 gram berat tubuh kerang hijau
3.5.2 Metode analisis PAH
Persamaan analisis PAH di bawah berikut telah diberlakukan olehU.S Environmental Protecting Agency(U.S EPA) dalam menentukan komposisi hidrokarbon terutama PAH dalam air, sedimen dan organisme akuatik (EPA,
1996).
Dimana : Cc : konsentrasi PAH (ppm)
Ac : luasan area larutan contoh
Ast : luasan area larutan standar
W : banyaknya contoh (gram untuk biota dan liter untuk air laut)
W Kst
Ast Ac
4. HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Parameter fisik dan kimia
4.1.1.1 Salinitas
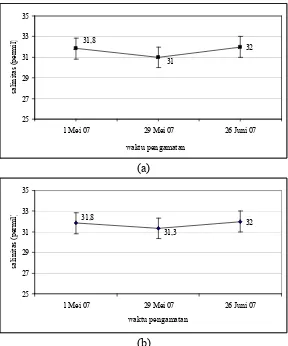
Salinitas di Stasiun 1 memiliki kisaran 30‰ sampai 33‰ dengan nilai rerata
sebesar 31,6‰ (bulan Mei hingga Juni 2007). Di Stasiun 2 memiliki kisaran
salinitas yang tidak jauh berbeda yaitu antara 30‰-33‰ dengan nilai rerata
31,7‰ (Gambar 3).
Data salinitas dalam setiap pengambilan di kedua stasiun disajikan dalam
Lampiran 1. Menurut penelitian yang dilakukan oleh Fadhlina (2007), salinitas
perairan Teluk Jakarta berkisar antara 30‰ sampai 33‰. Dan menurut hasil
penelitian Litasari (2002) diketahui bahwa kisaran salinitas perairan Teluk Jakarta
antara 13,9 – 30,0‰. Menurut Walker (1982)inVakily (1989), kisaran salinitas optimum untuk kerang hijau berkisar antara 20,7‰ – 35,4‰. Kerang hijau juga
mampu mentolerir fluktuasi salinitas yang lebar. Dengan demikian, perairan
Kamal Muara dapat dijadikan habitat kerang hijau.
Salinitas yang diamati di perairan Kamal Muara tersebut memiliki kisaran
yang sempit (30-33‰). Hal ini mengindikasikan bahwa di wilayah pengamatan,
kondisi salinitas relatif sama karena adanya pengaruh kondisi oseanografis
khususnya gerakan massa air di wilayah Teluk Jakarta yang mampu
menyeragamkan sifat salinitas perairan.
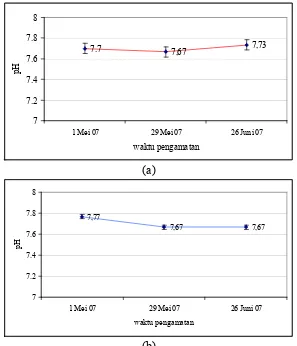
4.1.1.2 pH
pH di Stasiun 1 berkisar antara 7,5-7,9 dengan rerata 7,7. Begitu juga dengan
pH di Stasiun 2 yang berkisar antara 7,5-7,9 dengan rerata 7,7. Data pH juga
disajikan dalam Lampiran 1. Kedua stasiun memiliki nilai pH yang relatif sama
satu sama lain. Hal ini terkait dengan kondisi kimiawi perairan khususnya sifat
penyangga air laut yang mampu menahan perubahan-perubahan pH yang besar.
Di samping itu, kondisi fisik seperti gerakan massa air juga berperan penting
dalam penyeragaman sifat air. Pada hasil penelitian tahun 1988 oleh Meneg LH,
pH di Teluk Jakarta berkisar antara 6,5-9,0. Dengan demikian, dapat disimpulkan
bahwa kisaran pH di Teluk Jakarta tepatnya Kamal Muara masih berada dalam
air laut berkisar antara 6,2-8,2 (Vakily, 1989). Maka dapat disimpulkan bahwa
perairan Kamal Muara dapat dijadikan area pertumbuhan kerang hijau (Gambar
4).
Gambar 4. Nilai rerata dan kisaran pH di perairan Kamal Muara, Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2
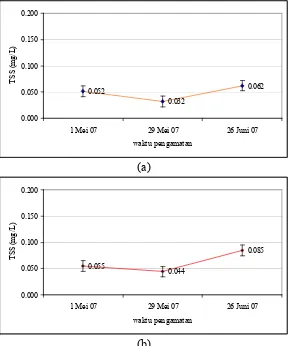
4.1.1.3 Total padatan tersuspensi (TSS)
TSS di Stasiun 1 berada pada kisaran 0,02-0,08 mg/L dengan rerata 0,05
mg/L, sedangkan untuk Stasiun 2, kisarannya antara 0,030-0,133 mg/L dengan
rerata 0,082 mg/L (Lampiran 1). Nilai TSS di perairan Teluk Jakarta sudah
diamati oleh beberapa peneliti diantaranya oleh Dinas PPK DKI (2004)
dilakukan oleh Bapedal (2000), kandungan TSS berkisar antara 100-150 mg/L.
Nilai hasil pengamatan ini menunjukkan nilai yang relatif rendah jika
dibandingkan dengan data penelitian sebelumnya. Nilai relatif rendah ini
menunjukkan kondisi yang masih baik bagi perairan (Gambar 5).
0.052
Gambar 5. Nilai rerata dan kisaran TSS di perairan Kamal Muara, Teluk Jakarta.(a) Stasiun 1 (b) Stasiun 2
4.1.2Polycyclic Aromatic Hydrocarbon(PAH) 4.1.2.1 PAH dalam air laut
Hasil pengukuran contoh air laut (dalam bentuk terlarut) menunjukkan bahwa
terdapat hanya 7 senyawa PAH yang terdeteksi yakni naphtalen, 1-metil
contoh kromatogram PAH keluaran GC-MS dari air laut ditampilkan pada
Lampiran 9. Di antara ketujuh senyawa tersebut, naphtalen adalah senyawa PAH
yang memiliki rerata konsentrasi tertinggi (61 dan 65%), sebaliknya asenaphthen
memiliki rerata konsentrasi terendah (1%) pada kedua stasiun pengamatan
(Gambar 6).
Gambar 6. Diagram cakram komposisi PAH rerata di perairan Kamal Muara, Teluk Jakarta (a) Stasiun 1 (b) Stasiun 2
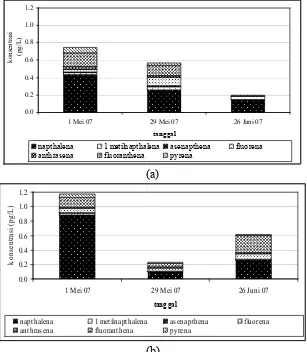
Namun demikian, secara keseluruhan konsentrasi PAH berkisar antara 0,1687
-0,8722ρg L-1dengan nilai rerata0,5964 ρg L-1di Stasiun 1 dan 0,2350 - 1,1723
Tabel 3. Konsentrasi total 7senyawa PAH (ρg L-1)dalam air laut per stasiun di
perairan Kamal Muara, Teluk Jakarta.
Konsentrasi total PAH Stasiun 1 Stasiun 2
1 Mei 2007 0,7482 1,1723
29 Mei 2007 0,8722 0,2350
26 Juni 2007 0,1687 0,6125
Rerata 0,5964 0,6733
Hasil pengukuran juga menunjukkan konsentrasi-konsentrasi dengan
variabilitas tinggi selama pengamatan dari waktu ke waktu, walaupun naphtalen
tetap sebagai komponen dominan (Gambar 7). Data konsentrasi tiap senyawa
PAH dapat dilihat pada Lampiran 2.
0.0
napthalena 1 metilnapthalena asenapthena fluorena anthrasena fluoranthena pyrena
napthalena 1 metilnapthalena asenapthena fluorena anthrasena fluoranthena pyrena
(b)
Sebagai contoh pada Stasiun 1, konsentrasi PAH cenderung menurun, sebaliknya
pada Stasiun 2 pengamatan ke-2 menunjukkan konsentrasi total senyawa PAH
terendah. Jika dilihat dari Gambar tersebut, maka dapat dikatakan bahwa
konsentrasi PAH dalam air laut tidak selalu menurun atau meningkat dan
sewaktu-waktu dapat berubah sesuai dengan kondisi oseanografi perairan
khususnya arus.
Nilai konsentrasi PAH baik di Stasiun 1 maupun Stasiun 2 sangat rendah dan
karenanya PAH termasuk ke dalam komponen senyawa kelumit (trace
compound). Informasi konsentrasi PAH di perairan Indonesia sampai saat ini masih sangat jarang diperoleh. Dengan demikian sebagai perbandingan, hasil
pengamatan di beberapa perairan laut diantaranya di Laut Baltik memiliki
konsentrasi PAH sebesar 0,3 – 0,594 ng/L, di Teluk Xiamen Barat, China sebesar
106 - 945 ng/L, dan di Teluk Daya, China sebesar 4228 – 29325 ng/L (Azevedoet al., 2004). Konsentrasi tersebut masih lebih tinggi dibandingkan dengan hasil pengamatan di perairan Teluk Jakarta.
Nilai rendah di Teluk Jakarta diduga karena PAH yang ada dalam air laut
mendapat input dari sumber alami (hasil pembakaran suhu tinggi pada bahan
organik yang biasa disebut proses pirogenik) juga antropogenik (kontaminasi dari
petroleum) dengan jumlah sangat rendah (Neff, 1979). PAH dapat juga berubah
dikarenakan adanya kondisi oseanografis dari laut khususnya kondisi arus. PAH
dalam air laut dapat berbentuk terlarut ataupun partikel yang ada di kolom
perairan. Kondisi ini memungkinkan PAH untuk memiliki mobilisasi tinggi dan
bisa terbawa ke tempat lain oleh arus, sehingga hasil pengamatan di lokasi
PAH sehingga keberadaannya dalam air laut tidak bertahan lama dan akan
terdeposit dengan cepat ke sedimen dasar serta tertahan di dalamnya (Websteret al., 2002). Kondisi ini diduga menjadi penyebab tingkat konsentrasi PAH sangat rendah pada hasil pengamatan.
Naphtalen menjadi senyawa PAH dengan konsentrasi tertinggi dalam air laut.
Hal ini dapat dikarenakan adanya masukan petrogenik (antropogenik) yakni
kontaminasi dari petroleum. Fluoranthen juga muncul sebagai salah satu senyawa
PAH yang memiliki konsentrasi tinggi. Senyawa ini memiliki jumlah cincin
aromatik 4 buah dan biasanya senyawa PAH dengan jumlah 4 buah cincin
tersebut berasal dari sumber pirogenik atau alami. Dengan demikian, PAH dalam
air laut juga diduga berasal dari sumber yang alami.
4.1.2.2 PAH dalam kerang hijau (Perna viridis L.)
Hasil pengukuran contoh menunjukkan bahwa terdeteksi 7 senyawa PAH
yang terdapat dalam kerang hijau. Pada Stasiun 1 dan 2, dapat diketahui bahwa
naphtalen menjadi senyawa yang memiliki konsentrasi tertinggi di setiap ukuran
panjang tubuh kerang hijau selama 5 kali pengambilan (Lampiran 3). Setelah
naphtalen, senyawa yang juga memiliki konsentrasi tinggi adalah fluoranthen.
Untuk senyawa yang memiliki konsentrasi terendah adalah 1 metilnaphthalen
(Gambar 8). Dari tabel dapat diketahui bahwa di Stasiun 1 dari awal sampai akhir
pengambilan contoh, ukuran panjang tubuh 1,0 -1,5 cm memiliki kisaran
konsentrasi PAH total antara 50,7600-283,7465 µg g-1berat basah, panjang tubuh
2,5 -3,0 cm berkisar antara 23,2507-125,7143 µg g-1berat basah, panjang tubuh
tubuh 5,5 - 6,0 cm memiliki kisaran konsentrasi PAH total antara
34,7362-111,1149 µg g-1berat basah.
Rata-rata Stasiun 1
1-1,5 2,5-3 4-4,5 5,5-6
panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0
panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren
anthrasen fluoranthen pyren
(b)
Gambar 8. Diagram batang komposisi senyawa PAH rerata dalam kerang hijau di Stasiun 1 (a) dan 2 (b) perairan Kamal Muara, Teluk Jakarta.
Untuk Stasiun 2, juga bisa diketahui bahwa ukuran panjang tubuh 1,0 -1,5 cm
memiliki kisaran konsentrasi PAH total antara 24,6307-121,3696 µg g-1berat
basah, panjang tubuh 2,5 -3,0 cm berkisar antara 13,5232-100,2161 µg g-1berat
basah, panjang tubuh 4,0 - 4,5 cm berkisar antara 36,4154-134,4152 µg g-1berat
basah dan panjang tubuh 5,5 - 6,0 cm memiliki kisaran antara 14,8467-76,0554 µg
g-1berat basah (Tabel 4). Untuk kromatogram PAH keluaran GC-MS dari kerang
Tabel 4. Konsentrasi total 7 senyawa PAH (µg g-1berat basah) dalam kerang hijau per stasiun di perairan Kamal Muara, Teluk Jakarta.
Waktu pengambilan ukuran panjang tubuh (cm) total PAH di stasiun 1 total PAH di Stasiun 2
1 Mei 2007 1,0-1,5 50,7600 121,3696
2,5-3,0 125,7143 42,1027
4,0-4,5 111,2253 52,7324
5,5-6,0 55,7763 43,4054
15 Mei 2007 1,0-1,5 58,2781 61,1507
2,5-3,0 23,2507 67,1654
4,0-4,5 41,7883 39,3873
5,5-6,0 111,1149 49,4394
29 Mei 2007 1,0-1,5 53,7919 24,6307
2,5-3,0 42,5160 13,5232
4,0-4,5 45,1003 36,4154
5,5-6,0 34,7362 14,8467
12 Juni 2007 1,0-1,5 283,7465 91,3369
2,5-3,0 114,0512 100,2161
4,0-4,5 68,5058 94,5715
5,5-6,0 35,8997 76,0554
26 Juni 2007 1,0-1,5 68,8143 44,7943
2,5-3,0 38,5203 55,4332
4,0-4,5 52,8252 134,4152
5,5-6,0 58,4807 65,5957
Hasil konsentrasi yang didapat dalam kerang hijau memiliki kisaran nilai yang
cukup tinggi. Pada penelitian yang sudah dilakukan, konsentrasi PAH dalam
biota kerang di area budidaya perairan Loch Seven, Skotlandia sebesar >4000
ng/g berat basah yakni mencapai 8256 ng/g berat basah (McIntoshet al., 2004) dan di perairan Skotlandia yang lain (Shetland dan Orkney) sebesar 14,7 – 7177
ng/g berat basah (Websteret al.,2002). Nilai pengukuran yang didapat di Teluk Jakarta tergolong tinggi dibandingkan dengan kedua penelitian tersebut. Namun
jika dibandingkan dengan penelitian McDowellet al.(1999) di perairan New Bedford, Massachusetts yang memiliki nilai sebesar 1940 mg/g berat basah,
konsentrasi PAH dalam kerang hijau di Teluk Jakarta termasuk rendah. Hal ini
dapat dikarenakan perairan New Bedford merupakan daerah pelabuhan
kapal-kapal besar sehingga diduga PAH yang ada dalam tubuh kerang berasal dari
kerang hijau diduga berasal dari hasil pembakaran tidak sempurna bahan bakar
fosil, kayu, emisi pembakaran batubara dan kendaraan motor serta aktivitas
antropogenik seperti peristiwa tumpahan minyak yang menghasilkan minyak
mentah (crude oil) (McIntoshet al., 2004).
Hasil pengukuran juga menunjukkan konsentrasi tiap senyawa PAH dalam
kerang hijau memiliki nilai yang bervariasi di setiap kali pengambilannya.
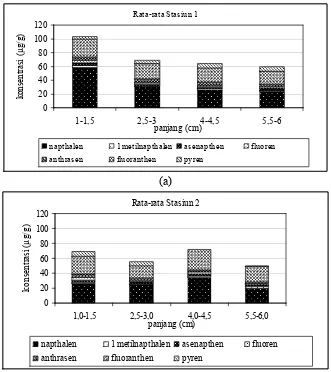
Namun yang cenderung terjadi khususnya di Stasiun 1 adalah penurunan
konsentrasi tiap senyawa PAH dari ukuran terkecil ke ukuran terbesar, seperti
yang terjadi pada pengambilan contoh ke-1, 3 dan 4 (Gambar 10 dan 11).
Senyawa Naphthalen, dengan kisaran nilai pada ukuran tubuh 1,0 - 1,5 cm, 2,5 –
3,0 cm, 4,0 4,5 cm dan 5,5 – 6,0 cm berada antara 23,4692 199,8053; 15,5774
-51,3920; 22,6816 - 40,8023 dan 16,0421 - 26,8799 µg g-1berat basah,
1 Mei 2007
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0
panjang (cm)
Gambar 10. Diagram batang komposisi PAH dalam 4 ukuran tubuh kerang hijau (Perna viridis) pada 2 waktu pengambilan di Stasiun 1
29 Mei 2007
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1,0-1,5 2,5-3,0 4,0-4,5 5,5-6,0 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
Gambar 11. Diagram batang komposisi PAH dalam 4 ukuran tubuh kerang hijau (Perna viridis) pada 3 waktu pengambilan di Stasiun 1
menjadi senyawa PAH yang memiliki konsentrasi tertinggi di semua ukuran,
sedangkan asenapthen sebagai senyawa PAH berkonsentrasi terendah dengan
kisaran nilai untuk ukuran panjang 1,0 - 1,5 cm berada pada 0,5605-1,0947 µg g-1
basah, ukuran panjang 4,0 - 4,5 cm berada pada 0,4091-1,4465 µg g-1berat basah
dan ukuran panjang 5,5 – 6,0 cm berada pada 0,7828-1,0797 µg g-1berat basah.
Di Stasiun 2, pola yang terbentuk cenderung menurun ke arah ukuran kerang
hijau yang semakin besar, namun pada ukuran sebelumnya (4,0-4,5 cm),
konsentrasi tiap senyawa PAH cenderung meningkat hingga maksimal seperti
yang terjadi pada pengambilan ke-1,3 dan 5 (Gambar 12 dan 13). Hal ini berbeda
dengan konsentrasi tiap senyawa PAH dalam kerang hijau di Stasiun 1.
1 M ei 2007
1-1,5 2,5-3 4-4,5 5,5-6
panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1-1,5 2,5-3 4-4,5 5,5-6 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
29 Mei 2007
1-1,5 2,5-3 4-4,5 5,5-6
panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1-1,5 2,5-3 4-4,5 5,5-6
panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
1-1,5 2,5-3 4-4,5 5,5-6 panjang (cm)
napthalen 1 metilnapthalen asenapthen fluoren anthrasen fluoranthen pyren
Gambar 13. Diagram batang komposisi PAH dalam 4 ukuran panjang tubuh kerang hijau (Perna viridis) pada 3 waktu pengambilan di Stasiun 2
Pada Stasiun 2, senyawa PAH yang paling sering muncul sebagai nilai
konsentrasi tertinggi pada setiap ukuran panjang tubuh adalah napthalen. Hal ini
terdapat di setiap pengambilan contoh kerang hijau kecuali pada saat pengambilan
fluoranthen dengan ukuran tubuh 1,0 - 1,5 cm sebesar 30,8751 µg g-1berat basah
, 2,5 – 3,0 cm sebesar 36,5159 µg g-1berat basah , 4,0 - 4,5 cm sebesar 46,5790
µg g-1berat basah dan 5,5 – 6,0 cm sebesar 46,5301 µg g-1berat basah. Hal ini
memberikan perbedaan dengan Stasiun 1 dimana dalam setiap ukuran tubuh
kerang hijau terdapat senyawa naphtalen dengan nilai konsentrasi tertinggi.
Senyawa PAH yang paling sering muncul dengan nilai konsentrasi terendah pada
setiap ukuran panjang tubuh kerang hijau di Stasiun 2 adalah 1metil naphtalen.
PAH yang masuk ke dalam tubuh kerang hijau bisa didapatkan dari
kandungan PAH dalam perairan yang diakumulasi oleh kerang hijau saat
menyerap makanan yang ada di kolom perairan. Kerang hijau merupakan
organisme yang memiliki cara makan yang cukup berbeda yakni menyaring
semua makanan yang masuk ke dalam mulutnya. Kolom perairan dimana kerang
hijau berkembang sangat mudah dimasuki oleh berbagai polutan baik yang berasal
dari rumah tangga ataupun industri. Sumber ini disebut sumber petrogenik
(Websteret al., 2002). Selain itu, penyerapan PAH ke dalam tubuh kerang
tergantung daribioavailabilitysenyawa PAH tersebut yang selanjutnya tergantung dari tingkat kelarutannya dalam air. Semakin tinggi berat molekul senyawa PAH,
maka semakin rendah tingkat kelarutannya dalam air. Kerang hijau juga memiliki
kandungan lemak dalam tubuhnya dan pada bagian ini diduga bahwa PAH dapat
mengalami reaksi ikatan sehingga terakumulasi oleh kerang hijau. Karena sistem
metabolisme tubuh yang rendah, maka PAH sangat sulit untuk dilepaskan kembali
ke lingkungannya (Fleminget al., 2004).
Di Stasiun 1, naphthalen merupakan senyawa PAH yang paling tinggi nilai
pembentukan senyawa PAH dengan berat molekul lebih rendah dari petrolum
dalam bentuk buangan serta tumpahan minyak ke laut. Dari awal hingga akhir
pengambilan contoh kerang hijau, dapat dilihat bahwa nilai konsentrasi PAH
mengalami fluktuasi yang berbeda-beda.
Jika dibandingkan dengan Stasiun 1, kandungan PAH di Stasiun 2 tidak jauh
memiliki perbedaan. Perbedaan yang mencolok di Stasiun 2 adalah nilai
konsentrasi senyawa fluoranthen yang mendominasi di pengambilan contoh ke-4
dan naphthalen di pengambilan contoh ke-1. Hal ini membedakan sumber
masuknya PAH ke dalam tubuh kerang hijau. Fluoranthen adalah senyawa PAH
yang memiliki cincin berjumlah lebih dari 3 buah, dan mengindikasikan bahwa
senyawa ini termasuk anggota senyawa PAH dengan berat molekul tinggi,
sedangkan naphthalen adalah senyawa PAH dengan berat molekul lebih rendah
dengan jumlah cincin 2 buah. Dengan demikian sumber masukan kedua senyawa
tersebut berbeda. Untuk fluoranthen, senyawa ini dapat muncul di semua ukuran
panjang tubuh di pengambilan ke-4 diduga disebabkan oleh proses pirogenik
yakni hasil pembakaran bahan organik yang kurang sempurna di perairan
(Fleminget al., 2004).
Konsentrasi PAH dalam kerang hijau dapat dihubungkan dengan kondisi
ukuran tubuh dari kerang hijau itu sendiri, dimana dalam kasus ini adalah panjang
tubuhnya. Berdasarkan hasil yang telah didapat, konsentrasi PAH dalam tubuh
organisme kerang hijau mengalami kecenderungan peningkatan seiring
bertambahnya ukuran panjang tubuhnya (Gambar 15). Hal ini juga didukung
dengan menghubungkan antara ukuran panjang dan berat tubuh kerang hijau
juga berbanding lurus yakni peningkatan ukuran berat seiring dengan
pertambahan panjang tubuh baik di Stasiun 1 maupun 2.
0.0
kisaran panjang tubuh 1,0-1,5 cm kisaran panjang tubuh 2,5-3,0 cm kisaran panjang tubuh 4,0-4,5 cm kisaran panjang tubuh 5,5-6,0 cm
rata-rata Expon. (rata-rata)
kisaran panjang tubuh 1,0-1,5 cm kisaran panjang tubuh 2,5-3,0 cm kisaran panjang tubuh 4,0-4,5 cm kisaran panjang tubuh 5,5-6,0 cm rata-rata Expon. (rata-rata)
(b)
Gambar 14. Grafik sebaran berat tubuh dengan panjang tubuh kerang hijau (Perna viridis) di Stasiun 1 (a) dan Stasiun 2 (b)
.
Dilihat dari penjelasan dan gambar 14 dan 15, konsentrasi PAH di setiap
ukuran panjang tubuh memiliki pola yang semakin meningkat ke arah panjang
ukuran panjang ini mengakumulasi PAH dalam tubuhnya dari perairan secara
teratur. Hal ini juga menunjukkan optimasi kemampuan tubuh kerang hijau yang
berbeda-beda dalam melakukan penyerapan senyawa PAH.
0
kisaran panjang tubuh 1,0-1,5 cm kisaran panjang tubuh 2,5-3,0 cm kisaran panjang tubuh 4,0-4,5 cm kisaran panjang tubuh 5,5-6,0 cm rata-rata Expon. (rata-rata)
kisaran panjang tubuh 1,0-1,5 cm kisaran panjang tubuh 2,5-3,0 cm kisaran panjang tubuh 4,0-4,5 cm kisaran panjang tubuh 5,5-6,0 cm rata-rata Expon. (rata-rata)
(b)
Gambar 15. Grafik sebaran konsentrasi PAH kerang hijau (Perna viridis) menurut 4 kisaran panjang tubuh di Stasiun 1 (a) dan Stasiun 2 (b).
Hal ini diungkapkan oleh penelitian Bruneret al.(1994) yang menyatakan bahwa kerang yang berukuran lebih kecil diduga mempunyai kemampuan untuk
besar. Dari hasil yang didapat, dapat dibuktikan dalam kerang hijau dengan
panjang tubuh 1,0-1,5 cm, yang sedang dalam proses pertumbuhan, mampu
menyerap komponen senyawa PAH dalam jumlah besar melalui proses
penyaringan makanan dibanding kerang hijau dengan panjang tubuh 5,5-6,0 cm
yang berumur lebih tua dan semakin sedikit menampung makanan dari sekitar
perairan. Hal lain yang bisa diungkap juga adalah kerang yang sedang dalam
masa pra pemijahan biasanya mampu menyerap PAH lebih banyak dibandingkan
kerang yang sudah melewati masa pemijahan. Kerang berukuran 1,0 -1,5 cm
merupakan kerang hijau yang sedang dalam masa tersebut sehingga diduga
mampu menyerap PAH lebih banyak (Bruneret al., 1994).
Kondisi di Stasiun 2 tidak jauh berbeda dengan Stasiun 1. Namun pada
ukuran panjang tubuh 4,0 - 4,5 cm, kandungan PAH dalam tubuh kerang hijau
memiliki nilai konsentrasi tertinggi dibandingkan dengan 3 ukuran panjang tubuh
yang lain. Hal ini diduga karena kerang hijau ukuran ini mengandung lemak yang
lebih banyak dibandingkan kerang ukuran yang lain, dimana semakin tinggi
kandungan lemak dalam tubuhnya, maka akan semakin mudah untuk berikatan
dengan senyawa yang bersifat lipofilik atau hidrofobik tinggi seperti PAH (Bruner
et al., 1994). Selain itu, hal ini juga bisa dikarenakan ukuran panjang ini lebih lama terpaparkan di perairan dibandingkan dengan ukuran yang lebih kecil.
4.1.3 Faktor biokonsentrasi PAH
Faktor biokonsentrasi adalah rasio konsentrasi zat dalam biota (berat zat/berat
biota) dan dalam air (berat zat/berat air) pada kondisi setimbang, dimana
spesifikasi zat dalam hal ini adalah PAH. Nilai konsentrasi ini menunjukkan cara