PROSES KOAGULASI – FLOKULASI
PADA PENGOLAHAN TERSIER LIMBAH CAIR
PT. CAPSUGEL INDONESIA
Oleh
SUCI YULIATI
F34101060
2006
FAKULTAS TEKNOLOGI PERTANIAN
ii
Suci Yuliati. F34101060. Proses Koagulasi – Flokulasi Pada Pengolahan Tersier Limbah Cair PT. Capsugel Indonesia. Di bawah bimbingan Muhammad Romli dan Andes Ismayana. 2006.
RINGKASAN
Proses koagulasi – flokulasi merupakan salah satu cara pengolahan limbah cair untuk menghilangkan partikel-partikel yang terdapat didalamnya. Koagulasi diartikan sebagai proses kimia fisik dari pencampuran bahan koagulan ke dalam aliran limbah dan selanjutnya diaduk cepat dalam bentuk larutan tercampur. Flokulasi adalah proses pembentukan flok pada pengadukan lambat untuk meningkatkan saling hubung antar partikel yang goyah sehingga meningkatkan penyatuannya (aglomerasi).
Penelitian ini bertujuan untuk mempelajari penggunaan beberapa koagulan untuk proses koagulasi – flokulasi pada pengolahan tersier limbah cair PT. Capsugel Indonesia, serta untuk mengetahui pengaruh penambahan dosis koagulan dan pH yang berbeda pada masing-masing koagulan. Koagulan yang dicobakan adalah alum, PAC, FeCl3.
Tahapan awal yang dilakukan dalam penelitian ini adalah melakukan uji toksisitas efluen terhadap ikan. Hal ini bertujuan untuk mengetahui bahwa efluen setelah proses klorinasi bersifat toksik bagi ikan. Tahapan selanjutnya adalah melakukan uji perubahan dosis kaporit terhadap efluen untuk menemukan dosis optimum sehingga dapat mengurangi residu klorin dalam efluen. Kemudian dilakukan penentuan awal dosis koagulan melalui proses koagulasi – flokulasi dengan menggunakan peralatan Jartest untuk mendapatkan tiga dosis terbaik. Tahapan selanjutnya adalah proses koagulasi – flokulasi dengan memberikan perlakuan pH pada tiga dosis terbaik dari tahapan sebelumnya. Kemudian efluen hasil proses koagulasi – flokulasi tersebut diuji nilai kekeruhan, warna, dan klorinnya. Koagulan dengan dosis dan pH terbaik ditentukan berdasarkan hasil uji kekeruhan dan warna yang terendah.
Suci Yuliati. F34101060. Coagulation – Flocculation Process in Tertiary Wastewater Treatment of PT. Capsugel Indonesia. Under The Guidance of Muhammad Romli and Andes Ismayana. 2006.
ABSTRACT
Coagulation – flocculation process is one of ways of wastewater treatment to eliminate particle in it. Coagulation as physical chemistry process of coagulant addition into wastewater stream and mixed rapidly in the form of liquid mixed. Flocculation is forming floc process at slow mix to increase each other link to floc particle and it would become its agglomeration.
This research is purposed to study the use of various coagulant for coagulation – flocculation process in tertiary wastewater treatment of PT. Capsugel Indonesia, and it also to examine the effect of various dosage and pH addition on each coagulant. The coagulants to be analyzed are alum, PAC, and FeCl3.
The first step within this research was performed by testing the effluent toxicity on fishes. This is purposed to examine that the effluent after the chlorination process would become a toxic for fishes. The next step is testing the change of calcium hypochlorite dosage to the effluent to find the optimum dosage and it would become reduce the residual chlorine in the effluent. It would also perform by first determining of coagulant dosage with coagulation – flocculation process using Jartest equipment, and it would purpose to get three best dosages. Furthermore, those dosages are treated with pH. The effluent that produced by coagulation – flocculation process will be tested for its turbidity, color, and chlorine. The optimum dosage and pH of coagulant are determined based on the lowest value of its turbidity and color.
iv
PROSES KOAGULASI – FLOKULASI
PADA PENGOLAHAN TERSIER LIMBAH CAIR
PT. CAPSUGEL INDONESIA
Oleh
SUCI YULIATI
F34101060
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
2006
FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN
PROSES KOAGULASI – FLOKULASI
PADA PENGOLAHAN TERSIER LIMBAH CAIR
PT. CAPSUGEL INDONESIA
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen Teknologi Industri Pertanian Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
SUCI YULIATI
F34101060
Dilahirkan pada tanggal 13 Juli 1983 di Jakarta – Indonesia
Tanggal Lulus : 28 April 2006
Menyetujui, Bogor, Mei 2006
vi
RIWAYAT HIDUP SINGKAT
Penulis bernama lengkap Suci Yuliati, dilahirkan di Jakarta, 13 Juli 1983 dari Bapak K. Sudiyono dan Ibu Kasriti. Pendidikan dasar penulis dilakukan di SDN 08 Pagi Cipinang Besar Selatan – Jakarta pada tahun 1989-1995. Kemudian dilanjutkan ke SLTPN 117 Duren Sawit – Jakarta pada tahun 1995-1998 dan SMUN 54 Jatinegara – Jakarta tahun 1998-2001.
Pendidikan tinggi dilanjutkan di IPB pada Fakultas Teknologi Pertanian (FATETA) – Departemen Teknologi Industri Pertanian melalui jalur Undangan Seleksi Masuk IPB (USMI – 2001).
Penulis telah menyelesaikan penelitian akhir dan menyusun skripsi di bawah bimbingan Dr. Ir. Muhammad Romli, MSc. (dosen pembimbing I) dan Ir. Andes Ismayana, MT. (dosen pembimbing II). Skripsi dengan judul ”Proses Koagulasi – Flokulasi Pada Pengolahan Tersier Limbah Cair PT. Capsugel Indonesia” dibuat berdasarkan penelitian yang telah dilakukan pada bulan Juni – Oktober 2005 di Laboratorium IPAL PT. Capsugel Indonesia – Cibinong dan di Laboratorium TIN – FATETA IPB.
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul ”Proses Koagulasi – Flokulasi Pada Pengolahan Tersier Limbah Cair PT. Capsugel Indonesia” adalah karya hasil saya sendiri dengan arahan dosen pembimbing akademik, kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, Mei 2006
i
KATA PENGANTAR
Puji dan syukur penulis panjatkan ke hadirat Allah SWT karena berkat rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Skripsi dengan judul ”Proses Koagulasi – Flokulasi Pada Pengolahan Tersier Limbah Cair PT. Capsugel Indonesia” disusun berdasarkan penelitian akhir yang telah dilaksanakan pada bulan Juni – Oktober 2005 di PT. Capsugel Indonesia – Cibinong dan di Departemen Teknologi Industri Pertanian, FATETA – IPB.
Pada kesempatan yang sangat baik ini, penulis ingin mengucapkan terima kasih kepada:
1. Ibunda Kasriti, Bapak Sudiyono tercinta dan keluarga besar penulis yang selalu memberikan bimbingan, cinta, kasih sayang, dan doa pada penulis selama menjalani pendidikan di IPB.
2. Dr. Ir. Muhammad Romli, MSc., sebagai dosen pembimbing I yang telah memberikan bimbingan dan dukungan selama penulis menjalani pendidikan di FATETA IPB.
3. Ir. Andes Ismayana, MT., sebagai dosen pembimbing II yang telah memberikan arahan dan nasehat serta memotivasi penulis selama pelaksanaan tugas akhir ini hingga selesai.
4. Bapak Edi Suyadi selaku Plant Manager PT. Capsugel Indonesia yang telah mengizinkan penulis untuk melaksanakan penelitian.
5. Bapak Hadi Sulistyanto (mantan ME Manager) dan Bapak Idwan selaku ME Manager PT. Capsugel Indonesia yang telah mengakomodasikan semua kebutuhan penelitian.
6. Bapak Maryudi dan seluruh karyawan PT. Capsugel Indonesia – Cibinong yang telah memberikan bimbingan dan dukungan kepada penulis selama melakukan penelitian.
7. Taufiq Kurniawan yang telah memberikan dukungan dan memotivasi penulis selama penyelesaian tugas akhir.
9. Anis Annisa Adnan, Henny Wijaya Arief, dan Yulnia Azriani atas kebersamaan, dukungan, bantuan, dan kekompakannya dengan penulis selama menjalani kuliah di IPB.
10.Teman – teman TIN 38 atas kebersamaan dan kekompakannya selama menjalani kuliah di IPB.
11.Staf pegawai FATETA IPB dan semua pihak yang telah membantu penulis. Semoga skripsi hasil penelitian akhir ini dapat memberikan banyak manfaat bagi yang membutuhkannya. Penulis menyadari tidak ada sesuatu yang sempurna, begitu pula dalam penyusunan skripsi ini sehingga kritik dan saran yang membangun sangat penulis harapkan.
Bogor, Mei 2006
iii
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... viii
I. PENDAHULUAN ... 1
A. LATAR BELAKANG ... 1
B. TUJUAN PENELITIAN ... 2
II. TINJAUAN PUSTAKA ... 3
A. PENGOLAHAN LIMBAH CAIR PT. CAPSUGEL INDONESIA .... 3
B. KOAGULASI DAN FLOKULASI ... 5
C. KOAGULAN ... 8
D. KLORINASI ... 12
III. METODOLOGI ... 16
A. BAHAN DAN ALAT ... 16
B. TAHAPAN PENELITIAN ... 16
1. Karakterisasi Efluen ... 16
2. Penelitian Pendahuluan ... 16
a. Uji Toksisitas Efluen Terhadap Ikan... 16
b. Proses Optimasi Penggunaan Kaporit dengan Jartest ... 17
c. Proses Penentuan Awal Dosis Koagulan ... 18
3. Penelitian Utama ... 19
C. ANALISA DATA ... 20
IV. HASIL DAN PEMBAHASAN ... 22
A. SUMBER DAN KARAKTERISTIK EFLUEN ... 22
B. UJI TOKSISITAS EFLUEN TERHADAP IKAN ... 23
C. OPTIMASI PENGGUNAAN KAPORIT ... 25
D. PROSES KOAGULASI – FLOKULASI AWAL ... 26
2. PAC ... 28
3. FeCl3 ... 29
E. PENELITIAN UTAMA ... 31
1. Alum ... 31
2. PAC ... 37
3. FeCl3 ... 42
F. PERBANDINGAN HASIL PROSES KOAGULASI – FLOKULASI KETIGA KOAGULAN ... 48
V. KESIMPULAN DAN SARAN ... 50
A. KESIMPULAN ... 50
B. SARAN ... 50
DAFTAR PUSTAKA ... 52
v
DAFTAR TABEL
Halaman Tabel 1. Hasil proses klorinasi dengan penambahan kaporit pada IPAL PTCI .. 13Tabel 2. Kondisi uji toksisitas efluen terhadap ikan ... 17
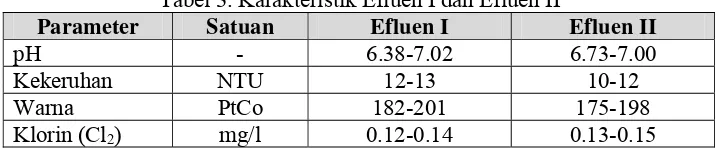
Tabel 3. Karakteristik Efluen I dan Efluen II ... 23
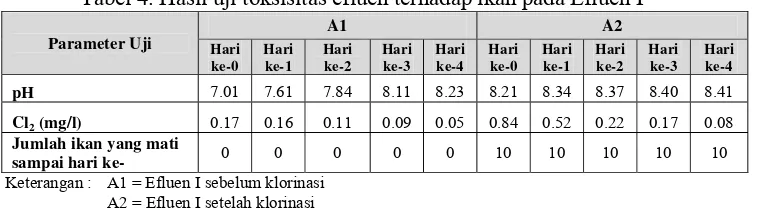
Tabel 4. Hasil uji toksisitas efluen terhadap ikan pada Efluen I ... 24
Tabel 5. Hasil uji toksisitas efluen terhadap ikan pada Efluen II ... 24
Tabel 6. Hasil analisis persen penurunan parameter pada perlakuan pH 6.5 ... 25
Tabel 7. Hasil analisis proses optimasi penambahan kaporit perlakuan pH 6.5 ... 26
DAFTAR GAMBAR
Halaman
Gambar 1. Skema proses input output penelitian... 19
Gambar 2. Peralatan Jartest ... 20
Gambar 3. Penampakan Efluen I dan Efluen II ... 22
Gambar 4. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen I (alum) ... 27
Gambar 5. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen II (alum) ... 28
Gambar 6. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen I (PAC) ... 29
Gambar 7. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen II (PAC) ... 29
Gambar 8. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen I (FeCl3) ... 30
Gambar 9. Hasil analisa koagulasi – flokulasi dengan perlakuan dosis pada Efluen II (FeCl3) ... 31
Gambar 10. Hubungan nilai pH dan kekeruhan pada Efluen I (alum) ... 33
Gambar 11. Hubungan nilai pH dan kekeruhan pada Efluen II (alum) ... 33
Gambar 12. Hubungan nilai pH dan warna pada Efluen I (alum) ... 34
Gambar 13. Hubungan nilai pH dan warna pada Efluen II (alum) ... 35
Gambar 14. Hubungan nilai pH dan klorin pada Efluen I (alum) ... 36
Gambar 15. Hubungan nilai pH dan klorin pada Efluen II (alum) ... 36
Gambar 16. Hubungan nilai pH dan kekeruhan pada Efluen I (PAC) ... 38
Gambar 17. Hubungan nilai pH dan kekeruhan pada Efluen II (PAC) ... 38
Gambar 18. Hubungan nilai pH dan warna pada Efluen I (PAC) ... 40
Gambar 19. Hubungan nilai pH dan warna pada Efluen II (PAC) ... 40
Gambar 20. Hubungan nilai pH dan klorin pada Efluen I (PAC) ... 42
Gambar 21. Hubungan nilai pH dan klorin pada Efluen II (PAC) ... 42
vii
Gambar 24. Hubungan nilai pH dan warna pada Efluen I (FeCl3) ... 46
Gambar 25. Hubungan nilai pH dan warna pada Efluen II (FeCl3) ... 46
Gambar 26. Hubungan nilai pH dan klorin pada Efluen I (FeCl3) ... 47
DAFTAR LAMPIRAN
Halaman Lampiran 1. Tata kerja analisa dan pengujian ... 55 Lampiran 2. Diagram alir pengolahan air limbah di IPAL PT. Capsugel Indonesia ... 57 Lampiran 3. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada alum (kekeruhan) ... 58
Lampiran 4. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada alum (warna) ... 59
Lampiran 5. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada alum (Cl2) ... 60 Lampiran 6. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada PAC (kekeruhan) ... 61 Lampiran 7. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada PAC (warna)... 62 Lampiran 8. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada PAC (Cl2) ... 63
Lampiran 9. Analisa pengaruh antar perlakuan dan uji lanjut Duncan pada FeCl3 (kekeruhan) ... 64
ix Lampiran 16. Hasil analisa koagulasi – flokulasi penelitian utama pada Efluen I ... 71 Lampiran 17. Hasil analisa koagulasi – flokulasi penelitian utama pada Efluen II ... 74 Lampiran 18. Hasil analisa persen penurunan parameter Efluen I ... 77
Lampiran 19. Hasil analisa persen penurunan parameter Efluen II ... 80 Lampiran 20. Baku Mutu Perairan Berdasarkan Kelas, PP No. 82 Tahun
I. PENDAHULUAN
C. LATAR BELAKANG
Proses koagulasi – flokulasi merupakan salah satu cara pengolahan limbah cair untuk menghilangkan partikel-partikel yang terdapat didalamnya. Koagulasi diartikan sebagai proses kimia fisik dari pencampuran bahan koagulan ke dalam aliran limbah dan selanjutnya diaduk cepat dalam bentuk larutan tercampur. Flokulasi adalah proses pembentukan flok pada pengadukan lambat untuk meningkatkan saling hubung antar partikel yang goyah sehingga meningkatkan penyatuannya (aglomerasi).
Proses saling mengikat antar partikel atau terjadinya pembentukan flok dapat dijelaskan dalam berbagai macam teori. Pertama, pembentukan flok terjadi karena adanya tumbukan partikel koloid dengan koagulan (sweep
coagulation). Kedua, pembentukan flok terjadi karena terjadi
penetralan/pemuatan partikel koloid yang dilanjutkan dengan adanya gaya tarik menarik antar partikel. Ketiga, pembentukan penghubung polimer (inter particle bridging). Pemahaman terjadinya proses pembentukan flok tersebut tergantung dari macam koagulan yang ditambahkan dalam proses tersebut.
Koagulan adalah bahan kimia yang mempunyai kemampuan menetralkan muatan koloid dan mengikat partikel tersebut sehingga siap/mudah membentuk flok atau gumpalan (Hammer, 1986). Bahan kimia yang dapat digunakan sebagai koagulan adalah kapur, alum, dan polielektrolit (organik sintesis) (Hammer, 1986), koagulan anorganik [poly alumunium chloride (PAC)] (Wenbin et al., 1999), dan garam-garam besi seperti feri klorida dan besi sulfat (Davis dan Cornwell, 1991).
2 kekeruhan akibat proses koagulasi – flokulasi ditujukan juga untuk mengurangi warna dalam limbah cair sebelum masuk ke tahap pengolahan selanjutnya.
PT. Capsugel Indonesia (PTCI) merupakan industri yang bergerak di bidang farmasi dengan memproduksi cangkang kapsul dengan bahan dasar gelatin. Limbah cair yang dihasilkan dari proses tersebut telah mengalami pengolahan pada IPAL yang dimiliki oleh PT. Capsugel Indonesia yaitu melalui tahapan pengolahan primer (ekualisasi, penurunan suhu, dan pengaturan pH), pengolahan sekunder (denitrifikasi, nitrifikasi), dan pengolahan tersier (klorinasi).
Pada pengolahan tersier, proses klorinasi yang dilakukan bertujuan untuk membantu menghilangkan warna yang masih tersisa dalam efluen. Berdasarkan pengamatan pada kolam indikator yang ditempatkan setelah proses pengolahan tersier (klorinasi), terlihat adanya kematian ikan yang terdapat didalamnya. Kematian ikan ini diduga disebabkan oleh kadar klorin efluen yang tinggi yaitu mencapai 0.78-4.62 mg/l. Menurut www.o-fish.com (2002), klorin sangat beracun bagi ikan, dan untuk menghindari efek berbahaya dari bahan tersebut maka residu klorin dalam air harus dijaga agar tidak lebih dari 0.003 mg/l dan klorin pada konsentrasi 0.2 - 0.3 mg/l sudah cukup untuk membunuh ikan dengan cepat. Oleh karena itu, diperlukan suatu penanganan yang tepat dalam menangani permasalahan ini, salah satu caranya adalah dengan proses koagulasi dan flokulasi sebagai substitusi proses klorinasi.
D. TUJUAN PENELITIAN
Penelitian ini dilakukan dengan tujuan, yaitu :
1. Mempelajari penggunaan beberapa koagulan untuk proses koagulasi – flokulasi pada pengolahan tersier limbah cair PT. Capsugel Indonesia. 2. Mengetahui pengaruh penambahan dosis koagulan dan pH yang berbeda
II. TINJAUAN PUSTAKA
E. PENGOLAHAN LIMBAH CAIR PT. CAPSUGEL INDONESIA
Pengolahan air limbah di PT. Capsugel Indonesia meliputi pengolahan secara fisika, kimia dan biologis. Tahapan pengolahannya tidak selalu sama tergantung dari karakteristik air limbah dan dengan treatability test dapat diketahui pengolahan apa yang tepat.
Pengolahan air limbah secara fisika meliputi : penurunan suhu, penyaringan, ekualisasi, pengendapan, dan mixing. Pengolahan secara kimia meliputi : koagulasi dan flokulasi, presipitasi, pengaturan pH, oksidasi, dan desinfeksi. Pengolahan biologi meliputi nitrifikasi dan denitrifikasi.
Berikut ini adalah gambaran secara umum proses pada IPAL : 1. Ekualisasi
Sebelum diolah air limbah ditampung dalam bak ekaluasasi. Untuk meratakan konsentrasi dan debit, agar air limbah dapat diolah dengan debit yang sama dan konsentrasi rata-rata yang mendekati sama. Bak ekualisasi dilengkapi dengan pompa transfer berikut Water Level Control (WLC) yang mengatur mati hidupnya pompa. Jika air mencapai level minimum, pompa mati dan pompa akan jalan lagi air mencapai level maksimum.
2. Cooling Tower
Cooling Tower berfungsi untuk menurunkan temperatur air limbah yang berasal dari bak ekualisasi hingga sesuai yang disarankan untuk pengolahan secara biologis (maksimum 35 °C).
3. Pengaturan pH
Dari ekualisasi air limbah dipompa ke bak pengaturan pH untuk diatur pada range pH 7-8.5 dengan menggunakan bahan kimia Na2CO3. Waktu tinggal yang dipakai adalah 6 menit.
4. Anosik
4 dan OH-. Pada proses denitrifikasi tidak ada penambahn O2. Untuk menjaga bakteri tetap tersuspensi maka dipakai pengaduk mekanik.
5. Aerasi
Dalam bak aerasi air limbah mengalami proses nitrifikasi dimana ammonium diubah oleh bakteri Nitrosomonas dengan bantuan oksigen menjadi NO2- dan sel baru. Kemudian oleh bakteri nitrobakter NO2 -diubah menjadi NO3- dan sel baru. Dissolved oxygen (DO) dijaga minimal 2 mg/L dengan penambahan oksigen dari blower. Sebagian air limbah mengalir ke bak sedimentasi dan sebagian lagi dipompa kembali ke bak pengaturan pH dan terus masuk ke bak anosik (internal recycle). Pada aliran internal recycle dipasang flow meter untuk mengetahui debit air limbah yang dikembalikan ke bak anosik.
6. Bak Sedimentasi / Clarifier
Dari bak aerasi air limbah mengalir ke bak sedimentasi. Di sini flok-flok bakteri (biomass) yang ikut dalam effluent aerasi diendapkan dan dipompa kembali ke bak anosik melalui bak pengatur pH, supaya Mixed Liquor Suspended Solid (MLSS) diatur cukup tinggi sesuai dengan kriteria disain (3000 mg/L). Pada aliran ini juga dilengkapi flow meter dan kelebihan lumpur dapat dibuang ke bak pengumpul lumpur. Overflow rate yang digunakan maksimum 0.7 m/jam. Air limbah yang berupa cairan jernih kemudian mengalir ke bak klorinasi.
7. Klorinasi
Sebelum dibuang ke lingkungan air limbah melewati bak klorinator untuk proses desinfektan dan juga membantu mengurangi konsentrasi ammonium dan warna yang masih tersisa dalam effluent. Waktu tinggal yang dipakai adalah 30 menit.
8. Sand Filter
9. Bak Kontrol
Air hasil perlakuan pada sand filter ditampung dalam bak control sebelum dialir untuk keperluan cooling tower, recycle dan dibuang ke saluran umum.
10.Sludge Holding Tank / SHT
SHT berfungsi untuk menampung lumpur yang dibuang dari bak sedimentasi sebelum diangkut dari TPA. Pada SHT ini terdapat 2 buah
outlet untuk supernatan dan satu buah outlet untuk pembuangan lumpur. 11.Weir V-notch flow meter dengan ultrasonic level meter
Untuk mengetahui debit inlet dan outlet di dalam proses pengolahan air limbah. Di sini ultrasonic flow meter dipasang di dua tempat yaitu pada inlet (sebelum masuk bak pengaturan pH) dan outlet sebelum dibuang ke lingkungan.
12.Tangki Kimia
Pada proses pengolahan air limbah di PT. Capsugel ini dibutuhkan 4 buah tangki untuk penyiapan bahan-bahan yang dibutuh dalam pengolahan yaitu Na2CO3, HCl (tidak dipakai lagi), TSP dan kaporit. Masing-masing tangki dilengkapi pompa dosing agar bahan kimia dapat dipompa sesuai kebutuhan dan mixer untuk melarutkan bahan kimia yang sukar larut.
F. KOAGULASI DAN FLOKULASI
Menurut Alaerts dan Santika (1987), jenis partikel koloid merupakan penyebab kekeruhan dalam air (efek Tyndall) yang disebabkan oleh penyimpangan sinar nyata yang menembus suspensi tersebut. Partikel-partikel koloid tidak terlihat secara visual sedangkan larutannnya (tanpa partikel koloid) yang terdiri dari ion-ion dan molekul-molekul tidak pernah keruh. Larutan tidak keruh jika terjadi pengendapan (presipitasi) yang merupakan keadaan kejenuhan dari suatu senyawa kimia.
6 berikatan membentuk flok-flok besar dari partikel koloid yang berukuran sangat kecil. Hal ini disebut sebagai proses flokulasi.
Menurut Steel dan McGhee (1985), koagulasi diartikan sebagai proses kimia fisik dari pencampuran bahan kimia ke dalam aliran limbah dan selanjutnya diaduk cepat dalam bentuk larutan tercampur. Flokulasi adalah proses penambahan flokulan pada pengadukan lambat untuk meningkatkan saling hubung antar partikel yang goyah sehingga meningkatkan penyatuannya (aglomerasi).
Metcalf dan Eddy (1991), menyatakan bahwa untuk mendorong pembentukan agregat pertikel, harus diambil langkah-langkah tertentu guna mengurangi muatan atau mengatasi pengaruh muatan partikel. Pengaruh muatan dapat diatasi dengan : (1) penambahan ion berpotensi menentukan muatan sehingga terserap atau bereaksi dengan permukaan koloid untuk mengurangi muatan permukaan, atau penambahan elektrolit yang akan memberikan pengaruh mengurangi ketebalan lapisan difusi listrik sehingga mengurangi zeta potensial, (2) penambahan molekul organik berantai panjang (polimer) yang sub-bagiannya dapat diberi muatan sehingga disebut polielektrolit, hal ini menyebabkan penghilangan partikel melalui adsorbsi dan pembuatan penghubung (bridging), dan (3) penambahan bahan kimia yang membentuk ion-ion yang terhidrolisis oleh logam.
Menurut Hammer (1986), dua gaya yang menentukan kekokohan koloid adalah,(1)gaya tarik menarik antar partikel yang disebut dengangaya
Vander Walls, cenderung membentuk agregat yang lebih besar, (2) gaya tolak menolak yang disebabkan oleh pertumpangtindihan lapisan tanda elektrik yang bermuatan sama yang mengakibatkan kekokohan dispersi koloid.
paling ekonomis dapat dicapai dengan menggunakan anionik polimer, walaupun padatan yang terkandung dalam air bermuatan negatif (Weber, 1972).
Agar proses destabilisasi efektif, molekul polimer harus mengandung kelompok kimia yang dapat berinteraksi dengan permukaan partikel koloid. Pada saat terjadi kontak antara molekul polimer dengan partikel koloid, beberapa dari kelompok kimia pada polimer terserap ke permukaan partikel, meninggalkan molekul polimer yang tersisa pada larutan. Apabila terjadi kontak antar molekul polimer yang tersisa dengan partikel kedua yang memiliki permukaan adsorbsi yang kosong, maka akan terjadi ikatan. Partikel polimer komplek akan terbentuk dengan polimer sebagai penghubung. Jika partikel kedua tidak dapat berikatan, maka seiring dengan waktu bagian polimer yang tersisa perlahan akan terserap pada permukaan partikel yang lain, sehingga polimer tidak dapat lagi berfungsi sebagai penghubung.
Dosis polimer yang berlebih akan mengakibatkan koloid menjadi stabil kembali karena tidak adanya ruang untuk membentuk penghubung antar partikel. Pada kondisi tertentu, sustu sistem yang telah didestabilisasi dan membentuk agregat dapat menjadi stabil kembali dengan meningkatkan agitasi, akibat putusnya polimer permukaan partikel dan proses berulang antara polimer tersisa dengan permukaan partikel (Weber, 1972).
Menurut Benefield et al. (1982), untuk merangsang partikel koloid bergabung membentuk gumpalan yang lebih besar diperlukan dua cara, yaitu partikel harus didestabilisasikan dan dipindahkan. Destabilisasi partikel dapat dicapai melalui cara penekanan lapisan ganda listrik, penyerapan untuk netralisasi, penjeratan pada presipitasi, dan pembentukan antar partikel.
8 sedangkan yang muatannya berlawanan akan tarik menarik (Surdia et al., 1981).
Menurut Nathanson (1977), keberhasilan dari proses koagulasi dan flokulasi tergantung beberapa faktor diantaranya adalah dosis koagulan yang diberikan, suhu dari limbah, pH dan alkalinitas. Dosis koagulan yang diberikan disesuaikan dengan karakteristik dari air limbah yang akan ditangani. Untuk mengetahui dosis optimum koagulan dilakukan pengujian dilaboratorium menggunakan peralatan yang disebut Jartest.
G. KOAGULAN
Koagulan adalah bahan kimia yang mempunyai kemampuan menetralkan muatan koloid dan mengikat partikel tersebut sehingga membentuk flok atau gumpalan (Hammer, 1986).
Menurut Davis dan Cornwell (1991), koagulan merupakan substansi kimia yang dimasukkan ke dalam air untuk menghasilkan efek koagulasi. Ada tiga hal penting yang harus diperhatikan pada suatu koagulan, yaitu:
1. Kation bervalensi tiga (trivalen). Kation trivalen merupakan kation yang paling efektif untuk menetralkan muatan listrik koloid.
2. Tidak beracun (toksik). Persyaratan ini diperlukan untuk menghasilkan air atau air limbah hasil pengolahan yang aman.
3. Tidak larut dalam kisaran pH netral. Koagulan yang ditambahkan harus terpresipitasi dari larutan, sehingga ion-ion tersebut tidak tertinggal dalam air.
Menurut Hammer (1986), bahan kimia yang digunakan sebagai koagulan adalah kapur, alum, dan polielektrolit (organik sintesis). Polielektrolit dapat berupa kation, anion, nonionik dan Miccellaneous (Liu dan Liptak, 2000). Garam-garam besi seperti feri klorida (FeCl3) dan besi sulfat (Fe2(SO4)3.H2O) dapat dipergunakan pula sebagai koagulan (Davis dan Cornwell, 1991).
Alumunium sulfat dan poly alumunium chloride (PAC) merupakan koagulan anorganik dengan produksi terbanyak.
Menurut Suciastuti dan Sutrisno (1987), alumuniun sulfat biasanya disebut juga sebagai tawas. Bahan ini banyak dipakai, karena efektif untuk menurunkan kadar karbonat. Bahan ini paling ekonomis (murah) dan mudah didapat pada pasaran serta mudah disimpan. Menurut Alaerts dan Santika (1987), alum dalam air akan mengalami proses hidrolisis menurut reaksi umum adalah sebagai berikut:
Al2(SO4)3 + 6H2O 2Al(OH)3 + 6H+ + 3SO4
2-Menurut Davis dan Cornwell (1991), alum padat komersil (Al2(SO4)3.14H2O) mempunyai bobot molekul 594. Komposisi alum padat terdiri 48.8 persen alum (8.3% Al2O3) dan 51.2 persen air.
Menurut Kurniawan (2005), penambahan alum pada air lindi (cairan sampah) dengan dosis 15 mg/l hingga 80 mg/l dapat menurunkan kekeruhan sebesar 64.43 persen hingga 87.20 persen dan menurunkan warna sebesar 40.50 persen hingga 73.97 persen, dan menurut Pujiantoro (1995), penambahan alum pada penanganan primer limbah cair industri rayon dengan dosis 100 mg/l hingga 400 mg/l dapat menurunkan kekeruhan sebesar 76 persen hingga 90 persen. Proses koagulasi – flokulasi dengan koagulan alum, kisaran pH yang mungkin adalah pada pH 5 hingga pH 8 (Davis dan Cornwell, 1991).
10 Menurut Hardman (2005), PAC terdiri dari berbagai jenis, yaitu sebagai berikut:
1. PAC-AC
PAC yang mempunyai basicity yang tinggi dalam cairannya untuk proses koagulasi pada pengolahan air minum dan limbah cair.
2. PAC-SP
PAC yang mempunyai basicity yang sedang dalam cairannya untuk proses koagulasi pada pengolahan air minum dan limbah cair.
3. PAC-PW
PAC yang mempunyai basicity yang sedang dalam cairannya untuk proses koagulasi pada pengolahan air minum dan limbah cair dengan berbagai kondisi yang luas.
Dalam cairan PAC, ion-ion garam alumunium dibentuk menjadi polimer-polimer yang terdiri dari sekelompok ion yang dihubungkan oleh atom-atom oksigen. Polimer-polimer ini hanya terbentuk dalam cairan garam alumunium yang sebagian telah dinetralkan melalui reaksi dengan basa. Derajat polimerisasi meningkat seiring dengan besarnya netralisasi. Netralisasi mengubah karakteristik dasar cairan. Netralisasi total garam aluminium mengakibatkan presipitasi aluminium hidroksida, dengan formula Al(OH)3 atau Al2(OH)6. Pada formula Hardman untuk PAC-AC (Concentrated High
Basicity Poly Aluminium Chloride Solution) yaitu Al2(OH)5Cl, diduga sebanyak 5/6 larutan Al(OH)3 ternetralisasi (Hardman Australia Pty Ltd., 2002).
Senyawa PAC mempunyai karakteristik tertentu, seperti: padatan berwarna kuning jernih, titik didih lebih dari 100ºC, titik beku -12ºC, specific grafity 1.36-1.38, larut dalam air dan stabil di bawah kondisi biasa (www.chemicalland21.com, 2005).
temperatur rendah (T<10ºC), flok terbentuk sangat cepat, serta memiliki waktu singkat untuk bereaksi dan mengendap (Wenbin et al., 1999).
Beberapa keuntungan koagulan PAC adalah selain sangat baik untuk menghilangkan kekeruhan dan warna, memadatkan dan menghentikan penguraian flok, membutuhkan kebasaan rendah untuk hidrolisis, sedikit berpengaruh pada pH, menurunkan atau menghilangkan kebutuhan penggunaan polimer, serta mengurangi dosis koagulan sebanyak 30–70% (Eaglebrook Inc., 1999).
Menurut Kurniawan (2005), penambahan dosis PAC pada air lindi (cairan sampah) dalam kisaran 10 mg/l hingga 60 mg/l dapat menurunkan kekeruhan sebesar 49.24 persen hingga 81.34 persen dan warna sebesar 3.72 persen hingga 62.98 persen. Proses koagulasi – flokulasi dengan koagulan PAC akan menurunkan kadar COD 40 – 70% dengan perlakuan pH dibawah 6.5 (Klimiuk et al.,1999).
Feri Klorida (FeCl3.6H2O) merupakan koagulan utama dalam proses koagulasi limbah cair industri. Reaksi hidrolisis feri klorida mirip dengan reaksi hidrolisis alum. Pemakaian feri klorida terbatas untuk penanganan beberapa limbah cair industri. Feri klorida dibuat dari reaksi klorinasi besi, tersedia dalam bentuk padatan atau cairan dan sangat korosif (Hammer, 1986).
Menurut Davis dan Cornwell (1991), besi dapat diperoleh dari garam sulfat Fe2(SO4)3.H2O atau garam klorida FeCl3.xH2O yang tersedia dalam bentuk padatan atau larutan. Reaksi FeCl3 dalam air yang mengandung alkalinitas adalah sebagai berikut :
FeCl3 + 3 HCO3- Fe(OH)3(s) + 3CO2 + 3Cl- Dan reaksinya dalam air yang tidak mengandung alkalinitas adalah:
FeCl3 + 3H2O Fe(OH)3(s) + 3HCl Pembentukan asam klorida akan menurunkan pH.
12 koagulan FeCl3 pada proses koagulasi – flokulasi adalah pH 4 hingga pH 9 (Davis dan Cornwell,1991).
Menurut www.menlh.go.id/usaha-kecil/ (2003), Pengolahan limbah cair pada pabrik tekstil dilakukan apabila limbah pabrik mengandung zat warna, maka aliran limbah dari proses pencelupan harus dipisahkan dan diolah tersendiri. Limbah operasi pencelupan dapat diolah dengan efektif untuk menghilangkan logam dan warna, jika menggunakan flokulasi kimia, koagulasi dan penjernihan yaitu dengan menggunakan garam feri (FeCl3). Limbah dari pengolahan kimia dapat dicampur dengan semua aliran limbah yang lain untuk dilanjutkan ke pengolahan biologi.
Pada beberapa pengolahan limbah cair FeCl3 dapat digunakan sebagai
flocculating agent, etching agent untuk penanganan permukaan logam, dan desinfektan (www.chemicalland21.com, 2005). Koagulan FeCl3 dapat menimbulkan masalah, terutama timbulnya warna dan sifat korosif apabila proses koagulasi tidak berlangsung dengan baik. Timbulnya warna tersebut dikarenakan oleh Fe3+ dari koagulan yang terlarut dalam air olahan. Adanya Fe3+ yang terlarut dalam air olahan menyebabkan timbulnya warna merah (Reynolds, 1982; Peavy et al., 1986).
H. KLORINASI
Proses klorinasi pada IPAL PT. Capsugel Indonesia terjadi pada tahap pengolahan tersier (setelah proses sedimentasi). Sebelum dibuang ke lingkungan efluen melewati proses klorinasi dengan menambahkan kaporit [Ca(OCl)2] sebagai desinfektan dan juga membantu mengurangi konsentrasi ammonium dan warna yang masih tersisa dalam efluen.
Produksi cangkang kapsul dengan pewarna “Erythrosin B” akan menghasilkan efluen berwarna bening kemerahan (Efluen I), sedangkan produksi cangkang kapsul dengan pewarna “Brilliant Blue FCF” akan menghasilkan efluen berwarna bening kebiruan (Efluen II).
Tabel 1. Hasil proses klorinasi dengan penambahan kaporit pada IPAL PTCI
Parameter
Kaporit (24 – 32 mg/l )
Efluen I Efluen II
Kekeruhan (NTU) 0.03 < 0.01
Warna (PtCo) 0 0
Klorin (mg/l) 4.62 4.39
Sumber: PT. Capsugel Indonesia (2005).
Klorinasi adalah proses penambahan senyawa klor (kaporit) ke dalam air sebagai penjernih air sehingga dapat dikonsumsi oleh manusia (www.wikipedia.com, 2006). Air yang telah bereaksi dengan klor efektif mencegah penyebaran penyakit. Namun, dengan proses klorinasi ini menjadikan kadar klorin (Cl2) dalam efluen meningkat. Jika penambahan klor dilakukan secara kurang tepat dan kadarnya melebihi ambang batas yang ditentukan dapat bersifat toksik bagi makhluk perairan serta menimbulkan bau dan rasa pada air (Effendi, 2003).
Menurut www.wikipedia.com (2006), kalsium hipoklorit merupakan suatu garam dari asam hipoklorus (HClO). Kalsium hipoklorit adalah bubuk penghilang warna (bleaching powder). Di dalam air olahan, kalsium hipoklorit secara parsial membelah menjadi kation Ca2+ dan anion ClO-, sedangkan bagian yang substansial terhidrolisis menjadi kalsium hidroksida dan asam hipoklorus. Kemampuan terakhir anion hipoklorit untuk mengoksidasi menyebabkan efek penghilangan warna (bleaching effect).
Warna di dalam kebanyakan pewarna dan pigmen dihasilkan oleh molekul, seperti beta karotin, yang mengandung bagian pembawa warna yang dikenal sebagai kromopor. Bahan kimia penghilang warna (bleaches) bekerja dengan cara:
14 menjadi sebuah substansi yang berbeda yang mana tidak mengandung kromopor atau kromopor yang tidak menyerap cahaya tampak.
2. Penghilang warna pereduksi bekerja dengan mengubah ikatan ganda pada kromopor menjadi ikatan tunggal. Hal ini menghilangkan kemampuan kromopor untuk menyerap cahaya tampak (www.wikipedia.com, 2006).
Kaporit sering digunakan sebagai desinfektan untuk menghilangkan mikroorganisme yang tidak dibutuhkan, terutama bagi air yang diperuntukkan bagi kepentingan domestik. Beberapa alasan yang menyebabkan kaporit sering digunakan sebagai desinfektan adalah sebagai berikut:
1. Dapat dikemas dalam bentuk gas, larutan, dan bubuk (powder) 2. Relatif murah
3. Memiliki daya larut yang tinggi serta dapat larut pada kadar yang tinggi (7.000 mg/l).
4. Residu klorin dalam bentuk larutan tidak berbahaya bagi manusia, jika terdapat dalam kadar yang berlebihan
5. Bersifat sangat toksik bagi organisme perairan, dengan cara menghambat aktivitas metabolisme organisme tersebut.
(Tebbut, 1992).
Kaporit merupakan bahan kimia yang biasa digunakan sebagai pembunuh kuman (disinfektan) di perusahan-perusahan air minum seperti PAM atau PDAM. Klorin (Cl2) merupakan gas berwarna kuning kehijauan dengan bau yang menyengat. Bau ini bisa dikenali seperti bau air kolam renang yang biasanya secara intensif diberi perlakuan klorinasi dengan kaporit (www.o-fish.com, 2002). Kaporit (kapur klorida) dalam air akan membentuk kalsium hipoklorit [Ca(OCl)2] yang merupakan molekul klor/klorin (Cl2) (Riegel, 1933). Klorin bekerja dengan baik pada kondisi asam ataupun netral dengan pH antara 1.5 – 7 (www.terranet.com, 2006).
kondisi demikian proporsi asam hipoklorus yang terbentuk akan meningkat (www.o-fish.com, 2002).
16
III. METODOLOGI
D. BAHAN DAN ALAT
Bahan-bahan yang digunakan dalam penelitian adalah efluen tahap pengolahan sekunder yaitu yang berasal dari bak sedimentasi (clarifier) PT. Capsugel Indonesia, Cibinong, Jawa Barat. Efluen tersebut terdapat dalam 2 jenis yaitu Efluen I (hasil dari pewarnaan cangkang kapsul dengan “Erythrosin B”) dan Efluen II (hasil dari pewarnaan cangkang kapsul dengan “Brilliant Blue FCF”).
Koagulan yang digunakan adalah alum padat, PAC padat, FeCl3 padat, dan kaporit padat. Bahan-bahan lain yang digunakan adalah kertas saring, bahan-bahan kimia seperti DPD Free Chlorine Powder Pillow (serbuk) untuk analisis klorin (metode DPD dengan spektrofotometer) dan larutan H2SO4, HCl, dan NaOH untuk pengaturan pH.
Alat yang digunakan dalam penelitian adalah VELP – scientificaTest di cessione C6F Jartester, oven, spektrofotometer Direct Reading (DR) 2000, timbangan, pH meter, turbidimeter, dan alat-alat gelas.
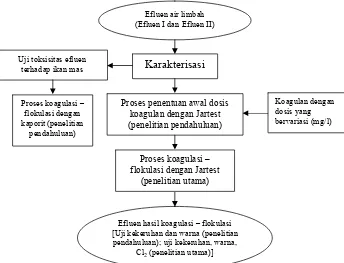
E. TAHAPAN PENELITIAN
1. Karakterisasi Efluen
Efluen diperoleh dari bak sedimentasi yang berupa cairan tanpa flok yang merupakan hasil dari proses penanganan secara biologis pada bak aerasi. Efluen dianalisis baik fisik maupun kimia yang meliputi: pH, kekeruhan (Nefelo Turbidity Unit – NTU), warna (PtCo), dan klorin (mg/l).
2. Penelitian Pendahuluan
d. Uji Toksisitas Efluen Terhadap Ikan
plastik, volume 21 liter. Semua wadah plastik diisi efluen hingga 20 liter. Jumlah wadah plastik yang digunakan adalah 4 buah, 1 buah diisi dengan Efluen I sebelum klorinasi (A1), 1 buah diisi dengan Efluen I setelah klorinasi (A2), dan 2 buah wadah plastik lainnya diisi dengan Efluen II sebelum klorinasi (B1), 1 buah lagi diisi dengan Efluen II setelah klorinasi (B2). Kualitas efluen yang dimasukkan ke dalam wadah plastik dianalisis pH dan kadar klorinnya sebelum ikan dimasukkan.
Ke dalam tiap-tiap wadah percobaan dimasukkan 10 ekor ikan. Jenis ikan yang akan digunakan adalah ikan mas (Cyprinus carpio) dengan ukuran panjang antara 3 – 5 cm dan berasal dari tempat yang tidak/belum dikenal pencemaran (Suriawiria, 2003).
Uji toksisitas dilakukan selama 96 jam (4 hari). Setelah ikan mas dimasukkan ke dalam masing-masing wadah, dilakukan perhitungan jumlah ikan yang mati (setiap 24 jam), dan setiap 24 jam dilakukan pengukuran pH dan klorin dari masing-masing efluen dalam wadah percobaan, sehingga secara bertahap akan diketahui ketahanan dari ikan percobaan terhadap air limbah selama 4 hari percobaan.
Gambaran tentang penentuan kondisi uji toksisitas efluen terhadap ikan dapat dilihat pada Tabel 2.
Tabel 2. Kondisi uji toksisitas efluen terhadap ikan
Kondisi Uji Efluen I Efluen II
A1 A2 B1 B2
Volume Efluen 20 L 20 L 20 L 20 L
Jumlah ikan 10 ekor 10 ekor 10 ekor 10 ekor
Keterangan : A1 = Efluen I sebelum klorinasi A2 = Efluen I setelah klorinasi B1 = Efluen II sebelum klorinasi B2 = Efluen II setelah klorinasi
e. Proses Optimasi Penggunaan Kaporit dengan Jartest
18 Perlakuan dosis yang diberikan pada tahap ini adalah 5, 10, 15 mg/l. Rentang penggunaan dosis kaporit ini didasarkan pada penggunaan kaporit dengan dosis yang lebih rendah dibandingkan dengan proses klorinasi di IPAL PT. Capsugel Indonesia yaitu kurang dari 24 mg/l. Perlakukan pH yang diberikan pada tahap ini adalah 4, 4.5, 5, 5.5, 6, 6.5. Penentuan rentang pH adalah pada kondisi asam hingga netral (www.terranet.com, 2006).
Proses penentuan dosis terbaik pada penambahan kaporit ini dilakukan dengan menggunakan peralatan Jartest. Hasil dari proses tersebut dilakukan uji kekeruhan, warna, dan klorin.
f. Proses Penentuan Awal Dosis Koagulan
Proses penentuan awal dosis koagulan dilakukan dengan membedakan dosis masing-masing koagulan yang didasarkan pada dosis terbaik dari penelitian sebelumnya.
Perlakuan dosis yang diberikan pada tahap pertama untuk masing-masing koagulan ini adalah sebagai berikut :
Koagulan Dosis Koagulan (mg/l) Alum 40, 50, 60, 80, 100, dan 120 PAC 40, 100, 150, 180, 210, dan 250 FeCl3 40, 50, 60, 100, 150, dan 200
Rentang penggunaan dosis ini didasarkan pada penelitian yang dilakukan oleh Kurniawan (2005) untuk alum sebanyak 15-80 mg/l, dan untuk PAC sebanyak 10-60 mg/l. Penggunaan FeCl3 didasarkan pada penelitian yang dilakukan oleh Pujiantoro (1995) sebanyak 50-300 mg/l.
Gambar 1. Skema proses input output penelitian
3. Penelitian Utama
Tiga dosis yang optimal yang didapatkan dari penentuan dosis kemudian ditambahkan perlakuan pH dengan menggunakan Jartest. Adapun perlakuan pH yang dilakukan pada tahapan selanjutnya adalah sebagai berikut :
Koagulan pH
Alum 5.5, 6, 6.5, 7, 7.5, dan 8 PAC 6, 6.5, 7, 7.5, 8, dan 8.5 FeCl3 5.5, 6, 6.5, 7, 7.5, dan 8
Penentuan rentang pH ini didasarkan oleh keefektifan masing-masing koagulan, seperti yang dikemukakan oleh Davies dan Cornwell (1991), untuk alum (5-8), FeCl3 (4-9) dan juga oleh Klimiuk et al. (1999), untuk PAC yang efektif sekitar 6.5.
Hasil dari proses koagulasi – flokulasi dengan perlakuan pH dilakukan uji kekeruhan, warna, dan klorin. Uji ini bertujuan untuk mendapatkan kombinasi terbaik antara dosis dan pH berdasarkan hasil
Efluen air limbah (Efluen I dan Efluen II)
Karakterisasi
Proses penentuan awal dosis koagulan dengan Jartest (penelitian pendahuluan)
Efluen hasil koagulasi – flokulasi [Uji kekeruhan dan warna (penelitian
pendahuluan); uji kekeruhan, warna, Cl2 (penelitian utama)]
Koagulan dengan dosis yang bervariasi (mg/l) Uji toksisitas efluen
terhadap ikan mas
Proses koagulasi – flokulasi dengan Jartest
(penelitian utama)
Proses koagulasi – flokulasi dengan kaporit (penelitian
20 yang optimal dari masing-masing parameter uji, khususnya untuk parameter kekeruhan dan warna.
Gambar 2. Peralatan Jartest
F. ANALISIS DATA
Analisis data diolah dengan manggunakan Microsoft Excel 2003. Hasil proses penentuan awal dosis koagulan pada penelitian pendahuluan dianalisis dengan menggunakan pendekatan grafis untuk mendapatkan tiga dosis terbaik.
Hasil uji dari perlakuan dosis dan pH pada penelitian utama diolah dengan rancangan percobaan desain blok acak lengkap dengan subsampling. Hal ini bertujuan untuk mengetahui pengaruh perlakuan dosis dan pH yang berbeda terhadap parameter yang diukur, serta untuk mengetahui kombinasi terbaik antara dosis dan pH dari masing-masing koagulan. Kombinasi terbaik antara dosis dan pH ditentukan berdasarkan hasil analisis pengukuran parameter kekeruhan dan warna yang terendah. Model matematis untuk rancangan percobaan desain blok acak lengkap dengan subsampling, dapat dituliskan dalam bentuk:
Yijk = μ + βi + πj + єij + ηijk dimana:
Yijk = Variabel yang diukur µ = Rata-rata umum
βi = Efek rata-rata blok/efluen ke i
πj = Efek rata-rata pH ke j
22
IV. HASIL DAN PEMBAHASAN
G. SUMBER DAN KARAKTERISTIK EFLUEN
Sumber efluen yang digunakan untuk proses koagulasi – flokulasi berasal dari cairan tanpa flok pada bak sedimentasi (clarifier) PT. Capsugel Indonesia. Pada bagian ini, efluen telah mendapatkan penanganan secara fisik, kimia, dan biologis. Penanganan secara fisik meliputi ekualisasi dan penurunan suhu. Penanganan secara kimia meliputi penurunan pH, dan penanganan secara biologis meliputi nitrifikasi dan denitrifikasi.
Lumpur aktif dari kolam aerobik mengalir ke bak sedimentasi. Flok-flok bakteri (biomass) yang ikut dalam efluen aerobik diendapkan di dalam
clarifier dan dipompa kembali ke kolam anoksik atau dikenal dengan return activated sludge (RAS). Efluen yang berupa cairan tanpa flok kemudian mengalir ke bak klorinasi.
Efluen yang berupa cairan dari bak sedimentasi ini memiliki dua penampakan secara visual yang berbeda yaitu warna bening kemerahan (Efluen I) dan bening kebiruan (Efluen II). Perbedaan ini dikarenakan bahan pewarna cangkang kapsul yang digunakan berbeda yaitu cangkang kapsul yang menggunakan pewarna “Erythrosin B” dan cangkang kapsul yang menggunakan pewarna “Brilliant Blue FCF”. Penampakan Efluen I dan Efluen II disajikan pada Gambar 3.
[image:38.612.178.475.528.685.2]Produksi cangkang kapsul dengan pewarna “Erythrosin B” akan menghasilkan efluen berwarna bening kemerahan (Efluen I), sedangkan produksi cangkang kapsul dengan pewarna “Brilliant Blue FCF” akan menghasilkan efluen berwarna bening kebiruan (Efluen II). Adapun hasil uji beberapa parameter dari efluen dapat dilihat pada Tabel 3.
Tabel 3. Karakteristik Efluen I dan Efluen II
Parameter Satuan Efluen I Efluen II
pH - 6.38-7.02 6.73-7.00
Kekeruhan NTU 12-13 10-12
Warna PtCo 182-201 175-198
Klorin (Cl2) mg/l 0.12-0.14 0.13-0.15
Berdasarkan karakteristik diatas nilai dari masing-masing parameter antara Efluen I dan Efluen II tidak memiliki perbedaan yang signifikan. Nilai pH Efluen I dan Efluen II berkisar antara 6.38-7.02, dimana sebelumnya efluen telah mengalami pengaturan pH pada rentang pH 7-8.5 dengan penambahan bahan kimia Na2CO3, sehingga pada saat memasuki bak sedimentasi (clarifier) pH efluen berada dalam kisaran pH netral.
Lumpur aktif dari kolam aerobik mengalir ke bak sedimentasi. Flok-flok bakteri (biomass) yang ikut dalam efluen aerobik diendapkan di dalam
clarifier dan dipompa kembali ke kolam anoksik. Hal ini menyebabkan efluen yang berupa cairan yang terpisah dari flok-flok bakteri tersebut mempunyai nilai kekeruhan dan warna yang cukup rendah.
Kadar klorin Efluen I dan Efluen II tidak dalam nilai yang berlebih yaitu berkisar antara 0.12-0.15 mg/l. Namun, menurut www.o-fish.com (2002), untuk menghindari efek berbahaya dari klorin maka kadarnya dalam air harus dijaga agar tidak lebih dari 0.003 mg/l.
H. UJI TOKSISITAS EFLUEN TERHADAP IKAN
24 Tabel 4. Hasil uji toksisitas efluen terhadap ikan pada Efluen I
[image:40.612.147.527.88.192.2]Keterangan : A1 = Efluen I sebelum klorinasi A2 = Efluen I setelah klorinasi
Tabel 5. Hasil uji toksisitas efluen terhadap ikan pada Efluen II
Keterangan : B1 = Efluen II sebelum klorinasi B2 = Efluen II setelah klorinasi
Berdasarkan pengamatan dari hasil diatas, seluruh biota uji A1 dan B1 masih dapat bertahan hidup dengan kadar klorin sebesar 0.17 dan 0.13 mg/l pada 24 jam pertama. Biota uji A1 masih dapat bertahan hingga hari keempat, sedangkan pada B1 hanya satu ekor ikan yang mati hingga hari keempat. Hal ini menunjukkan bahwa sebelum proses klorinasi berlangsung; efluen cukup aman bagi kehidupan ikan. Ketahanan ikan tersebut juga didukung oleh menurunnya kadar klorin A1 karena telah menguap. Klorin dalam air relatif tidak stabil dan akan segera terbebas ke udara (www.o-fish.com, 2002).
Berbeda dengan A1 dan B1, seluruh biota uji A2 dan B2 mati pada 24 jam pertama. Hal ini diduga adanya pengaruh klorin sebagai akibat dari penambahan larutan kaporit. Kaporit padat (kalsium hipoklorit) dalam air akan membentuk senyawa kalsium hipoklorit [Ca(OCl)2] yang merupakan molekul klorin (OCl- atau HOCl-) (Riegel, 1933), sehingga semakin banyak kaporit yang ditambahkan akan semakin tinggi kadar klorinnya.
Pada uji contoh terlihat bahwa kandungan residu klorin setelah klorinasi adalah 0.84 mg/l dan pengamatan pada 24 jam pertama terhadap efluen setelah klorinasi menunjukkan kematian seluruh ikan yang ada. Hal ini menunjukkan bahwa kandungan klor tersebut bersifat toksik bagi ikan, karena
Parameter Uji
A1 A2
Hari ke-0 Hari ke-1 Hari ke-2 Hari ke-3 Hari ke-4 Hari ke-0 Hari ke-1 Hari ke-2 Hari ke-3 Hari ke-4
pH 7.01 7.61 7.84 8.11 8.23 8.21 8.34 8.37 8.40 8.41
Cl2 (mg/l) 0.17 0.16 0.11 0.09 0.05 0.84 0.52 0.22 0.17 0.08
Jumlah ikan yang mati
sampai hari ke- 0 0 0 0 0 10 10 10 10 10
Parameter Uji
B1 B2
Hari ke-0 Hari ke-1 Hari ke-2 Hari ke-3 Hari ke-4 Hari ke-0 Hari ke-1 Hari ke-2 Hari ke-3 Hari ke-4
pH 7 7.57 7.79 7.95 8.01 7.78 7.82 7.95 7.99 8.04
Cl2 (mg/l) 0.13 0.11 0.10 0.06 0.03 0.78 0.43 0.19 0.15 0.04
Jumlah ikan yang mati
klorin pada konsentrasi 0.2 - 0.3 mg/l sudah cukup untuk membunuh ikan dengan cepat (www.o-fish.com, 2002).
I. OPTIMASI PENGGUNAAN KAPORIT
Hasil uji toksisitas efluen terhadap ikan menunjukkan bahwa proses klorinasi di IPAL PT. Capsugel Indonesia menghasilkan efluen yang mengandung residu klorin yang toksik bagi ikan. Untuk mengurangi residu klorin dalam efluen tersebut diupayakan optimasi penggunaan kaporit dengan mencari dosis yang lebih rendah.
Berdasarkan hasil yang didapat, pada penambahan dosis kaporit sebesar 5, 10, dan 15 mg/l dengan perlakuan pH 4-6.5 menunjukkan penurunan kekeruhan dari 82.80 persen hingga 92.40 persen (Efluen I) dan 81.82 persen hingga 91.36 persen (Efluen II). Pada warna terjadi penurunan dari 49.35 persen hingga 73.89 persen (Efluen I) dan 47.72 persen hingga 69.44 persen (Efluen II). Hal ini menunjukkan bahwa penggunaan kaporit efektif untuk menurunkan warna. Menurut Ucko (1982) kaporit sangat aktif dalam mengoksidasi warna dan mengubah warna menjadi terang dengan memecah molekul penyebab warna menjadi substansi yang lain. Hasil analisis persen penurunan dapat dilihat pada Tabel 6.
Tabel 6. Hasil analisis persen penurunan parameter pada perlakuan pH 6.5 Penurunan
Parameter
Dosis 5 mg/l pH 6.5 Dosis 10 mg/l pH 6.5 Dosis 15 mg/l pH 6.5 Efluen
I
Efluen II
Efluen I
Efluen II
Efluen I
Efluen II
Kekeruhan 83.60% 80.00% 90.00% 76.36% 92.40% 91.36%
Warna 50.39% 49.06% 66.84% 63.27% 73.89% 69.44%
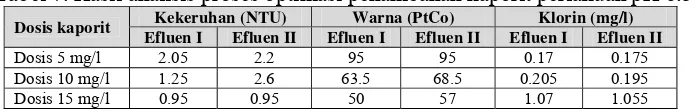
26 Tabel 7. Hasil analisis proses optimasi penambahan kaporit perlakuan pH 6.5
Dosis kaporit Kekeruhan (NTU) Warna (PtCo) Klorin (mg/l)
Efluen I Efluen II Efluen I Efluen II Efluen I Efluen II
Dosis 5 mg/l 2.05 2.2 95 95 0.17 0.175 Dosis 10 mg/l 1.25 2.6 63.5 68.5 0.205 0.195 Dosis 15 mg/l 0.95 0.95 50 57 1.07 1.055
Namun, penurunan nilai kekeruhan dan warna yang terjadi tersebut berlawanan dengan residu klorin yang dihasilkan. Residu klorin meningkat seiring dengan semakin besarnya dosis kaporit dan pH yang diberikan. Hal ini terjadi karena kaporit dalam efluen akan membentuk kalsium hipoklorit [Ca(OCl)2] yang merupakan molekul klorin (Riegel, 1933), sehingga semakin banyak kaporit yang ditambahkan akan meningkatkan residu klorin dalan efluen.
Penambahan dosis kaporit sebanyak 15 mg/l dengan pH 6.5 dihasilkan kadar klorin sebesar 1.07 mg/l (Efluen I) dan 1.055 mg/l (Efluen II). Hasil ini menunjukkan bahwa proses optimasi yang dilakukan ini tidak menekan jumlah residu klorin dalam efluen dan masih bersifat toksik bagi ikan.
J. PROSES KOAGULASI – FLOKULASI AWAL
Proses koagulasi – flokulasi dengan penambahan koagulan dilakukan sebagai upaya substitusi penggunaan kaporit sebagai penghilang warna yang masih tersisa dalam efluen. Melalui proses koagulasi – flokulasi dengan penambahan koagulan ini diharapkan tidak meningkatkan residu klorin dalam efluen sehingga tidak berbahaya bagi makhluk perairan.
Koagulan yang digunakan adalah alum, PAC, dan FeCl3. Hasil penentuan kondisi proses koagulasi – flokulasi untuk mendapatkan dosis yang optimal dalam menjernihkan efluen disajikan menurut masing-masing koagulan.
4. Alum
karena alum dalam air akan mengalami proses hidrolisis dan membentuk asam menurut reaksi sebagai berikut :
Al2(SO4)3 + 6H2O 2Al(OH)3 + 6H+ + 3SO4
Hasil pengamatan menunjukkan bahwa semakin tinggi dosis alum yang ditambahkan akan semakin sulit flok-flok tersedimentasi, sehingga perolehan nilai kekeruhan dan warna semakin tinggi. Hal ini dikarenakan pembentukan flok-flok pada penambahan koagulan alum akan maksimal dengan penambahan dosis yang kecil dan tingkat sedimentasinya akan menjadi cepat (Echanpin, 2004).
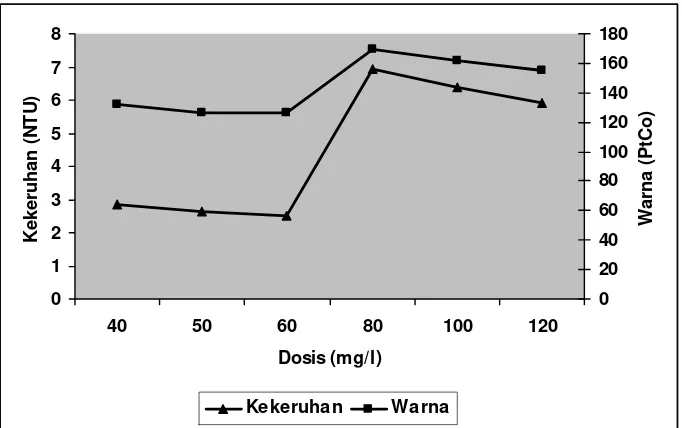
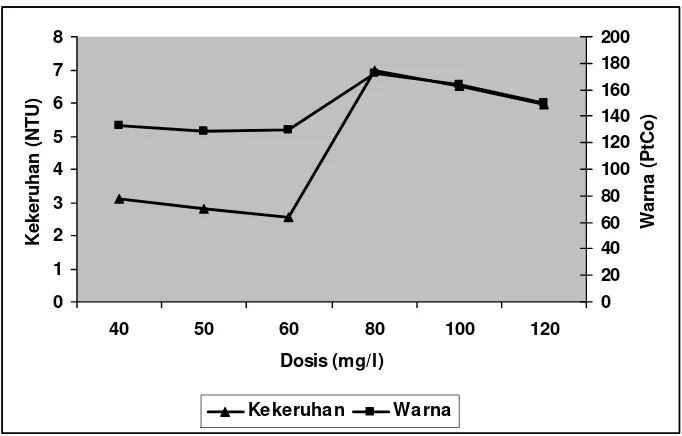
Dosis optimal terpilih adalah 40, 50, dan 60 mg/l. Hasil analisis koagulasi - flokulasidengan perlakuan dosis pada Efluen I dan Efluen II untuk penambahan koagulan alum dapat dilihat pada Gambar 4 dan 5. Data hasil analisis penelitian pendahuluan selengkapnya dapat dilihat pada Lampiran 14 dan 15.
0 1 2 3 4 5 6 7 8
40 50 60 80 100 120
[image:43.612.170.511.371.585.2]Dosis (mg/l) K e k e ruha n ( N TU ) 0 20 40 60 80 100 120 140 160 180 Wa rn a (P tCo ) Kekeruhan Warna
28 0 1 2 3 4 5 6 7 8
40 50 60 80 100 120
[image:44.612.169.510.80.298.2]Dosis (mg/l) K e k e ruha n ( N TU ) 0 20 40 60 80 100 120 140 160 180 200 Wa rn a (P tCo ) Kekeruhan Warna
Gambar 5. Hasil analisis koagulasi - flokulasi dengan perlakuan dosis pada Efluen II (alum)
Nilai kekeruhan dan warna terbaik pada Efluen I dan Efluen II dicapai pada dosis 40, 50, dan 60 mg/l. Pada rentang dosis ini pH efluen yang dihasilkan tidak terlalu asam, dan kemampuan koagulan alum untuk membentuk flok-flok maksimal dengan tingkat sedimentasi yang cepat.
5. PAC
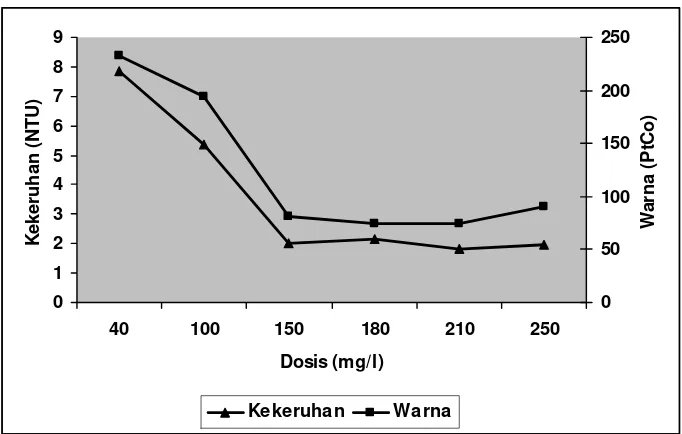
Penggunaan PAC sebagai koagulan sebanyak 40-250 mg/l menunjukkan adanya perubahan warna dan kekeruhan. Nilai kekeruhan dan warna paling baik pada Efluen I dan Efluen II adalah dengan penambahan dosis koagulan PAC sebanyak 150, 180, dan 210 mg/l. Dengan makin besarnya dosis koagulan PAC yang diberikan maka nilai kekeruhan dan warnanya akan semakin kecil. Namun, pada penambahan dosis sebanyak 250 mg/l nilai kekeruhan dan warnanya meningkat lagi. Hal ini terjadi karena pada penambahan dosis tersebut telah berlebih sehingga koloid yang terbentuk telah menjadi stabil kembali karena tidak adanya ruang untuk membentuk penghubung partikel (Weber, 1972).
menggunakan koagulan PAC pada Efluen I dan Efluen II selengkapnya dapat dilihat pada Gambar 6 dan 7.
0 1 2 3 4 5 6 7 8 9
40 100 150 180 210 250
[image:45.612.170.510.126.339.2]Dosis (mg/l) K e k e ruha n ( N TU ) 0 50 100 150 200 250 Wa rn a (P tCo ) Kekeruhan Warna
Gambar 6. Hasil analisis koagulasi – flokulasi dengan perlakuan dosis pada Efluen I (PAC)
0 1 2 3 4 5 6 7 8 9
40 100 150 180 210 250
Dosis (mg/l) K e k e ruha n ( N TU ) 0 50 100 150 200 250 Wa rn a (P tCo ) Kekeruhan Warna
Gambar 7. Hasil analisis koagulasi – flokulasi dengan perlakuan dosis pada Efluen II (PAC)
6. FeCl3
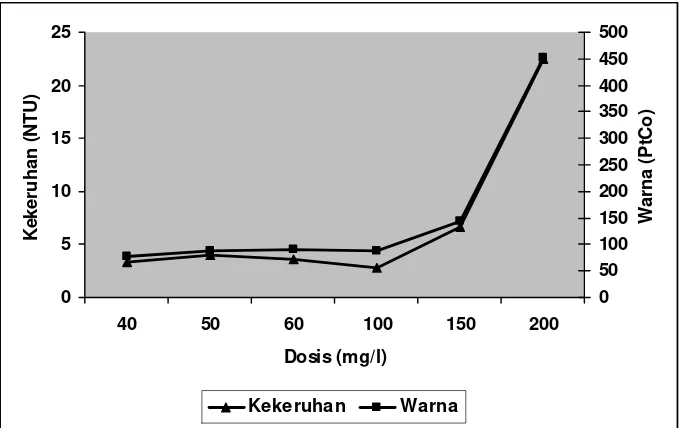
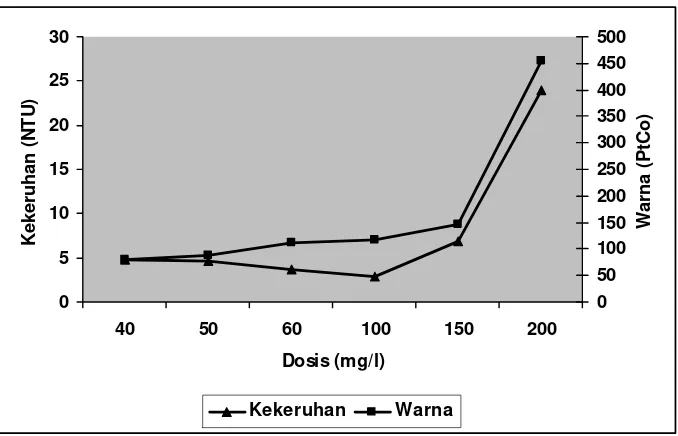
[image:45.612.169.510.376.593.2]30 40, 50, dan 60 mg/l. Semakin banyak koagulan FeCl3 yang ditambahkan akan semakin meningkatkan nilai kekeruhan dan warna hal ini disebabkan oleh Fe3+ dari koagulan yang terlarut dalam efluen. Adanya Fe3+ yang terlarut dalam efluen menyebabkan timbulnya warna kemerahan. Koagulan FeCl3 dapat menimbulkan masalah, terutama timbulnya warna dan sifat korosif apabila proses koagulasi tidak berlangsung dengan baik (Reynolds, 1982; Peavy et al., 1986).
Seperti halnya alum, semakin banyak FeCl3 yang ditambahkan akan mengakibatkan pH efluen turun. Penurunan pH ini disebabkan disebabkan oleh terlepasnya proton (H+) hasil hidrolisis FeCl3 (MetCalf dan Eddy, 1992). Hasil analisis koagulasi – flokulasi dengan penambahan koagulan FeCl3 pada Efluen I dan Efluen II selengkapnya dapat dilihat pada Gambar 8 dan 9.
0 5 10 15 20 25
40 50 60 100 150 200
Dosis (mg/l) K e k e ruha n ( N TU ) 0 50 100 150 200 250 300 350 400 450 500 Wa rn a (P tCo )
[image:46.612.170.511.341.555.2]Kekeruhan Warna
0 5 10 15 20 25 30
40 50 60 100 150 200
[image:47.612.171.510.80.298.2]Dosis (mg/l) K e k e ruha n ( N TU ) 0 50 100 150 200 250 300 350 400 450 500 Wa rn a (P tCo ) Kekeruhan Warna
Gambar 9. Hasil analisis koagulasi – flokulasi dengan perlakuan dosis pada Efluen II (FeCl3)
K. PENELITIAN UTAMA
Berdasarkan hasil penentuan kondisi proses koagulasi – flokulasi diatas didapatkan tiga dosis terbaik, kemudian ketiga dosis tersebut diberikan perlakuan pH menurut rentang pH optimal pada masing-masing koagulan. Hal tersebut bertujuan untuk mengetahui kombinasi terbaik antara dosis dan pH dalam menjernihkan efluen.
1. Alum
Pengamatan terhadap penggunaan dosis koagulan alum pada dosis 40, 50, dan 60 mg/l dengan pengaturan pH antara 5.5–8 pada Efluen I dan Efluen II menunjukkan adanya penurunan kekeruhan. Pada Efluen I, pemberian dosis koagulan alum sebesar 40 mg/l dengan pH 5.5-8 menunjukkan peningkatan nilai kekeruhan dengan bertambahnya nilai pH. Pemberian dosis 50 dan 60 mg/l dengan pH 5.5-8 juga menunjukkan peningkatan nilai kekeruhan dengan bertambahnya nilai pH. Berdasarkan pengamatan tersebut didapatkan kombinasi terbaik yaitu pada dosis 60 mg/l dengan pH 5.5 yaitu dengan nilai kekeruhan terkecil 2.05 NTU.
32 kekeruhan terkecil 2.1 NTU. Hal ini menunjukkan bahwa perlakuan pH akan menentukan dalam pembentukkan formasi dari flok-flok yang selanjutnya mempengaruhi hasil dari proses koagulasi dan flokulasi (Nathanson, 1997). pH 5.5 ini merupakan hasil terbaik dari hasil proses koagulasi – flokulasi dengan alum pada efluen PTCI, karena pada pH ini proses flokulasi dapat berlangsung dengan baik dan paling sesuai untuk membentuk Al(OH)3. Rentang pH yang terbaik intuk membentuk Al(OH)3 adalah pH 5-8 (Alaerts dan Santika, 1987). Terbentuknya flok Al(OH)3 semakin berkurang seiring dengan perlakuan pH yang diberikan. Grafik hubungan antara perlakuan pH yang diberikan dengan parameter kekeruhan, disajikan pada Gambar 10 dan 11.
Berdasarkan hasil uji statistik (Lampiran 3) juga menunjukkan bahwa perlakuan dosis, pH, dan interaksi antara perlakuan dosis dan pH memberikan pengaruh yang berbeda nyata terhadap nilai kekeruhan pada Efluen I dan Efluen II. Berdasarkan uji lanjut Duncan terlihat bahwa semakin tinggi jumlah dosis yang ditambahkan nilai kekeruhannya akan semakin kecil, dan semakin tinggi pH nilai kekeruhannya akan semakin besar. Dengan demikian penambahan dosis koagulan alum sebanyak 60 mg/l pada pH 5.5 merupakan kombinasi terbaik dalam menurunkan nilai kekeruhan pada Efluen I dan Efluen II.
0 0.5 1 1.5 2 2.5 3 3.5
5.5 6 6.5 7 7.5 8
pH K e k e ruha n ( N TU )
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
[image:49.612.169.510.81.297.2]Alum Dosis 60 m g/l
Gambar 10. Hubungan nilai pH dan kekeruhan pada Efluen I (alum)
0 0.5 1 1.5 2 2.5 3 3.5 4
5.5 6 6.5 7 7.5 8
pH K e k e ruha n ( N TU )
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
Alum Dosis 60 m g/l
[image:49.612.167.513.242.526.2]34 nyata terhadap warna (Fhitung < Ftabel) karena perbedaan yang dihasilkan dari setiap pertambahan dosis dan pH ini tidak berbeda nyata seperti yang terlihat pada grafik (Gambar 12 dan 13).
Berdasarkan uji lanjut Duncan menunjukkan bahwa dengan bertambahnya perlakuan pH yang diberikan akan bertambah tinggi nilai warnanya, dan semakin tinggi dosis yang diberikan akan semakin kecil nilai warnanya. Penambahan dosis alum sebesar 60 mg/l dengan pH 5.5 merupakan kombinasi terbaik dalam menurunkan warna yaitu mencapai 91 PtCo pada Efluen I dan 104.5 PtCo pada Efluen II.
Menurut Alaerts dan Santika (1987), partikel warna (pH < 7) terikat dan diendapkan oleh flok-flok Al(OH)3, sehingga pH 5.5 merupakan suasana yang paling sesuai agar flok-flok Al(OH)3 yang terbentuk dapat mengikat dan mengendapkan partikel warna dengan baik. Nilai warna yang semakin tinggi seiring dengan bertambahnya pH dipengaruhi oleh berkurangnya pembentukan flok-flok Al2(OH)3 sehingga partikel warna yang dapat diikat oleh flok-flok tersebut semakin sedikit.
0 20 40 60 80 100 120 140 160
5.5 6 6.5 7 7.5 8
pH
Wa
rn
a
(P
tCo
)
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
[image:50.612.169.511.396.613.2]Alum Dosis 60 m g/l
0 20 40 60 80 100 120 140 160
5.5 6 6.5 7 7.5 8
pH
Wa
rn
a
(P
tCo
)
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
[image:51.612.168.511.81.294.2]Alum Dosis 60 m g/l
Gambar 13. Hubungan nilai pH dan warna pada Efluen II (alum) Hasil uji statistik menunjukkan bahwa perlakuan efluen mempunyai pengaruh yang berbeda nyata terhadap warna. Hal ini dikarenakan pengaruh penggunaan pewarna yang berbeda pada Efluen I dan Efluen II menyebabkan penggunaan koagulan alum pada Efluen I lebih efektif menurunkan warna dibandingkan dengan Efluen II. Hal ini ditunjukkan pada penurunan warna Efluen I yaitu sebesar 27.94 persen hingga 52.48 persen, sedangkan pada Efluen II penurunan warna yang terjadi sebesar 24.13 persen hingga 43.97 persen.
36 Hasil pengamatan penggunaan alum menunjukkan konsentrasi residu klorin 0.12 mg/l (Efluen I) dan 0.13 mg/l (Efluen II). Kondisi ini tidak menimbulkan sifat toksik terhadap ikan, seperti yang digambarkan pada uji toksisitas efluen pada penelitian pendahuluan. Hasil uji toksisitas efluen menunjukkan bahwa kadar klorin 0.13-0.17 mg/l masih dapat ditoleransi oleh ikan. Oleh karena itu, efluen dengan kadar klorin seperti yang disebutkan diatas masih dapat ditoleransi oleh ikan juga (cukup aman untuk ikan hidup).
0 0.05 0.1 0.15 0.2 0.25
5.5 6 6.5 7 7.5 8
pH
K
lo
rin
(
m
g
/l)
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
[image:52.612.167.513.236.694.2]Alum Dosis 60 m g/l
Gambar 14. Hubungan nilai pH dan klorin pada Efluen I (alum)
0 0.05 0.1 0.15 0.2 0.25
5.5 6 6.5 7 7.5 8
pH
K
lo
rin
(
m
g
/l)
Alum Dosis 40 m g/l
Alum Dosis 50 m g/l
[image:52.612.168.511.238.456.2]Alum Dosis 60 m g/l
2. PAC
Pengamatan terhadap penggunaan dosis koagulan PAC sebanyak 150, 180 dan 210 mg/l dengan pengaturan pH antara 6-8.5 pada Efluen I dan Efluen II menunjukkan adanya perubahan kekeruhan. Berdasarkan hasil uji statistik (Lampiran 6) juga menunjukkan bahwa perlakuan dosis, pH, dan interaksi antara perlakuan dosis dan pH memberikan pengaruh yang berbeda nyata terhadap nilai kekeruhan pada Efluen I dan Efluen II (Fhitung > Ftabel).
Menurut uji lanjut Duncan pada penggunaan koagulan PAC untuk Efluen I dan Efluen II ini menunjukkan peningkatan nilai kekeruhan dengan bertambahnya pH. Semakin tinggi dosis koagulan PAC yang diberikan akan semakin kecil nilai kekeruhannya.
38 0 0.5 1 1.5 2 2.5 3 3.5
6 6.5 7 7.5 8 8.5
pH K eker u h a n ( N T U )
PAC Dosis 150 m g/l
PAC Dosis 180 m g/l
[image:54.612.170.509.80.296.2]PAC Dosis 210 m g/l
Gambar 16. Hubungan nilai pH dan kekeruhan pada Efluen I (PAC) Pada Efluen II, kombinasi terbaik antara dosis dan pH adalah pada penambahan PAC dengan dosis sebesar 210 mg/l dengan pH 6 yaitu dengan nilai kekeruhan 1.4 NTU.
0 0.5 1 1.5 2 2.5 3 3.5
6 6.5 7 7.5 8 8.5
pH K eker u h a n ( N T U )
PAC Dosis 150 m g/l
PAC Dosis 180 m g/l
PAC Dosis 210 m g/l
[image:54.612.169.511.392.603.2]sebesar 76 persen hingga 88.40 persen, angka perubahan ini lebih besar dibandingkan dengan Efluen II dengan penurunan nilai kekeruhan sebesar 73.18 persen hingga 87.27 persen.
Menurut pengamatan secara visual, perubahan warna yang dihasilkan setelah penambahan koagulan PAC cukup terlihat, yaitu menjadi lebih pucat, walaupun masih tetap ada warna yaitu kemerahan (Efluen I) dan kebiruan (Efluen II). Secara kuantitatif dengan pengukuran spektrofotometrik sudah terjadi penurunan warna. Hasil uji statistik (Lampiran 7) menunjukkan bahwa perlakuan dosis dan pH memberikan pengaruh yang berbeda nyata terhadap penurunan warna pada Efluen I dan Efluen II (Fhitung > Ftabel). Namun, interaksi antara perlakuan dosis dan pH tidak memberikan pengaruh yang nyata terhadap warna (Fhitung < Ftabel). Hal ini dapat juga dilihat pada Gambar 18 dan 19, dimana warna untuk masing-masing dosis relatif sama besar. Berdasarkan uji lanjut Duncan juga menunjukkan bahwa perubahan warna antara dosis 150, 180, dan 210 mg/l tidak berbeda nyata, dan perubahan warna antara pH 6-8.5 tidak berbeda nyata.
40 0 20 40 60 80 100 120 140
6 6.5 7 7.5 8 8.5
pH Wa rn a (P tCo )
PAC Dosis 150 m g/l
PAC Dosis 180 m g/l
[image:56.612.169.511.83.292.2]PAC Dosis 210 m g/l
Gambar 18. Hubungan nilai pH dan warna pada Efluen I (PAC)
0 10 20 30 40 50 60 70 80 90
6 6.5 7 7.5 8 8.5
pH Wa rn a (P tCo )
PAC Dosis 150 m g/l
PAC Dosis 180 m g/l
PAC Dosis 210 m g/l
Gambar 19. Hubungan nilai pH dan warna pada Efluen II (PAC) Pada Efluen I, kombinasi terbaik antara dosis dan pH pada penambahan koagulan PAC ini adalah pemberian dosis 210 mg/l dengan pH 6 dengan nilai warna terkecil yaitu 64 PtCo. Pada Efluen II, kombinasi terbaik adalah pada penggunaan dosis sebesar 210 mg/l dengan pH 6 yaitu dengan nilai warna 67.5 PtCo.
[image:56.612.166.511.230.528.2]dengan koagulan alum, penggunaan PAC sebagai koagulan pada Efluen I lebih efektif dari Efluen II. Hal ini ditunjukkan pada Efluen I dengan penurunan warna sebesar 36.81 persen hingga 66.58 persen, angka perubahan ini lebih besar dibandingkan dengan Efluen II dengan penurunan warna sebesar 54.42 persen hingga 63.81 persen.
Pengamatan kadar klorin setelah penambahan koagulan PAC terdapat perubahan (uji statistik pada Lampiran 8). Perlakuan efluen (blok), dosis dan pH memberikan pengaruh yang berbeda nyata terhadap kadar klorin (Fhitung > Ftabel). Namun, interaksi antara perlakuan dosis dan pH tidak memberikan pengaruh yang nyata terhadap kadar klorin (Fhitung < Ftabel). Berdasarkan uji lanjut Duncan juga menunjukkan bahwa kadar klorin antara dosis 180 dan 210 mg/l tidak berbeda nyata.
42 0 0.05 0.1 0.15 0.2 0.25 0.3
6 6.5 7 7.5 8 8.5
pH K lo rin ( m g /l)
PAC D